有关官能团的保护
chapt3-官能团的保护
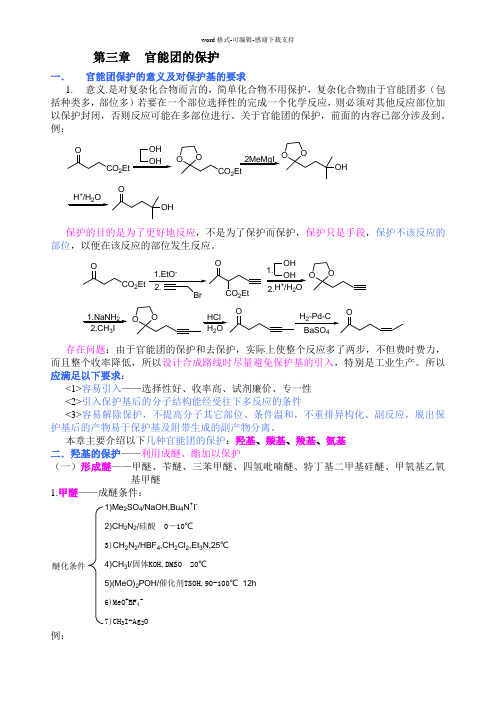
第三章 官能团的保护一. 官能团保护的意义及对保护基的要求1. 意义.是对复杂化合物而言的,简单化合物不用保护,复杂化合物由于官能团多(包括种类多,部位多)若要在一个部位选择性的完成一个化学反应,则必须对其他反应部位加以保护封闭,否则反应可能在多部位进行。
关于官能团的保护,前面的内容已部分涉及到。
例:CO 2EtOOH OHOOCO 2Et2MeMgI OOOH+2OOH保护的目的是为了更好地反应,不是为了保护而保护,保护只是手段,保护不该反应的部位,以便在该反应的部位发生反应。
CO 2EtOOH OH O O+2O-CO 2Et 1.2.1.NaNH 23OOHCl H 2O存在问题:由于官能团的保护和去保护,实际上使整个反应多了两步,不但费时费力,而且整个收率降低,所以设计合成路线时尽量避免保护基的引入,特别是工业生产。
所以应满足以下要求:<1>容易引入——选择性好、收率高、试剂廉价、专一性 <2>引入保护基后的分子结构能经受往下多反应的条件<3>容易解除保护,不提高分子其它部位、条件温和,不重排异构化、副反应,脱出保护基后的产物易于保护基及附带生成的副产物分离。
本章主要介绍以下几种官能团的保护:羟基、羰基、羧基、氨基 二.羟基的保护——利用成醚、酯加以保护(一)形成醚——甲醚、苄醚、三苯甲醚、四氢吡喃醚、特丁基二甲基硅醚、甲氧基乙氧基甲醚1.甲醚——成醚条件:1)Me 2SO 4/NaOH,Bu 4N +I -2)CH 2N 2/硅酸 0-10℃3)CH 2N 2/HBF 4,CH 2Cl 2,Et 3N,25℃4)CH 3I/固体KOH,DMSO 20℃5)(MeO)2POH/催化剂TSOH,90-100℃ 12h 6)MeO +BF 4-7)CH 3I-Ag 2O醚化条件例:OH+Me 2SO 4NaOHMeOSO 3Na+OCH3CH 2N 2+RCH 2OH RO -RCH 2OCH 3R 2CN 2ArOHR 2CHOAr CH2N 2ROHHBF 4ROCH 3+++N 2特别是酚羟基一般用MeO -醚保护,反应容易,解脱也容易,醇羟基形成甲醚较稳定,不易脱掉,故少用,在糖类化合物中羟基的保护勿用形成醚。
有机化学中的官能团保护与反应选择

有机化学中的官能团保护与反应选择在有机化学领域,官能团保护与反应选择是一项关键而重要的技术。
它们在有机合成中发挥着重要的作用,可以实现对特定官能团进行保护,以及控制反应的选择性。
本文将探讨有机化学中的官能团保护与反应选择的原理、方法和应用。
一、官能团保护的原理和方法官能团保护是在有机合成中使用特定的试剂或方法对特定官能团进行保护,以阻止其在反应中发生不需要的转化或损失。
这种保护可以临时地对官能团进行屏蔽,以防止不需要的反应发生。
一旦需要,这些保护官能团可以很容易地被去除,使得官能团再次可用。
常见的官能团保护方法包括酯化、缩醛、缩酮、硅烷保护、硼酸酯保护等。
例如,在酯化反应中,羧酸可以与醇发生酯化反应,形成酯。
这种反应可以通过加入催化剂、调节反应条件和使用适当的反应物比例来控制。
一旦酯形成,官能团保护就实现了。
二、反应选择性的控制在有机合成中,反应选择性是指在具有多个官能团的分子中,选择性地引发或控制特定官能团的反应。
反应选择性的控制对于合成复杂的有机化合物非常重要,可以避免副反应的发生,并帮助提高产率和纯度。
反应选择性的控制可以通过多种方法实现,如调节反应条件、选择适当的催化剂、改变反应物的比例、使用合适的试剂和溶剂等。
以亲核取代反应为例,当分子中存在多个能提供亲核位点的官能团时,可以通过调节反应条件和选择适当的反应物比例,去控制反应的进行。
三、官能团保护与反应选择的应用官能团保护和反应选择在有机合成中有广泛的应用。
其中最具代表性的应用之一是在多步合成中,其中的中间体需要在反应过程中保护起来,以防止意外的转化或副反应的发生。
通过对中间产物进行官能团保护,可以控制整个反应过程,确保预期产物的高产率和选择性。
另一个重要的应用是在天然产物合成中。
天然产物通常具有复杂的结构和多个官能团,官能团保护和反应选择技术可以被用来合成这些天然产物或其类似化合物。
通过选择性地引发或控制特定官能团的反应,可以构建复杂分子骨架,实现对天然产物的全合成。
有机合成-5官能团的保护

CH2OH CHOCO(CH2)14CH3 CH2OH OCH3 HO HO O O OH OCH3 89% TsOH O O 少量 HCl 蒸镏
CH2OH CHOH CH2OOC(CH2)14CH3
1) mCPBA, 99% 2) (CH3)2CuLi, 乙醚, 94% HO O O
2、形成碳酸环酯
HOH2C
O
O O P OLi OLi OH
HO
二、羰基的保护
CH3OH, H+ R2C O 2 mol/L, H2SO4 O HN H C2H5 O p-TsOH, PhH HOCH2CH2OH 85% O O HS(CH2)3SH, BF3(C2H5)2O R2C O CH3I, H2O, CH3OH R2C S S HN H C2H5 O 1) LiAlH4, THF 2) NaOH aq 3) 1 mol/L HCl O HN H C2H5 R2C OCH3 OCH3
AcO
OAc O Ar, reflux Ph condition
O
H H OAc taxinine (1)
O
AcO
OAc +
AcO
OAc
AcO +
OAc
O H
H OAc
OH HO
N H
H OAc 29-a
OH
N HO
H
H OAc
OH
taxinineA (29)
29-b
Table 2: Selective Hydrolysis of Cinnamoyl Group at C-5 of taxinine (1) yields (%) entry Reagents (equiv) conditions 29 NH2OH. HCl (12) NaOAc (12) H2O 1,4-dioxane NH2OH. HCl (15) NaOAc (15) MeOH 1,4-dioxane NH2OH. HCl (15) NaOAc (10) H2O 1,4-dioxane NH2OH. HCl (10) NaOAc (15) H2O 1,4-dioxane NH2OH. HCl (5) NaOAc (10) EtOH, H2O 1,4-dioxane 70-75 oC, 64 h 29-a 29-b 1
保护官能团的方法

保护官能团的方法嘿,朋友们!今天咱来聊聊保护官能团的那些事儿。
官能团就像是化学世界里的宝贝疙瘩,得好好保护着才行呢!你想想看啊,官能团就好比是一件珍贵的瓷器,稍有不慎就可能磕了碰了。
那怎么保护它们呢?这可得有点小技巧啦。
比如说,有些官能团特别怕水,那咱就得像给宝贝盖被子一样,把它们和水隔开呀。
不然一不小心让水给沾到了,那不就糟糕啦!还有些官能团怕酸怕碱,那咱就得像保护小公主一样,给它们创造一个酸碱适宜的环境,可不能让那些酸碱来捣乱呀。
就好像你有个特别喜欢的玩具,你肯定会小心翼翼地放在安全的地方,不会让别人随便碰到一样。
保护官能团也是这个道理呀。
有时候呢,我们还得给官能团穿上一层“保护衣”。
这层“保护衣”就像是冬天的棉袄,能帮它们抵御外界的各种干扰。
而且这“保护衣”还得选得合适,不能太大也不能太小,得刚刚好才行呢。
再打个比方,官能团就像是你养的小宠物,你得时刻关注着它,给它提供合适的食物、水和住所。
要是你不精心照料,它生病了或者出问题了,那你得多心疼呀!在实验操作中,我们可得加倍小心。
不能像个马大哈似的,随随便便就对待这些官能团。
每一个步骤都要考虑到它们的感受,就像哄小孩子一样,要温柔、细心。
还有啊,不同的官能团保护方法也不一样哦。
这就像是不同性格的人需要不同的对待方式一样。
有的需要特别的关照,有的则稍微注意一下就行。
总之呢,保护官能团可不是一件简单的事儿,但只要我们用心,就一定能把它们保护得好好的。
这样我们才能在化学的世界里畅游无阻,做出更多有趣的实验和发现呀!所以啊,大家可千万不能马虎对待哦,一定要把保护官能团这件大事放在心上!。
有关官能团的保护

有机合成中旳基团保护、导向基(高考必备) (一)基团保护在有机合成中,些不但愿起反映旳官能团,在反映试剂或反映条件旳影响下而产生副反映,这样就不能达到估计旳合成目旳,因此,必须采用对这些基团进行保护,完毕合成后再除去保护基,使其复原。
对保护措施一定要符合下列规定:①只对要保护旳基团发生反映,而对其他基团不反映;②反映较容易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其他基团。
下面只简略简介要保护旳基团旳措施。
1、羟基旳保护在进行氧化反映或某些在碱性条件进行旳反映,往往要对羟基进行保护。
如避免羟基受碱旳影响,可用成醚反映。
避免羟基氧化可用酯化反映。
2、对氨基旳保护氨基是个很活泼旳基团,在进行氧化、烷基化、磺化、硝化、卤化等反映时往往要对氨基进行保护。
(1)乙酰化(2)对NR 2可以加H+ 质子化形成季铵盐,– NH 2也可加H+– OH–CH C 或酸–NH 2-C O-O -C O–成 – NH3而保护。
3、对羰基旳保护羰基,特别是醛基,在进行氧化反映或遇碱时,往往要进行保护。
对羰基旳保护一般采用缩醛或缩酮反映。
4、对羧基旳保护羧基在高温或遇碱性试剂时,有时也需要保护,对羧基旳保护最常用旳是酯化反映。
5、对不饱和碳碳键旳保护碳碳重键易被氧化,对它们旳保护重要要加成使之达到饱和。
(二)导向基在有机合成中,往往要“借”某个基团旳作用使其达到预定旳目旳,预定目旳达到后,再把借来旳基团去掉,恢复本来面貌,这个“借”用基团 我们叫“导向基”。
固然这样旳基团,要符合易“借”和易去掉旳原则,如由苯合成1,3,5 – 三溴苯,在苯旳亲电取代反映中,溴是邻、对位取代基,而1,3,5 – 三溴苯互居间位,显然不是由溴旳–COOH + R –OH H –CHO +2ROH H定位效应能引起旳。
但如苯上有一种强旳邻、对位定位基存在,它旳定位效应比溴旳定位效应强,使溴进入它旳邻、对位,这样溴就会呈间位,而苯环上本来并无此类基团,显然要在合成时一方面引入,完毕任务后,再把它去掉,正好氨基能完毕这样旳任务,由于它是一种强旳邻、对位定位基,它可如下引入:– H → – NO 2 → – NH 2 ,同步氨基也容易去掉:– NH2→ – N 2 → – H 因此,它旳合成路线是:根据导向基团旳目旳不同,可分为下列几种状况:1、致活导向 如果要合成 可以用 但这种措施产率低,由于丙酮两个甲基活性同样,会有副反映发生:但在丙酮旳一种甲基上导入一种致活基团,使两个甲基上旳氢旳活性有明显差别,这可用一种乙酯基(–C OO C2H 5)导入丙酮旳一种甲基上,则这个甲基旳氢有较大旳活性,使这个碳成为苄基溴攻打旳部位,因此,运用乙酰乙酸乙酯而不用丙酮,完毕任务后,把乙酯基OC 6O + C 6BrO C 6C 6Br O COOC C 2H 5O O COOC C6O COOC 1)2)△ C 6O OC6C 6Br碱C 6Br 碱OC 6C 6O水解成羧基,运用β– 酮酸易于脱羧旳特性将导向基去掉,于是得出合成路线为:2、致钝导向活化可以导向,有时致钝也能导向,如合成 氨基是很强旳邻、对位定位基,进行取代反映时容易生成多元取代物:如只在苯胺环上旳氨基旳对位引入一种溴,必须将氨基旳活性减少,这可通过乙酰化反映来达到,同步乙酰氨基是一种邻、对位定位基,而此状况下对位产物是重要产物:3、运用封闭特定位置来导向例如合成 ,用苯胺为起始原料,用混酸硝化,一方面苯胺易被硝酸氧化,另一方面,苯胺与硫酸还会生成硫酸盐,而 是一种H 2Br NH 2+ Br 2NH 2BrBr BrNH 2 BrNHCO BrBr 2H 2ONHCONH 2 NH 2NO–⊕间位定位基,硝化时得到,因此苯胺硝化时,要把苯胺乙酰化后,再硝化。
例谈有机合成中官能团的保护_熊光发

CH |
2OH
CH2OH
OO R—C—R' H2O/H+
O ‖ R—C—R'
O
(2)R—‖C—OC2H5 LiAlH4
H2O RCH2OH+C2H5OH
试以丙烯及其 他 必 要的 有 机试 剂为原 料 合成
CH3COCH2OH,无机试剂任选,写出合成流程图。 解 析:结合 题 给 信息,不 难 设 计出前半 段合成 线
步骤④用丙酮与其他四个羟基反应以保护它们,然后
在步骤⑥中水解脱保护。
第Ⅱ小题中的有机合成则要求学生对上述所用到
的羟基保护方法,在领会的基础上加以运用。
答案:
I.(1)①(A 与 H2 加成得 B)、③(C 分子内 5 号 C
上的羟基与 2 号 C上的碳氧双键发生加成作用得 D:)
21|CCH=O2OH
一线教师在课堂教学中,要做到难点突破和重点 掌握,实现教学的有效性和高效性,有时很需要概览知 识内容的全部,再加以条分缕析和方法指导,彰显知识 构建的逻辑性,既要求得学生当下的发展(解决某个问 题)又要赢得长远发展(遇到新问题能触类旁通)。我 在进行高中化学“有机合成”的教学时,作了些许有关 的尝试。
路:
CH3CH=CH2
Br2
CH3|CH-|CH2 NaOH
官能团保护

官能团保护的意义
有机反应往往会伴有副反应,原因就是
有机反应的复杂性,反应条件、官能团 的相互影响等都会影响反应的进行.在 有些反应中,使某个官能团参加反应时, 可能会有其他的官能团受到影响,这样 就需要对官能团进行保护.
官能团的保护
一、保护基的基本条件 二、羟基保护 三、羰基保护
在一些例子中,最后一条可以放宽,允许保护基 被直接转变为另一种官能团。
二、羟基的保护基团
保护醇类 ROH 的方法一般是制成醚类 (ROR ′ ) 或酯 类(ROCOR′),缩醛或缩酮类。前者对氧化剂或还原剂都有 相当的稳定性。 1
. 醚类衍生物
①形成甲醚类 ROCH3 可以用碱脱去醇ROH质子,再与合成子 +CH3作用,如 使用试剂NaH/Me2SO4。也可先作成银盐 RO-Ag+ 并与碘甲 烷反应,如使用 Ag2O/MeI;但对三级醇不宜使用这一方法 。醇类也可与重氮甲烷CH2N2,在Lewis酸(如BF3·Et2O) 催化下形成甲醚.
以羧基为保护基:
OH CO2/NaHCO3 OH COOH OH Br Br2/AcOH OH COOH H3O OH
+
OH Br
OH
OH
以磺酸基为保护基:
CH3 浓H2SO4 CH3 Cl2,Fe CH3 Cl H3O
+
CH3 Cl
SO3H
SO3H
以硝基为保护基:
C(CH3)3
HNO3 H2SO4
Et2O AgNO3/H2O/EtOH
Ag
KCN/H2O -AgCN
H
格氏反应和有机锂合成中的保护
PhLi+RC CH
高中化学有机合成中的官能团保护

高中化学有机合成中的官能团保护在有机合成中,某些不希望起反应的官能团,在反应试剂或反应条件的影响下而产生副反应,这样就不能达到预计的合成目标,因此,必须采取措施保护某些官能团,待完成反应后再除去保护基,使其复原。
1、保护措施必须符合如下要求①只对要保护的基团发生反应,而对其它基团不反应;②反应较易进行,精制容易;③保护基易脱除,在除去保护基时,不影响其它基团。
2、常见的基团保护措施①羟基的保护在进行氧化或某些在碱性条件下进行的反应,往往要对羟基进行保护。
a.防止羟基受碱的影响,可用成醚反应。
b.防止羟基氧化可用酯化反应。
②对羧基的保护羧基在高温或碱性条件下,有时也需要保护。
对羧基的保护最常用的是酯化反应。
③对不饱和碳碳键的保护碳碳双键易被氧化,对它们的保护主要用加成反应使之达到饱和。
;④对羰基的保护(以信息题出现)羰基,特别是醛基,在进行氧化反应或遇碱时,往往要进行保护。
对羰基的保护一般采用生成缩醛或缩酮的反应。
(缩醛或缩酮)(缩酮)生成的缩醛或缩酮水解又变成原来的醛或酮。
3、题例解析例1、已知下列信息:①烯键在一定条件下氧化可生成二元醇:②醛能发生如下反应生成缩醛:缩醛比较稳定,与稀碱和氧化剂均难起反应,但在稀酸中温热,会水解为原来的醛。
现有如下合成路线:试回答下列问题:(1)写出A、B的结构简式:________、________。
(2)写出反应Ⅲ的化学方程式:________。
解析:由题给信息知,欲使CH2=CH—CHO变为CH2OH—CHOH—CHO,需将C=C双键氧化,而—CHO对氧化剂敏感,故应先进行保护,待C=C双键氧化完毕,再将醛基还原出来,故合成路线为:答案:(1)A:CH2=CH=CH(OC2H5)2 B:CH2OH—CHOH—CH(OC2H5)(2)CH2OH—CHOH—CH(OC2H5) CH2OH—CHOH—CHO+2C2H5OH例2、已知胺(R—NH2)具有下列性质:(Ⅰ)R—NH2+(CH3CO)2O R—NHCOCH3+CH3COOH(Ⅱ)R—NHCOCH3+H2O R—NH2+CH3COOH硝基苯胺是重要的化工原料,其合成路线如下:(1)a、c、e分别为________。
有机化学官能团的保护.

5.羧基的保护
COOH KOH CH2Cl COOK
COOCH2
H2,Pt
COOH
苯甲酯可由羧酸与苯甲基卤在碱性条件 下反应而得.它除了可在强酸性或碱性条 件下水解,还可以被氢解.
感谢各位老师与同学
Байду номын сангаас
2.1 转变成醚
• 叔丁醚
将醇的二氯甲烷溶液或悬浮液在 硫酸复 合物存在下,在室温与过量的异丁烯作用, 可得到叔丁醚。
优点:对碱及催化氢化是稳定的。
缺点:对酸敏感,其稳定性低于甲醚。由 于脱保护基所用的酸性条件剧烈,当分子 中存在对酸敏感的基团时不适用
2.1
• 三甲硅醚
转变成醚
三甲硅醚广泛用于保护糖类、甾类及其他醇 羟基。通常引入三甲基硅基保护基所用的试 剂有三甲基氯化硅和碱;六甲基二硅氨烷。 在含水醇溶液中加热回流即可除去保护基。 优点:醇的三甲硅醚对催化氢化、氧化还 原反应是稳定的,该保护基可在非常温和 的条件下引入和去除。 缺点:对酸和碱敏感,只能在中性条件下 使用。
官能团的保护
蔡婷婷 张香香 马雅洁 尹莉 李佳家
选择保护基时应符合以下要求
• 1.易于被保护基团反应,且除被保护 基团外不影响其他基团。 • 2.保护基团必须经受得起在保护阶段 的各种反应条件。 • 3.保护基团易于除去。
化学合成中常用的保护基
• 羧 基 的 保 护 • 羰 基 的 保 护 • 氨 基 的 保 护 • 羟 基 的 保 护 • 碳 氢 键 的 保 护
2.2
转变成缩醛或缩酮
• 2,3-二氢-4H-吡喃在酸的催化作用下, 与醇类起加成反应,生成四氢吡喃醚衍 生物。这是最常用的醇羟基的保护方法 之一。此保护基广泛用于炔醇、甾类及 核苷酸的合成中。
有机化学中的官能团保护与去保护

有机化学中的官能团保护与去保护有机化学是化学中最为广泛的一个分支,研究的对象是有机化合物。
在有机化学领域中,有机合成是一项非常重要的技术。
在有机合成中,有时需要对其中的官能团进行保护或去保护的操作。
本文将介绍在有机化学中官能团的保护与去保护的相关知识。
一、官能团保护的概念及原因在有机合成中,官能团保护是一种重要的手段。
官能团保护是指在合成具有多个官能团的有机分子时,为了防止其他官能团发生不必要的反应而采取的临时措施。
有时候,某个官能团在反应过程中可能会引起竞争反应或者副反应,从而导致产物的纯度下降。
为了避免这种情况的发生,可以对这个官能团进行保护,待需求反应完成后再去除保护基团,从而得到目标产物。
二、官能团保护的方法1. 缩合反应:在目标官能团和保护官能团之间发生缩合反应,形成保护官能团。
这种方法适用于比较活泼的官能团。
2. 加成反应:在目标官能团上引入保护基团,使其转化成一种不活泼的官能团。
这种方法适用于不易被化学反应破坏的官能团。
3. 消除反应:通过消除反应去除保护基团。
官能团保护方法的选择取决于具体的反应条件和合成需求。
三、官能团去保护的方法在有机合成中,有时需要去除官能团的保护基团。
官能团去保护的方法主要有以下几种:1. 氢化还原:利用还原剂将保护基团还原成相应的氢。
2. 酸水解:在酸性条件下将保护基团水解去除。
3. 碱水解:在碱性条件下将保护基团水解去除。
4. 加热或照射:有些保护基团在受热或紫外光照射下会发生裂解,从而去除官能团保护。
官能团去保护方法的选择也取决于具体的反应条件和合成需求。
四、典型的官能团保护与去保护反应1. 羟基的保护与去保护:羟基常用酯化或硅烷化的方法进行保护,在酸性或碱性条件下可以去除保护基团。
2. 羰基的保护与去保护:羰基可用亚硫酸盐或酮醇的方法进行保护,通过还原剂可以去除保护基团。
3. 氨基的保护与去保护:氨基可用酯或酰亚胺的方法进行保护,酸性或碱性条件下可以去除保护基团。
有机化学中的官能团保护与去保护

有机化学中的官能团保护与去保护官能团保护是有机化学中的一项重要技术。
官能团保护可以在合成反应中起到保护和控制官能团反应的作用,使其不受到其他反应条件的干扰。
而去保护则是将保护官能团去除,使官能团恢复原来的活性。
本文将重点讨论有机化学中的官能团保护与去保护的相关内容。
一、官能团保护1. 保护官能团的目的在有机合成中,有时候需要保护某些官能团,以免其受到其他反应条件的干扰。
官能团保护的目的有以下几个方面:(1) 避免副反应:有机合成中常常伴随着多步反应,有些副反应会发生在特定的官能团上,通过保护这些官能团可以有效地避免不必要的副反应。
(2) 控制反应速率:有机反应中,一些官能团可能会加速或减缓反应的进行,通过保护官能团,可以控制反应速率,以便更好地控制合成过程。
(3) 保护活性官能团:有机合成中的一些活性官能团,如羟基、胺基等,容易受到空气、湿气等环境因素的影响,通过保护这些官能团,可以保持其活性。
2. 常见的官能团保护方法官能团保护有多种方法,下面介绍几种常见的官能团保护方法:(1) 酯保护:通过酯化反应将酸敏感官能团(如羟基)保护成酯,常用的保护剂有甲基、乙基等醇酚和对甲苯磺酸等。
(2) 醚保护:通过醚化反应将醇敏感官能团(如胺基)保护成醚,常用的保护剂有甲基、乙基等醇酚和氯甲基、溴甲基等卤代烷。
(3) 硅保护:通过硅化反应将官能团保护成硅醚,常用的保护剂有三甲基氯硅烷、三甲基乙氧基硅烷等。
二、官能团去保护官能团去保护是官能团保护的反向操作,它将保护官能团还原为原来的活性官能团。
官能团去保护可通过以下几种方式实现:1. 氢化还原:对于酯保护,可以使用氢气和催化剂进行还原反应,还原成羟基。
对于醚保护,可以使用硼酸或三氟乙酸等酸性条件还原为胺基。
2. 碱性水解:对于酯保护,可以使用氢氧化钠或氢氧化钾等碱性条件进行水解反应,水解为羟基。
对于醚保护,可以使用氢氧化钠或氢氧化钾等碱性条件还原为胺基。
3. 酸性水解:对于碳酸酯或脲保护,可以使用酸性条件进行水解反应,恢复原来的官能团。
官能团保护

Ar OH CH3I or (CH3)2SO4 NaOH Ar OCH3
脱去保护基:
甲醚对碱稳定,遇酸则分解,即甲醚需用强酸。常 用HBr,HI.在冰醋酸中回流。
Ar OCH3
Байду номын сангаас
HI
Ar OH
例题1:
CH3
COOC2H5
形成酰胺
答案:
NH2 CH3COCl (CH3CO)2O
NHCOCH3 HNO3 H2SO4
H2O O2N NHCOCH3 OH
-
O2N
NH2
总结:
基团 羟基 保护基形成 1.与甲基化试剂 形成醚 2.与酸酐形成酯 与乙二醇形成 缩酮或缩醛 与醇反应形成酯 与酰氯或酸 酐形成酰胺 脱保护基条件 1.H2O/H+ 2.H2O / OHH2O / H+ H2O / OHOH- / H+ H2O
官能团u盘写保护怎么去掉消费者权益保护法公主保护计划老年人权益保护法u盘写保护女职工劳动保护规定保护萝卜环境保护部环境保护法
官能团保护
羟基 羰基 羧基 氨基
羟基保护:(形成醚、酯)
1.形成醚类保护基(酚羟基)
由于 醇易被氧化,且具有活性 氢,一般用于对含格氏试剂的 反应及氧化反应加以保护
保护基的形成:
+
o
OH
CH2CO2H
氨基保护:(形成酰胺)
保护基形成:与酰氯或酸酐形成酰胺
RNH2 R'COCl/(R'CO)2O
由于易被氧化,常 用于氧化反应中对 氨基的保护
R'CONHR
脱去保护基:酸或碱条件下水解
高考有机化学考查新热点官能团的保护

关键词:有机化学,官能团,保 护,高考
引言
引言
随着有机化学的发展和广泛应用,官能团在有机化合物中的重要性日益凸显。 高考是有机化学考查的重要环节,考查官能团的保护成为高考有机化学的热点之 一。本次演示将介绍官能团保护在有机化学中的重要性,并针对高考考查新热点, 提供相应的方法和策略。
保护官能团
2、官能团保护的策略和技巧
2、官能团保护的策略和技巧
考生在复习过程中,应注重理解官能团保护的策略和技巧。例如,如何选择 合适的保护剂、如何避免副反应的发生等。结合实例题目进行练习,可以有效地 提高解题能力和效率。
3、强化应试心理素质
3、强化应试心理素质
高考是有机化学考查的重要组成部分,考生在面对此类考题时,需要具备扎 实的理论基础和良好的应试心理素质。在解题过程中,保持冷静、专注,合理安 排时间,做到思路清晰、严谨作答。
3、反应后处理
3、反应后处理
在反应结束后,可以通过选用适当的溶剂、加热、酸碱处理等手段将保护基 团去除,恢复官能团原有的结构和性质。
3、反应后处理
方法与策略 针对高考有机化学考查新热点——官能团的保护,以下方法和策略可供参考。
1、熟练掌握常见官能团及其性 质
1、熟练掌握常见官能团及其性质
考生需要熟练掌握各类常见官能团的化学性质和反应特性,以便在解题过程 中正确分析、判断和解决问题。
引言
机化学考查的历史和现状,阐述官能团的结构、性质及其对有机化学反应的 影响,并探讨如何在有机化学反应中保护官能团,最后通过高考热点题目解析来 说明保护官能团的重要性和解题技巧。
背景
背景
高考有机化学考查历来是考生的焦点。近年来,随着高考命题的不断创新, 有机化学考查的内容也越来越丰富多样。官能团的保护作为有机化学的核心知识 点,越来越受到高考命题专家的青睐。官能团的保护旨在让考生掌握如何在有机 化学反应中保护
导向基及官能团的保护

在上面的反应中①丙酮生成的烯醇式很少 产率不高 产率不高. 在上面的反应中①丙酮生成的烯醇式很少,产率不高 ② 由于丙酮 羰基的两侧均能反应,控制不好副产物较多 控制不好副产物较多. 羰基的两侧均能反应 控制不好副产物较多 为了反应更好的进行,我们需要使丙酮两侧甲基活性有较大的差异 我们需要使丙酮两侧甲基活性有较大的差异, 为了反应更好的进行 我们需要使丙酮两侧甲基活性有较大的差异 要大大提高一侧的反应活性.可以用 三乙”来代替丙酮. 可以用“ 要大大提高一侧的反应活性 可以用“三乙”来代替丙酮
四.基团保护
在复杂化合物的合成中, 在复杂化合物的合成中,反应底物中通常含有不止一 种官能团,为了保证主反应的顺利进行, 种官能团,为了保证主反应的顺利进行,避免另一些官能团 参与该反应,或在反应过程中这些官能团遭到破坏, 参与该反应,或在反应过程中这些官能团遭到破坏,目前主 要采用两种方法:一种是使用选择性试剂或控制反应条件; 要采用两种方法:一种是使用选择性试剂或控制反应条件; 另一种是将这些不希望反应的官能团用某种试剂保护起来, 另一种是将这些不希望反应的官能团用某种试剂保护起来, 当反应结束后,再除去这个试剂,使被保护的官能团复原, 当反应结束后,再除去这个试剂,使被保护的官能团复原, 这就是基团保护。 这就是基团保护。保护的方法涉及不同官能团的一些化学反 应,以及产物在不同环境中的稳定性. 以及产物在不同环境中的稳定性
一. 活化基
活化基在导向基中占主导地位,在有机合成中经常会遇到 活化基在导向基中占主导地位 在有机合成中经常会遇到. 在有机合成中经常会遇到 例如: 由苯合成1,3,5—三溴苯 例如 由苯合成 三溴苯
NH2 1) 混酸 2)Fe + HCl Br Br2 Br NH2 Br 1) NaNO2 + H 2) H3PO2 / H2O / Br Br Br
有机合成 第三章 官能团保护-PPT精品文档

CH H OAc H
3
2 Ac
O H
2
H
1
1 2
CH ,
2 Cl
O AcO
4
H , , H
5
CH
2 Cl
3 ONa 3 OH
脱 乙 酰 基 TM
H
3
,
H
OAc. 四氢吡喃醚 • 一元醇在TOH存在下与二氢吡喃作用生成 四氢吡喃醚
Ts OH , O OH Et O 2
+ H O, H 2
O O 混合型缩醛结构
OH
+ H
ROH O RO O H
+ -H
O
RO O
合成 CH CCH OH 由 HOC C CCO 2 2
• 答:
O CH CCH OH 2 , Ts OH O EtM gBr OCH C CH 2 O THF
OCH C CM g 2
. 1
6 4 % HOCH C CCOOH 2 . H O,+ H 2 2
第 三 章 官 能 团 的 保 护
学习内容
一 、 羰基的保护 二 、羟基的保护
三 、氨基的保护
四、 其他
一、羰基的保护
(一)形成缩醛和缩酮衍生物
• 1.二甲基或二乙基缩醛和缩酮 • 醛(酮)与醇或原甲酸酯 在酸催化下反 应 得缩醛(酮)--• 对还原剂、氧化剂(中性、碱性)、格 氏试剂很稳定。 • 特点: • 只适用于醛或位阻小的酮(选择性)!
6
,
2 OH
CH H
4 5
H OH H
6
3
O H
2
H
1
1 2
CH ,
3
2 OH
官能团保护1

在糖和核苷酸化学中,苄基广泛地用来保护羟基 制备: 1、醇/苄氯/强碱,加热
2、醇/苄氯/氧化银/DMF,室温反应
稳定性:
苄基醚对氧化剂(高碘酸盐、四乙酸铅等)、 还原剂(氢化铝锂等)、酸、碱都相当稳定。
脱保护:
1、Pd/H2(钯催化加氢)
2、Na/NH3(液)还原,Na/乙醇
举例:
O 碱 Cl3CH2CH2OC OR
脱去保护基:乙酸/Zn或乙酸/Zn-Cu, 室温
举例:
O
O O OH 1. Cl3C
O Cl 2. HCl/H2O/MeOH
HO 1.R HO OTceoc
O C Cl
RCOO
2.Zn/AcOH
RCOO
OH
成醚 1、苄基醚
通式:
碱 ROH + PhCH2Cl
RO-CH2Ph
五、胺基的保护
一、活波碳-氢键的保护
主要讨论的内容: 1)末端炔烃的碳-氢键的保护 2)环酮α-碳-氢键的保护
(一)端炔的C-H键
末端炔烃C-H易与活波金属、强碱、强氧化剂以
及有机金属化合物反应。因此,在某种情况下要
对炔氢进行保护
一、端炔的C-H键
例1:
Br Mg/THF BrMg C CSiMe3 C CH 1. RMgBr 2. Me2SiCl Br C CSiMe3
一、活化定位导向(主要手段)
例1 合成下列化合物
O
分析:
O
Ph
O +
Ph
Br
Ph
合成:
O B Ph Br O + Ph Ph
副产物
O Ph
本方法产率低,因为有二苄基酮产生。
官能团保护知识详解

高考有机预测有机合成中的防官能团的保护与恢复方法有机合成中有时会遇到这样的情况,本意只想对某个官能团进行处理,结果却影响了其它官能团。
“投鼠忌器”,防止对其它官能的影响,常常采用先保护后恢复的方法。
1.酚羟基的保护酚甲醚对碱稳定,对酸不稳定。
2.醛、铜羰基的保护缩醛(酮)或环状缩醛(酮)对碱Grignard试剂,金属氢化物等稳定,但对酸不稳定。
3.羧基的保护4。
氨基的保护一、防官能团受还原影响的保护与恢复试以丙烯及其它必要的有机试剂为原料来合成CH3COCH20H,无机试剂任选,写出有关反应的化学方程式。
已知:(1)RCR'ORCR'OC H 2CH 2O RCR'O HOCH 2CH 2OH H 2(2)R C OC 2HORCH 2OHC 2H 5OH[简析]解有机合成题可以根据所要合成的物质,采用顺推、逆推齐推的思维方法。
依题给的有关信息反应的规律并结合所学的知识,可由顺推法初步形成以下的合成路线;CH 3CH=CH2CH 3CHBrCH 2CH 3CHOH-CH 23COCOOHBr 2若将-COOH 转化-CH 2OH 就“OK ”了。
再结合信息反应(2)可知,先将-COOH 转化为-COOC 2H 5,然后在LiALH 4作催化剂时与H 2成即可。
但要注意在这一转化过程中,CH 3-CO-中的O也可与H 2加成,故必须考虑将该官能团加以掩蔽和保护,最后重新将其 “复原”,这可以利用信息反应(2)的方法而达到目的。
从而易写出合成 CH 3-CO-CH 20H 的有关反应方程式如下 CH 3CH=CH 2+Br 2CH 3CHBr-CH 2BrCH 3CHBr-CH 2Br CH 3CHOH-CH 2CH 3CHOH-CH 23COCOOHCH 3COCOOHC 2H5OHCH 3COCOOC2H 5+H 2OCH 3COCOOC 2H 5+HOCH 2CH 2OHCH 3CCOOC 2H 5O O其他略二、防官能团受氧化影响的保护与恢复工业上用甲苯生产对羟基苯甲酸乙酯COOC 2H 5OH ,其生产过各如下图根据上图OHCH3CH 3ICH 3O CH 3O CH 3COOHCOOC 2H 5OHC 2H 5OHIH回答:(1)有机物A 的结构简式为____________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机合成中的基团保护、导向基(咼考必备)
(一)基团保护
在有机合成中,些不希望起反应的官能团,在反应试剂或反应条件的影响下 而产生副反应,这样就不能达到预计的合成目标, 因此,必须采取对这些基团进 行保护,完成合成后再除去保护基,使其复原。
对保护措施一定要符合下列要求:①只对要保护的基团发生反应,而对其他 基团不反应;②反应较容易进行,精制容易;③保护基易脱除,在除去保护基时, 不影响其他基团。
下面只简略介绍要保护的基团的方法。
1、羟基的保护
在进行氧化反应或某些在碱性条件进行的反应, 往往要对羟基进行保护。
女口 防止羟基受碱的影响,可用成醚反应。
-OH A - OR
2、对氨基的保护
氨基是个很活泼的基团,在进行氧化、烷基化、磺化、硝化、卤化等反应时 往往要对氨基进行保护。
防止羟基氧化可用酯化反应。
-OH -------- - O
OC
(1)乙酰化
-NH 2C 或酸OC 1 O
-NH 2— C —
CH 3
(2)对NR 可以加H +质子化形成季铵盐,-NH 也可加H +成-NHr 而保护。
3、对羰基的保护
羰基,特别是醛基,在进行氧化反应或遇碱时,往往要进行保护。
对羰基的 保护一般采用缩醛或缩酮反应。
+
_ H
-CHO + 2ROH
-CH(OR )2
o
CHjOH II + I
R —0—R
CH 2CH
f
化反应
4、对羧基的保护
羧基在高温或遇碱性试剂时,有时也需要保护,对羧基的保护最常用的是酯 -COOR
-COOH + R -OH
c\
o O
5、对不饱和碳碳键的保护
碳碳重键易被氧化,对它们的保护主要要加成使之达到饱和
(二)导向基
在有机合成中,往往要“借”某个基团的作用使其达到预定的目的,预定目 的达到后,再把借来的基团去掉,恢复本来面貌,这个“借”用基团 我们叫“导 向基”。
当然这样的基团,要符合易“借”和易去掉的原则,如由苯合成 1,3,5 -
三溴苯,在苯的亲电取代反应中,溴是邻、对位取代基,而
1,3,5 -三溴苯互居
间位,显然不是由溴的定位效应能引起的。
但如苯上有一个强的邻、对位定位基 存在,它的定位效应比溴的定位效应强,使溴进入它的邻、对位,这样溴就会呈 间位,而苯环上原来并无此类基团,显然要在合成时首先引入,完成任务后,再 把它去掉,恰好氨基能完成这样的任务,因为它是一个强的邻、对位定位基,它 可如下引入:
-H — -NO 2 f -NH 2,同时氨基也容易去掉:-NH 2 f -N 2 f -H 因此,它的合成路线是:
根据导向基团的目的不同,可分为下列几种情况: 1、致活导向
(
办
/
假如要合成
C 6H5
可以用
C 6H 5
/\
+ C 6H 5
Br -------- 扌
C 6H
5
+ H^O ———- C — b —
OH H
N6 NHa
NHa N 2OSO 3H
但在丙酮的一个甲基上导入一个致活基团,使两个甲基上的氢的活性有显著差别,这可用一个乙酯基(-COOC5 )导入丙酮的一个甲基上,则这个甲基的氢有较大的活性,使这个碳成为苄基溴进攻的部位,因此,利用乙酰乙酸乙酯而不用丙酮,完成任务后,把乙酯基水解成羧基,利用1 -酮酸易于脱羧的特性将导向基去掉,于是得出合成路线为:
2、致钝导向
活化可以导向,有时致钝也能导向,如合成N「
_Br
氨基是很强的邻、对位定位基,进行取代反应时容易生成多元取代物:
冒 2 NH2
「+ Br2 —Br_" Br
T
Br
如只在苯胺环上的氨基的对位引入一个溴,必须将氨基的活性降低,这可通过乙酰化反应来达到,同时乙酰氨基是一个邻、对位定位基,而此情况下对位产物是主要产物:
3、利用封闭特定位置来导向
例如合成“
NO,用苯胺为起始原料,用混酸硝化,一方面苯胺易被
©
硝酸氧化,另-NH3SO4H
硝化时得到
NHCOCH 3
6
Br 2〉
NHCOCH 3
6
I
Br
一方面,苯胺与硫酸还会生成硫酸盐,而是一个间位定位基,
2欢迎下载
Br
,所以苯胺硝化时,要把苯胺乙酰化后,再硝化
微量
NHCOCH 3 一
d
NO 2
3
欢迎下载
(90%)
NHCOCH 3 [^J^NO 2
NO 2
(主要)
微量
由于乙酰基此时主要是对位产物,所以仍不能达到目的。
如果导向一个磺酸 基,先把氨基的对位封闭,再硝化,可以得到满意结果:
SO 3H
SO 3H
2
NHCOCH 3
I
「-NO 2
精品文档
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求。
