乙酰氯〉乙酸酐〉冰醋酸
实验二 乙酰苯胺的制备及纯化

冰浴
抽滤
冷却 结晶
洗涤
重结晶(无色晶体不需要) 干燥,称重
六、注意事项
1.量取乙酸酐的量筒一定要干燥。
2. 制备苯胺盐酸盐时,加热若有油珠出现,可以 用分液漏斗分去。
3.活性炭除去有色杂质时,需要趁热过滤。布氏 漏斗及抽滤瓶要预热。
注意事项
4.乙酰苯胺在不同温度下溶解度不同。所以重 结晶要加热水,控制水和活性炭的用量,以免 造成乙酰苯胺的损失。
有机化学实验 实验二、乙酰苯胺的制备及纯化
一、实验目的
1.掌握苯胺乙酰化的反应原理和制备方法; 了解芳胺乙酰化在有机合成中的应用。
2.掌握布氏漏斗抽滤等实验操作技能。
3. 进一步巩固固体物质提纯方法—重结晶 的操作技术
二、实验原理
1.胺的酰化在有机合成中有着重要的作用。 (1)作为一种保护措施,保护氨基; (2)重要工业原料和医药中间体。
五、实验步骤
3.水泵减压抽滤,冷水洗涤,干燥称重。 4.重结晶纯化乙酰苯胺。熔点:
113~114℃ 。
250ml 烧杯
煮沸 3分钟
操作流程
60ml 水 2.5ml 浓盐酸
搅拌 冷却
2.8g 苯胺
加少许活性炭 0.5g
热过滤
冷至 50oC
4.5g 乙酸钠+10 3.7ml 醋酸酐 水( 溶液)
三、药品及仪器装置
药品:60 mL配制好的稀盐酸;2.8 g (5 mL, 0.055 mol)苯胺(新蒸); 4.5 g 醋酸钠;3.7 mL醋酸酐;0.5 g 活性炭
仪器:250 mL烧杯;烧杯;温度计; 锥形瓶;布氏漏斗;抽滤瓶。
四、实验装置及重结晶装置
布氏漏斗
抽 滤 瓶
常用乙酰化试剂概览

常用乙酰化试剂概览常用乙酰化试剂概览引言:乙酰化试剂是化学实验室中常用的试剂之一,在有机合成和分析化学研究中发挥着重要的作用。
本文将对常用的乙酰化试剂进行概览,并深入探讨它们的性质、用途以及注意事项。
第一部分:乙酰化试剂的定义和基本原理乙酰化试剂是一类能够引入乙酰基(CH3CO-)的化合物,常用于有机合成中的酰基化反应。
它们通常是无色或淡黄色的液体,在室温下可挥发,具有刺激性气味。
乙酰化试剂通过与底物反应,将乙酰基添加到底物的官能团上,从而改变底物的性质和活性。
第二部分:常用的乙酰化试剂及其性质和用途1. 乙酸酐(Acetic Anhydride):乙酸酐是最常用的乙酰化试剂之一,它具有良好的稳定性和反应活性。
乙酸酐通常用于酯化反应、酰化反应、乙酰化反应等有机合成反应中。
然而,乙酸酐在反应过程中会产生腐蚀性气体,因此使用时需要注意安全措施。
2. 乙酸(Acetic Acid):乙酸是一种常见的简单酸,它是乙酰化试剂中最简单的一种。
乙酸通常用于酯化反应、酰化反应和乙酰化反应等有机合成反应中。
与乙酸酐相比,乙酸反应速度较慢,但相对更安全易得。
3. 乙酰氯(Acetyl Chloride):乙酰氯是一种常用的乙酰化试剂,它具有较高的反应活性和选择性。
乙酰氯通常用于酯化反应、酰化反应和乙酰化反应等有机合成反应中。
然而,乙酰氯具有剧烈的腐蚀性和刺激性,使用时应戴手套和防护眼镜。
4. 乙酰溴(Acetyl Bromide):乙酰溴是一种反应活性较高的乙酰化试剂,它通常用于酰化反应和乙酰化反应等有机合成反应中。
乙酰溴与水反应会分解产生乙酸和盐酸,因此使用时应注意避免水分的存在。
第三部分:使用乙酰化试剂的注意事项1. 安全性注意:乙酰化试剂大多具有刺激性和腐蚀性,使用时应佩戴适当的个人防护装备,如手套、防护眼镜和实验服。
2. 反应条件控制:乙酰化反应通常在室温下进行,但有些底物对反应条件要求较高。
在进行乙酰化反应时,应根据底物的特性选择适当的反应温度和时间。
《医用有机化学》课后习题答案(总)
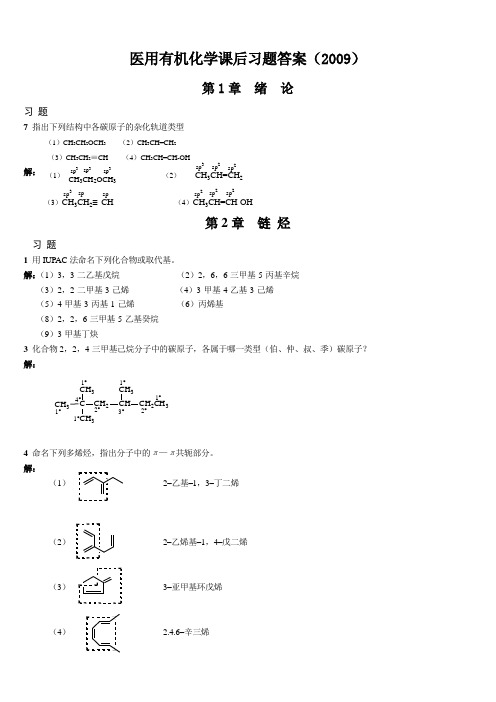
医用有机化学课后习题答案(2009)第1章 绪 论习 题7 指出下列结构中各碳原子的杂化轨道类型(1)CH 3CH 2OCH 3 (2)CH 3CH=CH 2 (3)CH 3CH 2≡CH (4)CH 3CH=CH-OH解:第2章 链 烃习 题1 用IUPAC 法命名下列化合物或取代基。
解:(1)3,3-二乙基戊烷 (2)2,6,6-三甲基-5-丙基辛烷 (3)2,2-二甲基-3-己烯 (4)3-甲基-4-乙基-3-己烯 (5)4-甲基-3-丙基-1-己烯 (6)丙烯基 (8)2,2,6-三甲基-5-乙基癸烷 (9)3-甲基丁炔3 化合物2,2,4-三甲基己烷分子中的碳原子,各属于哪一类型(伯、仲、叔、季)碳原子? 解:CH 3CCH 3CH 3CH 2CHCH 3CH 2CH 31°4°1°2°1°3°2°1°1°4 命名下列多烯烃,指出分子中的π—π共轭部分。
解:(1) 2–乙基–1,3–丁二烯(2) 2–乙烯基–1,4–戊二烯(3) 3–亚甲基环戊烯(4) 2.4.6–辛三烯spsp2sp 3sp 2sp 2spsp 2CH 3CH=CH 2sp 2(1) (2)(3)CH 3CH 2≡CH (4)CH 3CH=CH-OH CH 3CH 2OCH 3sp 3sp3sp 3sp 3(5)5–甲基–1.3–环己二烯(6)4–甲基–2.4–辛二烯9 将下列自由基按稳定性从大到小的次序排列: 解:(3)>(2)>(1)>(4)10 按稳定性增加的顺序排列下列物质,指出最稳定者分子中所含的共轭体系。
解:(1)d >b >c >a (2)d >c >b >a12下列化合物有无顺反异构现象?若有,写出它们的顺反异构体。
解:(1)无 (2)有C=CCH 3HH 2H 5C =CCH 3HHC 2H 5(3)有C =CHC =CH BrCl C 4H 9Br ClC 4H 9(4)有3C =CBrCl HCH 3C =CBr ClH(6)有C =CC 2H 5CH 3C 2H 5CHCH 3CH 3C =CC 2H 5CH 32H 5CHCH 3CH 314 经高锰酸钾氧化后得到下列产物,试写出原烯烃的结构式。
有机化学B教材第二版课后习题解析第九章 羧酸和羧酸衍生物课后习题参考答案
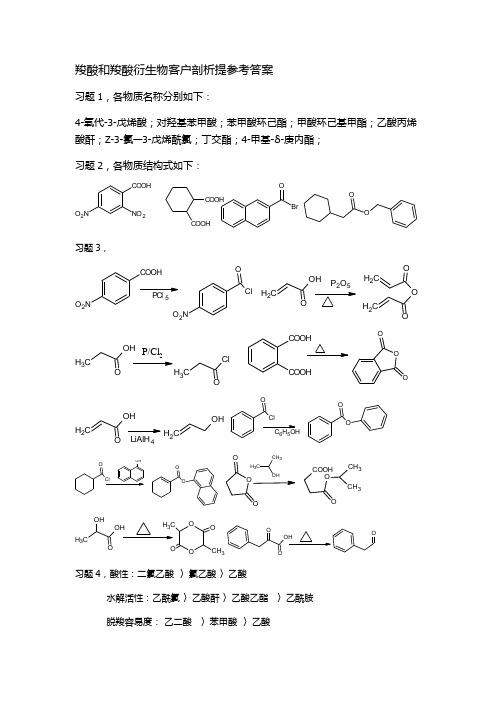
羧酸和羧酸衍生物客户剖析提参考答案习题1,各物质名称分别如下:4-氧代-3-戊烯酸;对羟基苯甲酸;苯甲酸环己酯;甲酸环己基甲酯;乙酸丙烯酸酐;Z-3-氯—3-戊烯酰氯;丁交酯;4-甲基-δ-庚内酯;习题2,各物质结构式如下:COOHNO2O2NCOOHCOOH OBrOO习题3,O2O2NOCH2OH P2O5CH2CH2OO CH3OHP/Cl2CH3ClCOOHCOOHOOO LiAlH4CH2OHCH2OHOOOOCOOHOOCH3CH3 CH3OHOOOOCCH3OO习题4,酸性:二氯乙酸〉氯乙酸〉乙酸水解活性:乙酰氯〉乙酸酐〉乙酸乙酯〉乙酰胺脱羧容易度:乙二酸〉苯甲酸〉乙酸醇解活性: 乙酰氯 〉丙烯酰氯 〉苯甲酰氯 与苯酚反应:乙酰氯 〉乙酸酐 〉乙酸习题5,H 2/Ni 用于碳碳双键,羰基的还原,没有选择性。
氢化铝锂用于羰基、羧基、硝基、卤代烃还原,对这些基团没选择性,但不还原C=C 。
遇水、活泼氢物质剧烈反应,遇空气自燃。
硼氢化钠只还原羰基,还可以在水溶液中进行。
习题6,COOH OO OH HOOCOOHOH C H 3OOH COOHOHOOCOOHOH CH 3KM nO 4褪色不褪色OH C H 3HOOCO OH2,4-二硝基苯肼COOHOO OH 丙酮酸苯甲酸水杨酸丙酮酸苯甲酸水杨酸显色不显色FeCl 3水杨酸苯甲酸(丙酮酸是少见的有银镜反应的羧酸)乙酰氯乙酸乙酯氯乙酸乙酰氯乙酸乙酯甲酸乙酯甲酸甲酯甲酸甲酯(水解产生乙醇的会有碘仿反应,水解产生甲酸的会有银镜反应)丙酮酸苯甲酸肉桂酸丙酮酸苯甲酸肉桂酸褪色不褪色苯甲酸Br Br肉桂酸草酸丙二酸丁二酸草酸酸色非酸色KM nO 4褪色不褪色丙二酸丁二酸强热pH 试纸检验气体丙二酸丁二酸苯甲酰氯苄氯对氯苯甲酸酸色非酸色KM nO 4褪色不褪色pH 试纸OH 2苯甲酰氯苄氯对氯苯甲酸苯甲酰氯苄氯另取样O H 2(苯甲酰氯水解产生氯化氢,可使高锰酸钾褪色) 习题7, 1)CH 3+4CH 3O O H -C3OAg+3C3O2)NH 3CH 3OH 24C H 3CH 2OH 3+CH 3CH 3OH KM nO C H 3CH 3OCN-CH 33OHOH 3+C H 3CH 3OHH 2SO 4CH 2CH 33)CH 3OHOCl /PCH 3OHOCH 2OHOSOCl CH 2ClO4)BrMgE t 2O MgBrOH 3553OHO5)CH 3OHOLiAlH CH 3OH CH 2CH 3CH 3CH 3O H 3+CH 3CH 3O KM nO 46)I KOHCH 3COOHLiAlH CH 3OH SOCl 2CH 3ClCH 3CH 3O MgE t 2OC H 3MgClCH CH 3O CH CH 3OHCH 37)CH 2CH 23+C H 3OHC H 3-CH 3OCrO /C H N +3CH 3C3OH H 2SO 4CH 3O CH 3O8)CH 3OH KM nO 4CH 3C OOHC l /POHOOH ON9)H 2Br NCCNBrBrOH 3+HOOCCOOH H 2/NiCOOH习题8,1)2个不饱和度,2个氧,无酸性,有C=C ,可水解(可能为酯),银镜反应为醛(烯醇酯异构成)碘仿反应为乙醛,综合为乙酸乙烯醇酯。
乙酰化

作用
乙酰化作用是生物体内经常进行的反应之一。例如:胆碱乙酰化形成生成乙酰胆碱,葡萄胺乙酰化生成乙酰 葡萄胺。又如脂肪酸的合成,萜类化合物、胡萝卜素、类固醇的合成,都必须通过一系列的乙酰化反应。一般通 过形成活性乙酰基即乙酰辅酶A而实现。
感谢观看
NH3(氨)+(CH3CO)2O(醋酸酐)→CH3CONH2(乙酰胺)+CH3COOH(醋酸)
剂
常用的乙酰化试剂有乙酰氯、乙酸酐和冰醋酸等,其中以冰醋酸最为价廉易得,乙酰氯反应最快。 二乙酰胺[ArN(COCH3)2]副产物的生成
优点
乙酰化(1)产物转化率高,达到95%以上;(2)催化剂活性高,用量小;(3)反应条件温和,反应时间短;(4) 催化剂可以重复使用数次仍保持高活性;(5)环保。
乙酰化
化学反应
01 释义
0Байду номын сангаас 优点 05 作用
目录
02 剂 04 特征过程
乙酰化就是将有机化合物分子中的氮、氧、碳原子上引入乙酰基CH3CO-的反应,最常见的是组蛋白乙酰化。 常用氯乙酰和醋酸酐等作为乙酰化剂。
释义
生命科学
有机化学
乙酰化是指将乙酰基转移到氨基酸侧链基团上的过程,最常见的是组蛋白乙酰化。
特征过程
乙酰化这种催化乙酰化反应的方法,其特征在于:在醇或酚与乙酸酐所进行的乙酰化反应过程中,以 [MORBSA][HSO4]离子液体作催化剂,催化剂用量占反应原料总摩尔数的0.5~1.0%,反应结束后,分离催化剂, 测定反应转化率;其具体步骤如下:第1步[MORBSA][HSO4]离子液体的制备将摩尔比为1.1∶1的吗啡啉和1,4丁烷磺内酯置于容器中,在50℃条件下,加入与反应物摩尔比为1∶0.8~1.2的乙醇作溶剂混合搅拌4~5h;反 应结束后,得到白色固体1-烷基-3-(丁基-4-磺酸基)吗啉盐;将该盐用乙醚洗涤2~4次,并进行真空干燥;在室 温下,将与上述1-烷基-3-(丁基-4-磺酸基)吗啉盐等摩尔的浓硫酸逐滴加入该盐中;于70~90℃下搅拌4~6h, 得到[MORBSA][HSO4]离子液体;所得离子液体用乙醚洗涤2~4次,除去非离子残余物后进行旋蒸除去乙醚;第2 步乙酰化反应在室温下,醇或酚和乙酸酐摩尔比为1∶1.0~4.0的溶液中加入0.5~1.0mol%的 [MORBSA][HSO4]离子液体,室温反应1~10min;反应完毕,得产物。
合成对溴苯胺

以硝基苯为起始原料合成对溴苯胺摘要以硝基苯为起始原料设计合成了对溴苯胺,其中要合成三个中间体,分别为苯胺、乙酰苯胺、对溴乙酰苯胺,各中间体的颜色、形状等物理性质均符合文献数据,理论产量较高。
通过本实验的合成步骤,能较为有效和便捷地合成对溴苯胺,提供了一个较好的合成方法。
关键词硝基苯;对溴苯胺;苯胺;乙酰苯胺;对溴乙酰苯胺;合成1 前言本实验以硝基苯为起始原料合成对溴苯胺,其中要合成三个中间体,分别为苯胺、乙酰苯胺、对溴乙酰苯胺。
)导入芳环上,而是经过间接方法来制苯胺的制取不可能用任意直接方法将氨基(-NH2取。
将硝基苯还原就是制取苯胺的一种重要的方法。
实验室常用的还原剂有锡-盐酸、二氯化锡-盐酸,铁-盐酸、铁-醋酸及锌-醋酸等。
用锡-盐酸作还原剂时,作用较快,产率较高,但价格较贵,同时,酸碱用量较多,铁-盐酸的缺点是反应时间较长,但成本低,酸的用量仅为理论量的1/40,如用铁-醋酸,还原时间还能显著缩短。
综合考虑,本实验选择锡-盐酸作还原剂。
乙酰苯胺可以通过苯胺与酰基化试剂如乙酰氯、乙酸酐或冰醋酸作用来制备。
乙酰氯、乙酸酐与苯胺反应过于剧烈,不宜在实验室内使用,而冰醋酸与苯胺反应比较平稳,容易控制,且价格也最为便宜,故本实验采用冰醋酸做酰基化试剂。
苯环卤代反应:卤素对苯环上的取代反应属亲电取代反应。
常用的催化剂有铁、铝、磷及其卤化物等。
苯环上如有取代基,则按取代基的亲电取代定位规则进行反应。
对溴乙酰苯胺在酸性条件下去保护生成对溴苯胺,这是常见的去保护基的方法。
243N O21.H C l3.N aO HN H2C H3C O O HN H C O C H32,H A cN H C O C H3B rH C lN H2B r图1 合成流程图表1 对溴苯胺的物理常数2实验部分2.1 主要仪器与试剂硝基苯;锡粒;浓盐酸;乙醚;氯化钠;氢氧化钠;冰醋酸;锌粉;活性炭;溴;乙醇;亚硫酸氢钠。
圆底烧瓶;回流冷凝管;空气冷凝管;刺形冷凝管;水蒸气蒸馏装置;保温漏斗;电动搅拌器;抽滤瓶;布氏漏斗。
有机化学实验思考题答案【精选】

实验一乙酰苯胺的制备(苯胺5ml、冰醋酸7.5ml,生成苯-NHCOCH3+、水,韦氏分馏柱、温度计蒸馏头尾接管等、布氏漏斗抽滤)1.制备乙酰苯胺为什么选用乙酸做酰基化试剂?(乙酰氯、乙酸酐反应过于激烈。
)答:冰醋酸与苯胺反应最慢,但反应平稳、易于控制,且醋酸价格较便宜。
2.为什么要控制分馏柱上端温度在100到110之间,若温度过高有什么不好?答:主要由原料CH3COOH和生成物水的沸点所决定。
控制在100到110度之间,这样既可以保证原料CH3COOH 充分反应而不被蒸出,又可以使生成的水立即移走,促使反应向生成物方向移动,有于提高产率。
3.本实验中采用了那些措施来提高乙酰苯胺的产率?答:加入过量冰醋酸,分馏时加入少量锌粉,控制分馏时温度,不断除去生成的水。
4.常用的乙酰化试剂有哪些?哪一种较经济?哪一种反应最好?答:常用的乙酰化试剂有乙酸、乙酸酐和乙酰氯。
乙酸较经济。
乙酰氯反应速度最快,但易吸潮水解。
因此应在无水条件下进行反应。
实验二重结晶(乙酰苯胺,加热溶解、稍冷却、加活性炭、继续加热、热过滤、冷却结晶、抽滤)1.重结晶一般包括哪几个操作步骤?各步操作的目的是什么?答:重结晶一般包括:溶解、脱色、热过滤、冷却结晶、抽滤、干燥等操作步骤。
各步操作的目的如下:熔解:配制接近饱和的热溶液;脱色:使样品中的有色杂质吸附于活炭上,便于在热过滤时将其分离;热过滤:除去样品中的不溶性杂质;冷却结晶:使样品结晶析出,而可溶性杂质仍留在溶液中;抽滤:使样品可溶性杂质与样品分离。
干燥:使样品结晶表面的溶剂挥发。
2.在什么情况下需要加活性炭?应当怎样加活性炭?答:样品颜色较深时,需要加入活性炭进行脱色。
为了防止爆沸,加活性炭时应将热溶液取下稍冷后再加。
3.为什么热过滤时要用折叠滤纸?答:增大过滤面积,加快过滤速度。
4.为什么利用重结晶只能提纯杂质含量低于5%的固体有机物?答:如果样品中杂质含量大于5%,则可能在样品结晶析出时,杂质亦析出,经抽滤后仍有少量杂质混入样品,使重结晶后的样品纯度仍达不到要求。
实验复习

7、脂肪提取器是利用溶剂回流和(虹吸)原理,使固体物质连续不断地为纯溶剂所萃取的仪器。
3、在下列( c )实验中,采用了升华操作。
A、黄连素的提取B、烟碱的提取C、咖啡因的提取D、菠菜色素的提取6.在苯甲酸的碱性溶液中,含有( b )杂质,可用水蒸汽蒸馏方法除去。
A、MgSO4B、CH3COONaC、C6H5CHOD、NaCl.8.检验重氮化反应终点用( a )方法。
A、淀粉-碘化钾试纸变色B、刚果红试纸变色C、红色石蕊试纸变色D、pH试纸变色10.在进行硅胶薄层层析中,Rf值比较大,则该化合物的极性( b )。
A、大B、小C、差不多D、以上都不对4、乙酸乙酯的制备中,为提高产率应加入过量的乙酸还是过量的乙醇?为什么?答:一般采用加入过量乙酸,以使乙醇转化完全,避免由于乙醇和水及乙酸形成二元或三元恒沸物给分离带来困难。
5、在肉桂酸制备实验中,为什么要用新蒸馏过的苯甲醛答:苯甲醛放久了,由于自动氧化而生成较多量的苯甲酸,这不但影响反应的进行,而且苯甲酸混在产品中不易除干净,将影响产品的质量。
故本反应所需的苯甲醛要事先蒸馏,截取170~180℃馏分供使用。
1、在色谱中,吸附剂对样品的吸附能力与(吸附剂的含水量)、(吸附剂的粒度)、(洗脱溶剂的极性)以及(洗脱溶剂的流速)有关。
5、乙酸乙酯中含有(有色有机杂质)杂质时,可用简单蒸馏的方法提纯乙酸乙酯。
6、合成乙酰苯胺时,反应温度控制在(100-110 )摄氏度左右,目的在于(蒸出反应中生成的水,且尽可能避免醋酸蒸出)。
当反应接近终点时,蒸出的水分极少,温度计水银球不能被蒸气包围,从而出现温度计(读数下降)的现象。
7、升华是纯化(固体)有机化合物的一种手段,它是由化合物受热直接(汽化为蒸汽)然后由(蒸汽又直接冷凝)为固体的过程。
1、在乙酰苯胺的制备过程中,为促使反应向正方向进行,实验中使用了( d )。
A、干燥剂B、滴液漏斗C、接点式温度计D、刺形分馏柱3、当反应产物为碱性化合物时,要对其进行纯化,所采取的简单方法为( b )。
常用的乙酰化试剂

常用的乙酰化试剂
乙酰化试剂是一类常用的有机化合物,其主要作用是将羟基、胺基等
官能团乙酰化,从而改变化合物的性质。
以下是常用的乙酰化试剂及
其特点。
1. 乙酸酐:乙酸酐是一种常见的乙酰化试剂,适用于大多数羟基化合
物的乙酰化反应。
它易于制备和储存,具有较高的反应速度和较高的
选择性。
2. 乙酸氧化铜:乙酸氧化铜也是常用的乙酰化试剂之一,适用于一些
较难乙酰化的化合物,如糖类、多肽类。
但由于其反应条件较为苛刻,需要在惰性气体保护下反应,所以操作起来相对较为复杂。
3. 乙酰氯:乙酰氯是一种廉价、易于制备的乙酰化试剂,适用于一些
脂肪族羟基化合物的乙酰化反应。
但由于其反应条件较为苛刻,需要
在低温下反应,并且具有较强的腐蚀性,使用时需要小心操作。
4. 乙酸银:乙酸银是一种较为温和的乙酰化试剂,适用于一些温和的
羟基化合物的乙酰化反应。
但由于其反应速度较慢,需要较长的反应
时间,并且具有较高的成本,所以应用较为有限。
5. 乙酸醋酸酯:乙酸醋酸酯是一种可溶于有机溶剂的乙酰化试剂,适
用于一些不溶于水的化合物的乙酰化反应。
由于其反应条件较为温和,不需要惰性气体保护,且易于操作,所以得到了广泛的应用。
乙酰化试剂具有广泛的应用价值,在药物合成、生物化学等领域中得
到了广泛的应用。
但使用乙酰化试剂时需要注意选择适合的试剂,根
据化合物的性质和反应条件选择合适的乙酰化试剂,并且要注意操作
安全,防止危险发生。
实验八 乙酰苯胺的制备

能找到一种合适的溶剂时,常可使用混合溶剂而得到满意的结果。
三、实验参数
名称 分子量 性状
密度 /g/cm3
熔点 /℃
沸点 /℃
溶解度
水
油
无色油状
苯胺 93.12
1.02
液体
-6.2 184.4
微溶
易溶于乙醇、乙 醚等
乙酸 60.05 无色液体 1.0492
(25℃)、3.5g(80℃)、5.5g(100℃);乙醇:36.9g(20℃)甲醇:69.5g(20℃)氯仿:3.6g (20℃)。乙酰苯胺在水中的含量为 5.2%时,重结晶效率好,乙酰苯胺重结晶产率最大。在 体系中的含量稍低于 5.2%,加热到 83.2℃时不会出现油相,水相又接近饱和溶液,继续加 热到 100℃,进行热过滤除去不溶性杂质和脱色用的活性炭,滤液冷却,乙酰苯胺开始结晶, 继续冷却至室温(20℃),过滤得到的晶体乙酰苯胺纯度很高,可溶性杂质留在母液中。一 个经验的办法是按操作步骤给出的产量 5g(初做的学生很难达到),估计需水量为 100mL, 加热至 83.2℃,如果有油珠,补加热水,直至油珠溶完为止。个别同学加水过量,可蒸发部 分水,直至出现油珠,再补加少量水即可。
7.不应将活性炭加入沸腾的溶液中,否则会引起暴沸,会使溶液溢出容器。 8.减压过滤:用布氏漏斗趁热过滤时,为了避免在漏斗中析出晶体,需用热水浴或蒸 气浴把漏斗预热,然后用来减压过滤。抽滤瓶也可同时预热。布氏漏斗中铺的圆形滤纸要剪 得比漏斗内径小,使其紧贴于漏斗的底壁。在抽滤前先用少量溶剂把滤纸润湿,然后打开水 泵将滤纸吸紧,防止固体在抽滤时从滤纸边沿吸入瓶中。布氏漏斗的斜口要远离抽气口,用 玻璃棒引导将脱色后的固液混合物分批倒入布氏漏斗中抽滤。过滤完成后,关闭水泵前应先 将抽滤瓶与水泵间连接的橡皮管断开,以免水倒流入抽滤瓶内。 9.滤饼的洗涤:把滤饼尽量抽干、压干,拔掉抽气的橡皮管,使恢复常压。把少量溶 剂均匀地洒在滤饼上,使溶剂恰能盖住滤饼。静置片刻,使溶剂渗透滤饼,待有滤液从漏斗 下端滴下时,重新抽气,再把滤饼抽干。这样反复几次,就可洗净滤饼。 10.结晶的析出:结晶时,让溶液静置,使之慢慢地生成完整的大晶体,若在冷却过程 中不断搅拌则得较小的结晶。若冷却后仍无结晶析出,可用下列方法使晶体析出: ① 用玻璃棒摩擦容器内壁; ② 投入晶种; ③ 用冰水或其他冷冻溶液冷却,如果不析出晶体而得油状物时,可将混合物加热到澄 清后,让其自然冷却至开始有油状物析出时,立即用玻璃棒剧烈搅拌,使油状物分散在溶液 中,搅拌至油状物消失为止,或加入少许晶种。 六、问题讨论 1.乙酰苯胺制备实验为什么加入锌粉?锌粉加入量对操作有什么影响? 答:苯胺易氧化,锌与乙酸反应放出氢,防止氧化。锌粉少了,防止氧化作用小,锌粉 多了,消耗乙酸多,同时在后处理分离产物过程中形成不溶的氢氧化锌,与固体产物混杂在 一起,难分离出去。 2.乙酰苯胺重结晶时,制备乙酰苯胺热的饱和溶液过程中出现油珠是什么?它的存在 对重结晶质量有何影响?应如何处理? 答:油珠是未溶解的乙酰苯胺。它的存在,冷却后变成固体,里面包夹一些杂质,影响 重结晶的质量。应该再补加些水,使它溶解,保证重结晶物的纯度。 3.乙酰苯胺制备实验加入活性炭的目的是什么?怎样进行这一操作?
乙酰苯胺的制备实验
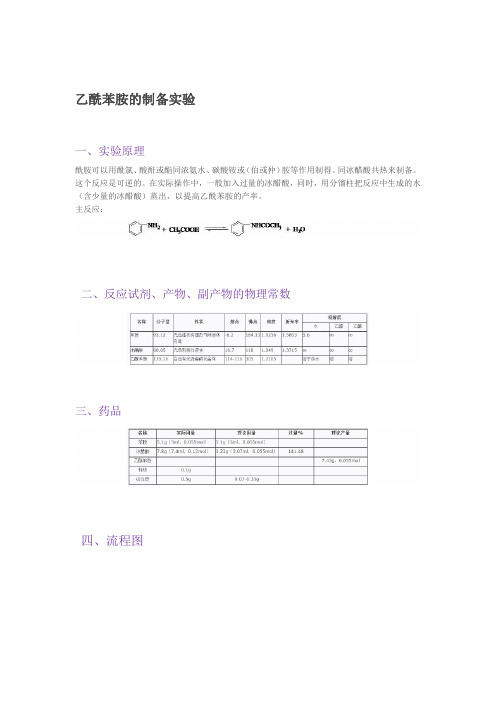
乙酰苯胺的制备实验一、实验原理酰胺可以用酰氯、酸酐或酯同浓氨水、碳酸铵或(伯或仲)胺等作用制得。
同冰醋酸共热来制备。
这个反应是可逆的。
在实际操作中,一般加入过量的冰醋酸,同时,用分馏柱把反应中生成的水(含少量的冰醋酸)蒸出,以提高乙酰苯胺的产率。
主反应:二、反应试剂、产物、副产物的物理常数三、药品四、流程图五、实验装置图)干燥装置(3 (2)抽滤装置)分馏装置(1六、实验内容℃温度计,用一个小锥形60ml锥形瓶上装一个分馏柱,柱顶插一支200在瓶收集稀醋酸溶液。
冰醋7.4ml(0.13mol))新蒸馏过的苯胺、在锥形瓶中放入5.0ml(0.055mol,然后逐渐升0.1g酸和锌粉,缓慢加热至沸腾,保持反应混合物微沸约10min,反应所生成的60min~℃左右。
经过温,控制温度,保持温度计读数在10540水(含少量醋酸)可完全蒸出。
当温度计的读数发生上下波动或自行下降时(有时反应容器中出现白雾),表明反应达到终点。
停止加热。
这时,蒸出的。
水和醋酸大约有4ml在不断搅拌下把反应混合物趁热以细流慢慢倒入盛100ml冷水的烧杯中。
继续剧烈搅拌,并冷却烧杯,使粗乙酰苯胺成细粒状完全析出。
用布氏漏斗抽滤析出的固体,用玻璃瓶塞把固体压碎,再用5~10ml冷水洗涤以除去残留的酸液。
把粗乙酰苯胺放入150ml热水中,加热至沸腾。
如果仍有未溶解的油珠,需补加热水,直到油珠完全溶解为止。
稍冷后加入约0.5g粉末状活性炭,用玻璃棒搅动并煮沸5-10min。
趁热用保温漏斗过滤或用预先加热好的布氏漏斗减压过滤。
冷却滤液,乙酰苯胺呈无色片状晶体析出。
减压过滤,尽量挤压以除去晶体中的水分。
产品放在表面皿上晾干后测定其熔点。
产量:约5.0g。
纯乙酰苯胺为无色片状晶体。
熔点mp=114.3℃。
(一)制备阶段1.安装分馏装置:如图(1)所示,在100ml锥形瓶上装一个分馏柱,柱顶插一支200℃温度计,用一个100ml锥形瓶收集稀醋酸溶液。
实验八-乙酰苯胺的制备-ok
m.p/℃ -6.2 16.6 114.3
b.p/℃ 184.4 118.1 304
ρ/g·cm-3 1.02 1.05 1.22
水溶性 微溶 易溶
20℃:0.46g;100℃:5.5g
有机化学实验
二.实验原理
Chem is try !
薄层色谱 (TLC):
属固-液吸附色谱,是一种微量、快速、简便、应用广 泛的分析分离方法;常用于分离、提纯和化学反应进程 指示等,也可用于柱层析前的 “预试”;适于样品量 0.01μg-500mg;特别适于挥发性较小,或在较高温度下 易发生变化而不能用气相色谱分离的物质。
2. 结晶抽滤:搅拌下,趁热倒入100mL冷水中,剧烈搅拌, 冷至室温,抽滤,压干。用5~10mL冷水洗涤,再抽干。
3. 重结晶:粗产品用150mL热水溶解;稍冷后,加入约 0.2g活性炭,搅拌下煮沸1~2min;趁热抽滤;滤液自然冷 却至室温,晶体析出;抽滤,压干;晶体干燥;称重。
有机化学实验
五.注意事项
本实验用薄层色谱法来监控反应进程;
本实验产品用重结晶法(以水为溶剂)进行纯化。
有机化学实验
三.实验药品和装置
Chem is try !
药品:苯胺、冰醋酸、锌粉、活性炭、乙酸乙酯、石油醚 装置:
有机化学实验
四.实验步骤
Chem is try !
1. 向100mL二口圆底烧瓶中加入5mL苯胺, 7.4mL冰乙酸 和0.1g锌粉,安装装置。微沸回流,控制柱顶温度105℃左 右,反应约40~60min。(从侧口用毛细管取液,通过薄层 色谱监控反应进程)。
固定相:硅胶、氧化铝等,吸附;
流动相:展开剂,溶解。极性顺序为:
ab
乙酰苯胺的制备实验论文

量变引起质变——乙酰苯胺制备的最佳条件姓名:胡一凡孔荣院系/单位:资源与环境学院专业班级:环境工程二班From quantitative change to qualitative change——Preparation of acetanilide -- the best conditionsName: Hu Yifan Kong RongDepartment / unit: College of resources and environmentThe professional class: Environmental Engineering two class摘要:本文通过实验研究了勒夏特列原理(改变反应物的量)对乙酰苯胺合成产率的影响,以确定乙酰苯胺制备的最佳条件。
利用加热回流和重结晶法进行制备和提纯,通过改变反应物的剂量,争取利用最少剂量的试剂和最短的时间以获得满意的实验效果,得到最多的乙酰苯胺。
关键词:重结晶醋酸热过滤Abstract: This paper experimental study of Le Chatelier's principle (change of reactants amount) on acetanilide yield, in order to determine the optimum conditions for preparation of acetanilide. The use of heating reflux and recrystallization method preparation and purification, by changing the reactant dosage, strive for use at least dosage of reagents and the shortest time to obtain a satisfactory experimental results, get most of acetanilide.Key words: heavy crystallization acetic acid hot filtration前言:2011年10月18日,吉林农业大学2010级环境工程专业2班同学于有机化学实验室探讨了乙酰苯胺制备微型实验的最佳条件。
乙酰氯〉乙酸酐〉冰醋酸

一般来说,有机合成实验可分为合成和精制两步。 本反应为可逆反应,合成时为提高产量,可以把生成的 水蒸出使反应不断向右进行。 粗产品的精制可以采用热过滤、重结晶等提纯方法。 重结晶利用同一溶剂对被提纯物质及杂质的溶解不 同,将被提纯物质从过饱和溶液中析出,而将杂质留在 溶液中。
上页 下页
退出
三、实验步骤
下页退出上页三实验步骤返回1合成如图搭好装置10ml011mol新蒸的苯胺15ml冰醋酸沸石加热控制温度在10540min馏出液68ml时结束反应搅拌下将产物倒入100ml冰水析出结晶抽滤蒸馏水洗涤3次抽干得粗产品
实验六 乙酰苯胺制备
下页 返回 退出
一、实验目的
1、掌握乙酰苯胺的制备原理并加深对乙 酰苯胺反应的理解。 2、熟练掌握重结晶、脱色、保温过滤、 抽滤等基本操作技术。
上页 下页 返回 退出
四、注意事项
1.趁热过滤时可将漏斗先进行保温,这样可避免热溶液 在漏斗中结晶造成损失。
ቤተ መጻሕፍቲ ባይዱ
2.倒入冰水后应不停搅拌,以免结块。
3. 活性炭不能加入沸腾或很热的溶液中以免溶液“暴 沸”。
上页 下页 返回 退出
1、合成
如图搭好装置,10ml(0.11mol)新蒸的苯胺+15ml冰醋酸+沸石→加
热,控制温度在105℃,40min→馏出液6~8ml时结束反应→搅拌下将产 物倒入100ml冰水,析出结晶→抽滤,蒸馏水洗涤3次,抽干得粗产品。
2、精制
加热下将粗产品溶于100~150ml蒸馏水→0.5g活性炭脱色,加热搅拌 5min→趁热过滤,冷冻滤液,析出晶体→抽滤,蒸馏水洗涤3次,抽干 得精品并称量,计算产率。
上页 下页 返回 退出
二、实验原理
乙酰苯胺现在是合成许多苯系取代物的中间 体,它的制备常使用乙酰化反应,即在苯胺中引 入乙酰基。 反应反应式为:苯胺 分子量93.13
冰醋酸乙酰氯反应

含水丁醇或戊醇对皂苷的溶解度较好,是提取和纯化皂苷时常用的 溶剂。 3.皂苷多具有苦、辛辣味,对人体粘膜有强烈刺激性。
第三节 三萜类化合物的理化性质 及溶血作用
二、熔点与旋光性
游离三萜类化合物具有固定的熔点,带羧基者熔点较高。 如齐墩果酸为308℃~310℃。三萜皂苷的熔点也较高,它们常在 到达熔点之前已发生分解,因此多无明显的熔点,测得是分解点, 一般在200~300℃之间。
六、溶血作用
皂苷又称皂毒类(sapotoxins),是指其有溶血作用。 溶血指数—在一定条件下能使血液中红细胞完全溶解的最低浓度。 皂苷的水溶液大多能破坏红细胞而有溶血作用(∴不能静脉注射给药) 皂苷水溶液肌肉注射易引起组织坏死,口服则无溶血作用。(可能在肠 胃不被吸收的原故) 。树脂、脂肪酸、挥发油等亦能产生溶血作用。产生假 阳性反应。 鞣质抑制溶血。 人参皂苷A抗溶血,B、C显著溶血,综合无溶血作用。
3.三氯醋酸反应(Rosen-Heimer)
TLC 25%三氯醋酸/EtOH 红 紫 PC
4.氯仿-浓硫酸反应(Salkowski )
样品/CHCl3浓H2SO4C源自Cl3层有绿色荧光, 硫酸层显红或蓝色
第三节 三萜类化合物的理化性质 及溶血作用
5.冰醋酸—乙酰氯反应(Tschugaeff ):
样品/冰醋酸 乙酰氯及氯化锌 淡红色或紫红色。
第三节 三萜类化合物的理化性质 及溶血作用
四、显色反应
1.醋酐-浓硫酸反应(Liebermann-Burchard)
样品/醋酐 浓H2SO4 黄
红
褪色
紫蓝
2.五氯化锑反应 样品/CHCl3 or 醇
20%五氯化锑
60-70
Or三氯化锑/ CHCl3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上页 下页 返回 退出
四、注意事项
1.趁热过滤时可将漏斗先进行保温,这样可避免热溶液 在漏斗中结晶造成损失。
2.倒入冰水后应不停搅拌,以免结块。
3. 活性炭不能加入沸腾或很热的溶液中以免溶液“暴 沸”。
上页 下页 返回 退出
实验六 乙酰苯胺制备
下页 返回 退出
一、实验目的
1、掌握乙酰苯胺的制备原理并加深对乙 酰苯胺反应的理解。 2、熟练掌握重结晶、脱色、保温过滤、 抽滤等基本操作技术。
上页 下页 返回 退出
二、实验原理
乙酰苯胺现在是合成许多苯系取代物的中间 体,它的制备常使用乙酰化反应,即在苯胺中引 入乙酰基。 反应反应式为:苯胺 分子量93.13
O NH2
+
CH3COOH
105
O
C
NH C
CH3
+
H2O
上页 下页 返回 退出
常用的乙酰化试剂:乙酰氯、乙酸酐或冰醋酸等。 活性顺序:乙酰氯〉乙酸酐〉冰醋酸 本次实验采用冰醋酸作为酰化剂。因为冰醋酸价格 便宜并且操作方便。
一般来说,有机合成实验可分为合成和精制两步。 本反应为可逆反应,合成时为提高产量,可以把生成的 水蒸出使反应不断向右进行。 粗产品的精制可以采用热过滤、重结晶等提纯方法。 重结晶利用同一溶剂对被提纯物质及杂质的溶解不 同,将被提纯物质从过饱和溶液中析出,而将杂质留在 溶液中。
上1、合成
如图搭好装置,10ml(0.11mol)新蒸的苯胺+15ml冰醋酸+沸石→加
热,控制温度在105℃,40min→馏出液6~8ml时结束反应→搅拌下将产 物倒入100ml冰水,析出结晶→抽滤,蒸馏水洗涤3次,抽干得粗产品。
2、精制
加热下将粗产品溶于100~150ml蒸馏水→0.5g活性炭脱色,加热搅拌 5min→趁热过滤,冷冻滤液,析出晶体→抽滤,蒸馏水洗涤3次,抽干 得精品并称量,计算产率。
