电化学复习PPT教学课件
合集下载
电化学基础-PPT课件

35
3. 氢镍电池是近年开发出来的可充电电池,
它可以取代会产生镉污染的镉镍电池。氢镍
电池的总反应式是:
1/2H2+NiO(OH)
Ni(OH)2
CD
据此反应判断,下列叙述中正确的是( )
A. 电池放电时,负极周围溶液的pH不
断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
Ag
电解质溶液Y是__A_g_N__O_3_溶__液_;
(2)银电极为电池的___正_____极,CuSO4溶液 Y
发生的电极反应为__A_g_+__+__e_-__=_A__g___
X电极上发生的电极反应为
__C_u___-2__e_-___=__C__u_2_+__________;
(3)外电路中的电子是从__负__(_C_u_电) 极流向
14
6. 双液原电池的工作原理(有关概念)
(1)盐桥中装有饱和的KCl溶液和琼脂制成的 胶冻,胶冻的作用是防止管中溶液流出
(2)盐桥的作用是什么?
可提供定向移动的阴阳离子,
使由它连接的两溶液保持电
中性,盐桥保障了电子通过
外电路从锌到铜的不断转移
,使锌的溶解和铜的析出过 程得以继续进行。
盐桥的作用: (1)形成闭合回路。
?思考
1、银器皿日久表面逐渐变黑色,这是由于生成硫
化银,有人设计用原电池原理加以除去,其处理方 法为:将一定浓度的食盐溶液放入一铝制容器中, 再将变黑的银器浸入溶液中,放置一段时间后,黑 色会褪去而银不会损失。 试回答:在此原电池反应中,负极发生的反应
为 Al -3e- = Al3+ ; 正极发生的反应为 Ag2S+2e- = 2Ag;+S2-
3. 氢镍电池是近年开发出来的可充电电池,
它可以取代会产生镉污染的镉镍电池。氢镍
电池的总反应式是:
1/2H2+NiO(OH)
Ni(OH)2
CD
据此反应判断,下列叙述中正确的是( )
A. 电池放电时,负极周围溶液的pH不
断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
Ag
电解质溶液Y是__A_g_N__O_3_溶__液_;
(2)银电极为电池的___正_____极,CuSO4溶液 Y
发生的电极反应为__A_g_+__+__e_-__=_A__g___
X电极上发生的电极反应为
__C_u___-2__e_-___=__C__u_2_+__________;
(3)外电路中的电子是从__负__(_C_u_电) 极流向
14
6. 双液原电池的工作原理(有关概念)
(1)盐桥中装有饱和的KCl溶液和琼脂制成的 胶冻,胶冻的作用是防止管中溶液流出
(2)盐桥的作用是什么?
可提供定向移动的阴阳离子,
使由它连接的两溶液保持电
中性,盐桥保障了电子通过
外电路从锌到铜的不断转移
,使锌的溶解和铜的析出过 程得以继续进行。
盐桥的作用: (1)形成闭合回路。
?思考
1、银器皿日久表面逐渐变黑色,这是由于生成硫
化银,有人设计用原电池原理加以除去,其处理方 法为:将一定浓度的食盐溶液放入一铝制容器中, 再将变黑的银器浸入溶液中,放置一段时间后,黑 色会褪去而银不会损失。 试回答:在此原电池反应中,负极发生的反应
为 Al -3e- = Al3+ ; 正极发生的反应为 Ag2S+2e- = 2Ag;+S2-
电化学基本概念ppt课件
i i
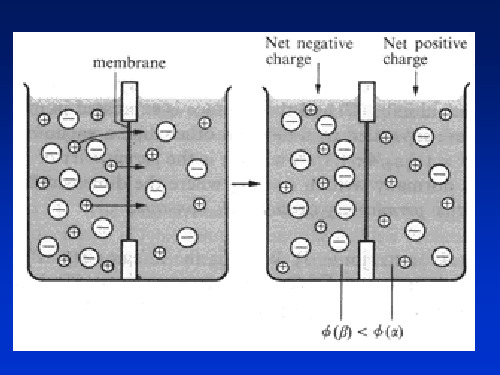
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
化学选修四《电化学复习》PPT课件

()
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为: O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为: Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH 保持不变。
D.电池工作时,电子通过外电路从正极流向负极。
2.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。 下列叙述错误的是( ) A.a为电池的正极
•常见的化学电源 化学电池分类:
一次 电池(如锌锰干电池、碱性锌锰电池) 二次 电池(又叫充电电池或蓄电池)(如铅蓄电池) 燃料 电池(如氢氧燃料电池)
(1)一次电池 ①碱性锌锰电池
构成:负极是锌,正极是MnO2,正极是KOH 工作原理:负极 Zn+2OH—-2e-=Zn(OH)2; 正极:2MnO2+2H2O+2e-=2MnOOH+2OH- 总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 特点:比能量较高,储存时间较长,可适用于大电流和连续放电。 ②钮扣式电池(银锌电池) 锌银电池的负极是Zn,正极是Ag20,电解质是KOH, 总反应方程式:Zn+Ag20=2Ag+ZnO
一、原电池组成 1、对比下面2个反应现象 a.由此得出原电池是将化学能转化成电能 b.原电池组成:活动性不同的两种金属做电极或一种金属和 一种非金属导体做电极;两极不能都是惰性电极。两极必须 浸入电解质溶液;电极形成闭合电路,可以把两极用导线连 接或把两极接触。电池中存在能自发的发生氧化还原反应。 原电池包括正极和负极 判断正负极 金属活动性强的为负极 与电解质溶液反应的为负极 化合价升高的为负极 ④外电路电子由负极流向正极 ⑤外电路电流由正极流向正极 ⑥质量减少的为负极 ⑦质量增加或是有气泡的为正极
《电化学》专题复习.ppt

精炼池
电解池
硫酸溶液 CuSO4溶液
原电池
电镀池
练习2、判断下列装置各属于什么池?
负极 正极
阳极 阴极
原电池
电解池
七、电极反应的书写
★如何书写电极反应?
规律:原电池或电解池的两电极反应式 之和即为总反应式,
写法:总反应式减去一电极反应式即为另 一个电极反应式。对于较复杂的、陌生的 反应可用该方法解题并检验。 书写注意事项:一看电极材料;二看环境 介质;三看附加条件与信息
(3)在E中,Cu______为极,发生_______反应,
电极反应为
。碳棒为______为极,发生
_______反应,电极反应为
。E中的实验
现象为
2. (1)右图的装置会出现什么现象?并完成 电极反应式和总反应式。
(2) 左边烧杯为____________装置,右边烧 杯为____________装置。当Zn减轻 0.65_______ g时,左边烧杯的碳棒增重 _______ g,右边烧杯的左边碳棒为_______ 极,产生的气体为_______ mol,右边烧杯 的右边碳棒为_______极,在标状下产生的 气体为_______ mL。
(4)设计电池 从理论上说,任何自发的氧化还原反
应均可设计成原电池
例:利用下述反应:2FeCl3 + Cu == 2FeCl2 + CuCl2设计一个原电池装置。
①画出装置图; ②标明电极材料和电解质溶液; ③写出电极反应式。 负极 正极 总反应式: 2 Fe3+ + Cu == 2Fe2+ + Cu2+
放电时:负极:Pb-2e-+SO42- =PbSO4 正极:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
到了四五月,各种花 竞相开放,争奇斗艳, 而橘子树却不声不响地 长出米粒大小的花骨朵。
花骨朵绽放开来,形状像 茉莉,一瓣一瓣的,有指 甲那么大,小巧、洁白、 清新、朴素,一簇簇藏在 枝叶间,星星点点的,不 大起眼。
但当你走近,那阵 阵香气扑面而来, 会使你醉倒。
到了四五月,各种花竞相开放, 争奇斗艳,而橘子树却不声不响 地长出米粒大小的花骨朵。花骨 朵绽放开来,形状像茉莉,一瓣 一瓣的,有指甲那么大,小巧、 洁白、清新、朴素,一簇簇藏在 枝叶间,星星点点的,不大起眼。 但当你走近,那阵阵香气扑面而 来,会使你醉倒。
练习
3. 右 图 中 x 、 y 分 别 是 直 流电源的两极,通电后发 现a极板质量增加,b极板 处有无色无臭气体放出, 符合这一情况的
A
小结:二、电解池的应用----电镀及氯碱工业
待镀制品
1、电镀
铜片 硫酸铜溶液
①电极: 阳极——镀层金属 阴极——待镀金属制品 ②电镀液:含有镀层金属离子的电解质溶液。
阴极放电:电极材料受保护,溶液中阳离子放电。
4、判断溶液的pH变化: 先分析原溶液的酸碱性,再看电极产物。
(1)如果只产生氢气而没有氧气,只pH变大; (2)如果只产生氧气而没有氢气,只pH变小; (3)如果既产生氢气又产生氧气
①若原溶液呈酸性则pH减小; ②若原溶液呈碱性pH增大; ③若原溶液呈中性pH不变。
③电解质溶液:溶液中CuSO4的浓度保持不变。
⒉氯碱工业氯原碱理工业(离子膜法)
Cl2
+
H2
-
淡盐水
Cl2 H+
NaOH溶液
Na+
Cl- OH-
Na+交换膜
精制饱和NaCl
H2O含少量NaOH
拓展练习
举例: 1、a 极变细,b 极变粗: 2、a 极变细,b 极有气泡: 3、a 极变粗, b 极有气泡: 4、a 极有气泡, b 极有气泡,且气体体积比为2 :1 5、a 极有气泡, b 极有气泡;阴极加酚酞变红
D、溶液中阴离子向正极方向移动,阳离子向负极方向移动。
练习
10.为下图所示装置中,a、b都是惰性电极,通
电一段时间后,b极附近溶液呈红色。下列说法正
确的是
A.X是正极,Y是负极
AC
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小 D.CuSO4溶液的PH值不变
•X Y •
Pt
Cu
a
b
CuSO4溶液
正极: 还原反应极→ 得电子极→ 电子流入极 充电:电解池 阳极: 氧化反应极 → 失电子极 → 电子流出极 阴极: 还原反应极 得电子极 → 电子流入极
拓展练习
7.银锌电池广泛用于电子仪器的电源,它的充电 和放电过程可表示为:
充电
2Ag + Zn(OH)2
Ag2O + Zn + H2O
放电
D
此电池放电时,负极下图为氢氧燃料电池原理示意图,按照此图的
提示,下列叙述不正确的是 A.a电极是负极
BD
B.b电极的电极反应为:4OH—-4e →2H2O+O2 C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种只能将氧化剂和燃料全部
储藏在电池内的发电装置
练习
12.一种新型的燃料电池,它以多孔镍板为电极插入
练习
4、下列图一、图二是铁钉在水中被腐蚀的实验
数天后
数天后
图一
图二
(1)上述两装置中铁钉发生变化的共性是: 发生了原电池 反应 (2)图一说明原溶液呈 中性或弱碱 性,铁钉发生 吸氧 腐蚀, 电极反应为:负极:Fe -2e = Fe2+ ; 正极:2H2O +O2 +2e =4OH(3)图二说明原溶液呈 较强酸性 性,铁钉发生 析氢 腐蚀, 电极反应为:负极:Fe -2e = Fe2+ ;正极:2H+ +2e = H2↑
巩固练习
2.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn电解质 溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn
+Ag2O== ZnO+2Ag根据以上提供的资料,判断下列说法正确的
是
AB
A、锌为负极,Ag2O为 正极;
B、放电时正极附近溶液的PH值升高;
C、放电时负极附近溶液的PH值升高;
小结:一、原电池与电解池的比较及判断:
1、池型的判断
有外加电源一定为电解池,无外加电源一定为原电池; 多池组合时,一般含活泼金属的池为原电池,其余都是 在原电池带动下的电解池。
2、电极的判断
原电池,看电极材料,电解池看电源的正负极。
3、电解池放电顺序的判断
阳极放电: 1)惰性电极:则溶液中阴离子放电。 2)非惰性电极:电极材料首先失电子。
小结:三、电解池及原电池的应用----金属的防护
1)金属腐蚀快慢的判断
①电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀> 有防腐蚀措施的腐蚀
②同一种金属的腐蚀:
强电解质>弱电解质>非电解质 2)金属的防护方法
①改变金属内部结构
②覆盖保护层 ③电化学保护法
外加电源的阴极保护法 牺牲负极的正极保护法
我的家乡在 长江边上,那里 有成片的橘园。
家乡的红橘, 真让人喜爱呀!
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
巩固练习
1.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确
的是
A、P是电源的正极
B
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑ C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极均参
加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
拓展练习
5.下列装置暴露空气中一段时间,铁的腐蚀由快到慢 顺序 D E F A C B .
Fe
Fe Zn
Fe C
A(海水)
Zn Fe
B(海水)
Fe Sn
C(海水)
Fe Sn
D(海水)
E(海水)
F(天然水)
练习
6、汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一 组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总
KOH溶液中,然后分别向两极通入乙烷和氧气,其总
反 应 为 : 2C2H6+7O2+8KOH==4K2CO3+10H2O , 有 关
此电池的推断正确的是
BC
A.负极反应为14H2O+7O2+28e-==28OHB.放电一段时间后,负极周围的pH减低
C.每消耗1molC2H6,则电路上转移的电子为14mol D.放电过程中KOH的物质的量浓度不变
反应式为:Pb+PbO2+2H2SO4
2PbSO4+2H2O
(1)试写出放电时的正、负极反应式
正极:_P__b_O_2_+_4_H_+_+_S_O__42_-__+_2_e_-__=_P_b_S_O_4_+_2__H_2_O_____
负极:_P__b_+__S_O_4_2_-_-__2_e_-__=_P_b_S__O_4_______________
9·家乡的 红橘
风霜考验 明媚 花骨朵竞 相开放 绽放 茉莉 一 瓣一瓣 一簇簇 朴素 又酸 又涩 成熟 沉甸甸 鲜嫩 舒畅
春天来了,经受了风 霜考验的橘子树更加茂 盛。
那四季常青的叶片在明 媚的阳光下闪着绿油油 的光。
春天来了,经受了风 霜考验的橘子树更加茂 盛,那四季常青的叶片 在明媚的阳光下闪着绿 油油的光。
秋天,橘子树结出 了肥实的青色果子, 一串串压弯了树枝, 谁见了谁爱,但这时 吃起来还又酸又涩。
十一月左右,果 实成熟了,绿叶丛 中露出了一盏盏红 色的小灯笼。
它们有的两个一排,有 的三个一束,有的四五 个抱成团……沉甸甸的, 把枝条儿越压越弯。
走近细看,红橘的 皮上还有一个个的 小窝窝呢。
剥掉皮,就是鲜嫩的、 金黄色的瓤,掰一瓣放 入嘴里轻轻一咬,满嘴 都是甜甜的汁,使人感 到舒畅极了。
十一月左右,果实成熟了,绿叶 丛中露出了一盏盏红色的小灯笼。 它们有的两个一排,有的三个一束, 有的四五个抱成团……沉甸甸的,把 枝条儿越压越弯。走近细看,红橘的 皮上还有一个个的小窝窝呢。剥掉皮, 就是鲜嫩的、金黄色的瓤,掰一瓣放 入嘴里轻轻一咬,满嘴都是甜甜的汁, 使人感到舒畅极了。
练习
1、写出下列装置的电极反应,并标明氧化反应还原反应
Fe
Cu
Fe
Cu
氯化铜
A
溶液
Cu
C
氯化钠
溶液 B
C
Cu
氯化铜溶液
C
氯化铜溶液
D
练习
2、写出下列装置的极反应,并判断A、B、C溶液PH 值的变化。
Fe
Ag
(D) AgNO3
Cu Ag Cu C
(A)
AgNO3
(B)
CuSO4
Pt Pt (C)
NaHSO4
(2)试写出充电时的阳、阴极反应式
阳极:__P_b_S_O__4+__2_H_2_O_-_2_e_-__=_P_b_O__2 _+__4_H_+_+_S_O__42_-____ 阴极:__P__b_S_O_4__+_2_e__- _=_P_b___+__S_O_4_2_-_____________
小结:四、原电池电解池的应用----可充电电池 放电:原电池 负极: 氧化反应极 →失电子极→ 电子流出极
