生物乳腺反应器的原理及进展
动物乳腺生物反应器
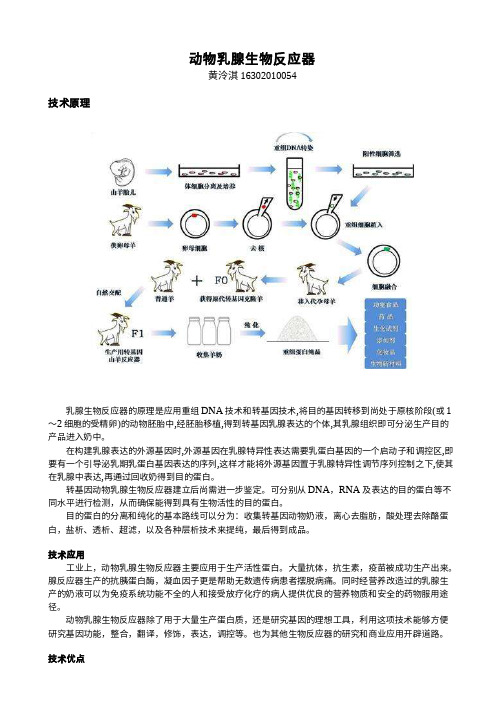
动物乳腺生物反应器黄泠淇 16302010054技术原理乳腺生物反应器的原理是应用重组DNA技术和转基因技术,将目的基因转移到尚处于原核阶段(或1~2细胞的受精卵)的动物胚胎中,经胚胎移植,得到转基因乳腺表达的个体,其乳腺组织即可分泌生产目的产品进入奶中。
在构建乳腺表达的外源基因时,外源基因在乳腺特异性表达需要乳蛋白基因的一个启动子和调控区,即要有一个引导泌乳期乳蛋白基因表达的序列,这样才能将外源基因置于乳腺特异性调节序列控制之下,使其在乳腺中表达,再通过回收奶得到目的蛋白。
转基因动物乳腺生物反应器建立后尚需进一步鉴定。
可分别从DNA,RNA及表达的目的蛋白等不同水平进行检测,从而确保能得到具有生物活性的目的蛋白。
目的蛋白的分离和纯化的基本路线可以分为:收集转基因动物奶液,离心去脂肪,酸处理去除酪蛋白,盐析、透析、超滤,以及各种层析技术来提纯,最后得到成品。
技术应用工业上,动物乳腺生物反应器主要应用于生产活性蛋白。
大量抗体,抗生素,疫苗被成功生产出来。
腺反应器生产的抗胰蛋白酶,凝血因子更是帮助无数遗传病患者摆脱病痛。
同时经营养改造过的乳腺生产的奶液可以为免疫系统功能不全的人和接受放疗化疗的病人提供优良的营养物质和安全的药物服用途径。
动物乳腺生物反应器除了用于大量生产蛋白质,还是研究基因的理想工具,利用这项技术能够方便研究基因功能,整合,翻译,修饰,表达,调控等。
也为其他生物反应器的研究和商业应用开辟道路。
技术优点1.动物乳腺的表达可进行翻译后修饰,如信号肽切除,蛋白的糖基化,羟基化及羧基化等,相比原核生物生产的外源蛋白,这种方法生产的蛋白具有生物活性和稳定性。
2.这种蛋白表达体系简单,一旦建立转基因动物乳腺生物反应器,只要简单地饲养好动物,利用动物乳腺的高表达能力,即可源源不断地得到贵重的药物蛋白。
3.转基因动物乳腺反应器的生产过程是一个畜牧业过程,饲养费用低廉,对环境没有污染,有广阔的发展前景。
动物乳腺生物反应器的原理及研究进展

般要 求 日粮 中钙 的供 应量 在 10 5 g左右 低 血镁 和 低血 磷 也 常常 造成 围产 期 奶 牛产 乳 热 的 发生 .围产 期给 奶 牛饲喂 含镁量 为 0 5 0 %的 日粮 . %~ . 3 4
可 以防止 产后 血镁浓 度 的降低 . 每头 奶 牛每 天饲 喂 4 ~ 0
到最 佳效 果 。在 添加 阴离 子盐 2 3 d后 . 可 以对 尿液 就
p H值 进 行 测 定 . 定 方 法 是 : 喂 后 2 4 测 饲 h采 集 尿样 ,
用p H计 或 p H试纸 测试 添加 阴离 子 有效 激 活 了钙 的代 谢 .但 也增 加 了钙
的排泄 . 为了满 足奶 牛 自身 维持 需 要 和胎 儿 生长 需要 .
一
保 证有 充 足 的有 效 长纤 维 ( 于 26 I) 可每 天饲 喂 大 . n c 2 4 g优质 长干 草 ( 好是 苜蓿 )确 保 瘤 胃充盈 状 态和 -k 最 . 健 康功 能 。添加 缓 冲剂 . 以稳定 瘤 胃 p 增 加 D 一 H. MI 般小苏 打 与氧化镁 一起 使用 . 比例为 2 3份 小苏 打对 1 ~ 份氧 化镁 , 小苏 打添加 量 为 07 % . 5 重点 观 察子 宫排 出物 的气 味与 物理 状 态 .如 有 异 常 . 时处 理 。 检测 粪 便 . 及 如果 粪 便 出现 稀 薄 、 色 发 颜 灰、 恶臭 等 不 正 常 现象 . 说 明瘤 胃功 能 不 正 常 , 适 则 应 当减 少精 料 . 进奶 牛 对长粗 纤 维的采 食 。 促 记录体 温 .以便 及早 发 现可 能 患 有乳 腺 炎或其 他
5g , 0 磷 可满足磷 的需要量 。 严禁 饲 喂缓 冲 剂并 控制 食 盐 的饲 喂量 .因 为钠 与 钾 是强 致碱 性 阳离 子 . 一方 面会 提 高 日粮 D A C B值 . 容
生物乳腺反应器的原理及进展

动物乳腺生物反应器的原理及进展摘要:动物乳腺生物反应器技术是转基因技术的应用,于上世纪80年代提出,其目的是利用动物乳腺产生目的蛋白。
利用该技术生产的蛋白具有低成本,高活性,易提取纯化的优点。
虽然该技术尚处于发展时期,但具有广阔的应用前景和巨大地商业潜力,是许多公司大力发展的对象。
关键词:动物乳腺生物反应器、原理、进展、优点动物乳腺生物反应器(mammary gland reactor)是指利用动物乳腺特异性启动子调控元件指导外源基因在乳腺中特异性表达,并能从转基因动物乳汁中获取重组蛋白的一种生物反应器。
1生物反应器(bioreactor) 经历了3 个发展阶段:细菌基因工程、细胞基因工程、转基因动物生物反应器。
细菌基因工程产物往往不具备生物活性,必须经过糖基化、羟基化等一系列修饰加工后, 才能成为有效的药物,而细胞基因工程又因为哺乳动物细胞的培养条件要求相当苛刻,成本太高,限制了规模生产。
动物生物反应器具有产品质量高,容易提纯的特点,弥补了其它各类基因表达系统的缺陷。
它是在转基因技术体系基础上发展起来的。
7自从上世纪80年代出现以来,已经取得了许多突破,现己成为生物技术研究的热点。
并向商业化阶段转变,显示了广阔的应用前景。
并且利用转基因动物乳腺生物反应器生产饮用奶,以期望获得既能满足蛋白质需要,又能增加抵抗力的品质全面的奶,为人类服务。
21、动物乳腺生物反应器的原理乳腺生物反应器的原理是应用重组DNA 技术和转基因技术,将目的基因转移到尚处于原核阶段的动物胚胎中,经胚胎移植得到转基因乳腺表达的个体。
1 外源基因在乳腺特异性表达需要乳蛋白基因的一个启动子和调控区,即需要一个引导泌乳期乳蛋白基因表达的序列,这样才能将外源基因置于乳腺特异性调节序列控制之下,使其在乳腺中表达再通过回收奶获得具有生物活性的目的蛋白。
它是一个专门化的分泌腺体,可以生产出具完全生物活性的药用重组蛋白质,其纯化简单,生产投资及成本相对较少,而且对环境不具污染性,也被称为“分子农场”。
《转基因克隆法制作人胰岛素原牛乳腺生物反应器的研究》范文

《转基因克隆法制作人胰岛素原牛乳腺生物反应器的研究》篇一一、引言随着生物技术的飞速发展,利用转基因克隆技术生产人胰岛素已成为研究热点。
通过将人胰岛素基因整合到牛乳腺细胞的基因中,我们能够在动物乳腺中实现高产量的人胰岛素生产。
这种方法不仅能够克服传统人胰岛素生产的局限,还可以减少人类对外部药物的依赖。
本文将详细探讨利用转基因克隆法制作人胰岛素原牛乳腺生物反应器的研究进展和潜在应用。
二、研究背景与目的近年来,糖尿病已成为全球范围内的一个重大健康问题。
胰岛素作为治疗糖尿病的关键药物,其需求量巨大。
传统的胰岛素生产方法主要依赖于生物合成或从动物胰腺中提取,但这些方法存在产量低、纯度不稳定等问题。
因此,寻找一种高效、稳定且可持续的胰岛素生产方法显得尤为重要。
利用转基因克隆技术制作人胰岛素原牛乳腺生物反应器的研究,旨在解决上述问题,实现人胰岛素的高效生产。
三、研究方法本研究采用转基因克隆技术,通过将人胰岛素基因与牛乳腺细胞的基因整合,以实现人胰岛素在牛乳腺中的表达。
首先,研究人员通过基因工程技术将人胰岛素基因进行改造,以适应在动物细胞中的表达;其次,利用体细胞核移植技术对基因修饰后的细胞进行克隆处理;最后,通过动物生殖细胞的媒介实现胚胎移植并完成生产。
四、研究进展与成果经过深入研究与试验,本研究取得了以下重要成果:1. 成功构建了含有重组人胰岛素基因的转基因牛乳腺细胞模型,并通过体细胞核移植技术实现了转基因克隆牛的成功培育。
2. 通过对转基因克隆牛的乳腺进行检测,发现其能够稳定表达人胰岛素基因,并成功在乳腺中合成和分泌人胰岛素。
3. 通过对转基因克隆牛的长期观察和监测,证实了其生产的胰岛素在质量和纯度上均达到了临床使用标准。
五、潜在应用与价值本研究为糖尿病治疗提供了新的可能性和解决方案。
通过将人胰岛素基因整合到牛乳腺细胞中,我们可以在动物乳腺中实现人胰岛素的高效生产。
这种方法的优势在于其高产量、高纯度和稳定性,为解决全球糖尿病患者的用药问题提供了新的途径。
动物乳腺生物反应器

动物乳腺生物反应器动物物乳腺生物反应器是基于转基因技术平台,使外源基因导入动物基因组中并定位表达于动物乳腺,利用动物乳腺天然、高效合成并分泌蛋白的能力,在动物的乳汁中生产一些具有重要价值产品的转基因动物的总称。
乳腺生物反应器生产的外源蛋白种类广泛,从小分子肽到大分子复杂蛋白质,从生物活性酶到抗体、病毒抗原蛋白均可有效生产。
利用动物乳腺生物反应器生产重组蛋白的优点有:(1)生物活性高,无污染。
动物乳腺有完整的蛋白质翻译后修饰系统,包括糖基化、磷酸化、羧基化等,从而保证了产品的高生物活性。
(2)易分离提纯,成本低廉。
现有的一些人药物蛋白之所以昂贵,除了原料难以收集外,另一原因是分离提纯极为困难成本极高。
而动物乳腺生物反应器的产物直接经乳汁分泌出体外,只需用常规方法除去酪蛋白沉淀乳清,再经层析即可得到重组蛋白,已经建立起完整的分离纯化生产程序。
(3)产量高。
外源基因在动物乳腺中的表达量可以达到每升几克到几十克,小群转基因大家畜的产量即可满足全世界市场的需求。
动物乳腺生物反应器已经成为生物技术领域最具开发应用前景的尖端方向。
动物乳腺生物反应器发展简史转基因动物的研究始于20世纪80年代初。
1980年,Gordon等将重组DNA用显微注射法导入小鼠受精卵原核,首次获得了整合有外源基因的小鼠。
1982年,Palmiter等将大鼠生长激素基因显微注射到小鼠受精卵中,首次获得了体重为正常小鼠2 倍以上的“超级小鼠”并提出了从转基因动物中提取药物蛋白的设想。
此后几年的许多研究奠定了转基因动物技术体系的基础,但真正的乳腺生物反应器研究则始于1987 年Gordon 等的工作,他们将组织型纤溶酶原激活剂(tPA)与小鼠乳清酸蛋白(WAP)基因的启动子构成重组基因,成功地培育出了37只在乳汁中能表达tPA 的转基因小鼠,同年,世界上第一只能从乳汁中分泌α1-抗胰蛋白酶(AAT)的转基因绵羊在英国罗斯林研究所诞生。
从此,开始了乳腺生物反应器的实用性研究。
生物技术制药的研究进展

动物乳腺生物反应器的研究进展班级:生物工程学号:071454116 姓名:刘俊超摘要:动物乳腺生物反应器(Mammary Bioreactor)是一种利用动物转基因技术在乳腺细胞中表达多肽药物、工业酶、疫苗和抗体等蛋白的技术。
该技术具有低投入高产出的特点,其效率是利用以大肠杆菌和动物细胞培养技术的100倍,是一种非常有潜力的高新技术。
本文综述了乳腺生物反应器的原理,研究进展与应用。
关键词:乳腺生物反应器;研究进展;应用1乳腺生物反应器的原理乳腺生物反应器(mammary gland bioreactor)技术是指利用乳腺特异表达的乳蛋白基因的调控序列构建表达载体,制作转基因动物,指导外源基因在动物乳腺中特异性、高效率地表达,以期从转基因动物乳汁中源源不断地获得外源活性蛋白。
乳腺生物反应器的原理是应用重组DNA技术和转基因技术,将目的基因转移到尚处于原核阶段(或1~2细胞的受精卵)的动物胚胎中,经胚胎移植得到转基因乳腺表达的个体。
外源基因在乳腺特异性表达需要乳蛋白基因的一个启动子和调控区,即需要一个引导泌乳期乳蛋白基因表达的序列,这样才能将外源基因置于乳腺特异性调节序列控制之下,使其在乳腺中表达,再通过回收乳汁获得具有生物活性的目的蛋白。
2研究现状2.1国外进展GordonL[l] 等将重组DNA 采用显微注射方法导人小鼠受精卵,首次获得了带有外源基因的转基因小鼠。
Palmiter等[2]将大鼠生长激素基因显微注射到小鼠的受精卵中,获得比普通小鼠大得多的“硕鼠”,并提出可以从转基因动物中提纯有价值的药用蛋白。
此后,国外在此项技术上不断取得新的进展。
荷兰的Phraming公司[3]培育出含人乳铁蛋白的转基因牛,每升牛奶中含有人乳铁蛋白1 g。
英国爱丁堡制药公司[4]已培育成功含a一1一抗胰蛋白酶(AA T)的转基因羊,每升羊奶中会有此种蛋白30 g。
V elander W H 等L3 报导用转基因猪生产人蛋白C的量为1 g/L。
乳腺生物反应器的原理和概念

乳腺生物反应器的原理和概念
乳腺生物反应器是一种用于研究乳腺组织生物学活性的实验装置。
其原理是将乳腺组织或细胞培养于三维支架中,提供适宜的环境条件,以模拟体内乳腺组织的微环境,使其能够维持其生物反应,进而进行生物学研究。
具体而言,乳腺生物反应器的原理包括以下几个方面:
1. 支架结构:乳腺组织被培养于三维支架中,该支架可以提供细胞附着和生长的支持,并且能够模拟组织的结构和力学环境。
2. 细胞培养条件:为了维持乳腺组织的生物反应,需要提供适宜的培养条件,包括培养基、营养物质、氧气和二氧化碳浓度等。
3. 生理刺激:乳腺组织生物反应器可以提供一定的生理刺激,例如适当的流动剪切力、机械压力、电刺激等,以模拟体内的生理环境,促进乳腺组织的生物学功能。
通过乳腺生物反应器,可以实现对乳腺组织生物学的研究和探索。
例如,可以研究乳腺组织在不同环境条件下的生长、分化、迁移、转化等生物学过程,进而深入了解乳腺组织的发育和疾病发生机制。
此外,乳腺生物反应器还可以用于药物筛选和新药研发,以提高乳腺癌的治疗效果和优化乳腺重建技术。
总之,乳腺生物反应器作为一种模拟体内乳腺组织生物学环境
的实验装置,可以为乳腺组织相关研究提供可靠的平台,并在生理和病理状态下模拟和研究乳腺组织的生物学反应。
动物乳腺生物反应器的原理及研究进展

1920
0. 9 20 次实验统计
193
0. 7
7为保证产品数量和质量的稳 定 ,必须将转基因乳腺表达的个体培育成遗传稳定的 家系或品系 。这方面美国 FDA 已有明确规定 。而生 产遗传性一致的家系最有效的方法就是进行转基因动 物的克隆 ,这样可由一头转基因动物可生产出性能一 致的群体 。 4. 3. 5 产品的纯化 :从乳腺生物反应器获得的产品作 药用 ,需要纯化技术 。 5 经济效益估测
美国学者根据目前乳腺生物反应器技术的现状和 发展趋势 ,对乳腺生物反应器生产人重组蛋白质的经 济效益作了测算 (表 3) ,表 3 中的数字表明 ,乳腺生物 反应器技术的完善和发展 ,将不断满足市场对许多药 用蛋白的种类和数量的需求 ,并使产品成本大幅度的 降低 。
综 述
— 53 —
值得注意的是 ,在构建乳腺表达的外源基因时 ,外 源基因在乳腺特异性表达需要乳蛋白基因的一个启动 子和调控区 ,即要有一个引导泌乳期乳蛋白基因表达 的序列 ,这样才能将外源基因置于乳腺特异性调节序 列控制之下 ,使其在乳腺中表达 ,再通过回收奶得到目 的蛋白 。目前大多数蛋白基因的启动子已用于外源基 因在转基因动物乳腺中表达 。 4 国内外研究 、开发现状与进展 4. 1 国外研究 、开发概况 自 80 年代末 、90 年代初 , 英国人相继实现了用小鼠和绵羊乳腺生产人的抗胰蛋 白酶以来 ,国外在乳腺生物反应器技术研究上取得了 巨大的发展 ,已有数十种产品在实验动物小鼠乳腺中 合成 ,表明控制外源基因在动物乳腺特异和高效表达 的技术 ,已日渐成熟 。到目前为止 ,至少有 10 种产品 在大动物上生产成功 ,少数产品已完成中试 ,即将投入
虽然动物乳腺可生产任何一种蛋白质和多肽产 品 ,但从商业和社会需求的角度来看 ,最能发挥其技术 优势的是生产那些需求量大 、单位零售价格又不太高 、 而其他生产体系难以解决的产品 。包括一次用量大的 多肽药物 ,治疗抗体 、血液蛋白 、工业用酶 、动物疫苗和 各种功能性蛋白等 ,都具有相当大的市场容量和开发 前景 。
乳腺反应器应用的技术原理

乳腺反应器应用的技术原理1. 介绍乳腺反应器是一种用于研究乳腺生物学的实验设备。
它模拟乳腺的生理环境,包括细胞生长、分化、迁移等过程。
乳腺反应器的应用在乳腺癌研究、乳腺组织工程等方面具有重要意义。
2. 技术原理乳腺反应器的技术原理基于以下几个方面:2.1 细胞培养乳腺反应器使用细胞培养技术,通过培养乳腺上皮细胞、间质细胞等乳腺组织相关的细胞种类,模拟乳腺生物学过程。
细胞培养需要一定的培养基和培养条件,以提供细胞生长所需的养分和环境。
2.2 恒定流体环境乳腺反应器模拟乳腺的内部流体环境,通过流体的输送和流动控制,为细胞提供养分和氧气,同时带走废物和代谢产物。
通过恒定流体环境,可以更加准确地研究乳腺细胞的生长、分化及相关生物学过程。
2.3 细胞-基质相互作用乳腺反应器模拟乳腺组织中细胞与基质的相互作用。
基质是乳腺组织中的非细胞组分,包含蛋白质、胶原等。
乳腺反应器中的基质可以通过特定的材料或涂层来模拟乳腺组织的基质,并提供细胞黏附和生长所需的信号。
2.4 多维环境乳腺反应器可以创造多维环境,模拟乳腺组织的复杂性。
多维环境包括三维细胞培养、流体环境和细胞-基质相互作用。
这种多维环境可以更好地模拟乳腺组织中细胞之间的相互作用和组织结构,有助于更准确地研究乳腺生物学。
3. 应用乳腺反应器的技术原理可以应用于以下领域:3.1 乳腺癌研究乳腺反应器可以模拟乳腺癌的发生、发展和转移过程,研究乳腺癌的相关机制。
通过模拟乳腺微环境,可以更深入地理解乳腺癌细胞生长、迁移和侵袭的本质,并为乳腺癌治疗提供新的策略和方法。
3.2 乳腺组织工程乳腺反应器可以用于乳腺组织工程的研究。
通过构建三维的乳腺组织模型,并在乳腺反应器中培养和分化细胞,可以实现乳腺组织的原位再生和修复。
这对乳腺缺损的修复、乳腺重建等有重要意义。
3.3 药物筛选和毒性测试乳腺反应器可以用于药物筛选和毒性测试。
通过在乳腺反应器中培养细胞并加入不同的药物或化合物,可以评估药物的疗效和毒性。
乳腺生物反应器

乳腺生物反应器
概述
乳腺生物反应器是一种模拟人体乳腺组织结构和功能的体外培养系统,用于研
究乳腺相关疾病和开发药物。
乳腺生物反应器通常由细胞培养室、培养基循环系统、气体控制系统和监测设备等部分组成,能够提供稳定的培养环境和连续的营养供应,以满足乳腺组织的生长和分化需求。
技术原理
乳腺生物反应器的原理是将乳腺细胞种植在支架或载体上,通过培养基的循环
流动和气体控制系统的调节,模拟人体乳腺组织的微环境,促进细胞的增殖和分化。
同时,监测设备能够实时监测细胞的生长状态和代谢产物,为后续实验和研究提供数据支持。
应用领域
乳腺生物反应器在乳腺疾病研究、药物筛选和生物医学领域有着广泛的应用。
通过模拟乳腺组织的生长和发育过程,可以更好地理解乳腺疾病的发病机制,寻找新的治疗方法。
同时,乳腺生物反应器还可以用于评估药物的毒性和有效性,加速药物的研发过程。
挑战与展望
尽管乳腺生物反应器在疾病研究和药物开发中具有重要意义,但其模拟效果仍
有待提高,特别是对于乳腺组织的复杂结构和功能。
未来的发展方向包括优化生物反应器的设计和控制系统,提高其模拟人体乳腺组织的能力,同时结合生物成像技术和生物信息学手段,实现对乳腺组织的全面解析和监控,为乳腺疾病的诊断和治疗提供更有效的手段。
结论
乳腺生物反应器是一种重要的研究工具,可以模拟人体乳腺组织的生长和发育
过程,为乳腺疾病研究和药物开发提供支持。
随着技术的不断进步和应用的扩展,乳腺生物反应器将在未来发挥更大的作用,为乳腺领域的科研和临床带来新的突破和机遇。
动物乳腺生物反应器研究进展

动物乳腺生物反应器研究进展摘要介绍了动物乳腺生物反应器的概念,综述了动物乳腺生物反应器及其载体的发展现状,以为动物乳腺生物反应器进一步研究提供借鉴。
关键词动物乳腺生物反应器;表达载体;发展现状1动物乳腺生物反应器的概念动物乳腺生物反应器(Mammary gland bioreactor)属于转基因动物范畴,其原理是通过转基因技术,将乳腺组织特异性启动子驱动的外源基因,在动物乳腺组织高效表达,通过乳汁分泌到体外,该方式不会对动物自身机体造成损害,通过回收乳汁就可以提取有重要价值的生物活性蛋白。
通常情况下,这种外源蛋白的特异性表达方式更安全、可靠。
2动物乳腺生物反应器表达载体的发展外源基因在动物乳腺中高效表达有2个前提:一是选用的调控元件要能指导目的基因在乳腺中高效、特异性表达,并且表达产物能分泌到乳汁中;二是整合到动物染色体基因组中的表达载体要处于开放和活跃转录状态,而这2个前提都归结于表达载体的成功构建[1]。
2.1基于普通质粒的表达载体哺乳动物的染色体是由许多独立、分散的区域组成,区域内含有单个或多个转录单元,包括调控基因表达的所有控制元件。
乳蛋白基因以独立区域的形式存在于染色体上。
对乳蛋白区域进行调控的一些重要控制元件可分为三类:①调控基因转录的元件,包括启动子、增强子和激素应答元件。
乳蛋白的启动子和增强子在大多数情况下位于转录起始位点数百个碱基处的5’侧翼区,有时可远至10kb。
乳蛋白激素应答区的表达受催乳素、胰岛素、糖皮质激素及细胞间质的诱导。
②具有使染色体变构和开放功能的元件,有位点控制区和核基质黏附区,主要用于对抗位点效应。
位点控制区位于5’远端,是大区域的DNaseI高敏区。
位点控制区包括多个DNaseI高敏区,各个高敏区与其反式因子结合成一个单元,然后对启动子复合物起作用。
因此,一般认为位点控制区具有增强子和绝缘子的双重功效[2]。
核基质黏附区也起到绝缘子的作用,并且还具有转录增强活性,多数位于区域的两端,可以把区域拴在核基质上。
动物乳腺生物反应器名词解释

动物乳腺生物反应器名词解释
动物乳腺生物反应器是一种用于研究和模拟动物乳腺生物过程的实验装置。
它通常由细胞培养系统、培养基、培养皿、培养槽等组成,用于模拟和研究动物乳腺组织的生长、分化、分泌等生物反应过程。
动物乳腺生物反应器的主要功能是提供一个模拟动物乳腺环境的平台,使乳腺细胞能够在体外条件下生长和发育。
它可以为科学家和研究人员提供一个实验室内的控制环境,以便他们可以更好地理解乳腺生物学的基本原理和机制。
在动物乳腺生物反应器中,乳腺细胞被培养在培养基中,通过提供适当的营养物质和生长因子,细胞可以进行增殖、分化和分泌乳液等生物反应。
这种系统可以模拟乳腺组织的生理状态,帮助研究人员研究乳腺发育、乳腺疾病以及乳腺细胞对外界刺激的反应。
动物乳腺生物反应器的应用广泛,既可以用于基础研究,也可以用于药物筛选和毒性测试。
通过对乳腺细胞在反应器中的生长和功能进行观察和分析,可以深入了解乳腺生物学过程,为乳腺疾病的治疗和预防提供理论依据。
总之,动物乳腺生物反应器是一种重要的实验装置,它可以模拟和研究动物乳腺组织的生物反应过程,为乳腺生物学的研究和乳腺疾病的治疗提供有益的工具和平台。
浅谈哺乳动物乳腺生物反应器的研究现状及应用

浅谈哺乳动物乳腺生物反应器的研究现状及应用摘要:应用生产乳腺生物反应器可以获得高效、安全、足量的人类重组蛋白、药用蛋白及其目的蛋白为人类社会作出积极的贡献。
本文在述乳腺生物反应器概念的基础上,介绍了乳腺生物反应器的原理及其应用,指出乳房生物反应器优缺点、存在的问题并展望了乳腺生物反应器前景。
关键词:哺乳动物; 乳腺生物反应器; 应用自从1987年Gordon等报道以转基因小鼠的乳汁表达分泌人组织纤维酶原激活剂(tPA)以来。
转基因动物的研究进入了一个新的发展时期, 成为生物技术研究中最具活力和产业化前景的热点研究领域。
目前,研究对象已从家畜及试验动物扩展到了人;研究内容也从动物的育种扩展到生产药用珍稀蛋白[l, 2〕。
其中以乳腺生物反应器生产有生物活性的多肤产品,是一种全新的生产模式,具有生物活性稳定、成本低、质量高、生产周期短、经济效益高等优点。
本文就动物乳腺生物反应器的操作流程、应用、优点、存在的问题及其国内外研究进展和产业化现状作一综述。
1.动物乳腺生物反应器及其原理动物乳腺生物反应器技术是指利用动物乳腺特异性表达的启动子元件构建转基因动物, 指导外源基因在乳腺中表达, 并从转基因动物的乳中获取重组蛋白。
由于这一特异表达方式安全、可靠, 且不对家畜造成伤害, 因此转基因动物最理想的表达部位和表达场所以乳腺最佳。
目前已成功的在绵羊、山羊乳腺中表达了人凝血因子IX、a ,抗胰蛋白酶和人尿激酶等。
动物乳腺生物反应器技术是指利用动物乳腺特异性表达的启动子元件构建转基因动物,指导外源基因在乳腺中表达, 并从转基因动物的乳中获取重组蛋白。
由于这一特异表达方式安全、可靠, 且不对家畜造成伤害,因此转基因动物最理想的表达部位和表达场所以乳腺最佳。
目前已成功的在绵羊、山羊乳腺中表达了人凝血因子IX、a , 抗胰蛋白酶和人尿激酶等。
泌生产目的产品进人乳中。
乳腺生物反应器成功的关键在于乳腺组织特异性表达载体构建的合理性和有效性, 这包括外源基因在活体动物乳叶中分泌表达, 表迭是否具消组织特异性, 表达水平及其蛋白是否具有全部的生物学活性目前, 国外一般采用各乳球蛋白(BLG)、酸性乳清蛋白(wAP)、俘一酪蛋白的启动子及部分内含子进行乳腺特异性表达的调控;采用基因组DNA或小基因替代cDNA,以提高基因表达水平;采用YAC 携带大容量的外源基因和侧翼顺序,消除基因的位置效应图。
动物乳腺生物反应器3篇

动物乳腺生物反应器第一篇:动物乳腺生物反应器的概述动物乳腺生物反应器是一种用于生产乳制品的新型生物技术。
它利用细胞培养技术、分子生物学技术和生物加工技术,通过对乳腺细胞进行基因工程改造,使其在体外生产出含丰富营养的乳制品。
动物乳腺生物反应器的原理是将规模化的乳腺细胞进行基因修饰,使其在培养基中生长和分化,进而产生出高含量的乳制品。
乳腺细胞被转染后,通过细胞培养技术和生物加工技术,在适宜的生长环境下,进行培养和提取。
与传统乳制品生产相比,动物乳腺生物反应器具有以下优点:1. 生产速度快。
传统乳制品生产需要经过动物生长及乳牛日常喂养等步骤,而动物乳腺生物反应器能够快速生产出高品质的乳制品。
2. 产品质量稳定。
由于生产环境受到人为控制,动物乳腺生物反应器生产的乳制品味道、质量、口感都具有一定的保证。
3. 减少了动物使用。
传统乳制品生产需要使用大量的奶牛和其他动物,而动物乳腺生物反应器生产可以通过细胞工程技术,减少对动物的使用,也更加环保。
总之,动物乳腺生物反应器是一种具有重要意义的生物技术,它可以帮助我们生产出高品质、高价值的乳制品,加速农业生产的现代化进程。
第二篇:动物乳腺生物反应器的应用动物乳腺生物反应器可以应用于生产各种类型的乳制品,包括牛奶、羊奶、马奶等。
具体应用范围如下:1. 牛奶生产。
利用动物乳腺生物反应器提取牛乳蛋白、乳糖、矿物质和维生素等成分,生产高品质、高营养价值的牛奶。
2. 马奶生产。
动物乳腺生物反应器是提取马奶乳糖、抗体等重要成分的有效工具,可以帮助生产高品质、高技术含量的马奶。
3. 羊奶生产。
利用动物乳腺生物反应器提取羊乳蛋白、羊乳酸、羊乳钙等营养成分,生产高品质、高营养价值的羊奶。
此外,动物乳腺生物反应器还可以通过基因工程技术进行优良品种的育种,提高生物的产奶量和产奶质量,增加乳制品生产的效益。
第三篇:动物乳腺生物反应器的未来发展随着科技的不断发展,动物乳腺生物反应器的应用前景将会越来越广阔。
乳腺生物反应器名词解释

乳腺生物反应器名词解释
一、乳腺生物反应器
乳腺生物反应器是一种利用转基因动物(如牛和羊)的乳腺作为生物反应器,生产重组蛋白或特定产物的技术。
通过将外源基因导入动物的受精卵,使得该基因在动物体内稳定整合并遗传给后代。
在乳腺组织中表达的重组蛋白可以通过乳汁获取,具有高效、安全、经济等优点。
二、转基因动物
转基因动物是指通过基因工程技术将外源基因导入动物受精卵,并使其稳定遗传给后代的动物。
这种技术可以用于生产具有特定性状的转基因动物,如带有特定基因的转基因牛、羊等。
三、重组蛋白
重组蛋白是指利用基因工程技术生产的蛋白质。
这些蛋白质可以在转基因生物(如转基因植物、转基因动物或微生物)中表达,也可以在实验室条件下使用重组DNA技术在大肠杆菌或酵母等微生物中表达。
重组蛋白具有纯度高、产量高、安全性好等优点,在医疗、制药、农业和工业等领域有广泛应用。
乳腺生物反应器PPT课件

分为乳腺生物反 应器、血 液生物
反 应 器 、卵 生 物 反 应 器 、尿 生 物 反 应器、精 囊腺生物反应器、 唾液腺生物反应 器等。
2
乳腺生物反应器的原理及步骤
乳腺生物反应器的研究进展
乳腺生物反应器的优点及其应用
乳腺生物反应器的存在的问题
.
3
乳腺生物反应器的原理及步骤
1991年,Brem等报道乳腺表达牛凝乳酶的转基因兔,表达 水平达到1~10g/L。
1992年,Ve-lande:等报道了乳腺表达人C蛋白的转基因猪, 表达水平达到1g/L以上。
目前,从转基因动物乳汁中提取的抗人胰蛋白酶、抗凝血酶 Ⅲ和人C蛋白等基因工程产品已进入临床试验阶段,并已初 步形成以转基因动物乳腺为主. 要生产手段的医药产业。 7
国内研究进展
20世纪80年代初,施履吉院士就提出乳腺生物反应器的构 想 ,并成功获得表达乙肝病毒表面抗原的转基因兔 ,为 我国通过转基因动物的途径获得珍贵药物奠定了基础。
1995年,我国首次在小鼠乳腺中成功地表达了人的基因;
1996年10月上海医学遗传研究所与复旦大学合作研制成功的 能在乳腺中表达人凝血因子Ⅳ的转基因羊。
.
12
安全性
动物体内虽然可以对外源蛋白进行 翻译后修饰,但由于牛、羊等家畜存在自身机体 保护系统可对所有外源性物质产生排斥反应,如 出现蛋白质水解等问题。 此外乳汁中可能含有的 微生物及不完全修饰的多肽都对产品的安全性构 成了极大的威胁,所以在分离过程中要去除所有 可能引起人类变态反应的蛋白质,同时对含量低 的产物加以纯化,才能得到与目的蛋白结构、功 能和理化特性相同的产品。 另外,要防止把动物 性疾病传染给人。
药物其效率是利用以大肠杆菌和动物细胞培养 技术的100倍
乳腺反应器

1 动物乳腺生物反应器的原理
动物乳腺生物反应器的原理是应用重组DNA技术和转基因技术等,先将外源基因置于乳腺特异性调控序列之下,再将该基因转移到尚处于原核阶段或1~2细胞的受精卵的动物胚胎中,经胚胎移植得到转基因乳腺表达的动物个体,通过回收乳汁获得表达产物。用转基因动物生产药用蛋白的基本过程提高外源基因表达量因在乳腺组织中特异性表达需要乳蛋白基因的一个启动子和调控区,即引导泌乳期乳蛋白基因表达的序列。目前,用于转基因动物乳腺生物反应器的调控元件主要有B一乳球蛋白基因(BLG)调控序列、B一酪蛋白基因调控序列、乳清酸蛋白基因(WAP)调控序列和乳清白蛋白基因调控序列,这些乳腺组织特异性表达的调控元件可以跨越种属界限。转基因技术是制备乳腺生物反应器的核心技术。目前,制备乳腺生物反应器的转基因方法除了原核显微注射法外,还有逆转录病毒介导法、精子介导法、胚胎干细胞(ES)介导法、基因打靶、体细胞克隆等。各种转基因方法均有其独特的优点和各自的局限性,但原核显微注射法仍是主要的动物转基因方法。
特别值得一提的是,2006年6月份由全球最著名的动物乳腺生物反应器研发企韭美国GTC研制成功的世界上第1个利用转基因动物乳腺生物反应器生产的基因工程蛋白药物——重组人抗凝血酶Ⅲ(商品名为ATryn)的上市许可申请获得了欧洲医药评价署人用医药产品委员会肯定的批准意见。据估计该药的全球潜在市场每年高达1.5亿美元。20世纪80年代初,我国就已经开始了转基因动物和动物乳腺生物反应器的研究,国家对该领域的研究也给予了大力支持。1983年,中国科学院的施履吉院士首次在国内提出了乳腺生物反应器的构想,并成功获得了表达乙肝病毒表面抗原的转基因兔,为我国通过转基因动物的途径获得珍贵药材打下了基础。1998年,国家在“863”计划中将“动物乳腺生物反应器研究”列为重大专项,加强了研究和开发的力度。目前,我国在动物乳腺生物反应器制药技术研究领域中已先后获得了转基因鼠、转基因绵羊、转基因山羊、转基因猪和转基因牛等,并且还获得了一批高效表达重组蛋白的转基因动物乳腺生物反应器。如2005年,在科技部“863”计划生物反应器重大专项的资助下,中国农业大学李宁教授领导的“高效表达人乳铁蛋白等药用保健蛋白的奶牛乳腺生物反应器”课题组与北京济普霖生物技术有限公司合作,经过4年的努力,首次在国际上利用体细胞克隆技术获得人乳铁蛋白转基因克隆牛和人仅一乳清白蛋白转基因克隆牛,其中人乳铁蛋白转基因克隆牛表达量达到3.4g/L,为世界上重组人乳铁蛋白在奶牛乳腺中最好的表达水平(3.0g/L),而人仅一乳清白蛋白转基因克隆牛也获得1.5g/L的表达,接近国际最好水平,并且具有与天然蛋白相同的生物活性。
乳腺生物反应器概念高中

乳腺生物反应器概念高中乳腺生物反应器概念在高中生物学领域中被广泛讨论和研究。
乳腺生物反应器是一个模拟人类乳腺生理过程的实验装置,它可以帮助人们更好地了解乳腺的结构和功能,并为乳腺疾病的研究提供重要参考。
乳腺是女性乳房结构的主要组成部分,也是哺乳动物产乳的重要器官之一。
它由乳腺小叶、导管和脂肪等组织构成。
乳腺小叶中含有大量的乳腺腺泡,这些腺泡能够合成、分泌乳汁,在哺乳期供养孩子的营养需求。
乳腺生物反应器的设计初衷是为了解决乳腺相关疾病的研究难题。
乳腺癌是乳腺疾病中最常见的一种,对女性的生命健康造成了严重威胁。
通过研究乳腺生物反应器,科学家可以更好地模拟乳腺的结构和功能,从而深入探究乳腺癌的发生机制,寻找治疗和预防乳腺癌的新方法。
乳腺生物反应器的核心部分是由细胞培养技术构建的三维组织结构。
乳腺腺泡的细胞可以在这个结构中自由生长和分化,从而模拟出真实乳腺组织的形态和功能特点。
这种三维培养技术可以更好地模拟人体内细胞在体外的生长环境,有助于研究人体内部复杂的生物反应过程。
乳腺生物反应器的研究不仅可以帮助人们更好地理解乳腺癌的发生机制,还可以为乳腺癌的早期诊断提供支持。
通过观察乳腺生物反应器中细胞的生长状态和特征,科学家可以及早发现乳腺癌的迹象,从而提高诊断和治疗的准确性和效果。
此外,乳腺生物反应器还可以用于药物筛选和新药开发。
通过将潜在的药物在乳腺生物反应器中进行测试,科学家可以评估药物对乳腺细胞的作用和效果,从而选择出最适合的治疗乳腺癌的药物。
这种个性化的药物筛选方法可以提高治疗的针对性,减少患者对于化疗的不良反应。
尽管乳腺生物反应器概念在高中生物学课程中并不常见,但它却是现代乳腺疾病研究的重要工具和手段。
通过乳腺生物反应器的研究,科学家们可以更深入地了解乳腺的结构和功能,解决乳腺癌等乳腺疾病的难题,为乳腺疾病的诊断和治疗提供新的思路和方法。
这对于提高女性健康水平,保障女性的生命质量和幸福感具有重要意义。
乳腺生物反应器ppt课件

应用
组织纤溶酶原激活剂(TPA):由美国遗传技术公司开发
的血栓溶解剂,1987 年11月经联邦食品及药物管理局 (FDA)批准上市。1988年的销售额为1.5~1.6亿美元, 1989年为1.8~1.9亿美元。今后每年的市场销售额约为2 ~2.5亿美元。
重组人抗凝血酶ii:世界上第一个动物乳腺生物反映器重
由于目的基因在动物基因中的 整合是随机的,因此包括整合位点、整合 的拷贝数等机制还不清楚。所以易发生调 节失控、遗传不稳定、表达率不高等问题。
转基因动物的成活率低
在目的基因的分离和改造,乳 腺特异表达载体的构建及转基因技术的关 键性技术上存在缺陷,无法保证对基因的 定点整合,因此转基因动物常会出现繁殖 力下降、胚胎早期死亡等各种生理及病理 缺陷 。
原理:
应用重组 DNA技术和转基因技术, 将目的基因转移到尚处于原核阶段的动物胚胎中, 经胚胎移植得到转基因乳腺表达多肽药物、工业 酶、疫苗和抗体等蛋白的技术。
外源基因在乳腺特异性表达需要乳 蛋白基因的一个启动子和调控区,即需要一个引 导泌乳期乳蛋白基因表达的序列,这样才能将外 源基因置于乳腺特异性调节序列控制之下,使其 在乳腺中表达再通过回收奶获得具有生物活性的 目的蛋白。
2005年,国家 “863”计划组利用转基因体细胞克隆技术 , 分别获得了 转人乳铁蛋白、转人溶菌酶、转乳清白蛋白 等转人基因 蛋白,其中人乳 铁蛋白和人α-乳清白蛋白 是国际上首次 利用转基因克隆牛而获得的。 虽然我国在 该项技术上取得了较大进展,但还处于探索阶段,与国外 还有一定的差距。 自国家“863”计划对 “动物乳腺生 物反应器应用研究”立项后,逐步受到有关部门和企业界 的重视,研究和开发的力度加 强,前景非常乐观。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
动物乳腺生物反应器的原理及进展摘要:动物乳腺生物反应器技术是转基因技术的应用,于上世纪80年代提出,其目的是利用动物乳腺产生目的蛋白。
利用该技术生产的蛋白具有低成本,高活性,易提取纯化的优点。
虽然该技术尚处于发展时期,但具有广阔的应用前景和巨大地商业潜力,是许多公司大力发展的对象。
关键词:动物乳腺生物反应器、原理、进展、优点动物乳腺生物反应器(mammary gland reactor)是指利用动物乳腺特异性启动子调控元件指导外源基因在乳腺中特异性表达,并能从转基因动物乳汁中获取重组蛋白的一种生物反应器。
1生物反应器(bioreactor) 经历了3 个发展阶段:细菌基因工程、细胞基因工程、转基因动物生物反应器。
细菌基因工程产物往往不具备生物活性,必须经过糖基化、羟基化等一系列修饰加工后, 才能成为有效的药物,而细胞基因工程又因为哺乳动物细胞的培养条件要求相当苛刻,成本太高,限制了规模生产。
动物生物反应器具有产品质量高,容易提纯的特点,弥补了其它各类基因表达系统的缺陷。
它是在转基因技术体系基础上发展起来的。
7自从上世纪80年代出现以来,已经取得了许多突破,现己成为生物技术研究的热点。
并向商业化阶段转变,显示了广阔的应用前景。
并且利用转基因动物乳腺生物反应器生产饮用奶,以期望获得既能满足蛋白质需要,又能增加抵抗力的品质全面的奶,为人类服务。
21、动物乳腺生物反应器的原理乳腺生物反应器的原理是应用重组DNA 技术和转基因技术,将目的基因转移到尚处于原核阶段的动物胚胎中,经胚胎移植得到转基因乳腺表达的个体。
1 外源基因在乳腺特异性表达需要乳蛋白基因的一个启动子和调控区,即需要一个引导泌乳期乳蛋白基因表达的序列,这样才能将外源基因置于乳腺特异性调节序列控制之下,使其在乳腺中表达再通过回收奶获得具有生物活性的目的蛋白。
它是一个专门化的分泌腺体,可以生产出具完全生物活性的药用重组蛋白质,其纯化简单,生产投资及成本相对较少,而且对环境不具污染性,也被称为“分子农场”。
2、动物乳腺生物反应器的主要研究内容2、1 乳腺特异表达载体的构建乳腺特异表达载体就是能够在动物的乳腺部位特异表达携带外源目的基因的DNA片段。
目前已克隆并用作构建载体的乳蛋白基因主要有-乳球蛋白(BLG)基因、s1-酪蛋白基因、酪蛋白基因、乳清酸蛋白(WAP)以及乳清蛋白基因。
7乳腺特异表达载体的首先要具备乳腺特异的启动子,目前所熟知的乳腺特异启动子有Beta-乳球蛋白基因的启动子,αS1 /Beta 酪蛋白启动子( αS1 /Beta Casein,CA) ,乳清酸蛋白基因启动子,其中研究最多和效果较佳的是绵羊的BLG、牛的αS1CA、山羊的Beta-CA、小鼠的WAP 等基因的启动子.如果得用目的基因的DNA序列而不是cDNA,表达效果可能会更好。
不翻译的外显子和内含子的掺入可能有利于转基因的表达。
52. 2 乳腺生物反应器的基因介导方法91) 微注射法微注射法是指直接将裸露的线形DNA 直接注射到胚胎原核中,使得目的DNA 整合到宿主基因组上。
这种方法基因整合效率低,在家畜中尤其如此,家兔和猪为5% ~ 15%,山羊2%,绵羊1% ~ 5%,而牛不超过0. 5%,而且成本高; 基因只能加入,不能剔除或原位修饰; 整合是随机的,由于插人位点的关系,转基因的表达不确定;随机整合可能破坏重要的内源性DNA 序列或激活细胞的致癌基因; 产生的转基因动物常常是嵌合体,即并非所有细胞都整合有外源基因; 以及不能在胚胎早期确定性别等。
2) 细胞转染与核移植利用近年来发展起来的基因打靶技术,可以将目的基因定点整合至细胞染色体上的特定位置,目前基因打靶的位置主要还集中在乳蛋白基因座,因为乳蛋白的敲除对于宿主本身的影响不是很大。
目前反刍动物的干细胞发展很缓慢,利用体细胞打靶在理论上是可行的,但是体细胞基因打靶的效率比干细胞要低2 个数量级。
而且非同源重组的效率特别高,需要提高多种途径提高打靶效率,目前核移植的方法几乎就是整个转基因的关键步骤,也是限制转基因动物生产的“限速步骤”,目前体细胞克隆技术也有很多有待完善的地方,如克隆胎儿怀孕率低、易流产、出生后健康状况不好等,导致克隆技术效率低下,平均不到10%的克隆胚胎会产生一个活的后代。
核移植技术的常规化需要在众多方面加以改进,特别是针对围产期胚胎死亡和细胞体外长期培养对克隆胚胎造成的不利影响。
3) 精子载体法该方法实验的重复性很差,且DNA 整合进基因组后,基因重排现象严重。
然而,最近有研究显示,通过体外受精或人工授精的方法,目的DNA 与抗精子表面蛋白的抗体结合,能有效进入受精卵中,这个方法目前已经成功地生产出转基因小鼠与猪,外源基因以这种途径进入动物体内整合效率高,没有基因重排现象,能表达且能传递给子代.这种方法似乎又给精子作为载体的转基因方法带来的曙光。
4) 逆转录病毒法将外源基因替换病毒基因组的gag,pol 和env 等基因,通过顺式元件的调控序列和感染成分重组病毒载体,然后注射到第二次减数分裂中期的卵母细胞,体外受精和筛选后,将胚胎移人假孕母体的子宫内,继续发育成转基因动物。
该方法整合稳定,拷贝数和插入位点相对固定,转基因效率高。
然而转录病毒载体容量有限,只能转移小于10kb 片段的DNA,而且基因是随机插入的,由于多处整合而产生嵌合体; 虽然设计时缺失复制功能序列,但复制大量载体所需的辅助病毒基因组也可能与目的基因一起整合到同一细胞核中,有可能产生辅助病毒株,从而产生生物安全性问题。
5) 电穿孔法电穿孔法是在外界高电压短脉冲的作用下改变了细胞膜的结构,使细胞膜产生可逆性电穿孔,使得外源DNA 通过细胞膜进入细胞,然后将经过筛选的转基因细胞用显徽注射法,注入去核的卵母细胞的卵周隙,施加电脉冲使供体核与去核卵母细胞融合,获得转基因重构胚。
再经过电激活或化学激活,使重构胚胎发育,然后在体外或通过中间受体使其发育到囊胚,最后将胚胎移植到同期发情处理的受体中,适于转染多种细胞。
6) 脂质体法通过脂质体包埋、介导,将外源基因转染到培养的体细胞,然后将此细胞与去核卵母细胞融合,融合的重构胚胎经电激活后在体外培养至囊胚,移入受体动物,最终获得转基因个体。
脂质体法产生个体的外源基因整合率为100%.采用脂质体方法转染体细胞,相比较而言,脂质体转染的效率要高于电穿孔法转染,且对细胞的损伤较小,但对于有些类型的细胞,脂质体的转染效果要比电穿孔转染差。
7) 干细胞介导法利用化学转染或电击法将目的基因导人为分化的胚胎干细胞( ES) 中,目的基因通过同源重组整合到细胞染色体基因组特定位点上,然后将转基因ES 细胞注人同系动物胚胎的囊胚中,发育成携带有目的基因的转基因动物个体。
该方法最大的优点是能在细胞水平进行筛选和确定性别; 能随机整合和同源重组整合; 能加入、剔除或替换某个基因、进行小到一个或几个核苷酸修饰。
其局限性是目前ES 细胞仅在小鼠、鸡和人的早期胚胎中分离出来,其它动物还没有成功建立分离ES 细胞的技术; 并且ES 细胞的培养条件苛刻,不同ES 细胞株的生殖系传代能力相差很大,而且ES 细胞介导的转基因需要经过嵌合体这一中间步骤。
2.3 转基因动物模型的建立2表达产物是否有生物活性、对动物生长发育是否有副作用及其表达水平能否达到商业化生产的需求等,是衡量乳腺生物反应器是否成功的重要标准,因此需要动物模型来检测效果。
制作转基因动物模型时要考虑研究周期、可操作性、成功率、成本及风险等诸多因素,跟其他动物相比,小鼠是最理想的动物模型,它成本低、研究周期短、可操作性强,因此大部分研究者将小鼠作为动物实验模型。
1987 年,Gordon 等构建了由小鼠WAP 基因启动区驱动的人组织纤溶酶原激活剂( t-PA) 重组表达载体,首建乳腺生物反应器小鼠模型。
3、动物乳腺生物反应器的历史及研究进展3.1国外研究现状自20世纪80年代末提出动物乳腺生物反应器的设想以来,国外在此方面的研究取得了突破性进展。
1987年,Gordon首次成功地从转基因小鼠的乳汁中获得了人类组织型溶酶原激活剂,此举开创了新的研究领域,随后各国展开了大量的研究。
1990年,美国获得世界上第一头转基因公牛,该公牛可与非转基因母牛生产转基因后代,其1/4的后代母牛乳腺表达了人乳铁蛋白。
Park等于2006年通过精子微注射受精卵获得了整合人重组促红细胞生成素的转基因猪,对F1代和F2代母猪的乳样进行分析表明,其氨基酸组成与商业化的重组促红细胞生成素完全相同。
美国GTC Biotherapeutics 公司利用山羊乳腺生物反应器生产的重组人抗凝血酶Ⅲ( 商品名: ATryn)已于2006 年获得欧洲药监局批准上市, 2009 年2 月该药获得美国FDA 批准上市,标志着一场生物制药革命的开始。
荷兰Genpharm公司用转基因牛生产乳铁蛋白,预计每年从乳汁中提炼出来的营养奶粉的销售额是50亿美元。
2、43.2国内研究现状尽管我国在该项技术上取得了较大进展,但仍处于探索研究阶段。
我国对动物乳腺生物反应器的研究起步较早,上世纪80年代初,施履吉院士就提出了乳腺生物反应器的构想,并成功获得了表达乙肝病毒表面抗原的转基因兔子。
2005年,李宁等在国际上首次利用体细胞克隆技术获得人乳铁蛋白基因和人——乳清白蛋白转基因克隆牛;在国际上首次获得人岩藻糖转移酶转基因奶牛,并在其乳腺中实现了高效表达Lewis抗原,还在世界上首次获得人溶菌酶转移酶转基因奶牛,这是我国第一次成功研制了具有商业开发前景的奶牛乳腺生物反应器。
2007年,周兴等用收获的病毒上清转染妊娠期奶牛乳腺组织,结果表明牛奶具有明显的纤溶活性,即蚓激酶基因已经整合到奶牛乳腺组织并能实现相对稳定的表达。
2008年,吴湃等用筛选出活性最强的重组β-酪蛋白启动子,构建出了新型的高效重组奶牛乳腺定位表达载体。
24、动物乳腺生物反应器的优点乳腺组织表达的重组蛋白与天然表达蛋白在结构、功能上极其相似甚至是相同。
动物乳腺生物反应器生产具有生物活性的多肽药物和具有特殊营养意义的蛋白质,已成为一个新兴的转基因制药业,它的优越性有如下几点。
4.1 表达产物能充分修饰且具有稳定的生物活性利用。
DNA重组技术的微生物发酵工程来生产的药用蛋白,由于细菌等微生物不能进行蛋白质合成后的加工, 因而生物活性低, 需要对其进行复杂的加工才能获得有活性的目的蛋白;并且具有免疫原性,而利用转基因动物生产药用蛋白却免除这些问题。
84.2 产品成本低,可以大规模生产。
据计算,与生物发酵技术相比,动物乳腺生物反应器生产成本只有其百分之一。
作为生物反应器的转基因动物可无限扩繁,且饲养成本低,可进行大规模的药物生产。
