复习版 电导法测定乙酸乙酯皂化反应的速率常数含思考题答案
实验十电导法测定乙酸乙酯皂化反应的速率常数

实验十电导法测定乙酸乙酯皂化反应的速率常数Ⅰ、目的要求1.用电导法测定乙酸乙酯皂化反应速率常数,了解反应活化能的测定方法。
2.了解二级反应的特点,学会用图解计算法求取二级反应的速率常数。
3.掌握电导仪的使用方法。
Ⅱ、基本原理乙酸乙酯皂化,是一个二级反应,其反应式为CH3COOC2H5+Na++OH- → CH3COO-+ Na++C2H5OH在反应过程中,各物质的浓度随时间而改变。
某一时刻的OH-离子浓度,可以用标准酸进行滴定求得,也可以通过测量溶液的某些物理性质而求出。
以电导仪测定溶液的电导值G随时间的变化关系,可以监测反应的进程,进而可求算反应的速率常数。
二级反应的速率与反应物的浓度有关。
为了处理方便起见,在设计实验时将反应物CH3COOC2H5和NaOH采用相同浓度c作起始浓度。
当反应时间为t时,反应所生成的CH3COO-和C2H5OH的浓度为x,那么CH3COOC2H5和NaOH的浓度则为(c-x)。
设逆反应可以忽略,则应有CH3COOC2H5+NaOH → CH3COO Na+C2H5OHt=0时 c c 0 0t=t时c-x c-x x xt→∞时→0 →0 →c →c二级反应的速率方程可表示为积分得显然,只要测出反应进程中t时的x值,再将c代入,就可以算出反应速率常数k值。
由于反应是在稀的水溶液中进行的,因此可以假定CH3COONa全部电离。
溶液中参与导电的离子有Na+、OH-和CH3COO-等,而Na+在反应前后浓度不变,OH-的迁移率比CH3COO-的迁移率大得多。
随着反应时间的增加,OH-不断减少,而CH3COO-不断增加,所以体系的电导值不断下降。
在一定范围内,可以认为体系电导值的减少量和CH3COONa的浓度x的增加量成正比,即t = t时x = β (G0-Gt) (3)t = ∞时 c = β (G0-G∞) (4)式中G0和Gt分别为起始和t时的电导值,G∞为反应终了时的电导值,β为比例常数。
电导法测定乙酸乙酯皂化反 应的速率常数

实验七 电导法测定乙酸乙酯皂化反应的速率常数一、实验目的1.了解电导法测定乙酸乙酯皂化反应的速率常数和活化能。
2.了解二级反应的特点,学会用图解法求二级反应的速率常数。
3.熟悉电导率仪的使用方法。
二、实验原理乙酸乙酯皂化反应是双分子反应,是一典型的二级反应,其反应方程式为CH3COOC2H5+Na++OH-= CH3COO-+Na++ C2H5OH 在反应过程中,各物质的浓度随时间而改变(注:Na+在反应前后浓度不变)。
若乙酸乙酯的初始浓度为a,氢氧化纳的初始浓度为b,当时间为t,各生成物的浓度均为x,此时刻的反应速度为=k(a-x)(b-x) ( 2-15-1)式中,k为反应的速率常数,将上式积分可得kt=ln为便于数据处理,使两种反应物的起始浓度相同,(a=b),则式(2-15-1)可以写成=k(a-x)2 (2-15-2)将式(2-15-2)积分,得kt=(2-15-3)不同时刻各物质的浓度可用化学分析法测出,例如分析反应中的OH-浓度,也可用物理法测量溶液的电导而求得。
在本实验中采用电导法来测定。
电导是导体导电能力的量度,金属的导电是依靠自由电子在电场中运动来实现的,而电解质溶液的导电是正、负离子向阴极、阳极迁移的结果。
本实验中乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不致影响电导的数值。
反应中Na+的浓度始终不变,它对溶液的电导具有固定的贡献,而与电导的变化无关。
体系中只是OH-和CH3COO-的浓度变化对电导的影响较大,由于OH-的迁移速度约是CH3COO-的5倍,所以溶液的电导随着OH-的消耗而逐渐降低。
若令G0、G t、G分别表示反应起始时、反应时间t时、反应终了时溶液的电导,显然G0是浓度为a的NaOH溶液的电导,G是浓度为a的CH3COONa溶液的电导,G t是浓度为(a-x)的NaOH溶液与浓度为x的CH3COONa溶液的电导之和。
由此可得下式G t=G0+G(2-15-4)解之得x=a(2-15-5)将式(2-15-5)代入式(2-15-3)并化简得=kt (2-15-6)即G t=+G (2-15-7)从式(2-15-7)可以看出,以G t对作图,可得一直线(说明为二级反应),直线的斜率为,由此就能求出反应的速率系数k。
实验报告_电导法测定乙酸乙酯皂化反应的速率

用准一级反应的方法测定乙酸乙酯皂化反应的速率常数一.[实验目的]①学习用准一级反应方法研究非一级反应的方法。
②用电导法测定乙酸乙酯反应常数。
③掌握测量原理, 并熟悉电导率仪的使用。
二.[实验原理]乙酸乙醋的皂化反应为:CH 3COOC 2H 5+NaOH →CH 3COONa +C 2H 5OH在该反应中, 设乙酸乙酯和碱的起始浓度分别为a 和b(a>>b), x 为t 时刻反应物已反应掉的浓度(也就是不同时刻生成的NaAc 的浓度)CH 3COOC 2H 5+NaOH →CH 3COONa +C 2H 5OHt=0 a b 0 0t= t a-x b-x x x t= ∞ →a-x →b-x →b →b则其反应速率公式可写为但是a>>b 所以(a-x)→a 则上式可写为)(x b Ka dtdx n -= (1) 对(l)式进行积分得反应速度常数K 的表达式为 ln t ka bx b n -=- 显然, 只要测出反应进程中t 时的x 值, 再将a, b 代入上式, 就可以算出反应速率常数k 值。
由于反应在水溶液中进行, 可以假定CH3COONa 全部电离。
溶液中参与导电的离子有Na+, OH-和CH3COO-等, 而Na+ 反应前后不变, OH-的迁移率比CH3COO-的迁移率大得多。
随反应时间的增加, OH-不断减少, 而CH3COO-不断增加, 所以, 体系的电导率值不断下降。
在一定的范围内, 可以认为体系电导率的减少与CH3COONa 的浓度x 的增加量成正比, 即t=t: x=β(κ0-κt ) t=∞: b=β(κ0-κ∞)式中κ0为t=0时的初始电导率, κt 为t=t 时溶液的电导率值, κ∞为t →∞, 即反应完全后溶液的电导率值, β为比例常数。
将x 和a 及电导率的关系式分别代入积分式得:-ka n t=In ∞-∞-k k k kt 从上式可知, 只要测定κ0, κ∞以及一组相应于t 时kt 值, 以 对t 作图, 可得一直线, 由直线的斜率即可求得反应速率k 值, k 的单位为min-1mol-1L三.[实验仪器与试剂]DDS 一11A 电导率仪(上海第二分析仪器厂)1台;501型超级恒温水浴(重庆试验仪器厂) 1台;双管电导池(带胶塞与大洗耳球)2个, 25mL, 10mL 移液管各1支;50mL 容量瓶2个;停表1支.NaOH (分析纯)CH 3COOC 2H 5 (分析纯)CH 3COONa (分析纯)四.[试验步骤]1.启用恒温槽, 调节至实验所需温度(20℃)。
6. 电导法测定乙酸乙酯皂化反应速率常数-

实验5 电导法测定乙酸乙酯皂化反应速率常数一.实验目的1. 用电导法测定乙酸乙酯皂化反应速率常数。
2. 用图解法验证二级反应的特点。
3. 掌握电导率仪的使用方法。
二.实验原理酯在碱性介质中的水解反应习惯上称为皂化。
乙酸乙酯的皂化反应是一个典型的二级反应:即 CH 3COOC 2H 5 + NaOH −→ CH 3COONa + C 2H 5OHt =0时 a b 0 0 t=t 时 a-x b-x x x反应速率方程为))((k x b x a dtdx--= (1) 式中:a,b 分别表示两反应物的初始浓度,x 表示经过时间t 后消耗的反应物浓度,k 表示反应速率常数。
为了数据处理方便,设计实验使两种反应物的起始浓度相同,即a =b ,此时上式可以写成2)(k x a dtdx-= 积分得: )(k x a ta x-=(2)皂化反应的逆反应很少,可认为能完全进行。
稀溶液中NaOH ,CH 3COONa 可完全电离,反应各阶段各物质的浓度为:CH 3COOC 2H 5 + NaOH −→ CH 3COONa + C 2H 5OHt =0时 a a 0 0 t=t 时 a-x a-x x x t →∞时 0 0 x →a x →a只要测得t 时刻某一组份的浓度就可求得反应速率常数。
测定该反应体系组分浓度的方法很多,例如,可用标准酸碱滴定测出不同时刻OH -离子的浓度。
本实验使用电导率仪测量皂化反应进程中体系电导随时间变化的变化,从而达到跟踪反应物浓度随时间变化的目的。
其根据是:(1) 溶液中OH -的电导率比CH 3COO -大很多且随反应的进行而减少,整个体系电导变化明显。
(2) 稀溶液中各强电解质的电解质的电导率与其浓度成正比 (3) 溶液总电导率等于各电解质电导率之和 因此,a A ⋅=10κ ① a A ⋅=∞2κ ② x A x a A t 21)(+-=κ③式中,A1、A2是与温度、溶剂、电解质性质有关的比例常数;0κ,∞κ为反应开始和终了时溶液的电导率(反应开始时只有NaOH 导电,终了时只有CH 3COONa 导电);t κ是时间为t 时溶液的总电导率。
复习版 电导法测定乙酸乙酯皂化反应的速率常数含思考题答案

电导法测定乙酸乙酯皂化反应的速率常数指导老师:李国良【实验目的】①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; ②了解二级反应的特点,学会用图解计算法求二级反应的速率常数; ③熟悉电导仪的使用。
【实验原理】(1)速率常数的测定乙酸乙酯皂化反应时典型的二级反应,其反应式为:CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OHt=0 C 0 C 0 0 0t=t Ct Ct C 0 - Ct C 0 -Ct t=∞ 0 0 C 0 C 0速率方程式 2kc dtdc=-,积分并整理得速率常数k 的表达式为: t0t0c c c c t 1k -⨯=假定此反应在稀溶液中进行,且CH 3COONa 全部电离。
则参加导电离子有Na +、OH -、CH 3COO -,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO -,随着反应的进行, OH - 不断减小,CH 3COO -不断增加,所以体系的电导率不断下降,且体系电导率(κ)的下降和产物CH 3COO -的浓度成正比。
令0κ、t κ和∞κ分别为0、t 和∞时刻的电导率,则:t=t 时,C 0 –Ct=K (0κ-t κ) K 为比例常数 t →∞时,C 0= K (0κ-∞κ) 联立以上式子,整理得:∞+-⨯=κκκκtkc 1t00t 可见,即已知起始浓度C 0,在恒温条件下,测得0κ和t κ,并以t κ对tt0κκ-作图,可得一直线,则直线斜率0kc 1m = ,从而求得此温度下的反应速率常数k 。
(2)活化能的测定原理: )11(k k ln21a 12T T R E -=因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】电导率仪1台铂黑电极1支大试管5支恒温槽1台移液管3支氢氧化钠溶液(1.985×10-2mol/L)乙酸乙酯溶液(1.985×10-2mol/L)【实验步骤】①调节恒温槽的温度在26.00℃;②在1-3号大试管中,依次倒入约20mL蒸馏水、35mL 1.985×10-2mol/L的氢氧化钠溶液和25mL1.985×10-2mol/L乙酸乙酯溶液,塞紧试管口,并置于恒温槽中恒温。
电导法测定乙酸乙酯皂化反应的速率常数实验
1
2
3
4
5
(k 0-k t )/(k t -k ∞)
t/min
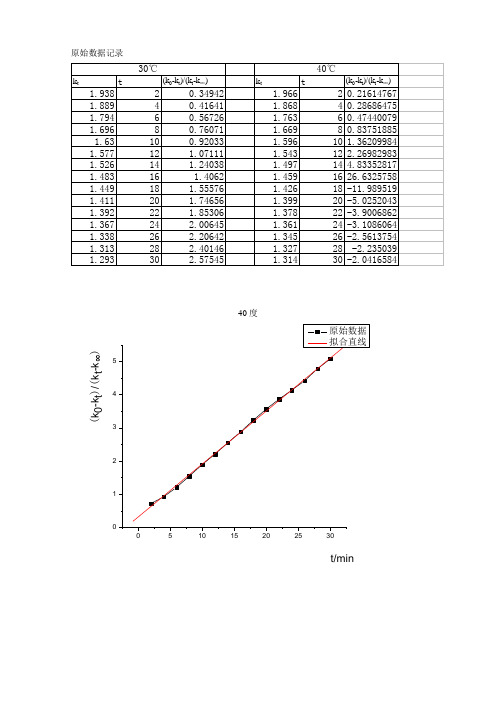
原始数据记录
0.0
0.5
1.0
1.5
2.0
2.5
3.0
t/min
(k o -k t )/ln ()k k Ea R T T 2121
11
=--
活化能 = 5.99×10-3 J
思考题:
1、反应分子数与反应级数是两个完全不同的概念,反应级数只能通过实验来确定。
试问如何从实验结果来验证乙酸乙酯皂化反应为二级反应?
答:如果通过本实验测定了κ0、κ∞以及一组相应于t 时κt 值,以()()∞--κκκκt t 0对t 作图,可得一直线即可验证乙酸乙酯皂化反应为二级反应。
2、乙酸乙酯的皂化反应为吸热反应,试问在电导法测定乙酸乙酯皂化反应的速率常数实验中,如何处置这一影响而是使实验得到较好的结果? 答:采用恒温槽恒温。
3、 在电导法测定乙酸乙酯皂化反应的速率常数实验中,如果NaOH 和CH 3COOC 2H 5溶液为浓溶液时,能否用此法求k 值,为什么?
答:不能。
因为影响因素太多,在浓的溶液中不可认为CH 3COONa 全部电离,该反应的逆反应不能忽略,此时不可以认为体系电导率值的减少与CH 3COONa 的浓度x 的增加量成正比。
电导法测定乙酸乙酯皂化反应的速率常数数据处理

【数据处理】① 25℃的反应速率常数k T 1,将实验数据及计算结果填入下表:恒温温度=24.9℃ 0κ=1.994m s ·cm-1V 乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/LVNaOH=10.00mL [NaOH]=0.0200mol/L c 0=0.5×0.0200=0.01mol/L图1:25℃t κ-tt0κκ-由于第一个数据偏离其它数据太多,有明显的误差,所以舍去。
数据处理:t κ对tt0κκ-作图,求出斜率m ,并由0kc 1m =求出速率常数.直线公式:y=16.616x + 0.7888 R 2=0.9998m=16.616,k T 1=1/(mc 0)=1/(16.616*0.01)mol ·L -1·min= 6.02L/(mol ·min) 文献参考值:k (298.2K )=(6±1)L/(mol ·min)② 用同样的方法求37℃的反应速率常数k T 2,计算反应的表观活化能Ea : 恒温温度=35.0℃0κ=2.27ms ·cm -1V 乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/L V NaOH =10.00mL [NaOH]=0.0200mol/L c 0=0.5×0.0200=0.0100mol/L图1:25℃t κ-tt0κκ-直线公式:y=13.369x + 0.8954 R 2=0.969m=13.369,k T 2=1/(mc 0)=1/(13.369*0.01)mol ·L -1·min= 7.48L/(mol ·min) 文献参考值:k (308.2K )=(10±2)L/(mol ·min) b .计算反应的表观活化能:文献值:Ea=46.1kJ/mol ln(k T 2/k T 1)=Ea/R ·(1/T 1-1/T 2) ∴Ea=Rln(k T 2/k T 1)/[T 1T 2/(T 2-T 1)]=8.314×ln (7.84/6.02)/[298×308÷(308-298)]J/mol =20.16kJ/mol分析:31.4℃时速率常数符合文献参考值,说明乙酸乙酯混合比较充分,电导率能较好地反应其反应速率,37.4℃时,实验过程中加入乙酸乙酯后混合得并不充分就开始测定,且有部分溶液露在恒温水面之上,温度并没有37.4℃。
电导法测定乙酸乙酯皂化反应的速率常数

电导法测定乙酸乙酯皂化反应的速率常数————————————————————————————————作者:————————————————————————————————日期:电导法测定乙酸乙酯皂化反应的速率常数一、实验目的1.了解二级反应的特点,学会用图解计算法求取二级反应的速率常数;2.用电导法测定乙酸乙酯皂化反应的速率常数,了解反应活化能的测定方法。
二、实验原理乙酸乙酯皂化是一个二级反应,其反应式为:在反应过程中,各物质的浓度随时间而变。
某一时刻的OH-离子浓度可用标准酸进行滴定求得,也可通过测定溶液的某些物理性质而得到。
用电导仪测定溶液的电导值G随时间的变化关系,可以监测反应进程,进而可求算反应的速率常数。
二级反应的速率与反应物的浓度有关。
若反应物CH3COOC2H5和NaOH的初始浓度相同(均设为c),设反应时间为t时,反应所产生的CH3COO-和C2H5OH的浓度为x,若逆反应可忽略,则反映物和产物的浓度时间的关系为:上述二级反应的速率方程可表示为:dx/dt=k(c-x)(c-x) (1)积分得:kt=x/c(c-x) (2)显然,只要测出反应进程中任意时刻t时的x值,再将已知浓度c代入上式,即可得到反应的速率常数k值。
因反应物是稀水溶液,故可假定全部电离。
则溶液中参与导电的离子有Na+、OH-和CH3COOH 等,Na+在反应前后浓度不变,OH-的迁移率比的大得多。
随着反应时间的增加,OH-不断减少,而CH3COO-不断增加,所以体系的电导值不断下降。
在一定范围内,可以认为体系电导值的减少量与CH3COONa的浓度x的增加量成正比,即:t=t时,x=β(G0-G t) (3)t=∞时,c=β(G0-G∞) (4)式中G0和G t分别是溶液起始和t时的电导值,,G∞为反应终了时的电导值,β是比例系数。
将(3)、(4)代入(2)得:kt=β(G0-G t)/cβ[(G0-G∞)- (G0-G t)]= (G0-G t)/c (G t-G∞) (5)或写成 (G0-G t)/ (G t-G∞) = ckt (6)从(6)式可知,只要测出G0、G∞和一组G t值,由(G0—G∞)/(G t—G∞)对t作图,应得一直线,从其斜率即可求得速率常数k值。
实验4-电导法测定乙酸乙酯的皂化反应速率常数

电导法测定乙酸乙酯皂化反应的速率常数【实验目的】(1)学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; (2)了解二级反应的特点,学会用图解计算法求二级反应的速率常数; (3)熟悉电导仪的使用。
【实验原理】(1)速率常数的测定乙酸乙酯皂化反应时典型的二级反应,其反应式为: CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OH t=0 c 0 c 0 0 0 t=t c t c t c 0 - c t c 0 -c t t=∞ 0 0 c 0 c 0则2kc dtdc=-,c 为反应任一时刻的浓度。
积分并整理得速率常数k 的表达式为: t0tc c c c t 1k -⨯= 假定此反应在稀溶液中进行,且CH 3COONa 全部电离,则参加导电离子有Na +、OH -、CH 3COO-,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO -。
随着反应的进行,OH -不断减小,CH 3COO -不断增加,所以体系的电导率不断下降,且体系电导率(κ)的下降和产物CH 3COO-的浓度成正比。
令κ0、κt 和κ∞分别为0、t 和∞时刻的电导率,则:t=t 时,c 0 – c t = K (κ0 - κt ) K 为比例常数 t→∞时,c 0 = K (κ0 - κ∞) 联立以上式子,整理得:∞+-⨯=κκκκtkc 1t 00t 可见,即已知起始浓度c 0,在恒温条件下,测得κ0和κt ,并以κt 对tt0κκ-作图,可得一直线,则直线斜率0kc 1m =,从而求得此温度下的反应速率常数k 。
(2)活化能的测定原理:)11(k k ln21a 12T T R E -=因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】电导率仪1台,铂黑电极1支,人形试管2支,直行试管2支,恒温槽 1台,移液管 3支,0.0200 mol/L NaOH,0.0200mol/L CH3COOC2H5,0.0100mol/L CH3COONa(均新鲜配制)。
电导法测乙酸乙酯皂化反应速率常数的数据处理及问题讨论

实验四电导法乙酸乙酯皂化反应速率常数的测定1.实验目的1)了解测定化学反应速率常数的一种物理方法——电导法。
2)了解二级反应的特点,学会用图解法求二级反应的速率常数。
3)掌握DDS-11AT型数字电导率仪和控温仪使用方法。
2.实验注意事项1)本实验所用的蒸馏水需事先煮沸,待冷却后使用,以免溶有的C02致使NaOH溶液浓度发生变化。
2)配好的NaOH溶液需装配碱石灰吸收管,以防空气中的C02进入瓶中改变溶液浓度。
3)测定298.2K、308.2K的κ0时,溶液均需临时配制。
4)所用NaOH溶液和CH3COOC2H5溶液浓度必须相等。
5)CH3COOC2H5溶液须使用时临时配制,因该稀溶液会缓慢水解影响CH3COOC2H5的浓度,且水解产物(CH3COOH)又会部分消耗NaOH。
在配制溶液时,因CH3COOC2H5易挥发,称量时可预先在称量瓶中放入少量已煮沸过的蒸馏水,且动作要迅速。
6)为使NaOH溶液与CH3COOC2H5溶液确保混合均匀,需使该两溶液在叉形管中多次来回往复。
7)不可用纸拭擦电导电极上的铂黑。
3.数据处理1)将列表。
表一,293.2K时的实验数据时间t/min kt k0-kt (k0-kt)/t2 1866 434 217.004 1725 575 143.756 1616 684 114.008 1529 771 96.3810 1458 842 84.2012 1397 903 75.2514 1346 954 68.1416 1301 999 62.4418 1263 1037 57.6120 1229 1071 53.5522 1199 1101 50.0524 1172 1128 47.0026 1149 1151 44.2728 1126 1174 41.9330 1106 1194 39.8032 1088 1212 37.88表一,298.2K时的实验数据时间t/min kt k0-kt (k0-kt)/t2 2170 260 130.004 1961 469 117.256 1833 597 99.508 1728 702 87.7510 1645 785 78.5012 1577 853 71.0814 1523 907 64.7916 1477 953 59.5618 1438 992 55.1120 1406 1024 51.2022 1376 1054 47.9124 1349 1081 45.0426 1328 1102 42.3828 1306 1124 40.1430 1287 1143 38.1032 1272 1158 36.192)用图解法绘制 图。
实验二电导法测乙酸乙酯皂化反应的速率常数

2024/4/6
10
4.κ0 的测量 分别量取0.02MNaOH液和蒸馏水各
25.00ml于50ml小烧杯中混匀,用此混合 液淋洗电极2~3遍后,将此混合液倒入 另一干燥专用试管中,插入电极,此时 显示屏上的电导率数值即为κ0,记下该 值
2024/4/6
11
5. κt 的测量 先量取0.02MNaOH液25.00
2024/4/6
2
当乙酸乙酯与氢氧化钠溶液的起 始浓度相同时,均为a,则反应速 率表示为:
dC kC dt
起始浓度a为已知,因此只要由实验测得
不同时间t时的x值,以
对t作图,应
得一直线,从直线的斜率m(=ak)便可求出k值。
2024/4/6
3
反应中,参加导电的离子有OH-、Na+和
CH3COO-,由于反应体系是很稀的水溶液, 可
洗干净,并放入蒸馏水中保养。
2024/4/6
16
请保护公共仪器设备! 请注意安全!
谢谢!
2024/4/6
17
2024/4/6
13
(2)将测得κt数据记入下表。
t(min)
κ0 (µS·cm-1)
κt -
(µS·cm-1)
(κ0- κt)/(κt -κ∞)
3 6 9
60
2024/4/6
14
(3)反应级数的判定。 以(κ0- κt)/(κt -κ∞)对t作图,若
得一直线,即可证明乙酸乙酯皂化反应为 二级反应。由直线的斜率计算出反应速率
常数k。
2024/4/6
15
(五)注意事项
(1)测κ0 时是测0.0100M的NaOH, 而测κt时,是将0.02MNaOH液25.00 Ml与0.02M的乙酸乙酯液25.00ml混合。
物化实验思考题答案

物化实验思考题答案实验十乙酸乙酯皂化反应速率常数的测定1.本实验为什么需要在恒温下进行?答:因为反应速率k受温度的影响大,(kT+10)/kT=2-4,若反应过程中温度变化比较大,则测定的结果产生的误差较大。
2.为什么在测定κ0时要用0.0100mol·dm-3的氢氧化钠溶液,测定κ∞时要用0.0100mol·dm-3的CH3COONa溶液?答:κ0是反应:CH3COOC2H5+NaOH →CH3COONa+C2H5OH 体系t=0时的电导率,但是CH3COOC2H5与NaOH混合的瞬间就已开始反应,因而混合后第一时间测的κ也不是t=0时的电导率。
根据CH3COOC2H5与NaOH体积和浓度都相等,二者混合后浓度均稀释一倍,若忽略CH3COOC2H5的电导率,0.0100 mol·dm-3NaOH所测κ即为κ0;κ∞是上述反应t=∞时的电导率,当反应完全时,CH3COONa的浓度和t=0时NaOH浓度相同,若忽略C2H5OH 的电导率,0.0100mol·dm-3的CH3COONa所测κ即为κ∞。
3.为什么NaOH溶液和CH3COOC2H5溶液要足够稀?答:因为乙酸乙酯与氢氧化钠反应的本质原理是乙酸乙酯和水发生水解反应,若氢氧化钠浓度过高的话则会抑制水的电离,而乙酸乙酯的溶解度不高,所以只能配稀溶液。
只有溶液足够稀,每种强电解质的电导率才与其浓度成正比,溶液的总电导率才等于组成溶液的各种电解质的电导率之和,才可通过测定反应液的电导率来跟踪反应物浓度的变化。
4.本实验为什么可用测定反应液的电导率的变化来代替浓度的变化?答:因为本实验的反应液中只有NaOH 和NaAc 两种强电解质,并且OH-离子的电导率比Ac-离子的电导率大许多。
在反应溶液的浓度相当低的条件下,可近似地认为溶液的电导率与OH-离子的浓度成正比,所以可用测得的反应液的电导率来代替浓度变化。
5.本实验为什么要求NaOH溶液和CH3COOC2H5溶液混合一半时就开始计时?反应液的起始浓度应该是多少?答:乙酸乙酯微溶于水,刚开始反应时乙酸乙酯和水分层,混合不均匀;随着水解的进行,生成的乙醇和乙酸乙酯及水能互溶,其次,故反应一半时开始计时能够提高测定的准确率;反应液的起始浓度应为0.0100 mol·dm-3。
(整理)实验八十二电导法测定乙酸乙酯皂化反应的速率常数题目.

实验八十二 电导法测定乙酸乙酯皂化反应的速率常数一、预习提问1、简述电导法测定乙酸乙酯皂化反应的速率常数的实验原理。
答:乙酸乙酯皂化反应是一个二级反应,其反应式为:CH 3COOC 2H 5 +Na + + OH - → CH 3COO - + Na + +C 2H 5OH 随着反应的进行,OH -离子浓度减低,使得溶液的电导率逐渐减少。
故用电导率法测定反应速率。
2、书上要测的是溶液的电导值,而我们测定的是溶液的电导率值,对结果有无影响?答:没有影响,该实验是以()()0t t κκκκ∞--对t 作图 ,而电导池常数被约去,对())0t t κκκκ∞--没有影响。
3、实验中,初始浓度过大或过小,对实验有何影响? 答:初始浓度过大,离子就不能完全电离,不能以()ckt t t=--∞κκκκ0作图。
初始浓度过小,则电导率变化太小影响准确度。
4、可否将NaOH 溶液稀释一倍后测得的电导率值作为皂化反应的初始电导率?为什么?答:可以,乙酸乙酯不具有明显的电导率。
5、如何测得乙酸乙酯皂化反应的活化能?答:测定不同温度下的反应速率常数k 1,k 2 。
根据阿仑尼乌斯(Arrhenius)公式ln()k k Ea R T T 212111=--来计算Ea 的值计算得到。
二、书后思考题1.反应分子数与反应级数是两个完全不同的概念,反应级数只能通过实验来确定。
试问如何从实验结果来验证乙酸乙酯皂化反应为二级反应?2.乙酸乙酯的皂化反应为吸热反应,试问在实验过程中如何处置这一影响而是使实验得到较好的结果?答:采用稀溶液控制反应速率,并适当搅拌。
3.如果和溶液均为浓溶液,试问能否用此方法求得K 值?为什么? 答:不能。
因为影响因素太多,在浓的溶液中不可认为CH 3COONa全部电离,该反应的逆反应不能忽略,此时不可以认为体系电导率值的减少与CH 3COONa 的浓度x 的增加量成正比。
4.为什么两溶液混合一半是就开始计时?答:因为溶液要尽快混合,而且反应速率较快,电导率也下降较快,所以加入一半时,就开始计时。
实验九电导法测定乙酸乙酯皂化反应的速率常数

实验九 电导法测定乙酸乙酯皂化反应的速率常数一、实验目的用电导法测定乙酸乙酯皂化反应在不同时刻的反应物浓度,验证其为二级反应并求反应速度常数。
二、实验原理乙酸乙酯皂化,是双分子反应,其反应式为: CH 3COOC 2H 5+Na +OH -→CH 3COO -Na ++C 2H 5OH在反应过程中,各物质的浓度随时间而改变,不同反应时间的OH -的浓度,可以用标准酸进行滴定求得,也可以通过间接测量溶液的电导率而求出。
为了处理方便起见,在设计这个实验时将反应物CH 3COOC 2H 5和NaOH 采用相同浓度c ,作为起始浓度。
设反应时间为t ,反应所生成的CH 3COONa 和C 2H 5OH 的浓度为x,那麽,CH 3COOC 2H 5和NaOH 的浓度则为(c -x ),即OH H C COONa CH NaOH H COOHC CH 523523+⇔+t =0 c c 0 0 t =t c-x c-x x x t →∞ 0 0 x →c x→c因是双分子反应,所以时间为t 的反应速度和反应物浓度的关系为dx/dt=k(c-x)2 (1)式中:k 为反应速率常数。
将上式积分可得:)(/x c c x kt -= (2) 从式(2)中可看出,原始浓度c 是已知的,只要测出t 时的x 值,就可算出反应速度常数k 值。
首先假定整个反应体系是在稀释的水溶液中进行的,因此可以认为CH 3COONa 是全部电离的,在本实验中我们用测量溶液的电导率求算x 值的变化,参与导电的离子有Na +、OH -、和CH 3COO -,而Na +在反应前后浓度不变,由于OH -不断减少而CH 3COO -不断增加,所以,体系的电导值不断下降。
显然,体系电导值的减少量和CH 3COONa 的浓度x 的增大成正比,即:t=t 时 )()(0'0t t K G G K x κκ-=-= (3) t →∞时 )()(0'0∞∞-=-=κκK G G K c (4) 式中:0G 、0κ为起始时的电导、电导率,t G 、t κ为t 时的电导、电导率;∞G 、∞κ为t →∞时的电导率;K 、'K 为比例常数。
物理化学实验乙酸乙酯皂化反应速率常数的测定

物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定一.实验目的及要求1.了解测定化学反应速率常数的一种物理方法----电导法。
2.了解二级反应的特点,学会用图解法求二级反应的速率常数。
3.掌握DDS-307型数字电导率仪和控温仪使用方法。
二.实验原理乙酸乙酯皂化反应是典型的二级反应。
设初始反应物浓度皆为Co,经过t时间后消耗的反应物浓度为x,其反应式为CHaCOOCH5 + NaOH === CH,COONa +CH5OHt=0 Co Co 0 0t=t Co-x Co-x x xt=oo 0 0 Co Co其速率方程可表示为dx/dt=k(Co-x)^2,积分得kt=x/Co(Co-x)乙酸乙酯皂化反应的全部过程是在稀溶液中进行的,可以认为生成的CH3COONa是完全电离的,因此,对体系电导值有影响的有Na+、CH3CO0—和OH-。
Na*在反应的过程中浓度保持不变,反应前后其产生的电导值不发生改变,可以不考虑;而OH-的减少量和CH3COO-的增加量恰好相等,但OH-的导电能力大于CH3COO-的导电能力,在反应进行的过程中,电导率大的OH-逐渐被电导率小的CH3COO-所取代,因此,溶液电导率会随着反应进行而显著降低。
对于稀溶液而言,强电解质的电导率:与其浓度成正比,溶液的总电导率就等于组成该溶液的电解质电导率之和。
本实验采用电导法测量乙酸乙酯在皂化反应中电导率κ随时间t的发化。
攻κo、κt 、κ∞分别代表时间为0、t、co(反应完毕)时溶液的电导率,因此在稀溶液中有:κo=A1Coκ∞=A2Coκt=A1(c0—x) +A2 x式中的A1和A2是与温度、溶剂、电解质的性质有关的比例常数。
由以上三式可以推出:因此,对于二级反应,以κt对κo/t-κt/t 作图得到一条直线,直线的斜率为1/c o k,由此可以求出反应常数k。
由两个不同温度下的反应速率常数k(T1)和k(T2),根据阿伦尼乌斯公式可求出该反应的的活化能。
电导法测定乙酸乙酯皂化反应的速率常数

电导法测定乙酸乙酯皂化反应的速率常数一、实验目的1 掌握电导法测定反应速率常数的原理和方法2 用图解法验证二级反应的特点3 掌握电导率仪的使用方法二、实验原理乙酸乙酯皂化反应是一个典型的二级反应反应速率方程为(18.1)式中:a ,b分别表示两反应物的初始浓度,x表示经过时间t后消耗的反应物浓度,k表示反应速率常数。
为了数据处理方便,设计实验使两种反应物的起始浓度相同,即a=b, 此时(181)式可以写成(18.2)积分得:(18.3)由(18.3)式可知,只要测得t时刻某一组分的浓度就可求得反应速率常数。
测定该反应体系组分浓度的方法很多,例如,可用标准酸滴定测出不同时刻OH-离子的浓度。
本实验使用电导率仪测量皂化反应进程中体系电导随时间的变化,从而达到跟踪反应物浓度随时间变化的目的。
随着乙酸已酯皂化反应的进行,溶液中导电能力强的OH-离子逐渐被导电能力弱的CH3COO-离子取代,Na+离子浓度不发生变化,而CH3COOC2H5和C2H5OH不具有明显的导电性,所以溶液的电导逐渐减小,故可以通过反应体系电导的变化来度量反应的进程。
令G0、G t和G∞分别表示反应起始时、反应时间 t时和反应终了时反应体系的电导。
显然G0是浓度为 a的NaOH溶液的电导,G∞是浓度为 a的CH3COONa溶液的电导,G t是浓度为(a-x)的NaOH溶液与浓度为x的CH3COONa溶液的电导之和。
由此可得到下列关系式:(18.4)由(18.4)式可得:(18.5)将(18.5)式代入(18.3)式,得:(18.6)或(18.7)由(18.6)和(18.7)式可以看出,以作图均可得一条直线,由直线斜率可求得速率常数,后者无需测得值。
若在不同得温度下测得反应速率常数,则可根据Arrhenius公式:(18.8)或(18.9)求得反应的活化能E三、仪器和试剂玻璃恒温水浴 1套 NaOH标准溶液 (0.02mol.L-1)DDS-11A型电导率仪 1套 CH3COOC2H5(A.R)秒表 1块叉管电导池 1个移液管 (20ml) 2支容量瓶(100ml) 1个锥形瓶(150ml) 1个四、实验步骤1. 0.02mol.L-1CH3COOC2H5溶液配制先计算配制0.02M乙酸已酯100ml所需乙酸已酯的质量。
乙酸乙酯皂化反应速率常数的测定(详细参考)

乙酸乙酯皂化反应速率常数的测定一、实验目的1.学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法;2.了解二级反应的特点,学会用图解计算法求二级反应的速率常数;3.熟悉电导仪的使用。
二、实验原理(1)速率常数的测定乙酸乙酯皂化反应时典型的二级反应,其反应式为:CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OHt=0 C 0 C 0 0 0t=t Ct Ct C 0 - Ct C 0 -Ct t=∞ 0 0 C 0 C 0速率方程式 2kc dtdc=-,积分并整理得速率常数k 的表达式为: t0t0c c c c t 1k -⨯=假定此反应在稀溶液中进行,且CH 3COONa 全部电离。
则参加导电离子有Na+、OH -、CH 3COO -,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO -,随着反应的进行,OH - 不断减小,CH 3COO -不断增加,所以体系的电导率不断下降,且体系电导率(κ)的下降和产物CH 3COO -的浓度成正比。
令0κ、t κ和∞κ分别为0、t 和∞时刻的电导率,则:t=t 时,C 0 –Ct=K (0κ-t κ) K 为比例常数 t→∞时,C 0= K (0κ-∞κ) 联立以上式子,整理得:∞+-⨯=κκκκtkc 1t00t 可见,即已知起始浓度C 0,在恒温条件下,测得0κ和t κ,并以t κ对tt0κκ-作图,可得一直线,则直线斜率0kc 1m = ,从而求得此温度下的反应速率常数k 。
(2)活化能的测定原理: )11(k k ln21a 12T T R E -= 因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
三、仪器与试剂电导率仪 1台 铂黑电极 1支 大试管 5支 恒温槽 1台 移液管 3支氢氧化钠溶液(0.02mol/L ) 乙酸乙酯溶液(0.02mol/L ) 四、实验步骤1.标定NaOH 溶液及乙酸乙酯溶液的配制计算标定0.023/dm mol NaOH 溶液所需的草酸二份,放入锥形瓶中,用少量去离子水溶解之,标定溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电导法测定乙酸乙酯皂化反应的速率常数指导老师:李国良【实验目的】①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; ②了解二级反应的特点,学会用图解计算法求二级反应的速率常数; ③熟悉电导仪的使用。
【实验原理】(1)速率常数的测定乙酸乙酯皂化反应时典型的二级反应,其反应式为:CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OHt=0 C 0 C 0 0 0t=t Ct Ct C 0 - Ct C 0 -Ct t=∞ 0 0 C 0 C 0速率方程式 2kc dtdc=-,积分并整理得速率常数k 的表达式为: t0t0c c c c t 1k -⨯=假定此反应在稀溶液中进行,且CH 3COONa 全部电离。
则参加导电离子有Na +、OH -、CH 3COO -,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO -,随着反应的进行, OH - 不断减小,CH 3COO -不断增加,所以体系的电导率不断下降,且体系电导率(κ)的下降和产物CH 3COO -的浓度成正比。
令0κ、t κ和∞κ分别为0、t 和∞时刻的电导率,则:t=t 时,C 0 –Ct=K (0κ-t κ) K 为比例常数 t →∞时,C 0= K (0κ-∞κ) 联立以上式子,整理得: ∞+-⨯=κκκκtkc 1t00t 可见,即已知起始浓度C 0,在恒温条件下,测得0κ和t κ,并以t κ对tt0κκ-作图,可得一直线,则直线斜率0kc 1m = ,从而求得此温度下的反应速率常数k 。
(2)活化能的测定原理: )11(k k ln21a 12T T R E -=因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】电导率仪1台铂黑电极1支大试管5支恒温槽1台移液管3支氢氧化钠溶液(1.985×10-2mol/L)乙酸乙酯溶液(1.985×10-2mol/L)【实验步骤】①调节恒温槽的温度在26.00℃;②在1-3号大试管中,依次倒入约20mL蒸馏水、35mL 1.985×10-2mol/L的氢氧化钠溶液和25mL1.985×10-2mol/L乙酸乙酯溶液,塞紧试管口,并置于恒温槽中恒温。
③安装调节好电导率仪;κ的测定:④从1号和2号试管中,分别准确移取10mL蒸馏水和10mL氢氧化钠溶液注入4号试管κ;中摇匀,至于恒温槽中恒温,插入电导池,测定其电导率κ的测定:⑤t从2号试管中准确移取10mL氢氧化钠溶液注入5号试管中至于恒温槽中恒温,再从3号试管中准确移取10mL乙酸乙酯溶液也注入5号试管中,当注入5mL时启动秒表,用此时刻作为反应的起始时间,加完全部酯后,迅速充分摇匀,并插入电导池,从计时起2min κ值,以后每隔2min读一次,至30min时可停止测量。
时开始读t⑥反应活化能的测定:κ值。
在35℃恒温条件下,用上述步骤测定t【数据处理】①求26℃的反应速率常数k1,将实验数据及计算结果填入下表:κ=2.29m s·cm-1恒温温度=28.00℃V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/LV NaOH=10.00mL [NaOH]=1.9850×10-2mol/Lc0=0.5×1.9850×10-2mol/L实验数据记录及处理表1:图1:t κ-tt0κκ-:1.11.21.31.41.51.61.71.81.9κt /m s /c m -1κ0-κt )/t /ms/cm -1数据处理:t κ对tt0κκ-作图,求出斜率m ,并由0kc 1m =求出速率常数 m=4.15,k 1=1/(mc 0)=1/(4.15*1.9850*0.5*10-2)mol ·L -1·min=24.3L/(mol ·min) 文献参考值:k (298.2K )=(6±1)L/(mol ·min)②采用同样的方法求35℃的反应速率常数k 2,计算反应的表观活化能Ea :a 、35℃的反应速率常数k 2恒温温度=35.00℃ 0κ=2.63m s ·cm-1V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/LVNaOH=10.00mL [NaOH]=1.9850×10-2mol/Lc 0=0.5×1.9850×10-2mol/L图2:t κ-tt0κκ-:κ0-κt )/t /ms/cm -1κt /m s /c m -1m=2.34,k 1=1/(mc 0)=1/(2.34*1.9850*0.5*10-2)mol ·L -1·min=43.1L/(mol ·min) 文献参考值:k (308.2K )=(10±2)L/(mol ·min)b .计算反应的表观活化能: ∵k 1/k 2=m 2/m 1∴ln(k 2/k 1)=Ea/R ·(1/T 1-1/T 2) ln(m 1/m 2)=Ea/R ·(1/T 1-1/T 2) ∴Ea=Rln(m 1/m 2)·[T 1T 2/(T 2-T 1)]=8.314×ln (4.15÷2.34)×[308×299÷(308-299)]J/mol =48.7kJ/mol文献值:Ea=46.1kJ/mol 相对误差:(48.7-46.1)÷46.1×100%=5.64%【结果分析与讨论】①根据本实验中测定的数据作t κ-tt0κκ-图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。
如果从6min 开始测定,即去掉前两个数据,重新作图,则t κ-tt0κκ-图线性提高了。
以26.0℃数据为例作图对比: 去点前:κt /m s /c m -1κ0-κt )/t /ms/cm -1去点后:/tκt /m s /c m -1κ0-κt )/t /ms/cm -1②作t κ-tt0κκ-图得斜率m ,根据m 求出k 值约为文献值的4倍:26.0℃:m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)文献参考值:k(298.2K)=(6±1)L/(mol·min)35.0℃:m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)文献参考值:k(308.2K)=(10±2)L/(mol·min)分析原因:实验过程中加入乙酸乙酯后没有充分混合就开始测定,由于电导率仪处于主要是乙酸乙酯的环境氛围内,所以测定的κt偏小,而t t0κκ-值偏大,则作图所得斜率偏小。
由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
【提问与思考】①为何本实验要在恒温条件进行,而CH3COOC2H5和NaOH溶液在混合前还要预先恒温?答:因为反应速率k受温度的影响大,(k T+10)/k T=2~4,若反应过程中温度变化比较大,则测定的结果产生的误差较大;反应物在混合前就预先恒温是为了保证两者进行反应的时候是相同温度的,防止两者温差带来温度的变化影响测定结果。
②为什么CH3COOC2H5和NaOH起始浓度必须相同,如果不同,试问怎样计算k值?如何从实验结果来验证乙酸乙酯反应为二级反应?答:因为乙酸乙酯的皂化反应是二级反应,为了简化计算,采用反应物起始浓度相同。
如果不同,则k=1/t(a-b)·ln[b(a-x)/a(b-x)]。
选择不同浓度的CH3COOC2H5和NaOH溶液,测定不同浓度的反应物在相同反应条件下的反应速率。
③有人提出采用pH法测定乙酸乙酯皂化反应速率常数,此法可行吗?为什么?答:可以。
CH3COOC2H5+OH-=CH3COO-+C2H5OH,反应速率方程为:v=dx/dt=k(a-x)(b-x),当起始浓度相同(a=b),对该式积分简化得:k=x/ta(a-x)。
设t时刻溶液的pH值为ε(t),则此时溶液OH-的浓度为c t(OH-)=10(pH-14),即a-x=10(pH-14),ka=[a-10(pH-14)]/[t·10(pH-14)],用a-10(pH-14)对[t·10(pH-14)作图,可得一条直线,该直线的斜率m=ka,即k=m/a。
④为什么要将电导率仪的温度旋钮选为“25”?答:测量值就是待测液在实际温度下未经补偿的原始电导率值。
2 反应分子数与反应级数是两个完全不同的概念,反应级数只能通过实验来确定。
试问如何从实验结果来验证乙酸乙酯为二级反应?答:保证实验条件完全相同的情况下,采用不同浓度的CH3COOC2H5和NaOH进行实验,比较实验的反应速率常数来证明乙酸乙酯皂化反应为二级反应。
3 乙酸乙酯皂化反应为吸热反应,试问在实验过程中如何处置这一影响而使实验得到较好的结果?答:实验采用稀溶液在超级恒温水浴中进行,并反应前水浴槽恒温10分钟才进行实验,NaOH和CH3COOC2H5溶液在混合前还要预先恒温10分钟,以保证整个实验过程都在相对稳定的温度下进行。
4如果乙酸乙酯和 NaOH 溶液均为浓溶液,试问能否用此方法求得 k 值?为什么?答:不能。
因为反应过程中浓溶液稀释会放出大量的热,对实验温度有影响。
而且只有强电解质的稀溶液的电导率与其浓度成正比。
6.为什么要使两溶液尽快混合完毕?开始一段时间的测定时隔期为什么要短?答:(1)实验过程中,要记录不同反应时间时体系的电导率,因此两溶液要尽快混合,且在混合时开始按下秒表计时。
(2)反应在开始一段时间内,体系的电导率下降较快,因此这段时间测定的时间间隔期要短。
7.为什么由0.0100mol·dm-3的NaOH溶液和0.0100mol·dm-3的CH3COONa溶液测得的电导率可以认为是κ0、κ∞?答:κ0是反应:CH3COOC2H5+NaOH→CH3COONa+C2H5OH 体系t=0时的电导率,但是CH3COOC2H5与NaOH混合的瞬间就已开始反应,因而混合后第一时间测的κ也不是t=0时的电导率。
