《无菌检验原始记录》
无菌检查记录

无菌检查记录一、任务背景无菌检查是医疗机构中非常重要的环节之一,它用于确保手术器械、医疗设备和手术室等环境的无菌状态,以避免术后感染的发生。
本文旨在编写一份标准格式的无菌检查记录,以满足医疗机构对无菌检查过程和结果的详细记录需求。
二、无菌检查记录格式日期:2022年10月20日检查人员:王医生手术室:A手术室手术器械:手术刀、镊子、钳子等无菌检查结果:1. 手术刀:外观整洁,无锈迹,包装完好,无明显破损。
2. 镊子:外观整洁,无锈迹,包装完好,无明显破损。
3. 钳子:外观整洁,无锈迹,包装完好,无明显破损。
无菌检查过程:1. 王医生首先戴上手套,并准备好所需的无菌检查工具。
2. 王医生依次检查每个手术器械,仔细观察其外观情况,检查有无锈迹、包装是否完好、有无明显破损等。
3. 检查完成后,王医生将手术器械放置在无菌台上,并在记录表中填写相关信息。
备注:1. 本次无菌检查工作由王医生负责,检查结果显示手术器械外观整洁,包装完好,无明显破损,符合无菌要求。
2. 所有无菌检查过程严格按照医疗机构的相关规范和操作流程进行,确保检查结果的准确性和可靠性。
3. 本次无菌检查记录将被归档保存,以备后续审查和追溯。
三、数据统计和分析根据本次无菌检查记录,我们可以得出以下数据统计和分析结果:1. 本次检查的手术器械总数:3个2. 无菌检查结果符合要求的手术器械数量:3个3. 无菌检查结果不符合要求的手术器械数量:0个4. 无菌检查合格率:100%根据以上数据统计和分析结果,本次无菌检查工作取得了非常好的效果,所有手术器械均符合无菌要求,无菌检查合格率达到100%。
四、结论本次无菌检查记录详细记录了检查过程和结果,所有手术器械外观整洁,包装完好,无明显破损,符合无菌要求。
根据数据统计和分析,本次无菌检查工作取得了非常好的效果,无菌检查合格率达到100%。
这表明医疗机构在无菌检查工作中严格按照相关规范和操作流程进行,确保手术器械和手术室的无菌状态,为患者手术安全提供了可靠的保障。
《无菌检验原始记录》
培养天
数
菌别
1234567891011121314
需气菌
厌气菌
30~35℃薄
膜
法
样
品
阳
性
直
接
法
1
2
3
4
5
6阳
性阴性
真薄膜法
7
无菌检查原始记录
检品编号:
产品名称检验日期
生产批号规
格
完成
日期
灭菌批号效期检验者
生产单位或
产地检品
数量
11支
校对
者
检验依据方法:
菌 23~28℃
直接法8 9 10 11
阴性
培养基: 硫乙醇酸盐流体培养基 配制批号:
改良马丁培养基 配制批号:
稀释液、冲洗液:□ 0.1%蛋白胨水溶液 □ PH7.0氯化钠-蛋白胨缓冲液 □ 0.9%无菌氯化钠溶液
配制批号:
对照菌:
取上述对照菌新鲜培养物1ml ,用9ml0.9%无菌氯化钠溶液10倍系列稀
释,取稀释液1ml 作为对照用菌液。
第 代培养物,稀释级别 计数结果
CFU/ml
设备编号: 隔水式恒温培养箱: 霉菌培养箱: 集菌仪:
无菌室菌落培养(30~35℃)
碟号时间123(应≤1CFU/平板)24小时菌落
数 结果:
符合 □
不符合 □
48小时菌落
数 平均菌落数
检验结果
无菌检查结果判断:□符合规定□不符合规定。
无菌检验原始记录
4.阳性对照管:在阳性间的无菌操作环境下,将对应的阳性菌5个接种置硫乙醇酸盐流体培养基和改良马丁培养基。
5.阴性对照管:空白硫乙醇酸盐流体培养基和改良马丁培养基。
6.将接种好后硫乙醇酸盐流体培养基置30~35℃,改良马丁马丁培养基置23~28℃,培养14天观察结果。
结果记录
培养基灵敏度:
日期
硫乙醇酸盐流体培养基
改良马丁培养基
空白对照
无菌检查:
日期
供试管
阳性对照管
阴性对照管
备注:
成品检验报告:
结论:
(盖章)
将5个供试品在无菌操作环境下每个包装用50100ml无菌09生理盐水பைடு நூலகம்别冲洗样品的内壁和外表收集冲洗液于无菌容器中用放有无菌过滤膜的无油真空泵过滤抽取冲洗液然后将过滤膜取出接种置硫乙醇酸盐流体培养基
无菌检验原始记录
样品名称
样品批号
检验数量
样品数量
检验日期
灭菌批号
检验项目
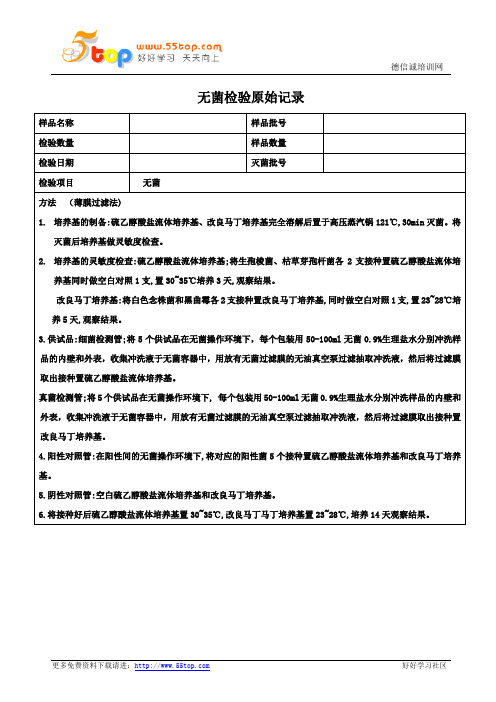
无菌
方法(薄膜过滤法)
1.培养基的制备:硫乙醇酸盐流体培养基、改良马丁培养基完全溶解后置于高压蒸汽锅121℃,30min灭菌。将灭菌后培养基做灵敏度检查。
检验人:复核人:
2.培养基的灵敏度检查:硫乙醇酸盐流体培养基;将生孢梭菌、枯草芽孢杆菌各2支接种置硫乙醇酸盐流体培养基同时做空白对照1支,置30~35℃培养3天,观察结果。
改良马丁培养基:将白色念株菌和黑曲霉各2支接种置改良马丁培养基,同时做空白对照1支,置23~28℃培养5天,观察结果。
菌落总数检验原始记录

结果:
n2
步骤同上
原液 1:10 1:100 1:1000 空 白
1 2 1 2 1 2 1 2 1 2
结果:
n3
步骤同上
原液 1:10 1:100 1:1000 空白
1 2 1 2 1 2 1 2 1 2
结果:
n4
步骤同上
原液 1:10 1:100 1:1000 空白
步骤同上
原液 1:10 1:100 1:1000 空白
1 2 1 2 1 2 1 2 1 2
结果:
n5
步骤同上
原液 1:10 1:100 1:1000 空白
1 2 1 2 1 2 1 2 1 2
结果:
检验员:审核:
大肠菌群检验原始记录
样品编号:
检验项目
检验起
止时间
温度℃
湿度%
大气压
样品序号
检验记录
报出值
大肠总数
CFU/g
GB4789.2
n1
通过无菌操作取25ml试样加入入225ml生理盐水中,吸1ml入9ml生理盐水内递增稀释,每次换吸管,同时各吸1ml入平皿,两平行。1ml稀释液做空白对照。各皿注入结晶紫中性红胆盐琼脂约15ml。36℃下保温48小时后计数计算。
原液 1:10 1:100 1:1000 空 白
1 2 1 2 1 2 1 2 1 2
结果:
n5
步骤同上
原液 1:10 1:100 1:1000 空白
1 2 1 2 1 2 1 2 1 2
结果:
检验员:审核:
铜绿假单胞菌检验原始记录
样品编号:
检验项目
检验起
止时间
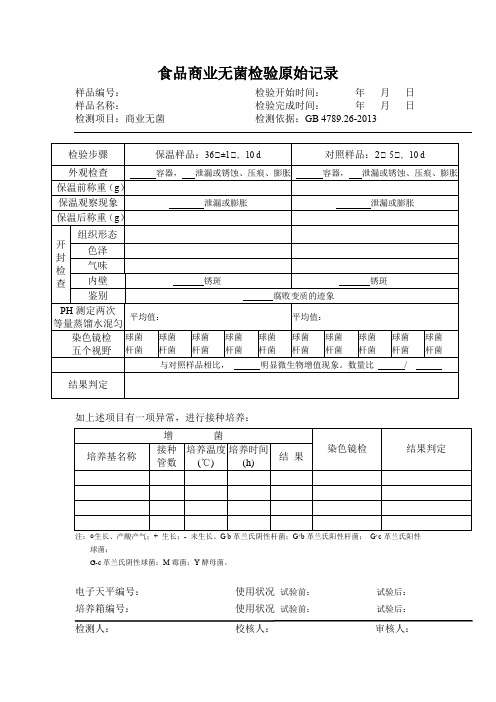
商业无菌检验原始记录表2013

外观检查
马口铁容器,无泄漏或锈蚀、压痕、膨胀 马口铁容器,无泄漏或锈蚀、压痕、膨胀
保温前称重(g) 356.3
367.9
保温观察现象 无泄漏或膨胀
无泄漏或膨胀
保温后称重(g) 355.7
365.7
组织 紧密略有弹性,略粘
紧密略有弹性,略粘
形态 方块状
开
罐
色泽 不均匀的粉红色
检 查
气味 芳香,无不良异味
5 个视野
与对照样品相比, 无 明显的微生物增殖现象。数量比: 6 / 6
结封性检查见附页
校核者:
某某检验机构
商业无菌检验原始记录表
(受控文件号)************
样品流转号
食检 14-0374
样品名称
共 页第 页 午餐肉罐头
生产批号 检验地点 检验依据
培养基 检验日期
20131209
洁净实验室 508-2
GB 4789.26-2013 商业无菌检验 结晶紫染色液 20131226 无菌蒸馏水 20140313
14 年 3 月 13 日~ 3 月 23 日
仪器和设备
SC6010 电子天平 恒温培养箱 冰箱 □超净工作台 PHS-3C 酸度计 Olympus 显微镜
编号 W036 编号 W007 编号 W041 编号 W016 编号 W002 编号 W022
检验步骤
保温样品 36℃±1℃,10 d
对照样品 2℃~5℃,10 d
内壁 无锈斑
方块状 不均匀的粉红色 芳香,无不良异味 无锈斑
鉴别
无 腐败变质的迹象
pH 测定两次 等量蒸馏水混匀
7.41 7.43
平均值:7.42
7.45 7.45
《无菌检验原始记录》资料

无菌检验原始记录资料1. 引言无菌检验是医药行业中一项非常重要的检测项目,用于评估药品或医疗器械是否符合无菌要求。
本文档将记录无菌检验的原始数据,包括实验设计、样品准备、实验过程、结果分析等内容。
2. 实验设计在进行无菌检验前,需要制定合理的实验设计,明确实验目的、方法和操作流程。
以下是本次无菌检验的实验设计:•实验目的:评估药品A的无菌性能,判断是否达到临床使用的要求。
•样品准备:从批次A中随机抽取10个单位作为样品。
•实验方法:采用膜过滤法进行无菌检验。
•实验流程:样品制备、膜过滤、培养基接种、培养、读取结果。
3. 样品准备样品准备是无菌检验中的重要环节,确保样品的真实性和可再现性。
在本次无菌检验中,我们从药品A批次中随机抽取了10个单位作为样品。
样品准备步骤如下:1.检查药品A批次的包装是否完好。
2.选择10个单位的药品,注意不要接触到外部环境。
3.将药品放入灭菌环境中,准备进行后续的膜过滤操作。
4. 实验过程本次无菌检验采用膜过滤法进行。
实验过程如下:1.准备所需材料和设备:膜过滤器、采样器、移液器、灭菌培养基等。
2.将膜过滤器装入采样器,并进行预灭菌处理。
3.使用移液器将样品精确地转移至采样器中。
4.将采样器连接至真空泵,启动泵抽取样品。
5.将膜过滤器转移到灭菌培养基板上,确保膜迅速接触到培养基。
6.将培养基板置于恒温培养箱中,设定合适的温度和时间。
7.培养结束后,观察培养基板上是否有细菌生长。
5. 结果分析根据观察结果,我们对实验结果进行分析和解读。
以下是对本次无菌检验结果的分析:•样品1-10:观察结果显示,所有样品在培养基板上均未发现细菌生长。
•正、负对照:正对照(已知含有细菌)显示细菌生长,而负对照(未接触到样品)未发现细菌生长。
•结论:根据实验结果,可以得出结论,药品A批次显示出良好的无菌性能,符合临床使用的要求。
6. 总结本文档记录了一次无菌检验的原始数据,包括实验设计、样品准备、实验过程、结果分析等内容。
无菌检查原始记录019
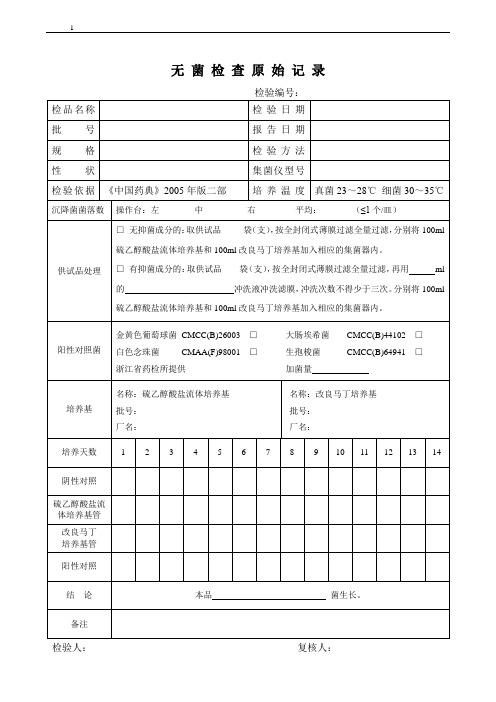
生孢梭菌CMCC(B)64941□
加菌量
培养基
名称:硫乙醇酸盐流体培养基
批号:
厂名:
名称:改良马丁培养基
批号:
厂名:
培养天数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
阴性对照
硫乙醇酸盐流体培养基管
改良马丁
培养基管
阳性对照
结论
本品菌生长。
备注
检验人:复核人:
无菌检查原始记录
检验编号:
检品名称
检验日期
批号
报告日期
规格
检验方法
性状
集菌仪型号
检验依据
《中国药典》2005年版二部
培养温度
真菌23~28℃细菌30~35℃
沉降菌菌落数
操作台:左_____中_____右_____平均:_____(≤1个/皿)
供试品处理
□无抑菌成分的:取供试品_____袋(支),按全封闭式薄膜过滤全量过滤,分别将100ml硫乙醇酸盐流体培养基和100ml改良马丁培养基加入相应的集菌器内。
□有抑菌成分的:取供试品____袋(支),按全封闭式薄膜过滤全量过滤,再用ml的冲洗液冲洗滤膜,冲洗次数不得少于三次。分别将100ml硫乙醇酸盐流体培养基和100ml改良马丁培养基加入相应的集菌器内。
阳性对照菌
金黄色葡萄球菌CMCC001□
浙江省药检所提供
《无菌检验原始记录》

《无菌检验原始记录》
日期:YYYY年MM月DD日
实验目的:通过进行无菌检验,检测样品是否受到外源性微生物污染。
实验材料:
1.无菌培养基
2.无菌试管
3.无菌匀液棒
4.无菌平板
5.微生物荧光灯
6.净化工作台
实验步骤:
1.将样品取出,在净化工作台上进行操作。
2.取一支无菌试管,将培养基倒入试管中约1/4满。
3. 用无菌匀液棒沾取样品约0.1ml,并迅速划线于无菌培养基上。
4.取另一支无菌试管,使用同样的方法将培养基倒入试管中,作为对
照组。
5.将培养基涂布在无菌平板上,旋转均匀。
6.将培养基固化后,将平板放置于微生物荧光灯下观察,并记录菌落
的出现情况。
7.对照组同样进行观察,用于比对差异结果。
实验结果:
对照组观察结果:未观察到任何菌落的生长。
样品观察结果:观察到部分菌落的生长。
实验分析与讨论:
根据实验结果,对照组未观察到任何菌落的生长,说明实验的无菌操作得到了有效执行。
而样品中观察到了部分菌落的生长,表明样品中存在微生物的外源性污染。
实验结论:
根据实验结果,样品中观察到了部分菌落的生长,表明样品受到了外源性微生物污染。
为了确保样品的质量和安全性,在进一步的研究中,需要采取相应措施降低污染源,并加强无菌操作的执行。
食品商业无菌检验原始记录
染色镜检
结果判定
培养基名称
接种
管数
培养温度
(℃)
培养时间
(h)
结果
注: 生长、产酸产气;+生长;-未生长。G-b革兰氏阴性杆菌;G+b革兰氏阳性杆菌;G+c革兰氏阳性球菌;
G-c革兰氏阴性球菌;M霉菌;Y酵母菌。
电子天平编号:使用状况试验前:试验后:
培养箱编号:使用状况试验前:试验后:
检测人:校核人:审核人:
泄漏或膨胀
泄漏或膨胀
保温后称重(g)
开
封
检
查
组织形态
色泽
气味
内壁
锈斑
锈斑
鉴别
腐败变质的迹象
PH测定两次
等量蒸馏水混匀
平均值:
平均值:
染色镜检
五个视野
杆菌
球菌
杆菌
球菌
杆菌
球菌
杆菌
球菌
杆菌
球菌
杆菌
球菌
杆菌
与对照样品相比,明显微生物增值现象。数量比/
结果判定
如上述项目有一项异常,进行接种培养:
食品商业无菌检验原始记录
样品编号:检验开始时间:年月日
样品名称:检验完成时间:年月日
检测项目:商业无菌检测依据:GB 4789.26-2013
检验步骤
保温样品:36℃±1℃,10 d
对照样品:2℃-5℃,10 d
外观检查
容器,泄漏或锈蚀、压痕、膨胀
容器,泄漏或锈蚀、压痕、膨胀
保温前称重(g)
保温观察现象
无菌检查记录
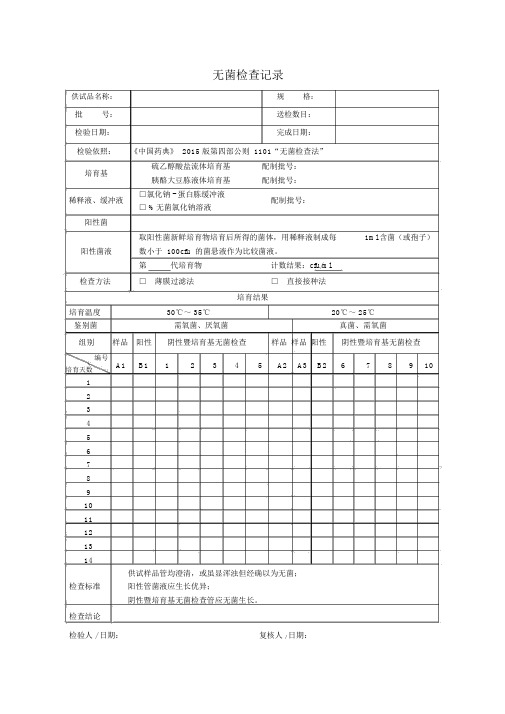
无菌检查记录
供试品名称:批号:检验日期:规格:送检数目:完成日期:
检验依照:《中国药典》 2015 版第四部公则 1101“无菌检查法”
培育基硫乙醇酸盐流体培育基配制批号:胰酪大豆胨液体培育基配制批号:
稀释液、缓冲液□氯化钠 - 蛋白胨缓冲液
配制批号:□ %无菌氯化钠溶液
阳性菌
取阳性菌新鲜培育物培育后所得的菌体,用稀释液制成每1ml 含菌(或孢子)
阳性菌液数小于 100cfu 的菌悬液作为比较菌液。
第代培育物计数结果:cfu/ml
检查方法□ 薄膜过滤法□ 直接接种法
培育结果
培育温度30℃~ 35℃20℃~ 25℃
鉴别菌需氧菌、厌氧菌真菌、需氧菌
组别样品阳性阴性暨培育基无菌检查样品样品阳性阴性暨培育基无菌检查编号
A1 B1 1 2 3 4 5 A2 A3 B2 6 7 8 9 10 培育天数
1
2
3
4
5
6
7
8
9
10
11
12
13
14
供试样品管均澄清,或虽显浑浊但经确以为无菌;
检查标准阳性管菌液应生长优异;
阴性暨培育基无菌检查管应无菌生长。
检查结论
检验人 / 日期:复核人 / 日期:。
无菌检验原始记录

无菌检验原始记录
嘉兴康谷医用材料有限公司
供试品名称 规格型号 样品数量 供试液制备
培养基批号
培养 基制
生产批号 检验日期
灭菌批 号 接种方式
培养基预培养时 间
QMR-088-00
培养仪器
生化培养箱
培养箱编号
培养温度
培 养 基 天数
30℃~35℃
细菌培养基 A
阴性对照 阳性对照 (加 (加1ml0.9%氯 1ml金黄色葡 化钠注射液) 萄球菌菌液)
复核 人/日 期:
生效日期:2016年05月18日
B
C
20℃~25℃
改良马丁培养基 A
阴性对照 阳性对照 (加 (加1ml0.9%氯 1ml白色念珠 化钠注射液) 菌菌液)B NhomakorabeaD
1
2
3
4
5
6
7
8
9
10
11
12
13
14 培养结果判 定备:注: 培养 结果阳性用“
培养皿编号 24H菌落数
48H菌落数
72H菌落数
平均值 结果判定
无菌室菌落
1
数测试 2
3
检验人/日 期:
《无菌检验原始记录》资料

无菌检验原始记录资料1. 引言本文档为《无菌检验原始记录》资料的详细记录和分析。
无菌检验是指在无菌条件下对物品进行检验,以确定其中是否存在细菌或其他微生物的方法。
本次无菌检验涉及的物品包括药品、医疗器械、食品等。
本文档将提供检验过程的详细记录,并分析结果以评估物品的无菌性能。
2. 检验对象及目的2.1 检验对象本次无菌检验的对象为医疗器械A。
2.2 检验目的检验医疗器械A是否符合无菌要求,以评估其无菌性能。
3. 检验方法3.1 前期准备•清洁工作台:使用消毒剂对工作台进行彻底清洁,并进行适当灭菌处理。
•检验器具:收集所需的各种无菌器具,如培养皿、无菌填料等。
•培养基:准备适当的培养基。
3.2 检验步骤1.将医疗器械A放置在清洁工作台上,检查其外部是否有明显污染。
2.使用消毒液对医疗器械A进行清洁,消毒时间为10分钟。
3.将清洁后的医疗器械A放入无菌培养皿中。
4.将培养皿密封并标记,以便后续分析。
5.将培养皿放入适当的培养基中,培养时间为24小时。
6.培养结束后,观察培养皿中是否有细菌生长。
7.根据细菌生长情况,评估医疗器械A的无菌性能。
4. 实验结果经过24小时的培养,观察到培养皿中无任何细菌生长。
因此,医疗器械A符合无菌要求,具有较好的无菌性能。
5. 结论和建议根据本次无菌检验的结果,可以得出以下结论和建议:1.医疗器械A通过了无菌检验,满足无菌要求。
2.建议继续保持对医疗器械A的无菌条件管理,并进行定期检验,以确保其无菌性能。
6. 参考文献1.无菌检验技术规范,国家药典委员会、中国食品与药品监督管理局。
2.WHO《无菌技术指南》。
本文档详细记录了《无菌检验原始记录》的实验步骤、检验结果以及结论和建议。
通过本次检验,我们可以对医疗器械A的无菌性能进行初步评估,并提出后续管理建议,以确保其安全使用。
无菌检查原始记录(直接接种法)
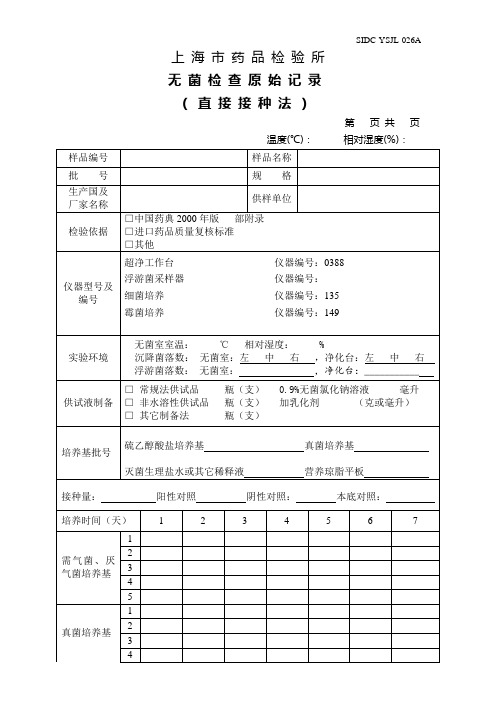
培养时间(天)
1
2
3
4
5
6
7
需气
5
真菌培养基
1
2
3
4
5
其它检验方法
备注
结论
□(均)符合规定□(均)不符合规定
检验者:校对者:审核者:
日期:日期:日期:
实验环境
无菌室室温:℃相对湿度:%
沉降菌落数:无菌室:左中右,净化台:左中右
浮游菌落数:无菌室:,净化台:___________
供试液制备
□常规法供试品瓶(支)0.9%无菌氯化钠溶液毫升
□非水溶性供试品瓶(支)加乳化剂(克或毫升)
□其它制备法瓶(支)
培养基批号
硫乙醇酸盐培养基真菌培养基
灭菌生理盐水或其它稀释液营养琼脂平板
上海市药品检验所
无菌检查原始记录
(直接接种法)
第页共页
温度(℃):相对湿度(%):
样品编号
样品名称
批号
规格
生产国及
厂家名称
供样单位
检验依据
□中国药典2000年版部附录
□进口药品质量复核标准
□其他
仪器型号及编号
超净工作台仪器编号:0388
浮游菌采样器仪器编号:
细菌培养仪器编号:135
霉菌培养仪器编号:149
食品生产经营企业商业无菌检验原始记录式样
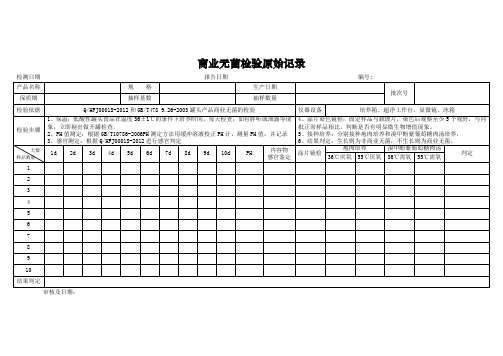
检测日期
报告日期
编号:
产品名称
规 格
生产日期
批次号
保质期
抽样基数
抽样数量
检验依据
Q/HFJ0001S-2012和GB/T478 9.26-2003罐头产品商业无菌的检验
仪器设备
培养箱、超净工作台、显微镜、冰箱
检验步骤
1、保温:低酸性罐头食品在温度36±1℃的条件下培养时间,每天检查,如有胖听或泄露等现象,立即剔出做开罐检查。
2、PH值测定:根据GB/T10786-2006PH测定方法用缓冲溶液校正PH计,测量PH值,并记录
3、感官测定:根据Q/HFJ0001S-2012进行感官判定
4、涂片染色镜检:固定样品与载玻片,染色后观察至少5个视野,与同批正常样品相比,判断是否有明显微生物增值现象。
5、接种培养:分别接种疱肉培养和溴甲酚紫葡萄糖肉汤培养,
6、结果判定:生长则为非商业无菌,不生长则为商业无菌。
天数
样品数量
1d
2d
3d
4d
5d
6d容物
感官鉴定
涂片镜检
疱肉培养
溴甲酚紫葡萄糖肉汤
判定
36℃厌氧
55℃厌氧
36℃需氧
55℃需氧
1
2
3
4
5
6
7
8
9
10
结果判定
检验人员: 核验人员:
审核及日期:
微生物检验原始记录范本
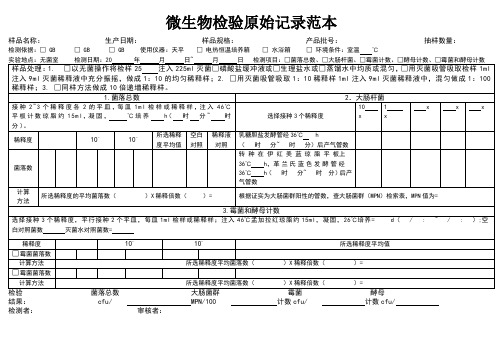
所选稀释度的平均菌落数( )X稀释倍数( )=
根据证实为大肠菌群阳性的管数,查大肠菌群(MPN)检索表,MPN值为=
3.霉菌和酵母计数
选择接种3个稀释度,平行接种2个平皿,每皿1ml检样或稀释样;注入46℃孟加拉红琼脂约15ml,凝固,26℃培养=d( / :~/ : );空白对照菌数灭菌水对照菌数=
微生物检验原始记录范本
样品名称:生产日期:样品规格:产品批号:抽样数量:
检测依据:□ GB□GB□GB使用仪器:天平□ 电热恒温培养箱 □ 水浴箱 □ 环境条件:室温℃
实验地点:无菌室检测日期:20年月日~月日检测项目:□菌落总数、□大肠杆菌、□霉菌计数、□酵母计数、□霉菌和酵母计数
样品处理:1.□以无菌操作将检样25注入225ml灭菌□磷酸盐缓冲液或□生理盐水或□蒸馏水中均质或混匀,□用灭菌吸管吸取检样1ml注入9ml灭菌稀释液中充分振摇,做成1:10的均匀稀释样;2. □用灭菌吸管吸取1:10稀释样1ml注入9ml灭菌稀释液中,混匀做成1:100稀释样;3. □同样方法做成10倍递增稀释样。
1.菌落总数
2.大肠杆菌
接种2~3个稀释度各2的平皿,每皿1ml检样或稀释样,注入46℃平板计数琼脂约15ml,凝固,℃培养h(时分~时分)。
选择接种3个稀释度
10
x
1
x
x
x
x
稀释度
10-
10-
所选稀释度平均值
空白对照
稀释液对照
乳糖胆盐发酵管经36℃h
(时 分~时分)后产气管数
菌落数
转 种 在 伊 红 美 蓝 琼 脂 平 板上36℃h,革兰氏蓝色发酵管经36℃h(时分~时 分)后产气管数
稀释度
10-
注射液的无菌检查原始记录.

注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:洁净室动态测定∑= CFU/皿(规定100级∑≤1 CFU/皿)符合规定室温℃相对湿度 %细菌培养箱:真菌培养箱:压力蒸汽灭菌器:培养基名称:硫乙醇酸盐流体培养基(1)硫乙醇酸盐流体培养基(2)改良马丁培养基阳性对照菌:金黄色葡萄球菌 [CMCC(B)26 003] 生孢梭菌 [CMCC(B)64 941] 白色念珠菌[CMCC(F)98 001] 大肠埃希菌 [CMCC(B)44 102]注射液的无菌检查原始记录样品名称:规格:样品编号:生产单位:批号:样品状态:检验日期:完成日期:一检验依据二样品处理:取本品三检验方法:(1)直接接种法(2)薄膜过滤法稀释液、冲洗液:(1)0.1%蛋白胨水溶液(2)pH7.0氯化钠-蛋白胨缓冲液四无菌检查结果:基本信息【药品名称】通用名称:头孢呋肟商品名称:西力欣、明可欣、达力新英文名称:汉语拼音:xilixin【成份】头孢呋辛酯化学名称为:(6R,7R)-7-[2-呋喃基(甲氧亚氨基)乙酰氨基]-3-氨基甲酰氧甲基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸,1-乙酰氧基乙酯【性状】本品为白色胶囊形薄膜衣片。
【作用类别】【规格】 250mg/片 125mg/片适应症头孢呋辛酯适用于敏感细菌造成的感染的治疗。
- 下呼吸道感染:如急性支气管炎及慢性支气管炎急性发作和肺炎。
- 上呼吸道感染:包括耳、鼻、咽喉感染,如中耳炎、鼻窦炎、扁桃体炎及咽炎。
- 生殖泌尿道感染:如肾盂肾炎,膀胱炎和尿道炎。
- 皮肤及软组织感染:如疖病,脓皮病和脓疱病。
治疗成人和12岁以上儿童的早期莱姆病,以及其后对晚期莱姆病的预防。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
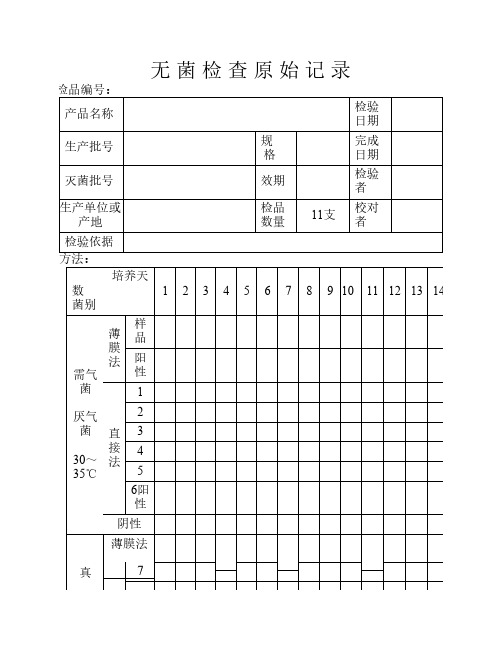
检品编号:
产品名称
检验日期
生产批号
规格
完成日期
灭菌批号
效期
检验者
生产单位或产地
检品数量
11支
校对者
检验依据
方法:
培养天数
菌别
1
2
3
4
5
6
7
8
9
10
11
12
13
14
需气菌
厌气菌
30~3ቤተ መጻሕፍቲ ባይዱ℃
薄膜法
样品
阳性
直接法
1
2
3
4
5
6阳性
阴性
真菌
23~28℃
薄膜法
直接法
7
8
9
10
11
阴性
培养基:硫乙醇酸盐流体培养基配制批号:
改良马丁培养基配制批号:
稀释液、冲洗液:□%蛋白胨水溶液□氯化钠-蛋白胨缓冲液□%无菌氯化钠溶液
配制批号:
对照菌:
对照菌菌液:取上述对照菌新鲜培养物1ml,用%无菌氯化钠溶液10倍系列稀释,取稀释液1ml作为对照用菌液。
第代培养物,稀释级别 计数结果 CFU/ml
设备编号:隔水式恒温培养箱:霉菌培养箱:集菌仪:
无菌室菌落培养(30~35℃)
碟号
时间
1
2
3
(应≤1CFU/平板)
24小时菌落数
结果:
符合□
不符合□
48小时菌落数
平均菌落数
检 验 结 果
无菌检查结果判断: □符合规定 □不符合规定
