人教版2020中考化学真题分类汇编 3 化学实验与探究 考点17 科学探究 3 物质成分的鉴别(无答案)
2021中考化学试题分类汇编:科学探究(含答案).docx
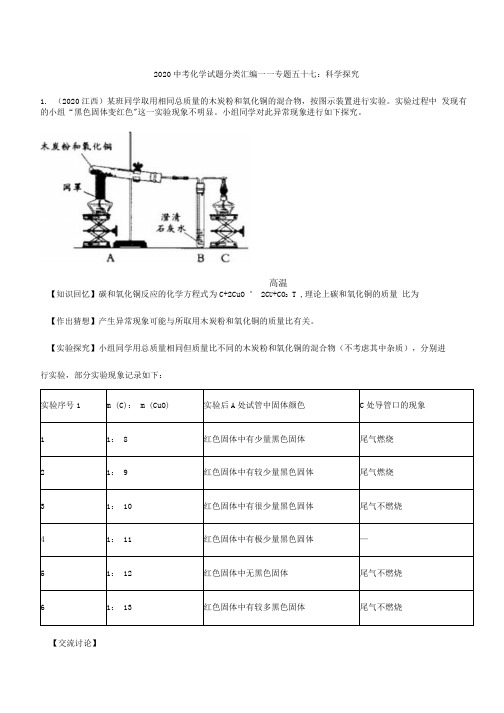
2020中考化学试题分类汇编一一专题五十七:科学探究1.(2020江西)某班同学取用相同总质量的木炭粉和氧化铜的混合物,按图示装置进行实验。
实验过程中发现有的小组“黑色固体变红色"这一实验现象不明显。
小组同学对此异常现象进行如下探究。
高温【知识回忆】碳和氧化铜反应的化学方程式为C+2CuO °2C U+CO2 T ,理论上碳和氧化铜的质量比为【作出猜想】产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
【实验探究】小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:【交流讨论】(1)推测实验4中“C处导管口的现象”是»(2)上述探究可得出,实验时所用木炭粉和氧化铜的质量比控制在1: 10~1: 12之间,可观察到黑色固体明显变红,同时还可减少(填化学式)排放,防止空气污染。
(3)检验实验6反应后A处试管中黑色固体物质,可滴加的试剂是,观察到的现象是 o【反思评价】分析发现,实验5中m (C): m (CuO)比值与理论值不符,实验后却无黑色固体残留。
请用化学方程式解释实验中过量的黑色固体消失的原因:(写一个即可)。
2.(2020绥化)某兴趣小组发现,上周做实验用的氢氧化钠固体忘记了盖瓶盖,他们欲对该固体的变质情况进行探究。
(提出问题)该瓶氢氧化钠固体是否变质,变质情况如何?(查阅资料)①碳酸钠溶液的pH最大约为10.6,饱和的碳酸氢钠溶液约为8.0,氯化钙溶液呈中性。
②NaOH、NazCOa分别在水和酒精中的溶解度如下表所示:(作出猜想)猜想I :固体未变质;猜想II:固体部分变质;猜想III:固体全部变质。
(实验探究)(1)兴趣小组同学取少量样品于烧杯中,加适量水溶解,测得溶液的pH约为12。
由此他们得出猜想I 正确,但其他同学很快予以否定,否定的理由是(2)组内其他同学取步骤(1)烧杯中少量溶液于试管中,加入过量的—溶液,振荡,有白色沉淀生成; 不再产生沉淀时,取上层清液于另一支试管中,滴加—,溶液变红。
(人教版)2020中考化学真题分类汇编 专题分类 科学探究(含解析)

专题分类:科学探究1.(2019 自贡)制取CO2后残留的废液收集在学校实验室的废液缸中。
某化学课外小组的同学想探究废液中溶质的成分,请我们共同参与探究并回答下列问题:(1)[查阅资料]CaCl2溶液呈中性。
(2)[提出问题]废液中的溶质是什么物质?(3)[作出猜想]猜想一:废液中的溶质只有CaCl2。
猜想二:废液中的溶质有CaCl2和HCl (填化学式)。
(4)【实验与结论】①甲同学取少量CaCl2溶液和废液分别加入到2支试管中,并向其中分别滴加无色酚酞溶液做对比实验,结果两试管中溶液均无色,于是甲同学认为猜想一是正的。
②你认为甲同学的实验不能(填“能”或“不能”)证明猜想是正确的,理由是含有盐酸的氯化钙溶液也不能使酚酞试液变色。
③如果要证明猜想一是正确的,你做对比实验时选择加入的试制是紫色石蕊试液,实验时装有废液的试管中可能观察到的现象是石蕊试液不变色,或石蕊试液变红色。
【解析】猜想一是废液中的溶质只有CaCl2,猜想二是废液中的溶质有CaCl2和HCl。
(4)甲同学的实验不能证明猜想是正确的,理由是含有盐酸的氯化钙溶液也不能使酚酞试液变色。
如果要证明猜想一是正确的,做对比实验时选择加入的试制可以是紫色石蕊试液,实验时,如果溶液中不含有盐酸,实验现象是石蕊试液不变色,如果溶液中含有盐酸,实验现象是石蕊试液变红色。
2.(2019重庆B 23)某未知气体X可能含有CO、CH4中的一种或两种,某同学设计实验进行探究。
查阅资料:(ⅰ)加热时,CH4能与CuO反应生成Cu、CO2和H2O;(ⅱ)20℃时,Ca(OH)2和Ba(OH)2溶解度分别为:0.165g,2.1g(1)仪器M的名称是酒精灯,CH4与CuO反应的化学方程式为CH4+4CuO4Cu+CO2+2H2O 。
(2)气体X成分的猜想与探究猜想1:只有CO 猜想2:只有CH4 猜想3:既有CO又有CH4①实验时,先往装置中通一段时间的N2,再通入气体X后加热,实验中有下列变化。
2020年中考人教版化学科学探究《质量守恒定律的实验探究》专题练习

科学探究《质量守恒定律的实验探究》1、某化学实验小组用如图所示实验探究质量守恒定律(1)甲同学利用图一实验验证质量守恒定律,在锥形瓶底铺一层细沙的目的;玻璃管的作用,气球的作用。
实验结果:白磷燃烧反应前后总质量(变大,变小,不变),(能,不能)成功验证质量守恒定律。
(2)乙同学用A实验验证质量守恒定律,结果生成物的质量比镁条的质量小,原因是,若在燃烧的镁条正上方罩上罩,使生成物全部收集起来,则生成物体质量比镁条质量(大,小,不变)(3)丙同学用BCD实验探究,能成功验证质量守恒定律的是实验,不能验证原因是,。
(4)结论:当有气体参加或生成的化学反应来验证质量守恒定律时,应在装置中进行,才能判断反应前后总质量是否相等。
2、在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如图所示。
请回答下列问题:(1)此实验能否不用气球,改为直接用橡皮塞使锥形瓶密封?且说明理由。
(2)实验中观察到气球先变大后变小,用理化知识解释产生此现象的原因是。
(3)该同学联想到以前测定氧气体积分数时也用到红磷,且当时红磷必须过量,请解释原因。
经过分析该同学认为上述探究质量守恒定律的实验中白磷也应过量,你认为她的观点正确吗?并加以解释。
(4)上述探究质量守恒定律的实验后,该同学为了验证锥形瓶内是否还有氧气剩余,用如下方法:打开瓶塞,用燃着的木条伸入锥形瓶,发现木条继续燃烧,说明瓶内还有少量氧气剩余。
请你评价其实验方法正确与否,并解释:。
3、某兴趣小组依据教材实验对质量守恒定律进行了如下探究。
根据如图回答问题:(1)甲组反应过程中气球的变化是,反应的化学方程式为。
(2)乙组反应后天平指针会向(“左”或“右”)偏转,原因是。
某同学将乙组烧杯换成甲组中的带气球的锥形瓶装置,药品不变重新反应后仍达不到实验效果,则造成误差的原因可能是干扰了实验结果;已知碳酸钠与盐酸反应与碳酸钙与盐酸反应原理相似,请试着写出该反应的化学方程式。
2020中考化学真题分类汇编 3考点16 常用的化学实验技能 3简单装置的选择(无答案)

常用的化学实验技能(18河南)23.(3分)下图是实验室制取气体的常用装置。
(1)写出一个用A装置制取O2的化学方程式。
(2)B和C装置均可制取CO2,与B相比较,C的主要优点是什么?(3)用试管采用排空气法收集H2 ,请在D处方框中画出装置图(只画试管和导气管)。
(18通辽)15. (6分)下图是实验室制取气体的有关装置图,据图回答下列间题:(1)实验室中用A来制取O2的化学反应方程式为;(2)实验室中常用大理石和稀盐酸来制取CO2,所有可选择的装置组合为;若要检验制得的气体是CO2,请用化学方程式表示出检验的原理:。
(3)小明同学在装置B中加入15%的过氧化氢溶液和Mn O2制取氧气。
①若用F装置收集O2,则O2应从_(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流,小红同学提出可以从两个方面改进:一是将制取装置B换为上图中的装置_;。
二是将过氧化氢溶液加水稀释,若把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为5%的溶液需加水的质量为_g。
(18乌鲁木齐)14.(7 分)根据下图所示实验装置回答问题:(1)标号为 a 的仪器名称是。
(2)实验室用氯酸钾制取较纯净的氧气,选择的发生装置和收集装置是① (填字母),反应的化学方程式是② 。
其中氯酸钾中氯元素的化合价是③ 。
若制得的氧气不纯净,其原因可能是④。
(3)实验室用锌粒和稀硫酸反应制取氢气,若用 G 装置收集氢气,气体应从① (填“m” 或“n”)处通入。
制取二氧化碳可选 B 作为发生装置。
如果把 B 中带单孔塞的导管换成 C,其优点是② (写1 点)。
(8黄冈)30、(3分)下图是实验室制取气体的发生装置和气体收集装置。
回答下列问题:(1)用装置B和E制取氧气,其反应的化学方程式是_____________________。
(2)现需要制取并收集一瓶氢气,在装置A、B、C、D、E中,应选择的装置组合是____________________。
2020年中考人教版化学科学探究《测定空气里氧气含量的探究》专题练习
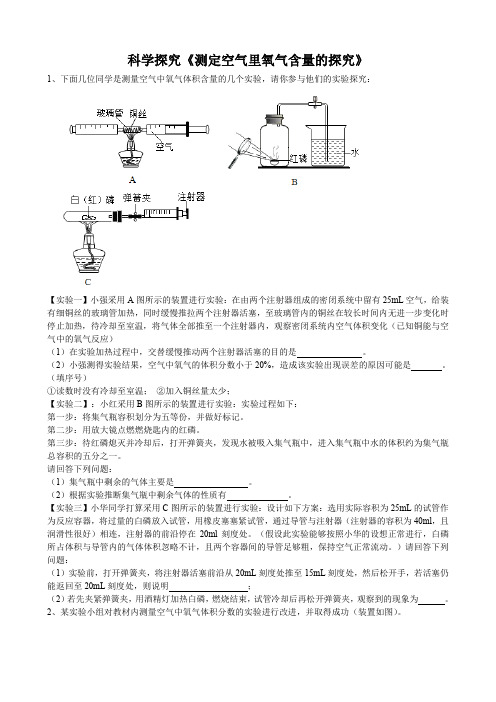
科学探究《测定空气里氧气含量的探究》1、下面几位同学是测量空气中氧气体积含量的几个实验,请你参与他们的实验探究:【实验一】小强采用A图所示的装置进行实验:在由两个注射器组成的密闭系统中留有25mL空气,给装有细铜丝的玻璃管加热,同时缓慢推拉两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化(已知铜能与空气中的氧气反应)(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是。
(2)小强测得实验结果,空气中氧气的体积分数小于20%,造成该实验出现误差的原因可能是。
(填序号)①读数时没有冷却至室温;②加入铜丝量太少;【实验二】:小红采用B图所示的装置进行实验:实验过程如下:第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:用放大镜点燃燃烧匙内的红磷。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的五分之一。
请回答下列问题:(1)集气瓶中剩余的气体主要是。
(2)根据实验推断集气瓶中剩余气体的性质有。
【实验三】小华同学打算采用C图所示的装置进行实验:设计如下方案:选用实际容积为25mL的试管作为反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与注射器(注射器的容积为40ml,且润滑性很好)相连,注射器的前沿停在20ml刻度处。
(假设此实验能够按照小华的设想正常进行,白磷所占体积与导管内的气体体积忽略不计,且两个容器间的导管足够粗,保持空气正常流动。
)请回答下列问题:(1)实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明;(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,试管冷却后再松开弹簧夹,观察到的现象为。
2、某实验小组对教材内测量空气中氧气体积分数的实验进行改进,并取得成功(装置如图)。
中考化学汇编化学实验与探究考点 科学探究定性和定量实验(1)

科学探究(18威海)16. (12分)某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
定性检验(1))要确定该产品中是否含有杂质氯化钠,你的方法是_________________。
定量测定(2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是(用化学疗程式表示)_______________________________。
(3)假设你取样的质量为m1,根据你确定的反应原理,你需要通过实验测量沉淀(填化学式)____的质量(假设你测得的沉淀的质量为m2)。
(4)请你设计实验方案,获得数据m1、m2,把方案填在下表中。
请用含m1、m2的式子表示所测样品中碳酸钠的质量分数。
______________________。
分析讨论(6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。
除沉淀法外,还可依据反应(用化学方程式表示)_______________来测定该纯碱样品中碳酸钠的质量分数。
(18温州)29.海螵蛸是一味中药,其主要成分是碳酸钙,某同学利用如图装置测定其中碳酸钙的含量。
①在锥形瓶中加入质盘为m的海螵蛸粉末,向分液漏斗中加入稀盐酸。
在烧杯中加人足量氢氧化钠溶液,并称量烧杯及氢氧化钠溶液总质量m1②先打开止水夹,再打开分液深斗活塞,滴加盐酸并及时关闭活塞。
完全反应后,再次称量烧杯及其中液体的总质量m2.③利用m2与m1的差值,即反应生成的二氧化碳质量,再计算海螵蛸中碳酸钙的含量。
(1)海螵蛸具有治疗胃酸过多、能为骨质发育提供重要元素的功效,其原因是___________。
(2)实验前要检查装置的气密性,方法是:用止水夹夹住橡胶管,往分液漏斗中加入适量水。
打开分液漏斗的活塞.观察到_______,说明装置气密性良好。
(3)下列情况会导致海螵蛸中碳酸钙质量分数测量值偏小的是______(可多选)。
A.海螵蛸中滴加盐酸过量B,锥形瓶内部分水蒸气随二氧化碳逸出C.反应结束后,锥形瓶内有二氧化碳残留D.反应速度过快,大量气泡从氢氧化钠溶液中溢出(18泰安)25、(8分)某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2(Na2SO3+H2SO4(浓)==Na2SO4+SO2↑+H2O]。
中考化学总复习第1篇考点聚焦模块五科学探究第17讲物质的检验与鉴别

D CuSO4溶液
质
第九页,共二十六页。
【解答】盐酸(yán suān)和氯化镁的混合液中加入氢氧化钠溶液,则盐酸和氢氧化钠先反应。
A.加入锌粉有气泡产生,说明含有盐酸,则氯化镁没有参加反应,故一定含有氯化镁,
正确;
B.加入氧化铜粉末没有现象,说明不含有盐酸,则一定有生成的氯化钠,若是氢氧化 钠与氯化镁恰好反应,则不含有氯化镁,只含有氯化钠,错误;
向固体中加入(jiārù)过量稀盐酸时,无气泡产生(或在步骤Ⅰ中未观察到有气泡产生)
第十八页,共二十六页。
Na2SO4+Ba(NO3)2===2NaNO3+BaSO4↓
(3)步骤Ⅱ中产生白色沉淀的化学方程式是__________硝__酸__(x_i_ā_o_s_u_ān_)_、__硝__酸__(。xiāo suān)钠、硝酸(xiāo s
第十五页,共二十六页。
【例5】(2015,巴中)某校举行了一次化学实验技能比赛,某参赛同学抽到的题目是:现
有A、B、C、D四瓶无色溶液,它们分别是盐酸、氯化钙溶液、氢氧化钾溶液、碳酸钠溶液中的一种
,要求不使用任何试剂将它们鉴别出来。该同学采用(cǎiyòng)两两相互反应方法进行实验,其相互
反应实验现象如下表:(“↑”表示气体,“↓”表示沉淀,“-”表示无明显现象)。
比较人体吸入的空气和呼出 将燃着的木条分别插入空气
A
气体中氧气的含量
样品和呼出气体的样品中
BHale Waihona Puke 鉴别CO和CO2分别通过灼热的CuO
用玻璃棒分别蘸取酒精和水
验证燃烧的条件之一是温度
C
,放在酒精灯火焰上加热片
要达到可燃物的着火点
刻
D 除去CaCl2溶液中少量的盐 加入过量的碳酸钙,待没有
2020中考化学复习《实验探究与设计》专项测试试题(含答案)

17.将一个装有饱和石灰水的试管放入盛有25℃饱和石灰水的广口瓶中,如图所示。向试管中逐渐加入氧化钙粉末。
(1)可以观察到的现象是试管中____________________;广口瓶中________________;导管中________________。
①过氧化钠属于氧化物②该反应属于置换反应③反应前后部分氧元素化合价发生了变化④实验室可利用这一原理制取纯净的氧气。
A.①③④B.①③C.①④D.①②③
12.碳酸镁晶须(MgCO3•nH2O,n=1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。为测定碳酸镁晶须中n的值,某化学小组设计了如图装置并进行实验。
D.分别滴几滴在玻璃片上,烘干,观察玻璃片表面是否残留白色固体
5.下列图象分别与选项中的操作相对应,其中合理的是( )
A. 等质量的红磷和氧气在点燃条件下充分反应
B. 向等质量、等浓度的稀盐酸中分别加入足量的金属锌和铁
C. 一定温度时,向一定量的饱和石灰水中加入熟石灰
D. 向一定量稀硫酸中加入水
6.氧气是一种比较活泼的气体,许多物质都能与氧气发生反应。下列物质在足量氧气中燃烧的产物正确的是
B.打开浓盐酸的瓶塞会看到白烟,而打开浓硫酸瓶塞无明显现象
C.硫粉在氧气中燃烧产生蓝紫色火焰
D.在氯化铜溶液中加入锡片,析出红色固体铜单质
11.过氧化钠(Na2O2)能与二氧化碳反应生成氧气,可作为呼吸面具中氧气的来源。潜水艇遇到紧急情况时,也使用过氧化钠来供氧,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。以下从该反应获取的信息中,正确的是
②装置D的作用是防止空气中的水蒸气和二氧化碳进入装置C中,减小实验误差;
2020年中考人教版化学科学探究《药品是否变质的探究》专题练习

科学探究《药品是否变质的探究》1、某化学兴趣小组的同学发现,上个月做实验用的NaOH溶液忘记盖瓶盖。
对于该溶液是否变质,甲、乙两同学分别进行了如下实验探究:【提出猜想】该溶液是否变质,溶液中溶质是什么?【猜想假设】猜想1:该溶液没有变质,溶液中溶质只有NaOH;猜想2:该溶液部分变质,溶液中溶质有NaOH和Na2CO3;猜想3:该溶液全部变质,溶液中溶质只有。
【查阅资料】Na2CO3溶液显碱性,能使无色酚酞溶液变红。
【实验探究】(1)甲同学取样滴加无色酚酞溶液,溶液呈红色,得出结论:猜想3错误。
乙同学认为甲同学的结论不正确,理由是。
(2)乙同学另取样滴加稀盐酸,有产生,发生反应的化学方程式为:,乙同学得出结论:该溶液中含碳酸钠。
【实验启示】氢氧化钠溶液露置在空气中会发生变质的化学方程式为:。
2、一瓶长时间放置NaOH固体,某学习小组对其变质的情况进行实验探究。
(1)对其是否变质作出三个猜想(填化学式):猜想1:没有变质,即全部是;猜想2:部分变质,即既有,又有;猜想3:全部变质,即全部是;(2)小红取部分样品于试管中,加水溶解,再滴加无色酚酞,发现溶液变红色,她认为NaOH样品没有变质。
你(同意、不同意)小红的结论,理由是。
(3)为探究该样品是否变质,小组同学设计了如下实验方案,请你一起探究:取部分样品于试管中,加水溶解,再滴加稀盐酸,①若无气泡产生,则说明该样品(已经变质、没有变质);②若有产生,则说明该样品已经变质;有关反应的化学方程式为:。
溶液?为什么?。
223、实验室有一瓶长期放置的氢氧化钠固体,某化学兴趣小组的同学对该固体的变质情况选行探究。
【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?【查阅料】①氢氧化钠在空气中容易变质但不会转化为 NaHCO3;②CaCl2溶液呈中性。
【提出猜想】猜想Ⅰ:固体未变质;猜想Ⅱ;固体部分变质;以上猜想是否严谨,并说明理由。
【进行实验】小丽同学取少量样品于烧杯中,加足量水溶解,再向溶液中滴入几滴酚酞溶液,溶液变红,由此她得出猜想Ⅰ正确,但其他同学很快予以否定,理由是。
2020届中考化学总复习科学探究能力《质量守恒定律的实验探究》测试试题(word版有答案)
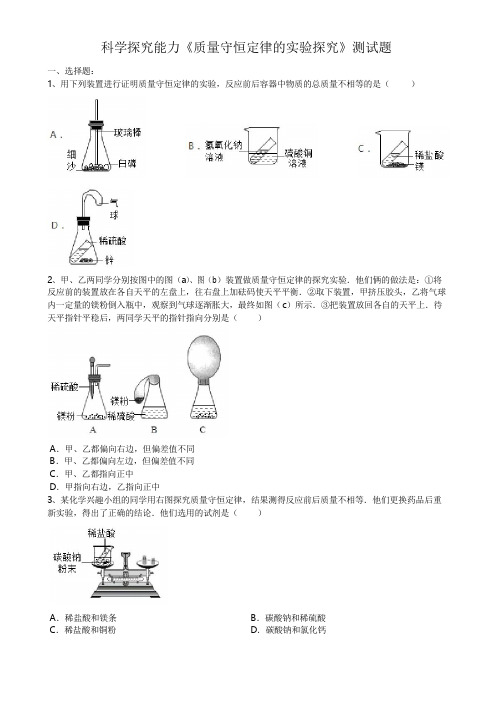
科学探究能力《质量守恒定律的实验探究》测试题一、选择题:1、用下列装置进行证明质量守恒定律的实验,反应前后容器中物质的总质量不相等的是()2、甲、乙两同学分别按图中的图(a)、图(b)装置做质量守恒定律的探究实验.他们俩的做法是:①将反应前的装置放在各自天平的左盘上,往右盘上加砝码使天平平衡.②取下装置,甲挤压胶头,乙将气球内一定量的镁粉倒入瓶中,观察到气球逐渐胀大,最终如图(c)所示.③把装置放回各自的天平上.待天平指针平稳后,两同学天平的指针指向分别是()A.甲、乙都偏向右边,但偏差值不同B.甲、乙都偏向左边,但偏差值不同C.甲、乙都指向正中D.甲指向右边,乙指向正中3、某化学兴趣小组的同学用右图探究质量守恒定律,结果测得反应前后质量不相等.他们更换药品后重新实验,得出了正确的结论.他们选用的试剂是()A.稀盐酸和镁条C.稀盐酸和铜粉B.碳酸钠和稀硫酸D.碳酸钠和氯化钙4、某同学将蜡烛燃烧后的蜡油收集起来,发现质量变小。
下列说法中,正确的是()A.蜡烛减少的质量一定等于生成物的质量B.要分析此现象,必须考虑所有的反应物和生成物C.燃烧后各生成物的质量一定等于燃烧前蜡烛的质量D.蜡烛燃烧后质量变小,说明蜡烛燃烧时质量不再守恒5、下列涉及学科观点的有关说法正确的是()A.守恒观:化学反应前后分子个数一定不变B.微粒观:水是由氢原子和氧原子构成的C.转化观:氧气和水在一定条件下可相互转化D.结构观:氯原子和氯离子的核外电子数不同,属于不同种元素6、实验室使用一定质量的高锰酸钾加热分解制氧气,各物理量随加热时间变化的图象正确的是()7、在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图所示,下列说法中正确的是()A.x=2.6gB.丙一定为该反应的催化剂C.反应中生成乙和丁的质量比为5:11D.甲为该反应的生成物8、将A,B,C三种物质各8g混合,一定条件下充分反应后测得混合物中有6g A,13.5g C和一定质量的D,B完全反应若A、B、C、D的相对分子质量之比为8:16:22:9,则该反应物的化学方程式可表示为()A.A+2B=C+2D B.2A+B=2C+D C.A+2B=2C+D D.A+B=C+2D9、下列情况中,能实现“1+1=2”这一结果的是()A.1毫升酒精加1毫升水得到2毫升酒精的水溶液B.1克硫粉加1克氧气完全反应得到2克二氧化硫C.1克氢氧化钙加1克水充分溶解后得到2克氢氧化钙溶液D.1克氯化钡溶液加1克硫酸溶液充分反应后得到2克混合溶液10、金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B A2B,某校甲、乙、丙三位同学分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是10.0g。
2020-2021中考化学专题训练---探究题的综合题分类含答案

一、中考初中化学科学探究题1.化学课堂上,老师做了如图一的实验(网罩的作用是集中火焰,提高温度)。
(1)随着不断加热,试管①里逐渐有红色固体产生,化学方程式为C+2CuO=2Cu+CO2↑,该反应的基本反应类型属于______________。
同时试管②里的现象是___________________________,化学方程式为_____________________________ 。
(2)小明发现通入试管②里的气体有逸出液面的现象,怀疑试管①里还有其它气体生成,比如一氧化碳。
老师首先赞扬小明有科学的质疑精神,建议在化学兴趣小组的活动中展开探究。
请你也参与其中,一起探究。
(提出问题)碳还原氧化铜的反应还有一氧化碳生成吗?(猜想与假设)猜想一:没有一氧化碳生成;猜想二:还有一氧化碳生成(设计方案)在老师的帮助下,小明设计出如图二实验。
为了提高实验效果,小明加大了反应物的用量。
老师提示:先将两个开关都打开,再加热,反复挤压气球一会儿。
老师这样提示的目的是___________________________________。
(进行实验)实验操作实验现象实验结论先按老师的提示操作,加热一会儿后,关闭开关2。
待充分反应,关闭开关1,停止加热。
______________________逸出液面的气体不是二氧化碳__________________________________逸出液面的气体是一氧化碳。
猜想二成立(交流与提高)同学们通过对以上实验的讨论与分析,认为一氧化碳的产生至少源自两个反应:一是试管内反应物直接反应生成;二是生成物又发生反应而生成。
请你写出其中一个化学方程式___________________________________。
实验中生成的二氧化碳被氢氧化钠浓溶液吸收没有明显现象,同学们想进一步检验该反应的生成物,可选用的药品有________(填序号)。
①酚酞溶液②氢氧化钙溶液③稀盐酸④锌粒⑤氯化钙溶液(评价与反思)经过本次活动,同学们感到,正是因为小明具有___________ 精神,我们这次活动才有了更多、更新的收获。
2020年全国中考化学试题分类(17)——化学实验探究

2020年全国中考化学试题分类(17)——化学实验探究一.物质除杂或净化的探究(共12小题)1.(2020•淄博)除去下列物质中的杂质,选用试剂和方法均正确的是()选项物质杂质(少量)试剂和方法A氯化钾氯酸钾加入少量二氧化锰粉末,加热B稀硫酸稀盐酸加入适量的氯化钡溶液,过滤C氯化钙溶液氢氧化钙加入稍微过量的稀盐酸,蒸发D硝酸钾溶液硫酸钾加入过量的硝酸钡溶液,过滤A.A B.B C.C D.D2.(2020•百色)除去下列物质中的少量杂质,所选试剂及操作方法均正确的是()选项物质(括号内为杂质)除杂方法及操作A CO2(CO)在空气中点燃B N2(O2)通过灼热的铜网C Cu(NO3)2溶液(FeCl2)加足量的铜粉、过滤D KCl溶液(CaCl2)加入足量的碳酸钠溶液,过滤A.A B.B C.C D.D3.(2020•鞍山)除去下列物质中的少量杂质,所用操作方法正确的是()选项物质所含杂质操作方法A H2水蒸气通过足量的氢氧化钠溶液B铁粉木炭粉加入适量的稀硫酸、过滤C CaCl2溶液稀盐酸加入过量的石灰石、过滤D CaCO3CaO高温煅烧A.A B.B C.C D.D4.(2020•兴安盟)除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是()A.N2(O2)﹣﹣通过灼热的铜网B.NaCl(泥沙)﹣﹣溶解、过滤、蒸发结晶C.木炭粉(CuO)﹣﹣在空气中灼烧D.CO(CO2)﹣﹣通过足量的NaOH溶液,干燥5.(2020•宜宾)下列实验操作不能达到实验目的的是()选项实验目的实验操作A除去FeSO4溶液中少量的CuSO4加入过量锌粉,充分反应后过滤B除去KCl固体中少量的MnO2加水溶解,过滤,将滤液蒸发结晶C除去铜粉中少量的镁粉加入足量稀盐酸,充分反应后,过滤、洗涤、干燥D除去N2中少量的O2将气体缓缓通过灼热的铜网A.A B.B C.C D.D6.(2020•湖北)下表有关物质的除杂方法中,不正确的是()选项括号内的物质是杂质除杂方法A O2(水蒸气)将气体通过浓H2SO4B CO2(O2)将气体通过灼热的铜网C NaCl溶液(MgCl2溶液)加入适量的NaOH溶液、过滤D稀盐酸(稀硫酸)加入适量的Ba(NO3)2溶液、过滤A.A B.B C.C D.D7.(2020•威海)下列除去物质中杂质(括号内为杂质)的方法,不正确的是()选项物质(杂质)除杂方法A CuO(Cu)将物质在空气中加热B MnO2(NaCl)将物质加水溶解,过滤,洗涤,干燥C CO(CO2)将混合气体依次通过足量的氢氧化钠溶液和浓硫酸D NaCl(Na2CO3)将物质溶解后,加适量石灰水,过滤,蒸发结晶A.A B.B C.C D.D8.(2020•青海)除去下列物质中的杂质,所选方法正确的是()A.除去CO2气体中混有少量的CO,让气体通过氢氧化钠溶液B.除去FeCl2溶液中混有少量的CuCl2,加入过量的铁粉、过滤C.除去NaCl溶液中混有少量的Na2CO3,加入适量稀硫酸、蒸发结晶D.除去BaCl2固体中混有少量的KCl,加水溶解、过滤9.(2020•哈尔滨)除去下列物质中的少量杂质。
2020届中考化学复习《实验探究与设计》专项测试试题(含答案)

《实验探究与设计》专项测试题一、单选题(每小题只有一个正确答案)1.一元硬币的外观有银白的金属光泽,一些同学认为它可能是铁制成的.在讨论时,有同学提出:“我们可以先拿磁铁来吸一下”.就“拿磁铁来吸一下”这一过程而言,属于科学探究中的()A.实验法B.比较法C.观察法D.分类法2.下列实验能达到实验目的是()A.探究燃烧条件B.测定空气中氧气含量C.探究分子运动D.验证质量守恒定律3.下列实验操作或现象正确的是(部分夹持固定装置已略去)()A.铁在O2中燃烧B.加热KMnO4制O2C.电解H2O实验D.过滤4.为确定Cu2(OH)2CO3、CuO、Cu混合粉末中各组分的质量分数,化学兴趣小组进行下面两个步骤的实验,每个步骤中均准确称量反应前后装置内固体的质量,已知:Cu2(OH)2CO3受热分解为CuO、CO2和H2O,实验中操作无误,所有反应均充分进行。
下列说法中不正确的是A.根据步骤一反应前后的固体质量,可求得样品中Cu2(OH)2CO3的质量分数B.若步骤二反应后的固体中含有少量水,则测得样品中Cu的质量分数会偏小C.若步骤二中将H2换为O2,也能达到实验目的D.若步骤二改为将步骤一所得固体放入足量稀硫酸中充分反应后,进行过滤、洗涤、干燥,也能达到实验目的5.下列实验现象描述正确的是( )A.向氢氧化钠溶液中滴加氯化铁溶液:无色溶液中产生白色沉淀B.甲烷在空气中燃烧:无色气体燃烧,放热,产生淡蓝色火焰C.涤纶和羊毛燃烧:都可闻到一股烧毛发的焦糊味D.木炭还原氧化铜:黑色固体中有紫红色固体生成6.为了探究酸碱中和反应是否放热,某同学设计了如图所示的实验装置(夹持等固定装置图略),针对该实验目的,下列评价或改进,错误的是A.若观察到红墨水向右移,则说明该实验一定有放热现象B.为了使实验现象更明显,可改用氢氧化钠固体C.在打开活塞a之前应先打开橡皮管上的止水夹D.为了使实验更具有说服力,可用氢氧化钾溶液再次实验7.下列家庭小实验不能成功的是A.用柠檬酸和小苏打制汽水 B.用蜡烛和小瓷碟制取少量炭黑C.用鸡蛋壳和食醋制取二氧化碳 D.用食盐水除铁锈8.如图所示,在小烧杯乙和丙中分别放入不同的物质后,立即用大烧杯甲罩住小烧杯乙和丙。
2024年中考化学考点分类训练科学探究题

2024年中考化学考点分类训练:科学探究题1.胃酸过多会引起不适,不同病症需要服用不同的抗酸药。
实验小组同学对抗酸药选择进行探究。
【查阅资料】1.抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为1~2片(约0.5g~1g)2.氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
3.胃蛋白酶是胃中唯一的消化性蛋白酶,当pH为3~5时活性较好,当pH超过6时,因变性而失去活性。
4.理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】I.是否引起胃内压强的变化锥形瓶中模拟胃酸过多的环境。
将气球中的抗酸药加入锥形瓶中。
装置及药品序号抗酸药现象1-1氢氧化铝片气球无明显变化1-2碳酸氢钠片气球明显膨胀1-3铝碳酸镁咀嚼片气球无明显变化1-4氧化镁粉末气球无明显变化Ⅱ.是否引起胃内温度和pH的变化利用图1进行实验。
向4个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加0.37%的足量稀盐酸。
传感器测得的相关结果见图2、3、4。
【解释与结论】(1)Ⅱ中,1-1发生反应的化学方程式为 。
(2)药品用量在1~2片内,针对“严重胃溃疡患者”不建议选用的抗酸药是 ,理由是 。
(3)下列关于氧化镁粉末、氢氧化铝片分别与盐酸反应的叙述正确的是______(填标号)。
A .氧化镁粉末的反应会引起温度上升 B .反应后溶液均显碱性 C .氢氧化铝片的反应更快D .均有水生成(4)由上述实验可知,铝碳酸镁咀嚼片的优势有 。
【反思与评价】(5)查阅资料发现Ⅱ中实验1-3无明显现象是与物质的用量有关。
小明同学设计实验证明了铝碳酸镁咀嚼片中含有碳酸根离子,实验操作和现象:取6片铝碳酸镁咀嚼片于试管中, 。
2.碳酸钠和碳酸氢钠是初中化学教材中出现的两种常见的盐,同时也是日常生活中有重要应用的物质,下面是阳阳小组进行的研究性学习过程,请你参与并回答相关问题。
[查阅资料](1)相同条件下,23Na CO 溶液比3NaHCO 溶液的碱性强; (2)20Ⅱ时,23Na CO 、3NaHCO 的溶解度分别为21.3g 和9.6g ;(3)3NaHCO 在270Ⅱ时能发生反应:323222NaHCO Na CO CO H O +↑+△,23Na CO 受热不易分解;(4)()32Ca HCO 易溶于水。
【人教版】2020中考化学真题分类汇编 3 化学实验与探究 考点17 科学探究 实验意外情况探究(无答案)

劳动合同:湖南矿山井下行业劳动合同范本(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典合同,如建筑合同、房屋合同、劳动合同、买卖合同、服务合同、贸易合同、金融合同、施工合同、装修合同、其他合同等等,想了解不同合同格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this store provides you with various types of classic contracts, such as construction contracts, housing contracts, labor contracts, sales contracts, service contracts, trade contracts, financial contracts, construction contracts, decoration contracts, and other contracts. If you want to know different contract formats and writing methods, please pay attention!劳动合同:湖南矿山井下行业劳动合同范本劳动合同除了具有合同的共同特征外,还有自己独有的下列特征:(1)劳动合同主体具有特定性。
2020年中考人教版化学科学探究《探究金属锈蚀的条件》专题练习
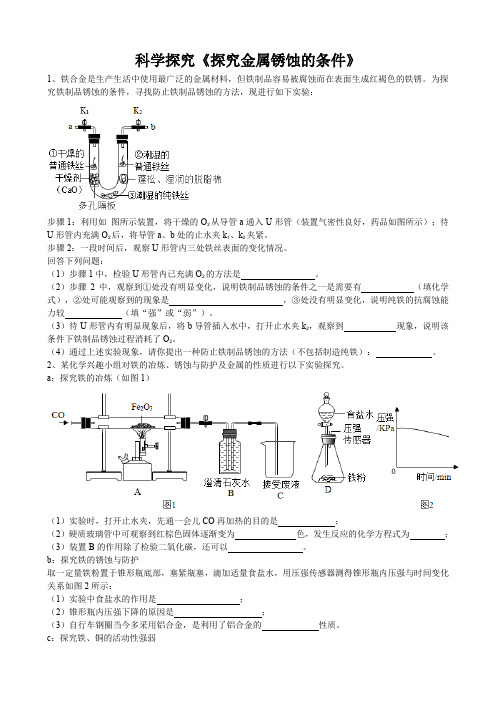
科学探究《探究金属锈蚀的条件》1、铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。
为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:步骤1:利用如图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:(1)步骤1中,检验U形管内已充满O2的方法是。
(2)步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有(填化学式),②处可能观察到的现象是,③处没有明显变化,说明纯铁的抗腐蚀能力较(填“强”或“弱”)。
(3)待U形管内有明显现象后,将b导管插入水中,打开止水夹k2,观察到现象,说明该条件下铁制品锈蚀过程消耗了O2。
(4)通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁):。
2、某化学兴趣小组对铁的冶炼、锈蚀与防护及金属的性质进行以下实验探究。
a:探究铁的冶炼(如图1)(1)实验时,打开止水夹,先通一会儿CO再加热的目的是;(2)硬质玻璃管中可观察到红棕色固体逐渐变为色,发生反应的化学方程式为;(3)装置B的作用除了检验二氧化碳,还可以。
b:探究铁的锈蚀与防护取一定量铁粉置于锥形瓶底部,塞紧瓶塞,滴加适量食盐水,用压强传感器测得锥形瓶内压强与时间变化关系如图2所示:(1)实验中食盐水的作用是;(2)锥形瓶内压强下降的原因是;(3)自行车钢圈当今多采用铝合金,是利用了铝合金的性质。
c:探究铁、铜的活动性强弱将形状、大小相同的铁、铜分别放入装有等质量等浓度的X溶液的2支试管中,通过观察现象即能得出实验结论。
则X溶液可能是。
A.稀硫酸 B.硫酸铜溶液 C.硫酸锌溶液3、久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3],某化学兴趣小组对铜生锈的条件进行了以下探究。
2020年中考人教版化学科学探究《实验探究物质变化的条件和影响物质变化的因素》专题练习

科学探究《实验探究物质变化的条件和影响物质变化的因素》1、某校兴趣小组同学用图1装置进行实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
(1)观察到“烧杯中饱和石灰水先变浑浊后逐渐澄清”一现象进行探究。
【提出假设】假设1:挥发出的HCl使浑浊变澄清假设2:。
【设计实验】为除去CO2中的HCl.小明在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→→→乙(填字母序号);其中存放的试剂合理是(填选项序号)。
A.NaOH溶液B.浓硫酸C.饱和NaHCO3溶液D.饱和Na2CO3溶液【实验现象】饱和石灰水浑浊后,继续通入足量CO2,浊液逐渐变澄清【得出结论]由以上探究可得出结论是上面假设成立,用化学方程式解释。
(2)该兴趣小组在老师指导下,用pH传感器测得图1烧杯中溶液的pH随通入时间的变化曲线如图。
①AB段pH值不变的可能原因是;②BC段发生的化学方程式主要有;③D点所得溶液的成分除H2O外还有。
2、学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。
甲组同学进行图1所示的实验,却未观察到预期现象。
【提出问题】未观察到浑浊的原因是什么?【猜想和假设】①与氢氧化钙溶液的浓度有关。
若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。
若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。
经讨论,同学们认为猜想①不合理,其理由是。
【进行实验】乙组同学针对猜想②进行实验。
【解释与结论】(1)补全上述实验操作“……”部分:取4支试管,向其中分别加入2mL,浓度为10%,5%,1%,0.5%的碳酸钠溶液,再分别滴加。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是。
(3)乙组实验证明:猜想②(填“成立”或“不成立”)。
理由是。
【实验反思】(4)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。
设计了多组实验,其中部分同学的实验过程及结果如图2:丙组同学的实验结论是。
2020年中考人教版化学科学探究《影响化学反应速率的因素探究》专题练习
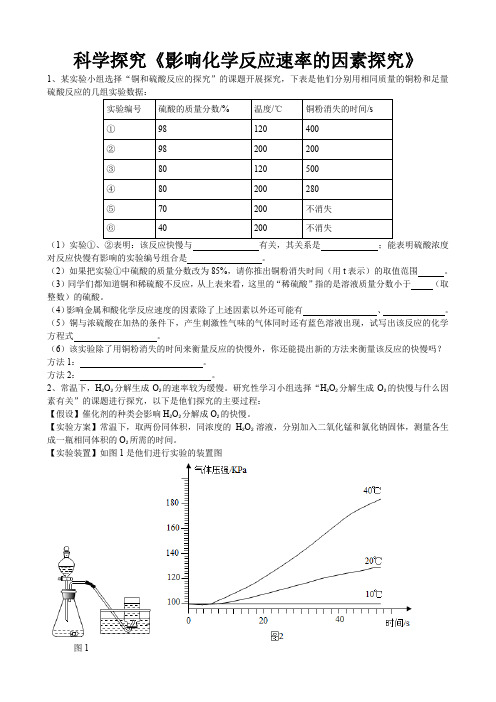
科学探究《影响化学反应速率的因素探究》1、某实验小组选择“铜和硫酸反应的探究”的课题开展探究,下表是他们分别用相同质量的铜粉和足量硫酸反应的几组实验数据:(1)实验①、②表明:该反应快慢与有关,其关系是;能表明硫酸浓度对反应快慢有影响的实验编号组合是。
(2)如果把实验①中硫酸的质量分数改为85%,请你推出铜粉消失时间(用t表示)的取值范围。
(3)同学们都知道铜和稀硫酸不反应,从上表来看,这里的“稀硫酸”指的是溶液质量分数小于(取整数)的硫酸。
(4)影响金属和酸化学反应速度的因素除了上述因素以外还可能有、。
(5)铜与浓硫酸在加热的条件下,产生刺激性气味的气体同时还有蓝色溶液出现,试写出该反应的化学方程式。
(6)该实验除了用铜粉消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?方法1:。
方法2:。
2、常温下,H2O2分解生成O2的速率较为缓慢。
研究性学习小组选择“H2O2分解生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】催化剂的种类会影响H2O2分解成O2的快慢。
【实验方案】常温下,取两份同体积,同浓度的H2O2溶液,分别加入二氧化锰和氯化钠固体,测量各生成一瓶相同体积的O2所需的时间。
【实验装置】如图1是他们进行实验的装置图图1【实验操作】检查装置气密性良好,将分液漏斗中的液体加入锥形瓶中,立即收集一瓶气体。
实验记录如下表:【分析】实验室用H2O2溶液制取氧气的化学方程式为,实验①中加入氯化钠固体的质量a的值为。
【结论】该探究过程得出的结论是。
【反思】若要证明二氧化锰、氯化钠固体是该反应的催化剂,还需要验证它们在化学反应前后的和是否改变。
准确地比较化学反应速度的快慢除了上述方法外,还可以通过测定。
【交流讨论】(1)使用压强传感器等设备,检测不同温度下过氧化氢分解时气体压强的变化。
经过实验、数据处理等,获得如图2所示的压强-时间的曲线变化图。
由此得到的信息是。
2020届中考化学第一轮科学探究能力《实验探究物质变化的条件和影响物质变化的因素》测试题(word版有答案)

科学探究能力《实验探究物质变化的条件和影响物质变化的因素》测试题一、选择题:1、比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素(括号内为影响化学反应的因素),其中推理不合理的是()A.铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧(反应物浓度)B.碳在常温下不与氧气反应,而在点燃时能与氧气反应(反应温度)C.粗树干在空气中很难燃烧,而细树枝在空气中较易燃烧(反应物的种类)D.双氧水在常温下较难分解,而在加入二氧化锰后迅速分解(催化剂)2A.A、B.B、C.C、D.D、3A、4A.A、B.B、C.C、D.D、5、比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中不合理的是()A.A、B.B、C.C、D.D、6A.A、B.B、C.C、D.D、7、比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推A.A、B.B、C.C、D.D、8A.A、B.B、C.C、D.D、二、填空题:1、为探究碳还原氧化铜的最佳实验条件,取木炭粉和氧化铜的干燥混合物1-2.5g用如图所示装置进行实验。
(1)木炭还原氧化铜的化学方程式为。
实验过程中A装置中试管内产生的现象是。
(2)酒精灯火焰加金属网罩的目的是。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:CuO+H2SO4═CuSO4+H2O+Cu【进行试验】取一定量的混合物,用上图所示装置进行实验。
序号木炭粉与氧化铜的质量比反应后物质的颜色、状态1 1:9红色固体有金属光泽混有少量黑色物质2 1:10 混有很少量黑色物质3 1:11 混有极少量黑色物质4 1:12 无黑色物质5 1:13 混有较多黑色物质【结论与解释】(3)由上述实验可以得到的结论是,条件最佳。
【反思与评价】(4)为了检验生成的红色固体中是否含有Cu2O,所需试剂是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
科学探究(18葫芦岛)25.同学们用大理石和稀盐酸制取二氧化碳后,小欣同学发现容器内液体是浑浊的,她很好奇,浑浊液体是什么?于是她和同学们一起将浑浊的液体过滤,得到滤液和固体,并对此展开了探究(溶解于水中的气体成分忽略不计)【提出问题】滤液中的溶质以及过滤得到的固体的成分是什么?【查阅资料】①大理石中含有SiO2(不溶于水,且不与盐酸反应),可能含有少量的Fe2O3等。
②FeCl3溶液遇到硫氰化钾(KSCN)溶液能够很灵敏显现出红色。
【猜想验证】Ⅰ经讨论,大家认为滤液中一定含有CaCl2,原因是(用化学方程式表示)Ⅱ小欣同学根据资料中大理石的成分,猜想滤液中可能含有少量。
她取少量滤液于试管中,滴加硫氰化钾(KSCN)溶液,观察到滤液颜色无变化,由此得出的结论是。
Ⅲ小雨又提出猜想,滤液中还可能含有(填化学式)。
请你和小雨一起验证他的猜想。
(18云南)27.(6分)某白色固体可能由BaC12、NaOH、Na2CO3、Na2SO4;中的一种或几种物质组成,某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答相关问题。
I.初步探究:小金同学设计的实验过程及现象如下图所示。
【查阅资料】BaC12溶液显中性。
【初步结沦】(1)原白色固体中一定有的物质是,一定没有的物质是。
(2)M溶液中的溶质一定有,一定没有氯化钡。
【交流讨论】小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。
若要进一步确定,需对溶液M继续进行探究。
为此同学们进行了如下的探究:Ⅱ.继续探究:【提出问题】无色溶液M中有氢氧化钠吗?【猜想与假设】猜想一:有NaOH猜想二:没有NaOH【探究与结论】(18烟台)22.(9分)图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。
实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:(1)在图一所示的实验中,试管②中发生反应的化学方程式是。
(2)甲烧杯中的物质完全反应后,发现红色固体物质明显增多。
下列说法正确的是(填序号)A.试管②反应后的固体中一定不含铁B.完全反应后,甲烧杯中的固体一定含有铁C.完全反应后,甲烧杯的溶液中可能含有Cu2+D.完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+(3)乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。
则试管④反应后的溶液中的溶质共有哪些(写化学式)。
(4)将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:实验操作实验现象实验结论步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液,有白色沉淀生成①生成的白色沉淀是(写化学式,下同)②滤液中的溶质共有哪些步骤2:静置,向上层清夜中滴加无色酚酞试液溶液变红(5)在上述(4)的实验探究中,步骤1中加入足量硝酸钡溶液的目的是。
(18通辽)16. (6分)将一定量的K2CO3溶液与BaCI2溶液混合,过滤反应后的混合物。
某兴趣小组的同学们欲探究滤液中溶质的组成。
请你一同参与探究并回答有关问题:【查阅资料】K2C03溶液显碱性;BaCI2、 KCI溶液显中性。
【提出猜想】猜想1:滤液溶质是KCl;猜想2:滤液溶质是_;猜想3:滤液溶质是KCl和K2CO3。
【实验探究】【问题讨论】小丽同学认为要证明猜想2成立也可改用AgN03溶液,你认为小丽同学(填“能”或“不能”)达到实验目的。
【反思拓展】实验结束后,组内同学认为K2CO3是盐而其水榕液却显碱性,这可能与它的构成微粒有关,微粒符号是。
(18包头)10.(4分)内探究CuO和稀硫酸反座后溶液中溶质的成分,同学们设计了实验、歩驟如下:(1)取少量CuO粉末于试管中,滴加稀硫酸,粉末全部溶解,得到溶液A。
(2)向歩驟(1)的試管中滴加BaCl2溶液,有白色況淀生成。
得出结论:A中溶质只有CuSO4。
有同学认为该结论不合理,继续迸行实验。
(3)向歩驟(2)的武管中滴加NaOH溶液,产生沉淀质量随加入NaOH溶液貭量的変化关系如右图。
回答下列问题:①A中的溶质有_____(填化学式),b~c之间的沉淀是___________。
②c点对应溶液中溶质的可能组成有_________(填化学式)。
③由以上实验总结出:在分析化学反应后溶液中溶质的成分时,除了考虑生成物外,还需要考虑____________。
(18桂林)29、(11分)实验课上,同学们发现一瓶久置空气中的氧化钙固体的瓶口有白色粉末。
在老师指导下,同学们对该白色粉末的成分进行了讨论。
【猜想与假设】猜想I:白色粉末是碳酸钠猜想II:白色粉末是氢氧化钠猜想白色粉末是_____________________III:【查阅资料】CaCl2溶液,Ca(NO3)2溶液呈中性。
【实验探究】取白色粉末溶于水形成溶液A,设计如下实验:(1)由上述实验可知,猜想_______肯定不成立。
(2)若操作①滴加过量稀盐酸有气体B产生,而滴加少量稀硫酸可能没有气体B产生。
其可能的原因是:____________________________________________________________________(用化学方程式回答)。
(3)适合操作③的X溶液是_______(填字母序号)。
A. CaCl2溶液B. Ca(OH)2溶液C. Ba(OH)2溶液D. Ca(NO3)2溶液(4)操作④需要用到的玻璃仪器是______________。
(5)请写出操作⑤的两种方案并得出结论。
方案一:______________________________________________________________________。
方案二:______________________________________________________________________。
(18十堰)19.(6分)某学习小组在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液,(如图所示),经实验员分析可知原瓶溶液中的溶质可能是 NaHCO3,NaOH,Na2CO3,NaCl中的一种,请你对该试剂作出猜想并进行实验探究:【提出问题】这瓶试剂是什么溶液?【猜想与假设】甲猜想:NaHCO3溶液乙猜想:NaOH溶液丙猜想:Na2CO3溶液丁猜想:NaCl溶液【查阅资料】上述四种物质相关信息如下物质NaHCO3NaOH Na2CO3NaCl 常温下溶解度/g 9.6 109 21.5 36常温下稀溶液的pH 9 13 11 7【实验探究1】取瓶中溶液少许于试管中,滴加几滴酚酞溶液,溶液变红。
【实验探究2】另取瓶中溶液少许于试管中,滴加足量的稀盐酸,产生生气泡。
【实验分析】通过【实验探究1】可知同学的猜想一定错误。
甲同学仔细分析四种物质的相关信息表后发现自已的猜想错误,他的理由是。
丙同学分析【实验探究2】并结合以上同学的实验结论,认为原瓶溶液是NaCO3溶液。
【实验探究2】中发生反应的化学方程式为。
【讨论质疑】乙认为以上同学分析有漏洞,需要进一步实验确定,于是又进行了如下探究。
【实验探究3】在【实验探究1】试管中的红色溶液中滴加过量氯化钙溶液(中性),充分反应后,试管中溶液仍呈红色,但有白色沉淀产生。
【得出结论】通过【实验探究3】可证明这瓶试剂为溶液,但已经部分变质。
【反思与拓展】学习小组反思了这瓶试剂因为而变质,得出了该溶液正确的保存方法,若要除去该溶液变质部分所采用的方法是(用化学反应方程式表示)。
(18荆州)19.(6分)(6分)某化学活动兴趣小组用如图装置进行一氧化碳还原氧化铜的探究实验,反应一段时间后,玻璃管内黑色粉末全部变成红色,澄清石灰水变浑浊。
(1)从安全环保的角度考虑,上述实验需要改进的是。
(2)装置B中发生反应的化学方程式为。
(3)同学们通过查阅资料得知:氧化亚铜(Cu2O)和铜均为红色固体,且Cu2O能和稀硫酸反应,反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O.他们对反应后玻璃管中的红色固体进行如下探究:【提出问题】反应后生成的红色固体成分是什么?【作出猜想】猜想一:红色固体只有Cu猜想二:红色固体只有Cu2O猜想三:红色固体可能含有。
【实验探究】设计如下实验方案实验操作现象结论取少量红色固体于试管中,加入过量的稀硫酸。
红色固体含有Cu2O 【思考与分析】甲同学认为猜想二正确,同学们分析后认为他的结论不准确,理由是。
为此,同学们补充进行了以下实验:称取mg红色固体于试管中,加入过量的稀硫酸充分反应,然后过滤、洗涤、干燥、称量,得到ng固体。
当n>(含m的代数式)时,可以得出猜想三的结论正确。
(18安顺)13、(8分)氢化钙固体是登山运动员常用的能源提供剂。
某探究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。
探究斯小组的同学吧一定量的CaH2加入Na2CO3燃油中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的充分是碳酸钙。
【提出问题】滤液中溶质的充分是什么?猜想一:NaOH 猜想二:NaOH、Ca(OH)2猜想三:NaOH、Na2CO3猜想四:NaOH、Na2CO3、Ca(OH)2经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因。
【实验验证】【反思与拓展】(1)写出氢化钙(CaH2)与水反应的化学方程式。
(2)若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和。
(3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是(18黔南)13. (8分)某化学兴趣小组在学习酸碱中和反应实验时,进行了如下探究。
I.探究酸和碱能否发生反应甲同学向盛有少量KOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由_____色变成无色。
甲同学得出结论:酸和碱能发生反应。
请写出稀硫酸和氢氧化钾溶液反应的化学方程式__________。
II.探究酸和碱反应后溶液中溶质的成分乙同学对探究I中甲同学实验后的无色溶液展开探究。
【提出问题】试管中无色溶液的溶质除了酚酞还有什么?【提出猜想】(1) K2SO4;(2) K2SO4和_______【设计实验】A.Ba(NO3)2B.锌粒C.CuD.盐酸(18黄石)38. (5分)松花皮蛋是黄石八珍之一。
腌制皮置的一种原料是由NaC1、CaO和Na2CO3组成的固体混合物。
某化学兴题小组用该原料,在实验室进行如下实验:将该固体混合物放入烧杯中,加入足量的蒸馏水。
充分溶解后过滤,得到白色沉淀和无色澄清滤液。
同学们对滤液的溶质成分进行了探究。
请完成以下探究过程,并将①~⑤处答案填入答题卡相应位置。
固体溶解过程中发生了两个化学反应: CaO+H2O=Ca(OH)2_______。
