有机溶剂溶解度相对理论
附录1常用有机溶剂在水中的溶解度

附录附录1:常用有机溶剂在水中的溶解度附录2:关于有毒化学药品的知识1、高毒性固体很少量就能使人迅速中毒甚至致死。
2、毒性危险气体3、毒性危险液体和刺激性物质长期少量接触可能引起慢性中毒,其中许多物质的蒸气对眼睛和呼吸道有强刺激性。
4.其他有害物质(1)许多溴代烷和氯代烷,以及甲烷和乙烷的多卤衍生物,特别是下列化合物:(2)芳胺和脂肪族胺类的低级脂肪族胺的蒸气有毒。
全部芳胺,包括它们的烷氧基、卤素、硝基取代物都有毒性。
下面是一些代表性例子:(3)酚和芳香族硝基化合物5、致癌物质下面列举一些已知的危险致癌物质:(1)芳胺及其衍生物联苯胺(及某些衍生物) β-萘胺二甲氨基偶氯苯α-萘胺(2)N-亚硝基化合物N-甲基-N-亚硝基苯胺N-亚硝基二甲胺N-甲基-N-亚硝基脲N-亚硝基氢化吡啶(3)烷基化剂双(氯甲基)醚硫酸二甲脂氯甲基甲醚碘甲烷重氮甲烷β-羟基丙酸内酯(4)稠环芳烃苯并[a]芘二苯并[c,g]咔唑二苯并[a,h]蒽7,12-二甲基苯并[a]蒽(5)含硫化合物硫代乙酸胺(thioacetamide) 硫脲(6)石棉粉尘6、具有长期积累效应的毒物这些物质进入人体不易排出,在人体内累积,引起慢性中毒。
这类物质主要有:(1)苯。
(2)铅化合物,特别是有机铅化合物。
(3)汞和汞化合物,特别是二价汞盐和液态的有机汞化合物。
在使用以上各类有毒化学药品时,都应采取妥善的防护措施。
避免吸入其蒸气和粉尘,不要使它们接触皮肤。
有毒气体和挥发性的有毒液体必须在效率良好的通风橱中操作。
汞的表面应该用水掩盖,不可直接暴露在空气中。
装盛汞的仪器应放在一个搪瓷盘上以防溅出的汞流失。
溅洒汞的地方迅速撒上硫磺石灰糊。
附录3:常用法定计量单位[注][注](1)本表选自1984.2.27国务院“关于在我国统一实行法定计量单位的命令”。
表中量的名称是国家标准GB3102规定的。
(2)*为我国选定的非国际单位制的单位;**为已习惯使用应废除的单位,其余为SI单位。
有机溶剂的极性与溶解度的计算

有机溶剂的极性与溶解度的计算在化学领域中,溶解度是指在一定温度和压力下溶液中最大能溶解的物质量,常用质量分数或摩尔分数来表示。
溶解度的计算对于化学实验、工业生产以及药物研发具有重要意义。
本文将探讨有机溶剂的极性与溶解度之间的关系,并介绍一些计算溶解度的方法。
有机溶剂的极性是指溶剂分子中极性键的数量和强度。
极性键是由原子间的电荷差异引起的化学键,如两个原子间的电负性差异较大。
一般来说,带有电子云分布不均匀的分子更加极性。
极性溶剂可以与带电离子或者带电部分形成静电相互作用,从而溶解离子化合物或极性化合物。
相反,非极性溶剂则倾向于溶解非极性或者低极性的物质。
当我们需要计算有机溶剂的溶解度时,可以考虑以下几个因素:1. 溶剂极性与溶质极性的匹配:通常来说,极性溶剂更适合溶解极性溶质,而非极性溶剂更适合溶解非极性溶质。
这是因为溶剂和溶质之间极性相近时,静电相互作用更强,有利于溶解。
2. 溶剂分子的结构:溶剂分子的结构也会影响其溶解能力。
在一般情况下,较大的溶剂分子对溶解性的提高有利,因为它们具有更多的接触面积,可以与更多的溶质分子发生相互作用。
3. 温度和压力:温度和压力是影响溶解度的重要因素。
温度升高会增加溶质的动力学能量,有利于其在溶剂中溶解。
而压力的增加可以促进溶质与溶剂间的相互作用,从而提高溶解度。
在计算有机溶剂的溶解度时,可以使用一些常见的方法:1. 溶解度参数法:溶解度参数法是一种基于物质属性的经验方法,通过实验数据拟合得到溶剂和溶质的参数,从而预测溶解度。
这些参数包括极性参数、氢键参数和键键参数等。
2. 分子力场模拟:分子力场模拟是使用计算机模拟方法研究溶质和溶剂之间相互作用的方法。
通过构建溶质和溶剂分子的三维结构,并根据它们之间的相互作用力场进行计算,可以预测溶解度。
3. 溶解度预测软件:目前,有一些商业软件可以根据分子结构,使用量化构效关系(QSAR)的方法预测化合物的溶解度。
这些软件使用了大量的实验数据和统计学算法,提供了便捷且准确的溶解度预测。
常见有机溶剂的溶解性汇总

常用溶剂的沸点、溶解性和毒性溶剂名称沸点(101.3kPa)溶解性毒性液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、*****、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似***** 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶*****性戊烷36.1 与乙醇、*****等多数有机溶剂混溶低毒性员?婷疋0?二氯甲烷39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,*****性强二硫化碳46.23 微溶与水,与多种有机溶剂混溶*****性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15 与乙醇、*****、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强*****性甲醇64.5 与水、*****、醇、酯、卤代烃、苯、酮混溶中等毒性,*****性四氢呋喃66 优良溶剂,与水混溶,很好的溶解乙醇、*****、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
*****性,刺激性三氟代乙酸71.78 与水,乙醇,*****,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷74.0 与丙酮、、甲醇、*****、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,*****性乙醇78.3 与水、*****、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,*****性丁酮79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、*****、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性乙睛81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40 与乙醇、*****、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48 与乙醇、*****、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
有机化学基础知识点有机物的溶解性和溶解度

有机化学基础知识点有机物的溶解性和溶解度有机化学基础知识点:有机物的溶解性和溶解度有机化学是研究含有碳元素的化合物的科学,是化学中的重要分支之一。
在有机化学中,有机物的溶解性和溶解度是两个重要的概念。
本文将介绍有机物的溶解性和溶解度的定义、影响因素以及实际应用。
一、有机物的溶解性有机物的溶解性是指有机物能否溶解于某一给定溶剂中的性质。
溶解性的大小取决于溶剂和溶质之间的相互作用力。
如果有机物和溶剂之间的相互作用力较强,溶解性就较大;相反,如果相互作用力较弱,溶解性就较小。
溶解性常用溶解度来表示,即单位溶剂中能溶解单位溶质的物质的量。
溶解度的大小与溶剂和溶质的性质有关,通常采用摩尔溶解度(mol/L)或质量溶解度(g/L)来表示。
二、影响有机物溶解性的因素1. 分子极性:极性溶质通常易溶于极性溶剂,而非极性溶质倾向于溶解于非极性溶剂。
这是由于极性分子之间的吸引力较强,有利于溶解。
2. 温度:一般情况下,溶解度随温度的升高而增加。
这是因为温度升高会增加分子间的热运动,从而使溶质分子能够克服相互作用力更容易进入溶液。
3. 压力:对固体或气体溶质来说,压力对溶解度影响较大。
根据Henry定律,气体的溶解度随压力的增加而增加,固体溶质的溶解度一般不受压力的影响。
4. 溶剂的选择:不同的有机物需要选择适合其溶解的溶剂。
例如,极性有机物通常溶解于极性溶剂(如水、乙醇等),而非极性有机物溶解于非极性溶剂(如石油醚、甲醇等)。
三、有机物的溶解度有机物的溶解度是指在一定温度下,有机物在溶剂中能达到的最大溶解度。
溶解度可用实验测定或计算得出,通过溶解度可以了解有机物的溶解特性,预测其在溶液中的行为。
不同有机物的溶解度差异较大,主要与分子结构相关。
常用的溶解度规律包括:"相似溶剂溶解相似溶质"原则、"极性溶剂溶解极性溶质"原则以及"类似结构的有机物溶解性相似"原则。
溶解理论

三、溶解度
溶解度是指在一定温度下(气体在一定压力下),一定量溶剂的饱和溶液中能溶解溶质 的量。溶解度一般以一份溶质(1g 或 1ml)溶于若干 ml 溶剂中表示。《中国药典》2000 年 版(二部)对药品的近似溶解度用以下名词表示: 极易溶解:系指 1g(ml)溶质能在 不到 1ml 溶剂中溶解。
易溶:系指 1g(ml)溶质能在 1~10ml 溶剂中溶解。
半极性溶剂
一些有一定极性的溶剂,如乙醇、丙二醇、聚乙二醇和丙酮等,能诱导某些非极性分子 产生一定程度的极性而溶解,这类溶剂称为半极性溶剂。半极性溶剂可作为中间溶剂,使极 性溶剂和非极性溶剂混溶或增加非极性药物在极性溶剂(水)中的溶解度。如:丙酮能增加 乙醚在水中的溶解度,乙醇能增大氢化可的松在水中溶解度等。
非极性溶剂
常用的非极性溶剂有氯仿、苯、液状石蜡、植物油、乙醚等。非极性溶剂的介电常数很 低,不能减弱电解质离子的引力,也不能与其它极性分子形成氢键。而非极性溶剂对非极性 物质的溶解是由于溶质和溶剂分子间的范德华力作用的结果,溶剂分子内部产生的瞬时偶极 克服了非极性溶质分子间内聚力而致溶解,而离子型或极性物质不溶于或仅微溶于非极性溶 剂中。
四、溶解速度
溶解速度是指在某一溶剂中单位时间内溶解溶质的量。溶解速度的快慢,取决于溶剂与 溶质之间的吸引力胜过固体溶质中结合力的程度及溶质的扩散速度。固体药物的溶出(溶解) 过程包括两个连续的阶段:先是溶质分子从固体表面释放进入溶液中,再是在扩散或对流的 作用下将溶解的分子从固液界面转送到溶液中。有些药物虽然有较大的溶解度,但要达到溶 解平衡却需要较长时间,即溶解速度较小,直接影响到药物的吸收与疗效,这就需要设法增 加其溶解速度。
溶解理论
盐酸土霉素在有机溶剂中溶解度测定、关联与异常现象分析

盐酸土霉素在有机溶剂中溶解度测定、关联与异常现象分析赵金芳;杨立国;刘俊果【摘要】盐酸土霉素是一种广谱抑菌剂,常用作兽用抗生素.现行工艺是在以土霉素碱为原料在甲醇中冷却结晶制得,但是得到的盐酸土霉素晶体具有晶粒小,形状不规则,流动性差等缺点,为了改进结晶工艺,本文测定了在不同温度下,盐酸土霉素在各种溶剂中的溶解度,并用半经验Apelblat方程和多项式经验方程进行拟合回归,拟合结果良好.试验中发现,盐酸土霉素澄清饱和溶液在搅拌过程中会变成乳白色液体,针对此异常现象的研究分析表明温度升高时能加剧一些副反应,如差向化反应,导致成品中的杂质含量超标.【期刊名称】《中国抗生素杂志》【年(卷),期】2016(041)003【总页数】5页(P218-222)【关键词】测定;盐酸土霉素;溶解度;关联【作者】赵金芳;杨立国;刘俊果【作者单位】河北科技大学生物科学与工程学院,石家庄050000;河北省发酵工程技术研究中心,石家庄050000;河北科技大学生物科学与工程学院,石家庄050000;河北省发酵工程技术研究中心,石家庄050000;河北科技大学生物科学与工程学院,石家庄050000;河北省发酵工程技术研究中心,石家庄050000【正文语种】中文【中图分类】R978.1土霉素(OTC),是淡黄色结晶性粉末,分子式为C22H24N2O9,是由土壤链霉菌发酵产生的,是一种广谱抗菌抑菌剂。
革兰阳性菌、革兰阴性菌、支原体、衣原体、立克次体等对该品敏感;也可用于治疗梨形虫病、附红细胞体病[1-3];但是肠球菌属对其耐药。
土霉素还可作为一种动物生长促进剂[4]。
口服或注射治疗应用最广的首选盐酸土霉素,盐酸土霉素的生产工艺[5]为:发酵液预处理→过滤→脱色→结晶→土霉素碱成品→溶解→脱色→结晶→干燥→盐酸土霉素成品。
靠现有生产工艺制得的盐酸土霉素虽然符合中国的药典、能通过欧盟及美国药品管理机构认证;但是,制备的盐酸土霉素的晶粒形状不规则、流动性差,无法满足某些高端客户的要求,寻求确定能产出高品质的盐酸土霉素晶体工艺条件迫在眉睫。
氯化锂、氯化钠在NMP中溶解度的测定与关联

氯化锂、氯化钠在NMP中溶解度的测定与关联李柏春;杜东雪;张文林;孟楷【摘要】为了回收聚苯硫醚生产中的助剂氯化锂,对氯化锂、氯化钠在溶剂NMP (N-甲基吡咯烷酮)中的溶解性能进行了研究。
利用激光衍射辅助法在297.95~364.75 K温度范围内对氯化锂、氯化钠在NMP中的溶解度进行了测定,并用经验方程、λh方程、改进的NRTL方程对氯化锂在NMP中的溶解度数据进行关联。
结果证明,改进的NRTL方程的拟合结果最好,平均相对偏差仅为0.41%,可适用于较高温度下氯化锂-NMP体系溶解度的数据估计。
%In order to recover the additive lithium chloride in the polyphenylene sulfide production, the disolution of lithium chloride and sodium chloride in solventN-methyl pyrrolidone (NMP) was studied. By using laser diffraction assistance method, solubility data of lithium chloride and sodium chloride in NMP were measured between 297.95 K and 364.75 K. Empirical formula,λh equation and improved NRTL equation were used to correlate the solubility data of lithium chloride in NMP. The results show that the solubility of lithium chloride increases with temperature while that of sodium chloride almost keeps unchanged. The improved NRTL equation can predict the solubility data well and the relative average error is 0.41%. Thus the K-NRTL equation is most suitable for description of solid-liquid equilibrium of lithium chloride in NMP at high temperature.【期刊名称】《化工学报》【年(卷),期】2014(000)012【总页数】5页(P4664-4668)【关键词】激光法;氯化锂;回收;NMP;相平衡;改进的NRTL方程;参数估值【作者】李柏春;杜东雪;张文林;孟楷【作者单位】河北工业大学化工学院,天津 300130;河北工业大学化工学院,天津 300130;河北工业大学化工学院,天津 300130;河北工业大学化工学院,天津300130【正文语种】中文【中图分类】TQ013.1聚苯硫醚(PPS)是一种优异的耐高温和耐腐蚀的特种工程塑料,具有良好的经济价值和应用前景。
第3章溶解理论

二、影响溶解速度的因素
• 固体溶解是一个溶解扩散的过程,一般用单位时间内溶液 浓度增加量表示,其符合Noyes-Whintney方程: • • (3-1) • 式中:是溶出速度;S为药物粒子的表面积;CS为溶质在 溶出介质中的溶解度;C为t时间溶液中溶质的浓度;D为 扩散系数;V为溶出介质体积;h为扩散层厚度;K为溶出 速度常数。
• CH 3-CH2 -O- CH2CH3
H
H
O
三、溶解度
• 溶解度是指在一定温度下(气体在 一定压力下),一定量溶剂的饱和 溶液中能溶解溶质的量。溶解度一 般以一份溶质(1g或1ml)溶于若干 毫升溶剂中表示。《中国药典》 2010年版二部对药品的近似溶解度 用以下名词表示:
易溶:系指1g(ml)溶质能在1~10ml溶剂中溶解。 3、溶解:系指1g(ml)溶质能在10~30ml溶剂中溶解。 4、略溶:系指1g(ml)溶质能在30~100ml溶剂中溶解。 5、微溶:系指1g(ml)溶质能在100~1000ml溶剂中溶解。 6、极微溶解:系指1g(ml)溶质能在1000~10000ml溶剂中 溶解。 7、几乎不溶或不溶:系指1g(ml)溶质在10000ml溶剂中不 能完全溶解。 • 药物的溶解过程,实为溶解扩散过程;一旦扩散达平衡, 溶解就无法进行。
第二节 影响药物溶解度与溶解速度 的因素
• 一、影响溶解度的因素 • 1、药物的分子结构 • 药物在溶剂中的溶解度是药物分子与溶剂 分子间相互作用的结果。根据“相似相溶” 原理,药物的极性大小对溶解度有很大的 影响,而药物的结构则决定着药物极性的 大小。
• 2、溶剂 • 溶剂通过降低药物分子或离子间的引力,使药物 分子或离子溶剂化而溶解,是影响药物溶解度的 重要因素。 • 极性溶剂可使盐类药物及极性药物产生溶剂化而 溶解;极性较弱的药物分子中的极性基团与水形 成氢键而溶解; • 非极性溶剂分子与非极性药物分子形成诱导偶极 -诱导偶极结合;非极性溶剂分子与半极性药物 分子形成诱导偶极-永久偶极结合。 • 通常,药物的溶剂化会影响药物在溶剂中的溶解 度。
《日用化学品制造原理与技术》第一章思考题

《日用化学品制造原理与技术》第一章思考题《日用化学品制造原理与技术》第一章思考题1.什么是表面活性物质?什么是表面活性剂?答:表面活性物质:具有能使溶剂表面张力降低的性质的物质。
表面活性剂:凡是能够使体系的表面状态发生明显变化的物质都称为表面活性剂。
2.什么是表面张力?它的单位如何表示?液体的表面张力是怎样产生的?答:表面张力是指作用于液体表面单位长度上使表面收缩的力。
单位:mN/m产生原因:由于液体分子之间的引力大于液体分子与表面外分子的引力,而造成的分子聚拢效应。
3.什么是cmc?为什么说cmc是表面活性剂的一个重要特性值?答:Cmc:临界胶束浓度是表面活性剂的一个重要参数,它是指表面活性剂分子或离子在溶液中开始形成胶束的最低浓度。
达到cmc后即有胶束形成,胶束中的表面活性剂分子可随时补充表面分子膜中分子的损失,从而使表面活性得以充分发挥。
4.什么是Krafft点?答:在较低温度下,表面活性剂在水中的溶解度随温度的上升而升高缓慢,但到某一温度后,表面活性剂在水中的溶解度随温度上升而迅速上升。
该溶解度突变所对应的温度称为Krafft点。
5.增溶的方式有哪几种?有机物在表面活性剂中的增溶与在有机溶剂中的溶解有什么区别?答:增溶是由于胶束的存在而使物质溶解度增加的现象,这些物质或溶入胶束的亲油基中间,或插于胶束的分子之间,或黏附于胶束的亲水基上,从而使溶解度大增。
表面活性剂增溶是利用离子型表面活性剂达到其cmc点(临界胶束浓度)后增加对于溶质的溶解度完成的。
与溶剂溶解溶质的理论不一样,有机溶剂对于溶质的溶解只受到温度的影响。
6.什么叫做接触角?接触角的大小与洗涤之间有什么关系?答:接触角:指气、液、固三相交处所作的气-液界面的切线穿过液体与固-液交界线之间的夹角θ。
当θ>90°时,在洗液中按照水力动力学的规律,由流动而产生的相对密度差产生了浮力,油滴除去时θ几乎保持一定,油在被洗物上附着的面积逐渐变小。
二苯基亚砜在有机溶剂中的溶解度测定和拟合

二苯基亚砜在有机溶剂中的溶解度测定和拟合欧阳博;孔明;钱超;陈新志【摘要】在温度288.30~334.32K、常压条件下,采用合成法测定二苯基亚砜在乙醇、乙酸乙酯、甲苯、丙酮、氯仿以及一系列浓度的乙醇-水混合溶剂中的溶解度.实验结果表明,在相同温度下,5种纯溶剂中二苯基亚砜的溶解度大小顺序如下,氯仿>丙酮>甲苯>乙酸乙酯>乙醇;乙醇-水混合溶剂中溶解度随着乙醇浓度下降而迅速降低;该溶解过程为吸热熵增过程,且随着溶解Gibbs斯自由能增大,溶解度减小.数据采用改进的Apelblat方程和van’t Hoff方程进行拟合,在乙醇-水混合溶剂中的溶解度数据还采用Jouban-Acree方程拟合.拟合结果与实验数据基本吻合.测定的固液平衡数据可为二苯基亚砜的合成与提纯等过程的溶剂选择提供依据.【期刊名称】《化工学报》【年(卷),期】2018(069)004【总页数】8页(P1307-1314)【关键词】二苯基亚砜;溶解;相平衡;混合溶剂;焓;熵【作者】欧阳博;孔明;钱超;陈新志【作者单位】浙江省化工高效制造技术重点实验室,浙江大学化学工程与生物工程学院,浙江杭州310027;浙江省化工高效制造技术重点实验室,浙江大学化学工程与生物工程学院,浙江杭州310027;浙江省化工高效制造技术重点实验室,浙江大学化学工程与生物工程学院,浙江杭州310027;浙江省化工高效制造技术重点实验室,浙江大学化学工程与生物工程学院,浙江杭州310027【正文语种】中文【中图分类】O642.4+2二苯基亚砜(CAS: 945-51-7)是一种价值高、应用广的含硫有机物,在农药、医药合成领域有重要作用[1-3]。
其分子式为C12H10SO,其分子结构式如图1所示。
选择性氧化法是制备二苯基亚砜的最常见的方法[3-5]。
为了得到纯品二苯基亚砜,通常需要对产物进行结晶和重结晶。
溶解度数据是进行结晶或重结晶步骤中最重要的数据[6-7],而现阶段并未有文献报道其在常见溶剂中的溶解度。
不同溶剂对光气介质体系影响比较

不同溶剂对光气介质体系影响比较乔洪虎* 杨向东 中海油石化工程有限公司 济南 250101摘要 借助Aspen Plus 软件模拟获得甲苯、氯苯、邻二氯苯溶剂对光气的溶解度、溶解热、平均相对挥发度、分离难易程度等数据,并对其数据进行分析比较,为光气化生产工艺溶剂的选择和工程设计提供理论分析依据。
关键词 光气 甲苯 氯苯 邻二氯苯 溶解度光气在常温常压下为无色、不燃、剧毒气体,比空气重,在低温或加压时易被液化,但和其它气体如氯化氢、二氧化碳混合后,通过液化方法很难将光气分离彻底,用溶剂吸收更加可靠、经济。
光气微溶于水,易溶于甲苯、二甲苯、氯苯、邻二氯苯等有机溶剂,其溶解度不仅取决于温度和光气分压,也取决于溶剂性质。
在甲苯二异氰酸酯(TDI)生产过程中[1],通常采用能溶解光气的溶剂作为分散剂和吸收剂,将未反应的多余光气吸收,然后再将含有光气的溶剂作为原料返回使用或将光气从溶剂脱除后循环利用。
选用溶剂的原则是既不能参与反应,又要对光气具有很好的溶解能力。
目前生产工艺中采用较多吸收剂有邻二氯苯、氯苯、甲苯等[2]。
这些溶剂对光气有较好的溶解作用,并不会与光气发生反应,且对光气尾气中的氯化氢、氮气、二氧化碳等气体溶解度低、选择性好。
本文从三种溶剂的基本特点出发,研究其对光气溶解度、光气溶液分离等方面的影响。
邻二氯苯、氯苯、甲苯和光气物系属于弱极性体系,且为低压环境。
在Aspen 模拟过程中,采用NRTL 方法即能达到很好的拟合效果,通过该方法开发的工艺在实际生产装置中也得到了很好的验证。
1 甲苯、氯苯、邻二氯苯基本物性比较光气、甲苯、氯苯、邻二氯苯基本物性见表1。
从表1数据看出,甲苯、氯苯与邻二氯苯相比,其沸点低得多。
在光气化生产工艺中进行溶剂回收时,可以采用低温位的蒸汽,TDI 等大分子光气化产品随着温度升高都会有不同程度的副反应发生,采用低沸点溶剂可以降低蒸馏温度,减少焦油等副产物的生成。
氯苯的闪点相比邻二氯苯要低,根据其闪点,判定氯苯的火灾危险性为乙A 类,在光气化产品生产中有蒸馏等操作,其工艺操作温度超过其闪点,根据石油化工企业设计防火标准,该介质的火灾危险性应视为甲B 类。
萃取实验原理

萃取实验原理一、引言萃取是化学实验中常用的一种分离纯化方法,它利用不同物质在不同溶剂中的相对溶解度差异,将需要分离的物质从混合物中提取出来。
本文将详细介绍萃取实验的原理、步骤及注意事项。
二、萃取原理萃取实验基于以下两个重要原理:1. 相对溶解度差异:不同物质在不同溶剂中的相对溶解度差异很大,这是进行萃取实验的前提条件。
通常情况下,我们会选择两种互不混溶的溶剂进行萃取,例如水和有机溶剂(如乙醚、氯仿等)。
2. 分配系数:分配系数是指在两相体系(如水-有机相)中某种物质在两相之间分布的比例关系。
在一个平衡状态下,某种物质在两相之间达到了一个动态平衡,此时其浓度比例就可以用分配系数来描述。
例如,某种化合物在水中浓度为1mol/L,在乙醚中浓度为10mol/L,则其分配系数为10。
三、实验步骤1. 准备样品:首先需要将待提取物质加入到适当的溶剂中,制备成混合物。
同时,需要准备好萃取用的两种互不混溶的溶剂。
2. 萃取操作:将混合物和第一种溶剂(如乙醚)加入到分液漏斗中,并摇匀,使两相充分接触。
然后等待两相分离后,将有机相收集起来。
3. 重复萃取:通常情况下,单次萃取并不能完全提取出目标化合物。
因此需要进行多次重复萃取,直到有机相中的目标化合物浓度足够高。
4. 合并有机相:将多次重复萃取得到的有机相合并起来,并用旋转蒸发仪除去有机溶剂,留下目标化合物。
四、注意事项1. 选择适当的溶剂:在进行萃取实验时,需要根据待提取物质的性质选择适当的溶剂。
通常情况下,我们会选择极性较小且与水互不混溶的有机溶剂。
2. 操作要注意安全:在进行萃取实验时,需要注意安全操作。
例如,在使用乙醚等易挥发性有机溶剂时,需要保持通风良好,避免引起火灾或中毒。
3. 重复萃取次数:在进行萃取实验时,需要注意重复萃取的次数。
过多的重复萃取会导致有机相中杂质的增加,从而影响分离效果。
4. 萃取时间:在进行萃取实验时,需要注意萃取时间。
过短的萃取时间会导致目标化合物无法完全提取出来,而过长的萃取时间则会导致有机相中杂质的增加。
常用有机化合物的物理常数
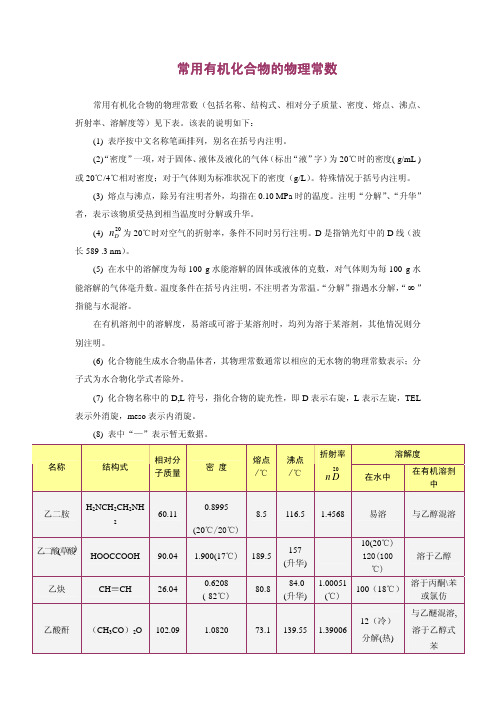
20 — 185.25
—95.35
290 分 解
—47.4
56.2
丙酸
CH3CH2COOH
74.08 0.9930 —20.8 140.99
异丙醇
(CH3)2CHOH
60.11 0.7855 —89.5 82.4
异戊醇 (CH3)2(CH2)2-CH2OH 88.15 0.8092 —117.2 128.5
溶于乙醇或乙醚
与乙醇、乙醚、丙酮 或苯混溶 溶于乙醇、乙醚、丙 酮或苯
续表
名称
结构式
β-苯酚 C10H7OH
偶氮苯 C6H5N=NC6H5
淀粉 硝基苯 氯乙烯 氯乙烷
(C6H10O5) C6H5NO2 CH2=CHCl CH3CH3Cl
溴苯
C6H5Br
相对分 子质量
密度
1440.19 1.28
182.23
60.06 1.3230 135
分解
168.12 1.89
分解 分解
84.16 0.77855 6.55 80.74
环已酮 CH2(CH2)4C=O 98.15 0.9478 -16.4
155.65
环已醇 CH2(CH2)4CHOH 100.16 0.9624 25.15 161.1
苯
C6H6
78.12 0.87865 5.5
常用有机化合物的物理常数
常用有机化合物的物理常数(包括名称、结构式、相对分子质量、密度、熔点、沸点、
折射率、溶解度等)见下表。该表的说明如下:
(1) 表序按中文名称笔画排列,别名在括号内注明。
(2)“密度”一项,对于固体、液体及液化的气体(标出“液”字)为 20℃时的密度( g/mL )
有机物的溶解性规律

有机物的溶解性规律一、相似相溶原理1.极性溶剂(如水)易溶解极性物质(离子晶体、分子晶体中的极性物质如强酸等);非极性溶剂(有机溶剂如苯、汽油、四氯化碳、酒清等)能溶解非极性物质(大多数有机物、Br2、I2等);2.含有相同官能团的物质互溶,如水中含羟基(—OH)能溶解含有羟基的醇、酚、羧酸。
二、有机物的溶解性与官能团的溶解性1.官能团的溶解性:(1)易溶于水的官能团(即亲水基团)有:—OH、—CHO、—COOH、、—NH2。
(2)难溶于水的官能团(即憎水基团)有:所有的烃基(—CnH2n+1、—CH=CH2、—C6H5等)、卤原子(—X)、硝基(—NO2)等。
2.分子中亲水基团与憎水基团的比例影响物质的溶解性:(1)当官能团的个数相同时,随着烃基(憎水基团)碳原子数目的增大,溶解度逐渐降低;例如,溶解度CH2OH>C2H5OH>C3H7OH>……,一般地,碳原子个数大于5的醇难溶于水。
(2)当烃基中碳原子数相同时,亲水基团的个数越多,物质的解度越大;例如,溶解度:CH3CH2CH2OH<CH3CH(OH)CH2OH<CH2(OH)CH(OH)CH2OH。
(3)当亲水基团与憎水基团的对溶解度的影响大致相同时,物质微溶于水;例如,常见的微溶于水的物质有:苯酚C6H5—OH、苯胺C6H5—NH2、安息香酸(苯甲酸)C6H5—COOH、正戊醇CH3CH2CH2CH2CH2—OH(上述物质的结构简式中“—”左边的为憎水基团,右边的为亲水基团);乙酸乙酯CH3COOCH2CH3(其中—CH3和—CH2CH3为憎水基团,为亲水基团)。
(4)由两种憎水基团组成的物质,一定难溶于水。
例如,卤代烃R-X、硝基化合物R-NO2,由于其中的烃基R­—、卤原子—X和硝基—NO2均为憎水基团,故均难溶于水一:溶剂极性参数表,方便以下比较展开剂。
环已烷 :-0.2、石油醚(Ⅰ类,30~60℃)、石油醚(Ⅱ类,60~90℃)、正已烷:0.0、甲苯:2.4、二甲苯:2.5、苯:2.7、二氯甲烷:3.1、异丙醇:3.9、正丁醇:3.9、四氢呋喃:4.0、氯仿:4.1、乙醇:4.3、乙酸乙酯:4.4、甲醇:5.1、丙酮:5.1、乙腈:5.8、乙酸:6.0、水:10.2 数值越大,极性越大二:常用溶剂的沸点、溶解性和毒性溶剂名称沸点℃(101.3kPa) 溶解性毒性液氨 -33.35 能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫 -10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺 -6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺 7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷 36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷 39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳 46.23 微溶与水,与多种有机溶剂混溶麻醉,强刺激性丙酮 56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷 57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿 61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇 64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性四氢呋喃 66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷 68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒,麻醉性,刺激性三氟代乙酸 71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷 74.0 与丙酮、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒四氯化碳 76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯 77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇 78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮 79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯 80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性环己烷 80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用乙睛 81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇 82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷 83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚 85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶, 能溶解各种树脂,还是二氧化硫、氯代甲烷、乙烯等气体的优良溶剂吸入和经口低毒三氯乙烯 87.19 不溶于水,与乙醇、乙醚、丙酮、苯、乙酸乙酯、脂肪族氯代烃、汽油混溶有机有毒品三乙胺 89.6 水:18.7以下混溶,以上微溶, 易溶于氯仿、丙酮,溶于乙醇、乙醚易爆,皮肤黏膜刺激性强丙睛 97.35 溶解醇、醚、DMF、乙二胺等有机物,与多种金属盐形成加成有机物高毒性,与氢氰酸相似庚烷 98.4 与己烷类似低毒,刺激性、麻醉性水 100 略略硝基甲烷 101.2 与醇、醚、四氯化碳、DMF、等混溶麻醉性,刺激性1,4-二氧六环 101.32 能与水及多数有机溶剂混溶,仍溶解能力很强微毒,强于乙醚2~3倍甲苯 110.63 不溶于水,与甲醇、乙醇、氯仿、丙酮、乙醚、冰醋酸、苯等有机溶剂混溶低毒类,麻醉作用硝基乙烷 114.0 与醇、醚、氯仿混溶,溶解多种树脂和纤维素衍生物局部刺激性较强吡啶 115.3 与水、醇、醚、石油醚、苯、油类混溶, 能溶多种有机物和无机物低毒,皮肤黏膜刺激性4-甲基-2-戊酮 115.9 能与乙醇、乙醚、苯等大多数有机溶剂和动植物油相混溶毒性和局部刺激性较强乙二胺 117.26 溶于水、乙醇、苯和乙醚,微溶于庚烷刺激皮肤、眼睛丁醇 117.7 与醇、醚、苯混溶低毒,大于乙醇3倍乙酸 118.1 与水、乙醇、乙醚、四氯化碳混溶,不溶于二硫化碳及C12以上高级脂肪烃低毒,浓溶液毒性强乙二醇一甲醚 124.6 与水、醛、醚、苯、乙二醇、丙酮、四氯化碳、DMF等混溶低毒类辛烷 125.67 几乎不溶于水,微溶于乙醇,与醚、丙酮、石油醚、苯、氯仿、汽油混溶低毒性,麻醉性乙酸丁酯 126.11 优良有机溶剂,广泛应用于医药行业,还可以用做萃取剂一般条件毒性不大吗啉 128.94 溶解能力强,超过二氧六环、苯、和吡啶,与水混溶,溶解丙酮、苯、乙醚、甲醇、乙醇、乙二醇、2-己酮、蓖麻油、松节油、松脂等腐蚀皮肤,刺激眼和结膜,蒸汽引起肝肾病变氯苯 131.69 能与醇、醚、脂肪烃、芳香烃、和有机氯化物等多种有机溶剂混溶低于苯,损害中枢系统乙二醇一乙醚 135.6 与乙二醇一甲醚相似,但是极性小,与水、醇、醚、四氯化碳、丙酮混溶低毒类,二级易燃液体对二甲苯 138.35 不溶于水,与醇、醚和其他有机溶剂混溶一级易燃液体二甲苯 138.5~141.5 不溶于水,与乙醇、乙醚、苯、烃等有机溶剂混溶,乙二醇、甲醇、2-氯乙醇等极性溶剂部分溶解一级易燃液体,低毒类间二甲苯 139.10 不溶于水,与醇、醚、氯仿混溶,室温下溶解乙睛、DMF等一级易燃液体醋酸酐 140.0邻二甲苯 144.41 不溶于水,与乙醇、乙醚、氯仿等混溶一级易燃液体N,N-二甲基甲酰胺153.0 与水、醇、醚、酮、不饱和烃、芳香烃烃等混溶,溶解能力强低毒环己酮 155.65 与甲醇、乙醇、苯、丙酮、己烷、乙醚、硝基苯、石油脑、二甲苯、乙二醇、乙酸异戊酯、二乙胺及其他多种有机溶剂混溶低毒类,有麻醉性,中毒几率比较小环己醇 161 与醇、醚、二硫化碳、丙酮、氯仿、苯、脂肪烃、芳香烃、卤代烃混溶低毒,无血液毒性,刺激性N,N-二甲基乙酰胺 166.1 溶解不饱和脂肪烃,与水、醚、酯、酮、芳香族化合物混溶微毒类糠醛 161.8 与醇、醚、氯仿、丙酮、苯等混溶,部分溶解低沸点脂肪烃,无机物一般不溶有毒品,刺激眼睛,催泪N-甲基甲酰胺 180~185 与苯混溶,溶于水和醇,不溶于醚一级易燃液体苯酚(石炭酸) 181.2 溶于乙醇、乙醚、乙酸、甘油、氯仿、二硫化碳和苯等,难溶于烃类溶剂,65.3℃以上与水混溶,65.3℃以下分层高毒类,对皮肤、黏膜有强烈腐蚀性,可经皮吸收中毒1,2-丙二醇 187.3 与水、乙醇、乙醚、氯仿、丙酮等多种有机溶剂混溶低毒,吸湿,不宜静注二甲亚砜 189.0 与水、甲醇、乙醇、乙二醇、甘油、乙醛、丙酮乙酸乙酯吡啶、芳烃混溶微毒,对眼有刺激性邻甲酚 190.95 微溶于水,能与乙醇、乙醚、苯、氯仿、乙二醇、甘油等混溶参照甲酚N,N-二甲基苯胺193 微溶于水,能随水蒸气挥发,与醇、醚、氯仿、苯等混溶,能溶解多种有机物抑制中枢和循环系统,经皮肤吸收中毒乙二醇 197.85 与水、乙醇、丙酮、乙酸、甘油、吡啶混溶,与氯仿、乙醚、苯、二硫化碳等难溶,对烃类、卤代烃不溶,溶解食盐、氯化锌等无机物低毒类,可经皮肤吸收中毒对甲酚 201.88 参照甲酚参照甲酚N-甲基吡咯烷酮 202 与水混溶,除低级脂肪烃可以溶解大多无机,有机物,极性气体,高分子化合物毒性低,不可内服间甲酚 202.7 参照甲酚与甲酚相似,参照甲酚苄醇 205.45 与乙醇、乙醚、氯仿混溶,20℃在水中溶解3.8%(wt) 低毒,黏膜刺激性甲酚 210 微溶于水,能于乙醇、乙醚、苯、氯仿、乙二醇、甘油等混溶低毒类,腐蚀性,与苯酚相似甲酰胺 210.5 与水、醇、乙二醇、丙酮、乙酸、二氧六环、甘油、苯酚混溶,几乎不溶于脂肪烃、芳香烃、醚、卤代烃、氯苯、硝基苯等皮肤、黏膜刺激性、经皮肤吸收硝基苯 210.9 几乎不溶于水,与醇、醚、苯等有机物混溶,对有机物溶解能力强剧毒,可经皮肤吸收乙酰胺 221.15 溶于水、醇、吡啶、氯仿、甘油、热苯、丁酮、丁醇、苄醇,微溶于乙醚毒性较低六甲基磷酸三酰胺(HMTA) 233 与水混溶,与氯仿络合,溶于醇、醚、酯、苯、酮、烃、卤代烃等较大毒性喹啉 237.10 溶于热水、稀酸、乙醇、乙醚、丙酮、苯、氯仿、二硫化碳等中等毒性,刺激皮肤和眼乙二醇碳酸酯 238 与热水,醇,苯,醚,乙酸乙酯,乙酸混溶,干燥醚,四氯化碳,石油醚,CCl4中不溶毒性低二甘醇 244.8 与水、乙醇、乙二醇、丙酮、氯仿、糠醛混溶,与乙醚、四氯化碳等不混溶微毒,经皮吸收,刺激性小丁二睛 267 溶于水,易溶于乙醇和乙醚,微溶于二硫化碳、己烷中等毒性环丁砜 287.3 几乎能与所有有机溶剂混溶,除脂肪烃外能溶解大多数有机物甘油 290.0 与水、乙醇混溶,不溶于乙醚、氯仿、二硫化碳、苯、四氯化碳、石油醚食用对人体无毒三、试剂极性从小到大:烷、烯、醚、酯、酮、醛、胺、醇和酚、酸(己烷-石油醚、苯、乙醚、氯仿、乙酸乙酯、正丁醇、丙酮、乙醇、甲醇、水)(学习的目的是增长知识,提高能力,相信一分耕耘一分收获,努力就一定可以获得应有的回报)。
有机物相似相溶原理比较溶解度

有机物相似相溶原理比较溶解度有机物是指由碳、氢、氧、氮、硫等元素组成的化合物。
在日常生活中,人们常常遇到有机物的相似相溶现象。
这种现象是指,相似结构的有机物在溶剂中溶解度相近或相同的现象。
有机物相似相溶原理与溶解度有着密切的关系。
有机物的溶解度与多种因素有关,比如说溶剂种类、温度、压力、溶质的结构等。
在这些因素中,溶质的结构因素是影响其溶解度的关键因素之一。
对于有机物来说,它们的结构特点决定了它们的物理化学性质,进而影响它们在不同溶剂中的相似相溶性。
有机物的结构特点有着很大的影响,其中最基本的就是它们的疏水性和亲水性。
这两个特性是决定有机物在溶液中溶解度的根本因素。
一般而言,具有疏水性的有机物可以在非极性溶剂中溶解度较高,而具有亲水性的有机物则更容易在极性溶剂中溶解。
此外,有机物还会因为它们的结构相似而在溶剂中表现出相似相溶现象。
这种现象通常出现在分子结构相似的有机物中,比如说同系列的烷基、烯基、炔基等化合物。
它们通常都具有相似的电性、极性以及分子大小和形状,因此它们在同种溶剂中的相似相溶度会非常接近,甚至相同。
相似相溶现象的出现可以让我们更方便地进行化学实验和工业生产。
在获得精确结果的同时,还可以节省化学试剂和时间成本。
此外,掌握有机物的相似相溶原理也有助于我们更深入地理解有机化学的基础原理,推动有机化学的理论研究与实际应用。
总之,有机物的相似相溶原理是指相似结构的有机物在同种溶剂中溶解度接近或相同的现象。
这种现象的出现受到有机物结构特点的影响,包括疏水性和亲水性等。
了解有机物的相似相溶原理对于化学实验和工业生产具有重要意义,同时也有助于我们深刻理解有机化学的基本原理。
二丁基醚溶解度

二丁基醚溶解度二丁基醚(di-n-butyl ether)是一种重要的有机化合物,常作为合成、萃取和提纯反应中的溶剂或提取剂。
对于溶液中二丁基醚的溶解度,其实是很重要的物理特性,下面将从多个角度探讨。
一、二丁基醚的物化性质首先需要了解的是,二丁基醚属于有机化合物,其分子式为C8H18O,外观为无色到稍黄色的液体,有刺激气味,密度为0.769 g/mL,沸点为142°C,相对分子质量为130.23 g/mol。
在室温下,二丁基醚是易挥发的透明液体,可以溶于醇、醚、芳烃等有机溶剂中,但不易溶于水。
二、影响二丁基醚溶解度的因素对于二丁基醚的溶解度,其实受到许多影响因素的影响,可以从以下几个方面来进行分析:1、温度随着温度升高,二丁基醚的溶解度会增加,因为温度升高会使得溶剂的运动速度增加,从而重力越大,分子的热运动越强烈,容易跨越能量壁垒,从而能更快进入溶液中,因而其溶解度也会随之增加,在实际应用中需要留意温度对溶解度的影响。
2、溶剂的性质溶剂的极性能对溶液的溶解度产生重要影响。
例如:在极性溶剂中,二丁基醚的溶解度通常更高。
不过值得注意的是,在高度极性的溶剂媒体中,二丁基醚的分子间相互作用力也会增加,从而使得其在溶液中的溶解度下降。
3、配合物的形成二丁基醚可以形成含有金属离子的配合物,在这种情况下,其在水中的溶解度将大大下降,而在非极性溶剂中的溶解度则会增加。
三、二丁基醚溶解度的应用1、在萃取中,二丁基醚是一种常用的有机溶剂,可以提高所需物质在有机相中的浓度,从而达到提取目的。
2、二丁基醚是无水硫酸和硝酸的重要溶剂之一,可以用于化学反应中的催化剂和萃取剂。
3、二丁基醚在化学实验中作为灵敏试剂的溶剂,例如,萃取萘类、温和反应烷基锂等,并在某些试剂中作为萃取剂调整反应条件。
总之,二丁基醚的溶解度是该有机化合物的一个重要物理特性,了解其对化学反应、萃取、提取以及合成等方面的影响有助于准确理解其在实际应用中的表现。
硫酸锂的溶解度

硫酸锂的溶解度
摘要:
一、硫酸锂的溶解度定义及影响因素
1.硫酸锂的溶解度定义
2.影响硫酸锂溶解度的因素
二、硫酸锂在不同环境下的溶解度表现
1.在水中的溶解度
2.在有机溶剂中的溶解度
三、硫酸锂溶解度的重要性及应用
1.电池行业中的应用
2.其他领域的应用
正文:
硫酸锂的溶解度是指在一定温度和压力下,硫酸锂在溶剂中达到平衡时溶解的最大量。
硫酸锂的溶解度受温度、压力、溶剂类型等多种因素影响。
硫酸锂在水中的溶解度相对较低,而在某些有机溶剂中,如甲醇、乙醇等,硫酸锂的溶解度较高。
在实际应用中,硫酸锂的溶解度特性决定了其在不同环境下的使用方法和效果。
在电池行业中,硫酸锂作为锂离子电池的重要材料,其溶解度对电池性能有着重要影响。
高溶解度的硫酸锂能提高电池的能量密度,从而提高电池的续航能力。
此外,硫酸锂在医药、陶瓷、玻璃等行业也有着广泛的应用。
总之,硫酸锂的溶解度在实际应用中具有重要意义。
对于电池行业而言,
提高硫酸锂的溶解度是提高电池性能的关键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机溶剂溶解度相对理论溶剂不仅用来溶解树脂、降低粘度以改善加工性能和施工性能,而且还影响涂料的粘结性、防腐性、户外耐久性及涂膜的表观性(起泡、流挂、流平等),因此,通过溶剂的选用可以改善涂料的某一或某几方面的性能。
第一节溶剂的类型按氢键强弱和形式,溶剂可分为三种类型:1)弱氢键溶剂:主要包括烃类和氯代烃类溶剂,烃类溶剂又分为脂肪烃芳香烃。
常用的有:石脑油、200#溶剂油、甲苯、二甲苯、三氯乙烷等。
2)氢键接受型溶剂:主要指酮类和酯类。
酮类比酯类便宜,但后者气味芳香。
常用的有:丁酮、丙酮、环己酮、甲苯异丁基酮、异佛尔酮、醋酸乙酯、醋酸丁酯、醋酸异丙酯、醋酸-2-丁氧基乙酯等。
第七章溶剂和溶解理论3)氢键授受型溶剂:主要为醇类溶剂。
常用的有:甲醇、乙醇、异丙醇、正丁醇、乙二醇、丙二醇、二甘醇单丁基醚等。
1,溶解理论:溶解力溶剂的溶解力是指溶剂溶解成膜物质而形成高分子聚合物的能力。
低分子化合物在溶剂中的溶解可用溶解度的概念来描述。
如蔗糖,食盐在水中的溶解,其机理是溶剂和溶质分子或离子间的吸引力,而使溶质分子逐渐离开其表面,并通过扩散作用均匀地分散到溶剂中去成为均匀溶液。
高分子化合物在溶剂中的溶解则大体上可分为溶胀阶段和全部溶剂化两个阶段。
接触溶剂表面的分子链最先溶剂化-------使高分子化合物内部溶剂化--------溶剂化程度逐渐增加---全部溶剂化。
2,溶剂和溶解理论可以看出,溶剂对高分子聚合物溶解力的大小,溶解速度的快慢,主要取决于溶剂分子和高聚合物分子的亲和力所决定的溶剂向高聚物分子间隙中扩散的难易程度。
二、极性相似原则3,溶剂和溶解理论(1)非极性分子四氯化碳没有电性的不对称、偶极矩为0 称为非极性物质。
(2)极性分子甲醇羟基显电负性而甲基显电正性,分子中电性分布不对称,偶极矩不为0 ,称为极性物质。
偶极矩数值越大,极性越大。
(3)极性分子的缔合规律:非极性溶质溶于非极性或弱极性溶剂中,极性溶质溶于极性溶剂中,即“同类溶解同类”------这就是极性相似原则的核心。
比如,乙醇是极性的,能够溶解于极性的水;而苯是非极性的,不和水相混溶;硝基纤维素是极性的,能够溶解于极性的酯和酮,而不溶解于非极性或弱极性的烃类化合物。
这个规律仅仅是从定性的方面来说明溶质与溶剂之间的关系,比较准确的方法是要考虑溶解度参数。
4,溶剂和溶解理论:溶解度参数相近的原则 1、溶解度参数的定义和物理意义溶解度参数是内聚能密度的平方根,它是分子间力的一种量度。
数字表达式为:δ=(△E/V)1/2 δ——溶解度参数(J/M3)1/2 、或(Cal/CM3)1/2 △E——每摩尔物质的内聚能 V——摩尔体积(1 Cal/CM3)1/2=2.046×10 3(J/CM3)1/2 如果以A——溶剂、B——溶质 FAA——溶剂分子间的自聚力。
FBB——溶质分子见的自聚力。
FAB ——溶剂和溶质分子间的相互作用力。
5,溶剂和溶解理论:当 FAA>FAB 或FBB>FAB 时,则不相溶。
当FAB >FAA 或 FAB >FBB 时,则溶质可以溶解在溶剂中。
实践证明:当作用于溶剂分子与溶质分子间的作用力相等时,最容易实现自由混溶,或者说,当溶剂和溶质的溶解度参数相同时,溶质便可以在溶剂中溶解。
所以,δ 是表征物质溶解性的一个物理量。
对于高分子物质体系,通常│δA -δB│<1.3--1.8 时,就可以估计为能够溶解,当然这个差值越小越好。
2 。
溶解度参数的确定(1)溶剂和混和溶剂溶解度参数a、单一溶剂溶解度参数可以从表中查得------涂料工业上常用有机溶剂溶解度参数及氢键值表。
6,溶剂和溶解理论:混合溶剂溶解度参数可以通过计算求出:δ mix =Ψ 1δ 1+Ψ 2δ 2+Ψ 3δ 3+?+Ψ nδ n 式中Ψ ——各组分的体积分数。
δ ——各组分溶解度参数。
例一、已知二甲苯的δ 1=8.8 、γ -丁丙酯的δ 2=12.6。
若以体积分数计、配制成33%二甲苯和67% γ -丁丙酯的混合溶剂,其δ mix 是多少?解:δ mix =Ψ 1δ1+Ψ 2δ 2 = 0.33×8.8 + 0.67×12.6 =10.6。
(2)高分子聚合物溶解度参数高聚物与溶剂不同,它们是不挥发性物质,可以通过实验对比的方法测得高聚物的δ值。
在涂料工业中常用树脂溶解度参数可以通过查表来确定——涂料中常用树脂溶解度参数表。
7,溶剂和溶解理论:溶解度参数的应用①依据溶解度参数相同或相近可以互溶的原则,判断树脂在溶剂(或混合溶剂)中,是否溶解。
例二、聚苯乙烯的δ1=8.5--9.3 聚醋酸乙烯树脂的δ2平均值为 9.4。
试问:前者在丁酮(δ丁酮=9.3)中,后者在苯、甲苯及氯仿中可否溶解?解:│δ1 –δ2│=│ 9.3-(8.5-9.3)│=(0--0.8)<(1.3-1.8)则聚苯乙烯在丁酮中可以溶解。
δ苯=9.3、δ甲苯 =8.9、δ氯仿=9.7 │δ苯–δ2│=│9.3-9.4│=0.1<1.3∽1.8 │δ苯–δ2│=│8.9-9.4│=0.5<1.3∽1.8 │δ苯–δ2│=│9.7-9.4│=0.3<1.3∽1.8 聚醋酸乙烯树脂在这三种溶剂中均可溶解。
8,溶剂和溶解理论:环己酮、甲基-酮、甲基-丁基酮溶剂,那种能溶解氯乙烯-醋酸乙烯共聚树脂?解:查表:δ环己酮=9.9、δ甲基=10.6、δ丁基=8.5、δ共聚 =10.5 环己酮│δ1 –δ2│=│9.9-10.5│=0.6<1.3∽1.8 苯基酮│δ1 –δ2│=│10.6-10.5│=0.1<1.3∽1.8 丁基酮│δ1–δ2│=│8.6-10.5│=2>1.3∽1.8 在丁基酮中不溶,与苯基酮的混溶性好。
9,溶剂和溶解理论:天然橡胶的δ 平均值=8.2,正己烷的δ =7.8,可以溶解天然橡胶,若加入适量的甲醇,可以使其溶解增强,试求甲醇的最佳加入量是多少?设:混合溶剂中甲醇所占的体积分数为X,则正己烷体积分数为1-X。
δ 甲醇=14.6,则混合溶剂的δ mix=(1-X)*7.8+X*14.6= 8.2(橡胶) X=0.125。
②依据溶解度参数相同或相近原则预测两种溶剂的互溶性。
10,溶剂和溶解理论:依据溶解度参数可以估计两种或两种以以上树脂的互溶性。
若几种树脂溶解度参数(或溶解度参数平均值)彼此相同或相差不大时,那么这几种树脂可以互溶,这对于预测几种树脂的混合溶液的贮存稳定性和固体涂膜的物化性质有理论及实用价值。
④判断涂膜的耐溶解性如果涂膜中成膜物的δ和某一溶剂(或混合溶剂)的δ 值相差较大,则该涂膜对该溶剂而言就有较好的耐溶剂性。
⑤利用溶解度参数相同或相近可以互溶的原则,选择增塑剂。
如果增塑剂与溶剂和树脂的δ值相近,那么该增塑剂就可用于该树脂和该溶剂之中,增塑剂溶解度参数可查表 ---常用增塑剂溶解度参数值表。
11,溶剂和溶解理论:利用溶解度参数可以在研制塑料漆过程中选用适当的树脂和溶剂。
要求:δ 树脂与δ 塑料尽量接近,以获得较好的附着力;δ 溶剂与δ 塑料相差越大越好,以免使塑料被咬起或起皱;δ 树脂与δ 塑料增塑剂相差越大越好,以保证增塑剂不渗析。
溶解度参数值可查表。
四.粘度在涂料生产中,不仅要求树脂能溶解在溶剂中,而且还要求相同固体含量的树脂溶液粘度越低越好。
这样当达到相同的施工粘度时,漆液的固体含量较高,这样可提高施工效率,而挥发到大气中的溶剂量较小,同时漆液干燥速度快。
12,溶剂和溶解理论:单一溶剂的粘度可由常用溶剂的粘度表中查得。
通通常树脂溶于溶剂所形成的树脂溶液的粘度比单一溶剂的粘度要高出几十倍甚至上百倍。
树脂溶液和溶剂的粘度关系可表示为Lnη 溶液=Lnη 溶剂+K(常数)。
比如甲基异丁基酮的粘度是0.55 mpa·s而其溶液的粘度可达到110 mpa·s 。
增加200倍;甲苯的粘度是0.59mpa·s,其溶液的粘度可达367mpa·s,增加622倍。
其原因可以从两方面来说明: (1)涂料用树脂多数是极性的和含有带氢键的基团如羟基,羧基等,这些基团的存在使树脂分子间倾向于互相缔合,大大增加了溶液的粘度。
13,溶剂和溶解理论:溶剂对单个树脂分子热力学体积的影响。
溶剂与树脂之间作用越强,则热力学体积越增大,粘度就越高。
2、混合溶剂的粘度混合溶剂的粘度可根据组分中各种单一溶剂的粘度计算而得。
溶剂(包括混合溶剂)与溶液粘度的关系,取决于树脂的分子量,树脂分子中极性基团的数目以及溶剂—树脂分子之间的相互作用等因素。
挥发速率溶剂的挥发速率是影响涂膜质量的一个重要因素,如果溶剂挥发太快,涂膜既不会流平,也不会充分润湿基材,因而不能产生很好的附着力;如果溶剂挥发太慢,不仅要长时间才能固化,而且涂膜会流挂或流淌而影响施工质量。
14,第七章溶剂和溶解理论:单一溶剂的挥发单一溶剂的挥发主要受,温度,蒸气压,表面积/体积及表面空气的流动速度等因素的影响。
溶剂的挥发速度通常以对醋酸正丁酯为标准溶剂的相对挥发速度来表示 E= t90(醋酸正丁酯) /t90(待测溶剂) t90表示90%的溶剂挥发所需要的时间,醋酸正丁酯的相对挥发速度定义为1,实验条件为25℃,空气流动速度为5L/min ,将0.7ml待测溶剂滴在滤纸上。
滤纸放置在平衡盘上并在封闭容器中测定90%重量的溶剂挥发所需要的时间。
一些溶剂的相对挥发速度可查表。
15,溶剂和溶解理论:混合溶剂的挥发混合溶剂的相对挥发速率可以通过体积分数(Ψ),活性系数(X)和单一溶剂的相对挥发速度(E)来测算: E总 = (Ψ XE)1+(Ψ XE)2+?+(Ψ XE)n 活性系数x是混合溶剂中不同组分之间相互作用的量度,其值随混合溶剂中各溶剂组分的类型及浓度而变化。
一般可以从活性系数图上查出按溶剂类型(烃类溶剂,酯类/酮类溶剂,醇类/)和溶液浓度分类的溶剂的活性系数。
16,溶剂和溶解理论:某硝化纤维素溶液的溶剂配方的体积百分浓度为醋酸正丁酯35%。
(E=1);甲苯5%(E=2.0);乙醇10% (E=1.7)及正丁醇5%(E=0.4),试计算该混合溶剂的相对挥发速率。
解、首先从活性系数图上查出各组分溶剂的活性系数X。
醋酸正丁酯X=1.6、乙醇 X=3.9、甲苯X=1.4、正丁醇 X=3.9、然后代入公式进行计算。
E总=(0.35×1.6×1.0)+(0.5×1.4×2.0)+ (0.1×3.9×1.7)+(0.05×3.9×0.4)=2.7317,溶剂和溶解理论:涂膜溶剂的挥发在涂料中,溶剂的挥发可分为两个阶段。
