物理化学傅献彩第四章多组分体系
大学物理化学公式总结(傅献彩_南京大学第五版)

热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=VT p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。
傅献彩《物理化学》第5版笔记和课后习题含考研真题详解(多组分系统热力学及其在溶液中的应用)【圣才出品

令 kb
R(Tb* )2MA
Δ
fus
Hห้องสมุดไป่ตู้
θ m,A
,则有
Tb kbmB
式中,kb 称为沸点升高系数,只与溶剂的性质有关。
3.渗透压 渗透压Π求解公式为
cBRT
式中,cB 为溶质的浓度,该式仅适用于稀溶液。
六、活度与活度因子(见表 4-1-2) 表 4-1-2 活度与活度因子
5 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:(1)质量摩尔浓度
mB
nH2SO4 W水
0.0947 0.1/ 0.09808 molkg1 (1 0.0947) 0.1
1.067molkg1
(2)物质的量浓度
cB
nB V
mB / M B m溶液 / B
0.0947 0.1kg / 0.09808kgmol-1 0.1kg /1.0603103 kgm3
2 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
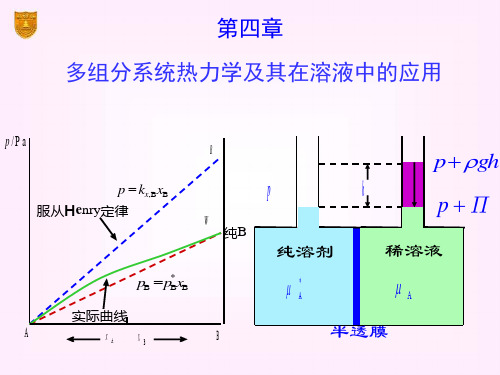
三、稀溶液中的两个经验定律
1.Raoult 定律
pA
p
A
x
A
2.Henry 定律
pB kx,B xB
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
四、理想液态混合物的通性
(1)应加入水的体积; (2)加水后,能得到含乙醇的质量分数为 0.56 的酒的体积。
8 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
已知该条件下,纯水的密度为 999.1 kg·m-3,水和乙醇的偏摩尔体积为 表 3-2-1
解:(1)先计算 10.0m3 的含乙醇 0.96 的酒中水和乙醇的物质的量。
(NEW)傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解

目 录第1章 气 体1.1 复习笔记1.2 课后习题详解1.3 名校考研真题详解第2章 热力学第一定律2.1 复习笔记2.2 课后习题详解2.3 名校考研真题详解第3章 热力学第二定律3.1 复习笔记3.2 课后习题详解3.3 名校考研真题详解第4章 多组分系统热力学及其在溶液中的应用4.1 复习笔记4.2 课后习题详解4.3 名校考研真题详解第5章 相平衡5.1 复习笔记5.2 课后习题详解5.3 名校考研真题详解第6章 化学平衡6.1 复习笔记6.2 课后习题详解6.3 名校考研真题详解第7章 统计热力学基础7.1 复习笔记7.2 课后习题详解7.3 名校考研真题详解第8章 电解质溶液8.1 复习笔记8.2 课后习题详解8.3 名校考研真题详解第9章 可逆电池的电动势及其应用9.1 复习笔记9.2 课后习题详解9.3 名校考研真题详解第10章 电解与极化作用10.1 复习笔记10.2 课后习题详解10.3 名校考研真题详解第11章 化学动力学基础(一)11.1 复习笔记11.2 课后习题详解11.3 名校考研真题详解第12章 化学动力学基础(二)12.1 复习笔记12.2 课后习题详解12.3 名校考研真题详解第13章 表面物理化学13.1 复习笔记13.2 课后习题详解13.3 名校考研真题详解第14章 胶体分散系统和大分子溶液14.1 复习笔记14.2 课后习题详解14.3 名校考研真题详解第1章 气 体1.1 复习笔记一、气体分子动理论1.理想气体理想气体:在任何压力、任何温度下都符合理想气体状态方程pV=nRT 的气体。
理想气体状态方程中,p为气体压力,单位是Pa;V为气体的体积,单位是m3;n为物质的量,单位是mol;T为热力学温度,单位是K;R是摩尔气体常数,。
2.气体分子动理论的基本公式(1)气体分子运动的微观模型①气体是大量分子的集合体;②气体分子不断地作无规则的运动,均匀分布在整个容器之中;③分子彼此的碰撞以及分子与器壁的碰撞是完全弹性的。
傅献彩版物理化学笔记

《物理化学》笔记第一章热力学第一定律二、热力学平衡n 如果体系中各状态函数均不随时间而变化,我们称体系处于热力学平衡状态。
严格意义上的热力学平衡状态应当同时具备三个平衡:2. 机械平衡:n 体系的各部分之间没有不平衡力的存在,即体系各处压力相同。
§2、热力学第一定律n 对于宏观体系而言,能量守恒原理即热力学第一定律。
n 热力学第一定律的表述方法很多,但都是说明一个问题¾能量守恒。
例如:一种表述为:n “第一类永动机不可能存在的”n 不供给能量而可连续不断产生能量的机器叫第一类永动机。
一、热和功热和功产生的条件:n 与体系所进行的状态变化过程相联系,没有状态的变化过程就没有热和功的产生。
符号表示:n 功W:体系对环境作功为正值,反之为负值。
n 热Q:体系吸热Q为正值,反之Q为负值。
二、热力学第一定律的数学表达式DU = Q-W (封闭体系)•如果体系状态只发生一无限小量的变化,则上式可写为:dU = dQ-dW (封闭体系)例1:设有一电热丝浸于水中,通以电流,如果按下列几种情况作为体系,试问DU、Q、W的正、负号或零。
(a)以电热丝为体系;(b)以电热丝和水为体系;(c)以电热丝、水、电源和绝热层为体系;(d)以电热丝、电源为体系。
解答:DU Q W(a)+ --(b)+ --(c)0 0 0(d)--0三、膨胀功(体积功):Wen 功的概念通常以环境作为参照系来理解,微量体积功dWe可用P外×dV表示:dWe = P外×dV式中P外为环境加在体系上的外压,即环境压力P环。
n 不同过程膨胀功:u (1)向真空膨胀We = P外×DV = 0u (2)体系在恒定外压的情况下膨胀We = P外×DVu (3)在整个膨胀过程中,始终保持外压P外比体系压力P小一个无限小的量dP此时,P外= P-dP,体系的体积功:We =∫V1V2 P外·dV =∫V1V2 (P-dP)dV= ∫V1V2 P dV此处略去二级无限小量dP·dV,数学上是合理的;即可用体系压力P代替P外。
854物理化学考试大纲

南昌大学硕士研究生入学考试初试科目考试大纲科目代码、名称: 854 物理化学适用专业: 070304物理化学一、考试形式与试卷结构(一)试卷满分及考试时间本试卷满分为150分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
试卷由试题和答题纸组成;答案必须写在答题纸相应的位置上。
(三)试卷题型结构选择题:10题,每小题1分,共10分填空题题:5题,第1、3题及第2题的第一空每空2分,其余每空1分,共15分计算题:6题,除一题25分,其余每题均为20分,共125分二、考查目标(复习要求)全日制攻读硕士学位研究生入学物理化学科目考试要求考生系统掌握本学科的基本知识、基础理论和基本方法,并能运用相关理论和方法分析、解决化学实验和工业生产中的实际问题。
三、考查范围或考试内容概要第一章气体(不考)第二章热力学第一定律1.掌握功、焓、热容、内能等基本概念及其相关公式2.热力学第一定律3.理想气体和实际气体的热力学能和焓的变化4.绝热过程方程式及功5.Carnot循环6.Joule-Thomson效应7.化学反应中的热效应。
第三章热力学第二定律1.热力学第二定律2.Carnot定理3.熵及其相关计算4.Gibbs自由能、Helmholtz自由能及其计算5.热力学基本关系式及其应用6.利用热力学判据判断过程的方向和限度7.热力学第三定律第四章多组分系统热力学及其在溶液中的应用1.多组分系统组成表示方法2.偏摩尔量的加和公式3.稀溶液中的两个经验定律4.不同状态下各组分的化学势表达式及某些符号的物理意义5.稀溶液的依数性及相关计算。
第五章相平衡1.相、组分、自由度、相律等基本概念2.Clausius-Clapeyron方程及相关计算3.单组分、二组分、三组分相图。
第六章化学平衡1.化学平衡定义及平衡条件2.在等温等压条件下反应方向的判据3.平衡常数的表达式4.影响平衡移动的因素及其相关计算。
第七章统计热力学基础(不考)第八章电解质溶液1.法拉第定律2.离子的电迁移和迁移数3.电解质的导电能力(电导、电导率、摩尔电导率)4.电解质的活度及活度因子5.徳、拜-休克尔极限公式6.强电解质溶液理论。
1物理化学-傅献彩版-知识归纳2-6章

∂T ∂T第二章 热力学第一定律1.热力学第一定律 热力学第一定律的本质是能量守恒定律,对于封闭系统,其数学表达式为∆U = Q + W微小过程变化: d U = δ Q + δW只作体积功: d U = δ Q - p e d V理想气体的内能只是温度的函数。
2. 焓和热容由于大多数化学反应是在等压下进行的,为了方便,定义 一个新的函数焓:H = U + pV焓是状态函数,是广度性质,具有能量单位,本身没有物理意义,在等压下没有非体积 功的热效应等于焓的改变量。
等容热容: C V等压热容: C p= δ Q V d Tδ Q= pd T ∂UV∂Hp对于理想气体: C p - C V = nR3. 理想气体各基本过程中W 、 Q 、 ∆U 、 ∆H 的计算= =4. 焦耳-汤姆逊系数μ = ∂T = - 1∂H∂p H5. 热效应的计算C p ∂p T不做非体积功的等压过程: Q p = ∆H不做非体积功的等容过程: Q V = ∆U化学反应等压热效应与等容热效应的关系: Q p - Q V = (∆n g )RT由标准摩尔生成焓求标准摩尔反应焓变: ∆r H m =∑υB∆fHm(B )由标准摩尔燃烧焓求标准摩尔反应焓变: ∆r H mB= -∑υB∆cHm (B )6. 基尔霍夫定律T 2 ∆r H m (T 2 ) = ∆r H m (T 1 ) + ⎰ B∆r C p d TT 1第三章热力学第二定律1. 热机效率η = WQ h可逆热机的效率:η = 1-T cT hCarnot 定理:ηir ≤ ηr2. 热力学第二定律的数学表达式——Clausius 不等式B∆S A →B - ∑ δ Q i ≥ 0T i =Ai3. Helmholtz 自由能和 Gibbs 自由能A = U - TSG = H - TS = U + pV - TS = A + pV4. 体系变化方向判据 熵判据:对于绝热体系 d S ≥ 0 ;Helmholtz 自由能判据:等温等容条件下不做非膨胀功 d A ≤ 0Gibbs 自由能判据:等温等压条件下不做非膨胀功 d G ≤ 05. 热力学函数的基本关系式 组成恒定(无相变、无化学变化),不做非体积功的封闭系统的热力学基本方程6. Gibbs-Helmholtz 方程ƒ ⎰ ϒ ∂ ∆G / ϒ ∂ ∆A / ' T ∞ ∆H ' T ∞ ∆U ' ∞ =- , ' ∞ =- ' ∂T∞ ≤' ∞ pT 2' ∂T ∞ T 2'≤ ∞ p7. 一些基本过程的 ∆S , ∆A , ∆G 的计算∆ S 的计算(1)理想气体单纯 pVT 过程的计算d S =δ Q rT = d U - δW rTnC d T - p d V= V,mT积分结果:∆S = nC V ,mln T 2 + nR ln V 2= nCp ,m T 1 V 1 ln T 2 nR ln p1T 1 p 2特例:恒温过程: ∆S = nR ln V 2 = nR ln p 1V 1 p 2恒容过程:恒压过程: ∆S = nC V ,m ∆S = nC p ,mln T 2T 1 ln T 2T 1nC (2)恒容过程: ∆S = V ,md TT(3) 恒压过程:nC p ,m∆S = ⎰Td T (4) 相变过程:可逆相变 ∆S = ∆H / T(5) 环境过程:认为是恒温的大热源,过程为可逆∆S = Q 环 / T 环 = -Q 体系 / T环(6)绝对熵的计算:利用热力学第三定律计算的熵为绝对熵,过程通常涉及多个相变过程, 是一个综合计算过程。
物理化学 傅献彩 第四章 多组分体系

第四章补充题:气体的状态方程为p V m (1-βp )=RT ,求其逸度的表示式。
解 B B B (g)(g)ln f RT p μμ⎛⎫=+ ⎪⎝⎭$$ T 一定时,ln d RT f μ=⎰-==p dp pf RT RT 0ln ln αγ ⎪⎪⎭⎫ ⎝⎛--=--=-=)1(11)1(p p p RT p p RT p RT V V re mid m ββα dp p p pp f p ⎰⎥⎦⎤⎢⎣⎡---=0)1(11ln β dp p p p p ⎰⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+--=0111ββ )1l n (10p dp pp βββ--=-=⎰ p p f β-=11 或 pp f β-=1 引申:对于范德华气体则有1、在298K 时,有0.10kg 质量分数为0.0947的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度m B ;(2)物质的量浓度c B 和(3)摩尔分数x B 来表示硫酸的含量。
已知在该条件下,硫酸溶液的密度为1.0603×103kg .m -3,纯水的密度为997.1kg .m -3。
解:m (B)= w B × = 0.0947×0.10kg =0.00947kg=9.47gn B = m (B)/M B =9.47/98.079=0.09655molm (A)= - m (B)= 0.10×(1-0.0947)=0.09153kg=91.53g n A = m (A)/M A =91.53/18.015=5.080766mol(1) m B =n B /m (A)= 0.09655/0.09153=1.055mol.kg -1(2) V 溶液= /ρ=0.10/(1.0603×103)=0.0943×10-3 m 3=0.0943dm 3 c B =n B /V=0.09655/0.0943=1.024mol.L -1(3) x B = n B / =0.09655/(0.09655+5.08076)=0.01864∑AA m ∑AA m ∑AA m ∑AA n2、在298K和大气压力下,含甲醇(B)的摩尔分数x B为0.458的水溶液的密度为0.8946kg.dm-3,甲醇的偏摩尔体积V B=39.80cm3.mol-1,试求该水溶液中水的偏摩尔体积V A。
(完整版)傅献彩物理化学主要公式及使用条件总结

第一章 气体的pVT 关系1. 理想气体状态方程式nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物 (1) 组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ϕ∑*AV y A m ,A式中∑AA n 为混合气体总的物质的量。
A m,*V 表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2) 摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中 ∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3) V V p p n n y ///B B B B *===式中pB 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3. 道尔顿定律p B = y B p ,∑=BB p p 适用于任意气体。
V RT n p /B B = 适用于理想气体4. 阿马加分体积定律V RT n V /B B =* 此式只适用于理想气体。
5. 范德华方程RT b V V a p =-+))(/(m 2m nRT nb V V an p =-+))(/(22式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。
物理化学 傅献彩版 知识归纳

−
E kT
⎞ ⎟⎠
dE
代表分子能量介于
E
~
(E + dE)
之间的分子
占总分子数的分数。
N E1→∞ N
=
exp
⎛ ⎜⎝
−
E1 kT
⎞ ⎟⎠
代表能量超过
E1
的分子占总分子数的分数。
N E2 →∞ N E1→∞
=
exp
⎛ ⎜⎝
−
E2 − kT
E1
⎞ ⎟⎠
代表能量超过
E2
与能量超过
E1
的分子数的比值。
最概然速率: vm =
诀窍:题目若要计算 ∆A ,一般是恒温过程;若不是恒温,题目必然会给出绝对熵。
∂V ∂T
⎞ ⎟⎠ p
6. Gibbs-Helmholtz 方程
5
乐山师范学院 化学与生命科学学院
⎡ ⎢ ⎢
∂
⎛ ⎜⎝
∆G T
⎞ ⎟⎠
⎤ ⎥ ⎥
=
−
∆H
,
⎡ ⎢ ⎢
∂
⎛ ⎜⎝
∆A ⎞ ⎤
T
⎟⎠
⎥ ⎥
= − ∆U
⎢ ∂T ⎥
T 2 ⎢ ∂T ⎥
T2
⎢⎣
⎥⎦ p
⎢⎣
⎥⎦ p
7. 一些基本过程的 ∆S, ∆A, ∆G 的计算
⎞ ⎟
(3β
⎠
−1)
=
8τ
8. 压缩因子
Z = pVm = pV RT nRT
若 Z > 1 ,表明在同温同压下,实际气体的体积大于理想气体的体积,即实际气体难于 压缩。若 Z < 1 ,则情况相反。先求对比压力和对比温度,查压缩因子图得到压缩因子,
物理化学(傅献彩著)04章 多组分系统热力学
偏摩尔量 (partial molar quantity)
偏摩尔量:在等温、等压条件下,在大量的定组成 系统中,加入单位物质的量的B物质所引起广度性 质Z的变化值。
或在等温、等压、保持B物质以外的所有组分 的物质的量不变的有限系统中,改变 d n B 所引起广 度性质Z的变化值。
xB def
nB nA
A
单位为1
即B的物质的量与混合物总的物质的量之比,又称为 物质的量分数 (amount of substance concentration of B)。
气态混合物中摩尔分数常用 y B 表示
溶液的组成表示法
1. 溶质B的质量摩尔浓度(molality of solute B) mB
ZB称为物质B的某种容量性质 Z 的偏摩尔量
Z* m ,B
代表纯物的摩尔量
代入下式并整理得:
dZBk=1(nZB)T,p,nc(cB)dnB
k
Z 1 d n 1 Z 2 d n 2 Z k d n k ZBdnB B=1
常见的偏摩尔量定义式
VB def
V n B T,p,nC(CB)
➢ 任何偏摩尔量都是T,p和组成的函数。
偏摩尔量的加和公式
按偏摩尔量定义:
Z ZB (nB)T,p,nc(cB)
k
则 d Z Z 1 d n 1 Z 2 d n 2 Z k d n k ZBdnB
B=1
在保持偏摩尔量不变的情况下,对上式积分
Z Z 10 n 1 d n 1 Z 20 n 2 d n 2 Z k0 n k d n k
mB def
nB m(A)
2024版傅献彩物理化学电子教案课件

01绪论Chapter物理化学概述物理化学的定义01物理化学的研究范围02物理化学在化学科学中的地位03物理化学的研究对象与任务研究对象研究任务实验方法通过实验手段观测和记录物质的物理现象和化学变化,获取实验数据。
理论方法运用数学、物理学等理论工具对实验数据进行处理和分析,揭示物质的基本规律。
计算方法利用计算机模拟和计算等方法,对物质的性质、结构和变化规律进行预测和研究。
物理化学的研究方法030201物理化学的学习方法与要求学习方法学习要求02热力学基础Chapter热力学基本概念与术语热力学系统状态与状态函数过程与途径热力学平衡态热力学第一定律能量守恒定律能量不能创造也不能消灭,只能从一种形式转化为另一种形式。
热力学能系统内能的变化等于传入系统的热量与外界对系统做功之和。
焓定义为系统的热力学能与体积的乘积,用于描述等压过程中的能量变化。
热力学第二定律热力学第二定律表述热力学温标熵增原理热力学函数与基本方程热力学函数热力学基本方程麦克斯韦关系式热力学在化学中的应用化学反应的热效应化学平衡相平衡03化学动力学基础Chapter化学反应速率的概念与表示方法化学反应速率表示方法摩尔浓度变化率、质量浓度变化率、气体分压变化率等化学反应速率理论简介碰撞理论过渡态理论01020304浓度越高,反应速率越快。
反应物浓度温度越高,反应速率越快。
温度催化剂可以降低反应的活化能,从而加快反应速率。
催化剂对于有气体参与的反应,压力的变化会影响反应速率。
压力影响化学反应速率的因素复杂反应动力学简介平行反应竞争反应连续反应根据反应条件(如温度、压力、浓度等)预测反应的速率。
预测反应速率通过调整反应条件(如温度、压力、催化剂等)来优化反应速率和选择性。
优化反应条件通过分析反应速率与各种因素的关系,可以推断出反应的机理和过渡态的性质。
研究反应机理化学反应速率理论的应用04电化学基础Chapter电化学基本概念与术语电化学电极电解质电离电导率将化学能转变为电能的装置。
《物理化学》第五版-(傅献彩主编)复习题答案--(全)

微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享1
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享2
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享11
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享12
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享
第十一章 表面现象
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享45
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享46
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 第三章 热力学第二定律
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享9
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享10
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享13
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享
物理化学上 傅献彩 期末填空复习

一章二 . 填空题:1. 对于任何宏观物质,其焓 H 一定 _______ 内能 U,(填上>、<、=) 因为_________;对于等温理想气体反应,分子数增多的△H 一定 _________ △U,因为____________ 。
2. 选择“>”,“<”,“=”中的一个填入下列空格:理想气体恒温可逆压缩△U ______ 0,△H ______ 03. 实际气体符合理想气体行为的条件是在 __________________ 温度时,该气体的[☯(PV)/ ☯P]T , P→0 的值应等于 ________________ 。
4. 在横线上填上>、<、=或?(?代表不能确定)氢气和氯气在绝热刚性容器中反应,则(A) W ____ 0 (B) △U ____ 0 (C) △H ____ 0 (D) △H ____ Q5. 在一绝热刚性容器中进行某一化学反应,该体系的内能变化为 ______ ,焓变化为 _______ 。
6. 300K 时将 2mol Zn 片溶于过量的稀硫酸中,若反应在敞口容器中进行时放热Q p,在封闭刚性容器中进行时放热 Q v,则 Q v- Q p= _______ J。
7. 已知反应 2H2(g) + O2 (g) → 2H2O(l) 在 298K 时恒容反应热Q v= -564 kJ.mol-1,则 H2 (g) 在 298K 时标准摩尔燃烧焓:△c H m= _______ kJ.mol-1。
8. 300K 时 0.125 mol 正庚烷(液体)在弹式量热计中完全燃烧,放热 602kJ,反应 C7H16 (l) + 11O2 (g) = 7CO2 (g) + 8H2 O(l) 的△r U m= _____________,△r H m = _____________ 。
(RT ≈ 2.5 kJ)9. 当一个化学反应的 ____________ 等于零时,该反应的热效应就不受温度影响。
湖北大学2024年研究生招生考大纲 815物理化学

《物理化学》课程考试大纲考试内容及要求涉及下列范围,不指定教材,下列各章标题系参考:傅献彩,沈文霞,姚天扬等编:《物理化学》(第五版),高等教育出版社,2006年,但不限于此教材。
第二章 热力学第一定律1.了解热力学的内容、方法和特点。
2.理解并掌握热力学的基本概念:体系、环境、热力学平衡态、状态函数、过程与途径、体系的性质、功、热、能等。
3.明确体系的内能、焓、热容的意义。
4.明确热力学第一定律的意义及其表示法:熟知功与热的符号惯例,从微观上了解热力学第一定律的本质。
5.明确准静态过程,可逆过程和热力学平衡态的意义,以及最大功的概念。
6.较熟练地应用热力学第一定律计算理想气体在等温、等压、等容、绝热等过程和卡诺循环的ΔU、ΔH、W和Q。
7.能较熟练地应用生成焓、燃烧焓来计算反应热,学会用键焓估算反应热的方法;8.明确Hess定律与Kirchhoff定律的意义,并学会这两个定律的应用;9.了解Carnot循环的意义以及理想气体在诸过程中热、功的计算。
第三章 热力学第二定律1.了解自发过程的特征,明确热力学第二定律的意义及其表述;2.了解热力学第二定律与Carnot定理的联系,理解从卡诺定理定理导出熵函数的逻辑推理和克劳修斯不等式的重要意义;3.明确熵函数概念及其微观统计意义,并熟记G和A的定义;4.了解体系各热力学函数间的基本关系;5.较熟练地计算一些简单过程的ΔS、ΔH、ΔA和ΔG;6.明确熵判据和吉布斯自由能判据的条件及它们之间的关系;7.学会处理ΔG与温度的关系;8.了解热力学第三定律的基本内容,明确规定熵的意义、计算及其运用;9.初步了解不可逆过程关于熵流和熵产生等基本知识。
第四章 多组分体系热力学及其在溶液中的应用1.熟悉溶液组成的各种表示法及其相互关系;2.明确偏摩尔量和化学势的意义及其区别,了解这两个概念在多组分体系重要性;3.理解拉乌尔定律和亨利定律,认识它们在溶液热力学中的作用;4.理解理想液态混合物的意义,熟悉理想液态混合物的特性;5.了解逸度与活度的概念,学会运用蒸汽压法求活度和活度系数;6.熟悉气体、溶液各组分化学势的公式;7.熟悉物质在混合气体、溶液中标准态和参考态的选取,认识相对活度与标准态或参考态的关系;8.认识稀溶液的依数性,理解各依数性公式的推导方法;9. 了解分配定律的热力学基础及其应用。
物理化学傅献彩[整理版]
![物理化学傅献彩[整理版]](https://img.taocdn.com/s3/m/88c2377dae1ffc4ffe4733687e21af45b207fe41.png)
物理化学傅献彩参考书目:1) 《物理化学》(第四版)傅献彩等编,高等教育出版社1990年版;2) 《物理化学》(第三版)王正烈等编,高等教育出版社1988年版一、考试要求:闭卷考试,书写规范、工整,所有答案均写在答题纸上,否则无效。
二、考试内容:1)气体p-V-T性质:a: 理解理想气体模型、实际气体和理想气体p-V-T性质的差别。
b: 掌握理想气体状态方程、范德华方程、分压、分容概念及应用、气体液化与临界性质、临界参数、对比参数、对应状态原理、压缩因子等概念。
2)热力学第一定律:a: 理解系统和环境、状态和状态性质、过程和途径、可逆过程、功和热的概念。
b: 掌握热力学第一定律、焓、Cp、Cv、、、相变焓等重要概念以及、与温度关系的重要关系式。
熟练掌握单纯pVT变化过程、相变过程、化学反应过程的Q、W、、的计算。
c: 会设计过程计算复杂情况下的热、功、温度、热力学能及焓的变化。
d: 掌握化学反应焓、相变焓和温度的关系、热力学第一定律对理想气体的应用、节流过程特点。
知道溶解焓、稀释焓、离子生成焓的概念。
3)热力学第二定律:a: 掌握卡诺循环、热机效率概念。
会在p-V,T-S,H-S等图上表示卡诺循环。
b: 理解第二定律的表述、实质、卡诺定理及其推论。
掌握熵的概念、实质、统计意义、克劳修斯不等式、熵增原理、熵判据、、判据。
c: 理解第三定律、规定熵、标准熵的概念及其数值求取。
d: 熟练掌握单纯pVT变化过程、相变过程、化学反应过程的、、、、的计算。
掌握热力学基本关系式、麦克斯韦关系式及其应用,能够较熟练地做有关证明题。
熟练克拉佩龙及克劳修斯-克拉佩龙方程的各种形式和应用。
4)多组分体系热力学:a: 熟练掌握拉乌尔定律和亨利定律。
b: 掌握偏摩尔量和化学势的定义,理解其物理意义、偏摩尔量间关系。
c: 掌握理想气体、理想溶液、稀溶液中化学势的表达、各种标准态的选取和化学势在化学平衡、相平衡中的应用、理想溶液、稀溶液定义、特点及微观说明。
大学物理化学上学期各章节复习题及答案傅献彩

第二章热力学第一定律一、选择题1、下列叙述中不具状态函数特征的是:()(A)系统状态确定后,状态函数的值也确定(B)系统变化时,状态函数的改变值只由系统的初终态决定(C)经循环过程,状态函数的值不变(D)状态函数均有加和性2、下列叙述中,不具可逆过程特征的是:()(A)过程的每一步都接近平衡态,故进行得无限缓慢(B)沿原途径反向进行时,每一小步系统与环境均能复原的(C)生成反应的温度必须是298.15K(D)生成反应中各物质所达到的压力必须是100KPa9、在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,那么:()(A) Q > 0,W > 0,∆U > 0 (B)Q = 0,W = 0,∆U < 0(C) Q = 0,W = 0,∆U = 0 (D) Q < 0,W > 0,∆U < 010、非理想气体进行绝热自由膨胀时,下述答案中哪一个是错误的? ( )(A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=011、下列表示式中正确的是 ( )(A)恒压过程ΔH=ΔU+pΔV (B)恒压过程ΔH=0(C)恒压过程ΔH=ΔU+VΔp (D)恒容过程ΔH=012、理想气体等温反抗恒外压膨胀,则 ( )(A)Q>W (B)Q<W (C)Q=W (D)Q=△U13、当理想气体其温度由298K升高到348K,经(1)绝热过程和(2)等压过程,则两过程的()(A)△H1>△H2 W1<W2 (B)△H1<△H2W1>W2(C)△H1=△H2W1<W2 (D)△H1=△H2 W1>W214、当理想气体从298K,2×105Pa 经历(1)绝热可逆膨胀和(2)等温可逆膨胀到1×105Pa时,则( )(A)△H1<△H2W1>W2 (B)△H1>△H2 W1<W2(C)△H1<△H2W1<W2 (D)△H1>△H2 W1>W215、对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条 (B) 二条 (C) 三条 (D) 三条以上16、实际气体绝热恒外压膨胀时,其温度将: ( )(A) 升高 (B) 降低 (C) 不变 (D) 不确定17、功的计算公式为W=nC v,m(T2-T1),下列过程中不能用此式的是()(A)理想气体的可逆绝热过程(B)理想气体的绝热恒外压过程(C)实际气体的绝热过程(D)凝聚系统的绝热过程18、凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是: ( )(A) ΔU> 0 , ΔH > 0 (B) ΔU= 0 , ΔH = 0(C) ΔU< 0 , ΔH < 0 (D) ΔU= 0 , ΔH大于、小于或等于零不确定19、一定量的理想气体从同一始态出发,分别经(1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( )(A) H1> H2 (B) H1= H2 (C) H1< H2 (D) H1>=H220、将H2(g)与O2以2:1的比例在绝热刚性密闭容器中完全反应,则该过程中应有()(A)ΔT=0 (B)Δp=0 (C)ΔU=0 (D)ΔH=021、刚性绝热箱内发生一化学反应,则反应体系为 ( )(A)孤立体系 (B)敞开体系 (C)封闭体系 (D)绝热体系22、理想气体可逆绝热膨胀,则下列说法中正确的是 ( )(A)焓总是不变 (B)内能总是增加(C)焓总是增加 (D)内能总是减少23、关于等压摩尔热容和等容摩尔热容,下面的说法中不正确的是( )(A)C p,m与C v,m不相等,因等压过程比等容过程系统多作体积功(B)C p,m–C v,m=R既适用于理想气体体系,也适用于实际气体体系(C)C v,m=3/2R适用于单原子理想气体混合物(D)在可逆相变中C p,m和C v,m都为无限大24、下列哪个过程的dT≠0,dH=0? ( )(A)理想气体等压过程 (B)实际气体等压过程(C)理想气体等容过程 (D)实际气体节流膨胀过程25、隔离系统内发生一变化过程,则系统的:(A)热力学能守恒,焓守恒(B)热力学能不一定守恒,焓守恒(C)热力学能守恒,焓不一定守恒 (D)热力学能、焓均不一定守恒二、判断题1、体系在某过程中向环境放热,则体系的内能减少。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 补充题:气体的状态方程为pV m (1-βp )=RT ,求其逸度的表示式。
解 B B B (g)(g)ln f RT pμμ⎛⎫=+ ⎪⎝⎭ T 一定时,ln d RT f μ= ⎰-==p dp pf RT RT 0ln ln αγ ⎪⎪⎭⎫ ⎝⎛--=--=-=)1(11)1(p p p RT p p RT p RT V V re m idm ββα dp p p pp f p ⎰⎥⎦⎤⎢⎣⎡---=0)1(11ln β dp p p p p ⎰⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-+--=0111ββ )1ln(10p dp pp βββ--=-=⎰ p p f β-=11 或 pp f β-=1 引申:对于范德华气体则有1、在298K 时,有0.10kg 质量分数为0.0947的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度m B ;(2)物质的量浓度c B 和(3)摩尔分数x B 来表示硫酸的含量。
已知在该条件下,硫酸溶液的密度为1.0603×103kg .m -3,纯水的密度为997.1kg .m -3。
解:m (B)= w B × = 0.0947×0.10kg =0.00947kg=9.47gn B = m (B)/M B =9.47/98.079=0.09655molm (A)= - m (B)= 0.10×(1-0.0947)=0.09153kg=91.53g n A = m (A)/M A =91.53/18.015=5.080766mol(1) m B =n B /m (A)= 0.09655/0.09153=1.055mol.kg -1(2) V 溶液= /ρ=0.10/(1.0603×103)=0.0943×10-3 m 3=0.0943dm 3 c B =n B /V=0.09655/0.0943=1.024mol.L -1(3) x B = n B / =0.09655/(0.09655+5.08076)=0.01864 ∑AA m ∑AA m ∑AA m ∑AA n2、在298K和大气压力下,含甲醇(B)的摩尔分数x B为0.458的水溶液的密度为0.8946kg.dm-3,甲醇的偏摩尔体积V B=39.80cm3.mol-1,试求该水溶液中水的偏摩尔体积V A。
解:设n B=1.0mol,则n总=n B/x B=1/0.458=2.183mol,n A=1.183 molm(B)=n B M B=1.0×32.042=32.042g,m(A)= n A M A=1.183×18.015=21.312gV={m(A)+m(B)}/ρ=(21.312+32.042)/0.8946= 59.64cm3V=n A V A+n B V B,V A=(V-n B V B)/n A=(59.64-1.0×39.80)/1.183=16.77 cm3.mol-13、在298K和大气压下,某酒窑中存有酒10.0m3,其中含乙醇的质量分数为0.96,今欲加水调制含乙醇的质量分数为0.56的酒,已知该条件下,纯水的密度为999.1 kg.m-3,水和乙醇的偏摩尔体积为:w(C2H5OH) V(H2O)/10-6m3.mol-1V(C2H5OH) /10-6m3.mol-10.96 14.61 58.010.56 17.11 56.58试计算:(1) 应加入水的体积;(2) 加水后,能得到含乙醇的质量分数为0.56的酒的体积。
解:(1)n B M B/ {n A M A+ n B M B}=0.96,46.068n B/(18.015n A+46.068n B)=0.96,18.015n A+46.068n B=46.068n B/0.96=47.988 n B,n B=9.38 n AV=n A V A+n B V B=10.0m3,(14.61n A+58.01n B)×10-6=10.0m3,(14.61n A+58.01×9.38 n A)×10-6=10.0m3,n A =17897.3mol,n B =167876.6mol,n B M B/ {n/A M A+ n B M B}=0.56,167876.6×46.068/(18.015n/A+167876.6×46.068)= 0.5618.015n/A+167876.6×46.068=167876.6×46.068/0.56=13810248.6n/A=337302.8mol,△n= n/A- n A=337302.8-17897.3=319405.5molρV水/18.015=319405.5V水=18.015×319405.5/999.1 kg.m-3=5.76 m3(2) V=n /A V A +n B V B =(337302.8×17.11+167876.6×56.58)×10-6=15.27 m 34、在298K 和大气压下,甲醇(B)的摩尔分数x B 为0.30的水溶液中,水(A)和甲醇(B)的偏摩尔体积分别为V A =17.765 cm 3.mol -1,V B =38.632 cm 3.mol -1,已知该条件下,甲醇(B)和水(A)的摩尔体积为V m,B =40.722 cm 3.mol -1,V m ,A =18.068cm 3.mol -1,现在需要配制上述水溶液1000 cm 3,试求:(1) 需要纯水和纯甲醇的体积;(2) 混合前后体积的变化值。
解:(1) V =n A V A +n B V B =1000cm 3,17.765n A +38.632n B =1000n B / (n A + n B )=0.30,n B =0.30n A +0.30 n B ,n B =3n A /717.765 n A +38.632×3 n A /7=1000,n A =29.136mol ,n B =3n A /7=12.487 molV 水= n A V m,A =29.136×18.068=526.43 cm 3V 甲醇= n B V m,B =12.487×40.722=508.50cm 3(2) V 混合前= V 水+ V 甲醇=526.43+508.50=1034.93 cm 3△V= V 混合前- V 混合后=1034.93-1000=34.93 cm 35、在298K 和大气压下,溶质NaCl(s)(B)溶于1.0kgH 2O(l)(A)中,所得溶液的体积V 与溶入NaCl(s)(B)的物质的量n B 之间的关系式为:V =[1001.38+1.625(n B /mol)+1.774(n B /mol)3/2+0.119(n B /mol)2]cm 3试求:(1) H 2O(l)和NaCl 的偏摩尔体积与溶入NaCl(s)的物质的量n B 之间的关系;(2) n B =0.5mol 时,H 2O(l)和NaCl 的偏摩尔体积;(3) 在无限稀释时,H 2O(l)和NaCl 的偏摩尔体积。
解:(1) V =[1001.38+1.625(n B /mol)+1.774(n B /mol)3/2+0.119(n B /mol)2]cm 3V B = =[16.625+3/2×1.774 (n B /mol)1/2 +2×0.119(n B /mol)] cm 3.mol -1 (2) V =(1001.38+16.625×0.5+1.774×0.53/2+0.119×0.52)=1010.349cm 3V B =(16.625+3/2×1.774×0.5 1/2 +2×0.119×0.5)=18.6256cm 3.mol -1n A =m (A)/M A =1.0×103/18.015=55.509molV A =(V -n B V B )/n A =(1010.349-0.5×18.6256)/55.509=18.0334 cm 3.mol -1C n p T B n V ,,)(∂∂(3) n B→0, V=1001.38 cm3,V B=16.625 cm3,V A=(V-n B V B)/n A=1001.38/55.509=18.04 cm3.mol-16、在293K时,氨的水溶液A中NH3与H2O的量之比为1:8.5,溶液A上方NH3的分压为10.64kPa,氨的水溶液B中NH3与H2O的量之比为1:21,溶液B上方NH3的分压为3.579kPa,试求在相同的温度下:(1) 从大量的溶液A中转移1molNH3(g)到大量的溶液B中的△G;(2) 将处于标准压力下的1molNH3(g)溶于大量的溶液B中的△G。
解:(1) p NH3=k x,A x NH3,k x,A=p NH3 / x NH3=10.64/(1/9.5)=101.18p NH3=k x,B x NH3,k x,B=p NH3 / x NH3=3.579/(1/22)=78.738n NH3(A,aq)+ n NH3(B,aq)→(n-1) NH3(A,aq) +(n+1)NH3(B,aq)△G=(n+1) u2,B(aq) +(n-1) u2,A(aq)- n u1,B(aq)- u1,A(aq)=(n+1)RTlnk x,B x2,B+(n-1) RTlnk x,A x2,A- nRTlnk x,B x1,B- nRTlnk x,A x1,A ∵n→∞,∴x2,B≈x1,B=x B=1/22,x2,A≈x1,A=x A=1/9.5△G=RTlnk x,B x B -RTlnk x,A x A=8.314×293{ln(78.738×1/22)- ln(101.18×1/9.5)}= -2656.5J(2) NH3(g)+ n NH3(B,aq)→(n+1)NH3(B,aq)△G=(n+1) u2,B(aq) - uө(T)- n u1,B(aq)=(n+1)RTlnk x,B/pө x2,B- nRTlnk x,B/pөx1,B∵n→∞,∴x2,B≈x1,B=x B=1/22△G= RTlnk x,B/pө x2,B=8.314×293ln(78.738/100×1/22)= -8112.1J7、300K时,纯A与纯B形成理想混合物,试计算如下两种情况的Gibbs自由能的变化值。
