放线菌的常温培养
放线菌培养条件

放线菌培养条件嘿,你知道放线菌不?这小家伙可神奇啦!咱今天就来聊聊放线菌的培养条件。
放线菌,那可是微生物世界里的小明星呢!它们就像是一群勤劳的小工匠,在自己的小天地里忙碌着。
要想让这些小工匠茁壮成长,可得给它们创造合适的条件。
首先说说培养基吧。
这培养基就像是放线菌的家,得舒舒服服的才行。
一般来说,高氏一号培养基就很不错。
这里面有各种营养物质,就像给放线菌准备了一桌丰盛的大餐。
有淀粉啦、硝酸钾啦、氯化钠啦等等。
这些东西能让放线菌吃得饱饱的,有力气干活。
你想想,要是你饿着肚子,能有精神做事不?温度也是很重要的哦。
放线菌可不像我们人类,能适应各种温度。
它们有自己喜欢的温度范围。
一般来说,28 度左右是比较合适的。
这个温度就像是春天的暖阳,不冷不热,刚刚好。
要是温度太高了,放线菌可能就会热得受不了,罢工啦!要是温度太低了,它们又会冻得缩手缩脚,没力气生长。
所以说,控制好温度,那可太重要啦!还有酸碱度呢。
放线菌喜欢偏碱性的环境。
就像我们有些人喜欢吃甜食,有些人喜欢吃辣的一样,放线菌也有自己的口味偏好。
把培养基的pH 值调到7.2 到7.6 之间,放线菌就会过得很开心。
要是酸碱度不合适,它们可能就会闹脾气,不好好生长。
氧气也是必不可少的。
放线菌需要氧气来呼吸。
就像我们人类需要空气一样,没有氧气,放线菌可活不下去。
可以通过振荡培养或者在培养基表面轻轻搅拌,让空气充分接触放线菌。
这样它们就能呼吸顺畅,茁壮成长啦!培养时间也不能马虎哦。
放线菌可不是一下子就能长大的。
得给它们足够的时间。
一般来说,几天到一周左右的时间,放线菌就能长得比较好了。
要是你太心急,没等它们长大就去看,可能会失望哦。
就像种庄稼一样,得有耐心,等它们慢慢成熟。
在培养放线菌的过程中,还得注意保持清洁。
不能让其他杂菌跑进来捣乱。
就像我们不希望有不速之客闯进自己的家一样,放线菌也不喜欢有别的细菌来抢它们的地盘。
所以要做好消毒工作,让放线菌有一个干净的生长环境。
放线菌种植

放线菌种植
放线菌是一类广泛存在于自然界中的细菌,它们具有很大的种类和数量。
种植放线菌主要是为了研究其代谢产物和生物活性物质,或者用于生物制药等应用领域。
以下是一般的放线菌种植步骤:
1. 选择培养基:放线菌通常在富含营养物质的培养基上生长,如琼脂培养基、啤酒麦芽汤等。
根据所需菌株的喜好选择相应的培养基。
2. 准备培养基:按照培养基配方,将相应的化学品溶解在适量的水中,进行灭菌处理。
3. 培养基分装:将培养基分装到培养器中,如琼脂培养基可倒入琼脂平板中,液体培养基可倒入培养瓶中。
4. 接种放线菌:通常使用接种针、接种环等工具,在无菌条件下将放线菌接种到培养基上。
5. 培养:将接种后的培养基放入恒温培养箱或培养箱中,培养温度通常根据放线菌的要求来确定。
6. 观察和筛选:定期观察培养基上的菌落生长情况,筛选出所需的放线菌。
7. 提取:从培养基中提取放线菌细胞或代谢产物,用于进一步分析和应用。
需要注意的是,放线菌的种植过程要在无菌条件下进行,防止污染。
此外,不同种类的放线菌在培养条件上可能存在差异,因此需根据具体菌株的特点进行调整。
微生物 生长 温度

微生物生长温度
微生物的生长温度根据其种类不同而有所差异。
1.绝大多数微生物最适生长温度为25℃~37℃。
2.原生动物的最适温度一般为16~25℃,工业废水生物处理过程中
的原生动物的最适温度为30℃左右,其最高温度在37~43℃,少数可在60℃中生存。
3.大多数放线菌的最适温度为23~27℃,其高温类型在50~65℃生
长良好,有的放线菌在20℃以下的温度中也可生长。
4.霉菌生长与温度的关系和放线菌差不多。
在实验室培养放线菌、
霉菌和酵母菌多采用的温度为28~32℃。
5.藻类的最适温度多数在28~30℃。
6.嗜冷性菌(低温菌)可在-10~30℃的条件下生长,其最适宜温度
为12~18℃;适温性菌(中温菌)可在20~50℃的条件下生存,其最适宜的温度为25~40℃;嗜热性菌(高温菌),可在37~75℃的条件下生长,其最适宜温度为55~65℃。
此外,微生物的生长也与温度有关,细胞内蛋白质和核酸等发生不可逆破害,导致微生物生长速率急剧下降。
因此,在选择合适的温度来促进微生物的生长时,必须考虑到微生物的种类和生长条件。
放线菌

放线菌放线菌(Actinobacillus)是一类主要呈菌丝状生长和以孢子繁殖的陆生性较强大的原核生物。
因在固体培养基上呈辐射状生长而得名。
大多数有发达的分枝菌丝。
菌丝纤细,宽度近于杆状细菌,约0.5~1微米。
可分为:营养菌丝,又称基质菌丝,主要功能是吸收营养物质,有的可产生不同的色素,是菌种鉴定的重要依据;气生菌丝,叠生于营养菌丝上,又称二级菌丝。
酶的分离纯化方法小结1.沉淀法酶在溶液中的稳定性与分子大小、带电荷量和水化作用有一定的相关性,改变这些因素会对酶的稳定性有所影响。
当酶的稳定性遭到破坏时就会沉淀析出。
常见的沉淀法有盐析法、有机溶剂沉淀法、重金属沉淀法及加热变性沉淀法,其中盐析法多用于酶的分离纯化。
1.1盐析沉淀盐析沉淀法是根据不同酶在一定浓度盐溶液中溶解度降低程度不同达到彼此分离的方法。
酶易溶于水,因为其分子的-COOH、-NH2和-OH都是亲水基团,这些基团与极性水分子相互作用形成水化层,包围于酶分子周围形成1~100nm大小的亲水胶体,从而削弱了酶分子之间的作用力。
酶分子表面亲水基团越多,水化层越厚,酶分子与溶剂分子之间的亲和力就越大,因而溶解度也越大。
亲水胶体在水中的稳定因素有两个,即电荷和水膜。
因为中性盐的亲水性大于酶分子的亲水性,当水中加入少量盐时,盐离子与水分子对酶分子的极性基团的影响,使酶在水中溶解度增大。
但盐浓度增加一定程度时,水的活度降低,酶表面的电荷大量被中和,水化膜被破坏,于是酶相互聚集而沉淀析出。
1.2等电点沉淀利用酶在等电点时溶解度最低,而各种酶又具有不同的等电点来分离酶的方法,称为等电点沉淀法。
酶的等电点(pI)即酶的净电荷为零时的pH值,由于等电点时的酶净电荷为零,因而失去了水化膜和分子间的相斥作用,疏水性氨基酸残基暴露,酶分子相互靠拢、聚集,最后形成沉淀析出。
1.3有机溶剂沉淀有机溶剂沉淀法是指有机溶剂能使酶分子间极性基团的静电引力增加,与水作用能破坏酶的水化膜,而水化作用降低,促使酶聚集沉淀。
17 放线菌

放线菌Actinomyces放线菌为原核细胞型微生物,形成有分枝的菌丝,因菌丝呈放射状排列,故名。
放线菌是抗生素的主要产生菌,目前广泛使用的抗生素约70%由各种放线菌产生,如链霉素、卡那霉素、红霉素和利福霉素等。
放线菌广泛分布于自然界,种类繁多。
对人有致病作用的主要是放线菌属和诺卡菌属中的菌群。
特征放线菌属诺卡菌属培养特点厌氧或微需氧,35-37℃生长专性需氧,37℃或20-25℃均可生长染色性非抗酸弱抗酸分布人和动物的口腔、胃肠道、泌尿生殖道在土壤等自然环境中,多为腐生菌感染来源内源性感染外源性感染放线菌属Actinomyces放线菌属为人体微生物群,正常寄居在人和动物的口腔、上呼吸道、胃肠道和泌尿生殖道。
具有致病性的有衣氏放线菌、牛放线菌、内氏放线菌、黏性放线菌和龋齿放线菌等。
其中对人致病性较强的是衣氏放线菌。
一、生物学性状1.形态与染色:为革兰阳性、非抗酸性丝状菌,有分枝。
2. 培养特性:厌氧或微需氧,在血琼脂平板上37℃培养5-7d 可长出灰白色或淡黄色微小圆形菌落。
衣氏放线菌还原硝酸盐、分解葡萄糖等。
二、致病性在机体抵抗力下降,口腔粘膜受损、拔牙等时,可引起内源性感染,软组织的化脓性炎症。
感染多呈慢性无痛性过程,并常伴有多发性瘘管形成,排出的脓液中含有硫磺样颗粒(sulfur granule)。
放线菌病多发生于面颈部,也可发生胸部、腹部和CNS感染。
面颈部感染者病原体可沿导管进入唾液腺和泪腺,或直接蔓延至眼眶。
若累及颅骨可引起脑膜炎和脑脓肿。
内氏和黏性放线菌能黏附在牙釉质上,形成牙菌斑。
由于细菌对食物中糖类的分解产酸腐蚀釉质,形成龋齿。
三、微生物学检查法主要和简单的方法是从脓或痰中检出硫磺样颗粒,即可确定诊断。
必要时作厌氧培养,观察菌落特点。
亦可取活检组织做病理检查。
四、防治原则注意口腔卫生,牙病早日诊治是预防感染的主要方法。
脓肿、瘘管的病损部位应进行外科清创处理。
抗菌药物:青霉素、复方新若明、林可霉素、氯霉素等。
霉菌和放线菌的接种、培养及形态观察

制备培养基 倒平板 放玻璃纸,铺平
制菌悬液
培养7d
涂布菌液
28℃倒置
制片观察。
2、真菌(载片法): 准备湿室 融化培养基 整理湿室
点接孢子
加水棉球
覆培养基
28℃保湿培养7d
加盖玻片
镜检。
3、形态观察
• 观察内容:
霉菌、放线菌的营养菌丝体、
气生菌丝体、孢子丝、分生孢子 头、分生孢子、孢子梗、足细胞 等的形态和结构。注意不同微生
六、实验报告:
绘图说明霉菌,放线菌的形态特点.
七、思考题:
1、玻璃纸法可否用于培养其他微生物,为什么?
2、什么是载片培养,它适用于哪几类微生物的
形态观察,为什么?
物典型结构形态的区别。
五、注意事项
1、本实验步骤均应无菌操作; 2、倒平板时,摇动培养皿要轻,以免溅出;
3、铺玻璃纸时,涂布棒冷却后,才可与玻璃 纸接触;
4、加盖玻片时要轻压,使培养物均匀的分布 在盖玻片下; 5、取玻璃膜观察时,取放线菌最薄的地方; 6、培养时,培养基滴半滴,以保证一周后结 果理想。
3、放线菌的培养观察方法: 插片法、搭片法、玻璃纸法。 4、霉菌的培养观察方法:载片培养法。
三、实验器材
1、器皿:湿室、镊子、平板、无菌滴管、
显微镜、涂布棒、移液器、滤纸、水棉球载 玻片等。 2、培养基:高氏一号培养基、半固体PDA 培养基。 3、菌种:5406链霉菌、黑曲霉、青霉。
四、实验步骤
霉菌和放线菌的接种、培养和 形态观察
一、实验目的:
1、了解霉菌,放线菌形态观察的基本方法并了 解其基本形态特征.
2、掌握培养基配置,无菌操作,接种与培养,
一株放线菌的发酵培养及产物分析[毕业作品]
![一株放线菌的发酵培养及产物分析[毕业作品]](https://img.taocdn.com/s3/m/a34f374f647d27284a73512e.png)
中文摘要天然产物的作用越来越大,天然产物的来源主要是植物和微生物。
现在微生物的研究发展迅速,而放线菌作用尤为突出。
本文的实验材料为放线菌,放线菌数量巨大种类繁多,在众多领域发挥着新颖独特不可取代的地位,长久以来在药学、化学、生物学等领域占有及其重要的研究价值,放线菌的应用潜力是我们无法想象到的,至今为止从放线菌中提取出的生物活性物质多于13700种,应用于各个领域发挥作用。
本文通过一系列的分离技术对发酵液进行分离纯化,最终对得到的活性物质进行结构鉴定。
分离纯化得到的化合物样品的结构鉴定主要运用氢谱(1H-NMR)技术与质谱(EI-MS)技术。
最后经过质谱和核磁共振波谱鉴定出了两种化合物的结构和分子量,经过数据分析和文献比对,最终确定了这两种化合物的名称分别是:1-Hydroxyphenazine和Resistomycin。
关键词:放线菌发酵分离纯化结构鉴定ABSTRACTThe natural products in modern society have an increasingly important role.The source of natural products is plants and microorganisms.Microbiological research and development is particularly rapid development.Actinomycetes contribute very much to natural products.The experimental material of this paper is actinomycetes.The large number of actinomycetes in a wide range of areas play a unique and irreplaceable position in many fields and have long been in the field of pharmacy, chemistry, biology and other important research value.The potential of application of actinomycetes is something we can not imagine.So far more than 13,700 species bio-active substances extracted from the actinomycetes are applied to play a role in various fields.The theoretical basis of this paper is natural product chemistry.The related technical methods are microbial fermentation technology, organic solvent extraction technology and column chromatography separation technology.Firstly,the ctinomycetes are expanded to ferment.Then,The fermentation broth is separated and purified.At last,the structure of the obtained active substance is identified.The step of separation of extracts and the completion of the purification was carried out primarily by reverse phase chromatography, Seghadex LH-20, and thin layer chromatography.Finally, the structure and molecular weight of the two compounds were identified by mass spectrometry and nuclear magnetic resonance spectroscopy. The final definition of these two compounds were 1-Hydroxyphenazine and Resistomycin according to the data analysis and literature comparison.Keywords:Actinomycetes;ferment;isolation and purification; structure identification目录第1章前言 (1)第1节放线菌的研究概括 (1)第2节分离纯化技术 (2)第3节结构研究主要技术 (3)第4节研究背景、目的和意义、方法和路线 (5)第2章放线菌种扩大培养 (7)第1节实验材料、试剂、仪器 (7)第2节放线菌的扩大发酵 (7)第3章放线菌次生代谢产物的提取 (9)第1节实验材料、试剂、仪器 (9)第2节发酵液的提取分离 (9)第4章放线菌次生代谢产物的分离纯化 (10)第1节实验材料、试剂、仪器 (10)第5章放线菌种的化合物鉴定 (13)第1节实验材料、样品、仪器 (13)第6章讨论 (14)结论 (16)致谢 (17)参考文献 (18)第1章前言第1节放线菌的研究概括放线菌在科学研究的方面是一类极其重要发挥着巨大作用的微生物资源,同时也是一类G+C含量极高的革兰氏阳性细菌。
放线菌的培养与观察 实验报告

放线菌的培养和形态观察摘要本实验目的是学习并掌握放线菌的培养方法,初步了解放线菌的形态特征。
以青色链霉菌(Streptomyces glaucus)和弗氏链霉菌(Streptomyces fradiae)为实验材料,利用高氏I号培养基进行培养,采用插片法制片,用高倍镜观察其菌丝及孢子丝形态。
【1】青色链霉菌(S.glaucus)的菌落呈青灰色,菌丝颜色较浅,孢子丝螺旋形;弗氏链霉菌(S.fradiae)菌落呈暗黄色,菌丝颜色较浅,孢子丝较菌丝粗且直。
关键词放线菌观察插片法菌丝孢子丝引言放线菌是能形成分枝丝状体或菌丝体的一类革兰氏阳性细菌,其菌丝(包括基内菌丝和气生菌丝)及孢子丝有着各种不同的形态,以孢子进行繁殖。
实验主要是观察其菌丝与孢子丝,为了保证菌丝与孢子丝的完整,实验采用插片法培养放线菌。
菌丝与孢子丝之间的区别比较明显,很容易区分,观察时需要注意的是它们的形态与位置关系。
1 材料和方法1.1材料1.1.1菌种青色链霉菌(S. glaucus),弗氏链霉菌(S. fradiae)。
1.1.2培养基髙氏I号培养基:可溶性淀粉2g KNO3 0.1g K2HPO4 0.05g MgSO4• 7H2O0.05g NaCl 0.05g FeSO4• 7H2O0.001g(母液)琼脂 2g 蒸馏水 100mL pH 7.2~7.41.1.3仪器和其他用品平板培养皿,盖玻片,镊子,酒精灯,显微镜,擦镜纸,接种环等。
1.2方法【1】1.2.1 配制培养基按配方配制100ml高氏I号培养基,并与培养皿一起高温灭菌30min。
1.2.2制作培养基平板1.2.3接种无菌操作分别在青色链霉菌和弗氏链霉菌高氏Ⅰ号培养基上挑取菌种在制备的高氏Ⅰ号培养基平板上密集划线接种。
1.2.4插片无菌操作用镊子取灭菌盖玻片以约45°角插入平板琼脂接种线上。
1.2.5 培养将平板倒置,于28℃培养7d。
1.2.6 菌落形态观察。
放线菌的培养与观察

放线菌的培养与观察摘要:对青色链霉菌(Streptomyces glaucus)和弗氏链霉菌(Streptomycesfradiae)进行有效的观察.实验利用高氏(Gause)一号培养基对放线菌在28℃下进行培养,并通过插片法,在普通光学显微镜下完成了对两种放线菌自然状态下的观察,观察到了基内菌丝以及孢子丝等结构。
关键词:放线菌插片法孢子丝链霉菌前言放线菌与人类的生产和生活关系极为密切,目前广泛应用的抗生素约70%是各种放线菌所产生。
一些种类的放线菌还能产生各种酶制剂,此外,放线菌还可用于甾体转化、烃类发酵、石油脱蜡和污水处理等方面。
而链霉菌属(Streptomyces)是最高等的放线菌,有发育良好的分枝菌丝。
已知放线菌所产抗生素的90%都由本属产生。
放线菌是属于一类具有分支状菌丝体的细菌,革兰染色为阳性。
大多数有发达的分枝菌丝。
菌丝纤细,宽度近于杆状细菌,约0.5~1微米。
可分为营养菌丝,气生菌丝,孢子丝三种,孢子丝的形状和排列方式因种而异。
孢子丝的形态、孢子的排列以及形状都是放线菌重要的分类学指标。
培养放线菌则使用的是高氏(Gause)一号培养基。
这种培养基属于合成培养基,对于其中的成分,我们能够精确地掌握。
实验中采用插片法来观察放线菌自然状态下的基内菌丝和孢子丝等结构。
本次试验就是将以这些为基础,培养和观察青色链霉菌(S. glaucus)与弗氏链霉菌(S. fradiae),加深对放线菌的认识和理解。
1.材料与方法1.1 材料1.1.1 菌种青色链霉菌(S. glaucus);弗氏链霉菌(S. fradiae)1.1.2 溶液与试剂可溶性淀粉;KNO3粉末;NaCl粉末;K2HPO4粉末;MgSO4粉末;FeSO4粉末;琼脂;水;1.1.3 仪器电子天平;烧杯;玻璃棒;药匙;加热器;10ml量筒;1ml移液管;高压蒸汽灭菌锅;培养皿;盖玻片;载玻片;酒精灯;接种环;镊子;试管;恒温箱;普通光学显微镜;300ml锥形瓶1.2 方法1.2.1 高氏一号培养基制备1.2.1.1 按照高氏一号培养基的配方称取各个成分,备下一步使用。
放线菌的科普

存在于正常人口腔、齿龈、扁桃体与咽部, 为条件致病菌 硫磺样颗粒(菌落) 压片或组织切片,显微镜下可见颗粒呈菊 花状
硫磺样颗粒(sulfur granule)
治疗原则
首选青霉素 治疗时间超过6周 结合手术
主要通过无性孢子的方式进行繁殖 主要通过横隔分裂方式形成孢子 链霉菌的生活史: 孢子萌发 芽管延长 基内 菌丝生长 气生菌丝 孢子 丝 孢子
放线菌的繁殖方式
放线菌的繁殖
无性孢子(主要)
菌丝片段
分生孢子
孢子囊孢子
横隔分裂
缩缢分菌的用途与危害
放线菌在医药上主要用于生产抗生素、 维生素和酶类等,少数寄生性的放线 菌对人和动植物具有致病性
一、产生抗生素的放线菌
产生抗生素最多的放线菌依次是: 链霉菌属 小单孢菌属 游动放线菌属 诺卡菌属 链孢囊菌属 马杜拉放线菌属
(一)链霉菌属
现有的抗生素80%由放线菌产 生,而其中90%又是由链霉菌 属产生的 根据气生菌丝、孢子堆和基内 菌丝的颜色及孢子丝的形态, 可把链霉菌属分为14个类群 灰色链霉菌产生链霉素,龟链 霉菌产生土霉素,卡那霉素链 霉菌产生卡那霉素等到 链霉菌有发育良好的基内菌丝、 气生菌丝和孢子丝,菌丝无隔, 孢子丝形状各异,可形成长的 孢子链
高温放线菌属的基内菌丝和气 生菌丝发育良好,单个孢子侧 生在基内菌丝和气生菌丝上 孢子是内生的,其结构和性质与 细菌芽孢类似,孢子外面有多层 外壁,内含吡啶二羧酸,能抵抗高 温、化学药物和环境中的其他 不利因素。 该属菌产生高温红霉素,对革 兰阳性菌和革兰阴性菌均有作 用。
二、病原性放线菌
海洋放线菌的培养鉴定与分离方法

海洋放线菌的培养鉴定与分离方法培养方法:1.海水培养基:海洋放线菌适应于富含海洋盐分的培养基。
一般的海水培养基包括海水、海营养盐、葡萄糖等成分。
2.杀菌处理:将培养基加热至沸腾,常温下过滤,或使用其他杀菌方法,如过滤器、紫外线照射等,以确保培养基无菌。
3.接种:将海洋样品(如海水、海洋沉积物等)加入到培养基中,翻腾混匀。
4.培养条件:通常在28-30℃下培养,选用适当的培养时间和转速,类似陆生放线菌的培养条件。
鉴定方法:1.形态学特征分析:观察海洋放线菌的形态特点,如菌落形态、颜色、边缘、透明度等。
2.生理生化特性检测:通过检测海洋放线菌的生理生化特征,如产生酸、氧化还原反应、产生酶、糖水解等。
3.生长特性分析:测定海洋放线菌的生长曲线、最适生长温度、最适生长pH等。
4.分子生物学鉴定:利用分子生物学技术,如16SrRNA序列分析、DNA-DNA杂交、脱氧核糖核酸酶电泳等,对海洋放线菌进行鉴定。
分离方法:1.稀释平板法:将海洋样品连续稀释后,取适量的稀释液均匀涂布于固体培养基平板上,在适当的温度下培养,待菌落形成后,进行分离和鉴定。
2.琼脂块分离法:将海洋样品均匀涂布于琼脂块上,培养至菌落形成后,将菌落分离,获得单菌落。
3.过滤法:将海洋样品过滤后,将过滤膜放置在含有适宜营养物质的培养基上,培养至菌落形成,进一步分离和鉴定。
4.琼脂滴定法:将海洋样品加入到含有适宜营养物质的琼脂液中,混合均匀后,滴定在含有固体琼脂的平板上,培养待菌落形成后,进行分离和鉴定。
总结:海洋放线菌的培养鉴定与分离方法主要包括培养基的选择、杀菌处理、接种、培养条件的确定等方面。
鉴定方法可以通过形态学特征分析、生理生化特性检测、生长特性分析和分子生物学鉴定等技术。
分离方法可以采用稀释平板法、琼脂块分离法、过滤法和琼脂滴定法等。
这些方法可以帮助研究人员获得纯培养的海洋放线菌菌种,为进一步的研究和利用奠定基础。
放线菌的分离

放线菌的分离(1)注意土样在用之前要风干处理20天以上,以除去大部分的细菌。
(2)注意在培养基中添加重铬酸钾适量(1)取体积为300ml的高氏一号培养基,加入0.1%的重铬酸钾15mL,使之终浓度为50ppm,摇匀,倒平板,待用。
(2)取土样5g,摊平于大号培养皿上,在恒温干燥箱中120℃干热处理1h。
(3)土样热处理后,加入装有45mL无菌水和少量玻璃珠的三角瓶中,加入0.5mL的笨酚,室温下振荡30分钟,静止5分钟,取上清液用无菌水稀释10倍。
同时另取土样5g,不加热和笨酚处理,余步骤同上,作为对照。
(4)用移液管分别吸取原液和10倍稀释液各0.1ml标志稀释倍数的平板上,涂抹均匀,倒置,28℃培养。
(5)培养10~14d,观察比较不同处理方法的生长情况、菌落特征。
挑取红色,无气生菌丝的小菌落以及其它菌落形态菌株接种斜面,进一步用于形态观察和鉴定。
高氏一号培养基配方:可溶性淀粉(20g),KNO3(1g),K2HPO4(0.5g),MgSO4· 7H2O(0.5g),NaCl(0.5g),FeSO4· 7H2O(0.01g),琼脂20g,pH=7.4-7.6 (1L)关于LB培养基的问题:LB培养基的配方如下:胰蛋白胨(Tryptone) 10g/L酵母提取物(Yeast extract) 5g/L氯化钠(NaCl) 10g/L另外根据经验值用NaOH调节该培养基的pH,使其达到7.4(LB固体培养基倒板1.配制:100mlLB培养基加入1.5g琼脂粉2.抗生素的加入:高压灭菌后,将融化的LB固体培养基置与55℃的水浴中,待培养基温度降到55℃时(手可触摸)加入抗生素,以免温度过高导致抗生素失效,并充分摇匀。
(抗生素怎么选)3.倒板:一般10ml倒1个板子。
培养基倒入培养皿后,打开盖子,在紫外下照10-15分钟。
4.保存:用封口胶封边,并倒置放于4℃保存,一个月内使用改良LB培养基:蛋白胨 10g;酵母粉 5g;氯化钠 10g;琼脂,18g;水1000mL;调至pH 7.2~7.4。
描述放线菌的菌落特点

描述放线菌的菌落特点一、前言放线菌是一类广泛存在于自然界中的细菌,它们具有许多独特的特点,其中最为显著的就是它们在培养基上形成的菌落。
本文将详细描述放线菌的菌落特点。
二、放线菌的基本介绍放线菌(Streptomyces)是一类革兰氏阳性细菌,属于链霉菌科(Streptomycetaceae),在自然界中广泛分布。
这类细菌具有复杂的生命周期和代谢途径,能够产生大量的次级代谢产物。
三、放线菌的培养条件放线菌在培养基上需要较长时间才能够形成可见的单个斑点或者斑块。
通常情况下,要求使用富含碳源和氮源等营养物质的培养基来进行培养。
同时,温度和pH值等因素也会对其生长产生影响。
四、放线菌的形态特征1. 形态:放线菌呈现出丝状或者分枝状结构,其体型相对较大。
2. 颜色:放线菌在不同培养条件下会呈现出不同的颜色,常见的颜色有白色、黄色、灰色、褐色等。
3. 表面特征:放线菌的表面通常比较粗糙,有时会形成一些凸起的结构。
五、放线菌的菌落特点1. 形态特征放线菌在培养基上形成的菌落通常呈现出圆形或者不规则形状。
它们通常呈现出淡黄色或者灰白色,有时也会呈现出其他颜色。
此外,在放线菌培养基上,可以看到许多细长而且分支状的物质,这些物质就是放线菌体。
2. 表面特征放线菌的表面比较粗糙,并且有时还会形成一些凸起的结构。
这些结构通常是由于细胞壁增厚所致。
3. 质地特征放线菌在培养基上形成的菌落相对较硬,并且比较干燥。
这是由于其产生了一些次级代谢产物,使得其表面变得比较坚硬。
六、总结综上所述,放线菌在培养基上形成的菌落具有独特的形态、表面和质地特征,这些特点使得其在科学研究和工业应用中具有广泛的应用前景。
高温放线菌最适合的温度

高温放线菌最适合的温度
放线菌中除致病类型外,一般为需氧菌,生长的最适温度为28-30℃,最适PH为7.5-8.0.自然环境中的放线菌多数为腐生型异养菌,容易吸收和利用的碳源主要是葡萄糖、麦芽糖、淀粉和糊精。
氮源以鱼粉、蛋白胨、玉米浆和一些氨基酸较为合适,硝酸盐、铵盐、尿素等可作为速效氮源被放线菌利用。
由于放线菌的次级代谢产物较丰富,多数种类都能产生抗生素,故在培养放线菌时,一般需要加入各种无机盐及一些微量元素,如钾、镁、铁、锰、铜、钴等。
对放线菌的培养主要采用液体培养和固体培养两种方式。
固体培养可以积累大量的孢子;液体培养则可获得大量的菌丝体及代谢产物。
在抗生素生产中,一般采用液体培养,并在发酵罐中通入无菌空气,以增加发酵液的溶氧度。
实验技术六放线菌的培养与形态观察

2. 制备琼脂玻璃纸平板培养物
(1)将高氏一号琼脂培养基熔化后倒平板,待凝 固后,无菌操作用镊子将玻璃纸覆盖在琼脂平板上, 展平。 (2)稀释菌液:将放线菌斜面菌种制成10-3的孢子 悬液。 (3)接种:用1mL无菌吸管取0.2mL孢子悬液滴加 在玻璃纸平板上,然后用无菌涂棒涂抹均匀。也可 用接种环挑取菌种斜面菌苔在玻璃纸上划线。 (4)培养:将平板倒置于28-30℃下培养5-7天。
实验技术六 放线菌的培 养与形态观察
一、实验目的
1. 学习并掌握用玻璃纸培养放线菌的方法; 2. 观察放线菌的培养特征; 3. 初步了解放线菌的个体形态特征。
二、基本原理
玻璃纸具有半透膜性,其透光性与载玻片基 本相同。将灭菌的玻璃纸覆盖在琼脂平板表面, 然后将放线菌接种于玻璃纸上,经培养使放线菌 生长在玻璃纸上。观察时,将长菌的玻璃纸剪取 小片,贴放在载玻片上,直接镜检。这种方法可 观察到放线菌的自然生长状态,也便于观察不同 生长期的形态。
3. 自然生长状态的观察
在洁净载玻片上加一杯水,用剪刀剪取小片玻 璃纸,菌面朝上平贴在玻片的水滴上(勿产生气 泡),先用低倍镜观察,再用高倍镜找到适宜部 位,用油镜仔细观察。要区别基内菌丝、气生菌 丝、孢子丝及孢子的形态、粗细和颜色的差异。
注意:1. 接种时注意玻璃纸与培养基间 不宜有气泡,以免影响其表面放线菌的 生长; 2. 操作过程,勿碰动玻璃纸菌面上的培 养物。
五、思考题
1. 为什么在培养基上放了玻璃纸后放线菌 仍能生长?
2. 玻璃纸法可否用于其他微生物?为什么?
三、实验器材
放线菌养殖方法

放线菌养殖方法
放线菌是一种重要的微生物资源,具有广泛的应用前景,如制药、农业、环保等。
下面介绍一种放线菌的养殖方法:
1. 培养基的配制:将酵母提取物、大豆粉、葡萄糖、石膏、镁硫酸盐、氯化钾等原料按一定比例混合,加入蒸馏水中混合均匀,过滤后灭菌,即为放线菌的培养基。
2. 菌种接种:将放线菌菌种接种于培养基上,放入恒温培养箱中,在适宜的温度和湿度下培养。
3. 培养条件的调节:放线菌的生长需要一定的温度、湿度和营养物质,应根据不同放线菌的要求进行合理的调节。
4. 采收和提取:采收放线菌后,可以通过离心、超声波破碎等方式将菌体分离提取,得到放线菌的发酵产物。
以上就是放线菌养殖的基本方法,希望对广大科研人员和农业生产者有所帮助。
- 1 -。
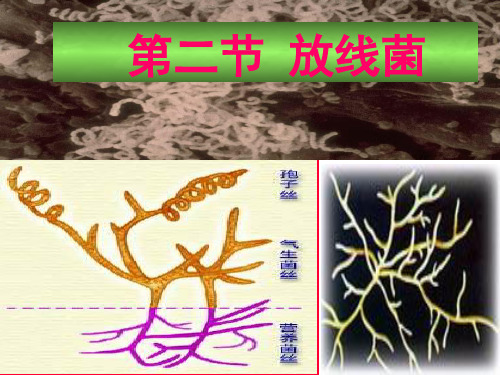
第七章 放线菌
四、病原性放线菌
少数寄生型放线菌可引起动植物病害
丛生轮生菌丝菌丝气生菌丝孢子丝气生菌丝孢子丝放线菌的菌丝形态结构模式图基质菌丝培养基分生孢子二孢子放线菌的繁殖器官分生孢子孢子囊孢子孢子排列方式形态颜色表面结构多样可用于种的鉴别
第二节 放线菌
看书找答案
1.放线菌的形态是?由哪些部分组成? 2.放线菌的繁殖方式是? 3.放线菌的培养条件是?
主要特点:
孢子丝
气生菌丝 菌
丝
培养基
基质菌丝
放线菌的菌丝形态结构(模式图)
(二)孢子
放线菌的繁殖器官
孢子 孢子囊孢子
排列方式、形态、颜色、 表面结构多样,可用于 种的鉴别。
分生孢子
பைடு நூலகம் 小单孢菌
小双孢菌
二、放线菌的培养特性 (一)培养条件
1、最适温度:28-32℃ 2、最适酸碱度: pH=7.2-7.6 3、气体:多为好气需氧
原核单细胞型微生物 呈分枝状 细胞壁含肽聚糖,革兰染色阳性 以孢子繁殖 生活在弱碱性环境 对抗生素的敏感性与细菌相同
一、放线菌的形态构造 分枝状原核单细胞微生物.
由菌丝和孢子组成。
(一)菌丝:分支状
细胞壁含肽聚糖,革兰染色阳性 1、菌丝直径:0.2-1.2μm. 2、根据形态和功能不同菌丝可分为: 基内菌丝(营养菌丝):吸收营养 气生菌丝:可分化为孢子丝 孢子丝:产生孢子 形态:直、波曲、螺旋 着生方式:丛生、轮生
生活史: 基内菌丝
萌发
条件适宜
气生菌丝
孢子丝 孢子
放线菌的生活史
孢子丝分化形成的孢子
2.2.3放线菌的生活史:
孢子丝 气生菌丝 孢子萌发
基内菌丝
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
放线菌的活菌计数与分离纯化
摘要:本次试验使用了含放线菌的固体制剂,在培养基中获取放线菌,并用平板涂布法进行活菌计数,然后挑取单菌落进行了纯培养,获取纯种的放线菌。
关键词:放线菌活菌计数平板分离技术
前言:本实验采用了活菌计数法中的平板涂布菌落技术法,通过梯度稀释和涂布平板,最终观察平板上的菌落数来计算原制剂中单位质量内含菌的数目,但由于不能绝对保证一个菌落只是有一个活细胞所形成的,计算出的活菌数称为菌落形成单位(CFU),CFU并不完全等同于样品种的活菌数。
由于放线菌的菌落形态与其他菌种的菌落形态大相径庭,所培养出的菌落通过观察即可大致的辨认出。
通过对平板上单菌落的划线培养,获得由单一细菌形成的单菌落,再接入试管斜面上进行菌落的保存。
1材料和方法
1.1材料
1.1.1菌种
固体菌制剂
1.1.2培养基
高氏1号培养基(可加如氯霉素作为放线菌分离培养基)
1.1.3溶液及试剂
氯霉素,盛9ml和4.5ml无菌水的试管,盛99ml无菌水并带有玻璃珠的三角烧瓶
1.1.4仪器及其他用品
无菌玻璃涂棒,无菌吸管,接种环,无菌培养皿等。
1.2方法
1.2.1稀释涂布平板法
1.2.1.1倒平板:将高氏1号琼脂培养基(含氯霉素1ml/1000ml)加热融化,冷却至55~60℃时,倒平板10个。
1.2.1.2制备土壤稀释液:称取土样10g,放入盛90ml无菌水并带有玻璃珠的三角烧瓶中,振摇约20min,使土样与水充分混合,使细胞分散。
用一支1ml无菌吸管吸取1ml土壤悬液加入盛有9ml无菌水的大试管中混合均匀,此为10-1 稀释液,10-2,10-3,10-4,10-5,和10-6几种稀释度的土壤溶液.
1.2.1.3涂布:将上述每种培养基的平板底部或培养皿盖周边用记号笔分别写上10-4,10-5,和10-63种稀释度字样,每种培养基的每稀释度标记3皿,然后用无菌吸管分别由10-4,10-5,和10-63管土壤稀释液中吸取适量对号放入已写好稀释度的平板中央位置,每皿准确放入0.2ml,用无菌玻璃涂棒在培养基表面轻轻地涂布均匀,其方法是将菌液先沿一条直线轻轻地来回推动,使之分布均匀,然后改变方向90°沿另一垂直线来回推动,平板内边缘处可改变方向用涂棒载涂布几次,室温下静置5-10min.
1.2.1.4:培养:将含高氏Ι号培养基倒置于28°C温室中培养3~5d.
1.2.1.5挑菌落:将培养后长出的单菌落分别挑去少量菌苔接种到高氏Ι号培养基的斜面上,置于28°C下温室培养;待菌苔长出后,检查其特征是否一致,同时将细胞涂片染色后用显微镜检查是否为单一的微生物细胞.若发现有杂菌.需再次进行分离纯化,直到获得纯培养.
1.2.2平板划线分离法
1.2.2.1倒平板:按稀释涂布平板法倒平板,并用记号笔标明培养基名称、土样编号和实验日期等。
1.2.2.2划线:在近火炎处,左手拿皿底,右手拿接种环,挑取上述10-1的土壤悬液一环在平板上划线。
用接种环按无菌操作挑取土壤悬液一环。
先在平板培养基的一边做第一次平板划
线,再转动平板约70°角,并将接种环上剩余物烧掉,待冷却后挑取悬液穿过第一次划线部分进行第二次划线,再用相同的方法穿过第二次划线部分进行第三次划线或再穿过第三次划线进行第四次划线划线完毕后,盖上培养皿,倒置于温室培养。
1.2.2.3挑菌落:从分离的平板上单个菌落挑取少许菌苔,涂在载玻片上,在显微镜下观察细胞的个体形态,结合菌落形态特征,综合分析。
如为不纯,仍需平板分离法进行纯化,直至确认纯培养为止。
