化学课件《离子晶体》优秀ppt(说课) 人教课标版
合集下载
人教版选修3 化学:3.4 离子晶体 课件(共22张PPT)

三、晶格能
1.定义:气态离子形成1摩离子晶体时释放的 能量。 仔细阅读表3—8,分析晶格能的大小与离子 晶体的熔点有什么关系?离子晶体的晶格能 与哪些因素有关? 2.晶格能的大小与阴、阳离子所带电荷的乘 积成正比,与阴、阳离子间的距离成反比。
3.晶格能对离子晶体性质的影响: 晶格能越大 (1)形成的离子晶体越稳定(离子键越强); (2)熔点越高; (3)硬度越大。
铯离子:6个 ;氯离子:8个
CaF2型晶胞
Ca2+
F-
一个CaF2晶胞中含: 4个Ca2+和8个F-
Ca2+的配位数: 8 F-的配位数: 4
ZnS型晶胞
①阳离子的配位数:4 ②阴离子的配位数:4 ③一个ZnS晶胞中含: 4个阳离子和4个阴离子
6.离子晶体的特点 (1)无单个分子存在;NaCl不表示分子式 (2)且随着离子电荷的增加,核间距离的缩短, 熔点升高 (3)熔沸点较高,硬度较大,难挥发难压缩 (3)一般易溶于水,而难溶于非极性溶剂 (4)固态不导电,水溶液或熔融状态下能导电
金属元素的原子 特征: 没有饱和性和方向性,以离子键结合
的化合物倾向于紧密堆积,每个离子 周围尽可能多的吸引异性离子
影响因素: 离子电荷和离子半径
二、离子晶体
1.定义: 由阳离子和阴离子通过离子键结 合而成的晶体。
2.成键粒子: 阴、阳离子 3.相互作用力: 离子键 4.常见的离子晶体:
强碱、活泼金属氧化物、大部分的盐类。
A.NH4Cl B.SiO2 C.P4 D.Na2SO4
2.下列晶体中,熔点最高的是( B )
A.KF
B.MgO C.CaO D.NaCl
3.下列性质适合于离子晶体的是( A ) ①熔点1070 ℃,易溶于水,水溶液能导电 ②熔点10.31 ℃,液态不导电,水溶液能导电 ③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃ ④熔点97.81 ℃,质软,导电,密度0.97g/cm3 ⑤熔点-218 ℃,难溶于水 ⑥熔点3900℃,硬度很大,不导电 ⑦难溶于水,固体时导电,升温时导电能力减弱 ⑧难溶于水,熔点高,固体不导电,熔化时导电
人教版《离子晶体》优质ppt课件1

(2)CsCl晶体
Cs+ ClCsCl晶体的结构
离子晶体
(2)CsCl晶体
①铯离子和氯离子的位置: 氯离子:顶点(构成简单立方堆积) 铯离子:体心(填充在立方体空隙中) ②每个晶胞含铯离子、氯离子的个数:
铯离子:1 氯离子:8×1/8=1
③配位数:8:8 与Cs+最近且等距离的Cl-有 8 个 与Cl-最近且等距离的Cs+有 8 个
离子晶体 (4)ZnS晶体
离子晶体
(4)ZnS晶体
①锌离子和硫离子的位置: 硫离子:面心和顶点
锌离子:小四面体体心
②每个晶胞含铯离子、氯离子的个数: 硫离子:8×1/8+6 ×1/2 =4 锌离子:4×1=4
③配位数:8:4 与Zn2+最近且等距离的S2-有 4 个 与S2-最近且等距离的Zn2+有 4 个
③配位数:6:6 与Na+最近且等距离的Cl-有 6 个 与Cl-最近且等距离的Na+有 6 个
离子晶体
(1)NaCl晶体
①1个NaCl晶胞中含 4 个Na+和 4 个Cl-。
②NaCl晶体中 无 NaCl分子,化学式NaCl
表示_N_a__+和___C_l_-的___最__简__个__数___比_。
A. K层
B. L层
C. M层
D. N层
D. 钢管发生析氢腐蚀,负极反应是Fe—3e- =Fe3+
【解析】
NaCl
CsCl
CaF2
ZnS
离子晶体
(1)NaCl晶体
NaCl晶体的结构
离子晶体
(1)NaCl晶体
①钠离子和氯离子的位置: 氯离子:面心和顶点(构成面心立方最密堆积) 钠离子:体心和棱心(填充在八面体空隙中) ②每个晶胞含钠离子、氯离子的个数:
Cs+ ClCsCl晶体的结构
离子晶体
(2)CsCl晶体
①铯离子和氯离子的位置: 氯离子:顶点(构成简单立方堆积) 铯离子:体心(填充在立方体空隙中) ②每个晶胞含铯离子、氯离子的个数:
铯离子:1 氯离子:8×1/8=1
③配位数:8:8 与Cs+最近且等距离的Cl-有 8 个 与Cl-最近且等距离的Cs+有 8 个
离子晶体 (4)ZnS晶体
离子晶体
(4)ZnS晶体
①锌离子和硫离子的位置: 硫离子:面心和顶点
锌离子:小四面体体心
②每个晶胞含铯离子、氯离子的个数: 硫离子:8×1/8+6 ×1/2 =4 锌离子:4×1=4
③配位数:8:4 与Zn2+最近且等距离的S2-有 4 个 与S2-最近且等距离的Zn2+有 4 个
③配位数:6:6 与Na+最近且等距离的Cl-有 6 个 与Cl-最近且等距离的Na+有 6 个
离子晶体
(1)NaCl晶体
①1个NaCl晶胞中含 4 个Na+和 4 个Cl-。
②NaCl晶体中 无 NaCl分子,化学式NaCl
表示_N_a__+和___C_l_-的___最__简__个__数___比_。
A. K层
B. L层
C. M层
D. N层
D. 钢管发生析氢腐蚀,负极反应是Fe—3e- =Fe3+
【解析】
NaCl
CsCl
CaF2
ZnS
离子晶体
(1)NaCl晶体
NaCl晶体的结构
离子晶体
(1)NaCl晶体
①钠离子和氯离子的位置: 氯离子:面心和顶点(构成面心立方最密堆积) 钠离子:体心和棱心(填充在八面体空隙中) ②每个晶胞含钠离子、氯离子的个数:
人教版化学选修三3.4离子晶体 课件ppt优秀课件

知识2、晶格能
3、晶格能的作用: 熔点越高硬度越大
晶格能越大 离子键越强
形成的晶体越稳定
岩浆晶出规则与晶格能
晶体析出次序与晶格能
矿物
晶格能 KJ/mol
晶出次序
ZnS 771.41
先
PbS
670.0
后
橄榄石 4400
最先
问题解读
1.离子晶体结构特点
课时小结 构成微粒 阴(阳)离子 微粒间作用力 离子键
配位数
4
半径比 0.2~0.4
空间构型 ZnS
6 0.4~0.7 NaCl
8 0.7~1.0 CsCl
问题解读
知识2、晶格能
1、定义:拆开1mol 离子晶体,形成完全气态阴阳离子所吸收的能量。
符号 U
氟化物 晶格能 /kJ·mol-1
NaF 923
MgF2 AlF3
2957 5492
2、晶格能的大小的影响因素 离子半径、所带电荷 所带电荷越多,离子半径越小,离子间的距离越小,晶格能越大
化学 · 选修 3
3.2.2离 子 晶 体
图片导学
离
子
食
晶
盐
体
视频导学
思考 为什么氯化钠的性质与干冰、金刚石的不同? 讨论
氯化钠 干冰 金刚石
熔点 (℃)
801
-56.2 3550
知识1、离子晶体
问题解读
1、定义: 由阳离子和阴离子通过离子键结合而成的晶体。
2、成键粒子: 阴、阳离子 3、相互作用力: 离子键
知识解读
知识1、离子晶体 ④ NaCl的晶体结构配位数
知识解读 与Na+等距离且最近的Cl¯ 有:6个
---Cl--- Na+
《离子晶体》高二上册化学选修三PPT课件

(3)CaF2型晶胞
1、一个ZnS晶胞中含: 4个阳离子和4个阴离子
2、阳离子的配位数:4 阴离子的配位数:4
科学探究
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子 晶体中离子配位数的因素。
配位数
4
6
8
半径比 0.2~0.4 0.4~0.7 0.7~1.0
空间构型 ZnS NaCl CsCl
我们用η表示含有的次品数,则η是一个随机变量. η=0,表示含有0个次品; η=1,表示含有1个次品; η=2,表示含有2个次品; η=3,表示含有3个次品; η=4,表示含有4个次品.
新知探究
例题3 从10张已编号的卡片(从1号到10号)中任取1张,被取出的卡片的号数ξ;
解:ξ可取1,2,…,10.
在研究随机现象时,需要根据所关心的问题恰当的定义随机变量.
例如,如果我们仅关心电灯泡的使用寿命是否不少于1000小时,那么就可以定义如下的随机变量:
课堂练习
1.在医学生物学试验中,经常以果蝇作为试验对象,一个关有6只果蝇的笼子里,不慎混入了两 只苍蝇(此时笼内共有8只蝇子:6只果蝇和2只苍蝇),只好把笼子打开一个小孔,让蝇子一只 一只地往外飞,直到两只苍蝇都飞出,再关闭小孔.以ξ表示笼内还剩下的果蝇的只数. (1)写出ξ的分布列(不要求写出计算过程);
解: ① ξ可取0,1,2,3.
ξ=i表示取出i支白粉笔,3-i支红粉笔,其中i=0,1,2,3;
② ξ可取3,4,5,6,7.其中 ξ=3表示取出分别标有1,2的两张卡片; ξ=4表示取出分别标有1,3的两张卡片; ξ=5表示取出分别标有1,4或2,3的两张卡片; ξ=6表示取出分别标有2,4的两张卡片; ξ=7表示取出分别标有3,4的两张卡片.
人教版《离子晶体》课件PPT

(人教版选修3)第三章《晶体结构与性质》
(3)离子晶体的化学式只表示晶体中阴阳离子的个数 比,而不是表示分子的组成。
(4)离子晶体的组成特点:①离子晶体由阴阳离子组 成,阴阳离子间的作用力是离子键;②离子晶体中不一定 都含有金属元素,如NH4Cl是离子晶体;③离子晶体中除 离子键外不一定不含其他化学键,如:NaOH晶体中还含有 极性共价键,Na2O2晶体中还含有非极性共价键;④由金 属元素和非金属元素组成的晶体不一定是离子晶体,如: AlCl3是由金属元素Al和非金属元素Cl组成的分子晶体, 含有金属离子的晶体不一定是离子晶体,如:金属晶体中 含有金属阳离子。
) A.分子晶体中一定含有共价键 B.原子晶体中共价键越强,熔点越高 C.离
子晶体中含有离子键,不含有共价键 D.金属阳离子只能存在于离子晶体中
子化合物;②主要类型:活泼金属的氧化物、氢化物、强 1.下列说法正确的是( ) A.分子晶体中一定存在分子间作用力,不一定存在共价键 B.分子中含两个氢原子的酸一定是二元酸
(人教版选修3) 第 三章《晶体结构与性质》
1.已知某离子晶体晶胞如图所示,其摩尔质量为M,阿伏加德罗常数为NA,晶体的密度为d g/cm3。 【温馨提示】离子晶体中除含有离子键外,还有可能含有共价键、配位键。 C.NaI晶体中既有离子键,又有共价键 D.共价键和离子键没有明显的界线 下面是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( ) ②离子的电荷数:离子正、负电荷的比值决定阴、阳离子的个数比,这对配位数有重要影响。 C.离子晶体中也可能含有共价键,如氢氧化钠属于离子晶体,既含有离子键,又含有共价键,故C错误; 【讨论交流】以生活中常见的离子晶体氯化钠为例,思考离子晶体具有哪些重要的物理性质? 当升高温度时,阴、阳离子获得足够能量克服离子间的相互作用,成为自由移动的离子,在外界电场作用下,离子定向移动而导电。 每个Cl-周围最近距离的Cs+也有 与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由此可知图(1)和(4)是属于 NaCl晶体的,C项正确,A、B、D三项错误。 不良导体(个别为半导体) (3)CaF2型:CaF2晶体中每个Ca2+周围同时吸引着8个F-,每个F-周围同时吸引着4个Ca2+(如图所示)。 NaCl>CsCl等。 元素的非金属性越强,其单质的活动性不一定越强,例如氮气。 ①每个Cs+周围最近距离的Cl-有8个,构成正六面体构型; 在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,故A正确; 分子周围有12个CO2 分子紧邻 D.在碘晶体中,碘分子的排列有两种不同的方向 31 ℃,液态不导电,水溶液能导电 ③能溶于CS2,熔点112. 【温馨提示】通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,一个离子可以同时 吸引多个异电性离子。 每个Cl-周围最近距离的Cs+也有 组成结构相似时,比较相对分子质量 ③离子晶体中除离子键外不一定不含其他化学键,如:NaOH晶体中还含有极性共价键,Na2O2晶体中还含有非极性共价键; 【温馨提示】(1)NaCl型:
人教版高中化学选修三第三章第四节离子晶体(17张ppt)
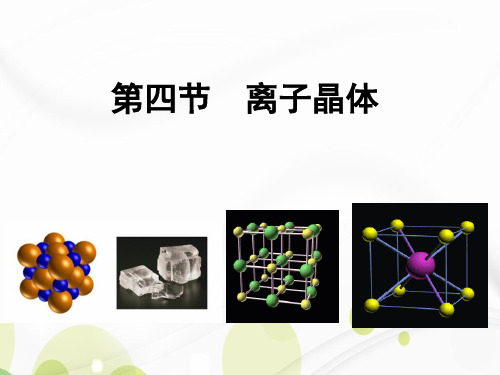
MgCl2 > CaCl2 > SrCl2 > BaCl2
熔点/℃ 摩氏硬度
NaBr 1
298 747
747 <2.5
NaCl 1
282 786
801 2.5
MgO 2
210 3791
2852 6.5
分析影响晶格能的因素
离子所带电荷越多、离子半径越小,晶格能 越大,离子键就越强。
1. 比较下列离子化合物的熔点
NaF < MgF2 < AlF3
2. 比较下列离子键强度
熔 沸 点 较 高
硬 度 较 大
离子晶体 CsCl NaCl NaBr NaI
熔点
645℃ 801℃ 747℃ 661℃
沸点
1290℃ 1413℃ 1390℃ 1304℃
离子所带电荷越多、离子半径越小,离子键就越强
5、离子晶体的物理通性 熔、沸点较高 硬度较大,质脆,延展性差
+-+-+-+ -+-+-+-
离子半径(pm) 95 169 181 74 184
NaCl型 CsCl型 ZnS型
r+ r- = 0.52
r+ r- = 0.93 r+ r- = 0.40
C.N.=6 C.N.=8 C.N.=4
(1)几何因素:晶体中正负离子的半径比 (2)电荷因素:晶体中正负离子的电荷比
思考:离子晶体的熔、沸点有什么特点?
受外力作用
+-+-+-+ -+-+-+-
二、晶格能
气态阴离子和气态阳离子形成1mol 离子晶体释放的能量
例: Na+(g) + Cl-(g)
熔点/℃ 摩氏硬度
NaBr 1
298 747
747 <2.5
NaCl 1
282 786
801 2.5
MgO 2
210 3791
2852 6.5
分析影响晶格能的因素
离子所带电荷越多、离子半径越小,晶格能 越大,离子键就越强。
1. 比较下列离子化合物的熔点
NaF < MgF2 < AlF3
2. 比较下列离子键强度
熔 沸 点 较 高
硬 度 较 大
离子晶体 CsCl NaCl NaBr NaI
熔点
645℃ 801℃ 747℃ 661℃
沸点
1290℃ 1413℃ 1390℃ 1304℃
离子所带电荷越多、离子半径越小,离子键就越强
5、离子晶体的物理通性 熔、沸点较高 硬度较大,质脆,延展性差
+-+-+-+ -+-+-+-
离子半径(pm) 95 169 181 74 184
NaCl型 CsCl型 ZnS型
r+ r- = 0.52
r+ r- = 0.93 r+ r- = 0.40
C.N.=6 C.N.=8 C.N.=4
(1)几何因素:晶体中正负离子的半径比 (2)电荷因素:晶体中正负离子的电荷比
思考:离子晶体的熔、沸点有什么特点?
受外力作用
+-+-+-+ -+-+-+-
二、晶格能
气态阴离子和气态阳离子形成1mol 离子晶体释放的能量
例: Na+(g) + Cl-(g)
离子晶体PPT课件新人教版选修3.pptx

与Na+等距离且最近的Na+ 有:12个 与Na+等距离且最近的Cl- 有:6个 Na+和Cl- 的配位数均为: 6
一、离子晶体
4、晶胞类型
(1)氯化钠型晶胞
NaCl的晶体结构模型
---Cl- --- Na+
一、离子晶体 4、晶胞类型
(1)氯化钠型晶胞
NaCl晶体中阴、阳离子配位数
Cl配 位 数 为 6
晶体类型
结 构成粒子 构
微粒间作 用力
物 硬度 理 性 延展性 质
熔点
分子晶体
分子
分子间作用力(范德华 力和氢键) 小
差 低
离子晶体 阴、阳离子
离子键 较硬而脆
差 较高
原子晶体 原子
共价键 很大 差 高
溶解性
“相似相溶”
多易溶于水
不溶
导电性 导热性
不良 不良
固态不导电, 熔化或溶于
水导电
不良
不良 不良
课堂练习
• 1、下表列出了有关晶体的知识,其中错误的是( B )
A
B
C
D
晶体
硫化钾 干冰 金刚石 碘
组成晶体的微粒 阴阳离子 分子 原子 分子
晶体微粒间存在的 离子键 作用力
共价键 共价键 范德华力
• 2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是 (C )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO • 3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
解:在该晶体中最小正方体中所含的
N即i晶2+、体O中2-每个个数小均正为方: 体4×中18平=均12(含个有)1/2个
一、离子晶体
4、晶胞类型
(1)氯化钠型晶胞
NaCl的晶体结构模型
---Cl- --- Na+
一、离子晶体 4、晶胞类型
(1)氯化钠型晶胞
NaCl晶体中阴、阳离子配位数
Cl配 位 数 为 6
晶体类型
结 构成粒子 构
微粒间作 用力
物 硬度 理 性 延展性 质
熔点
分子晶体
分子
分子间作用力(范德华 力和氢键) 小
差 低
离子晶体 阴、阳离子
离子键 较硬而脆
差 较高
原子晶体 原子
共价键 很大 差 高
溶解性
“相似相溶”
多易溶于水
不溶
导电性 导热性
不良 不良
固态不导电, 熔化或溶于
水导电
不良
不良 不良
课堂练习
• 1、下表列出了有关晶体的知识,其中错误的是( B )
A
B
C
D
晶体
硫化钾 干冰 金刚石 碘
组成晶体的微粒 阴阳离子 分子 原子 分子
晶体微粒间存在的 离子键 作用力
共价键 共价键 范德华力
• 2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是 (C )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO • 3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
解:在该晶体中最小正方体中所含的
N即i晶2+、体O中2-每个个数小均正为方: 体4×中18平=均12(含个有)1/2个
化学课件《离子晶体》优秀ppt11 人教课标版

6.某离子晶体部分结构如图 (1)晶体中每个Y同时吸引着最近的 4 个X,每个X同时吸引着最 ____ 8 个Y,该晶体的化学式 近的___ XY2 为________ (2)晶体中每个X周围与它最近且 12 个. 距离相等的X共有________ (3)晶体中距离最近的2个X与一个 109°28′ Y形成的夹角∠XYX的角度_____
5 、常见的离子晶体: 讨论:哪些物质属于离子晶体? 强碱、活泼金属氧化物、大部分的盐类。
二、晶格能:
拆开1mol离子晶体使之形成气态阴 ①定义: 离子和阳离子所吸收的能量。 ②符号和单位:
U; kJ· mol-1
讨论:1、晶格能与离子型化合物的物理性质的关系
2、影响晶格能的因素有哪些
NaBr 离子电荷数 核间距/pm 晶格能 /kJ.mol-1 熔点/℃ 摩氏硬度 1 298 747
( 1)每个Na+吸引——个Cl—,每个Cl-吸引——个 Na+。NaCI是分子式吗?—— (2)每个Na+周围与之等距离且最近的Na+有——个; 每个Cl-周围与之等距离且最近的Cl-有——个 (3)宏观的NaCI晶体是无数个晶胞延伸构成的, 位于顶点、面心、棱边、体心上的微粒实际提供 给每个晶胞的比例是—— (4)在每个NaCI晶胞中,平均占有Na+——个, Cl-———个,能否从晶胞的角度出发,再分析 NaCI的化学式的由来?————
(4)每个晶胞中有 Cs+,有 个Cl-
小结
8 个 Cl-,每个Cl1、每个Cs+同时吸引 同时吸引 8 个Cs+,而Cs+数目与Cl-数目之 为 1:1 化学式为 CsCl
2、在每个Cs+周围与它最近的且距离相等的 Cs+有 12 个
《离子晶体》ppt课件

铯离子:6个;氯离子:8个
( 配位数)
科学探究:
• 找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
பைடு நூலகம்
6
CsCl
8
8
13
(3)立方ZnS型(BeO、BeS)
14
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
●阴阳离子间通过离子键结合而成的晶体。
食盐(晶体)的形成:
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NCa+l--
Na+
ClNa+ Cl-
Cl-
Na+
1
NaCl的晶体结构示意图
Cl2
Na+
每个Na+周围有六个Cl3
每个Cl-周围有六个Na+ 4
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
( 配位数)
科学探究:
• 找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
பைடு நூலகம்
6
CsCl
8
8
13
(3)立方ZnS型(BeO、BeS)
14
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
●阴阳离子间通过离子键结合而成的晶体。
食盐(晶体)的形成:
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NCa+l--
Na+
ClNa+ Cl-
Cl-
Na+
1
NaCl的晶体结构示意图
Cl2
Na+
每个Na+周围有六个Cl3
每个Cl-周围有六个Na+ 4
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
人教版化学选修三离子晶体精品课件ppt

为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
典型离子晶体的结构(模型)
1.氯化钠晶体的结构模型 ①钠离子和氯离子的配位数: 每个Na+周围同时吸引6 个Cl-,每个Cl-周围同时 吸引6个 Na+ 化学式:NaCl ②每个晶胞含钠离子、氯离子的个数:
课堂练习
1. 如图所示,在氯化钠晶体中,与每个Na+等
距离且最近的几个Cl-所围成的空间几何构型
是(B )
A. 十二面体
B. 正八面体
C. 正六面体
D. 正四面体
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
晶格能的作用和意义
晶格能越大 ,则 ①形成的离子晶体越稳定;(离子键越强) ②熔点越高; ③硬度越大 ④岩浆中的矿物越易结晶析出
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
离子晶体的物理性质
①熔沸点较高 ②硬度较大 ③固态不导电,水溶液或者熔化时能导电 ④一般易溶于水,而难溶于非极性溶剂 规律:①一般而言,阴阳离子半径越小,所 带电荷越多,离子键越强,晶体熔沸点越高, 硬度越大; ②晶体熔沸点的一般规律: 原子晶体>离子晶体>分子晶体
化学课件《离子晶体》优秀ppt17 人教课标版
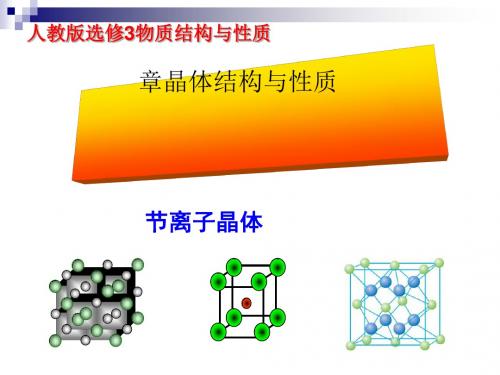
(4) 导电性 固态不导电,水溶液或者熔融状态下能导电。
随堂练习:
1、下列叙述错误的是(AD) A、带相反电荷离子之间的相互吸引 称为离子键
B、金属元素与非金属元素化合时, 不一定形成离子键
C、某元素的原子最外层只有1个电 子,它跟卤素相互结合时所形成的 化学键不一定是离子键
D、非金属原子间不可能形成离子键
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
二、晶格能
定义:气态离子形成1摩离子晶体时释放的
能量。
仔细阅读表3—8,分析 晶格能的大小与离子晶 体的熔点有什么关系? 离子晶体的晶格能与哪
些因素有关?
某些离子晶体的晶格能
F-
Cl-
【小结】本节的两个重点: 1、四种典型的离子晶体的结构。 2、影响离子晶体配位数的因素。
作业 自主学 P89 5、6、7、10。
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
离子晶体种类繁多,结构多样 4、几种常见的离子晶体的晶胞结构:
(1)氯化钠型晶胞
Na+ Cl-
钠离子和氯离子在晶胞中的位置:
氯离子:体心和棱中点; 钠离子:面心和顶点.
或者反之
(1)1个NaCl晶胞中,有 个Na+,有 个Cl-。
(2)在NaCl晶体中,Na+的配位数为 ,Cl-的配位数 为 。说明:离子晶体中某离子周围与它最近的异电性离 子的数目叫该离子的配位数 。 (配位数缩写为C.N.)
随堂练习:
1、下列叙述错误的是(AD) A、带相反电荷离子之间的相互吸引 称为离子键
B、金属元素与非金属元素化合时, 不一定形成离子键
C、某元素的原子最外层只有1个电 子,它跟卤素相互结合时所形成的 化学键不一定是离子键
D、非金属原子间不可能形成离子键
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
二、晶格能
定义:气态离子形成1摩离子晶体时释放的
能量。
仔细阅读表3—8,分析 晶格能的大小与离子晶 体的熔点有什么关系? 离子晶体的晶格能与哪
些因素有关?
某些离子晶体的晶格能
F-
Cl-
【小结】本节的两个重点: 1、四种典型的离子晶体的结构。 2、影响离子晶体配位数的因素。
作业 自主学 P89 5、6、7、10。
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
离子晶体种类繁多,结构多样 4、几种常见的离子晶体的晶胞结构:
(1)氯化钠型晶胞
Na+ Cl-
钠离子和氯离子在晶胞中的位置:
氯离子:体心和棱中点; 钠离子:面心和顶点.
或者反之
(1)1个NaCl晶胞中,有 个Na+,有 个Cl-。
(2)在NaCl晶体中,Na+的配位数为 ,Cl-的配位数 为 。说明:离子晶体中某离子周围与它最近的异电性离 子的数目叫该离子的配位数 。 (配位数缩写为C.N.)
新课标人教版化学选修三第三章离子晶体PPT课件
2021/7/24
23
科学视野P81 岩浆出晶规则与晶格能
晶格能高的晶体熔点高,更易 在在岩浆冷却过程中先晶出。
空间构型 ZnS NaCl CsCl
正四面体、正八面体、和立方体模型中阳离子
在中心,阴离子在顶点,对应的配位数分别是4、6、 8。中心的离子应与周围的离子相切,而周围的带 同种电荷的离子不能相切,阳、阴离子半径比减小
时,周围离子的距离会变近,当周围离子达到相切
时是一种极端情况,此时为阳、阴离子半径比的极 小值。
NaCl晶体中阴、阳离子配位数
(2)氯化铯型晶胞
1°铯离子和氯离子的位置: 铯离子:体心 氯离子:顶点;或者反之。
2°每个晶胞含铯离子、氯 离子的个数: 1个
3°与铯离子等距离且最近的铯离 子、氯离子各有几个?
铯离子:6个;氯离子:8个 (配位数)
CsCl晶体及晶胞结构示意图
---Cs+ ---Cl-
(3)一般易溶于水,而难溶于非极性溶剂。
(4)固态不导电,水溶液或者熔融状态下能 导电。
二、晶格能
1、定义:气态离子形成1摩离子晶体时释放 的
能量。
2、晶仔格细能阅的读大课小本的P80影表响3—因8素及下表,分析晶格
能的大小与离子晶体的熔点有什么关系?离子
晶体的晶格能与哪些因素有关?
氟化物
晶格能/kJ·mol-1
5、晶胞类型:(1)氯化钠型晶胞
1°钠离子和氯离子的位置:
①钠离子和氯离子位于立方体的顶 角上,并交错排列。 ②钠离子:体心和棱中点;
氯离子:面心和顶点,或反之。
2°每个晶胞含钠离子、氯离子的个数:
3°与Na+等距离且最近的Na+ 有:12个
化学课件《离子晶体》优秀ppt8 人教课标版

差别较大
无(硅为半导体)
无
导体
实例
金刚石、二氧化硅、 晶体硅、碳化硅
Ar、S等
Au、Fe、Cu、钢 铁等
晶体 氯化钠 干冰 金刚石
熔点 (℃)
801
思考:
-56.2 3550
为什么氯化钠的性质与干冰、金 刚石的不同?
阴、阳离子通过离子键形成离子晶体 1、离子晶体定义:由阳离子和阴离子通过离子键 结合而成的晶体 注: (1)结构微粒:阴、阳离子 (2)相互作用:离子键 (3)种类繁多:含离子键的化合物晶体:强碱、 活泼金属氧化物、绝大多数盐 (4)理论上,结构粒子可向空间无限扩展
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
(2)阴、阳离些子因的素半径有越关小?,晶格能越大。
晶格能 q1q2 r
(3)晶格能的作用
晶格能越大:
形成的离子晶体越稳定;(离子键越强) 熔点越高; 硬度越大。 晶格能也影响了岩浆晶出的次序,晶格
能越大,岩浆中的矿物越易结晶析出
小结:离子晶体的性质
无单个分子存在;NaCl不表示分子式。 熔沸点较高,硬度较大,难挥发难压缩。
0.934
配位数
4
6
8
半径比 0.2~0.4 0.4~0.7 0.7~1.0
空间构型
ZnS
NaCl
CsCl
无(硅为半导体)
无
导体
实例
金刚石、二氧化硅、 晶体硅、碳化硅
Ar、S等
Au、Fe、Cu、钢 铁等
晶体 氯化钠 干冰 金刚石
熔点 (℃)
801
思考:
-56.2 3550
为什么氯化钠的性质与干冰、金 刚石的不同?
阴、阳离子通过离子键形成离子晶体 1、离子晶体定义:由阳离子和阴离子通过离子键 结合而成的晶体 注: (1)结构微粒:阴、阳离子 (2)相互作用:离子键 (3)种类繁多:含离子键的化合物晶体:强碱、 活泼金属氧化物、绝大多数盐 (4)理论上,结构粒子可向空间无限扩展
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
(2)阴、阳离些子因的素半径有越关小?,晶格能越大。
晶格能 q1q2 r
(3)晶格能的作用
晶格能越大:
形成的离子晶体越稳定;(离子键越强) 熔点越高; 硬度越大。 晶格能也影响了岩浆晶出的次序,晶格
能越大,岩浆中的矿物越易结晶析出
小结:离子晶体的性质
无单个分子存在;NaCl不表示分子式。 熔沸点较高,硬度较大,难挥发难压缩。
0.934
配位数
4
6
8
半径比 0.2~0.4 0.4~0.7 0.7~1.0
空间构型
ZnS
NaCl
CsCl
化学课件《离子晶体》优秀ppt3 人教课标版

1 2
(×10-8㎝)3 =
62.0 a3
g.
㎝-3
总结
综合应用
变式 (1)NiO晶体结构与 NaCl相同,设NiO的摩尔质 量M g/mol,密度为ρg/mL, 阿伏加德罗常数为NA,求晶 胞中两个距离最近的氧离 子中心间的距离为多少cm?
解题思路: (1)每个晶胞中含NiO的个数(2) 一个晶胞的质量(3)一个晶胞的体积(4)晶胞 的边长(5)晶胞中任一个面对角线长度的一半
主页
综合应用
返回主菜单
(2)天然的和大部分人工制备的 晶体都存在各种缺陷,例如在 某种NiO晶体中就存在以下缺陷: 一个Ni2+空缺,另有两个Ni2+被 两个Ni3+所取代。其结果晶体仍 呈电中性,但化合物中Ni和O的 比值却发生了变化。某氧化镍 样品组成为Ni0.97O,试计算该晶 体中Ni3+与Ni2+的离子数之比。
⑵处于棱上的离 子,每个离子有 1/4属于晶胞。
⑶处于面上的离子,每个离子有1/2属于晶胞
⑷处于内部的离子,完全属于晶胞。
主页
思考
氯化铯 晶体中 氯离子 和铯离 子分别 处于晶 胞的什 么位置?
CsCl晶体的形成
14页 主页
氯化铯晶体
铯离子 氯离子
思考:氯化 铯晶体中氯离 子和铯离子分 别处于晶胞的
91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿·休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯·奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰·纳森·爱德瓦兹]
人教版《离子晶体》(上课)课件PPT1

如NaCl 和CsCl不是表示分子式。
2、离子所带电荷数:离子所带电荷数越多,离子键越强
三、离子晶体的特点(P83)
微粒种类 2、离子晶体中不存在的相互作用( )
金属阳离 (高考题)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合
阴阳离子 分子 原子 物化学式为
NaCl晶体中阴、阳离子配位数 三、离子晶体的特点(P83)
化而远离所吸收的能量。 解释下列离子晶体熔点高低的顺序。
提示 离子化合物中除存在离子键外,还可能存在共
2、离子晶体中不存在的相互作用( )
3、特性
4、晶体分析
合而成的化合物。
1、每个Na+与 个Cl-配位, 每个Cl-与
个Na+配位。
吸收的能量越多,晶格能越大,表 2、离子晶体中不存在的相互作用( )
每个Ba2+与 8 个Pb4+配位,每个Ba2+与 6
个
Ba2+配位
小结:
1、定义 3、特性
2、晶格能 4、晶体分析
作业布置: 双基二、课本P84:7、8、9
4、晶体的种类
(四、空根间构型据(探内究离部子晶体微的配粒位数的) 种类和微粒间的相互作用不同,)
(3)CH 4和CCl 4
C、晶格能:NaCl<NaBr D、熔沸点:CO2>NaCl
晶体类型 金属晶体 离子晶体 分子晶体 原子晶体 离子所带电荷数、阴阳离子间距离(离子半径)、晶体结构型
1、下列关系正确的是( )
,每个Ba2+与
个O2-配位。
子、自由 (3)CH 4和CCl 4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
引入
为什么固态的氯化钠不导电?
什么使阴、阳离子不能自由移动?
交流与讨论
阅读课本81页
破坏离 子键
熔点高低与晶格能大小的关系? 晶格能的影响因素有哪些?
知识巩固
试从结构角度解释以下现象
1.已知卤化钾的熔点
卤化钾 熔点/℃ KCl 772 KBr 735 KI 680
2.为什么离子晶体受到外力作用时容易破裂
个,距离是 个,距离是 个,距离是
. . .
2. 难点突破
确定氯化钠晶体中的晶胞结构
借助多媒体动画,教会学生如何进
行空间想像, 从而确定出氯化钠的晶胞
结构和化学式的含义.
交流讨论
确定氯化钠的晶胞结构
创设情境引起质疑
你认为NaCl晶体中,钠离子和氯离子的个 数比是多少? 请同学们算一下, 晶胞中钠离子和氯离子 的个数各为多少?
步骤2: 推测出阴、阳离子的相对位置
图中的圆点(不考虑体积的大小) 代表Na+或Cl-所处
的位置, 请将其中代表Na+的圆用笔涂黑,以完成 NaCl晶 体结构的假设。 画的过程就 是一个思考、想 象的过程. 让每个同学 都参与到这个思 维活动中.
步骤3: 交流讨论推测出的阴、阳离子相对位置是 否合理 为 什 么 要 这 样 画 ?
发现矛盾
进行批判性思考
孤立地看待问题
形成晶胞可以延伸的思想
多媒体展示
交流与讨论
归 纳 立 方 体 微 粒 数 计 算 的 方 法
体心
面心
顶点
棱心
小 结 氯 化 钠 化 学 式 的 含 义
在详细讨论氯化钠晶体结构特点的基
础上,使学生懂得从晶胞这个结构单元的
角度来认识晶体的内部结构,并利用它来 解决氯化铯及其他离子晶体的问题.
知识迁移应用
1. 以下是CsCl晶体结构图, 观察每个Cs+周围有几
个Cl- , 每个Cl-周围有几个Cs+. 计算一个晶胞中
实际拥有的阴、阳离子的个数. 复习空间想 像过程, 使 学生真正掌 握离子晶体 的研究方法
知识迁移应用
2. 确定钛酸钙的化学式
3. 难点突破
氯化钠晶体导电原因
借助多媒体将宏观现象和微观分析有效结 合起来,化抽象为具体.
2a
若立方体棱长为2a, 计算
d ( - )min = a ,
d ( - ) min = 2 a;
d ( - ) min = 2 a ,
合作究
氯化钠中阴、阳离子的配位数
1. 晶体中,与Na+距离最近的Cl-共有 2. 晶体中,与Cl-距离最近的Na+共有 3. 晶体中,与Na+距离最近的Na+共有
通过推测得到的结构与真实情况是否相符
步骤4: 验证我们得出的氯化钠晶体结构是否正确
布拉格首创用X射线衍射法来测定氯化钠的晶
体结构,并获得了1915年的诺贝尔奖。
1)氯化钠晶体属于立方晶系 2)若 d Na+- Cl- = a 则 d Cl-- Cl- = 2 a
d Na+-Na+ =
2
a
确定出晶体中阴、阳离子之间的相对距离
作业布置
• 请自行制作一个氯化钠晶体模型 • 上网查找关于离子晶体应用的相关 知识以小组形成写一篇相关报告
谢 谢 !
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰· B· 塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔· 卡内基] 87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯· 瑞斯] 88.每个意念都是一场祈祷。――[詹姆士· 雷德非] 89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰] 91.要及时把握梦想,因为梦想一死,生命就如一只羽翼受创的小鸟,无法飞翔。――[兰斯顿· 休斯] 92.生活的艺术较像角力的艺术,而较不像跳舞的艺术;最重要的是:站稳脚步,为无法预见的攻击做准备。――[玛科斯· 奥雷利阿斯] 93.在安详静谧的大自然里,确实还有些使人烦恼.怀疑.感到压迫的事。请你看看蔚蓝的天空和闪烁的星星吧!你的心将会平静下来。[约翰· 纳森· 爱德瓦兹] 94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰· 拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉· 班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳] 97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔· 普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉· 彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔· 卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰· 罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳· 厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝· C· 科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔· 卡内基] 110.每天安静地坐十五分钟· 倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克· 佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根· 皮沙尔· 史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。 ――[阿萨· 赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉· 海兹利特] 116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯· 里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可· 汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰· 夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯· 米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子] 126.在寒冷中颤抖过的人倍觉太阳的温暖,经历过各种人生烦恼的人,才懂得生命的珍贵。――[怀特曼] 127.一般的伟人总是让身边的人感到渺小;但真正的伟人却能让身边的人认为自己很伟大。――[G.K.Chesteron] 128.医生知道的事如此的少,他们的收费却是如此的高。――[马克吐温] 129.问题不在于:一个人能够轻蔑、藐视或批评什么,而是在于:他能够喜爱、看重以及欣赏什么。――[约翰· 鲁斯金]
学生阅读、分析、讨论 学生讨论
1.难点突破
氯化钠晶体结构 通过活动探究, 使学生自发形成氯化 钠的空间三维结构,从而顺利得出阴、阳离 子的配位数.
