测定氨基酸的方法以及试剂
茚三酮显色法测定氨基酸含量

❖(3)茚三酮显色液:称取85mg茚三酮和 15mg还原茚三酮,用10ml乙二醇甲醚溶解 (15ml/组)
❖ 还原型茚三酮按下法制备:称取0.5g茚三酮, 用12.5ml沸蒸馏水溶解,得黄色溶液。将 0.5g维生素C用25ml温蒸馏水溶解,一边搅 拌一边将维生素C溶液滴加到茚三酮溶液中, 不断出现沉淀滴定后继续搅拌15min,然后 在冰箱内冷却到4℃,过滤、沉淀用冷水洗 涤3次,真空干燥,置五氧化二磷真空干燥 器中保存备用
• 样品同时做三份取平均数
四、结果与计算
• 氨基酸的含量(g/100ml)=X*100
——X为查标准曲线所获得每ml含量g数
• 自配样品
——X*250/称取克数(X为查标准曲线所获得 每ml含量g数)
——250为稀释的倍数
• 五、讨论与分析
• 六、思考题
茚三酮是否可用于氨基酸和蛋白质的 定性鉴定?
实验三 茚三酮显色法测定氨基酸含量
一、实验原理
• 茚三酮溶液与氨基酸共热,生成氨。氨与 茚三酮和还原性茚三酮反应,生成紫色化 合物。颜色的深浅与氨基酸的含量成正比, 可通过测定570nm处的光密度,测定氨基 酸的含量
二、试剂与材料
❖(1)标准氨基酸溶液:配制成0.3mM溶液 (本实验用赖氨酸)(已配)
•(4)60%乙醇(50ml/组 ) •(5)样品液:每ml含0.5-50ug氨基酸(已配) •(6)分光光度计 •(7)水浴锅
三、操作方法
1、标准曲线的制作
• 分别取0, 0.2, 0.4, 0.6, 0.8,1.0ml0.3mM的 标准氨基酸溶液于试管中,用水补足到1ml。各加 入1ml2M醋酸缓冲液;再加入1ml茚三酮显色液,充 分混合后盖住试管口,在100℃水浴中加热15min, 用自来水冷却。放置5min后,加入3ml60%乙醇稀释, 充分摇匀,用分光光度计测定OD570(脯氨酸和羟脯 氨酸与茚三酮反应呈黄色,应测定OD440)。以OD570 为纵坐标,氨酸酸样品的测定:
总氨基酸含量的测定方法

总氨基酸含量的测定方法测定总氨基酸含量,听上去是不是有点高大上?其实啊,这个过程就像做一道简单的家常菜,虽然听起来复杂,做起来却很有趣。
氨基酸是蛋白质的基本构件,想想看,咱们身体里那一堆营养物质,都是要靠它们搭建起来的。
很多时候,我们吃的食物,里头的氨基酸含量就能告诉我们,这东西到底能不能补充能量,能不能让我们更强壮。
咱们就来聊聊,怎么测定这些小家伙的含量。
准备工作很重要。
你得有样本,可能是牛肉、豆腐或者鸡蛋,反正都是能吃的东西。
咱们就需要一些试剂。
这些试剂呢,像是厨房里的调料,少了可不行。
常见的有氢氧化钠、盐酸,还有一些专门用来显色的试剂,像那种喝了会变色的饮料,嘿嘿,效果可是杠杠的。
要是没这些东西,那就像做菜没盐,味道就不对了。
然后,就是要进行提取。
简单来说,就是把氨基酸从食物里“榨”出来。
这个步骤得小心翼翼,像煮汤时要控制火候,太大了会糊,太小了则不够味。
把样品放进溶液里,加热搅拌,让氨基酸慢慢溶解。
就像在调和一杯鸡尾酒,直到所有的成分都融合在一起。
提取出来的液体就是你的“氨基酸汤”,记得把它过滤掉杂质,留好清汤。
咱们得进入显色阶段。
这个环节可神奇了,氨基酸遇到试剂,颜色会变得好看得很。
不同的氨基酸有不同的显色反应,就像不同的花朵在阳光下各自盛开。
我们可以用分光光度计来测量这些颜色的深浅,深色就代表氨基酸含量高,浅色那就是少得可怜。
这个过程就像在给食物上色,看着渐渐变得绚丽,心里也是美滋滋的。
不过,数据出来后可别急着欢呼。
我们需要做一些计算,把颜色的强度换算成氨基酸的浓度。
这就像在餐馆里结账,得把每样菜的价格加在一起,才能知道最终要花多少银子。
根据标准曲线,把测得的值代入,最终就能得到你食物里的氨基酸总含量。
简简单单,经过一番“烹饪”,就能得到一份“营养报告”。
记得记录结果,像在做日记一样。
无论你测得的结果是高还是低,都代表着不同的营养价值。
要是高,那可得好好利用,加入日常饮食;要是低,也别气馁,可以考虑多吃些高蛋白的食物,像是肉类、鱼类、豆类,保证你身体里的氨基酸不缺。
游离氨基酸的测定实验报告

游离氨基酸的测定实验报告背景游离氨基酸是构成蛋白质的基本组成单位,对人体的生理功能起着重要作用。
因此,准确测定游离氨基酸的含量对于研究和分析蛋白质代谢、营养摄入以及疾病发展等方面具有重要意义。
本实验旨在通过一系列分析方法测定样品中游离氨基酸的浓度。
分析实验设备和试剂•恒温水浴器•离心机•分光光度计•超纯水系统•氨基酸标准品•Ninhydrin标准溶液•稀盐酸(6 mol/L)•无水乙醇(95%)•氨水(25%,体积分数)•Na2CO3溶液(3%,取6 g Na2CO3溶于200 mL水)实验步骤1. 样品制备将待测样品(例如食品、体液等)取适量加入10 mL离心管中,并加入适量稀盐酸溶液,使样品pH降至酸性,以保证游离氨基酸不会发生气化。
利用离心机对样品进行离心,取上层液保存。
2. 氨基酸含量测定2.1 Ninhydrin法准备一系列浓度已知的氨基酸标准品溶液,分别为0、2、4、6、8和10 μmol/mL。
取6个离心管,分别加入1 mL样品上层液或相应浓度的标准品溶液。
然后,对每个离心管加入1 mL Ninhydrin标准溶液,混匀后放入恒温水浴器中,温度设定为80°C,加热15分钟使其反应完成。
在背景相对较深的条件下使用分光光度计,设置波长为570 nm进行吸光度测定,记录吸光度值。
2.2 紫外分光光度法准备一系列浓度已知的氨基酸标准品溶液,分别为0、2、4、6、8和10 μmol/mL。
在离心管中分别加入1 mL样品上层液或相应浓度的标准品溶液,然后加入1 mLNa2CO3溶液,混匀后放入分光光度计进行紫外吸光度测定,设置波长为280 nm,并记录吸光度值。
3. 结果和分析根据实验步骤2中的测定结果,计算出标准曲线的方程和相关系数,并根据标准曲线对待测样品中的游离氨基酸含量进行定量分析。
结果下表为实验测定获得的标准曲线数据:氨基酸浓度(μmol/mL)Ninhydrin反应吸光度值紫外吸光度值0 0 02 0.3 0.14 0.7 0.26 1.2 0.38 1.6 0.410 2.1 0.5根据上述数据,可得到标准曲线的方程为:•Ninhydrin法:吸光度 = 0.2[氨基酸浓度(μmol/mL)] + 0.1,相关系数r = 0.99;•紫外分光光度法:吸光度 = 0.05[氨基酸浓度(μmol/mL)] + 0.1,相关系数 r = 0.98。
氨基酸含量测定

茚三酮比色测定氨基酸含量一、实验原理氨基酸在碱性溶液中能与茚三酮作用,生成蓝紫色或黄色化合物(除脯氨酸外均有此反应),可用吸光光度法测定。
生成的蓝紫色或黄色化合物颜色深浅与氨基酸含量成正比,其最大吸收波长分别为570nm或350nm,故据此可以测定样品中氨基酸含量。
二、实验试剂(1)1.2%茚三酮溶液:称取茚三酮1g于盛有35mL热水的烧杯中使其溶解,加入40mg氯化亚锡(SnCl2▪H2O),搅拌过滤(作防腐剂)。
滤液置冷暗处过夜,加水至50mL,摇匀备用。
(2)pH 8.04磷酸缓冲液:Ⅰ、准确称取磷酸二氢钾(KH2PO4)4.5350g于烧杯中,用少量蒸馏水溶解后,定量转入500mL容量瓶中,用水稀释至标线,摇匀备用。
Ⅱ、准确称取磷酸氢二钠(Na2HPO4)11.9380g于烧杯中,用少量蒸馏水溶解后,定量转入500mL容量瓶中,用水稀释到标线,摇匀备用。
Ⅲ、取上述配好的磷酸二氢钾溶液10.0mL与190mL磷酸氢二钠溶液混合均匀即为pH8.04的磷酸缓冲溶液。
(3)氨基酸标准溶液:准确称取干燥的氨基酸(如异亮氨酸)0.2000g于烧杯中,先用少量水溶解后,定量转入100mL容量瓶中,用水稀释到标线,摇匀,准确吸取此液10.0mL于100mL容量瓶中,加水到标线,摇匀,此为200μg/mL 氨基酸标准溶液。
三、实验方法及步骤(1)标准曲线绘制准确吸取200μg/mL的氨基酸标准溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0mL (相当于0、100、200、300、400、500、600μg 氨基酸),分别置于25mL 容量瓶或比色管中,各加水补充至容积为 4.0mL,然后加入茚三酮溶液(20g/L)和磷酸盐缓冲溶液(pH为8.04)各1mL,混合均匀,于90℃水浴上加热至显色恒定为止(该加热过程至少需要25分钟),取出迅速冷至室温,加水至标线,摇匀。
静置15min后,若生成蓝紫色化合物,在570nm波长下,以试剂空白为参比液测定其余各溶液的吸光度A ;若生成的化合物呈黄色,则在350nm 波长下,以试剂空白为参比液测定其余各溶液的吸光度A 。
18种氨基酸分析方法

1) 天平一台(精度0.1mg)2) 恒温水浴锅一台3) 容量瓶4) 试管(1.5×15cm或1.5×10cm)5) 微量进样器(5μL或10μL)一支6) 微量可调移液枪(1000μL,200μL)一支、吸头多个。
7) 旋涡混匀器一台8) HPLC系统及氨基酸分析专用柱(4.6×250mm 5μm)一. 仪器及试剂二. 流动相的配制三. 衍生化反应1. 对照品溶液浓度值18种氨基酸分析方法仪 器:流动相 A:0.1mol/L醋酸钠溶液(pH 6.5):乙睛=93.0:7.0流动相 B:水:乙腈=20.0:80.0配制方法:准确量取水200mL和乙腈800mL,混合均匀,抽滤过0.22µm滤膜1) 超纯水(≥18MΩ·cm)2) 乙腈(HPLC级)3) 三水合醋酸钠(分析纯)4) 冰醋酸(分析纯)5) 衍生试剂A和衍生试剂B溶液,至于冰箱保存(衍生试剂包对身体有害,用时请做好防护措施)6) 正己烷(HPLC级)7) 0.1mol/L盐酸溶液:量取9.0mL浓盐酸,加去离子水稀释至1000mL。
8) 正亮氨酸内标溶液:称取正亮氨酸约10mg,加0.1mol/L 盐酸溶液 10mL溶解,混匀。
试 剂:配制方法:准确称取三水合醋酸钠13.6g于1000mL水中,搅拌均匀,使之溶解,用冰醋酸或氢氧化钠溶液调pH值至6.50;准确量取配制好的三 水合醋酸钠溶液930mL和乙腈70mL,混合均匀,抽滤过0.22µm滤膜。
月旭科技(上海)股份有限公司公司官网:服务热线:400-808-67602. 注意事项:1)进样分析:先进对照品溶液,后进供试品溶液;2)缓冲溶液,隔天需重新配制;3)防止缓冲盐析出。
5)运行一次空白梯度; 6)进样分析;7) 分析完成后:I)用乙腈:水=20:80代替流动相A ,进水样(清洗自动进样器), 进行梯度洗脱;II)换90%乙腈冲洗色谱柱40min以上。
氨基酸的测定方法

食物中氨基酸的测定方法测定食物中的胱氨酸使用过甲酸氧化-氨基酸自动分析仪法,测定色氨酸使用荧光分光光度法,测定其它氨基酸使用氨基酸自动分析仪法。
一、氨基酸自动分析仪法1.原理食物蛋白质经盐酸水解成为游离氨基酸,经氨基酸分析仪的离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色测定氨基酸含量。
一份水解液可同时测定天冬,苏,丝,谷,脯,甘,丙,缬,蛋,异亮,亮,酪,苯丙,组,赖和精氨酸等16种氨基酸,其最低检出限为10pmol。
2.适用范围GB/T14965-1994食物中氨基酸的测定方法。
本法适用于食物中的16种氨基酸的测定。
其最低检出限为10pmol。
本方法不适用于蛋白质含量低的水果、蔬菜、饮料和淀粉类食物的测定3.仪器和设备3.1真空泵3.2恒温干燥箱3.3水解管:耐压螺盖玻璃管或硬质玻璃管,体积20~30ml。
用去离子水冲洗干净并烘干。
3.4真空干燥器(温度可调节)3.5氨基酸自动分析仪。
4.试剂全部试剂除注明外均为分析纯,实验用水为去离子水。
4.1浓盐酸:优级纯4.26mol/L盐酸:浓盐酸与水1:1混合而成。
4.3苯酚:需重蒸馏。
4.4混合氨基酸标准液(仪器制造公司出售):0.0025mol/L4.5缓冲液:4.5.1 pH2.2的柠檬酸钠缓冲液:称取19.6g柠檬酸钠(Na3C6H5O7.2H2O)和16.5ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至2.24.5.2 pH3.3的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和12ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节至pH至3.3。
4.5.3 pH4.0的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和9ml浓盐酸加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至4.0。
4.5.4 pH6.4的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和46.8g氯化钠(优级纯)加水稀释到1000ml,用浓盐酸或50%的氢氧化钠溶液调节pH至6.4。
氨基酸的定量测定教材

1、甲醛滴定法
特点:简单易行、快速方便,与亚硝酸氮气容量法分析结果相近 应用:脯氨酸与甲醛作用时产生不稳定的化合物,使结果偏低 酪氨酸含有酚羧基,滴定时也会消耗一些碱而致使结果偏高 溶液中若有铵存在也可与甲醛反应,往往使结果偏高 试剂:40%中性甲醛溶液(以百里酚酞作指示剂,用氢氧化钠溶液将 40%甲醛中和至淡蓝色) 1g/L百里酚酞乙醇溶液 1g/L中性红50%乙醇溶液 0.1mol/L氢氧化钠标准溶液
(VHClO4 cHClO4 VNaAC cNaAC ) M m
100%
(含有两个氨基的氨基酸,如赖氨酸、胱氨酸和精氨酸在此计算式中还应该除以2) 式中:VHClO4——所消耗的高氯酸标准溶液的体积 cHClO4——所消耗的高氯酸标准溶液的浓度 VNaAC——所消耗的醋酸钠溶液的体积 cNaAC——所消耗的醋酸钠溶液的浓度 M——被测氨基酸的摩尔质量 m——被测氨基酸的质量
②样品测定:吸取澄清的样品溶液1~4mL,按标准曲线制作步骤,在相同 条件下测定吸光度A值,测得的A值在标准曲线上可查得对应的氨基酸质量。
3、茚三酮比色法
结果计算:
m 100 氨基酸含量= (mg/100g) m1 1000
式中:m——从标准曲线上查得的氨基酸的含量,μg m1——测定的样品溶液相当于样品的质量,g
100%
式中:VHClO ——所消耗的高氯酸标准溶液的体积 cHClO ——所消耗的高氯酸标准溶液的浓度 M——被测氨基酸的摩尔质量 m——被测氨基酸的质量
4
4、非水溶液滴定法
②回滴法(适用于不易溶解于冰醋酸而能溶解于高氯酸的氨基酸):精确称取氨 基酸样品30~40mg 左右,溶解于5mL高氯酸标准溶液中,加2滴甲基紫指示剂,剩 余的酸以醋酸钠溶液滴定,颜色变化由黄,经过绿、蓝至初次出现不褪的紫色为 终点。 氨基酸含量=
氨基酸测定方法

氨基酸测定方法一、引言氨基酸是构成蛋白质的基本单位,因此对于蛋白质的研究和分析,氨基酸的测定是非常重要的。
目前,常用的氨基酸测定方法主要有色氨酸法、二硫化物法、硫酸铜法、乙醇胺法、二甲基乙二胺法等。
本文将从样品处理、试剂配制、实验步骤和数据处理等方面详细介绍氨基酸测定方法。
二、样品处理1. 样品收集:选择适当的组织或液体样品进行采集,如血清、尿液等。
2. 样品预处理:根据不同样品特点进行预处理,如尿液中可加入少量硝酸使其变为无色透明状态。
3. 样品保存:在低温条件下保存样品以避免其蛋白质降解。
三、试剂配制1. 氢氧化钠溶液:取固体氢氧化钠加入去离子水中搅拌至完全溶解。
2. 硫代乙酰胺溶液:取固体硫代乙酰胺加入去离子水中搅拌至完全溶解。
3. 氨基酸标准溶液:将各种氨基酸按照一定比例加入去离子水中,调节pH值至7.0左右。
4. 还原剂:取固体羟肟酸钠加入去离子水中搅拌至完全溶解。
四、实验步骤1. 样品处理:取适量的样品加入硫代乙酰胺溶液中,混合均匀后放置于60℃恒温水浴中反应20分钟。
2. 加入还原剂:将还原剂加入反应体系中,混合均匀后再次放置于60℃恒温水浴中反应20分钟。
3. 加入氢氧化钠溶液:将氢氧化钠溶液加入反应体系中,混合均匀后放置于60℃恒温水浴中反应30分钟。
4. 加入试剂:取适量的氨基酸标准溶液和待测样品分别加入反应体系中,混合均匀后放置于室温下静置10分钟。
5. 测定吸光度:使用分光光度计在570nm波长下测定反应体系的吸光度值。
五、数据处理1. 绘制标准曲线:将不同浓度的氨基酸标准溶液分别测定吸光度值,绘制标准曲线。
2. 计算待测样品中氨基酸含量:根据待测样品的吸光度值和标准曲线计算其中氨基酸含量。
3. 数据统计分析:对实验数据进行统计分析,如平均值、方差等。
六、注意事项1. 实验过程中要注意卫生和安全,避免试剂进入眼睛和口腔。
2. 样品处理时要避免过度稀释或过度浓缩,以保证实验结果的准确性。
氨基酸含量的测定-茚三酮比色法

实验九 氨基酸含量的测定 (茚三酮比色法)
1. 实验原理
凡含有自由氨基的化合物,如蛋白质、多肽、 氨基酸(脯氨酸除外)在碱性溶液中与水合茚三 酮共热时,产生紫色化合物,最大吸收波长在 570nm处,在一定浓度范围内,颜色深浅与氨基 酸含量成正比,可用比色法进行测定。
氨基酸与茚三酮的反应分两个步骤:
(3)通常采用的样品处理方法为:准确称取粉碎 后的样品5g~10g或吸取液体样品5mL~10mL, 置于烧杯中,加入50mL蒸馏水和5g左右的活性炭, 加热煮沸,过滤。用30mL~40mL热水洗涤活性 炭,收集滤液于100mL容量瓶中,加水至刻度线, 摇匀备用。
6. 思考题 (1)茚三酮法测定氨基酸的原理是什么? (2)试比较三种方法测定氨基酸含量的优缺点
2. 实验材料、仪器与试剂 材料:酱油 仪器:可见分光光度计,分析天平,容量 瓶,移液管,具塞刻度试管。 试剂:茚三酮、氯化亚锡、磷酸二氢钾、 磷酸氢二钠、标准氨基酸(异亮氨酸)。
(3)样品测定
管号
8 9 10 11
样品溶液/mL 0 0.5 0.5 0.5
水/mL
1.6 1.1 1.1 1.1
磷酸盐缓冲液/mL 0.4 0.4 0.4 0.4
茚三酮/mL
0.4 0.4 0.4 0.4
按上表加样后混匀,按标准曲线的步骤进行 实验,在相同条件下测定样品的吸光度,并在标 准曲线上查(1)该法是微量法,对氨基酸的最低检出量可 达0.5μg,其其灵敏度高,重现性好。 (2)脯氨酸和羟脯氨酸与茚三酮反应呈黄色, 最大吸收波长在440nm处。
测定氨基酸,磺基水杨酸的方法

测定氨基酸,磺基水杨酸的方法
测定氨基酸的方法主要有以下几种:
1. 布鲁斯试剂法:使用布鲁斯试剂与氨基酸发生反应,生成紫色或蓝色络合物,通过比色法或光度法来测定氨基酸的含量。
2. 紫外光谱法:氨基酸在紫外光下有特征性的吸收峰,通过测量吸收峰的强度来确定氨基酸的浓度。
3. 核磁共振法:使用核磁共振仪器对氨基酸样品进行分析,通过观察氨基酸在不同磁场下的共振信号来确定其结构和浓度。
磺基水杨酸的测定方法主要有以下几种:
1. UV-Vis光谱法:磺基水杨酸在紫外光下有特征性的吸收峰,通过测量吸收峰的强度来确定其浓度。
2. 氯化亚砜法:磺基水杨酸与氯化亚砜反应生成产物,通过测量产物浓度来确定磺基水杨酸的浓度。
3. 离子色谱法:使用离子色谱仪对磺基水杨酸进行分析,通过观察峰的面积或高度来确定其浓度。
请注意,以上方法仅为常用的测定方法之一,具体使用哪种方法还要根据实际情况来确定。
氨基酸测定方法
4。
1 光度分析法[5] [6]β-氨基丙酸和茚三酮溶液在弱酸的条件下可以生成蓝紫色物质[7],其颜色深浅主要与β-氨基丙酸的浓度有关。
因此可利用此显色反应采用比色法定量测量β—氨基丙酸。
我在实验中发现很多因素如浓度、pH 值、反应温度、以及反应时间等对此显色反应有很大的影响.如忽视这些因素会使实验产生很大的误差.就此显色反应的最佳条件我做了初步的探究.4.1。
1试剂的配制:缓冲液的配制:配制pH= 6。
00的NaAc -HAc 缓冲溶液β—氨基丙酸标准溶液的配制:用电子天平准确称取1。
020 g β-氨基丙酸(生化纯),溶于250ml pH=6.00缓冲溶液中,得到C = 4.080 g/L 标准溶液.茚三酮试剂的配制:称取0.5g 茚三酮溶于100ml 蒸馏水中,得到5g/L 的茚三酮水溶液。
4.1。
2标准曲线的确定分别准确移取0.30ml 、0。
40ml 、0。
50ml 、0.60ml 、0.70ml 、0。
80ml 、0.90ml 、1。
00ml 标准液于8个比色管中,用pH=6.00的缓冲溶液稀释到5.00ml 再加入1ml 茚三酮水溶液充分摇匀,将其放在沸水浴中加热10min 。
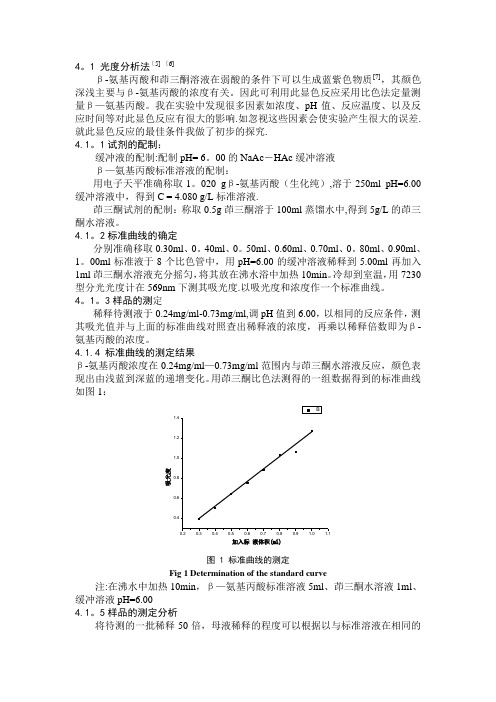
冷却到室温,用7230型分光光度计在569nm 下测其吸光度.以吸光度和浓度作一个标准曲线。
4。
1。
3样品的测定稀释待测液于0.24mg/ml-0.73mg/ml,调pH 值到6.00,以相同的反应条件,测其吸光值并与上面的标准曲线对照查出稀释液的浓度,再乘以稀释倍数即为β-氨基丙酸的浓度。
4.1.4 标准曲线的测定结果β-氨基丙酸浓度在0.24mg/ml —0.73mg/ml 范围内与茚三酮水溶液反应,颜色表现出由浅蓝到深蓝的递增变化。
用茚三酮比色法测得的一组数据得到的标准曲线如图1:吸光度加入标液体积(ml)图 1 标准曲线的测定Fig 1 Determination of the standard curve注:在沸水中加热10min ,β—氨基丙酸标准溶液5ml 、茚三酮水溶液1ml 、缓冲溶液pH=6.004.1。
HPLC测定发酵液中氨基酸的含量

HPLC测定发酵液中氨基酸的含量一、主要试剂及配置方法衍生试剂溶液:0.5%2,4-二硝基氟苯(DNFB)乙醇溶液衍生缓冲溶液的配制:称取衍生缓冲溶液固体组分(NaHCO3)4.2g加入至100mL 容量瓶中,定容并摇匀后备用。
定容缓冲溶液的配制:称取定容缓冲溶液固体组分(磷酸二氢钾)3.4g,加入至500mL容量瓶中,加入0.1mol/LNaOH145.5mL定容。
流动相A的配制:乙腈-水(1:1):相同体积的乙腈与水混合,超声波脱气10-15min。
流动相B的配制:流动相B固体成分(NaAc)8.2g加水至2000mL,超声波脱气10-15min。
氨基酸标样:每种色谱纯氨基酸标品秤取0.5g,用水溶解后,定容至100mL,配成5g/L的氨基酸标准溶液。
发酵液预处理:用可调微量移液器吸取1.0mL发酵液于1.5mL小离心管中,高速离心(10000r/min,2min)沉淀菌体等固形物。
二、衍生方法准确量取发酵液原液2微升,加入装有0.2mL衍生缓冲溶液的5mL塑料离心管中,然后加入0.1mL衍生试剂溶液,摇匀,注意不要漏液,将塑料离心管置于60℃水浴中暗处恒温加热60min后取出,注意不要让水进入离心管,放置待溶液冷至室温后,加入定容缓冲液0.7mL并摇匀,放置15min后可以开始进行色谱分离。
三、色谱分离条件色谱柱为依利特公司氨基酸分析专用ODS柱或C18柱;检测系统为:紫外检测器,柱温:33℃;采用二元梯度分析,梯度程序如表所示;波长360nm检测;流动相总流量为1mL/min。
流动相梯度时间表序号流量/mL/min 时间/min流动相A/%流动相B/%线性设定备注1 1 0 16 84 Line 初始状态2 1 0.3 16 84 Line3 14 30 70 Line4 1 7 34 66 Line6 1 22 55 45 Line7 1 25 55 45 Line8 1 34 98 2 Line9 10 11384016168484Line 系统开始重新平衡,恢复到初始状态四、计算方法定性和定量方法(1)根据保留时间和紫外吸收谱进行定性分析。
食品中氨基酸总量的测定实验报告

食品中氨基酸总量的测定实验报告一、实验目的本实验旨在测定食品中氨基酸的总量,了解食品中蛋白质的组成和营养价值,为食品质量控制和营养评估提供依据。
二、实验原理氨基酸是含有氨基和羧基的有机化合物,它们在一定条件下与某些试剂反应可以产生特定的颜色或荧光,通过比色或荧光检测可以定量测定氨基酸的含量。
本实验采用茚三酮显色法测定食品中氨基酸的总量。
茚三酮在弱酸性溶液中与氨基酸反应,生成蓝紫色化合物,其颜色的深浅与氨基酸的含量成正比。
在一定波长下测定溶液的吸光度,通过与标准曲线对比,可以计算出样品中氨基酸的总量。
三、实验材料与设备1、实验材料标准氨基酸溶液(已知浓度)待测食品样品(如肉类、豆类、谷物等)茚三酮试剂缓冲溶液(pH 值 50)乙醇蒸馏水2、实验设备分光光度计分析天平容量瓶(100 mL、50 mL、25 mL 等)移液管(1 mL、2 mL、5 mL 等)具塞刻度试管(25 mL)水浴锅离心机四、实验步骤1、标准曲线的绘制分别吸取 000 mL、020 mL、040 mL、060 mL、080 mL、100 mL 标准氨基酸溶液于 25 mL 具塞刻度试管中,用蒸馏水补足至 100 mL。
向各试管中加入 100 mL 缓冲溶液(pH 值 50)和 100 mL 茚三酮试剂,摇匀。
将试管置于沸水浴中加热 15 min,取出后立即用冷水冷却至室温。
向各试管中加入 500 mL 60%乙醇,摇匀。
使用分光光度计,在 570 nm 波长下,以蒸馏水为空白,测定各溶液的吸光度。
以氨基酸的含量(μg)为横坐标,吸光度为纵坐标,绘制标准曲线。
2、样品处理称取适量待测食品样品,精确至 0001 g,放入研钵中研碎。
将研碎的样品转移至离心管中,加入适量蒸馏水,在沸水浴中加热30 min,以提取氨基酸。
冷却后,离心(3000 rpm,10 min),取上清液备用。
3、样品测定吸取 100 mL 样品上清液于 25 mL 具塞刻度试管中,按照标准曲线绘制的步骤进行操作,测定样品溶液的吸光度。
氨基酸分析原理和色谱条件

氨基酸分析原理和色谱条件氨基酸分析是一种常用的生物化学分析方法,用于确定样品中各种氨基酸的含量和种类。
氨基酸是构成蛋白质的基本单位,对于研究蛋白质的结构和功能具有重要意义。
氨基酸分析的原理是通过分离、定量和鉴定各种氨基酸,从而获得样品中氨基酸的信息。
在样品前处理中,首先需要将蛋白质样品水解为氨基酸。
水解反应可以通过酸、碱或酶的作用来实现。
其中,最常用的水解试剂是6M盐酸和6M氢氧化钠。
将样品加入到水解试剂中,通常在110°C下加热8-24小时,使蛋白质完全水解为氨基酸。
水解反应后,通常使用酸或碱中和水解液,保证pH值在中性附近。
在分析测定中,最常用的方法是色谱法。
色谱法根据氨基酸的化学性质,将其分离并定量。
常用的色谱方法有两种,分别是离子交换色谱和手性色谱。
离子交换色谱是氨基酸分析的传统方法之一,其基本原理是利用氨基酸的带电性质,在离子交换树脂上发生吸附和洗脱。
在离子交换色谱中,通常使用强阳离子交换树脂和弱酸模式进行分析。
样品在酸性条件下通过样品加载装置,然后在逐渐提高pH值的梯度条件下进行洗脱。
各种氨基酸根据其酸碱性质的不同,以不同的速率洗脱出来,从而实现氨基酸的分离和定量。
手性色谱是分析氨基酸的另一种方法,其基本原理是利用氨基酸的手性性质进行分离。
氨基酸是手性分子,大部分氨基酸都有两种手性异构体,即L-型和D-型。
手性色谱使用手性固定相,如手性萃取剂、手性离子对等,可以将L-型和D-型氨基酸分离开来,并进行定量。
色谱条件对氨基酸分析的结果具有重要影响。
在离子交换色谱中,选择合适的离子交换树脂和洗脱缓冲液的pH值,以及合适的梯度条件,都对结果产生影响。
在手性色谱中,选择合适的手性固定相,以及优化洗脱条件和检测方法,也对结果产生重要影响。
总之,氨基酸分析是一种重要的生物化学分析方法,可以对样品中的氨基酸进行分离、定量和鉴定。
通过合适的样品前处理和选择适当的色谱方法和条件,可以获得准确和可靠的氨基酸分析结果。
氨基酸测定方法

氨基酸测定方法一、引言氨基酸是构成蛋白质的基本组成单位,对于生命体的生长和发育起着重要的作用。
因此,准确测定氨基酸的含量和组成对于研究蛋白质结构和功能具有重要意义。
本文将介绍一些常用的氨基酸测定方法,包括色谱法、光谱法和化学法等。
二、色谱法测定氨基酸2.1 气相色谱法气相色谱法是测定氨基酸含量和组成的常用方法之一。
该方法通过将氨基酸样品转化为易挥发的衍生物,然后使用气相色谱仪进行分析。
气相色谱法具有分离效果好、灵敏度高和操作简便等优点。
2.1.1 衍生化反应在气相色谱法中,常用的氨基酸衍生化反应包括酯化、酰化和取代反应等。
这些反应能够将氨基酸转化为易挥发的衍生物,便于后续的气相色谱分析。
2.1.2 气相色谱仪气相色谱仪是进行气相色谱分析的关键设备。
它由进样系统、色谱柱和检测器等部分组成。
进样系统用于将样品引入色谱柱,色谱柱用于分离氨基酸衍生物,检测器用于检测分离后的化合物。
2.2 液相色谱法液相色谱法也是测定氨基酸含量和组成的常用方法之一。
该方法通过将氨基酸样品溶解在溶剂中,然后使用液相色谱仪进行分析。
液相色谱法具有分离效果好、灵敏度高和选择性强等优点。
2.2.1 色谱柱选择在液相色谱法中,选择合适的色谱柱对于分离氨基酸非常重要。
常用的色谱柱包括离子交换柱、反相柱和手性柱等。
不同的色谱柱具有不同的分离机理和选择性,可以根据需要选择合适的色谱柱。
2.2.2 梯度洗脱条件在液相色谱法中,通过调整洗脱溶剂的组成和流速等参数,可以实现对氨基酸的有效分离。
梯度洗脱条件可以根据氨基酸的亲水性和极性等特性进行优化。
三、光谱法测定氨基酸3.1 紫外-可见光谱法紫外-可见光谱法是测定氨基酸含量和组成的常用方法之一。
该方法通过测量氨基酸在紫外-可见光波段的吸收特性,来推断其含量和组成。
紫外-可见光谱法具有操作简便、灵敏度高和选择性强等优点。
3.1.1 吸收峰特征不同氨基酸在紫外-可见光谱中具有不同的吸收峰特征。
通过测量氨基酸的吸收峰强度和位置,可以推断其含量和组成。
氨基酸的含量测定方法

氨基酸的含量测定方法
氨基酸的含量可以用不同的方法进行测定,以下是其中几种常用的方法:
1. 紫外吸收法(UV法):氨基酸分子中存在芳香族环和烯烃键,可以吸收紫外光,根据吸收的强度来确定氨基酸的浓度。
2. 高效液相色谱法(HPLC法):这是一种常用的测定氨基酸含量的方法,通过将样品中的氨基酸溶解后注入液相色谱仪中,利用氨基酸在不同条件下的保留时间和峰面积来测定其含量。
3. 伯里特法:伯里特试剂能与氨基酸发生比色反应,该方法适用于测定含有酪蛋白、皮质素等色泽较重的氨基酸的含量。
4. 显色法:该方法将氨基酸和特定试剂反应,生成显色产物,根据产物的颜色深浅来测定氨基酸含量。
常用的显色试剂有二。
氨基酸检测与加标实验方法

氨基酸检测方法及加标回收实验一、试剂:1、6mol/L盐酸溶液:500ml盐酸(浓度≥36%,优级纯)加水稀释至1000ml混匀。
2、ph=2.2柠檬酸钠缓冲液:取19.6g柠檬酸钠加入500ml水溶解,加入16.5ml盐酸,用水稀释至1000ml混匀,用6mol/L盐酸溶液或500g/L氢氧化钠溶液调节PH至2.2。
注:PH=2.2柠檬酸钠缓冲液可以用0.02mol/L盐酸代替。
二、样品处理1、称样:称样前应先测样品中的蛋白质含量,取试样使其蛋白质含量在10mg-20mg。
2、水解:试样中加入6mol/L的盐酸溶液10ml,封口放入恒温干燥箱110℃水解22-24小时后取出放凉。
注:1、一般水解过程需要先抽真空,因为蛋氨酸和半胱氨基酸会被氧化,测出来的值会偏小,其他氨基酸没有明显变化。
2、水解需要22-24小时,花费大量的时间,也可以用微波消解法快速完成:将备好的试样放入微波消解炉中,选择功率为(700-800)W,在150℃条件下,20分钟进行消解后,冷却。
3、烘干:过滤放凉的试样溶液到50ml容量瓶中,用蒸馏水少量多次冲洗水解管,最后定容至刻度,取1ml定容的试样放入干净的水解管中(也可以是其它容器),放入真空干燥箱中60℃真空抽干,加入1ml蒸馏水60℃真空抽干,重复1-2次。
注:抽真空烘干目的是赶酸,这一步可以在氮吹仪上60℃氮吹吹干,重复1-2次,可以节省大量时间。
4、检测:烘干后向试样中加入1-2ml配好的柠檬酸钠或0.02mol/L 的盐酸缓冲液,用注射器经过0.22um过滤头过滤到进样瓶中,上机检测。
三、加标回收实验在测定样品的同时,于同一样品的子样中加入一定量的标准物质进行测定,将其测定结果扣除样品的测定值,以计算回收率。
在这里我以检测小麦粉中各氨基酸的含量为例来说明。
1.计算蛋白质含量,由于在检测氨基酸前测定了小麦粉的蛋白质含量在12-13之间,所以取试样0.15g左右(精确到0.0001g)。
氨基酸含量的测定

五、计算
标准甘氨酸氨基氮的回收率=
VNaoH*0.0500mol/L *14.008 理论计算值
理论计算值:取用氨基酸的体积乘以浓度,再乘以14.008 VNaoH 两次测定所用氨基酸的体积的平均值
每毫升氨基酸溶液中含氨基氮的毫克数为
式中:V1为滴定样品消耗氢氧化钠的体积(ml); V2为滴空白消耗氢氧化钠的体积(ml);
氨基酸的定量分析 —甲醛滴定法
一、目的:
初步掌握甲醛滴定法测定氨基酸含量的原理和操作要点
二、实验原理
水溶液中的氨基酸为兼性离子,因而不能直接用碱 滴定氨基酸的羧基。甲醛可与氨基酸上的—N+H3结合, 形成 — NH—CH2OH、—N(CH2—OH)2 等羟甲基衍生物 ,使 N+H3 上的 H+ 游离出来,这样就可以用碱滴定 N+H3 放出H+,测出氨基氮,从而计算氨基酸的按下表加入试剂。
锥形瓶编号 试剂
1
2
3
4
5
0.1mol/L甘氨酸溶液 /mL
中性甲醛溶液/mL 水/mL 0.5%酚酞酒精溶液 (滴) 未知浓度的 氨基酸混合溶液/mL
0
1 4 4 0
1
1 3 4 0
1
1 3 4 0
0
1 3 4 1
0
1 3 4 1
2、用0.0500mol/L NaOH溶液滴定至溶液变微红色 注意:滴定管中溶液的初始位置和滴定结束时的位置; 滴定管的使用方法 3、用0.0500mol/L NaOH溶液滴定至溶液变微红色 4、记录每次滴定所用的0.0500mol/L NaOH溶液的 体积
若样品中只含有单一的已知氨基酸,则可由此法滴 定的结果算出氨基酸的含量。若样品中含有多种氨 基酸(如蛋白质水解液),测不能由此法算出氨基 酸的含量。 脯氨酸与甲醛作用后,生成的化合物不稳定,导致 滴定后结果偏低;酪氨酸含酚基结构,导致滴定结 果偏高。
氨基酸总量(氨态氮)的测定(甲醛滴定法)

氨基酸总量(氨态氮)的测定(甲醛滴定法)一、单指示剂甲醛滴定法:(一)原理:氨基酸具有酸、碱两重性质,因为氨基酸含有-COOH 基显示酸性,又含有-NH2基显示碱性。
由于这二个基的相互作用,使氨基酸成为中性的内盐。
当加入甲醛溶液时,-NH2与甲醛结合,其碱性消失,破坏内盐的存在,就可用碱来滴定-COOH基,以间接方法测定氨基酸的量,反应式可能以下面三种形式存在。
(二)试剂(1) 40%中性甲醛溶液(2) 0.1%麝香草酚酞乙醇溶液。
(3) 0.100N氢氧化钠标准溶液。
(三)操作步骤:称取一定量样品(约含20毫克左右的氨基酸)于烧杯中(如为固体加水50毫升),加2-3滴指示剂,用0.100N NaOH溶液滴定至淡蓝色。
加入中性甲醛20毫升,摇匀,静置1分钟,此时蓝色应消失。
再用0.100N NaOH溶液滴定至淡蓝色。
记录两次滴定所消耗的碱液毫升数,用下述公式计算计算:氨基酸态氮(%)=( N V×0.014×100)/W式中:N:NaOH标准溶液当量浓渡。
V:NaOH标准溶液消耗的总量(m1)W:样品溶液相当样品重量(克)。
0.014:氮的毫克当量。
三、双指示剂甲醛滴定法:(一)原理:与单色法相同,只是在此法中使用了两种指示剂。
从分析结果看,双指示剂甲醛滴定法与亚硝酸氮气容量法(此法操作复杂,不作介绍)相近单色滴定法稍偏低,主要因为单指示剂甲醛滴定法是以氨基酸溶液PH值作为麝香草酚酞的终点。
PH值在9.2,而双指示剂是以氨基酸溶液的PH值作为中性红的终点,PH值为7.0,从理论计算看,双色滴定法较为准确。
(二)试剂:(1) 40%中性甲醛溶液(2) 0.1%麝香草酚酞乙醇溶液。
(3) 0.100N氢氧化钠标准溶液。
(4) 0.1%中性红(50%乙醇溶液)(三)操作步骤:取相同的两份样品,分别注入100毫升三角烧瓶中,一份加入中性红指示剂2-3滴,用0.100N NaOH溶液滴定终点(由红变琥珀色),记录用量,另一份加入麝香草酚酞3滴和中性甲醛20毫升,摇匀,以0.100N NaOH准溶液滴定至淡蓝色。
氨基酸检测方法
最新课件
4
POWER038.PPT
茚三酮方法
伯氨基酸和仲氨基酸(亚氨基酸)
检 测 : 440nm ( 脯 氨 酸) or 570nm (primary)
反应温度 : 130 ℃
反应速度 : 快 速
试剂稳定性 : 不稳定( 必须冷藏)
衍生化产物稳定性 :最稳新课定件
5
POWER038.PPT
茚三酮方法
脱脂
脂类组分会影响分析柱 使用弱极性溶剂
❖ 乙酸乙酯 ❖ 氯仿 ❖ 正己烷等
两相分离后, 水相必须使用0.45 um 滤膜过 滤
最新课件
35
POWER038.PPT
除蛋白
蛋白组分会干扰氨基酸的分离 除蛋白试剂
❖ 酸性溶剂方法 ❖ 有机溶剂方法 ❖ 超滤方法
蛋白沉淀物必须采用离心 (3000 rpm, 5 min) 或过滤方法除去.
STR OD最S新-I课I件
20
自动氨基酸分析仪
对于“ 柱前”和“ 柱后”自动氨基酸分析 仪来说,采用何种方法更好?
要控制反应时间,采用柱后衍生方法更方 便。 这就是为什么采用柱后衍生法所得结 果之重复性更好的原因。
❖ 柱后衍生重复性, RSD 约为 1% ❖ 柱前衍生重复性, RSD > 2%
Rretention time Area value Retention timeretention timeArea value
Asparatic acid 0.2
1.2
Methionine
0.4
1.1
Threonine
0.2
1.0
Isoleucine
0.3
0.9
Serine
0.2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一采用氨基酸自动分析仪测定氨基酸
1.氨基酸测定原理:
食物蛋白质经盐酸水解成为游离氨基酸,经氨基酸分析仪的离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色测定氨基酸含量。
2.测定氨基酸所用仪器:
真空泵;恒温干燥箱;水解管:耐压螺盖玻璃管或硬质玻璃管,体积20~30mL。
用去离子水冲洗干净并烘干;真空干燥器(温度可调节);氨基酸自动分析仪。
3.测定氨基酸所用试剂及其配制方法:
3.1试剂:全部试剂除注明外均为分析纯,实验用水为去离子水。
浓盐酸(优级纯);苯酚(须重蒸馏); 混合氨基酸标准液(仪器制造公司出售):0.00250mol/L; 不同pH值柠檬酸钠缓冲液;氢氧化锂(LiOH·H2O);冰乙酸(优级纯);二甲基亚砜(C2H6OS);水合茚三酮(C9H4O3·H2O);还原茚三酮(C18H10O6·2H2O);NaOH;高纯氮气(纯度99.99%);冷冻剂:市售食盐与冰按1∶3混合。
3.2试剂配制方法:
3.2.1. 6mol/L盐酸∶浓盐酸(3.1)与水1∶1混合而成。
3.2.2. pH2.2的柠檬酸钠缓冲液:称取19.6g柠檬酸钠(Na3C6H5O7·2H2O)和16.5mL浓盐酸加水稀释到1000mL,用浓盐酸或50%的氢氧化钠溶液调节pH至2.2。
pH3.3的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和12mL浓盐酸加水稀释到1000mL,用浓盐酸或50%的氢氧化钠溶液调节pH至3.3。
pH4.0的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和9mL浓盐酸加水稀释到1000mL,用浓盐酸或50%的氢氧化钠溶液调节pH至4.0。
pH6.4的柠檬酸钠缓冲液:称取19.6g柠檬酸钠和46.8g氯化钠(优级纯)加水稀释到1000mL,用浓盐酸或50%的氢氧化钠溶液调节pH至6.4。
3.2.3. 茚三酮溶液
pH5.2的乙酸锂溶液:称取氢氧化锂(LiOH·H2O)168g,加入冰乙酸(优级纯)279mL,加水稀释到1000mL,用浓盐酸或50%的氢氧化钠溶液调节pH至5.2。
茚三酮溶液:取150mL二甲基亚砜(C2H6OS)和乙酸锂溶液(3.6.1)50mL加入4g水合茚三酮(C9H4O3·H2O)和0.12g还原茚三酮(C18H10O6·2H2O)搅拌至完全溶解。
二.液相法测定氨基酸
柱前衍生法:参见文献(高效液相色谱柱-前衍生化法测定饲料中的含硫氨基酸
柱前衍生化反相高效液相色谱法测定板蓝根中的氨基酸
高效液相色谱法测定酶促反应液中的L-半胱氨酸含量)
1.仪器:Waters2695 HPLC; Waters2998 PDA检测器;电热恒温鼓风干燥箱
色谱柱:Phenomenex Luna C18 (250mm×4.6mm,5μm)
试剂:流动相A:0.1mol/L醋酸钠缓冲液(以醋酸调pH6.5)-乙腈(93:7)
流动相B:乙腈-水(4:1)
梯度洗脱
检测波长:254nm
2.试剂:衍生试剂:PITC(异硫氰酸苯酯);浓盐酸;三乙胺;正己烷;苯酚;氨基酸标准品衍生化试剂的配制方法:1mol/L三乙胺-乙腈溶液:取三乙胺7mL加乙腈稀释至50Ml
0.01mol/L PITC-乙腈溶液:取PITC 60μL加乙腈稀释至50mL
柱后衍生法:参见文献(高效液相色谱法同时测定糯米酒中17种氨基酸)
1.仪器:ShimadzuLC-20A高效液相色谱仪(在线脱气机,荧光检测器,柱温箱);电子天平分析柱:钠离子交换柱(4.0×150mm,5μm)
保护柱:钠离子交换柱(3.0×20mm,5μm)
检测波长:350-450nm
梯度洗脱
2.试剂
流动相A:0.20mol/L柠檬酸钠(高氯酸调配pH至3.2);
流动相B:0.60mol/L柠檬酸钠与0.20 mol/硼酸,(4mol/LNaOH调配pH至10.0)
流动相C: 0.2mol/LNaOH溶液;
OPA(氨基甲酸酯)衍生化试剂;
氨基酸标准品
三国标饲料中氨基酸测定GB/T18246-2000
详见国标。
