元素化合物化学方程式-高中化学必修一
高中化学方程式大全和重要离子方程式

高中化学方程式大全和重要离子方程式高中化学方程式总结高考总复习之高中化学方程式总结化学第一册第一章卤素第一节氯气1、2 Na Cl 2 点燃 2 NaCl2、Cu Cl 2 点燃CuCl 23、 2 Fe 3Cl 2 点燃 2 FeCl 34、H2 Cl 2 点燃(光照) 2 HCl5、 2P 3Cl 点燃 2 PCl 326、PCl 3 Cl 2 PCl 57、 Cl 2 H 2 O HCl HClO8、 2 Ca ( OH )2 2 Cl 2 Ca ( ClO )2 CaCl 2 2H 2O9、Ca(ClO)2 CO 2 H 2 O CaCO 3 2 HClO10、2 NaOH Cl 2 NaClO NaCl H 2 O11、4HCl MnO 2 MnCl 2 2H 2O Cl 212、2 KMnO 4 16 HCl (浓)2MnCl 2 2 KCl 5Cl 28 H 2 O13、2 HClO 见光O 22 HCl第二节氯化氢14、NaCl H 2 SO (浓)4 NaHSO 4 HCl15、NaHSO 4 NaCl Na 2 SO 4 HCl17、 HCl AgNO3AgCl HNO318、 NaClAgNO3AgClNaNO 319、 KClAgNO3AgCl KNO320、 2 HCl CaCO 3CaCl2H 2 O CO 2 第三节氧化还原反应21、 CuOH 2 Cu H 2 O22、 C4HNO 3CO 24NO 2 2H 2O23、 4 Zn10 HNO (极稀) 4 Zn () NH 4NO 3 3H 2O 3NO 3 224、 11 P 15 CuSO 424H 2O5 Cu 3 P 6H 3PO 415H 2SO 425、 KClO36HCl (浓)3 Cl 2KCl3H 2O26、 4 Mg10 HNO(极稀)4Mg ( NO )NH 4NO 33H 2O33 227、 K 2Cr 2O76 Fe 3 O4 31 H 2SO4 Cr ( SO ) 9 Fe (SO ) K 2SO4 31 H 2O24 324 328、 2 KNO 33C SK 2 S N 2 3CO 2第四节卤族元素29、 H30、 H2F 2 2HF2 Br 2 2 HBr31、H 2I 22 HI32、 2 NaBr Cl 22 NaCl Br 233、 2KI Cl 2 2 KCl I 234、 2 KI Br 22 KBrI 235、 NaBrAgNO3AgBrNaNO 336、 KI AgNO 3AgIKNO337、 2 AgBr 光照2 Ag Br 2第二章摩尔反应热第一节摩尔38、 C O 2 CO 239、Mg 2 HCl MgCl 2 H 2第二节气体摩尔体积40、 Zn 2HCl ZnCl 2 H 2第三节物质的量浓度41、 2 NaOH H2SO4 Na 2 SO 4 2 H 2 O第四节反应热42、C(固)O (气)2 点燃CO (气)2 393 .5kJ43、 2 H (气)2 O (气)2 2H 2 O(气)483 .6 kJ44、 2 H (气)2 O (气)2 2H 2 O(液)571 .6 kJ45、C(固)H 2O(气)CO (气)H (2气)131 .3kJ第三章硫硫酸第一节硫46、2Cu S Cu 2 S47、Fe S FeS48、S H 2 H 2S49、S高温CS 2 C50、S点燃O 2 SO 251、3S 6 KOH 2K 2S K2SO4 3H2O 第二节硫的氢化物和氧化物52、H2S H 2 S53、2H2S 3O2(足)点燃2SO 22H 2O54、2H2S O 2 (不足)点燃2 S2H 2O点燃2H 2O 3S 55、2H2S SO256、H 2S Br2 S2 HBr57、FeS 2 HCl FeCl 2 H 2 S58、CuSO 4 H 2 S CuS H2SO459、PbAc 2 H 2 S PbS 2 HAc60、 H 2S NaOH NaHS H 2 O61、 NaHS NaOH Na 2 S H 2 O62、 H 2S 2 NaOH Na 2 S 2H 2O (60、61 结合)63、H2S 2 FeCl 3 S 2 FeCl 2 2 HCl64、H2SO(4 稀)FeS FeSO 4 H 2 S65、SO2 H 2 O H2SO366、 2SO 2 O 2 V2O5 2SO 367、SO3 H 2 O H2SO468、Na2SO3H2SO4 Na 2 SO 4 H2O SO269、SO2 2 NaOH Na 2 SO 3 H 2 O70、SO2 CaO CaSO 371、SO2 2Ca ( OH )2 CaSO 3 H 2 O72、SO73、SO74、 SO75、 SO 2CaSO 3 H 2 O Ca ( HSO 3)2 22H 2S 3S 2H 2O2Cl 2 2H 2O 2 HCl H2SO4 2Br 2 2H 2O 2 HBr H2SO476、 5SO 2 2 H 2 O 2 KMnO 4MnSO 4 K 2 SO 4 2 H 2 SO 4 第三节硫酸的工业制法高温78、2SO2 O2 V2O5 2SO 379、H2O SO3 H2SO4第四节硫酸硫酸盐80、C 2H 2SO (4浓)CO81、S 2H 2SO (4浓)3SO 2 2SO 2 2H 2O 22 H 2 O82、P H(浓)H3PO4 SO 2 2H 2O 2SO483、H2S H 2SO (4 浓)S SO2 2H 2O84、Cu 2H 2SO (4 浓)CuSO 4 SO 2 2H 2O85、BaCl86、BaCl87、BaCl 2H2SO4 BaSO 4 2 HCl2Na 2SO 4 BaSO 4 2 NaCl 2 Na 2CO3 BaCO 3 2 NaCl88、BaCO 3 2 HCl BaCl 2 H 2 O CO 289、BaCO 3 2 HNO 3 Ba ( NO 3)2 H 2 O CO 290、Na2CO3 H2SO3 Na 2 S H 2 O CO 291、2H2SO3 O 2 2H 2SO 492、2 Na2SO3O2 2Na 2 SO 493、2CaSO 3 O 2 2 CaSO 494、2 Fe 6 H(浓)()3SO 2 6H 2O 2SO4 Fe 2 SO 4 395、2 NaBr 2H 2SO (4浓)Br 2 SO 2 Na 2 SO 4 H 2 O96、2 NaCl H 2SO (4浓)Na 2 SO 4 2 HCl浓H2SO 412 C 11H 2O97、C11H22O11第四章碱金属第一节钠98、 4 Na O 2 Na O99、 2 NaO 2Na 2 O 2100、 2 Na点燃2 NaClCl 2101、 2 Na S 研磨Na 2 S102、 2 Na 2H 2O 2 NaOH H 2103、 2 Na 2H 2OCuSO 4Cu ( OH )2 Na 2 SO 4 H 2第二节钠的氧化物104、 Na 2OH 2 O2 NaOH105、 2 Na 2 O 22H 2O 4 NaOH O 2106、 Na2OCO 2 Na 2 CO 3107、 2 Na 2 O 22CO 2 2 Na 2 CO 3 O 2108、 Na 2 O2HCl2 NaClH 2 O109、 Na2O24 HCl 4 NaCl 2H 2O O 2 110、 Na 2 CO 3 2 HCl2 NaClCO 2 H 2 O 111、 NaHCO 3 HCl NaCl CO 2 H 2 O 112、 2 NaHCO3Na 2 CO 3CO 2H 2 O113、 NaHCO114、 2 NaHCO3NaOH Na 2 CO 3 H 2 O3 Ca ( OH )(少量)CaCO3Na 2CO3 2 H 2O2115、 NaHCO3Ca ( OH )(足量)CaCO3NaOHH 2O2116、 Na 2 CO 3 117、 Na 2 CO 3 BaClCaCl22BaCOCaCO332 NaCl2 NaCl118、 Ca ( HCO 3)22 HCl CaCl 2 2 CO 22H 2O119、 Ca ( HCO3)22NaOHCaCO 3 Na 2 CO 3 2H 2 O 120、 NaHSO HClNaClSO H O第三节碱金属元素121、4 Li点燃O 2 2Li 2 O122、K点燃KO 2 O 2123、2 M X 2 2 MX ( M 表示氧族元素, X 代表卤族元素)124、2 M H 2 2 MH125、2 M 2H2O 2MOHH 2第五章物质结构元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
元素化合物化学方程式-高中化学必修一

元素化合物化学⽅程式-⾼中化学必修⼀元素及其化合物的化学⽅程式有※的,还要写离⼦⽅程式!⼀、钠及钠的重要化合物1、常温钠与氧⽓反应4Na+O2=2Na2O2、加热条件下钠与氧⽓反应2Na+O2△Na2O23、※钠与⽔反应2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na++2OH-+H2↑4、※过氧化钠与⽔反应2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4Na++4OH-+O2↑5、过氧化钠与⼆氧化碳反应(呼吸⾯具,供氧剂)2Na2O2+2CO2=2Na2CO3+O2↑6、※氢氧化钠溶液中通少量⼆氧化碳2NaOH+CO2=Na2CO3+H2O2OH-+CO2=CO32-+H2O7、※氢氧化钠溶液中通过量⼆氧化碳NaOH+CO2 =NaHCO3 (OH-+CO2 =HCO3-) 可以分成两步写2NaOH+CO2=Na2CO3+H2O(2OH-+CO2=CO32-+H2O) Na2CO3+CO2+H2O=2NaHCO3 (CO32-+CO2+H2O=2 HCO3-) 8、※碳酸钠与盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑9、※碳酸氢钠与盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑10、※碳酸钠溶液不与氢氧化钠溶液反应,碳酸氢钠溶液与氢氧化钠溶液反应NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH-=CO32-+H2O11、※碳酸钠溶液和碳酸氢钠溶液分别都能与氢氧化钙(钡)溶液反应,都有⽩⾊沉淀⽣成沉淀Na2CO3+Ca(OH)2=CaCO3↓+2N aOHCO32-+Ca2+=CaCO3↓NaHCO3(少)+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+H2O2NaHCO3(过)+Ca(OH)2=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O 12、※碳酸钠溶液与氯化钙(钡)溶液反应有⽩⾊沉淀⽣成,碳酸氢钠溶液不与氯化钙(钡)溶液反应Na2CO3+CaCl2=CaCO3↓+2NaClCO32-+Ca2+=CaCO3↓13、※碳酸钠溶液能吸收⼆氧化碳⽓体发⽣反应,碳酸氢钠溶液不能吸收⼆氧化碳⽓体Na2CO3+CO2+H2O=2NaHCO3CO32-+ CO2+H2O =2HCO3-14、碳酸钠稳定受热不分解,碳酸氢钠不稳定受热分解2NaHCO3△Na2CO3+CO2↑+H2O⼆、铝及其重要化合物1、⾦属铝常温能与氧⽓反应,表⾯⽣成致密氧化膜(加热也可);铝在氯⽓中燃烧。
高中化学必修一二化学方程式汇总

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
化学元素及化合物所有化学方程式.doc

高中化学元素及化合物所有化学方程式非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三, 非金属氢化物(HF,HCl,H2O,H2S,NH3) 1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四,非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五,金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六,含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七,碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八,盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
高中化学方程式大全(完整版)

高中化学方程式大全(完整版) 高中化学方程式总结第1页共21页第一章卤素第一节氯气1、2Na + Cl2 → 2NaCl2、Cu + Cl2 → CuCl23、2Fe + 3Cl2 → 2FeCl3 (点燃)4、H2 + Cl2 → 2HCl5、2P + 3Cl2 → 2PCl3 (点燃)6、PCl3 + Cl2 → PCl57、Cl2 + H2O → HCl + HClO8、2Ca(OH)2 + 2Cl2 → Ca(ClO)2 + CaCl2 + 2H2O9、Ca(ClO)2 + CO2 + H2O → CaCO3↓ + 2HClO10、2NaOH + Cl2 → NaClO + NaCl + H2O (点燃)11、MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑12、2KMnO4 + 16HCl (浓) → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O13、2HClO → 2HCl + O2↑第二节氯化氢14、NaHSO4 + HCl↑ → NaCl + H2SO415、NaCl + H2SO4 (浓) → Na2SO4 + HCl↑16、2NaCl + H2SO4 (浓) → Na2SO4 + 2HCl↑ (14、15结合)17、HCl + AgNO3 → AgCl↓ + HNO318、NaCl + AgNO3 → AgCl↓ + NaNO319、KCl + AgNO3 → AgCl↓ + KNO320、2HCl + CaCO3 → CaCl2 + H2O + CO2↑第三节氧化还原反应21、CuO + H2 → Cu + H2O22、C + 4HNO3 → CO2↑ + 4NO2↑ + 2H2O23、4Zn + 10HNO3 (极稀) + NH4NO3 → 4Zn(NO3)2 + NH4Cl + 3H2O24、11P + 15CuSO4 + 24H2O → 5Cu3P + 6H3PO4 +15H2SO425、KClO3 + 6HCl (浓) → 3Cl2↑ + KCl + 3H2O26、4Mg + 10HNO3 (极稀) + NH4NO3 → 4Mg(NO3)2 + NH4Cl + 3H2O27、K2Cr2O7 + 6Fe3O4 + 8H2SO4 → 3Fe2(SO4)3 +Cr2(SO4)3 + K2SO4 + 8H2O31H2SO4和9Fe(2SO4)3和2K2SO4反应生成Cr(2SO4)3.这是一种化学反应方程式。
高中必修一化学第二章方程及公式

高中必修一化学第二章方程及公式以下列举部分高中化学必修一第二章(一般为金属及其化合物)中常见化学方程式及公式:1. 钠与氧气反应:钠在空气中缓慢氧化:4Na + O₂ = 2Na₂O钠在空气中点燃:2Na + O₂ = Na₂O₂2. 钠与水反应:2Na + 2H₂O = 2NaOH + H₂↑3. 钠与硫酸铜溶液反应:2Na + CuSO₄ + 2H₂O = Cu(OH)₂↓ + Na₂SO₄ + H₂↑4. 钠与氯化铁溶液反应:6Na + 2FeCl₃ + 6H₂O = 6NaCl + 2Fe(OH)₃↓ + 3H₂↑5. 氧化钠与水反应:Na₂O + H₂O = 2NaOH6. 过氧化钠与水反应:2Na₂O₂ + 2H₂O = 4NaOH + O₂↑7. 过氧化钠与二氧化碳反应:2Na₂O₂ + 2CO₂ = 2Na₂CO₃ + O₂8. 碳酸钠与盐酸反应:Na₂CO₃ + 2HCl = NaCl + CO₂↑ + H₂O9. 碳酸氢钠与盐酸反应:NaHCO₃ + HCl = NaCl + CO₂↑ + H₂O10. 碳酸氢钠与氢氧化钠反应:NaHCO₃ + NaOH = Na₂CO₃ + H₂O11. 氢氧化钠与氯化铁溶液反应:3NaOH + FeCl₃ = Fe(OH)₃↓ + 3NaCl12. 氢氧化铝与盐酸反应:Al(OH)₃ + 3HCl = AlCl₃ + 3H₂O13. 氢氧化铝与氢氧化钠溶液反应:Al(OH)₃ + NaOH = NaAlO₂ + 2H₂O14. 三价铁离子与氢氧根离子反应:Fe³⁺ + 3OH⁻ = Fe(OH)₃↓15. 二价铁离子与氢氧根离子反应:Fe²⁺ + 2OH⁻ = Fe(OH)₂↓16. 二价铁离子被氧化成三价铁离子:4Fe²⁺ + O₂ + 4H⁺ = 4Fe³⁺ + 2H₂O17. 二价铁离子被氯气氧化成三价铁离子:2Fe²⁺ + Cl₂ = 2Fe³⁺ + 2Cl⁻18. 二价铁离子被过氧化氢氧化成三价铁离子:2Fe²⁺ + H₂O₂ + 2H⁺ =2Fe³⁺ + 2H₂O19. 三价铁离子与硫氰根离子反应:Fe³⁺ + 3SCN⁻= Fe(SCN)₃以上信息仅供参考,如需高中化学必修一第二章的完整内容,建议查阅高中化学教材或教辅。
高三化学元素及化合物所有化学方程式

高中化学元素及化合物所有化学方程式非金属单质(F2 ;Cl2 ; O2 ; S; N2 ; P ; C ; Si)1;氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属)2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2;Cl2;Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23;(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化;加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热;浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二;金属单质(Na;Mg;Al;Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al;Fe在冷;浓的H2SO4;HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下;不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)三;非金属氢化物(HF;HCl;H2O;H2S;NH3) 1;还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22;酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3;碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打;苏打)4;不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2四;非金属氧化物低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H2氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg;Ca;Ba;Na;K等燃烧的火灾) SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3;与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水;可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34;与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2;再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥;SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2五;金属氧化物1;低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2;氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO;Al2O3几乎没有氧化性;很难被还原为Mg;Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3;与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4;与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷;稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O六;含氧酸1;氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4;但浓;热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2;还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2;Br2;I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3;酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S;HI;HBr;(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4;不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O七;碱低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)3与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OAl(OH)3+NH4Cl 不溶解3;不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O八;盐1;氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22;还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43;与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4;与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35;不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
高中化学方程式大全(绝对全)

高考总复习之高中化学方程式总结化学 第一册第一章 卤素第一节 氯气1、NaCl 2Cl Na 22−−→−+点燃2、22CuCl Cl Cu −−→−+点燃 3、32FeCl 2Cl 3Fe 2−−→−+点燃 4、HCl 2Cl H 22−−−−→−+点燃(光照)5、32PCl 2Cl 3P 2−−→−+点燃6、523PCl Cl PCl →+7、HClO HCl O H Cl 22+→+8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()(9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)(10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++−→−+∆2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+−−→−见光第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+−→−+∆HCl SO Na NaCl NaHSO 424 16、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+18、33NaNO AgCl AgNO NaCl +↓→+19、33KNO AgCl AgNO KCl +↓→+20、↑++→+2223CO O H CaCl CaCO HCl 2第三节 氧化还原反应21、O H Cu H CuO 22+−→−+∆22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++−→−+∆)((极稀)24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++−→−+∆)((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()(28、↑+↑+→++2223CO 3N S K S C 3KNO 2第四节 卤族元素29、HF 2F H 22→+30、HBr 2Br H 22→+31、HI 2I H 22→+32、22Br NaCl 2Cl NaBr 2+→+33、22I KCl 2Cl KI 2+→+34、22I KBr 2Br KI 2+→+35、33NaNO AgBr AgNO NaBr +↓→+36、33KNO AgI AgNO KI +↓→+37、2Br Ag 2AgBr 2+−−→−光照第二章 摩尔 反应热第一节 摩尔38、22CO O C →+39、↑+→+22H MgCl HCl 2Mg第二节 气体摩尔体积40、22H ZnCl HCl 2Zn +→+第三节 物质的量浓度41、O H 2SO Na SO H NaOH 224242+→+第四节 反应热42、kJ 5.393CO O C 22+−−→−+(气)(气)(固)点燃43、kJ 6.483O H 2O H 2222+→+(气)(气)(气) 44、kJ 6.571O H 2O H 2222+→+(液)(气)(气) 45、kJ 3.131H CO O H C 22-+−→−+∆(气)(气)(气)(固) 第三章 硫 硫酸第一节 硫46、S Cu S Cu 22−→−+∆47、FeS S Fe −→−+∆ 48、S H H S 22−→−+∆49、2CS C S −−→−+高温 50、22SO O S −−→−+点燃 51、O H 3SO K S K 2KOH 6S 32422++−→−+∆第二节 硫的氢化物和氧化物 52、↓+−→−∆S H S H 22 53、2222SO 2O H 2(O 3S H 2+−−→−+点燃足)54、↓+−−→−+S 2O H 2(O S H 2222点燃不足) 55、↓+−−→−+S 3O H 2SO S H 2222点燃 56、HBr 2S Br S H 22+↓→+57、↑+→+S H FeCl HCl 2FeS 2258、4224SO H CuS S H CuSO +↓→+59、HAc 2PbS S H PbAc 22+↓→+60、O H NaHS NaOH S H 22+→+61、O H S Na NaOH NaHS 22+→+62、O H 2S Na NaOH 2S H 222+→+(60、61结合) 63、HCl 2FeCl 2S FeCl 2S H 232++↓→+64、↑+→+S H FeSO FeS SO H 2442(稀) 65、3222SO H O H SO ⇔+66、3OV 22SO 2O SO 252∆−−→←+ 67、4223SO H O H SO →+68、↑++→+22424232SO O H SO Na SO H SO Na69、O H SO Na NaOH 2SO 2322+→+70、32CaSO CaO SO →+71、O H CaSO OH Ca 2SO 2322+↓→+)(72、23232HSO Ca O H CaSO SO )(→++73、O H 2S 3S H 2SO 222+↓→+74、42222SO H HCl 2O H 2Cl SO +→++75、42222SO H HBr 2O H 2Br SO +→++76、42424422SO H 2SO K MnSO KMnO 2O H 2SO 5++→++第三节 硫酸的工业制法77、↑+−−→−+23222SO 8O Fe 2O 11FeS 4高温78、3OV 22SO 2O SO 252∆−−→←+79、4232SO H SO O H →+第四节 硫酸 硫酸盐80、O H 2SO 2CO SO H 2C 22242+↑+↑−→−+∆(浓) 81、O H 2SO 3SO H 2S 2242+↑−→−+∆(浓) 82、O H 2SO PO H SO H P 224342+↑+−→−+∆(浓) 83、O H 2SO S SO H S H 22422++−→−+∆(浓) 84、O H 2SO CuSO SO H 2Cu 22442+↑+−→−+∆(浓) 85、HCl 2BaSO SO H BaCl 4422+↓→+86、NaCl 2BaSO SO Na BaCl 4422+↓→+87、NaCl 2BaCO CO Na BaCl 3322+↓→+88、↑++→+2223CO O H BaCl HCl 2BaCO 89、↑++→+222333CO O H NO Ba HNO 2BaCO )(90、↑++→+2223232CO O H S Na SO H CO Na91、42232SO H 2O SO H 2→+92、42232SO Na 2O SO Na 2→+93、423CaSO 2O CaSO 2→+94、O H 6SO 3SO Fe SO H 6Fe 22234242+↑+−→−+∆)((浓) 95、O H SO Na SO Br SO H 2NaBr 22422242++↑+−→−+∆(浓) 96、↑+−→−+∆HCl 2SO Na SO H NaCl 24242(浓) 97、O H 11C 12O H C 2SOH 11221142+−−−→−浓 第四章 碱金属第一节 钠98、O Na 2O Na 422→+99、222O Na O Na 2→+2101、S Na S Na 22−−→−+研磨 102、↑+→+22H NaOH 2O H 2Na 2103、↑++→++242242H SO Na OH Cu CuSO O H 2Na 2)(第二节 钠的氧化物104、NaOH 2O H O Na 22→+105、↑+→+2222O NaOH 4O H 2O Na 2106、3222CO Na CO O Na →+107、232222O CO Na 2CO 2O Na 2+→+108、O H NaCl 2HCl 2O Na 22+→+109、↑++→+2222O O H 2NaCl 4HCl 4O Na110、O H CO NaCl 2HCl 2CO Na 2232+↑+→+111、O H CO NaCl HCl NaHCO 223+↑+→+ 112、O H CO CO Na NaHCO 222323+↑+−→−∆113、O H CO Na NaOH NaHCO 2323+−→−+∆ 114、O H 2CO Na CaCO OH Ca NaHCO 2232323++↓→+(少量))( 115、O H NaOH CaCO OH Ca NaHCO 2323++↓→+(足量))( 116、NaCl 2BaCO BaCl CO Na 3232+↓→+117、NaCl 2CaCO CaCl CO Na 3232+↓→+118、O H 2CO 2CaCl HCl 2HCO Ca 22223+↑+→+)(119、O H 2CO Na CaCO NaOH 2HCO Ca 232323++↓→+)(120、O H SO NaCl HCl NaHSO 223+↑+→+第三节 碱金属元素22122、22KO O K −−→−+点燃 123、MX 2X M 22→+(M 表示氧族元素,X 代表卤族元素) 124、MH 2H M 22→+125、↑+→+22H MOH 2O H 2M 2 第五章 物质结构 元素周期律本章内容、性质特殊,所有化学反应方程式均融在其他章节中。
高一人教版化学元素化合物方程式总结

必修1化学方程式1、常温下钠与氧气反应:4Na + O2 = 2Na2O (白色)2、钠在空气中燃烧:2Na + O2△Na2O2(淡黄色)3、钠在氯气中燃烧:2Na + Cl2△2NaCl (白烟)4、钠与硫共热:2Na +S △2S5、钠与水反应:2Na + 2H2O = 2NaOH + H2↑6、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑7、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O28、铁在氧气中燃烧:3Fe+2O2点燃Fe3O49、铁与水蒸气反应:3Fe + 4H2O(g) △Fe3O4 + 4H210、2NaHCO3△Na2CO3 + CO2↑+ H2O11、Al与盐酸反应:2Al+6HCl===2AlCl3+3H2↑12、Al2O3与盐酸反应:Al2O3 + 6HCl===2AlCl3 + 3H2O13、Al(OH)3与盐酸反应:Al(OH)3 +3HCl=== AlCl3 + 3H2O14、Al与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O===2NaAlO2 + 3H2↑2Al + 2 OH- + 2H2O===2AlO2- + 3H2↑15、Al2O3与氢氧化钠溶液反应:Al2O3 + 2NaOH === 2NaAlO2 + H2OAl2O3 + 2OH-=== 2 AlO2- + H2O16、Al(OH)3与氢氧化钠溶液反应:Al(OH)3 + NaOH === NaAlO2 + 2H2O17、氧化亚铁与盐酸反应:FeO+2HCl=FeCl2 +H2O18、氧化铁与盐酸反应:Fe2O3 + 6HCl= 2FeCl3 + 3H2O19、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = 3NaCl + Fe(OH)3↓(红褐色)20、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓(白色)生成的白色沉淀迅速变成灰绿色最终变成红褐色4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)321、实验室制取氢氧化铝(铝盐溶液加氨水):Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓ + 3(NH4)2SO4Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+22、氢氧化铝加热分解:2Al(OH)3△Al2O3 + 3H2O23、氢氧化铁加热分解:2Fe(OH)3△3H2O + Fe2O3(红棕色粉末,俗称铁红)24、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3白色沉淀迅速变成灰绿色,最终变成红褐色25、FeCl3溶液与铁粉反应:2FeCl3 + Fe = 3FeCl22Fe3+ + Fe = 3Fe2+26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-27、FeCl3溶液与铜反应:2FeCl3 + Cu = 2FeCl2+CuCl22Fe3+ + Cu = 2Fe2++Cu2+28、除去碳酸氢钠溶液中的碳酸钠,方法:通过量CO2Na2CO3 +CO2 + H2O = 2NaHCO3 CO32- + CO2 + H2O = 2HCO3-29、锂在空气中燃烧:4Li + O2△2Li2O30、金属钾与水的反应:2K + 2H2O = 2KOH + H2↑31、氟气与氢气在暗处就能剧烈化合:F2 + H2 = 2HF32、氟气与水的反应:2F2 + 2H2O = 4HF +O2↑33、卤素单质间的置换反应:氯水与饱和溴化钠溶液:Cl2 + 2NaBr = Br2 + 2NaCl氯水与饱和碘化钾溶液:Cl2 + 2KI = I2 + 2KCl溴水与饱和碘化钾溶液:Br2 + 2KI = I2 + 2KBr34、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4↑+ 2H2O催化剂加热 35、二氧化硅与氧化钙高温反应:SiO 2 + CaO 高温CaSiO 336、二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O37、硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓38、氯气的实验室制法:MnO 2+4HCl (浓) △ MnCl 2+Cl 2↑+ 2H 2O 39、氯气与金属反应:2Fe + 3Cl 2点燃 2FeCl 3 (棕色烟) Cu + Cl 2 点燃CuCl 2 (棕黄色的烟) 2Na + Cl 2点燃 2NaCl (白烟) 40、氯气与氢气反应:H 2+Cl 2 △2HCl (苍白色火焰,有白雾生成)41、氯气与水反应:Cl 2 + H 2O = HCl + HClO次氯酸光照分解:2HClO HCl + O 2↑42、氯气与氢氧化钠溶液反应:Cl 2 + 2NaOH = NaCl + NaClO + H 2O43、氯气与消石灰反应制漂白粉:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O44、漂白粉长期置露在空气中:Ca(ClO)2 + H 2O + CO 2 = CaCO 3↓ + 2HClO45、硫的燃烧 S +O 2 点燃 SO 246、二氧化硫与水反应:SO 2 + H 2O H 2SO 347、二氧化硫与氧气反应:2SO 2+O 22SO 3 48、SO 3与氧化钙反应:SO 3+CaO =CaSO 449、三氧化硫与水反应:SO 3 + H 2O = H 2SO 450、二氧化硫与Ca (OH )2溶液反应:SO 2 + Ca (OH )2 = CaSO 3 +H 2O51、氮气与氧气在放电下反应:N 2 + O 2 2NO52、一氧化氮与氧气反应:2NO + O 2 = 2NO 253、二氧化氮与水反应:3NO 2 + H 2O = 2HNO 3 + NO54、合成氨反应:N 2+3H 2 催化剂 高温高压2NH 3 氨水受热分解:NH 3•H 2O △ NH 3↑ + H 2O光照 放电55、氨水显碱性的原因: NH3 + H2O NH3•H2O NH4+ + OH—56、氨气与氯化氢反应:NH3 + HCl = NH4Cl氯化铵受热分解:NH4Cl △NH3↑ + HCl↑57、碳酸氢氨受热分解:NH4HCO3△NH3↑ + H2O↑ + CO2↑58、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2O59、氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O60、氨气的实验室制取法:2NH4Cl + Ca(OH)2△CaCl2 + 2H2O + 2NH3↑61、浓硫酸与铜反应:Cu + 2H2SO4(浓) △4+ 2H2O + SO2↑62、浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2↑+ 2SO2↑ + 2H2O63、浓硝酸与铜反应:Cu + 4HNO3(浓) ===Cu(NO3)2 + 2H2O + 2NO2↑64、稀硝酸与铜反应:3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 4H2O + 2NO↑选考1、向碳酸钠溶液中逐滴滴加稀盐酸,现象:开始无现象,然后有气泡生成,溶液中碳酸根离子的物质的量的变化趋势:先增大再减小,发生反应的离子方程式:CO32- + H+ = HCO3- HCO3- + H+ = CO2↑+ H2O2、向AlCl3溶液中逐滴加入NaOH溶液至过量,现象是:有白色沉淀生成,白色沉淀先逐渐增多,后逐渐减少直至消失;有关离子方程式:Al3+ + 3OH-=== Al(OH)3↓Al(OH)3 + OH-=== AlO2- + 2H2O3、向NaAlO2溶液中逐滴滴加稀盐酸至过量,现象是:有白色沉淀生成,白色沉淀先逐渐增多,后逐渐减少直至消失;有关离子方程式:AlO2- + 2H2O + H+ === Al(OH)3↓Al(OH)3 + 3H+=== Al3+ + 3H2O 4、向明矾溶液中加入氨水,现象是:有白色沉淀生成,有关离子方程式是:Al3+ + 3NH3•H2O = Al(OH)3↓ + 3NH4+5、向含1mol明矾的溶液中加入含2mol Ba(OH)2的溶液,化学方程式是:KAl(SO4)2 + 2Ba(OH)2 = KAlO2 + 2BaSO4↓+ 2H2O。
人教版高中化学必修一必修二化学方程式汇总

化学必修一必修二方程式汇总必修一、必修二化学方程式汇总必修一1 、硫酸根离子的检验: B a C l2+ N a2 S O 4 = = = = B a S O 4↓ + 2 N a C l2 、碳酸根离子的检验: C a C l2+ N a 2 C O3 = = = = = C a C O 3↓ + 2 N a C l3 、碳酸钠与盐酸反应:N a 2 C O 3+ 2 H C l= = = = = 2 N a C l+ H 2 O+ C O2↑高温4 、木炭还原氧化铜: 2 C u O +C 2 C u+ C O 2↑5 、铁片与硫酸铜溶液反应: F e+ C u S O 4= = = = = F e S O 4+ C u6 、氯化钙与碳酸钠溶液反应: C a C l2+N a 2 C O 3= = = = = C a C O 3↓ +2 N a C l7 、钠在空气中燃烧: 2 N a+O 2N a 2 O 2钠与氧气反应: 4 N a+O 2= = = = 2 N a 2 O8 、过氧化钠与水反应: 2 N a 2 O 2+ 2 H 2 O = = = = 4 N a O H+O 2↑9 、过氧化钠与二氧化碳反应: 2 N a 2 O 2+ 2 C O 2= = = = 2 N a 2 C O 3+ O 21 0 、钠与水反应:2 N a+ 2 H 2 O = = = = 2 N a O H +H 2↑1 1 、铁与水蒸气反应: 3 F e+ 4 H2 O ( g )= = = = F e3 O 4+4 H 2↑1 2 、铝与氢氧化钠溶液反应: 2 A l + 2 N a O H + 2 H 2 O = = = = 2 N a A l O 2+ 3 H2↑1 3 、氧化钙与水反应: C a O +H2 O= = = = C a ( O H )21 5 、氧化铝与盐酸反应: A l2 O 3+ 6 H C l= = = = = 2 A l C l3+3 H 2 O1 6 、氧化铝与氢氧化钠溶液反应: A l2 O 3+ 2 N a O H = = = = = 2 N a A l O 2+H 2 O1 7 、氯化铁与氢氧化钠溶液反应: F e C l3+ 3 N a O H = = = = = F e ( O H )3↓+ 3 N a C l1 8 、硫酸亚铁与氢氧化钠溶液反应:F e S O 4 +2 N a O H = = = = F e ( O H )2↓+ N a 2 S O 41 9 、氢氧化亚铁被氧化成氢氧化铁: 4 F e ( O H )2+2 H 2 O +O 2= = = =4 F e ( O H )32 0 、氢氧化铁加热分解: 2 F e ( O H )3 F e 2 O 3+ 3 H 2 O ↑2 1 、实验室制取氢氧化铝: A l 2 (S O 4 )3+ 6 N H 3· H 2 O = = = =2 A l ( O H )3 ↓+ 3 ( N H 3 ) 2 S O 42 2 、氢氧化铝与盐酸反应: A l ( O H )3+3 H C l = = = = A l C l3+ 3 H 2 O2 3 、氢氧化铝与氢氧化钠溶液反应:A l ( O H )3+ N a O H = = = = N a A l O 2+ 2 H2O2 4 、氢氧化铝加热分解: 2 A l ( O H )3 A l 2 O 3+ 3 H 2 O2 5 、三氯化铁溶液与铁粉反应: 2 F e C l3+ F e= = = =3 F e C l22 6 、氯化亚铁中通入氯气: 2 F e C l2+ C l2= = = = = 2 F e C l32 7 、二氧化硅与氢氟酸反应:S i O 2+ 4 H F= = = =S i F 4+ 2 H 2 O硅单质与氢氟酸反应:S i+ 4 H F= = = =S i F 4+ 2 H 2↑高温2 8 、二氧化硅与氧化钙高温反应:S i O 2+ C a O C a S i O 32 9 、二氧化硅与氢氧化钠溶液反应:S i O 2+ 2 N a O H = = = = N a 2 S i O 3+H 2 O3 0 、往硅酸钠溶液中通入二氧化碳:N a 2 S i O 3 + C O 2 + H 2 O = = = N a 2 C O 3+H 2 S i O 3↓3 1 、硅酸钠与盐酸反应: N a 2 S i O 3 + 2 H C l = = = 2 N a C l + H 2 S i O 3↓点燃3 2 、氯气与金属铁反应: 2 F e+ 3 C l2 2 F e C l3点燃3 3 、氯气与金属铜反应: C u+ C l2 C u C l2点燃3 4 、氯气与金属钠反应: 2 N a+ C l2 2 N a C l3 5 、氯气与水反应: C l2+H 2 O = = = =H C l+H C l O光照3 6 、次氯酸光照分解: 2 H C l O 2 H C l+O 2↑3 7 、氯气与氢氧化钠溶液反应: C l2+ 2 N a O H = = = = = N a C l + N a C l O+H 2 O3 8 、氯气与消石灰反应: 2 C l2+ 2 C a ( O H ) 2= = = = C a C l2+C a ( C l O )2+ 2 H 2 O3 9 、盐酸与硝酸银溶液反应:H C l+ A g N O 3 = = = = A g C l↓ +H N O 34 0 、漂白粉长期置露在空气中: C a ( C l O )2+ H 2 O + C O 2 = = = = C a C O 3↓+2 H C l O4 1 、二氧化硫与水反应:SO2+H2O == =H2SO3放电4 2 、氮气与氧气在放电下反应:N 2+O 2 2 N O4 3 、一氧化氮与氧气反应: 2 NO +O2==== 2 NO24 4 、二氧化氮与水反应:3NO2+H2O = ===2HNO3+NO4 5 、二氧化硫与氧气在催化剂的作用下反应:2 S O 2 + O 2催化剂2 SO34 6 、三氧化硫与水反应:SO3+H2O == ==H2SO44 7 、浓硫酸与铜反应: C u+ 2 H 2 S O 4 (浓) C u S O 4+ 2 H 2 O +SO2↑4 8 、浓硫酸与木炭反应: C + 2 H2SO4(浓) C O2↑+ 2 SO2↑+ 2 H2O 4 9 、浓硝酸与铜反应: C u + 4 H N O 3 (浓)= = = = C u ( N O 3 ) 2 + 2 H 2 O+ 2 NO2↑5 0 、稀硝酸与铜反应: 3 C u + 8 H N O 3 (稀) 3 C u ( N O 3 )2+ 4 H 2 O+ 2 NO↑5 1 、氨水受热分解:NH3·H2O N H3↑+H2O5 2 、氨气与氯化氢反应:N H 3+H C l= = = =N H 4 C l5 3 、氯化铵受热分解:N H 4 C l N H 3↑ +H C l↑5 4 、碳酸氢氨受热分解:NH4HCO3N H3↑+H2O↑+CO2↑5 5 、硝酸铵与氢氧化钠反应:N H 4 N O 3 + N a O H N H 3↑ + N a N O 3 +H 2 O5 6 、氨气的实验室制取: 2 N H 4 C l+ C a ( O H )2 C a C l2+ 2 H 2 O + 2 NH3↑点燃5 7 、氯气与氢气反应: C l2+H 2 2 H C l5 8 、硫酸铵与氢氧化钠反应:(N H 4)2 S O 4+ 2 N a O H 2 N H 3↑ +N a 2 S O 4+ 2 H 2 O5 9 、 S O 2+ C a O = = = = C a S O 36 0 、 S O 2+ 2 N a O H= = = =N a 2 S O 3+H 2 O6 1 、 S O 2+ C a ( O H )2= = = = C a S O 3↓ +H 2 O6 2 、 S O 2+ C l2+ 2 H 2 O = = = = 2 H C l+H 2 S O 463、SO2+2H2S====3S+2H2O6 4 、 N O 、 N O 2的回收: N O 2+ N O + 2 N a O H = = = = 2 N a N O 2+H 2 O6 5 、 S i+ 2 F 2= = =S i F 46 6 、 S i+ 2 N a O H+H 2 O = = = =N a 2 S i O 3+ 2 H 2↑6 7 、硅单质的实验室制法高温电炉粗硅的制取:S i O 2+ 2 C S i+ 2 C O(石英沙)(焦碳)(粗硅)粗硅转变为纯硅:S i(粗)+ 2 C l2S i C l4高温必修二第一章物质结构元素周期律1 、 L i与O2反应(点燃):4 L i+O2 2 L i2ON a与 O 2反应(点燃) : 2N a + O 2N a 2 O 2N a与 H 2O反应:2N a + 2H 2 O = = = 2 N a O H + H 2↑K 与H2O反应: 2K+2H2O===2KOH+H2↑2 、卤素单质 F 2、C l2、B r2、I2与氢气反应:F 2+ H 2=== 2HF C l 2 + H 2 = = = 2 H C l Br 2 +H 2= = = 2 B rI2+H 2=== 2HI3、卤素单质间的置换反应:( 1 )氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:① C l 2 + 2 N a B r = = = B r 2 + 2 N a C l②C l 2 + 2 N a I = = = I 2 + 2 N a C l( 2 )溴水与碘化钠溶液反应: B r 2 + 2 N a I = = = I 2 + 2 N a B r4 、 M g与H2O反应:M g + 2 H2O= = =M g ( O H ) 2 +H 2↑A l与H C l反应: 2 A l + 6 H C l = = = 2 A l C l 3 + 3 H 2↑M g与H C l反应:M g + 2H C l= = =M g C l 2 +H 2↑5 、 N a与C l 2 反应(点燃):6、用电子式表示氯化氢的形成过程:第二章化学反应与能量1 、 B a ( O H )2 ?8 H 2 O 与 N H 4 C l的反应:B a ( O H ) 2 ·8H 2 O + 2 N H 4C l = = B a C l 2 + 2 N H 3↑ + 1 0 H 2 O2 、原电池原理典型的原电池(Z n - C u原电池)负极(锌):Z n - 2 e - = = = Z n 2 +(氧化反应)正极(铜): 2 H + + 2 e - = = = H 2↑(还原反应)电子流动方向:由锌经过外电路流向铜。
高中化学必修1化学方程式总结
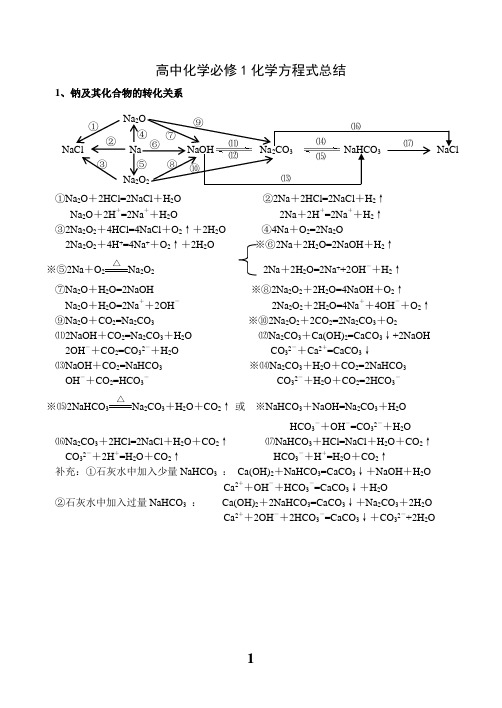
高中化学必修1化学方程式总结1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2ONaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④2、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2OAl Al 2O 3 A l (O H )3 KAl(SO 4)2NaAlO 2AlCl 3 ① ② ③ ④ ⑤ ⑥⑦⑧ ⑨⑩⑾⑿①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
高中化学必修一化学方程式整理

化学方程式整理答案一、钠及其化合物1、钠在氧气中燃烧 2Na+O 2 Na 2O 22、钠与水的反应 2Na+2H 2O=2NaOH+H 2↑3、过氧化钠与水反应 2Na 2O 2+2H 2O=4NaOH+O 2↑4、过氧化钠 与二氧化碳反应2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑《5、小苏打受热分解 2NaHCO 3 Na 2CO 3+H 2O+CO 2↑6、向小苏打溶液中滴加盐酸 NaHCO 3+HCl=NaCl+CO 2↑+H 2O7、向小苏打溶液中滴加烧碱溶液NaHCO 3+NaOH= Na 2CO 3+H 2O8、少量小苏打溶液与石灰水的反应 NaHCO 3+Ca(OH)2= CaCO 3↓+NaOH+H 2O 9、向盐酸中滴加苏打溶液 Na 2CO 3+2HCl=2NaCl +CO 2↑+H 2O10、向苏打溶液中滴加盐酸 Na 2CO 3+HCl=NaCl+NaHCO 3 NaHCO 3+HCl=NaCl+CO 2↑+H 2O 11、向苏打溶液中通入二氧化碳 Na 2CO 3+ H 2O+CO 2=2 NaHCO 312、向苏打溶液中滴加硝酸银溶液 Na 2CO 3+2AgNO 3=Ag 2CO 3↓+2NaNO 3—13、向硫酸钠溶溶中滴加氯化钡溶液 Na 2SO 4+BaCl 2=BaSO 4↓+2NaCl 二、镁、铝及其化合物1、镁溶于盐酸 Mg+2HCl=MgCl 2+H 2↑2、镁在二氧化碳中燃烧 2Mg+CO 2 2MgO+C3、氢氧化镁溶于盐酸 Mg(OH)2+2HCl=MgCl 2+2H 2O4、铝溶于盐酸 2Al+6HCl=2AlCl 3+3H 2↑5、铝溶于烧碱溶液 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑6、铝和氧化铁加热后的反应 2Al+Fe 2O 3 2Fe+Al 2O 37、氧化铝溶于盐酸 Al 2O 3+6HCl=2AlCl 3+3H 2O8、氧化铝溶于烧碱溶液 Al 2O 3+2NaOH=2NaAlO 2+ H 2O9、氢氧化铝溶于盐酸 Al(OH)3+ 3HCl = AlCl 3+3H 2O 10、氢氧化铝溶于烧碱溶液Al(OH)3+ NaOH=NaAlO 2+ 2H 2O 11、向氯化铝溶液中滴加烧碱溶液△ △点燃 !AlCl 3+3 NaOH= Al(OH)3↓+3NaCl Al(OH)3+ NaOH=NaAlO 2+ 2H 2O,12、向氯化铝溶液中滴加氨水 AlCl 3+3NH 3·H 2O= Al(OH)3↓+3NH 4Cl 13、向偏铝酸钠溶液中滴加盐酸 NaAlO 2+HCl+ H 2O= Al(OH)3↓+NaCl14、向偏铝酸钠溶液中通入过量的二氧化碳NaAlO 2+CO 2+2H 2O= Al(OH)3↓+ NaHCO 3 15、氢氧化铝受热分解 2Al(OH)3 Al 2O 3+ 3H 2O 三、铁及其化合物1、铁在氧气中燃烧 3Fe+2O 2 Fe 3O 42、铁与水蒸气的反应 3Fe+4H 2O (g) Fe 3O 4+4H 2↑3、铁在氯气中燃烧 2Fe+3Cl 2 2FeCl 34、铁溶于盐酸 Fe+2HCl=FeCl 2+H 2↑5、铁和硫酸铜溶液反应 Fe+CuSO 4=Cu+FeSO 46、氯化铁溶液和铁反应 2FeCl 3+Fe=3FeCl 27、氯化铁溶液和铜反应 2FeCl 3+Cu=CuCl 2+ 2FeCl 2%8、氯化铁溶液和碘化钾溶液反应2FeCl 3+2KI=I 2+ 2FeCl 2+2KCl 9、向氯化亚铁溶液中通氯气 2FeCl 2+ Cl 2=2 FeCl 310、向酸性氯化亚铁溶液中滴加双氧水(离子方程式)2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O 11、氯化铁溶液和硫氰化钾溶液反应 FeCl 3+3KSCN=Fe(SCN)3+3KCl 12、向氯化亚铁溶液中滴加烧碱溶液 FeCl 2+2NaOH=Fe(OH)2↓+2NaCl 13、向氯化铁溶液中滴加烧碱溶液 FeCl 3+3NaOH=Fe(OH)3↓+3NaCl 14、氢氧化铁受热分解 2Fe(OH)3 Fe 2O 3 +3H 2O…15、氢氧化亚铁与潮湿空气反应4 Fe(OH)2+ O 2 +2 H 2O=4Fe(OH)3 16、氢氧化铁溶于盐酸 Fe(OH)3 +3HCl=FeCl 3+3 H 2O 17、氢氧化亚铁溶于盐酸 Fe(OH)2 +2HCl=FeCl 2+2 H 2O 18、磁性氧化铁溶于盐酸 Fe 3O 4+8HCl=FeCl 2+ 2FeCl 3+4H 2O 四、氯及其化合物1、氢气在氯气中燃烧 H 2+Cl 2 2HCl>△点燃 】点燃△点燃或光照 点燃2、铜在氯气中燃烧 Cu+ Cl 2 CuCl 23、向溴化钠溶液中通入氯气2NaBr+ Cl 2=2NaCl+Br 24、向碘化钠溶液中通入氯气2NaI+ Cl 2=2NaCl+I 25、向碘化钠溶液中滴入溴水2NaI+ Br 2=2NaBr+I 26、氯气与水反应 Cl 2 +H 2O=HCl+HClO7、氯气与烧碱溶液反应 Cl 2 +2NaOH=NaCl+NaClO+ H 2O 8、氯气与消石灰反应2Cl 2 +2Ca(OH)2=CaCl 2+Ca(ClO)2+2 H 2O`9、次氯酸见光分解 2HClO 2HCl+O 2↑10、漂白粉与少量二氧化碳的反应 Ca(ClO)2+CO 2+ H 2O=CaCO 3↓+2HClO 11、二氧化锰与浓盐酸共热制氯气 MnO 2+4HCl(浓) MnCl 2+Cl 2↑+H 2O 12、氯化钠与硝酸银溶液反应 NaCl+AgNO 3=AgCl ↓+NaNO 3 13、溴化钠与硝酸银溶液反应 NaBr+AgNO 3=AgBr ↓+NaNO 3 14、碘化钠与硝酸银溶液反应 NaI+AgNO 3=AgI ↓+NaNO 3 五、硫及其化合物1、硫与氢气共热反应 S+H 2 H 2S2、硫在氧气中燃烧 S+O 2 SO 23、硫粉和铁粉共热反应 S+Fe FeS4、硫粉与铜粉共热反应 S+2Cu Cu 2S#5、二氧化硫与水的反应 SO 2+ H 2O H 2SO 36、向烧碱溶液中通入二氧化硫SO 2+ 2NaOH=Na 2SO 3+ H 2O SO 2+ Na 2SO 3+ H 2O=2NaHSO 37、二氧化硫与氧气在催化剂、共热条件下的反应 2SO 2+ O 22SO 38、二氧化硫与等物质的量的氯气混合后通入水中的反应SO 2+Cl 2+2H 2O=H 2SO 4+2HCl 9、二氧化硫与氯化铁溶液的反应 SO 2+2FeCl 3+2H 2O=2FeCl 2+H 2SO 4+2HCl?10、二氧化硫与高锰酸钾溶液的反应5SO 2+2KMnO 4+3H 2O=K 2SO 4+MnSO 4+3H 2SO 411、二氧化硫与硫化氢的反应SO 2+2H 2S=3S+2H 2O光照△ —点燃△ △催化剂 高温12、向烧碱溶液中通入硫化氢H 2S+ 2NaOH=Na 2S+ H 2O H 2S + Na 2S =2NaHS13、向硫酸铜溶液中通入硫化氢H 2S+CuSO 4=CuS ↓+H 2SO 4 14、三氧化硫与水的反应 SO 3+H 2O= H 2SO 4*15、浓硫酸与铜共热的反应 Cu+2 H 2SO 4(浓) CuSO 4+ SO 2↑+2 H 2O16、浓硫酸与木炭共热的反应C+2 H 2SO 4(浓) CO 2↑+ 2SO 2↑+2 H 2O六、氮及其化合物)1、氮气与氧气的反应 N 2+O 2 2NO2、氮气与氢气合成氨气 N 2+3H 22NH 33、一氧化氮与氧气的反应 2NO+O 2=2NO 24、二氧化氮与水的反应 3NO 2 + H 2O =2HNO 3+NO5、氨气与水的反应 NH 3+ H 2ONH 3·H 2O}6、氨气与氯化氢的反应 NH 3+HCl=NH 4Cl7、氨气与硝酸的反应 NH 3+HNO 3=NH 4 NO 38、氨气的催化氧化 4NH 3+ 5O 2 = 4NO+6 H 2O 9、氨水受热分解 NH 3·H 2O NH 3↑+ H 2O 10、向氨水中通入二氧化硫 2NH 3·H 2O+SO 2=(NH 4)2SO 3+ H 2O 11、氯化铵受热分解 NH 4Cl NH 3↑+ HCl ↑ 12、碳酸氢铵受热分解 NH 4HCO 3 NH 3↑+CO 2↑+ H 2O 13、硝酸铵与烧碱溶液共热 NH 4 NO 3+NaOH NaNO 3+ NH 3↑+ H 2O 14、氯化铵固体与熟石灰共热制氨气2 NH 4Cl+Ca(OH)2 CaCl 2+ 2NH 3↑+ 2H 2O 15、浓硝酸受热或见光分解 4 HNO 3 4NO 2↑+O 2↑+ 2H 2O 16、浓硝酸与木炭共热的反应 C+ 4HNO 3(浓) 4NO 2↑+CO 2↑+ 2H 2O△△放电或高温催化剂 高温、高压催化剂 △△*△△△ 】△17、浓硝酸与铜的反应Cu+4 HNO3(浓)=Cu(NO3)2+2NO2↑+2 H2O18、稀硝酸与铜的反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O七、硅及其化合物1、二氧化硅与氢氟酸的反应SiO2+4HF=SiF4↑+2H2O&2、二氧化硅与烧碱溶液的反应SiO2+2NaOH=Na2SiO3+H2O3、二氧化硅与生石灰的反应SiO2+CaO CaSiO34、水玻璃与盐酸的反应Na2SiO3+2HCl=H2SiO3↓+2NaCl5、向水玻璃中通足量二氧化碳Na2SiO3+2CO2+ 2H2O= H2SiO3↓+2NaHCO3^第三章金属及其化合物方程式一.基础部分:条目反应方程式(若是离子反应则写离子方程式)现象1《钠在空气中燃烧2Na +O2Na2O2黄色的火焰,生成淡黄色固体2钠块在空气中氧化4Na+O2=2Na2O钠表面很快变暗3)钠在氯气中燃烧2Na +Cl2点燃2NaCl黄色火焰,生成白色固体4钠与硫粉研磨2Na + S =Na2S研磨爆炸5.钠与水反应2Na +2H2O =2Na++2OH -+H2 ↑剧烈,钠熔化成银白色小球,浮于水面,四处游动等6过氧化钠与水的反应2Na2O2+2H2O =4Na++4OH -+O2↑放热、淡黄色变白7}2Na2O2+2CO2=2Na2CO3+O2同上高温祝你考试愉快。
高中无机化学化学方程式总结

高中化学元素化合物化方程式汇总(一)金属及其化合物一、钠及其化合物(37)1.钠与氧气常温反应:4Na+O2=2Na2O(白色)2.钠与氧气加热反应:2Na+O2≜Na2O2(淡黄色)3.钠和水反应:2Na+2H2O=2NaOH+H2↑(2Na+2H2O=2Na++2OH-+H2↑)4.钠与硫酸铜溶液反应:{2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4(不能置换出金属,先水后盐的原则)5.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑(2Na+ 2H+=2Na++H2↑)6.钠与氯气反应:2Na+Cl2点燃→2NaCl(白烟)7.钠与硫反应:2Na+S=Na2S8.氢化钠与水反应:NaH(s)+H2O=NaOH+H2↑9.氧化钠与水反应:Na2O+H2O=2NaOH10.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO311.氧化钠与盐酸溶液反应:Na2O+2HCl=2NaCl+H2O12.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑13.过氧化钠与二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O214.过氧化钠与盐酸溶液反应:2Na2O2+4HCl=4NaCl +2H2O+O2↑15.过氧化钠与氢气反应(“白吃”):Na2O2+H2氧气→2NaOH16.过氧化钠与一氧化碳反应(“白吃”):Na2O2+CO= Na2CO317.氢氧化钠与二氧化碳1:1反应:NaOH +CO2 =NaHCO318.氢氧化钠与二氧化碳2:1反应:2NaOH+CO2=Na2CO3+H2O19.氢氧化钠与二氧化碳反应(1:1与1:2总方):5NaOH+4CO2=3 NaHCO3+Na2CO3+H2O20.碳酸钠与水反应:CO32-+ H2O⇔HCO3-+OH-21.碳酸钠与少量酸反应:CO32-+H+= HCO3-22.碳酸钠与酸(1:1)反应:CO32-+H+= HCO3-23.碳酸钠与酸(1:2)反应:CO32-+2H+=H2O+CO2↑24.碳酸钠与氢氧化钠溶液反应:——25.碳酸钠与石灰水反应:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(CO32-+Ca2+=CaCO3↓)26.碳酸钠与氯化钡溶液反应:Na2CO3+BaCl2=2NaCl+BaCO3↓(CO32-+Ba2+=BaCO3↓)27.碳酸钠与二氧化碳反应:Na2CO3 +CO2+H2O =2NaHCO3↓28.碳酸氢钠与水反应:HCO3-+ H2O⇔H2CO3+OH-29.碳酸氢钠与盐酸溶液反应:NaHCO3+HCl=NaCl+H2O+CO2↑(HCO3-+H+=H2O+CO2↑)30.碳酸氢钠与氢氧化钠溶液反应:NaHCO3+NaOH=Na2CO3+H2O(HCO3-+OH-=CO32-+H2O)31.少量碳酸氢钠与石灰水反应:NaHCO3+ Ca(OH)2= NaOH+ CaCO3↓+H2O32.过量碳酸氢钠与石灰水反应:2NaHCO3+ Ca(OH)2= Na2CO3+ CaCO3↓+2H2O33.碳酸氢钠与氯化钡溶液反应:——34.碳酸氢钠与二氧化碳反应:——35.碳酸氢钠受热分解:2NaHCO3≜Na2CO3+H2O+CO2↑36.侯德榜制碱法:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3↓37.钠长期放在空气中的反应:Na+O2=Na2O+H2O→NaOH(固)+H2O→NaOH(液)+CO2→Na2CO3·10H2O→Na2CO3二、铝及其化合物(22)38.铝与水常温反应:2Al+6H2O= 2Al(OH)3+3H2↑39.铝与氧气加热反应:4Al+3O2≜2Al2O340.铝与氯气加热反应:2Al+3Cl2点燃→2AlCl341.铝与硫加热反应:2Al+3S≜Al2S342.铝与三氧化二铁反应:2Al+Fe2O3高温→2Fe+Al2O343.三硫化二铝与水:Al2S3+6H2O=2Al(OH)3↓+3H2S↓44.铝与盐酸溶液反应:2Al+6HCl=2AlCl3+3H2↑(2Al+6H+=2Al3++3H2↑)45.铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2Al+2OH-+2H2O=2AlO2-+3H2↑)46.铝与稀硝酸溶液的钝化反应:Al+4HNO3(稀) =Al(NO3)3 + NO↑+ 2H2O47.铝离子与偏铝酸根反应:Al3++3AlO2-+6H2O= 4Al(OH)3↓48.铝离子与氢氧根(1:3)反应:Al3++3OH-=Al(OH)3↓49.铝离子与氢氧根(1:4)反应:Al3++4OH-=AlO2-+2H2O50.铝离子与水反应:Al3++ H2O= Al(OH)3↓(胶体)+3H+51.偏铝酸根与酸(1:1)反应:AlO2-+H++H2O= Al(OH)3↓52.偏铝酸根与酸(1:4)反应:AlO2-+4H+= Al3++2H2O53.氧化铝与盐酸溶液反应:Al2O3+6HCl=2AlCl3+3H2O (Al2O3+6H+=2Al3++3H2O)54.氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3+2OH-=2AlO2-+H2O)55.氢氧化铝与酸反应:Al(OH)3+3H+=Al3++3H2O56.氢氧化铝与碱反应:Al(OH)3+OH-=AlO2-+2H2O57.氢氧化铝的制备方法1:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4[Al23++3NH3·H2O=Al(OH)3↓+3NH4+]58.氢氧化铝的制备方法2:AlO2-+CO2+2H2O= Al(OH)3↓+ HCO3-2AlO2-+CO2+3H2O= 2Al(OH)3↓+ CO32-59.氢氧化铝受热分解:2Al(OH)3≜Al2O3+3H2O三、镁及其化合物(11)60.镁与氧气反应:2Mg+O2点燃→2MgO61.镁与二氧化碳反应:2Mg+CO2点燃→2MgO+C62.镁与氮气反应:3Mg+N2点燃→Mg3N263.二氮化三镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑64.镁与水反应:Mg+2H2O≜Mg(OH)2+H2↑65.镁与酸反应:Mg+2H+=Mg2++H2↑66.氧化镁与酸反应:MgO+2H+=Mg2++H2O67.镁离子与碱反应(氢氧化镁的制备):Mg2++2OH-=Mg(OH)2↓68.镁离子与氨水反应(氢氧化镁的制备):Mg2++2 NH3·H2O=Mg(OH)2↓+ 2NH4+69.氢氧化镁与酸反应:Mg(OH)2+2H+=Mg2++2H2O70.氢氧化镁受热分解:Mg(OH)2≜MgO+H2O四、铁及其化合物(24)71.铁与氧气反应:3Fe+2O2点燃→Fe3O472.铁与氯气反应:2Fe+3Cl2点燃→FeCl3(棕色烟)73.铁与硫反应:Fe+S≜FeS74.铁与酸反应:Fe+2H+=Fe2++H2↑75.铁与稀硝酸反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O76.铁与硝酸铁反应:Fe+ Fe(NO3)3=3Fe(NO3)277.过量铁与稀硝酸反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O注:序号为75、76是二次反应,77为这个二次反应的总方。
高中化学必修一方程式(学生版)

高中常见化学方程式一、钠及其化合物有关的化学方程式序号反应条件化学反应方程式或离子方程式1 钠在常温下被空气氧化2 钠在加热时被空气氧化3 氧化钠与氧气加热生成过氧化钠4 钠与硫混合研磨生成Na2S5 钠在氯气中燃烧6 钠与氢气加热生成NaH7 钠与水的反应钠与盐酸的反应8钠投入硫酸氢钠溶液9 钠与硫酸铜的反应钠与氯化铁的反应10钠与氯化亚铁的反应11 工业制备金属钠12 氧化钠与水的反应13 氧化钠与二氧化碳的反应14 氧化钠与盐酸的反应15 过氧化钠与水的反应16 过氧化钠与二氧化碳的反应17 过氧化钠与盐酸的反应18 过氧化钠与二氧化硫的反应19 向碳酸钠溶液中逐滴加入盐酸20 向盐酸中逐滴加入碳酸钠溶液21 向饱和碳酸钠溶液中通入二氧化碳22 碳酸氢钠受热分解23 碳酸氢钠与盐酸反应24 碳酸氢钠与氢氧化钠反应25 少量的碳酸氢钠与澄清石灰水反应26 过量的碳酸氢钠与澄清石灰水反应27 侯氏制碱法的反应原理28 少量二氧化碳通入氢氧化钠溶液29 过量二氧化碳通入氢氧化钠溶液30 电解氯化钠溶液31 钛,钾的制备32 钠在二氧化碳中燃烧33 ★除杂★①除去碳酸氢钠溶液中混有的碳酸钠:②除去碳酸钠溶液中的碳酸氢钠:③除去碳酸钠固体中的碳酸氢钠:34 ★鉴别★①鉴别碳酸钠和碳酸氢钠溶液:不可以用氢氧化钙的原因:▲碳酸钠与氢氧化钙:●少量碳酸氢钠溶液滴入氢氧化钙溶液中:●少量氢氧化钙溶液滴入碳酸氢钠溶液中:②溶解度:③碳酸钠溶于水,碳酸氢钠溶于水④和盐酸反应的速率35 【补充】证明碳酸钠溶液中存在水解平衡的实验方法取少许碳酸钠溶液置于试管中,滴加几滴酚酞,溶液呈红色,再向红色溶液中滴加BaCl2溶液至过量,产生白色沉淀,溶液的红色逐渐消失,则证明碳酸钠溶液的碱性为碳酸根水解所致,即溶液中存在水解平衡。
▲钠及其重要化合物的应用物质日常应用原因分析钠核反应堆的传热介质二、镁、铝及其化合物有关的化学方程式序号反应条件化学反应方程式或离子方程式1 镁在氧气中燃烧2 镁在氮气中燃烧3 镁在二氧化碳中燃烧4 镁在氯气中燃烧5 镁与硫粉共热6 镁与盐酸反应7 镁与水反应8 工业制备镁9 铝与氧气反应10 泡沫灭火器的原理11 铝与硫粉共热12 铝与稀硫酸反应13 铝与氢氧化钠反应14 氢氧化铝的制备铝热反应----铝粉与某些金属氧化物(Fe2O3、V2O5、Cr2O3、MnO2等)在较高温度下发生剧烈反应并放出大量的热。
高中化学必修一非金属方程式

高中化学必修一非金属方程式TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-一、硅及其化合物(写出化学方程式,是离子反应的写离子方程式)1.硅与氢氟酸的反应 4HF+Si=SiF4↑+2H2↑2.硅与氢氧化钠溶液反应 Si+2NaOH+H2O =Na2SiO3+2H2↑(2OH-+ Si+H2O =SiO32–+2H2↑)3.硅与氟气反应 2F2+Si=SiF44.硅与氧气在加热条件下反应 O2+Si SiO25.二氧化硅与氢氟酸反应 4HF+SiO2=SiF4↑+2H2O6.二氧化硅与氢氧化钠溶液反应 SiO2+2NaOH=Na2SiO3+H2O (2OH-+SiO2=SiO32–+H2O)7.二氧化硅与氧化钙反应 SiO2+CaO=====高温CaSiO38.工业制备纯硅的过程2C+SiO2=====高温Si(粗)+2CO Si(粗)+2Cl2=====高温SiCl4SiCl4+2H2=====高温Si(纯)+4HCl9.碳酸钙与二氧化硅在高温下反应 CaCO3+SiO2=====高温CaSiO3+CO2↑10.碳酸钠与二氧化硅在高温下反应 Na2CO3+SiO2=====高温Na2SiO3+CO2↑11.硅酸钠溶液中通入少量的二氧化碳气体 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(SiO32-+CO2+H2O=H2SiO3↓+CO32-)12.硅酸钠溶液中通入过量的二氧化碳气体 Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3(SiO32-+2CO2+2H2O= H2SiO3↓+HCO3-)13.硅酸受热分解 H2SiO3SiO2+H2O二、卤素及其化合物(写出化学方程式,是离子反应的写离子方程式)1.碘单质与铁粉反应 I2+Fe FeI22.氯气与铜反应 Cl2+Cu CuCl23.氯气与钠反应 Cl2+Na NaCl4. 将Cl2通入NaBr溶液中方程式Cl2+2NaBr=2NaCl+Br2(Cl2+2Br-=2Cl-+Br2),再加入苯,其现象为溶液分层有机层变为橙红色5.将Cl2通入淀粉-KI溶液中方程式 Cl2+2KI=2KCl+I2(Cl2+2I-=2Cl-+I2),现象为淀粉溶液变蓝6.氯气与水反应 Cl2+H2O HCl+HClO (Cl2+H2O H++Cl–+HClO)7.氯气与氢氧化钠溶液反应 Cl2+2NaOH=NaCl+NaClO+H2O ( Cl2+2OH–=Cl–+ClO–+H2O)8.次氯酸见光分解 2HClO2HCl+O2↑ (2HClO2H++2Cl-+O2↑)9.向漂白粉溶液中通入少量CO2气体: Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓ (Ca2++2ClO-+CO2+H2O=2 HClO + CaCO3↓ )10.将氯水与硝酸银溶液混合的离子方程式 Cl-+Ag+=AgCl↓二、卤素及其化合物(写出化学方程式,是离子反应的写离子方程式)1. 红磷在氯气中燃烧 3Cl2+2P2PCl3Cl2+PCl3PCl52.氢气在氯气中燃烧 Cl2+H22HCl3.氯气与铁粉反应 3Cl2+2Fe2FeCl34.向碘化钾溶液中加入溴水 Br2+2KI =2KBr+I2(Br2+2I- =2Br-+I2)5.氟气通入水中2F2+2H2O =4HF+O26. 将氯气通入石灰乳(工业制漂白粉) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2Cl2+2 Ca(OH)2=2 Ca2++2Cl–+2ClO–+2H2O)7.漂白粉露置空气中失效 Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓ 2HClO2HCl+O2↑8.向漂白粉溶液中通入过量CO2气体: Ca(ClO)2+2CO2+2H2O= 2HClO +Ca(HCO3)2(ClO-+CO2+H2O= HClO + HCO3- )9.将氯水与氯化亚铁溶液混合的离子方程式 Cl2+2Fe2+=2Fe3+2Cl-10. 实验室制备Cl2 4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O(4H++2Cl–+MnO2Mn2++Cl2↑+2H2O)三、硫及其化合物(写出化学方程式,是离子反应的写离子方程式)1.硫单质与氢气加热 S+H2H2S2.硫粉与铁粉混合加热 S+Fe FeS3.硫粉与铜粉混合加热 S+2Cu Cu2S4.硫单质在纯氧中点燃 S+O2SO25. S与热NaOH溶液的反应 3S+6NaOH2Na2S+Na2SO3+3H2O(3S+6OH-2S2-+SO32-+3H2O)6.二氧化硫气体通入水中 SO2+H2O H2SO37.三氧化硫溶于水 SO3+H2O=H2SO4(SO3+H2O=2H++SO42–)8.亚硫酸受热分解 H2SO3H2O+SO2↑9.碳酸钠溶液中通入过量的二氧化硫气体 Na2CO3+H2O+2SO2(足)=2NaHSO3+CO2(CO32-+H2O+2SO2=2HSO3-+CO2)10.碳酸钠溶液中通入少量的二氧化硫气体 2Na2CO3(足)+H2O+SO2=Na2SO3+2NaHCO3(2CO32-+H2O+SO2=SO32-+2HCO3-)11.二氧化硫与饱和碳酸氢钠溶液 2NaHCO3+SO2(少) = Na2SO3+ CO2+ H2O 2 HCO3-+SO2(少) = SO32-+ CO2+ H2O NaHCO3+SO2(过)= NaHSO3+CO2HCO3-+SO2(少) = HSO3-+CO212.少量二氧化硫通入氢氧化钠溶液 SO2 + 2NaOH= Na2SO3+ H2O SO2+ 2OH-= SO32- + H2O13.过量二氧化硫通入氢氧化钠溶液 SO 2 + NaOH= NaHSO 3 CO 2 + OH -= HSO 3- 三、硫及其化合物(写出化学方程式,是离子反应的写离子方程式) 1.二氧化硫催化氧化 2SO 2+O 2催化剂 加热2SO 32.二氧化硫与硫化氢混合 SO 2+2H 2S=3S↓+2H 2O3.二氧化硫与氧化钙在高温下反应 SO 2+ CaO CaSO 34.三氧化硫与氧化钙在高温下反应 SO 3+ CaOCaSO 45.二氧化硫气体通入澄清石灰水先变浑浊后变澄清 SO 2+Ca(OH)2=CaSO 3↓+H 2O CaSO 3+ SO 2 +H 2O=Ca(HSO 3)2 (SO 2+Ca 2++2OH -=CaSO 3↓+H 2O CaSO 3+ SO 2 +H 2O=Ca 2++2HSO 3-通入Br 2水中: Br 2+SO 2+2H 2O =2HBr+H 2SO 4 (Br 2+SO 2+2H 2O =4H ++2Br -+SO 42- ) 通入KMnO 4溶液中: 5SO 2+2KMnO 4+2H 2O=K 2SO 4+2MnSO 4+2H 2SO 4 (5SO 2+2MnO 4-+2H 2O=5SO 42-+2Mn 2++4H +)通入FeCl 3溶液中: SO 2+2FeCl 3+2H 2O=FeCl 2+FeSO 4+4HCl(SO 2+2Fe 3++2H 2O=2Fe 2++SO 42-+4H +)9.将H 2S 气体通入亚硫酸中: 2H 2S+H 2SO 3=3S↓+3H 2O 10. 将H 2SO 4、Na 2SO 3、Na 2S 三种溶液混合: 3H 2SO 4 +Na 2SO 3+2Na 2S=3Na 2SO 4+3S↓+3H 2O(6H + +SO 32-+2S 2-=3S↓+3H 2O ) 11.将少量NaHSO 4滴到Ba(OH)2溶液中: NaHSO 4+Ba(OH)2= BaSO 4↓+NaOH+ H 2O(H ++SO 42-+Ba 2++OH -= BaSO 4↓+ H 2O ) 12.将Ba(OH)2滴加到NaHSO 4溶液中至中性: 2NaHSO 4+Ba(OH)2= BaSO 4↓+2H 2O (2H ++SO 42-+Ba 2++2OH -= BaSO 4↓+2H 2O ) 四、氮及其化合物(写出化学方程式,是离子反应的写离子方程式) 1.工业合成氨反应 N 2+3H 2催化剂 高温高压2NH 32.氮气与氧气反应生成一氧化氮 N2+O22NO与O2的反应 2NO+O2=2NO2与H2O的反应 3NO2+H2O=2HNO3+NO5.二氧化氮与氧气混合气体通入水中生成硝酸 4NO2+O2+2H2O=4HNO36.一氧化氮与氧气混合气体通入水中生成硝酸 4NO+3O2+2H2O=4HNO37.二氧化氮与氢氧化钠溶液反应生亚硝酸盐和硝酸盐2NO2+2NaOH=NaNO2+NaNO3+H2O(2NO2+2OH-=NO2-+NO3-+H2O )8.氨气溶于水 NH3+H2O NH3·H2O9.氨的催化氧化 4NH3+5O2催化剂△4NO+6H2O10.氨气与氯化氢气体反应 NH3+HCl =NH4Cl11.实验室制氨气 Ca(OH)2+2NH4Cl2CaCl2+2NH3↑+2H2O12.浓氢氧化钠溶液与氯化铵溶液不加热反应 NaOH+NH4Cl=NaCl+NH3H2O(+4NH+OH-= NH3H2O)13.氨气与稀硝酸反应 NH3+HNO3=NH4NO3(NH3+H+=NH4+)14.氯化铵受热分解 NH4Cl NH3↑+HCl↑15.氢氧化钠溶液与硝酸铵溶液加热反应 NaOH+NH4NO3NaNO3+NH3↑+H2O(+4NH+OH- NH3↑+H2O)五、硝酸硫酸(写出化学方程式,是离子反应的写离子方程式)和浓H2SO4加热条件下的反应 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O2.碳和浓H2SO4加热条件下反应 2H2SO4(浓)+C CO2↑+2SO2↑+2H2O3.铁和浓H2SO4加热条件下反应 6H2SO4(浓)+2Fe Fe2(SO4)3+3SO2↑+6H2O4.足量的浓硝酸与铁加热条件下反应 6HNO3(浓)+Fe Fe(NO3)3+3NO2↑+3H2O(6H++3NO3-+Fe Fe3++3NO2↑+3H2O)5.足量的稀硝酸与铁反应4HNO3(稀)+ Fe=Fe(NO3)3+NO↑+ 2H2O (4H++NO3-+Fe=Fe3++NO↑+2H2O)6.足量的铁与浓硝酸加热条件下反应 4HNO3(浓)+Fe=Fe(NO3)2+2NO2↑+2H2O(4H++2NO3-+Fe=Fe2++2NO2+2H2O)7.足量的铁与稀硝酸反应 8HNO3(稀)+3Fe=3Fe(NO3)2+2NO↑+4H2O(8H++2NO3-+3Fe=3Fe2++2NO↑+4H2O)8.实验室用铜和稀硝酸制取一氧化氮 8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O(8H++2NO3-+3Cu=3Cu2++2NO↑+4H2O)9.实验室用铜和浓硝酸制取二氧化氮 4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O(4H++2NO3-+Cu=Cu2++2NO2↑+2H2O)10.铁红与稀硝酸反应 Fe2O3+6 HNO3=2Fe(NO3)3+3H2O (Fe2O3+6 H+=2Fe3++3H2O)11.氧化亚铁与稀硝酸反应 3FeO+10 HNO3=3Fe(NO3)3+NO↑+5H2O(3FeO+10H++ NO3-=3Fe3++NO↑+5H2O)12.磁性氧化铁与稀硝酸反应 3Fe3O4+28 HNO3=9Fe(NO3)3+NO↑+14H2O(3Fe3O4+28H++ NO3-=9Fe3++NO↑+14H2O)13.碳与浓硝酸反应 4HNO3(浓)+C CO2↑+4NO2↑+2H2O14.硝酸见光分解 4HNO34NO2↑+O2↑+2H2O。
化学必修一化学方程式归纳

化学必修一化学方程式归纳
化学必修一涉及的化学方程式主要包括氧化还原反应和非氧化还原反应。
以下是一些常见的化学方程式:
氧化还原反应:
1. 钠与氧气反应:4Na + O2 = 2Na2O
2. 钠与水反应:2Na + 2H2O = 2NaOH + H2↑
3. 钠与硫酸反应:2Na + H2SO4 = Na2SO4 + H2↑
4. 氧化铁与一氧化碳反应:Fe2O3 + 3CO = 2Fe + 3CO2
5. 氧化铝与氢氧化钠反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O
6. 铜与硝酸银反应:Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
7. 铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑
非氧化还原反应:
1. 二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 = CaCO3↓ + H2O
2. 二氧化硫与氧气反应:2SO2 + O2 = 2SO3
3. 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO
4. 甲烷燃烧:CH4 + 2O2 = CO2 + 2H2O
5. 氯气与水反应:Cl2 + H2O = HCl + HClO
6. 氨气与氯化氢反应:NH3 + HCl = NH4Cl
7. 硫化氢与氧气反应:2H2S + O2 = 2S↓ + 2H2O
以上仅是部分化学方程式,更多内容建议查阅化学教材或相关教辅,以获取全面的信息。
人教版高中化学必修一、二化学方程式汇总

〔人教版〕高中化学必修一、二化学方程式汇总必修一1、硫酸根离子的检验: BaCl2 + Na2SO4==== BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl3、碳酸钠与盐酸反响: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑4、木炭复原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反响: Fe + CuSO4 ===== FeSO4 + Cu6、氯化钙与碳酸钠溶液反响:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 Na2O2钠与氧气反响:4Na + O2 ==== 2Na2O8、过氧化钠与水反响:2Na2O2 + 2H2O ==== 4NaOH + O2↑9、过氧化钠与二氧化碳反响:2Na2O2 + 2CO2 ==== 2Na2CO3 + O210、钠与水反响:2Na + 2H2O ==== 2NaOH + H2↑11、铁与水蒸气反响:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑12、铝与氢氧化钠溶液反响:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑13、氧化钙与水反响:CaO + H2O ==== Ca(OH)214、氧化铁与盐酸反响:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O15、氧化铝与盐酸反响:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反响:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反响:FeCl3 + 3NaOH ===== Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反响:FeSO4 + 2NaOH ==== Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 ==== 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O ==== 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反响:Al(OH)3 + 3HCl ==== AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反响:Al(OH)3 + NaOH ==== NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 Al2O3 + 3H2O25、三氯化铁溶液与铁粉反响:2FeCl3 + Fe ==== 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 ===== 2FeCl327、二氧化硅与氢氟酸反响:SiO2 + 4HF ==== SiF4 + 2H2O硅单质与氢氟酸反响:Si + 4HF ==== SiF4 + 2H2↑28、二氧化硅与氧化钙高温反响:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反响:SiO2 + 2NaOH ==== Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反响:Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓32、氯气与金属铁反响:2Fe + 3Cl2点燃2FeCl333、氯气与金属铜反响:Cu + Cl2点燃CuCl234、氯气与金属钠反响:2Na + Cl2点燃2NaCl35、氯气与水反响:Cl2 + H2O ==== HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反响:Cl2 + 2NaOH ===== NaCl + NaClO + H2O38、氯气与消石灰反响:2Cl2 + 2Ca(OH)2 ==== CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反响:HCl + AgNO3 ==== AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 ==== CaCO3↓ + 2HClO41、二氧化硫与水反响:SO2 + H2O === H2SO342、氮气与氧气在放电下反响:N2 + O2放电2NO43、一氧化氮与氧气反响:2NO + O2 ==== 2NO244、二氧化氮与水反响:3NO2 + H2O ==== 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反响:2SO2 + O2催化剂2SO346、三氧化硫与水反响:SO3 + H2O ==== H2SO447、浓硫酸与铜反响:Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反响:C + 2H2SO4(浓) CO2↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反响:Cu + 4HNO3(浓) ==== Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反响:3Cu + 8HNO3(稀) 3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O NH3↑ + H2O52、氨气与氯化氢反响:NH3 + HCl ==== NH4Cl53、氯化铵受热分解:NH4Cl NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反响:NH4NO3 + NaOH NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反响:Cl2 + H2点燃2HCl58、硫酸铵与氢氧化钠反响:〔NH4〕2SO4 + 2NaOH 2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO ==== CaSO360、SO2 + 2NaOH ==== Na2SO3 + H2O61、SO2 + Ca(OH)2 ==== CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O ==== 2HCl + H2SO463、SO2 + 2H2S ==== 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH ==== 2NaNO2 + H2O65、Si + 2F2 === SiF466、Si + 2NaOH + H2O ==== Na2SiO3 +2H2↑67、硅单质的实验室制法粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO〔石英沙〕〔焦碳〕〔粗硅〕粗硅转变为纯硅:Si〔粗〕 + 2Cl2 SiCl4SiCl4 + 2H2高温Si〔纯〕+ 4HCl必修二第一章物质构造元素周期律1、Li与O2反响〔点燃〕:4Li + O2 2Li2 ONa与O2反响〔点燃〕:2Na+O2Na2O2Na与H2O反响:2Na+2H2O===2NaOH+H2↑K与H2O反响:2K+2H2O===2KOH+H2↑2、卤素单质F2、Cl2、Br2、I2与氢气反响:F2 + H2 === 2HF Cl2 + H2=== 2HCl Br2 + H2=== 2Br I2 + H2=== 2HI 3、卤素单质间的置换反响:〔1〕氯水与饱和溴化钠、氯水与饱和碘化钠溶液反响:①Cl2+2NaBr===Br2+2NaCl ②Cl2+2NaI===I2+2NaCl〔2〕溴水与碘化钠溶液反响:Br2+2NaI===I2+2NaBr4、Mg与H2O反响:Mg+2H2O === Mg(OH)2+H2↑Al与HCl反响: 2Al+6HCl===2AlCl3+3H2↑Mg 与HCl 反响: Mg+2 HCl === MgCl 2+ H 2↑5、Na 与Cl 2反响〔点燃〕:6、用电子式表示氯化氢的形成过程:第二章化学反响与能量1、Ba(OH)2•8H 2O 与NH 4Cl 的反响 : Ba(OH)2·8H 2O+2NH 4Cl==BaCl 2+2NH 3↑+10H 2O2、原电池原理典型的原电池〔Zn-Cu 原电池〕负极〔锌〕:Zn-2e -===Zn 2+〔氧化反响〕正极〔铜〕:2H ++2e -===H 2↑〔复原反响〕电子流动方向:由锌经过外电路流向铜。
高中化学反应方程式

点燃点燃化学方程式一、金属:1.钠及其化合物:(必修一)(1)钠与氧气:4Na+O2==2Na2O;2Na2O+O2==2Na2O2(2)钠与水:2Na+2H2O==2NaOH+H2↑(3)钠与非金属单质:2Na+Cl2==2NaCl2Na+S==Na2S(4)钠与酸:2Na+H2SO4==Na2SO4+H2↑(5)氧化钠与酸(氧化钙与酸):Na2O+2HCl==2NaCl+H2OCaO+2HCl==CaCl2+H2O(6)氧化钠与水(氧化钙与水):Na2O+H2O==2NaOHCaO+H2O==Ca(OH)2(7)氧化钠与二氧化碳(氧化钙与二氧化碳): Na2O+CO2==Na2CO3CaO+CO2==CaCO3(8)过氧化钠与水:2Na2O2+2H2O==4NaOH+O2↑(9)过氧化钠与二氧化碳:2Na2O2+2CO2==2Na2CO3+O2↑(10)氢氧化钠与二氧化碳(二氧化碳不足)(氢氧化钙与二氧化碳): 2NaOH+CO2==Na2CO3+H2OCa(OH)2+CO2==CaCO3↓+H2O(11)氢氧化钠与二氧化碳(二氧化碳过量)(氢氧化钙与二氧化碳): NaOH+CO2==NaHCO3Ca(OH)2+CO2==Ca(HCO3)2(12)氢氧化钠与二氧化碳(二氧化碳与过氧化钠之比介于1/2和1之间): 2NaOH+CO2==Na2CO3+H2O;NaOH+CO2==NaHCO3(13)纯碱(苏打)与酸(写出离子方程式):Na2CO3+2HCl==2NaCl+CO2↑+H2OCO32-+2H+==CO2↑+H2O(14)小苏打与酸(写出离子方程式):NaHCO3+HCl==NaCl+CO2↑+H2OHCO3-+H+==CO2↑+H2O(15)小苏打与碱(写出离子方程式):NaHCO3+NaOH==Na2CO3+H2OHCO3-+OH-==CO32-+H2O加热点燃 点燃(16) 纯碱(苏打)转化为小苏打:Na 2CO 3+CO 2+H 2O==2NaHCO 3(17) 向纯碱中滴加酸(写出现象、化学方程式与离子反应方程式): 现象:开始没有气泡产生,一段时间后气泡产生Na 2CO 3+2HCl==2NaHCO 3CO 32-+2H +==2HCO 3-(18) 向酸中滴加纯碱(写出现象、化学方程式与离子反应方程式): 现象:一开始就有气泡放出Na 2CO 3+2HCl==2NaCl+CO 2↑+H 20CO 32-+2H +==CO 2↑+H 2O(19) 侯德榜制碱法原理:(选修)NaCl+NH 3+CO 2+H 2O==NaHCO 3+NH 4Cl2NaHCO 3==Na 2CO 3+CO 2↑+H 2O2. 镁及其化合物:(选修)(1) 镁与水:Mg+H 2O==Mg(OH)2+H 2↑(2) 镁与氧气:2Mg+O 2==2MgO (3) 镁与二氧化碳:Mg+CO 2==MgCO 3(4) 镁与酸:Mg+H 2SO 4==MgSO 4+H 2↑∆点燃 ∆ 电解 (5) 氧化镁与水(缓慢):MgO+H 2O==Mg(OH)2(6) 氧化镁与酸:MgO+H 2SO 4==MgSO 4+H 2O(7) 氢氧化镁加热分解:Mg(OH)2==MgO+H 2O3. 铝及其化合物:(必修一)(1) 铝在氧气中燃烧:Al+O 2==Al 2O 3(2) 铝与酸:2Al+6HCl==2AlCl 3+3H 2↑(3) 铝与碱:Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑(4) 铝热反应:(选修重点)2Al+Fe 2O 3==2Al 2O 3+2Fe(5) 氧化铝(三氧化二铝 两性氧化物)与酸: Al 2O 3+6H +==2Al 3++3H 2O(6) 氧化铝与碱:Al 2O 3+2NaOH==2NaAlO 2+3H 2↑(7) 氧化铝电解:(选修)Al 2O 3==4Al+3O 2↑∆ ∆ (8) “铝三角”之间的转化:(重点)(9) 制取Al(OH)3:(重点)① 氨气:Al 3++3NH 3H 2O==Al(OH)3↓+3NH 4+② 二氧化碳:AlO 2-+CO 2+H 2O==Al(OH)3↓+HCO 3-(10) 铝离子与偏铝酸根:Al 3++3AlO 2-+6H 2O==4Al(OH)3↓(11) 氢氧化铝受热分解:2Al(OH)3==Al 2O 3+3H 2O4. 铁及其化合物:(必修一)(1) 铁与水:3Fe+4H 2O(g)==Fe 3O 4+4H 2↑ Al(OH)3+ Al 3+ AlO 2- Al(OH)3→Al 3+Al(OH)3 + 3H + == Al 3+ + 3H 2OAl 3+→AlO 2-Al 3+ +4OH - ==AlO 2- + 2H 2OAlO 2-→Al(OH)3AlO 2- + H + +H 2O == Al(OH)3↓Al(OH)3→AlO 2-Al(OH)3 + OH - ==AlO 2- + 2H 2OAlO 2-→Al 3+AlO 2- + 4H + == Al 3+ + 3H 2OAl 3+→Al(OH)3Al 3+ + 3OH - == Al(OH)3↓∆ 点燃 点燃 (2) 铁与硫:(选修)Fe+S==FeS(3) 铁与氯气:2Fe+3Cl 2==2FeCl 3(4) 铁与氧气:3Fe+2O 2==Fe 3O 4(磁性氧化铁)(5) 铁与酸:Fe+2H +==Fe 2++H 2↑(6) “铁三角”之间的转化:(重点)(7) 氯化亚铁滴入氢氧化钠溶液中:FeCl 2+2NaOH==Fe(OH)2↓+2NaCl4Fe(OH)2+O 2+2H 2O==4Fe(OH)3↓FeFe+2 Fe+3Fe→Fe+2 Fe+ 2H + == Fe 2+ + H 2↑ Fe+2→Fe+3 2Fe 2+ + Cl 2 == 2Fe 3+ + 2Cl - Fe+3→Fe Fe 2O 3 + 3CO == 2Fe + 3CO 2 Fe→Fe+3 2Fe + 3Cl 2 == 2FeCl 3 Fe+3→Fe+2 2Fe 3+ + Fe == 3Fe 2+ Fe+2→Fe FeO + H 2 == Fe + H 2O高温高温∆点燃点燃点燃(8) 铁与稀硝酸(稀硝酸过量):(选修) Fe+4HNO 3==Fe(NO 3)3+2NO 2↑+2H 2O(9) 铁与稀硝酸(稀硝酸不足):(选修) 3Fe+8HNO 3==3Fe(NO 3)2+2NO ↑+4H 2O(10) 三价铁离子的检验:Fe3+3SCN -==Fe(SCN)3(血红色)(11) 氧化铁(与磁性氧化铁区分)与一氧化碳:(选修) Fe 2O 3 + 3CO == 2Fe + 3CO 2(12) 氧化亚铁与氢气:(选修)FeO + H 2 == Fe + H 2O(13) 氢氧化铁受热分解:2Fe(OH)3==Fe 2O 3+3H 2O5. 铜及其化合物:(1) 铜与氧气:2Cu+O 2==2CuO(2) 铜与硫:(选修)Cu+S==Cu 2S(3) 铜与氯气:Cu+Cl 2==CuCl 2(4) 铜与浓硫酸:Cu+2H 2SO 4==CuSO 4+SO 2↑+2H 2O∆∆ (5) 铜与浓硝酸:Cu+4HNO 3==Cu(NO 3)2+2NO 2↑+2H 2O(6) 铜与稀硝酸:3Cu+8HNO 3==3Cu(NO 3)2+2NO ↑+2H 2O(7) 铜绿(碱式碳酸铜)生成:(选修)2Cu+O 2+CO 2+H 2O==Cu 2(OH)2CO 3(8) 氢氧化铜分解:Cu(OH)2==CuO+H 2O(9) 无水硫酸铜干燥变色:(选修)CuSO 4(白色)+5H 2O==CuSO 45H 2O (蓝色)(10) 硫酸铜与强碱(离子方程式):Cu 2++2OH -==Cu(OH)2↓(11) 氧化铜受热分解:(选修)2CuO==Cu 2O+O 2↑点燃点燃 高温 高温 高温 高温 ∆ 二、非金属:1. 碳及其化合物(二氧化碳是分子晶体):(初中)(1) 碳的燃烧:① 不充分燃烧:2C+O 2==2CO② 充分燃烧:C+O 2==CO 2(2) 碳与氧化钙:(选修)3C+CaO==CaC 2+CO ↑(3) 碳与氧化铜:C+CuO==Cu+CO ↑C+2CuO==2Cu+CO 2↑(4) 碳与水蒸气:C+H 2O(g)==CO+H 2(5) 碳酸氢钙与氢氧化钠(氢氧化钠足量):(选修) Ca(HCO 3)2+2NaOH==CaCO 3↓+Na 2CO 3+2H 2O(6) 碳酸氢钙与氢氧化钠(氢氧化钠不足):(选修) Ca(HCO)2+NaOH==CaCO 3↓+NaHCO 3+H 2O2. 硅及其化合物(二氧化硅是原子晶体):(必修一)(1) 硅与氧气:Si+O 2==SiO 2(2) 硅与氟:Si+2F 2==SiF 4高温 高温 高温 高温 高温 点燃 点燃 (3) 硅与氟化氢(反常反应:唯一能反应的酸): Si+4HF==SiF 4↑+2H 2↑(4) 硅与氯气:Si+2Cl 2==SiCl 4(5) 二氧化硅与氧化钙:SiO 2+CaO==CaSiO 3(6) 二氧化硅与碳(反常反应):SiO 2+C==CO ↑+Si(7) 二氧化硅与氢氧化钠:SiO 2+2NaOH==Na 2SiO 3+H 2O(8) 四氯化硅与氢气:SiCl 4+H 2==Si+4HCl(9) 实验室制硅酸:Na 2SiO 3+CO 2+H 2O==Na 2CO 3+H 2SiO 3(胶体)(10) 二氧化硅与碳酸钠(反常反应): SiO 2+Na 2CO 3==Na 2SiO 3+CO 2↑3. 氯及其化合物:(必修一)(1) 钠与氯气:2Na+Cl 2==2NaCl (白烟)(2) 铜与氯气:Cu+Cl 2==CuCl 2(棕黄色烟)点燃点燃 光照或∆ ∆ 电解 电解 (3) 铁与氯气:2Fe+3Cl 2==2FeCl 3(棕褐色烟)(4) 氢气与氯气:H 2+Cl 2==2HCl(5) 磷与氯气(氯气不足):(选修)2P+3Cl 2==2PCl 3(6) 磷与氯气(氯气足量):(选修)2P+5Cl 2==2PCl 5(7) 氯气与强碱(制漂白剂):Cl 2+2NaOH==NaClO+NaCl+H 2O(8) 氯气与水(区分氯水与液氯):Cl 2+H 2O==HCl+HClO(9) 次氯酸分解:2HClO==2HCl ↑+O 2↑(10) 实验室制氯气:MnO 2+4HCl (浓)==MnCl 2+Cl 2↑+2H 2O(11) 氯化钠电解:(选修)2NaCl(aq )+2H 2O==2NaOH+H 2↑+Cl 2↑2NaCl(熔融)==2Na+Cl 2↑(12) 氯化氢与氨气:HCl+NH 3==NH 4Cl放热MnO 2 ∆ (13) 硝酸银与盐酸(氯离子的检验):AgNO 3+HCl==AgCl ↓+HNO 3(14) 氯气与亚硫酸根和水:Cl 2+SO 32-+H 2O==2H ++2Cl -+SO 42-(15) 氯气与二氧化硫和水Cl 2+SO 2+2H 2O==4H ++2Cl -+SO 42-(16) 卤素间的置换(写出离子方程式):(选修)2Br -+Cl 2==2Cl -+Br 22I -+Cl 2==2Cl -+I 22I -+Br 2==2Br -+I 2(17) 铁离子与碘离子:(选修)2Fe 3++2I -==2Fe 2++I 24. 氧、硫及其化合物:(必修一)(1) 氧气转化为臭氧:(选修)3O 2==2O 3(2) 过氧化氢分解:(选修)2H 2O 2==2H 2O+O 2↑(3) 实验室制氧气:(选修)2KClO 3==2KCl+3O 2↑(4) 双氧水与高锰酸:(选修)5H 2O 2+2MnO 4-+6H +==2Mn 2++5O 2↑+8H 2O点燃点燃 ∆ ∆ ∆ 高温、高压 催化剂 (5) 双氧水与亚铁离子在酸性条件下反应:(选修)H 2O 2+2Fe 2++2H +==2Fe 3++2H 2O(6) 硫的燃烧:S+O 2==SO 2(7) 硫与氢气:(选修)S+H 2==H 2S(8) 硫与铝:(选修)3S+2Al==Al 2S 3(9) 硫与铜:(选修)S+2Cu==Cu 2S (黑)(10) 硫与铁:(选修)S+Fe==FeS (黑)(11) 硫化氢与氢氧化钠:(选修)H 2S+2NaOH==Na 2S+2H 2O(12) 硫化钠与硫酸亚铁:(选修)Na 2S+FeSO 4==Na 2SO 4+FeS(13) 硫化亚铁与氢离子:(选修)FeS+2H +==Fe+H 2S ↑(14) 二氧化硫与水:SO 2+H 2O==H 2SO 3(15) 二氧化硫转化为三氧化硫:2SO 2+O 2 2SO 3点燃放点 (16) 二氧化硫与氢氧化钠:SO 2+2NaOH==Na 2SO 3+H 2O(17) 二氧化硫与硫化氢:SO 2+H 2S==S ↓+H 2O(18) 三氧化硫与水:SO 3+H 2O==H 2SO 4(19) 三氧化硫与氢氧化钠:SO 3+2NaOH==Na 2SO 4(20) 亚硫酸钠与氧气:2Na 2SO 3+O 2==2Na 2SO 4(21) 浓硫酸与碳:C+2H 2SO 4(浓)==CO 2↑+2SO 2↑+2H 2O(22) 亚硫酸根与硝酸反应:(选修)3SO 32-+2H ++2NO 3-==3SO 42-+2NO ↑+H 2O(23) 铜与浓硫酸:Cu+2H 2SO 4(浓)==CuSO 4+2SO 2↑+2H 2O5. 氮及其化合物:(1) 镁在氮气中燃烧:(选修)3Mg+N 2==Mg 3N 2(白色固体)(2) 氮的燃烧:N 2+O 2==2NO高温、高压催化剂 高温、高压催化剂 光照或∆(3) 工业合成氨:N 2+3H 2 2NH 3 (4) 氮化镁与水反应:(选修)Mg 3N 2+6H 2O==3Mg(OH)2+2NH 3↑(5) 氨被氧气氧化(四五四六反应):4NH 3+5O 2 4NO+6H 2O (6) 一氧化氮在空气中被氧化:2NO+O 2==2NO 2(7) 二氧化氮与水:3NO 2+H 2O==2HNO 3+2NO(8) 一氧化氮、氧气与水:4NO+3O 2+2H 2O==4HNO 3(9) 二氧化氮、氧气与水:4NO 2+O 2+2H 2O==4HNO 3(10) 二氧化氮与四氧化二氮的转化:(选修)2NO 2 N 2O 4(11) 二氧化氮与氢氧化钠:(选修)2NO 2+2NaOH==NaNO 3+NaNO 2+H 20(12) 一氧化氮、二氧化氮与氢氧化钠:(选修)NO 2+NO+2NaOH==2NaNO 2+H 2O(13) 硝酸分解:(选修)4HNO 3==4NO 2↑+O 2↑+2H 2O∆∆ ∆ ∆ (14) 铜与浓稀硝酸:Cu+4HNO 3==Cu(NO 3)2+2NO 2↑+2H 2O3Cu+8HNO 3==3Cu(NO 3)2+2NO ↑+2H 2O(15) 碳与浓硝酸:(选修)C+4HNO 3(浓)==CO 2↑+4NO 2↑+2H 2O(16) 氨气溶于水:NH 3+H 2O NH 3H 2O NH 4++OH -(17) 铵盐分解:NH 4Cl==NH 3↑+HCl ↑NH 4HCO 3==NH 3↑+CO 2↑+H 2O(NH 4)2CO 3==2NH 3↑+CO 2↑+H 2O(18) 实验室制氨气:2NH 4Cl+Ca(OH)2==2NH 3↑+2H 2O+CaCl 2三、离子反应方程式:(必修一)1.CO2与NaOH:(1)少量CO2:CO2+2OH-==CO32-+H2O(2)过量CO2:CO2+OH-==HCO3-特殊:当CO2通入苯酚钠溶液中,无论CO2少量还是过量,均生成碳酸氢钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素及其化合物的化学方程式有※的,还要写离子方程式!一、钠及钠的重要化合物1、常温钠与氧气反应4Na+O2=2Na2O2、加热条件下钠与氧气反应2Na+O2△Na2O23、※钠与水反应2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na++2OH-+H2↑4、※过氧化钠与水反应2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4Na++4OH-+O2↑5、过氧化钠与二氧化碳反应(呼吸面具,供氧剂)2Na2O2+2CO2=2Na2CO3+O2↑6、※氢氧化钠溶液中通少量二氧化碳2NaOH+CO2=Na2CO3+H2O2OH-+CO2=CO32-+H2O7、※氢氧化钠溶液中通过量二氧化碳NaOH+CO2 =NaHCO3 (OH-+CO2 =HCO3-) 可以分成两步写2NaOH+CO2=Na2CO3+H2O(2OH-+CO2=CO32-+H2O) Na2CO3+CO2+H2O=2NaHCO3 (CO32-+CO2+H2O=2 HCO3-) 8、※碳酸钠与盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑9、※碳酸氢钠与盐酸反应NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑10、※碳酸钠溶液不与氢氧化钠溶液反应,碳酸氢钠溶液与氢氧化钠溶液反应NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH-=CO32-+H2O11、※碳酸钠溶液和碳酸氢钠溶液分别都能与氢氧化钙(钡)溶液反应,都有白色沉淀生成沉淀Na2CO3+Ca(OH)2=CaCO3↓+2N aOHCO32-+Ca2+=CaCO3↓NaHCO3(少)+Ca(OH)2=CaCO3↓+NaOH+H2OHCO3-+Ca2++OH-=CaCO3↓+H2O2NaHCO3(过)+Ca(OH)2=CaCO3↓+Na2CO3+2H2O2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O 12、※碳酸钠溶液与氯化钙(钡)溶液反应有白色沉淀生成,碳酸氢钠溶液不与氯化钙(钡)溶液反应Na2CO3+CaCl2=CaCO3↓+2NaClCO32-+Ca2+=CaCO3↓13、※碳酸钠溶液能吸收二氧化碳气体发生反应,碳酸氢钠溶液不能吸收二氧化碳气体Na2CO3+CO2+H2O=2NaHCO3CO32-+ CO2+H2O =2HCO3-14、碳酸钠稳定受热不分解,碳酸氢钠不稳定受热分解2NaHCO3△Na2CO3+CO2↑+H2O二、铝及其重要化合物1、金属铝常温能与氧气反应,表面生成致密氧化膜(加热也可);铝在氯气中燃烧。
4Al+3O2=2Al2O32Al+3Cl2点燃====2AlCl32、※铝能与酸(盐酸、稀硫酸)反应,铝还有特性能与强碱溶液(氢氧化钠溶液)反应2Al+6HCl=2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑2Al+2NaOH+2H2O =2NaAlO2+3H2↑2Al+2OH-+2H2O=2AlO2-+3H2↑13、※氧化铝是两性氧化物,既能与酸(盐酸、稀硫酸)反应,又能与强碱溶液(NaOH溶液)反应Al2O3+6HCl=2AlCl3+3H2OAl2O3+6H+=2Al3++3H2OAl2O3+2NaOH=2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O4、※氢氧化铝是两性氢氧化物,既能与酸(盐酸、稀硫酸)反应, 又能与强碱溶液(NaOH溶液)反应Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2OAl(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O5、氢氧化铝受热分解2Al(OH)3△Al2O3+3H2O6、※向无色AlCl3溶液中滴加NaOH溶液直到过量,先有白色沉淀后消失AlCl3+3NaOH=Al(OH)3↓+3NaClAl3++3OH-=Al(OH)3↓Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O7、※向无色AlCl3溶液中滴加氨水直到过量,有白色沉淀不消失AlCl3+3NH3·H2O=Al(OH)3↓+3NH4ClAl3++3NH3·H2O=Al(OH)3↓+3NH4+8、※偏铝酸钠溶液通入少量(过量)CO22NaAlO2+CO2少+3H2O=2Al(OH)3↓+Na2CO32AlO2-+CO2少+3H2O=2Al(OH)3↓+CO32-NaAlO2+CO2过+2H2O=Al(OH)3↓+NaH CO3AlO2-+CO2过+2H2O=Al(OH)3↓+HCO3-9、※偏铝酸钠溶液滴加少量(过量)盐酸NaAlO2+HCl少+H2O=Al(OH)3↓+NaClAlO2-+H++H2O=Al(OH)3↓NaAlO2+4HCl过=AlCl3+NaCl+2H2OAlO2-+4H+=Al3++ 2H2O三、铁及铁的重要化合物1、铁丝在氧气中燃烧3Fe+2O2点燃====Fe3O42、铁与氯气反应(棕褐色烟)2Fe+3Cl2点燃====2FeCl33、※铁与稀盐酸(或稀硫酸)反应Fe+2HCl=FeCl2+H2↑Fe+2H+=Fe2++ H2↑4、铁与水蒸气在加热条件下反应3Fe+4H2O(g)=(高温)= Fe3O4 +4H2↑5、※FeO与盐酸反应FeO+2HCl=FeCl2+H2OFeO+2H+=Fe2++H2O6、※Fe2O3与盐酸反应Fe2O3+6HCl=2FeCl3+3H2OFe2O3+6H+=2Fe3++3H2O7、※Fe3O4与盐酸反应Fe3O4+8HCl=2FeCl3+ FeCl2+4H2OFe3O4+8H+=2Fe3++ Fe2++4H2O8、Fe2O3与CO在高温下反应(炼铁原理)Fe2O3+3CO=(高温)=2Fe+3CO29、向浅绿色FeCl2溶液中滴加NaOH溶液生成白色沉淀,沉淀立刻变灰绿色最后变红褐色FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe2++2OH-=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)310、※向黄色FeCl3溶液中滴加NaOH溶液有红褐色沉淀生成FeCl3+3NaOH= Fe(OH)3↓+3Na ClFe3++3OH-=Fe(OH)3↓11、Fe(OH)3受热分解2Fe(OH)3△Fe2O3+3H2O12、※向黄色FeCl3溶液中加足量铁粉充分反应后,再加KSCN溶液,溶液不变红色Fe+2FeCl3=3FeCl22Fe+2Fe3+=3Fe2+13、※黄色FeCl3溶液也可与金属铜反应,工业上利用此反应制备印刷电路板Cu+2FeCl3=2FeCl2+CuCl2Cu+2Fe3+=2Fe2++Cu2+14、※向浅绿色FeCl2溶液中先加KSCN溶液,溶液无变化,后滴加氯水,溶液变红色2FeCl2+Cl2=2FeCl32Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN- =Fe(SCN)315、※向沸水中滴几滴饱和FeCl3溶液后,再加热一小会制Fe(OH)3胶体FeCl3+3H2O(沸水) =Fe(OH)3(胶体)+3HCl 16、氯化亚铁溶液中滴加氨水FeCl2+2NH3·H2O=Fe(OH)2↓+2NH4ClFe2++2NH3·H2O=Fe(OH)2↓+2NH4+四、铜及铜的重要化合物1、铜在氯气中燃烧(棕黄色烟)Cu+Cl2点燃====CuCl2 2、铜和浓硫酸加热反应Cu+2H2SO4(浓)△4+2H2O+SO2↑3、※铜和稀硝酸反应3Cu+8HNO3稀=3Cu(NO3)2+2NO↑+4H2O 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 4、※铜和浓硝酸反应Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2OCu+4H++2NO3-=Cu2++2NO2↑+2H2O5、※向蓝色CuCl2溶液中滴加NaOH溶液,生产蓝色絮状沉淀CuCl2+2NaOH=Cu(OH)2↓+2NaClCu2++2OH- = Cu(OH)2↓6、※向蓝色CuCl2溶液中加足量铁粉充分反应CuCl2+Fe=FeCl2+CuCu2++Fe=Fe2++Cu五、氯气1、※Cl2与水反应Cl2+H2O=HCl+HClO(可逆)Cl2+H2O=H++Cl-+HClO(可逆)2、HClO不稳定,见光或受热分解2HClO=(光)=2HCl+O2↑3、※氯气与氢氧化钠溶液反应制取以次氯酸钠(NaClO)为有效成分的漂白液Cl2+2NaOH=NaCl+NaClO+H2OCl2+2OH-=Cl-+ClO-+H2O4、※氯气与Ca(OH)2(俗名消石灰或熟石灰)溶液反应制取以次氯酸钙[Ca(ClO)2]为有效成分的漂白粉或漂粉精2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O5、漂白粉露置在空气会变质的有关反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO2HClO=(光)=2HCl+O2↑6、※氯水滴入NaBr(NaI)溶液中;溴水滴入NaI溶液。
Cl2+2NaBr=2NaCl+Br2Cl2+2NaI=2NaCl+I2Br2+2NaI=2NaBr+I2Cl2+2Br-=2Cl-+Br2Cl2+2I-=2Cl-+I2Br2+2I-=2Br-+I27、※NaCl溶液滴加AgNO3溶液NaCl+AgNO3=AgCl↓+NaNO3Ag++Cl-=AgCl↓8、※SO2通入氯水(溴水、碘水)中SO2+Cl2+2H2O=H2SO4+2HClSO2+Br2+2H2O=H2SO4+2HBrSO2+I2+2H2O=H2SO4+2HISO2+Cl2+2H2O=4H++SO42-+2Cl-SO2+Br2+2H2O=4H++SO42-+2Br-SO2+I2+2H2O=4H++SO42-+2I-9、※FeCl2溶液中滴加氯水2FeCl2+Cl2=2FeCl32Fe2++Cl2=2Fe3++2Cl-310、※“84”为什么不能与“洁厕灵”同时使用NaClO+2HCl=NaCl+Cl2↑+H2OClO-+2H++Cl-=Cl2↑+H2O11、※实验室制备Cl2MnO2+4HCl浓△MnCl2+Cl2↑+2H2O MnO2+4H++2Cl-△Mn2++Cl2↑+2H2O六、硫及硫的重要化合物1、硫在空气中燃烧S+O2点燃====SO22、二氧化硫与水反应SO2+H2O=H2SO33、二氧化硫与氧化钙反应SO2+CaO=CaSO34、※少量SO2与氢氧化钠溶液反应SO2+2NaOH过=Na2SO3+H2OSO2+2OH-=SO32-+H2O5、※过量SO2与氢氧化钠溶液反应SO2+NaOH少=NaHSO3SO2+OH-=HSO3-6、SO2与O2反应2SO2+O2△2SO3(可逆,催化剂)7、SO3与H2O反应SO3+H2O=H2SO48、SO3与CaO反应SO3+CaO=CaSO49、SO3与Ca(OH)2反应SO3+Ca(OH)2=CaSO4+H2O 10、※铁与稀硫酸反应Fe+H2SO4(稀)=FeSO4+H2↑Fe+2H+=Fe2++ H2↑11、铜与浓硫酸共热反应Cu+2H2SO4(浓)△CuSO4+2H2O+SO2↑12、碳与浓硫酸共热反应C+2H2SO4浓△CO2↑+2SO2↑+2H2O13、SO2通入氢硫酸(H2S)SO2+2H2S=3S↓+2H2O14、SO2通入足量(少量)澄清石灰水中SO2+Ca(OH)2过=CaSO3↓+H2OSO2+Ca2++2OH-=CaSO3↓+H2O2SO2+Ca(OH)2少=Ca(HSO3)2SO2+OH-=HSO3-16、工业制硫酸原理:S→SO2→SO3→H2SO4,在下面写出有关反应方程式S+O2点燃====SO22SO2+O2△2SO3(可逆,催化剂)SO3+H2O=H2SO4七、氮及氮的重要化合物1、氮气与氧气在放电或高温条件下反应N2+O2=(放电或高温)=2NO2、一氧化氮因与氧气在常温下反应,而不能共存2NO+O2=2NO23、※NO2与水反应3NO2+H2O=2HNO3+NO3NO2+H2O=2H++NO3-+NO4、工业上合成氨的反应N2+3H2=2NH3(可逆、高温、高压、催化剂)5、NH3与水反应[氨气溶于水时,大部分与水结合成一水合氨(NH3·H2O)]6、一水合氨(NH3·H2O)不稳定,受热分解NH3·H2O△NH3↑+H2O7、NH3与盐酸反应(NH3与HCl相遇有白烟生成)NH3+HCl=NH4Cl48、NH3与O2反应(氨的催化氧化)4NH3+5O2=4NO+6H2O(催化剂、加热) 9、NH4HCO3固体受热分解的反应NH4HCO3△NH3↑+CO2↑+H2O10、NH4Cl固体受热分解的反应NH4Cl △NH3↑+HCl↑11、NH3的实验室制法:用铵盐(NH4Cl固体)、碱[Ca(OH)2固体]共热制NH32NH4Cl+Ca(OH)2△2NH3↑+CaCl2+2H2O12、浓HNO3跟炽热的碳反应C+4HNO3浓△CO2↑+4NO2↑+2H2O13、工业制硝酸原理:NH3→NO→NO2→HNO3 ,在下面写出有关反应方程式4NH3+5O2=4NO+6H2O(催化剂、加热)2NO+O2=2NO23NO2+H2O=2HNO3+NO八、硅及硅的重要化合物1、Si粉末在O2中加热Si+O2△SiO22、二氧化硅只与氢氟酸(HF)反应[雕刻玻璃;氢氟酸(HF)要保存在塑料瓶]SiO2+4HF=SiF4↑+2H2O3、二氧化硅在高温条件下与氧化钙反应SiO2+CaO=(高温)=CaSiO34、※二氧化硅与氢氧化钠反应(装碱的试剂瓶用胶塞)SiO2+2NaOH=Na2SiO3+H2OSiO2+2OH-=SiO32-+H2O5、※用Na2SiO3(硅酸钠)溶液[俗名水玻璃]与稀盐酸反应制取硅酸(白色胶状沉淀) Na2SiO3+2HCl=2NaCl+H2SiO3↓SiO32-+2H+=H2SiO3↓6、※Na2SiO3溶液露置在空气中会变质Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓SiO32-+CO2+H2O=CO32-+H2SiO3↓7、SiO2跟CaCO3、NaCO3高温SiO2+CaCO3=(高温)=CaSiO3+CO2↑SiO2+Na2CO3=(高温)=Na2SiO3+CO2↑8、用焦炭还原二氧化硅2C+SiO2=(高温)=Si+2CO↑9、硅酸受热分解H2SiO3△SiO2+H2O5。
