高考化学常见物质的俗名和别称
高考化学常见物质的俗名和别称

KFe(SO4)2·12H2O
锌的化合物
菱锌矿
ZnCO3
皓矾、锌矾
ZnSO4·7H2O
铅的化合物
密陀僧、黄丹
PbO
铅丹、红丹、红铅
Pbபைடு நூலகம்O4
铅矾
PbSO4
方铅矿
PbS
锰的化合物
软锰矿
MnO2
菱锰矿
MnCO3
灰锰矿
KMnO4
汞的化合物
甘汞、低汞
Hg2Cl2
升汞、高汞
HgCl2
雷汞
Hg(ONC)2
KNO3
苛性钾
KOH
红矾、红矾钾
K2Cr2O7
铵的化合物
碳铵
NH4HCO3
硫铵、肥田粉
(NH4)2SO4
硝铵
NH4NO3
安福粉
NH4H2PO4(75%)
(NH4)2HPO4(25%)
镁的化合物
菱镁矿
MgCO3
泻盐、苦盐
MgSO4·7H2O
卤盐
MgCl2
钙的化合物
生石灰
CaO
熟石灰、消石灰
Ca(OH)2
其它无机物
硼砂
Na4B2O7·10H2O
波尔多液
CuSO4、Ca(OH)2
肼、联氨
H2N-NH2
钠汞齐
NaxHgx即钠汞合金
有机化合物
电石气
C2H2
沼气、坑气、天然气
CH4
蚁酸
HCOOH
福尔马林
HCHO(35%~40%的水溶液)
火棉
电木、酚醛树脂
石炭酸
安息香酸
苦味酸
TNT
氟里昂
CCl2F2等
常见物质的化学名(俗名)及化学式
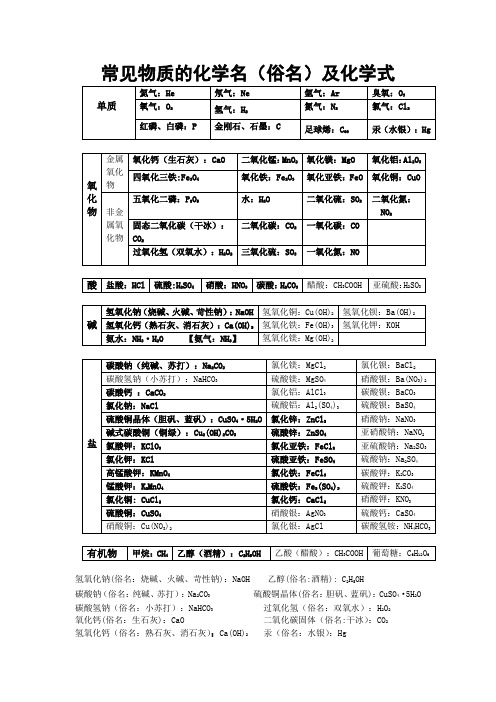
碱
氢氧化钠(烧碱、火碱、苛性钠):NaOH
氢氧化铜:Cu(OH)2
氢氧化钡:Ba(OH)2
氢氧化钙(熟石灰、消石灰):Ca(OH)2
氢氧化铁:Fe(OH)3
氢氧化钾:KOH
氨水:NH3·H2O【氨气:NH3】
氢氧化镁:Mg(OH)2
盐
碳酸钠(纯碱、苏打):Na2CO3
氯化镁:MgCl2
氧化亚铁:FeO
氧化铜:CuO
非金属氧化物
五氧化二磷:P化氮:NO2
固态二氧化碳(干冰):CO2
二氧化碳:CO2
一氧化碳:CO
过氧化氢(双氧水):H2O2
三氧化硫:SO3
一氧化氮:NO
酸
盐酸:HCl
硫酸:H2SO4
硝酸:HNO3
碳酸:H2CO3
醋酸:CH3COOH
硝酸钾:KNO3
硫酸铜:CuSO4
硝酸银:AgNO3
硫酸钙:CaSO4
硝酸铜:Cu(NO3)2
氯化银:AgCl
碳酸氢铵:NH4HCO3
有机物
甲烷:CH4
乙醇(酒精):C2H5OH
乙酸(醋酸):CH3COOH
葡萄糖:C6H12O6
氢氧化钠(俗名:烧碱、火碱、苛性钠):NaOH乙醇(俗名:酒精):C2H5OH
氯化钡:BaCl2
碳酸氢钠(小苏打):NaHCO3
硫酸镁:MgSO4
硝酸钡:Ba(NO3)2
碳酸钙:CaCO3
氯化铝:AlCl3
碳酸钡:BaCO3
氯化钠:NaCl
硫酸铝:Al2(SO4)3
硫酸钡:BaSO4
硫酸铜晶体(胆矾、蓝矾):CuSO4·5H2O
氯化锌:ZnCl2
化学一些常见物质俗名大全都有什么

引言概述:化学一些常见物质俗名大全是许多读者所感兴趣的话题之一。
本文将为您详细介绍一些常见化学物质的俗名,以增加对化学物质的了解。
正文内容:一、酸类1.硫酸:俗称油酸,是一种常见的强酸,在工业和实验室中广泛使用。
2.盐酸:又称盐酸酸溶液,具有强烈的刺激性气味,常用于实验室化学反应中。
3.醋酸:也被称为醋酸酸溶液,是一种常见的酸性溶液,常用于调味和工业生产中。
二、碱类1.氢氧化钠:又称烧碱或苛性钠,是一种强碱,常用于清洁和实验室中的酸中和反应。
2.氢氧化钾:又称苛性钾,是一种常用的强碱,广泛应用于工业和实验室反应中。
3.氨水:俗称氨水,是一种具有刺激性气味的弱碱性溶液,常用于清洁和草坪养护等方面。
三、盐类1.硫酸铜:俗称蓝矾,是一种蓝色晶体,常用于染料和实验室反应中。
2.氯化钠:又称食盐,是一种常见的盐类化合物,常用于调味和食品加工中。
3.醋酸铅:也被称为白醋酸铅,是一种有毒的物质,常用于皮革加工和保护木材。
四、气体1.氢气:常称为燃气,是一种无色无味的气体,广泛应用于工业生产和燃料电池中。
2.氧气:俗称纯氧,是一种支持燃烧和生命维持的关键气体,广泛应用于医疗和工业领域。
3.二氧化碳:俗称干冰,是一种常见的气体,常用于保鲜和实验室制冷。
五、有机化合物1.乙醇:俗称酒精,是一种常见的有机溶剂和饮料成分,广泛应用于医药和化妆品工业中。
2.甲醛:又称福尔马林,是一种刺激性气味的有机物,广泛用于防腐剂和实验室消毒中。
3.乙二醇:又称丙二醇,是一种无色无味的有机溶剂,常用于制备涂料和塑料。
总结:通过本文的介绍,我们了解了一些常见化学物质的俗名。
酸类、碱类、盐类、气体和有机化合物等各类物质都有其特定的俗名,这些俗名对于日常生活和实验室研究中的使用都具有重要意义。
希望本文能为读者提供更深入的化学知识,并对化学物质的常用俗名有一定的了解。
高考化学常见物质的俗名和别称

铅的化合物
密陀僧、黄丹
PbO
铅丹、红丹、红铅
Pb3O4
铅矾
PbSO4
方铅矿
PbS
锰的化合物
软锰矿
MnO2
菱锰矿
MnCO3
灰锰矿
KMnO4
汞的化合物
甘汞、低汞
Hg2Cl2
升汞、高汞
HgCl2
雷汞
HgONC2
朱砂、辰砂、丹砂
HgS
三仙丹
HgO
砷的化合物
白砒、砒霜
As2O3
雄黄、雄精
As4S6
钠的化合物
俗名和别名
主要化学成分
俗名和别名
主要化学成分
小苏打、重碱
NaHCO3
苛性钠、火碱、烧碱
NaOH
苏Na2SO4·10H2O
口碱、晶碱
Na2CO3·10H2O
无水芒硝、元明粉
Na2SO4
食盐
NaCl
钠硝石、智利硝石
NaNO3
钾的化合物
草碱、钾碱
K2CO3
硝石、钾硝石、火硝、土硝
铜的化合物
赤铜矿
Cu2O
胆矾、蓝矾
CuSO4·5H2O
辉铜矿
Cu2S
铜绿、孔雀石
Cu2OH2CO3
铝的化合物
明矾
KAlSO42·12H2O
冰晶石
Na3AlF6
刚玉、红宝石、蓝宝石
Al2O3
矾土
Al2O3·H2O、Al2O3·3H2O、少量Fe2O3和SiO2
银粉
Al
铁的化合物
铁丹、铁红、赤铁矿
Fe2O3
KNO3
苛性钾
KOH
红矾、红矾钾
高考化学常见物质的俗名和别名小汇

高考化学常见物质的俗名和别名小汇物质的俗名和别名的来由多种多样,有的是根据物质的特殊性质命名的,有的是根据产地或用途命名的,有的是沿袭音译或传统的称呼。
现将常见物质的俗名与别名总结如下,以供大家备战高考。
1. 钠的化合物
2. 钾的化合物
3. 铵的化合物
4. 镁的化合物
5. 钙的化合物
6. 钡的化合物
7. 铜的化合物
8. 铝的化合物
9. 铁的化合物
10. 锌的化合物
11. 铅的化合物
12. 锰的化合物
13. 汞的化合物
14. 砷的化合物
15. 硅的化合物
16. 硫的化合物
17. 其它无机物
18. 有机化合物
主要化学成分
主要化学成分
C 2H 2 CH 4
HCOOH
HCHO(35%~40%的水溶液)
[()]C H O ONO n 67223 []C H OHCH n 632
CCl 2F 2等
H 2N -CH 2-COOH
HOOCCH CH H C COOH
NH 222
--|。
高考化学常见物质的俗名和别称

高考化学常见物质的俗
名和别称
-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
白砒、砒霜 As 2O 3 雄黄、雄精 As 4S 6 雌黄、砒黄
As 2S 3 毒砂 FeAsS 硅的化合物
硅胶 mSiO 2·nH 2O
石英、水晶、玛瑙 SiO 2 金刚砂
SiC 泡花碱、水玻璃 Na 2SiO 3 硫的化合物
大苏打、海波
Na 2S 2O 3·5H 2O
硫化碱、臭碱
Na 2S ·9H 2O
硫钡粉
BaS ·S x 其它无机物
硼砂 Na 4B 2O 7·10H 2O 波尔多液 CuSO 4、Ca(OH)2 肼、联氨
H 2N -NH 2
钠汞齐
Na x Hg x 即钠汞合金
有机化合物
电石气 C 2H 2 沼气、坑气、天
然气 CH 4
蚁酸 HCOOH
福尔马林 HCHO(35%~40%的水溶液)
火棉 [()]C H O ONO n 67223
电木、酚醛树脂 []C H OHCH n 632
石炭酸
安息香酸
苦味酸
TNT
氟里昂 CCl 2F 2等
甘氨酸 H 2N -CH 2-COOH
尿素
谷氨酸
HOOCCH CH H C COOH
NH 222
--| 硝化甘油
卫生球
蚁醛 HCHO 木精 CH 3OH
氯仿
CHCl 3。
高考化学重要知识点分类归纳总结

高考化学重要知识点分类归纳总结一、俗名无机部分:纯碱、苏打、天然碱、口碱:N a2CO3 小苏打: NaHCO 3 大苏打:Na 2S2O 3 石膏(生石膏): CaSO4.2H2O 熟石膏: 2CaSO4· .H2O 莹石: CaF2 重晶石: BaSO4(无毒)碳铵: NH 4HCO3 石灰石、大理石: CaCO3 生石灰: CaO 食盐: NaCl 熟石灰、消石灰: Ca(OH) 2 芒硝: Na2SO4·7H2O (缓泻剂)烧碱、火碱、苛性钠: NaOH 绿矾:FaSO4· 7H2O 干冰: CO2 明矾: KAl (SO4) 2 ·12H 2O 漂白粉: Ca (ClO)2 、 CaCl2(混和物)泻盐: MgSO4· 7H2O 胆矾、蓝矾: CuSO4· 5H2O 双氧水: H2O2 皓矾: ZnSO4· 7H2O 硅石、石英: SiO2 刚玉: Al 2O3 水玻璃、泡花碱、矿物胶: Na2SiO3 铁红、铁矿: Fe2O3 磁铁矿: Fe3O4 黄铁矿、硫铁矿: FeS2 铜绿、孔雀石: Cu2 (OH)2CO3 菱铁矿:FeCO3 赤铜矿: Cu2O 波尔多液: Ca (OH)2和 CuSO4 石硫合剂: Ca (OH)2 玻璃的主要成分: Na2SiO3、 CaSiO3、SiO2 过磷酸钙(主要成分):Ca(H2PO4)2和 CaSO4 重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分): CH4 水煤气: CO 和 H2 硫酸亚铁铵(淡蓝绿色):Fe (NH 4) 2 (SO4)2 溶水后淡绿色光化学烟雾: NO 2在光照下产生的一种有毒气体王水:浓 HNO 3与浓 HCl 按体积比 1:3 混合而成。
铝热剂: Al + Fe2O3 或其它氧化物。
尿素: CO( NH 2) 2有机部分:氯仿: CHCl 3 电石: CaC2电石气: C2H2 (乙炔) TNT :三硝基甲苯酒精、乙醇: C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3 层。
高中化学中常见物质俗称或俗名总结

高中化学中常见物质俗称或俗名总结
1. NaCl (氯化钠) - 俗称食盐,是我们日常生活中常见的调味品之一。
2. H2O (水) - 俗称白水、自来水,是生命中不可或缺的基本物质。
3. CO2 (二氧化碳) - 俗称碳酸气,是一种常见的气体,在呼吸过程中产生,也是温室气体之一。
4. C6H12O6 (葡萄糖) - 俗称葡萄糖、葡糖,是一种重要的简单糖类,参与人体能量代谢。
5. Fe (铁) - 俗称铁,是一种常见金属元素,广泛应用于建筑、工业等领域。
6. Cu (铜) - 俗称铜,是一种黄色金属,具有良好的导电性和导热性能。
7. HCl (盐酸) - 俗称盐酸,是一种常见的酸性物质,常用于实
验室和工业。
8. CH4 (甲烷) - 俗称天然气、沼气,是一种无色、无味的气体,是一种重要的燃料。
9. NH3 (氨气) - 俗称氨气、氨,是一种具有刺激性气味的气体,常用于合成化合物和农业。
10. C12H22O11 (蔗糖) - 俗称蔗糖、白糖,是一种常见的复合
糖类,常见于食品中。
以上是高中化学中常见物质的俗称或俗名总结。
这些物质在我
们的日常生活中广泛应用,了解它们的俗称有助于加深对化学知识
的理解和应用。
高中化学重要物质的俗名

高中化学重要物质的俗名1.生石灰(主要成份是CaO);消石灰、熟石灰[主要成份是Ca(OH)2];水垢[主要成份是CaCO3和Mg(OH)2];石灰石、大理石、白垩、蛋壳、贝壳、骨骼中的无机盐(主要成份是CaCO3);波尔多液(石灰水与硫酸铜溶液的混合物);石硫合剂(石灰水与硫粉的悬浊液)。
碱石灰[由NaOH、Ca(OH)2的混合液蒸干并灼烧而成,可以看成是NaOH和CaO的混合物];2.烧碱、火碱、苛性钠(NaOH);苛性钾(KOH)3.苏打、纯碱、口碱(Na2CO3);小苏打(NaHCO3);大苏打、海波(Na2S2O3)纯碱晶体(Na2CO3·10H2O);泡花碱、水玻璃、矿物胶(Na2SiO3的水溶液)。
4.芒硝(Na2SO4·10H2O);重晶石(BaSO4);石膏(CaSO4·2H2O);熟石膏(2CaSO4·H2O)。
5.胆矾、蓝矾(CuSO4·5H2O);明矾[KAl(SO4)2·12H2O或K2SO4·Al2(SO4)3·24H2O];绿矾(FeSO4·7H2O);皓矾(ZnSO4·7H2O)。
6.菱镁矿(主要成份是MgCO3);菱铁矿(主要成份是FeCO3);磁铁矿(主要成份是Fe3O4);赤铁矿、铁红(主要成份是Fe2O3);黄铁矿、硫铁矿(主要成份是FeS2)。
7.磷矿石[主要成份是Ca3(PO4)2];重过磷酸钙、重钙[主要成份是Ca(H2PO4)2];过磷酸钙、普钙[主要成份是Ca(H2PO4)2和CaSO4]。
8.光卤石(KCl·MgCl2·6H2O);9.铜绿、孔雀石[Cu2(OH)2CO3];10.萤石(CaF2);电石(CaC2);冰晶石(Na3AlF6)水晶(SiO2);玛瑙(主要成份是SiO2);石英(主要成份是SiO2);硅藻土(无定形SiO2)宝石、刚玉(Al2O3);金刚砂(SiC)。
高考化学必背知识点

高考化学必背知识点一、俗名无机部分:纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O熟石膏:2CaSO4·.H2O莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3石灰石、大理石:CaCO3生石灰:CaO食盐:NaCl熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O(缓泻剂)烧碱、火碱、苛性钠:NaOH绿矾:FaSO4·7H2O干冰:CO2明矾:KAl(SO4)2·12H2O漂白粉:Ca(ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O双氧水:H2O2皓矾:ZnSO4·7H2O硅石、石英:SiO2刚玉:Al2O3水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2(OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O波尔多液:Ca(OH)2和CuSO4石硫合剂:Ca(OH)2和S玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca(H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca(H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe(NH4)2(SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al+Fe2O3或其它氧化物。
尿素:CO(NH2)2有机部分:氯仿:CHCl3电石:CaC2电石气:C2H2(乙炔)TNT:三硝基甲苯酒精、乙醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
醋酸:冰醋酸、食醋CH3COOH裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
高中化学常见物质及其俗称

高中化学常有物质及其俗称(和颜色)水银汞 Hg 钾碱、草碱、草木灰碳酸钾 K2CO3白金铂 Pt 硝石、火硝、土硝硝酸钾 KNO3硫磺硫S 灰锰氧、 PP粉高锰酸钾 KMnO4金刚石、石墨、木炭碳 C 冰晶石氟铝酸钠 Na3AlF6白磷、红磷、黄磷磷 P 大理石、方解石、石灰石盐酸、盐镪水氢氯酸 HCl 白垩碳酸钙 CaCO3硝镪水硝酸 HNO3 萤石、氟石氟化钙 CaF2硫镪水硫酸 H2SO4 钙硝石、挪威硝石硝酸钙 Ca(NO3)2王水浓硝酸、浓盐酸( 1:3) HNO3,HCl 电石碳化钙 CaC2双氧水过氧化氢 H2O2 铜绿、孔雀石碱式碳酸铜 CU2(OH)2CO3铅丹、红丹、红铅四氧化三铅 Pb3O4 重晶石、钡白硫酸钡 BaSO4砒霜、信石、白砒、砷华三氧化二砷 As2O3 钠硝石、智利硝石硝酸钠 NaNO3升汞、高汞氯化汞 HgCl2 生石膏、石膏硫酸钙 CaSO4.2H2O朱砂、辰砂、丹砂、银朱硫化汞 HgS 熟石膏、烧石膏硫酸钙 2CaSO4. H2O烧碱、火碱、苛性钠氢氧化钠 NaOH 过磷酸钙磷酸二氢钙 Ca(H2PO4)2苛性钾氢氧化钾 KOH 重钙磷酸二氢钙 Ca(H2PO4)2消石灰、熟石灰氢氧化钙 Ca(OH)2 漂白粉次氯酸钙 Ca(ClO)2苛性镁氢氧化镁 Mg( OH)2 氯仿、绿仿三氯甲烷 CHCl3碱石灰、钠碱石灰氢氧化钠、氧化钙混淆木精甲醇 CH3OHNaOH,CaO 甘油丙三醇 C2H5(OH)3碳铵碳酸氢铵 NH4HCO3 石炭酸苯酚 C6H5OH盐脑、电气药粉氯化铵 NH4Cl 蚁酸甲酸 HCOOH硫铵硫酸铵 (NH4)2SO4 草酸乙二酸 HOOC-COOH磷矿粉磷酸钙 Ca3(PO4)2 败脂酸丙烯酸 CH2=CH-COOH碳酸气、干冰二氧化碳 CO2 巴豆酸丁烯酸 CH3-CH=CH-COOH笑气氧化二氮 N2O 油酸十八烯酸 C17H33COOH硅石、石英、水晶、玛瑙硬脂酸十八酸 C17H35COOH砂子二氧化硅 SiO2 软脂酸棕榈酸十六酸 C15H31COOH矾土、刚玉氧化铝 Al2O3 月桂酸十二酸 C11H21COOH生石灰、煅烧石灰氧化钙 CaO 福尔马林甲醛溶液( 30%~40%) HCHO锌白、锌氧粉氧化锌 ZnO 尿素碳酰胺 CO(NH2)苫土、烧苫土氧化镁 MgO 安眠香酸苯甲酸 C6H5COOH苏打、纯碱碳酸铵 Na2SO4 赤铜矿氧化亚铜 Cu2O小苏打、重碱碳酸氢钠 NaHCO3 软锰矿二氧化锰 MnO2大苏打、海波硫代硫酸钠 Na2S2O3.5H2O 菱铁矿碳酸亚铁 FeCO3褐铁矿 2Fe2O3.3H2O 辉铜矿硫化亚铜 Cu2S铁锈氧化铁 Fe2O3 愚人金硫化亚铁 FeS2铜绿碱式碳酸铜 Cu2 ( OH)2CO3 铁丹、铁红、赭石、赤铁矿三氧化二铁 Fe2O3 芒硝、皮硝、马牙硝结晶硫酸钠 Na2SO4.10H2O 磁铁矿、铁黑四氧化三铁 Fe3O4泻盐、苦盐硫酸镁 MgSO4.7H2O 绿矾七水合硫酸亚铁 FeSO4.7H2O口碱结晶碳酸钠 Na2CO3.10H2O 保险粉连二亚硫酸钠 Na2S2O4明矾硫酸铝钾 KAl(SO4)2 .12H2O 酪酸正丁酸 CH3CH2CH2COOH皓矾硫酸锌 ZnSO4.7H2O 醋石一水醋酸钙( CH3COO)2 Ca.H2O胆矾硫酸铜 CuSO4.5H2O 菱镁矿碳酸镁 MgCO3红矾重铬酸钾 K2Cr2O7 水镁石氢氧化镁 Mg (OH) 2无水芒硝、元明粉硫酸钠 Na2SO4 蜜石酸苯六(甲)酸水玻璃、泡花碱硅酸钠 Na2SiO3 焦性蜜石酸均苯四甲酸硫化碱、臭碱硫化钠 Na2S 没食子酸 3 , 4, 5- 三羟基苯甲酸黄色:AgI 、 Ag3PO4、P4(黄磷)、溴水(黄 -- 橙)、 FeS2、 Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
高考化学必备之俗名大全

高考化学必备之俗名大全无机部分:纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O熟石膏:2CaSO4.H2O莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3石灰石、大理石:CaCO3生石灰:CaO食盐:NaCl熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂)烧碱、火碱、苛性钠:NaOH绿矾:FaSO4·7H2O干冰:CO2明矾:KAl (SO4)2·12H2O漂白粉:Ca (ClO)2 、CaCl2(混和物)泻盐:MgSO4·7H2O胆矾、蓝矾:CuSO4·5H2O双氧水:H2O2皓矾:ZnSO4·7H2O硅石、石英:SiO2刚玉:Al2O3水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2有机部分:氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔)TNT:三硝基甲苯氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
酒精、乙醇:C2H5OH裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。
高中化学物质颜色、俗称、用途汇总

中学化学物质颜色、俗名、用途汇总-、颜色1.红色:Fe(SCN)3(红色溶液)Cu2O(红色固体)Fe2O3(红棕色固体)红磷(暗红色固体)液溴(深红棕色)Fe(OH)3(红褐色固体)Cu (红色固体)溴蒸气、NO2(红棕色)品红溶液(红色) 在空气中久置的苯酚(粉红)石蕊遇酸性溶液(红色) 酚酞遇碱性溶液(红色)2.紫色:石蕊在中性溶液中(紫色)Fe3+与苯酚反应产物(紫色)I2(紫黑色固体)KMnO4固体(紫黑色)MnO4—(紫红色溶液)钾的焰色反应(紫色)I2蒸气、I2在非极性溶剂中(紫色)3.橙色:溴水(橙色)K2Cr2O7溶液(橙色)4.黄色:AgI(黄色固体)AgBr(淡黄色固体)Ag3PO4(黄色固体)FeS2(黄色固体)Na2O2(淡黄色固体)S(黄色固体)Au(金属光泽黄色固体)I2的水溶液(黄色)碘酒(黄褐色)久置的KI溶液(黄色)(被氧化为I2)Na的焰色反应(黄色)TNT(淡黄色针状)工业浓盐酸(黄色)(含有Fe3+)Fe3+的水溶液(黄色)硝基苯中溶有浓硝酸分解的NO2时(黄色)久置的浓硝酸(黄色)(溶有分解生成的NO2)浓硝酸粘到皮肤上(自然蛋白质)(显黄色)5.绿色:Cu2(OH)2CO3(绿色固体)Fe2+的水溶液(浅绿色)FeSO4·7H2O(绿矾)Cl2、氯水(黄绿色)F2(淡黄绿色)CuCl2的浓溶液(蓝绿色)7.棕色:FeCl3固体(棕黄色)CuCl2固体(棕色)6.蓝色:Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色)石蕊遇碱性溶液(蓝色)硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰)一氧化碳在空气中燃烧(蓝色火焰)淀粉遇I2变蓝色Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色)7.黑色:FeO;Fe3O4;FeS;CuO;CuS;Cu2S;MnO2;C粉;Ag2S;Ag2O;PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑;绝大多数金属在粉末状态时呈黑色或灰黑色。
高中化学复习必背知识点【高考必备】

高考化学复习必背知识点(一)一、常见物质的俗名及成分1 .硫酸盐类⑴ 皓矶:ZnSO4 7H2O (2)重晶石(银餐):BaSO4 (3)绿矶:FeSO4- 7H2O (4)芒硝:Na2SO4 10H2O (5)明矶:KAl(SO4)2 • 12H2O (6)蓝矶(胆矶):CuSO4 5H2O (7)熟石膏:2CaSO4 H2O2 .矿石类(1)电石:CaC2 (2)磁铁矿石:Fe3O4 (3)赤铁矿石:Fe2O3⑷ 石英:SiO2 (5)刚玉(蓝宝石,红宝石):Al2O33 .气体类⑴ 高炉煤气:CO CO冷混合气体(2)水煤气:CO H2 (3) 天然气(沼气):CH44 .有机类(1)福尔马林:35%^40%勺HCHOK溶3(2)蚁酸:HCOOH⑶ 尿素:CO(NH2)2 (4)氯仿:CHCl3 (5)甘油:CH2OHCHOH -CH2OH (6)硬脂酸:C17H35COOH⑺ 软脂酸:C15H31COOH(8)油酸:C17H33COOH(9)肥皂:C17H35COONa(1筑氨溶液:Ag(NH3)2OH (11)葡萄糖:C6H12O6 (12)蔗糖:C12H22O11 (13)淀粉:(C6H10O5)n (14)石炭酸:苯酚5 .其他类(1)石灰乳:Ca(OH)2 (2)铜绿:Cu2(OH)2CO3 (3)王水:浓盐酸、浓HNO3就体积比3 : 1混合)⑷泡花碱:Na2SiO3 (5)小苏打:NaHCO3 (6)纯碱、苏打:Na2CO3 (7)大苏打:Na2S2O3 5H2O(8)光卤石:MgCl2- 6H2O (9)生理盐水:0.9%的氯化钠溶液(10)漂白液:有效成分NaClQ非有效成分NaCl (11)漂白粉:有效成分Ca(ClO)2 ,非有效成分CaCl2 (12)碱石灰:CaONaOH二、物质的状态和颜色1 .固体物质淡黄色:S、Na2O2 AgBr、三硝基甲苯黄色:Au、AgI、Ag3PO4 FeS2紫红色:Cu红色:Cu2O 红棕色:红磷、Fe2O3棕黄色:CuCl2、FeCl3白色:P4 Fe(OH)2、无水CuSO4AgCl、BaSO4Al(OH)3、Mg(OH)2 BaCO3 CaCO3 Na2O MgO A12O3 黑色:石墨、CuS Cu2S FeS MnO2 FeO Fe3O4 CuO PbS 粉末状银和铁棕褐色:Ag2O紫黑色:I2红褐色:Fe(OH)3 蓝色:CuSO4 5H2O Cu(OH)2 绿色:FeSO4-7H2O Cu2(OH)2CO3银白色:块状铁、银、钠、钾2 .液体物质蓝色:Cu2+、[Cu(H2O)4]2 +、,遇I2的淀粉溶液黄色:Fe3+、碘的水3§液、遇浓HNO3勺蛋白质溶液、久置的浓硝酸、工业盐酸紫红色:MnO46)、碘的CCl4 溶液红色:[Fe(SCN)n]3 -n(n =1 〜6)深红棕色:液澳浅黄绿色:氯水橙色:澳水橙红色:澳的CCl4溶液红褐色:Fe(OH)3胶体褐色:碘的乙醇溶液3 .气体物质淡黄绿色:F2红棕色:NO2澳蒸气紫红色:碘蒸气黄绿色:C12无色:NH3 NO N2O4 SO2 H2s CH4 CH2===CH筹三、特殊的物理性质1 .易液化的物质常压下SO2(—10 C)、NH3(— 33.5 C)、C12( -34.6 C)2 . SO3熔点和沸点都很低,标准状况下是一种无色晶体.3 . H2SO4硫酸是一种无色透明、黏稠的油状液体,常用的浓硫酸的质量分数为98.3%,密度为1.84 g • cm- 3(物质的量浓度为18.4 mol ・ L—1),属高沸点、难挥发性酸.浓硫酸具有强腐蚀性,假设浓硫酸不慎溅到衣服或皮肤上,应先用湿布擦去,然后用大量的水冲洗,再用33 5%勺碳酸氢钠溶液冲洗.4 .单质澳易挥发,单质碘易升华5 .易潮解的物质NaOH MgCl2、CaCl2.6 .气体溶解性归纳难溶于水:H2 N2、CO NO CH4 C2H4 微溶于水:02、C2H2 较易溶于水:Cl2(1 : 2)、H2S(1 : 2.6)、C02(1: 1)、S02(1 : 40);极易溶于水:HF HCl、HBr、HI、NH3^.7 .物质的气味有刺激性气味的气体:HCl、NH3 Cl2、SO2有刺激性气味的液体:浓盐酸、浓硝酸、浓氨水、氯水、澳水.四、常见物质的重要用途1. O3:①漂白剂②消毒剂2. Cl2:①杀菌消毒②制盐酸、漂白剂③制氯仿等有机溶剂和多种农药3. N2:①焊接金属的保护气②填充灯泡③保存粮食作物④ 冷冻剂4. Al:①制导线电缆②食品饮料的包装③制多种合金④做机械零件、门窗等5. Na:①制Na2O2^②冶炼Ti等金属③电光源④N& K合金作原子反响堆导热剂6. A12O3:①冶炼铝②制作耐火材料7. NaCl:①化工原料②调味品③腌渍食品8. CO2①灭火剂②人工降雨③温室肥料9. NaHCO3①治疗胃酸过多②发醉粉10. AgI:①感光材料②人工降雨11. SO2①漂白剂②杀菌消毒12. H2O2①漂白剂、消毒剂、脱氯剂②火箭燃料13. CaSO4①制作各种模型②石膏绷带③调节水泥硬化速度14. SiO2:①制石英玻璃、石英钟表②光导纤维15. NH3①制硝酸、镂盐的主要原料②用于有机合成③制冷剂16. 乙酸乙酯:①有机溶剂②制备饮料和糖果的香料17. 乙烯:①制塑料、合成纤维、有机溶剂等②植物生长调节剂〔果实催熟〕18. 甘油:①重要化工原料②护肤五、常用的除杂方法1 .杂质转化法欲除去苯甲的苯酚,可参加氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开.欲除去Na2CO讣的NaHCO酊用加热的方法.2 .吸收洗涤法欲除去二氧化碳中混有的少量氯化氢和水, 可使混合气体先通过饱和碳酸氢钠的溶液后,再通过浓硫酸.3 .沉淀过滤法欲除去硫酸亚铁溶液中混有的少量硫酸铜,参加过量铁粉,待充分反响后,过滤除去不溶物,到达目的.4 .加热升华法欲除去碘中的沙子,可用此法.5 .溶剂萃取法欲除去水中含有的少量澳,可用此法.6 .溶液结晶法〔结晶和重结晶〕欲除去硝酸钠溶液中少量的氯化钠,可利用两者的溶解度不同,降低溶液温度,使硝酸钠结晶析生,得到硝酸钠纯晶.7 .分储、蒸播法欲除去乙醍中少量的酒精,可采用屡次蒸播的方法;将萃取后的碘单质和苯别离可采用蒸播法.8 .分液法欲将密度不同且又互不相溶的液体混合物别离,可采用此法, 如将苯和水别离.9 .渗析法欲除去胶体中的离子,可采用此法.如除去氢氧化铁胶体中的子°10 .综合法欲除去某物质中的杂质,可采用以上各种方法或多种方法综合运用.六、常见的环境污染1 .臭氧层空洞一一大气平流层中的臭氧层被氟里昂等氟氯烽破坏而减少或消失,使地球生物遭受紫外线的伤害.2 .温室效应一一大气中二氧化碳、甲烷等温室气体增多,造成地球平均气温上升,加速了水的循环,致使自然灾害频繁发生.3 .光化学烟雾一一空气中的污染性气体氮的氧化物在紫外线照射下,发生一系列光化学反响而生成有毒的光化学烟雾.空气中氮的氧化物主要来自石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气等.4 .赤潮一一海水富营养化〔含M P、K等污水的任意排放〕污染,使海藻大量繁殖,水质恶化.5 .水华一一淡水富营养化〔含M P、K等污水的任意排放〕污染,使水藻大量繁殖,水质恶化.6 .酸雨一一空气中硫、氮的氧化物在氧气和水的共同作用下形成酸雾随雨水降下,其pH通常小于5.6 o空气中SO注要来自化石燃料的燃烧,以及含硫矿石的冶炼和硫酸、磷肥、纸浆生产的工业废气.7 .汽车尾气一一主要是由汽油不完全燃烧产生的CO气态烽以及气缸中的空气在放电条件下产生的氮的氧化物等, 它是城市大气污染或造成光化学烟雾的主要原因.8 .室内污染一一由化工产品如油漆、涂料、板材等释放生的甲醛〔HCHO汽体;建筑材料产生的放射性同位素氢〔Rn〕;家用电器产生的电磁辐射等.9 .食品污染一一指蔬菜、粮食、副食品等在生产、贮存、运输、加工的过程中,农药、化肥、激素、防腐剂〔苯甲酸及其钠盐等〕、色素、增白剂〔“吊白块〞、大苏打、漂粉精〕、调味剂等,以及转基因技术的不恰当使用所造成的污染.七、常见化学反响〔一〕金属元素的反响1.碱金属的反响〔1〕碱金属单质的化学反响①与水反响2Na+ 2H2O===2NaOHH2T2K+ 2H2O===2KOHH2T2Na+ CuS042H2O===Na2SO4Cu〔OH〕2j + H2T【题源信息】钠与盐溶液反响,不能置换由盐中的金属,而是先与H2O反响生成NaOH然后生成的NaOH容液再与盐溶液反响,钠与H20酸反响的实质都是与H+反响,所以钠与酸溶液反响更为剧烈.钠与熔融的盐反响才可能置换由盐中的金属.②与氧气反响4Na+ O2===2Na2舞气中缓慢氧化)2Na+ O2 点燃=====Na2O22Na2d 02A =====2Na2O24Li +O2 点燃=====2Li2O【题源信息】①无论Na与O2反响生成Na2O或Na2O2只要参与反响的Na质量相等,那么转移电子的物质的量一定相等, 但得到Na2O2勺质量大于Na2O勺质量.②注意Na及其化合物发生焰色反响时火焰颜色均为黄色.③要注意推断题中的“题眼〞一一多步氧化关系:NaO2——> Na2OO2—-> Na2O2(2)碱金属化合物的化学反响① Na2O22H2d 2Na2O2===4NaOHO2T2CO4 2Na2O2===2Na2CO3O2SO4 Na2O2===Na2SO4【题源信息】1 mol Na2O渗与反响转移电子的物质的量为1 mol,该结论常用在考查NA的题目中.Na2O2f CO开口水蒸气组成的混合气体反响时,应先考虑Na2O2与CO2的反响.Na2O2具有强氧化性,能将具有复原性的物质氧化,注意相关反响离子方程式的书写〔如将Na2O殷入Na2s Na2SO3 NaI、FeSO/具有复原ft的溶液中〕o② Na2CO3Na2CO 3 2HC1〔过量〕===2NaCl+CO2t + H2ONa2CO3 HC1〔缺乏〕===NaC1 + NaHCO3Na2CO3 CO4 H2O===2NaHCO3Na2CO3 Ca〔OH〕2===CaCO3+ 2NaOH【题源信息】向Na2CO籀液中参加盐酸时反响分两步进行, 首先生成NaHCO3然后是NaHCO3f盐酸反响生成CO2两者滴加的顺序不同,产生的现象也不同,这就是不用其他试剂就能鉴别由Na2CO籀液和盐酸的原理.③NaHCO3NaHCO3 HC1===NaC1+ CO2T + H2ONaHCO3 NaOH===Na2CO3H2O2NaHCO3 Ca〔OH〕2〔缺乏尸==Na2CO3 CaCO3 + 2H2O NaHCO3 Ca〔OH〕2〔过量〕===CaCO3 + NaOH- H2O【题源信息】a .不能用常压下蒸发溶剂的方法制备NaHCO3 晶体,不能用澄清石灰水鉴别Na2CO3f NaHCO3b.在书写碳酸氢盐与澄清石灰水反响的离子方程式时要特别注意两者量的相对多少.c.吸收CO次体中的HCl不能用饱和Na2CO籀液,需用饱和NaHCO溶液.④ NaOH2NaOI+ H2SO4===Na2SO42H2OCO4 2NaOH过量〕===Na2CO3 H2OCO2M 量〕+ NaOH===NaHCO3⑤CO2与NaOH§液反响的产物可能是Na2CO3 NaHCO或两者的混合物,可根据Na+和C守恒法确定CO2与NaOH容液的反应产物.2 . Mg的反响(1)在CO2中燃烧2Mg+ CO2点燃=====2MgO- C⑵在空气中燃烧2Mg+ O2点燃=====2MgO 3Mg N2点燃=====Mg3N22Mg+ CO2点燃=====2MgO- C【题源信息】a .此反响在高考中是一个热点反响,主要由现在推断题中,是由金属单质作反响物生成非金属固体单质的置换反响.b.镁着火时不能用二氧化碳灭火器扑灭.c.常温下镁在空气中与O2反响生成一层巩固致密的氧化物保护膜,所以金属镁有抗腐蚀性.3 . Al及其化合物的反响(1)铝片产生氢气的反响2Al +6HCl===2AlCl3 + 3H2T2Al +2NaOH 2H2O===2NaAlO2 3H2T【题源信息】铝单质是中学化学中典型的既能与酸反响、又能与碱反响的金属单质,这常作为高考中物质推断题的“题眼〞.〔2〕铝热反响2A1 + Fe2O3高温=====2F计A12O34A1 + 3MnO扃温=====3Mn 2A12O3【题源信息】a.引发铝热反响的操作是高考实验考查的热点.主要操作是先铺一层KC1O3,插上镁条,然后点燃镁条.b.注意铝热反响是中学化学中唯一一个金属单质与金属氧化物在高温条件下的置换反响.c.该反响形式常在无机框图中由现,注意反响条件〔高温〕及信息〔铝热反响〕.〔3〕A12O3的反响〔两性〕A12O3+6HC1===2A1C13 + 3H2OA12O3+ 2NaOH===2NaA1O2 H2O【题源信息】由此可知A12O3是一种既能与酸反响,又能与碱反响的两性氧化物.⑷Al(OH)3的反响(两性)Al(OH)3 + 3HCl===AlCl3 + 3H2OAl(OH)3 + NaOH===NaA1022H2O【题源信息】由以上反响可知,Al(OH)3是一种既溶于酸又溶于碱的白色沉淀,这是高考推断题的常见“题眼〞.⑸铝盐的反响①铝盐与氨水反响Al3 + + 3NH3- H2O===Al(OH)31 + 3NH今【题源信息】a .不管氨水是否过量,都会发生此反响,Al(OH)3不溶于过量的氨水.b.此反响常用于制备Al(OH)3 o②偏铝酸盐的反响向偏铝酸盐溶液中滴加盐酸NaAlO2+ HCl+ H2O===Al(OH)31 + NaCl(少量盐酸) NaAlO2+ 4HCl===AlCl3 + NaCl+ 2H2O(£量盐酸)【题源信息】向偏铝酸盐中逐滴滴加过量盐酸的实验现象是先产生白色沉淀,然后沉淀溶解.向偏铝酸盐中通入CO2[Al(OH)3不溶于碳酸]2A1O2- + CO4 3H2O===2Al(OH)3; + CO32-(少量CO2) A1O2—+ COa 2H2O===A1(OH)3; + HCO3(足量CO2) 偏铝酸盐与铝盐反响A13 + + 3A1O2- + 6H2O===4A1(OH)3;【题源信息】a. A13+与A1O2—不能大量共存.b.此反响是一种最节省原料的制备A1(OH)3的方案.4 .铁及其化合物的反响(1)铁单质3Fe+ 2O2 点燃=====Fe3O4Fe+ S^A=====FeS2Fe+ 3C12 点燃=====2FeC133Fe+ 4H2O(g)高温=====Fe3O4 4H2Fe+2H+===Fe2++H2T 〔酸为非氧化性酸〕Fe+ 4HNO3梢===Fe(NO3)3 + NOT + 2H2O就适量) 3Fe+ 8HNO3梢===3Fe(NO3)2+ 2N0? + 4H2O铁过量)Fe+ CuSO4===CU FeSO42FeCl3+Fe===3FeCl2【题源信息】Fe与O2、H2O(g)反响的产物都是Fe3O4而不是Fe2O3 Fe与Cl2反响时生成FeCl3,与S反响时生成FeS,说明Cl2的氧化水平大于S的.常温下,Fe、Al在浓硫酸和浓硝酸中发生钝化,但加热后继续反响.⑵铁的化合物FeCl2 + 2NaOH===Fe(OH) 2 +2NaCl4Fe(OH)2+ O2+ 2H2O===4Fe(OH)32FeCl2+Cl2===2FeCl3Fe3+ + 3SCN- ===Fe(SCN)3FeCl3 + 3H2O佛水)△=====Fe(OH)3(胶体)+ 3HCl(氢氧化铁胶体的制备)Fe2O3・nH203H2O====铁发生吸氧腐蚀生成铁锈【题源信息】①FeCl2溶液与NaOH容液在空气中反响的现象变化,常用于物质推断.向Fe2+溶液中参加硝酸、KMnO4氯水等具有氧化性的物质时,溶液会由现浅黄绿色一棕黄色的颜色变化,该现象可用于Fe2+的初步检验.②制备Fe〔OH〕2的方法很多,原那么有两点,一是溶液中的溶解氧必须提前除去,二是反响过程中必须与02隔绝.③Fe3+的检验方法较多,如观察溶液颜色法〔棕黄色〕、NaOH 溶液法〔生成红褐色沉淀〕、KSCN容液法〔生成红色溶液〕,前面两种方法需溶液中Fe3+浓度较大时才适用,最好也最灵敏的方法是KSCN容液法.Fe2+的检验可采用参加KSCN§液后再参加氧化剂的方法.5 .铜及其化合物的反响〔1〕铜单质的反响①与非金属单质反响2Cu+ O2^ =====2CuO2Cu+ SA =====Cu2SCu+ Cl2 点燃=====CuCl2在潮湿空气中被锈蚀生成铜绿2Cu+ O2+ H2O CO2===Cu2(OH)2CO3②与酸反响Cu+ 2H2SO4侬)△ =====CuSO4 SO2T + 2H2O 3Cu+ 8HNO3梢===3Cu(NO3)2+ 2NOt + 4H2O Cu+ 4HNO3浓)===Cu(NO3)2+ 2NO才 + 2H2O(2)铜的重要化合物①黑色氧化铜高温分解生成红色氧化亚铜4CuOS温=====2Cu2Q 02T②蓝色硫酸铜晶体受热分解生成白色无水硫酸铜粉末CuSO4 5H28=====CuSO45H2O【题源信息】铜作为不活泼金属的代表,高考常考查:a.铜单质的化学性质;b.铜的化合物在反响中的颜色变化;c.CuSO4- 5H2O<不同温度条件下分解反响的简单计算.⑵①4H2+ Fe3O4高温=====3Fe+ 4H2O.其他铁的氧化物反应也可)②2Fe2+ + HCia H+ ===2Fe3+ + C1-+ H2O (3)稀硫酸、KMnO殆液取适量D固体于小烧杯中,再向烧杯中参加适量稀硫酸使固体完全溶解,将所得溶液滴入盛有KMnO特液的试管中,KMnO始液褪色【题型解读】此题考查常见无机物的性质及它们之间的转化. 此类试题融根本概念、根本理论及元素化合物等知识于一体, 具有考查知识面广、思维容量大、试题区分度高等特点,考查考生对所学知识进行重组、转换、迁移以解决实际问题的水平、逻辑推理水平和综合分析水平等,一直是高考命题专家的“宠儿〞.解答此类问题的关键是找准“突破口〞,可从物质的特殊颜色、特征性质、特殊反响条件、特殊转化关系(如连续氧化关系、三角关系、置换反响等)、特征数据、工业生产信息等方面进行分析,准确找由“突破口〞,继而完成其他物质的唯断.。
高考化学重要知识点

高考化学重要知识点俗名无机部分:纯碱、苏打、天然碱、碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O熟石膏:2CaSO4·.H2O莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3石灰石、大理石:CaCO3生石灰:CaO食盐:NaCl熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂)烧碱、火碱、苛性钠:NaOH绿矾:FaSO4·7H2O干冰:CO2明矾:KAl (SO4)2·12H2O漂白粉:Ca (ClO)2 、CaCl2(混和物)泻盐:MgSO4·7H2O胆矾、蓝矾:CuSO4·5H2O双氧水:H2O2皓矾:ZnSO4·7H2O硅石、石英:SiO2刚玉:Al2O3水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2 有机部分:氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔)TNT:三硝基甲苯酒精、乙醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
醋酸:冰醋酸、食醋CH3COOH裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HgS
三仙丹
HgO
砷的化合物
白砒、砒霜
As2O3
雄黄、雄精
As4S6
雌黄、砒黄
As2S3
毒砂
FeAsS
硅的化合物
硅胶
mSiO2·nH2O
石英、水晶、玛瑙
SiO2
金刚砂
SiC
泡花碱、水玻璃
Na2SiO3
硫的化合物
大苏打、海波
Na2S2O3·5H2O
硫化碱、臭碱
Na2S·9H2O
硫钡粉
BaS·Sx
漂白粉
CaCl2和Ca(ClO)2
萤石、氟石
CaF2
大理石、石灰石、白垩、方解石
CaCO3
熟石膏、烧石膏、煅石膏
2CaSO4·H2O
生石膏、石膏
CaSO4·2H2O
无水石膏、硬石膏
CaSO4
重钙
Ca(H2PO4)2
普钙
Ca(H2PO4)2和CaSO4
电石
CaC2
钡的化合物
钡白、钡餐、重晶石
BaSO4
银粉
Al
铁的化合物
铁丹、铁红、赤铁矿
Fe2O3
黄铁矿、硫铁矿
(愚人金)FeS2
铁黄、铁锈
Fe2O3·nH2O
铁黑、磁铁矿
Fe3O4
褐铁矿
2Fe2O3·3H2O
菱铁矿
FeCO3
绿矾、黑矾
FeSO4·7H2O
莫尔盐
(NH4)2Fe(SO4)2·6H2O
黄血盐
K4[Fe(CN)6]
赤血盐
K3[Fe(CN)6]
尿素
谷氨酸
硝化甘油
卫生球
蚁醛
HCHO
木精
CH3OH
氯仿
CHCl3
铁矾、铁钾明矾
KFe(SO4)2·12H2O
锌的化合物
菱锌矿
ZnCO3
皓矾、锌矾
ZnSO4·7H2O
铅的化合物
密陀僧、黄丹
PbO
铅丹、红丹、红铅
Pb3O4
铅矾
PbSO4
方铅矿
PbS
锰的化合物
软锰矿
MnO2
菱锰矿
MnCO3
灰锰矿
KMnO4
汞的化合物
甘汞、低汞
Hg2Cl2
升汞、高汞HgCΒιβλιοθήκη 2雷汞Hg(ONC)2
其它无机物
硼砂
Na4B2O7·10H2O
波尔多液
CuSO4、Ca(OH)2
肼、联氨
H2N-NH2
钠汞齐
NaxHgx即钠汞合金
有机化合物
电石气
C2H2
沼气、坑气、天然气
CH4
蚁酸
HCOOH
福尔马林
HCHO(35%~40%的水溶液)
火棉
电木、酚醛树脂
石炭酸
安息香酸
苦味酸
TNT
氟里昂
CCl2F2等
甘氨酸
H2N-CH2-COOH
KNO3
苛性钾
KOH
红矾、红矾钾
K2Cr2O7
铵的化合物
碳铵
NH4HCO3
硫铵、肥田粉
(NH4)2SO4
硝铵
NH4NO3
安福粉
NH4H2PO4(75%)
(NH4)2HPO4(25%)
镁的化合物
菱镁矿
MgCO3
泻盐、苦盐
MgSO4·7H2O
卤盐
MgCl2
钙的化合物
生石灰
CaO
熟石灰、消石灰
Ca(OH)2
锌钡白、立德粉
BaSO4和ZnS
钡垩
BaCO3
铜的化合物
赤铜矿
Cu2O
胆矾、蓝矾
CuSO4·5H2O
辉铜矿
Cu2S
铜绿、孔雀石
Cu2(OH)2CO3
铝的化合物
明矾
KAl(SO4)2·12H2O
冰晶石
Na3AlF6
刚玉、红宝石、蓝宝石
Al2O3
矾土
Al2O3·H2O、Al2O3·3H2O、少量Fe2O3和SiO2
钠的化合物
俗名和别名
主要化学成分
俗名和别名
主要化学成分
小苏打、重碱
NaHCO3
苛性钠、火碱、烧碱
NaOH
苏打、面碱
Na2CO3
芒硝、皮硝、朴硝
Na2SO4·10H2O
口碱、晶碱
Na2CO3·10H2O
无水芒硝、元明粉
Na2SO4
食盐
NaCl
钠硝石、智利硝石
NaNO3
钾的化合物
草碱、钾碱
K2CO3
硝石、钾硝石、火硝、土硝
