兽药进口申请表
2021《进口饲料加工使用存放企业备案申请表(Ι级风险)》

进口饲料加工使用存放企业备案申请表
(Ι级风险)
企业名称
企业注册地址
法人代表联系电话
联系人联系电话
统一社会信用代码
备案类型□加工□使用□存放
企业类别□国营□集体□私营□合资□独资□其他加工使用存放地址
仓库结构、数量及仓容
(年仓储能力)
企业、工厂总人数厂区面积(平方米)
仓库面积(平方米)加工车间面积(平方米)
日加工能力(吨)年加工能力(吨)
生产许可证编号添加剂和添加剂预混合饲料产品批准文号
检
验
技
术
人
员
情
况
姓名技术专业岗位职责
计划进口种类及数量
进境口岸、路线
输出国、生产商及注册号
进口商
申请进口饲料的主要成分饲料主要成分及含量
药物添加剂名称及含量
其它添加剂名称及含量
申请企业承诺
我单位现申请办理进口饲料加工使用存放企业备案,以上申报情况及随附材料准确无误、真实有效。
我单位将严格遵守《中华人民共和国进出境动植物检疫法》及其实施条例、《中华人民共和国进出口商品检验法》及其实施条例、《进出口饲料和饲料添加剂检验检疫监督管理办法》等要求,并接受海关的监督管理。
进口企业(公章):
法人代表(签名):
二○年月日。
进口饲料和饲料添加剂登记申请材料要求

附件1进口饲料和饲料添加剂登记申请材料要求一、登记范围由境外企业生产的、首次向中国境内出口的饲料和饲料添加剂。
我国香港、澳门特别行政区和台湾生产的饲料和饲料添加剂产品参照本要求申请登记。
本要求所指的饲料,是指经工业化加工、制作的供动物食用的产品,包括单一饲料、添加剂预混合饲料、浓缩饲料、配合饲料和精料补充料。
本要求所指的饲料添加剂,是指在饲料加工、制作、使用过程中添加的少量或者微量物质,包括营养性饲料添加剂和一般饲料添加剂。
二、申请材料格式要求(一)申请材料见《进口饲料和饲料添加剂登记申请材料一览表》(表1,以下简称《一览表》)。
(二)申请材料中、英文对照,中文在前,英文在后;我国香港、澳门特别行政区和台湾的登记申请,仅需提供简体中文申请材料。
申请材料一式两份,原件和复印件各一份。
(三)申请材料中的官方证明文件使用生产地官方语言出具,由非英语国家(地区)出具的官方证明文件还应提供英文或中文翻译件。
(四)申请材料原件使用生产企业文头纸出具,由生产企业负责人签字并加盖公章;中文翻译件由中国境内代理机构出具并加盖公章。
规格纸、小三号宋体打印,内容清晰、整洁、无(五)中文翻译件使用A4涂改。
(六)申请材料按《一览表》的顺序装订成册,标注页码并形成目录,各项材料之间使用明显的区分标志。
装订过程中,不得拆分官方证明文件。
(七)前次申请未予批准的,再次提交材料时应当提供《农业部行政审批综合办公办结通知书》复印件,并附修改说明。
(八)材料中不得夹带与申请无关的信息。
三、申请表填写要求《进口饲料和饲料添加剂登记申请表》(表2)使用中、英文对照填写,由申请企业负责人和境内代理机构负责人签字并加盖公章。
(一)商品名称:生产地销售时使用的商品名称和在中国销售时拟使用的中文商品名称。
中文商品名称应简明、易懂,符合中文语言习惯,不得全部使用外文字母、符号、汉语拼音和数字表示。
(二)通用名称:能够反映饲料和饲料添加剂产品的真实属性,符合《饲料标签》(GB 10648)标准规定。
进口兽药管理办法

进口兽药管理办法进口兽药管理办法第一章总则第一条为了保障进口兽药的质量和安全,促进国内兽药产业的健康发展,本办法规定了进口兽药的管理事项。
第二条进口兽药应当符合中国的药品监管法律、法规和标准,经国务院药品监督管理部门批准上市,并严格遵守国际贸易规则。
第三条进口兽药的生产企业应当具有已批准药品生产资质,并符合中国有关药品监管法律和法规的规定。
第四条进口兽药应当按照规定程序和要求进行质量控制和验证,进口商应当对进口兽药进行质量检验和评价。
第五条进口兽药的使用单位应当按照药品注册证明的适应症、用法、用量和注意事项使用,遵守药品不良反应和药品不良事件的上报要求。
第六条国务院药品监督管理部门负责进口兽药的登记、审批、监管和监测工作。
第二章进口兽药的登记和批准第七条进口兽药的登记应当符合以下条件:(一)已在原产国或者地区注册上市,并已取得上市许可或者备案;(二)已经按照中国相关药品监管规定进行注册登记或者批准上市。
第八条进口兽药的申报材料应当包括以下内容:(一)进口兽药注册申请书;(二)产品说明书和标签样本;(三)质量控制文件和质量保证文件;(四)生产企业生产许可证明文件;(五)进口商营业执照和代理合同。
第九条国务院药品监督管理部门应当在法定期限内对进口兽药的注册申请进行审批,并根据评审结果作出批准或者不批准的决定。
第十条进口兽药的注册证明应当包括以下内容:(一)产品名称、规格和型号;(二)生产企业名称、地址和生产许可证号码;(三)申请人名称、地址和许可证号码;(四)适应症、用法、用量和注意事项;(五)有效期和储存条件;(六)不良反应和药品不良事件报告要求。
第三章进口兽药的质量控制和验证第十一条进口兽药应当按照规定程序和要求进行质量控制和验证,进口商应当对进口兽药进行质量检验和评价。
第十二条进口兽药的质量控制应当符合以下规定:(一)生产企业应当按照中国和国际标准要求进行质量管理,并建立健全质量管理体系;(二)进口商应当按照药品登记证明、质量标准和相关法律法规和标准的规定对进口兽药进行质量检验和评价;(三)进口商应当建立兽药样品库并建立兽药品质追溯体系。
进口饲料和饲料添加剂登记申请表
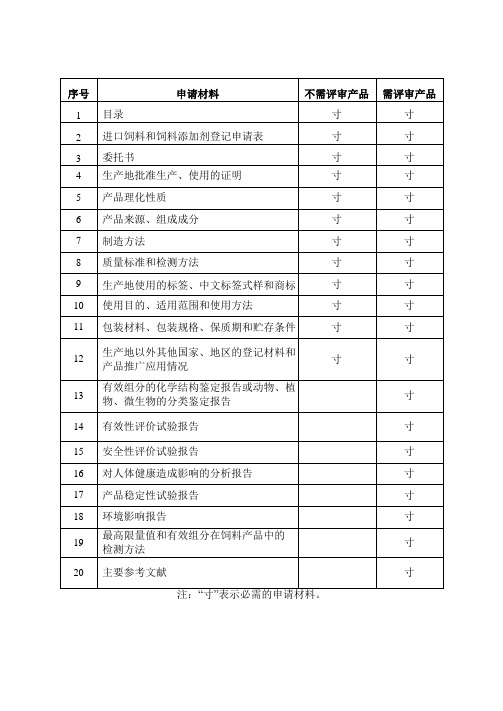
注:“寸”表示必需的申请材料。
注:“寸”表示必需的申请材料。
进口饲料和饲料添加剂登记申请表(示范文本)流水号Applicant Form for Registration of Import Feed or FeedAdditives-Sample1.境内代理机构应当如实向农业农村部提交有关材料,对翻译材料的准确性负责。
2.境外企业、境内代理机构隐瞒有关情况或者提供虚假材料的,按照《进口饲料和饲料添加剂登记管理办法》第二十九条规定承担相应的法律责任。
1.The domestic agent should submit the genuine documents to the MOA and take full responsibility for the accuracy of the translations.2.According to Article 29 of the Measures for the Administration of Registration of Import Feed and Feed Additives, foreign company and domestic agent have to bear corresponding legal liabilities if they hide relevant information on purpose or provide forged documents.进口饲料和饲料添加剂续展登记申请表(示范文本)流水号Applicant Form for Re-registration of Import Feed and FeedAdditives-Sample变更原因:(说明变更原因) Reasons for Alteration境内代理机构负责人签字: Signature of Domestic Agent盖章:(Seal )1.境内代理机构应当如实向农业农村部提交有关材料,对翻译材料的准确性负责。
进口兽药注册(兽药注册)申请表

流水号:进口兽药注册(兽药注册)申请表申请单位:申请日期:中华人民共和国农业部制填表说明1.通用名称:应当使用正式颁布的兽药国家标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
申报复方制剂或者中兽药制剂自拟兽药名称的,应当预先进行兽药名称核查工作。
2.英文名称/拉丁名:英文名填写INN英文名;中兽药制剂没有英文名的,可以免填;申报中药材的需提供拉丁名。
3.品种类别:按照《兽药注册资料要求》填写。
4.是否特殊管理兽药:属于兽用麻醉药品、精神药品、医疗用毒性药品、放射性药品管理办法管理的特殊药品,应分别选填。
5.专利:所申请兽药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利信息均应填写。
本项申请实施了其他专利权人专利的,应当注明是否得到其实施许可。
已知有外国专利的,注明专利权人。
6.已获准上市的国家(地区):系指该申请人申请的兽药被境外兽药管理机构批准上市情况。
应填写上市国家或地区名称、批准日期、注册号。
已在多个国家或地区上市的应逐一填写。
7.本项内容是各申请机构对于本项申请符合法律、法规和规章,以及注册资料、数据、样品真实性、合法性等的郑重保证,各申请机构应当一致同意。
8.其他特别申明事项:需要另行申明的事项。
9.生产企业相关信息:生产企业是指具备本产品生产条件,申请生产本产品并提供质量复核用样品的生产企业,生产地址应填写生产本产品的地址,不应填写总部地址。
10.兽药注册代表/代理机构:机构名称后的“○代表机构○代理机构”选项必须选填一项,不得空填。
兽药注册代理机构名称、公章、法定代表人签名、签名日期:兽药注册代理机构在此由法定代表人签名、加盖机构公章。
在注册申请过程中联系人发生变更,请及时与相关机构人员联系,以免不能及时获得信息,耽误注册。
11.申请单位:应当填写境外制药厂商(持证公司)的名称。
若申请单位与生产企业信息相同,也应当逐项填写。
如有国外包装的,也应增加填写。
进口药材申请表

相关证件:1.《营业执照》编号:****许可证》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
注册申请负责人:****签名:****职位:****
电话(含区号及分机号):****传真:****
21.机构(国外加工企业):****□本机构负责缴费
名称:****
组织机构代码:****
相关证件:《营业执照》编号:****
法定代表人:****职位:****
注册地址:****邮政编码:****
生产地址:****邮政编码:****
联系人:****电话:****
XXXXXX
申明
22.我们保证:①本申请遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《进口药材管理办法》等法律、法规和规章的规定;②申请表内容及所提交资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本药品所采用的方法和由本药品得到的试验数据;③一并提交的电子文件与打印文件内容完全一致。
8.出口地(国家):****
9.申请进口数量(公斤):****
10.包装材料:****
11.包装规格:****
12.合同号:****
13.检验标准:〇中国药典版
〇进口药材质量标准,标准来源
〇部颁药材标准,标准来源
〇省、自治区、直辖市药材标准,标准来源____________
〇自拟药材质量标准(仅限于无法定标准进口药材)
国家食品药品监督管理局
进口药材申请表
申请编号:XXXXXXXXX
申请事项
1.申请分类:〇首次进口药材:〇已有法定标准药材〇无法定标准药材
云阳县县外调入动物(产品)申请表

附件2:云阳县县外调入动物(产品)申请表入地乡镇畜牧兽医站各执一份。
附件3:中国动物卫生监督县外调入动物隔离观察通知书(年第号):你(单位)从省市县引进的动物,共计(大写)头(只),《重庆市动物调运备案单》编号为,《动物检疫合格证明(证)》编号为,于年月日时到达隔离观察场所,经我站、等名动物检疫监督人员现场检查,符合隔离观察要求,现通知你,自本日起至年月日止共日,为隔离观察期,请你采取以下防疫措施:一、严禁移出该批动物或调入其他动物混群饲养;二、安排专人饲养和观察该批动物的健康状况,并填写《县外调入动物隔离观察日志》;三、发现规定动物疫病()临床症状,立即向我站报告。
发现其他疾病,及时进行救治;四、对隔离观察圈舍及周边道路每周进行一次消毒;五、接受我站及县动物卫生监督所的定期监督检查。
本通知一式两份,一份送申请人,一份存档。
特此通知乡镇畜牧兽医站(签章)年月日附件4:县外调入动物隔离观察日志察内容”栏签署检查意见。
2、本页为日志首页,次页以后格式仅有“隔离观察日记录”及其以下部分。
附件5:中国动物卫生监督县外调入动物隔离观察解除通知书:你(单位)从省市县引进的动物,共计(大写)头(只),《重庆市动物调运备案单》编号编号为,《动物检疫合格证明(证)》编号为,于年月日时到达隔离观察场所,并按照我站下达的《县外调入动物隔离观察通知书》(编号为年第号)要求完成隔离观察任务,经我站、等名动物检疫监督人员现场检查,隔离观察合格,现予以解除隔离观察,可以投入正常生产。
本通知一式两份,一份送申请人,一份存档。
特此通知乡镇畜牧兽医站(签章)年月日附件6:县外调入动物隔离观察结果备案表注:本表一式二份,一份本站备存,一份送县动物卫生监督所。
云阳县县外调入动物(动物产品)告知书1、调运人从县外调入动物、动物产品,在调运前必须向所在地乡镇畜牧兽医站提出申请,经乡镇站审核同意,报市(县)动物卫生监督所审批同意,缴纳该批动物(动物产品)的疫病防控风险责任金元,方可调入。
兽药注册申请表

兽药注册申请表申请单位(盖章):__________________________申请日期:_________ 年____ 月 ____ 日受理日期:_________ 年____ 月 ____ 日中华人民共和国农业部制填表说明1申请分类:境内企业申请新兽药注册填写境内生产兽药申请;属进口兽药或中国香港、澳门和台湾生产的,选填进口兽药申请。
2.注册分类:按照《兽药注册资料要求》的注册分类填写,未列入上述附件的注册事项,选“其他”,并应当简要填写注册事项。
3.兽药名称:应当使用正式颁布的兽药国家标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
申报复方制剂或者中兽药制剂自拟兽药名称的,应当预先进行兽药名称核查工作。
4.英文名/拉丁名:英文名填写inn英文名;中兽药制剂没有英文名的,可以免填;申报中药材的需提供拉丁名。
5.汉语拼音:均需填写,注意正确区分字、词。
6.化学名:应当以文字正确表达药物活性物质的化学结构,不要采用结构式。
7.其他名称:系指曾经作为兽药通用名称使用,但经国家规范的兽药通用名称取代者。
8商品名称:申请人为方便其兽药上市销售而申请使用的商品名称。
进口兽药可同时填写英文商品名称。
9.兽药名称来源:来源于中国兽药典、部颁标准的,选填兽药国家标准;来源于国家药典委员会的,选填国家药典会;来源于文献的,选填文献;属申请人按有关命名原则自行命名的,选填自拟。
10.非制剂:根据本品类型进行选择。
其中“有效成份”系指中药或者天然药物的有效成份。
不属所列类型,选“其他”,并应简要填写所属类型。
11.制剂:在“剂型”后填写所属剂型;剂型属于《中国兽药典》选《中国兽药典》剂型;属《中国兽药典》现行版未收载的剂型,选新剂型,进口药品同时填写剂型的英文。
规格:填写本制剂的规格,使用公制单位符号。
每一份申请表只能填写一个规格。
12.包装规格:指一个最小销售单元里包装的完整制剂的个数,如X片/瓶,x支/盒。
进口兽药兽药再注册申请表

进口兽药/兽药再注册申请表申请单位(盖章):申请日期:年月日中华人民共和国农业部制填表说明1.申请进口兽药/兽药再注册,应当填写本表。
进口兽药再注册,指国外生产的兽药,兽药再注册范围指香港、澳门和台湾地区生产的兽药。
2.项目1“兽药分类”,按本品的种类选择对应项目,如不包含在可供选择的项目中,请在“其他”项目中写明具体分类。
3.项目2、3、7、8、9、10、11、12、15按本品的兽药批准证明文件及其附件内容填写。
4.项目4“其他名称”,系指曾经作为本品的兽药名称使用,但现在已被正式颁布的兽药国家标准或者《中国药品通用名称》及其增补本收载的药品通用名称取代者。
5.项目6“非制剂”,应当根据本品类型进行选择。
其中“有效成份”系指中药或者天然药物的有效成份。
不属所列类型,选“其他”,并应简要填写所属类型。
7.项目7中“规格”,应当根据进口兽药注册证书号或兽药注册证书号填写其对应规格,使用同一进口兽药注册证书号或兽药注册证书号的所有规格填写在一张申请表内。
8.项目8中“包装规格”指一个最小销售单元里包装的完整制剂的数量,如:×片/瓶,×支/盒。
使用同一进口兽药注册证书号或兽药注册证书号的所有包装规格填写在一张申请表内。
9.项目13,在兽药批准证明文件的本次有效期内,变更过兽药处方、生产工艺、制剂所用化学原料药生产厂、兽药标准或者说明书的,请据实选择。
10.项目14,在兽药批准证明文件的本次有效期内,如果申报过变更注册申请或者其他形式的变更申请,应在其下简要填写历次申报情况。
其中“变更注册申请事项或其他变更申请”应简要填写其事项,“申请号”为该次申请资料的申请编号,“批件编号”为该次申请的批准文件编号,未批准时,填写未批准,在审批。
11.项目15-18,申请人:机构1,对于新兽药申请是指具备本产品生产条件,申请生产本产品并提供质量复核用样品的生产企业;尚不具备生产条件或尚未确定本产品生产企业的,填中试样品委托生产企业。
兽药注册申请表【模板】

兽药注册申请表申请单位(盖章):申请日期:年月日中华人民共和国农业部制填表说明1.申请分类:境内企业申请新兽药注册填写境内生产兽药申请;属进口兽药或中国香港、澳门和台湾生产的,选填进口兽药申请。
2.注册分类:按照《兽药注册资料要求》的注册分类填写,未列入上述附件的注册事项,选“其他”,并应当简要填写注册事项。
3.兽药名称:应当使用正式颁布的兽药国家标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
申报复方制剂或者中兽药制剂自拟兽药名称的,应当预先进行兽药名称核查工作。
4.英文名/拉丁名:英文名填写INN英文名;中兽药制剂没有英文名的,可以免填;申报中药材的需提供拉丁名。
5.汉语拼音:均需填写,注意正确区分字、词。
6.化学名:应当以文字正确表达药物活性物质的化学结构,不要采用结构式。
7.其他名称:系指曾经作为兽药通用名称使用,但经国家规范的兽药通用名称取代者。
8.商品名称:新兽药注册无商品名称,进口兽药可同时填写英文商品名称。
9.兽药名称来源:来源于中国兽药典、部颁标准的,选填兽药国家标准;来源于国家药典委员会的,选填国家药典会;来源于文献的,选填文献;属申请人按有关命名原则自行命名的,选填自拟。
10.非制剂:根据本品类型进行选择。
其中“有效成份”系指中药或者天然药物的有效成份。
不属所列类型,选“其他”,并应简要填写所属类型。
11.制剂:在“剂型”后填写所属剂型;剂型属于《中国兽药典》,选《中国兽药典》剂型;属《中国兽药典》现行版未收载的剂型,选新剂型,进口药品同时填写剂型的英文。
规格:填写本制剂的规格,使用公制单位符号。
每一份申请表只能填写一个规格。
12.包装规格:指一个最小销售单元里包装的完整制剂的个数,如×片/瓶,×支/盒。
每一份申请表可填写多个包装规格。
13.有效期:本品种的有效期,以月为单位填写。
14.处方内药物活性成份或者中药药味:应当使用规范的药物活性成份或者中药材、中药饮片名称,同时应当填写按1000制剂单位计算的处方量。
兽药进口管理办法(2022年修订)

兽药进口管理办法(2022年修订)文章属性•【制定机关】农业农村部•【公布日期】2022.01.07•【文号】农业农村部令2022年第1号•【施行日期】2022.01.07•【效力等级】部门规章•【时效性】现行有效•【主题分类】畜牧业正文兽药进口管理办法(2007年7月31日农业部、海关总署令第2号公布,2019年4月25日农业农村部令2019年第2号、2022年1月7日农业农村部令2022年第1号修订)第一章总则第一条为了加强进口兽药的监督管理,规范兽药进口行为,保证进口兽药质量,根据《中华人民共和国海关法》和《兽药管理条例》,制定本办法。
第二条在中华人民共和国境内从事兽药进口、进口兽药的经营和监督管理,应当遵守本办法。
进口兽药实行目录管理。
《进口兽药管理目录》由农业农村部会同海关总署制定、调整并公布。
第三条农业农村部负责全国进口兽药的监督管理工作。
县级以上地方人民政府兽医主管部门负责本行政区域内进口兽药的监督管理工作。
第四条兽药应当从具备检验能力的兽药检验机构所在地口岸进口(以下简称兽药进口口岸)。
兽药检验机构名单由农业农村部确定并公布。
第二章兽药进口申请第五条兽药进口应当办理《进口兽药通关单》。
《进口兽药通关单》由中国境内代理商向兽药进口口岸所在地省级人民政府兽医主管部门申请。
申请时,应当提交下列材料:(一)兽药进口申请表;(二)代理合同(授权书)和购货合同复印件;(三)工商营业执照复印件;兽药生产企业申请进口本企业生产所需原料药的,提交工商营业执照复印件;(四)产品出厂检验报告;(五)装箱单、提运单和货运发票复印件;(六)产品中文标签、说明书式样。
申请兽用生物制品《进口兽药通关单》的,还应当向兽药进口口岸所在地省级人民政府兽医主管部门提交生产企业所在国家(地区)兽药管理部门出具的批签发证明。
第六条兽药进口口岸所在地省级人民政府兽医主管部门应当自收到申请之日起2个工作日内完成审查。
审查合格的,发给《进口兽药通关单》;不合格的,书面通知申请人,并说明理由。
进口饲料和饲料添加剂申请资料要求【模板】

附件1:进口饲料和饲料添加剂申请资料要求(征求意见稿)一、申请范围由境外企业生产的、首次在中国境内销售和使用的饲料和饲料添加剂。
我国香港、澳门特别行政区和台湾省生产的饲料和饲料添加剂产品依照本要求申请登记。
《饲料和饲料添加剂管理条例》所称饲料,是指经工业化加工、制作的供动物食用的产品,包括单一饲料、添加剂预混合饲料、浓缩饲料、配合饲料和精料补充料。
《饲料和饲料添加剂管理条例》所称饲料添加剂,是指在饲料加工、制作、使用过程中添加的少量或者微量物质,包括营养性饲料添加剂和一般饲料添加剂。
进口饲料和饲料添加剂应当遵循安全、有效的原则,并符合生产地和中国相关法律法规和技术标准要求。
生产地未批准生产、使用或禁止生产、使用的饲料、饲料添加剂,不予登记。
二、申请资料的格式要求(一)申请资料包括《进口饲料和饲料添加剂登记申请表》(见表1,以下简称《申请表》)和申请材料(具体内容见表2《进口饲料和饲料添加剂申请材料一览表》,以下简称《申请材料一览表》),如果申请产品为中华人民共和国尚未允许使用的饲料或饲料添加剂,或者属于《进口饲料和饲料添加剂登记管理办法》中规定的特殊情形,需要经过全国饲料评审委员会组织专家进行评审通过后方可进行登记。
(二)申请资料要求中、英、外文对照,中文在前,英文在次、外文在后。
如生产国为非英语语种国家,还应附具本语种登记材料,材料须翻译为英文或中文,翻译文件应当由中国境内公证机关公证,确保与原文内容一致。
所有申请资料一式两份,原件和复印件各一份。
(三)外文登记材料原件要求用生产厂家的文头纸出具,并由负责人签字或者加盖公章;翻译件由代理机构文头纸出具并加盖公章。
(四)中文登记材料应使用A4规格纸、小三号宋体打印,内容完整,不得涂改。
(五)申请资料中不应夹带与申报产品无关的信息。
(六)申请资料首页为目录,整套资料应按《申请资料一览表》的顺序打孔装订成册并标注页码;申请资料一共分为十三项,各项资料之间应当使用明显的区分标志,并标明各项资料名称及在目录中的序号;官方证明文件或公证文件不得随意拆分装订。
进口种畜禽资质申请书模板

尊敬的审批部门:您好!我司拟申请进口种畜禽资质,特此提交申请。
以下是我司关于进口种畜禽资质的详细申请内容:一、企业基本情况我司成立于xx年xx月,注册地为xx省xx市xx区,主要从事畜牧业生产、加工和销售。
企业占地面积xx亩,拥有现代化的养殖设施和专业的技术团队。
我司已通过ISO9001质量管理体系认证、ISO14001环境管理体系认证,具备良好的生产和质量管理能力。
二、进口种畜禽目的1. 引进优质种畜禽,提高我国畜牧业生产水平,促进农业产业结构调整。
2. 丰富我国畜禽遗传资源,提高畜禽抗病力和适应性。
3. 满足市场需求,提高农民收入。
4. 推动我国畜牧业与国际接轨,提升国际竞争力。
三、进口种畜禽种类和来源1. 种类:拟进口优质肉鸡、肉猪、奶牛等种畜禽。
2. 来源:拟从荷兰、丹麦、法国等具有高品质种畜禽生产能力的国家的知名牧场和养殖企业引进。
四、进口种畜禽质量保障措施1. 严格筛选进口种畜禽,确保品种优良、健康无病。
2. 建立健全进口种畜禽的饲养、管理和防疫制度,确保种畜禽生长环境和健康状况。
3. 定期对种畜禽进行疫病检测和监测,确保种畜禽群体健康。
4. 加强对种畜禽饲养人员的培训,提高饲养管理水平。
五、进口种畜禽的运输和储存1. 运输:采用专业冷链运输车辆,确保种畜禽在运输过程中温度稳定、安全抵达。
2. 储存:在目的地设置专用冷库,确保种畜禽在储存期间保持适宜的温度和湿度。
六、进口种畜禽的用途和销售渠道1. 用途:进口种畜禽主要用于我司的养殖场饲养和繁殖。
2. 销售渠道:进口种畜禽的产品主要通过我司的自营渠道和合作企业进行销售。
七、申请材料1. 企业法人营业执照副本复印件。
2. 组织机构代码证复印件。
3. 税务登记证复印件。
4. 养殖场土地使用权证复印件。
5. 养殖场设施设备清单及照片。
6. 专业技术人员资格证书复印件。
7. 种畜禽引进计划和销售渠道说明。
8. 种畜禽质量保障措施和疫病防控制度。
兽药进口审批

流水号:
兽药进口申请表
(示范文本)
申请单位(盖章):XXXXXXXXXX公司
申请日期:XXXX 年XX 月XX 日
中华人民共和国农业农村部制
填表说明
1. 本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式一份。
字迹不清、项目填写不全者不予受理。
2. 本表由申请单位填写、提供资料。
3. 报关口岸填写本省份或本地区的最大报关关区,如北京市,填写“北京关区”。
4. 如无商品编码,申请人在该栏填写英文状态写的反斜杠“/”。
5. 进口兽药资料一览表中兽药规格即“规格”字段填写时,需严格按照规定格式填写,格式为:“值+单位”,值必须写在前面,如250ml/瓶。
6. 进口兽药资料一览表填写时需要将不同的兽药批号对应信息分开填写,不要将所有的兽药批号填写在一个单元格内。
7. 本表签章复印件无效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.பைடு நூலகம்请单位资料
名 称
地 址
邮 编
联 系 人
联系电话
2.进口性质
3.进口日期
4.进口口岸
5.进口兽药资料
兽药名称
(中英文)
规格
单位
数量
生产厂(公司)(中英文)
进口兽药注册证书号
6.行政审批意见
审核: 审批:
盖章 年 月 日
7.有效期
自 年 月 日至 年 月 日
8.备注
兽药进口申请表
申 请 单 位(盖章):
申 请 日 期:年月日
受 理 日 期:年月日
中华人民共和国农业部制
填 表 说 明
1. 本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。字迹不清、项目填写不全者不予受理。
2. 本表1~5栏由申请单位填写、提供资料。
3. 6~8栏由农业部填写。
4. 本表签章复印件无效。
