人教版高中化学必修二课件化学键(1)
合集下载
人教版高中化学必修二课件:1.3.1离子键

式:
2Na+Cl2 2NaCl。
目标导航 预习引导
根据钠原子和氯原子的核外电子排布,钠原子要达到 8 电子的稳定 结构,就要失去 1 个电子;而氯原子要达到 8 电子的稳定结构,则需要获 得 1 个电子。钠和氯气反应时,钠原子的最外电子层上的 1 个电子转移 到氯原子的最外电子层上,形成带正电的钠离子和带负电的氯离子。带 相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成氯化 钠。人们把这种带相反电荷离子之间的相互作用称为离子键。由离子 键构成的化合物称为离子化合物。通常,活泼金属和活泼非金属形成离 子化合物。
括起来,并在括号的右上方标明“+”“-”及所带电荷数。
H
··
··
例如[H··N··H]+(铵根离子)、[∶O∶H]-等。
··
··
H
5.用电子式表示离子化合物的形成过程:
MgCl2:
问题导学 当堂检测
要点提示:①用电子式表示离子化合物和用电子式表示离子化合 物的形成过程是不同的。
②反应物要用原子的电子式表示,而不是用分子式或分子的电子 式表示;生成物中“同类项”,只能分写,不能合并。
第三节 化学键
第 1 课时 离子键
目标导航 预习引导
1.通过实验的演示及对离子键形成过程中的讨论,理解离子键和离子化合 物的概念。 2.学会用电子式表示离子键、离子化合物及其形成过程。 离子键的概念和电子式的书写。
目标导航 预习引导
1.离子键及其形成过程 写出钠和氯的原子结构示意图和金属钠与氯气反应的化学方程
NaCl+NaClO+H2O
问题导学 当堂检测
2.氯化钠的形成
问题导学 当堂检测
钠与氯气反应时,由于钠的金属性很强,在反应中容易失去一个电 子而形成 8 电子稳定结构;而氯的非金属性很强,在反应中容易得到一 个电子而形成 8 电子稳定结构。当钠原子和氯原子相遇时,钠原子最外 层的一个电子转移到氯原子的最外层上,使钠原子和氯原子分别形成 了带正电荷的钠离子和带负电荷的氯离子。这两种带相反电荷的离子 通过静电作用,形成了氯化钠。
2Na+Cl2 2NaCl。
目标导航 预习引导
根据钠原子和氯原子的核外电子排布,钠原子要达到 8 电子的稳定 结构,就要失去 1 个电子;而氯原子要达到 8 电子的稳定结构,则需要获 得 1 个电子。钠和氯气反应时,钠原子的最外电子层上的 1 个电子转移 到氯原子的最外电子层上,形成带正电的钠离子和带负电的氯离子。带 相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成氯化 钠。人们把这种带相反电荷离子之间的相互作用称为离子键。由离子 键构成的化合物称为离子化合物。通常,活泼金属和活泼非金属形成离 子化合物。
括起来,并在括号的右上方标明“+”“-”及所带电荷数。
H
··
··
例如[H··N··H]+(铵根离子)、[∶O∶H]-等。
··
··
H
5.用电子式表示离子化合物的形成过程:
MgCl2:
问题导学 当堂检测
要点提示:①用电子式表示离子化合物和用电子式表示离子化合 物的形成过程是不同的。
②反应物要用原子的电子式表示,而不是用分子式或分子的电子 式表示;生成物中“同类项”,只能分写,不能合并。
第三节 化学键
第 1 课时 离子键
目标导航 预习引导
1.通过实验的演示及对离子键形成过程中的讨论,理解离子键和离子化合 物的概念。 2.学会用电子式表示离子键、离子化合物及其形成过程。 离子键的概念和电子式的书写。
目标导航 预习引导
1.离子键及其形成过程 写出钠和氯的原子结构示意图和金属钠与氯气反应的化学方程
NaCl+NaClO+H2O
问题导学 当堂检测
2.氯化钠的形成
问题导学 当堂检测
钠与氯气反应时,由于钠的金属性很强,在反应中容易失去一个电 子而形成 8 电子稳定结构;而氯的非金属性很强,在反应中容易得到一 个电子而形成 8 电子稳定结构。当钠原子和氯原子相遇时,钠原子最外 层的一个电子转移到氯原子的最外层上,使钠原子和氯原子分别形成 了带正电荷的钠离子和带负电荷的氯离子。这两种带相反电荷的离子 通过静电作用,形成了氯化钠。
高中化学必修二1-3化学键 课件(共16张PPT)

(4)
(2)(2) 和(6) 质量数相等,但不能互称
同位素。
(3)(3) 和(4) 的中子数相等,但质子数 不相等,所以不是同一种元素。
氯的原子序数为17, 3517Cl是氯的一种
核素,下列说法正确的是 BD
A、 3517Cl原子所含的质子数为18
B、1/18mol的1H35Cl分子所含中子数 约为NA个
概念辨析 元素:具有相同核电荷数的同一类
原子的总称。 核素:具有一定数目质子和一定数
目中子的原子。
同位素:质子数相同而中子数不同 的不同原子的互称。
同素异形体:有相同元素组成不同 形态的单质。O3和O2
课堂练习
2142在 M((g11、))63((Li51、))(73和2(L)i5、)174(N互、61)为64(同3C)位中2131素N:a。、
核 组卷网
素
原子的组成
原子核
学科网
原子核由质子和中子组成
核外电子
原子的质量 取决于 原子核
质量数:
质量数(A) = 质子数(Z) + 中子数(N)
表示原子的通式为
A Z
X
质量数
234 92
U
表示一个质量数为234,院用放射性同位素 12553I 治疗肿瘤该同位素原子核内的中子数
C、3.5g35Cl2的体积约为2.24L
D、35Cl2气体的摩尔质量为70g/mol
1375CCl: 34.966 含量:75%
3177CCl: 36.969 含量:25%
问题:
Cl:35.5
35 17
Cl中的35表示:
35 17
Cl原子的质量数
,
Cl中的34.966表示:
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
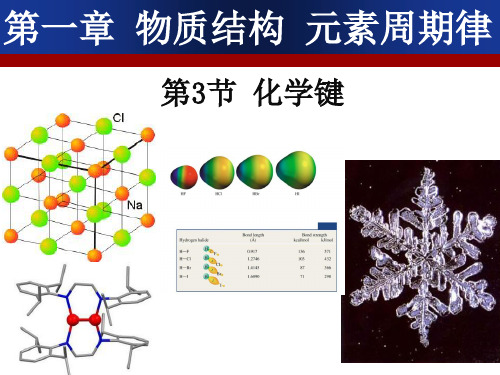
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
人教版高中化学必修二1-3化学键上课

一.离子键 使阴、阳离子结合成化合物的静电作用 (1)定义: ①成键方式 电子得失 ②成键微粒: 阴、阳离子 ③相互作用: 静电作用(静电引力和斥力) (2)离子化合物:含有离子键的化合物
①从元素间的相互化合分析
活泼的金属元素(IA、IIA)和活泼的非金 属元素(VIA、VIIA)之间形成的化合物
H· Na · · · Mg · · Ca · · · O· · · · · Cl · · · · ·
②阳离子的电子式 简单阳离子的电子式就是它的离子符号: H+、Na+、Ca2+。复杂阳离子(NH4+)例外 ③阴离子的电子式: 画出最外层电子数,还要用中括号“[ ]” 括起来,并在右上角标出所带电荷“n· -”
(2)用电子式表示离子化合物的形成过程
NaCl:
Na
Cl
Na Cl
用电子式表示离子化合物氯化镁的形成过程
MgCl2: Cl Mg
Cl
Cl Mg
2
Cl
[课练]用电子式表示下列离子化合物的形成过程
K2S:
K
S
KKS2-来自KMgBr2: Br
Mg
Br
Br Mg
2
Br
[ 练习]
1.用电子式表示下列离子化合物的形成过程 MgO、BaCl2、Na2S · · · 2+ [:· ]2· · · · → Mg Mg + O O: · · · ·
· 2· :: [ O ] · · · · : : [ Cl ] · ·
④离子化合物的电子式:
· · +[ : : Na Cl ] · · AB型
· - 2+ · · · [ : : Ca [ : : Cl ] Cl ] · · · · AB2型
高中化学必修二第一章 第三节化学键 课时1 离子键和共价键(共59张PPT)

•
下列有关离子化合物的说法正确的
是( )
• A.离子化合物一定易溶于水
• B.离子化合物由非金属元素和金属元素共
同组成
• C.熔融状态下能够导电的物质,一定是离
子化合物
• D.离子化合物在晶体状态下有离子存在,
但不导电
【解析】 离子化合物不一定易溶于水,如 AgCl、BaSO4等;离子化合物不一定由非金 属元素和金属元素共同组成,如NH4Cl等铵 盐全部由非金属元素组成;熔融状态能导电 的物质,不一定是离子化合物,如金属单质; 离子化合物由阴、阳离子构成,在晶体状态 下,离子不能自由移动,故不能导电。
• 【答案】 D
• 4.氯化钠是日常生活中人们常用的调味品。 在下列事实中,可以证明NaCl中一定存在离 子键的是( )
• (3)证明某化合物一定存在离子键的方法是看在熔融 状态下能否导电。
• 3.离子化合物
• (1)定义:由离子键构成的化合物叫做离子化 合物。
• (2)构成微粒:阴离子、阳离子。
• (3)主要物理性质:熔、沸点较高,硬度较大。
• (4)导电性:固态时不导电,溶于水或受热熔 化后导电。
• (5)溶解性:大多数离子化合物易溶于水,难 溶于汽油、苯、四氯化碳等有机溶剂。
子化合物 • C.离子化合物一定能导电 • D.只有在活泼金属元素和活泼非金属元素
化合时,才能形成离子键
• 【解析】 正确理解离子键和离子化合物的 内涵和外延才能解答本题。
• A项,离子键是指阴、阳离子间的静电作用, 包括引力和斥力二者的平衡;B项,离子键 形成的只能是离子化合物;C项,离子化合 物在熔融状态或水溶液里才能导电,D项NH 与活泼非金属元素之间也可形成离子键。
人教版高中化学必修2:第三节 化学键(1)

谢谢大家!
1.下列用电子式表示离子化合物的形成过程正确的
是 (A)
A K O K K [ O ]2 K B Cl Ba Cl [ Cl] [ Ba]2[ Cl]
C F Mg D K Cl
F
Mg 2 [ F ]2
K Cl
用电子式表示溴化钙的形成过程
ቤተ መጻሕፍቲ ባይዱ
→ :B··r
··
·+
·Ca·+
.
B····r :
[:B·r·:]··
Ca2+[:B·r·:]··
用电子式表示下列物质的形成过程
K 2O MgBr2 CaF2 BaCl2
书写要点
1.左边是原子的电子式,右边是化合物的电子式; 2.阴离子要用方括号括起来,离子须标明电荷 3.用箭头标明电子转移方向 4.箭头左右边相同的原子或离子不可以合并写 5.不能把“→”写成“=”。
新课标人教版化学必修Ⅱ
第一章 第三节化学键(第一课时)
微视频学习情况反馈
表现优秀的学生: 贾依霏、庄龙行、汪海毓、 李曼禾、蔡江涛、邓洋洋、 杨文婷、江淼。
微视频学习情况反馈
存在的问题:
1、大部分学生离子化合物的判断不准确,没 有掌握判断的技巧。
2、对离子和原子认识不清,电子式书写不正 确。
3、个别学生对常见的1—18号元素的原子的 最外层电子数记忆不准确。
作业一、下列物质中是离子化合物的有:
1、H2O 4、CaS
7、Na2O 10、CaF2 13、NH3 16、Mg3N2
2、CaCl2 5、H2SO4 8、 NaH
11、NH4Br 14 、 CO2
3、KOH
6、 Na2O2 9、 Na2SO4 12、 K2CO3 15、 Na3N
高中化学必修二课件-1.1元素周期表26-人教版

①③原阴子离的子电的子电式子:式
②阳离子的电子式:
:④离子化合物由的阴电、子阳式离:子的电子式组成。同性不相邻,离子合理分布,
相同离子不能合并。主要有AB型、A2B型、AB2型、A2B2型等。例如: NaCl、MgCl2、CaF2、Na2O、NaOH、 Na2O2等。
第三节 化学键
一、离子键 1、离子键:(1)—(7)
NaCl的微观形成过程和微观分析
e-
第三节 化学键
一、离子键
1、离子键 (1)形成原过子程得:、失电子形成阴、阳离子,阴、阳离子接近至一定距离时,
静电引力与斥力达到平衡,形成了离子键。
(2)离子键的定义:
使阴阳离子形成化合物时的静电的作用叫离子键 。
【思考】1、形成离子键的微粒是什么? 阴、阳离子
质量守恒定律,该式反映了化学反应的本质,既有新的化学键形成。
【学生活动】用电子式分别表示MgO、KF、MgCl2、K2S的形成过程(练习书写并分 组讨论,相互对照并纠错)
第三节 化学键
一、离子键 1、离子键:(1)—(7)
2、离子化合物: (1)—(2) 3、电子式及其应用
【学生活动】 自主学习:对照《新教材新学案》, 明确学习任务,探究、分析、讨论、 总结电子式的相关知识点。
元素周期表
问题导学
从元素周期表我们可以看出,到目前为止,已经发现了一百 多种元素,由这一百多种元素的原子组成了成千上万种物质。 【设问】1、物质是由哪些微粒构成的呢?
分子、原子或离子 2、元素的原子是通过什么作用相互结合构成物质的呢? 通过某种力的作用相互结合构成物质。这就是化学键,把这 种原子间的强烈的相互作用,叫做化学键。
号[ ]括起来,并在右上角标出正电荷数(n+)。例如:NH4+(有配位键) 。
高中化学人教版必修二《1.3.3化学键——分子间作用力、氢键》课件

相互作用的大小不同
四、分子间作用力和氢键
1、分子间作用力 定义: 把分子集合在一起的作用力叫做分子间作
用力(也叫范德华力)。
(1)分子间作用力比化学键弱很多,是一种柔弱的相互作用,它主 要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金 属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范畴很小(一样是300-500pm),只有分子间 的距离很小时才有。
(4)一样来说,对于组成和结构类似的物质,相对分子 质量越大,分子间作用力越大,物质的熔、沸点越高。如卤 素单质:
又如气态氢化物:
但是:
讨论:
2、氢键
为何HF、H2O和NH3 的沸点会反常呢?
定义:由于氢原子的存在而使分子间产生的一种 比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱很多,比分子 间作用力稍强,也属于分子间作用力的范畴,
(2)形成条件:氢原子与得电子能力很强、原子半径 很小的原子形成的分子之间。如HF、H2O、NH3等分子间 易形成氢键。
(3)特点:具有方向性。
(4)结果1:氢键的形成会使含有氢键的物质的熔、 沸点大大升高。如:水的沸点高、氨易液化等。这是 由于固体融化或液体汽化时,必须破坏分子间作用力 和氢键
4、下列说法正确的是( B ) A、含有共价键的化合物一定是共价化合物 B、分子中只有共价键的化合物一定是共价化合物 C、由共价键形成的分子一定是共价化合物 D、共价化合物中可以有离子键
5、下列说法正确的是(C )
A、单质分子中一定存在共价键 B、气态物质中一定有共价键 C、在共价化合物中一定有共价键 D、全部由非金属元素构成的化合物中,一定不含离子键
四、分子间作用力和氢键
1、分子间作用力 定义: 把分子集合在一起的作用力叫做分子间作
用力(也叫范德华力)。
(1)分子间作用力比化学键弱很多,是一种柔弱的相互作用,它主 要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金 属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范畴很小(一样是300-500pm),只有分子间 的距离很小时才有。
(4)一样来说,对于组成和结构类似的物质,相对分子 质量越大,分子间作用力越大,物质的熔、沸点越高。如卤 素单质:
又如气态氢化物:
但是:
讨论:
2、氢键
为何HF、H2O和NH3 的沸点会反常呢?
定义:由于氢原子的存在而使分子间产生的一种 比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱很多,比分子 间作用力稍强,也属于分子间作用力的范畴,
(2)形成条件:氢原子与得电子能力很强、原子半径 很小的原子形成的分子之间。如HF、H2O、NH3等分子间 易形成氢键。
(3)特点:具有方向性。
(4)结果1:氢键的形成会使含有氢键的物质的熔、 沸点大大升高。如:水的沸点高、氨易液化等。这是 由于固体融化或液体汽化时,必须破坏分子间作用力 和氢键
4、下列说法正确的是( B ) A、含有共价键的化合物一定是共价化合物 B、分子中只有共价键的化合物一定是共价化合物 C、由共价键形成的分子一定是共价化合物 D、共价化合物中可以有离子键
5、下列说法正确的是(C )
A、单质分子中一定存在共价键 B、气态物质中一定有共价键 C、在共价化合物中一定有共价键 D、全部由非金属元素构成的化合物中,一定不含离子键
【高中化学】化学键与化学反应中的能量变化 课件 高一下学期化学人教版(2019)必修第二册

H2
+
Cl2
H—H
Cl—Cl
点燃 2HCl 2 H—Cl
吸 断收 开能
量 2 H· +
吸 断收 开能
量 2 ·C····l
形成 放出能量
2H
C····l
·· ··
··
化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因
在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需 的能量,称为A-B键的键能,用符号E表示,单位为kJ.mol-1。如不指明温度
,应为298.15K。键能越大,化学键越牢固,含该键的分子越稳定, 自身具有的能量越低。
H2
+
Cl2
点燃 2HCl
吸收
断 开
436kJ/mol பைடு நூலகம்量
2 H·
+
断 开
吸收 243kJ/mol
能量
2 ·C····l
形成 放出
2 H C····l
2×431kJ/mol能量
·· ··
··
反应中能量变化:436+243 - (2×431kJ)kJ = -183kJ
3. 已知反应: X+Y=M+N放出能量,下列说法正确的是( A. X的能量一定高于M B. Y的能量一定高于N C. X和Y的总能量一定高于M和N的总能量 D. 因为该反应为放出能量,故反应不必加热
C)
4. 金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已 知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是
A. 金刚石与石墨互为同位素( C )
B. 石墨不如金刚石稳定 C. 金刚石不如石墨稳定 D. 等质量的石墨与金刚石完全燃烧,石墨放出的能量多
人教版高中化学必修二1.3《化学键(第1课时)离子键》讲课课件

第3节 化学键
第1课时 离子键
科学视野
• 1654年格里克在德国马德堡做了著名的马德堡 半球实验,16匹马的力量居然没有把两个合在 一起的抽空空气的铜球拉开!当原子和原子结 合为物质时,原子之间存在着强烈的相互作用 ———化学键!
那么什么是化学键?
钠与氯气反应形成氯化钠
那么什么是离子键?
实验1—2:钠在氯气中燃烧
属原子N
Nn-
离子键 合 物
式 表 示
例 Cl Mg Cl
Cl Mg2+ Cl
子最外层电子的式子,叫电子式 2.表示方法:
①原子的电子式:
举例: H O Cl Mg Na
三、用电子式表示离子键的形成过程
(一)电子式及其书写
②离子的电子式: ⅰ简单阳离子的电子式就是离子符号本身
举例: Na+ Mg2+ Al3+
三、用电子式表示离子键的形成过程
(一)电子式及其书写
②离子的电子式:
⒋成键元素:通常是活泼金属元素和活泼非金属元素
活泼金属元素
活泼非金属元素
二、离子化合物
⒈定义:由离子键构成的化合物叫做离子化合物。
⒉成键条件:
阴离子 阳离子
活泼的非金属离子(VIA,VIIA)
酸根离子、OHˉ 活泼的金属离子(IA,IIA)
铵根离子
完全由非金属元素形成的化合物可能是离 子化合物。
K·+ ·S·····+ K·→ K+ [:··S··:]2- K+
原子A的电子式 + 原子B的电子式 → 化合物的电子式
[练一练]
⑶下列用电子式表示的化合物的形成过程正确的是
C
离子键: 使阴、阳离子结合成化合物的静电作用.
第1课时 离子键
科学视野
• 1654年格里克在德国马德堡做了著名的马德堡 半球实验,16匹马的力量居然没有把两个合在 一起的抽空空气的铜球拉开!当原子和原子结 合为物质时,原子之间存在着强烈的相互作用 ———化学键!
那么什么是化学键?
钠与氯气反应形成氯化钠
那么什么是离子键?
实验1—2:钠在氯气中燃烧
属原子N
Nn-
离子键 合 物
式 表 示
例 Cl Mg Cl
Cl Mg2+ Cl
子最外层电子的式子,叫电子式 2.表示方法:
①原子的电子式:
举例: H O Cl Mg Na
三、用电子式表示离子键的形成过程
(一)电子式及其书写
②离子的电子式: ⅰ简单阳离子的电子式就是离子符号本身
举例: Na+ Mg2+ Al3+
三、用电子式表示离子键的形成过程
(一)电子式及其书写
②离子的电子式:
⒋成键元素:通常是活泼金属元素和活泼非金属元素
活泼金属元素
活泼非金属元素
二、离子化合物
⒈定义:由离子键构成的化合物叫做离子化合物。
⒉成键条件:
阴离子 阳离子
活泼的非金属离子(VIA,VIIA)
酸根离子、OHˉ 活泼的金属离子(IA,IIA)
铵根离子
完全由非金属元素形成的化合物可能是离 子化合物。
K·+ ·S·····+ K·→ K+ [:··S··:]2- K+
原子A的电子式 + 原子B的电子式 → 化合物的电子式
[练一练]
⑶下列用电子式表示的化合物的形成过程正确的是
C
离子键: 使阴、阳离子结合成化合物的静电作用.
第2章 第1节 共价键课件-2024-2025学年【新教材】人教版高中化学选择性必修2

返 首 页
返 首 页
(1)根据元素周期律可知 NH3 的稳定性强于 PH3,你能利用键参 数加以解释吗?
提示:键长:N—H<P—H,键能:N—H>P—H,因此 NH3 更稳定。
(2)一般来说,键长越短,键能越大。但 F—F 键长短,键能小,
请思考其原因。
提示:氟原子的半径很小,因此其键长短,而由于键长短,两个
返 首 页
(2)下表中是 H—X 的键能数据
共价键
H—F H—Cl
H—Br
H—I
键能/(kJ·mol-1 ) 568
431.8
366
298.7
①若使 2 mol H—Cl 断裂为气态原子,则发生的能量变化是
吸收 863.6 kJ 的能量 。
返 首 页
②表中共价键最难断裂的是 H—F ,最易断裂的是 H—I 。 ③ 由 表 中 键 能 数 据 大 小 说 明 键 能 与 分 子 稳 定 性 的 关 系 : HF 、 HCl、HBr、HI 的键能依次减小,说明四种分子的稳定性依次减弱, 即 HF 分子最稳定,最难分解,HI 分子最不稳定,最易分解。
个 π 键,π 键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没
有 π 键,σ 键稳定,不易断裂。 返 首 页
(3) H 原子和 H 原子、H 原子和 Cl 原子、Cl 原子和 Cl 原子分别 均以 σ 键结合成 H2、HCl 和 Cl2 分子,共价键轨道完全相同吗?
提示:不相同。H 原子的未成对电子位于 1s 轨道,Cl 原子的未 成对电子位于 3p 轨道,即 H 原子和 H 原子成键以 1s 和 1s 轨道“头 碰头”重叠,H 原子和 Cl 原子以 1s 和 3p 轨道“头碰头”重叠,Cl 原子和 Cl 原子以 3p 和 3p 轨道“头碰头”重叠。
返 首 页
(1)根据元素周期律可知 NH3 的稳定性强于 PH3,你能利用键参 数加以解释吗?
提示:键长:N—H<P—H,键能:N—H>P—H,因此 NH3 更稳定。
(2)一般来说,键长越短,键能越大。但 F—F 键长短,键能小,
请思考其原因。
提示:氟原子的半径很小,因此其键长短,而由于键长短,两个
返 首 页
(2)下表中是 H—X 的键能数据
共价键
H—F H—Cl
H—Br
H—I
键能/(kJ·mol-1 ) 568
431.8
366
298.7
①若使 2 mol H—Cl 断裂为气态原子,则发生的能量变化是
吸收 863.6 kJ 的能量 。
返 首 页
②表中共价键最难断裂的是 H—F ,最易断裂的是 H—I 。 ③ 由 表 中 键 能 数 据 大 小 说 明 键 能 与 分 子 稳 定 性 的 关 系 : HF 、 HCl、HBr、HI 的键能依次减小,说明四种分子的稳定性依次减弱, 即 HF 分子最稳定,最难分解,HI 分子最不稳定,最易分解。
个 π 键,π 键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没
有 π 键,σ 键稳定,不易断裂。 返 首 页
(3) H 原子和 H 原子、H 原子和 Cl 原子、Cl 原子和 Cl 原子分别 均以 σ 键结合成 H2、HCl 和 Cl2 分子,共价键轨道完全相同吗?
提示:不相同。H 原子的未成对电子位于 1s 轨道,Cl 原子的未 成对电子位于 3p 轨道,即 H 原子和 H 原子成键以 1s 和 1s 轨道“头 碰头”重叠,H 原子和 Cl 原子以 1s 和 3p 轨道“头碰头”重叠,Cl 原子和 Cl 原子以 3p 和 3p 轨道“头碰头”重叠。
人教版高中化学必修2《共价键及共价化合物》课件 (共20页)

第3节 化学键 化学计量在实验中的应用
物质的量的单位-摩尔
第1课时 离子键及离子 化合物
1 了解共价键的概念及形成过程,了解极性键和非极性键的区 别。 2 掌握共价分子电子式和结构式的书写方法,会用电子式 表示共价分子的形成过程。
3 了解共价化合物的概念,并能识别常见的共价化合物。 4 了解化学键的含义,能从化学键的角度理解化学反应的 实质。
2.常见的共价化合物:非金属氢化物、非金属氧化物、含氧酸
、大多数有机化合物等。
一对共用电子 N≡N
· · · · · · · · H· O· H · ·
H·+·O·+·H
四、化学键及化学反应的实质 1.离子键使离子结合形成离子化合物;共价键使原子结合 形成共价化合物或单质。人们把这种使离子相结合或原子 化学键 作用力 相结合的⑭作用力统称为 ⑮化学键。
Na
6.02X1023mol-1 n=N/M
(2)已知N2、CO2的结构式分别为
... ... .. .. .. .. .. ..
、
..
,则N2、CO2的电
.. .. N 、 O C_________ O 子式分别为 N 。 (3)分别写出NaOH、H2O2、Na2O2的电子式: .. .. .. +[ O H ] O O H Na .. NaOH: _______,H2O2: H .. .. ______, .. .. .. .. 2+[ O O Na .. ] Na+ .. Na2O2: ______________ 。 .. .. .. .. ..
C.Na+
.. O H] D. Na+[ ..
2 下列说法中不正确的是( D )。 A.液态氢氧化钠是电解质 B.离子化合物中可能含有共价键 C.共价化合物中不可能含有离子键
物质的量的单位-摩尔
第1课时 离子键及离子 化合物
1 了解共价键的概念及形成过程,了解极性键和非极性键的区 别。 2 掌握共价分子电子式和结构式的书写方法,会用电子式 表示共价分子的形成过程。
3 了解共价化合物的概念,并能识别常见的共价化合物。 4 了解化学键的含义,能从化学键的角度理解化学反应的 实质。
2.常见的共价化合物:非金属氢化物、非金属氧化物、含氧酸
、大多数有机化合物等。
一对共用电子 N≡N
· · · · · · · · H· O· H · ·
H·+·O·+·H
四、化学键及化学反应的实质 1.离子键使离子结合形成离子化合物;共价键使原子结合 形成共价化合物或单质。人们把这种使离子相结合或原子 化学键 作用力 相结合的⑭作用力统称为 ⑮化学键。
Na
6.02X1023mol-1 n=N/M
(2)已知N2、CO2的结构式分别为
... ... .. .. .. .. .. ..
、
..
,则N2、CO2的电
.. .. N 、 O C_________ O 子式分别为 N 。 (3)分别写出NaOH、H2O2、Na2O2的电子式: .. .. .. +[ O H ] O O H Na .. NaOH: _______,H2O2: H .. .. ______, .. .. .. .. 2+[ O O Na .. ] Na+ .. Na2O2: ______________ 。 .. .. .. .. ..
C.Na+
.. O H] D. Na+[ ..
2 下列说法中不正确的是( D )。 A.液态氢氧化钠是电解质 B.离子化合物中可能含有共价键 C.共价化合物中不可能含有离子键
高中化学化学键2课件人教必修2.ppt

(2)成键微粒:原子
(3)相互作用:共用电子对 (4)形成条件:
①同种或不同种非金属元素原子之间的结合:Cl2、 O2、N2、SO2、CO2、H2S、HF、HBr、HI等。
②某些金属元素原子与非金属元素原子间的结合:
AlCl3、BeH2、BeCl2、HgCl2、AgCl等。 (5)共价健存在于:
①非金属单质:Cl2、O2、N2等。稀有气体除外 ②共价化合物:H2O、CO2、SiO2、NH3等
[知识回顾] 一、离子键 (1)定义:使阴、阳离子结合成化合物的静电作用
(或带相反电荷离子之间的相互作用)
(2)成键微粒:阴、阳离子 (3)相互作用:静电作用(静电引力和斥力) (4)成键过程:阴、阳离子接近到某一距离,吸引
与排斥达到平衡就形成离子键 (5)形成条件:
①活泼的金属元素(ⅠA、ⅡA)和活泼的非金属元 素(ⅥA、ⅦA)之间形成的化合物。 ②活泼金属元素与OH-组成的化合物:NaOH、KOH ③活泼金属元素与酸根离子形成的盐:Na2SO4、KNO3 ④NH4+与酸根离子形成的盐:NH4Cl、NH4NO3
[ Na]+
[ ] H ×●
+
H×● N×● H
●●
●
×
[ ] [ ] ● ●
-
●●
-
Cl Mg Cl ●
●
●×
2+
●
×
● ●
●●
●●
N N ● ●
● ●
●● ●●
● ●
●●
●●
O O ● ● ●●
●●
●●●
2-
Na+
●
×
+
●●
—
H×● N×● H
(3)相互作用:共用电子对 (4)形成条件:
①同种或不同种非金属元素原子之间的结合:Cl2、 O2、N2、SO2、CO2、H2S、HF、HBr、HI等。
②某些金属元素原子与非金属元素原子间的结合:
AlCl3、BeH2、BeCl2、HgCl2、AgCl等。 (5)共价健存在于:
①非金属单质:Cl2、O2、N2等。稀有气体除外 ②共价化合物:H2O、CO2、SiO2、NH3等
[知识回顾] 一、离子键 (1)定义:使阴、阳离子结合成化合物的静电作用
(或带相反电荷离子之间的相互作用)
(2)成键微粒:阴、阳离子 (3)相互作用:静电作用(静电引力和斥力) (4)成键过程:阴、阳离子接近到某一距离,吸引
与排斥达到平衡就形成离子键 (5)形成条件:
①活泼的金属元素(ⅠA、ⅡA)和活泼的非金属元 素(ⅥA、ⅦA)之间形成的化合物。 ②活泼金属元素与OH-组成的化合物:NaOH、KOH ③活泼金属元素与酸根离子形成的盐:Na2SO4、KNO3 ④NH4+与酸根离子形成的盐:NH4Cl、NH4NO3
[ Na]+
[ ] H ×●
+
H×● N×● H
●●
●
×
[ ] [ ] ● ●
-
●●
-
Cl Mg Cl ●
●
●×
2+
●
×
● ●
●●
●●
N N ● ●
● ●
●● ●●
● ●
●●
●●
O O ● ● ●●
●●
●●●
2-
Na+
●
×
+
●●
—
H×● N×● H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成键微粒:非金属原子
相互作用:共用电子对 成键元素:同种或不同种非金属元素 共价化合物——以共用电子对形成分子的化合物
· · · · · · · · : : : Cl : Cl﹣Cl(结构式) +· Cl · Cl :→ Cl · · · · · · · ·
氢分子的形成:
氯分子的形成:
H ·+ · H → H H
下列说法是否正确? 1、分子内原子之间的相互作用叫化学键。
2、阴、阳离子间的静电吸引作用叫做离子键。
思考
1. 是不是所有的金属和非金属元素之间 都能形成离子键?为什么? 2. 是否只有金属与非金属之间才能形成 离子键?为什么?
小测
1、什么是离子键?哪些类型的元素化合 时可形成离子键? 2、用电子式表示CaF2、Na2O的形成过 程
Na+
Cl-
Cl
+17
287
Cl-
+17
288
二.离子键
1. 概念: 阴阳离子间通过静电作用所形成的化学键 2. 概念要点: 成键微粒 —— 阴阳离子 键的实质 —— 静电作用 成键范围 —— 活泼金属(IA IIA) 与非金属(VIA VIIA)
思考题
三、用电子式表示离子化合物的形成
1.电子式:在元素符号周围用小点(或×)来表示原 子的最外层电子,这种式子叫电子式。 原子: 离子:
练习:用电子式表示下列共价分子的形成过程, 写出下列分子的结构式。 : : : ::
· · · · · ·· · 碘 I ·+ · I → I I · · · · · ·· · · · 水 2 H ·+ · O ·→ H ﹕O﹕ H · · · · 硫化氢 2 H ·+ · S · → H ﹕S ﹕H · · H · ﹕ +· 氨 3H· N → H ﹕N · H · · · +2 · ﹕ C﹕ ﹕O C· → O﹕ 二氧化碳 · O· · · ·
五、分子间作用力和氢键
1、分子间作用力——范德华力
一般来说,对于组成和结构相似的物质,相对分子质量 越大,分子间作用力越大,物质的熔、沸点也越高。 2、氢键:是一种较强的分子间作用力。
练习:
1、课本习题P23 1、2、4、5、第3题做在作业本。 2、下列说法中正确的是( AD )
A.含有离子键的化合物必是离子化合物
裂和新化学键形成的过程。
离子化合物和共价化合物的比较
离子化合物 成键作用
离子键 成键微粒 阴、阳离子 成键本质 发生电子的得失,静 电作用 表示法 以NaCl为例
共价化合物
共价键 原子 共用电子对 以为HCl例
::
·] Cl· Na [ · ·
+
-
成键元素 典型的金属元素、典 同种元素或同类非金 型的非金属元素之间 属元素之间 熔沸点较高,硬度较 特征 大,熔融态可导电
A K
B C Cl F
O
Ba
K
Cl
K
[O ] K 2 Cl B a [ ] [ ] [ Cl ]
Mg 2
2
Mg
Cl
F
D H
[F] 2 H [ Cl ]
(2)CaCl2
2. 用电子式表示下列离子化合物的形成过程: (1)Na2O
讨论
(1)活泼的金属元素和活泼非金属元 素化合时形成离子键。请思考, 试分析氢 和氯的原子结构,你认为H2 、Cl2 、HCl的 形成和NaCl一样吗?非金属元素之间化合 时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电
﹕ ﹕ ﹕
· ·
﹕ ﹕ ﹕ ﹕
﹕
﹕
﹕
含有共价键的化合物是否一定是共价化合物?
【结论】含有离子键的化合物一定是离子化合物, 而含有共价键的化合物不一定是共价化合物;
在离子化合物中可能有共价键,而在共价化合物中 都不可能有离子键。
O· ·
Na
+
2+ · [· ] O · · Na
::
: :
讨论:用化学键的观点来分析化学反应的本质是什 么? 一个化学反应的的过程,本质上就是旧化学键断
本节小结
离子键:使阴、阳离子结合成化合物的静电作用.
活泼金 失去 属原子M 电子
活泼非金 得到 属原子N 电子
阳离子 Mm+ 阴离子 NnMg
静电作用
静电吸引=静电排斥
离子键
影响 因 素 ①离子半径 ②离子电荷
离 子 化 合 物
2
用 电 子 式 表 示
例
Cl
Cl
Cl Mg
Cl
课堂练习
练习 1.下列用电子式表示化合物的形成过程正确的是: ( A )
非极性键——共用电子对不偏移的共价键。 由同种(非金属)原子形成的共价键。A-A 极性键——共用电子对偏移的共价键。 由不同种(非金属)原子形成的共价键。A-B
思考: 1、对组成和结构相似的物质如:HCl、HBr、 HI,Cl2、Br2、I2,如何判断熔沸点高低顺序?
2、为什么NH3、H2O、HF的沸点都比同族元 素的氢化物高? 3、为什么冰能浮在水面上?
化学键
思考题: 1.为什么元素只有一百多种,却能形成二千 多万种化合物,原子之间是怎样结合的?
一. 化学键
——相邻的原子之间强烈的 相互作用
1.概念要点:
a. 相邻
b.原子之间 C.强烈作用
2.化学键主要类型: a.离子键 b.共价键
二.离子键
实验1:氯化钠的形成
Na
+11 281 Na+
+11 2 8
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键 D.离子化合物中可能含有共价键 3、下列物质中含有共价键的离子化合物是(
A
)
A.Ba(OH)2
B.CaCl2
C.H2O
D.H2
· · H Cl · · · ·
· ·
思考:比较H—H、H—Cl之间 的共价键有和不同。
H—H H—Cl 不同种原子 不同 偏向吸引电子能力 强的Cl H:带部分正电 Cl:带部分负电 极性键
组成
各原子吸引 电子能力 共用电子对 位置 成键原子电 性 结论
同种原子 相同 不偏向任何原子 不显电性 非极性键
思考题
判断下列作用属于化学键的是:
(1). 水分子中,O原子与H原子之间的作用
(2). 水分子中,H原子与H原子之间的作用
(3). 冰中,水分子与水分子之间的作用
(4). NaCl中, 钠离子与氯离子之间的作用
练习题
1. 用电子式表示Ca、Mg2+、N3-、S22. 用电子式表示K2O 、BaCl2、Na2S 3. 用电子式表示MgF2、Na2S、LiCl的形成过程
子的倾向。 (2)以HCl的形成为例,说明非金属元素 会以什么形式结合?
非金属元素的原子间可通过共用电子对
的方法使双方最外电子层均达到稳定结构。
氯化氢分子的形成:
· · · · H ·+ · Cl :→ H Cl · · · · · ·
· ·
H﹣Cl(结构式)
原子之间通过共用电子对所形成的相互 作用,叫做共价键。
· ·
H﹣H(结构式)
注意:没有形成阴阳离子,不需标离子电荷[]和电 子转移。
如何判断每个原子形成分子时, 形成几个共价键?
——根据化合价判断,化合价数=共用 电子对。若形成单质分子,则根据最低 化合价判断。
小测:
1. 用电子式表示BaCl2、HF、CO2的形成过程
2. 用电子式表示N2、NH3、CH4、CaF2 。
离子化合物:
H Cl
O O
Cl
2-
Mg Mg
2
Na
Na
2-
Na Cl Cl Mg
2
Na O Na Cl
2、用电子式表示离子化合物的形成过程
例:K
S
Mg
K
K
S K Br Mg
2
2-
Br
书写要点:
Br
Br
1. 2. 3. 4.不能把“→”写成“====” 5.用箭头标明电子转移方向。
相互作用:共用电子对 成键元素:同种或不同种非金属元素 共价化合物——以共用电子对形成分子的化合物
· · · · · · · · : : : Cl : Cl﹣Cl(结构式) +· Cl · Cl :→ Cl · · · · · · · ·
氢分子的形成:
氯分子的形成:
H ·+ · H → H H
下列说法是否正确? 1、分子内原子之间的相互作用叫化学键。
2、阴、阳离子间的静电吸引作用叫做离子键。
思考
1. 是不是所有的金属和非金属元素之间 都能形成离子键?为什么? 2. 是否只有金属与非金属之间才能形成 离子键?为什么?
小测
1、什么是离子键?哪些类型的元素化合 时可形成离子键? 2、用电子式表示CaF2、Na2O的形成过 程
Na+
Cl-
Cl
+17
287
Cl-
+17
288
二.离子键
1. 概念: 阴阳离子间通过静电作用所形成的化学键 2. 概念要点: 成键微粒 —— 阴阳离子 键的实质 —— 静电作用 成键范围 —— 活泼金属(IA IIA) 与非金属(VIA VIIA)
思考题
三、用电子式表示离子化合物的形成
1.电子式:在元素符号周围用小点(或×)来表示原 子的最外层电子,这种式子叫电子式。 原子: 离子:
练习:用电子式表示下列共价分子的形成过程, 写出下列分子的结构式。 : : : ::
· · · · · ·· · 碘 I ·+ · I → I I · · · · · ·· · · · 水 2 H ·+ · O ·→ H ﹕O﹕ H · · · · 硫化氢 2 H ·+ · S · → H ﹕S ﹕H · · H · ﹕ +· 氨 3H· N → H ﹕N · H · · · +2 · ﹕ C﹕ ﹕O C· → O﹕ 二氧化碳 · O· · · ·
五、分子间作用力和氢键
1、分子间作用力——范德华力
一般来说,对于组成和结构相似的物质,相对分子质量 越大,分子间作用力越大,物质的熔、沸点也越高。 2、氢键:是一种较强的分子间作用力。
练习:
1、课本习题P23 1、2、4、5、第3题做在作业本。 2、下列说法中正确的是( AD )
A.含有离子键的化合物必是离子化合物
裂和新化学键形成的过程。
离子化合物和共价化合物的比较
离子化合物 成键作用
离子键 成键微粒 阴、阳离子 成键本质 发生电子的得失,静 电作用 表示法 以NaCl为例
共价化合物
共价键 原子 共用电子对 以为HCl例
::
·] Cl· Na [ · ·
+
-
成键元素 典型的金属元素、典 同种元素或同类非金 型的非金属元素之间 属元素之间 熔沸点较高,硬度较 特征 大,熔融态可导电
A K
B C Cl F
O
Ba
K
Cl
K
[O ] K 2 Cl B a [ ] [ ] [ Cl ]
Mg 2
2
Mg
Cl
F
D H
[F] 2 H [ Cl ]
(2)CaCl2
2. 用电子式表示下列离子化合物的形成过程: (1)Na2O
讨论
(1)活泼的金属元素和活泼非金属元 素化合时形成离子键。请思考, 试分析氢 和氯的原子结构,你认为H2 、Cl2 、HCl的 形成和NaCl一样吗?非金属元素之间化合 时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电
﹕ ﹕ ﹕
· ·
﹕ ﹕ ﹕ ﹕
﹕
﹕
﹕
含有共价键的化合物是否一定是共价化合物?
【结论】含有离子键的化合物一定是离子化合物, 而含有共价键的化合物不一定是共价化合物;
在离子化合物中可能有共价键,而在共价化合物中 都不可能有离子键。
O· ·
Na
+
2+ · [· ] O · · Na
::
: :
讨论:用化学键的观点来分析化学反应的本质是什 么? 一个化学反应的的过程,本质上就是旧化学键断
本节小结
离子键:使阴、阳离子结合成化合物的静电作用.
活泼金 失去 属原子M 电子
活泼非金 得到 属原子N 电子
阳离子 Mm+ 阴离子 NnMg
静电作用
静电吸引=静电排斥
离子键
影响 因 素 ①离子半径 ②离子电荷
离 子 化 合 物
2
用 电 子 式 表 示
例
Cl
Cl
Cl Mg
Cl
课堂练习
练习 1.下列用电子式表示化合物的形成过程正确的是: ( A )
非极性键——共用电子对不偏移的共价键。 由同种(非金属)原子形成的共价键。A-A 极性键——共用电子对偏移的共价键。 由不同种(非金属)原子形成的共价键。A-B
思考: 1、对组成和结构相似的物质如:HCl、HBr、 HI,Cl2、Br2、I2,如何判断熔沸点高低顺序?
2、为什么NH3、H2O、HF的沸点都比同族元 素的氢化物高? 3、为什么冰能浮在水面上?
化学键
思考题: 1.为什么元素只有一百多种,却能形成二千 多万种化合物,原子之间是怎样结合的?
一. 化学键
——相邻的原子之间强烈的 相互作用
1.概念要点:
a. 相邻
b.原子之间 C.强烈作用
2.化学键主要类型: a.离子键 b.共价键
二.离子键
实验1:氯化钠的形成
Na
+11 281 Na+
+11 2 8
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键 D.离子化合物中可能含有共价键 3、下列物质中含有共价键的离子化合物是(
A
)
A.Ba(OH)2
B.CaCl2
C.H2O
D.H2
· · H Cl · · · ·
· ·
思考:比较H—H、H—Cl之间 的共价键有和不同。
H—H H—Cl 不同种原子 不同 偏向吸引电子能力 强的Cl H:带部分正电 Cl:带部分负电 极性键
组成
各原子吸引 电子能力 共用电子对 位置 成键原子电 性 结论
同种原子 相同 不偏向任何原子 不显电性 非极性键
思考题
判断下列作用属于化学键的是:
(1). 水分子中,O原子与H原子之间的作用
(2). 水分子中,H原子与H原子之间的作用
(3). 冰中,水分子与水分子之间的作用
(4). NaCl中, 钠离子与氯离子之间的作用
练习题
1. 用电子式表示Ca、Mg2+、N3-、S22. 用电子式表示K2O 、BaCl2、Na2S 3. 用电子式表示MgF2、Na2S、LiCl的形成过程
子的倾向。 (2)以HCl的形成为例,说明非金属元素 会以什么形式结合?
非金属元素的原子间可通过共用电子对
的方法使双方最外电子层均达到稳定结构。
氯化氢分子的形成:
· · · · H ·+ · Cl :→ H Cl · · · · · ·
· ·
H﹣Cl(结构式)
原子之间通过共用电子对所形成的相互 作用,叫做共价键。
· ·
H﹣H(结构式)
注意:没有形成阴阳离子,不需标离子电荷[]和电 子转移。
如何判断每个原子形成分子时, 形成几个共价键?
——根据化合价判断,化合价数=共用 电子对。若形成单质分子,则根据最低 化合价判断。
小测:
1. 用电子式表示BaCl2、HF、CO2的形成过程
2. 用电子式表示N2、NH3、CH4、CaF2 。
离子化合物:
H Cl
O O
Cl
2-
Mg Mg
2
Na
Na
2-
Na Cl Cl Mg
2
Na O Na Cl
2、用电子式表示离子化合物的形成过程
例:K
S
Mg
K
K
S K Br Mg
2
2-
Br
书写要点:
Br
Br
1. 2. 3. 4.不能把“→”写成“====” 5.用箭头标明电子转移方向。
