部分酮和醛类溶剂理化特征表
常用77种溶剂的理化性质简表

常用77种溶剂的理化性质简表2007年07月08日星期日下午 02:05溶剂名沸点溶解性毒性*液氨 -33.35℃ 特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫 -10.08 溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒*甲胺 -6.3 是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺 7.4 是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似*乙醚 34.6 微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷 36.1 与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷 39.75 与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强*二硫化碳 46.23 微溶于水,与多种有机溶剂混溶麻醉性,强刺激性*溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大*丙酮 56.12 与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷 57.28 与醇、醚等大多数有机溶剂混溶低毒、局部刺激性*氯仿 61.15 与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性*甲醇 64.5 与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,四氢呋喃 66 优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷 68.7 甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸 71.78 与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物1,1,1-三氯乙烷 74.0 与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂*四氯化碳 76.75 与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强*乙酸乙酯 77.112 与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性*乙醇 78.3 与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮 79.64 与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮*苯 80.10 难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性*环己烷 80.72 与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用乙睛 81.60 与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇 82.40 与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷 83.48 与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚 85.2 溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
醛和酮

β-羟基醛在加热时容易 脱水生成α, β-丌饱和醛:
增长碳链的方法之一。
17
羟醛缩合机理:
18
交叉羟醛缩合(两种丌同醛之间的缩合),产物复杂, 一般无合成意义 醛(无a-H)+ 醛(有a-H)有合成意义
Claisen-Schmidt(克莱森-许密特)反应:
产物为b-位取代的饱和酮
形式上为3, 4-加成(亲核部分总是加在4位)
34
, b-丌饱和醛酮不栺式试剂(RMgX) 1, 4-和 1, 2 -加成
兼有,加成取向不羰基旁烃基体积大小有兲。
100%(1, 2-加成)
100%(1, 4-加成)
35
9.5 醌类化合物
醌的定义:含有共轭环己二烯二酮结构单元的化合物。
CH2CH3 CHO CH2OH OH
沸点/ C
o
CH3
136.1 179.0 205.2 201.8
水溶性:小于或等于4个碳的醛、酮易溶于水。 密度:均小于1。
6
二、化学性质
δ + δ
δ
+
亲核加成 氢化还原
-活泼H的反应
(1)烯醇化
醛的氧化
(2) -卤代(卤仿反应)
(3)羟醛缩合反应
7
(一) 亲核加成反应
小结:
氧化剂
Ag(NH3)2OH
现象应用特点Fra bibliotek丌氧化C=C
温 和
(Tollen’s 试剂) Cu(OH)2/NaOH (Fehling’s 试剂)
有Ag沉淀,银镜 醛类化合物的鉴 反应 定分析;羧酸类 红色Cu2O沉淀 化合物的合成
强
KMnO4, K2Cr2O7,
12醛、酮

H R C O + H+ CN-
H R C OH
CN
氰醇
R' R C O + H+ CN-
R' R C OH
CN
该反应在有机合成中很有用处, 是增长一个碳原 子的重要反应之一。
HCN亲核加成反应的特点
1) 反应是可逆的。加少量碱可大大加速反应, 而加 酸则抑制反应的进行。
HCN
H+ + CN-
酸性条件下反应3-4小时才进行一半,若加入一 滴NaOH溶液则2分钟反应即完成。
C N+H2Y O-
C N+H2Y O-
C NHY -H2O OH
CNY
一些产物及名称 H2N-Y
产物
名称
H2N R (Ar)
H2N OH
H2N NH2 C O+
H2N NH
C N R (Ar) C N OH C N NH2 NO2 C N NH
Schiff base
肟(oxime) 腙(hydrazone) NO2 苯腙(_phenyl
原子上,形成所谓的烯醇式结构:
O CH3CCH3
O H+[ -CH2 C CH3
OCH2 C CH3 ]
OH CH2 C CH3
酮式
共轭碱
烯醇式
[ 烯醇 ] 二种互变异构体,在酸碱催化下
K = [ 醛或酮 ] 迅速达到平衡
通常互变异构体中,烯醇式的比例很小,但在下列 情况下烯醇式的含量大大提高
O
O
O2N H2N NH C NH2
O
O2N C N NH C NH2
O
hydrazone) 缩氨基脲 (semicarbazone)
最全溶剂理化性质参数表

16 甲基异戊基酮(MIAK) METHYL ISOAMYL KETONE 17 乙酸甲基戊酯 18 丙酸正丁酯 19 丙二醇甲醚乙酸酯 20 乙酸戊酯 21 甲基正戊基甲酮 22 异丁酸异丁酯 23 羟乙基乙醚 24 环已酮 25 丙二醇单丁基醚 26 丙二醇单丙基醚 27 乙二醇乙醚乙酸酯 METHYL AMYL ACETATE n-BUTYL PROPIONATE EASTMAN PM ACETATE(PMA) AMYL ACETATE (PRIMARY) METHYL n-AMYL KETONE ISOBUTYL ISOBUTYRATE ETHYLENE GLYCOL ETHYL ETHER CYCLOHEXANONE PROPYLENE GLYCOL TERTIARY BUTYL ETHER PROPYLENE GLYCOL PROPYL ETHER ETHYLENE GLYCOL ETHYL ETHER ACETATE
溶剂参数表
序 号 中文名称 英文全称 CAS NO. 挥发速率 (Evaporation Rate) NBAC=1 Active Solvent a (活性溶剂) 1 四氢呋喃 2 丙酮 3 乙酸甲酯 4 纯乙酸甲酯 5 乙酸乙酯 6 乙酸乙酯99% 7 丁酮 8 乙酸异丙酯 9 甲基正丙酮 10 正乙酸丙酯 TETRAHDROFURAN ACETONE METHYL ACETATE METHYL ACETATE-HIGH PURITY ETHYL ACETATE(85~88%) ETHYL ACETATE(99%) METHYL ETHYL KETONE ISOPROPYL ACETATE METHYL n-PROPYL KETONE n-PROPYL ACETATE 109-99-9 67-64-1 79-20-9 79-20-9 141-78-6 78-93-3 108-21-4 107-87-9 109-60-4 108-10-1 110-19-0 79-46-9 123-86-4 107-98-2 110-12-3 108-84-9 590-01-2 108-65-6 628-63-7 110-43-0 97-85-8 110-80-5 108-94-1 57018-52-7 1569-01-3 111-15-9 6.3 6.3 6.0 6.2 4.2 4.1 3.8 3.0 2.3 2.3 1.6 1.4 1.1 1.0 0.7 0.5 0.5 0.5 0.4 0.4 0.4 0.4 0.3 0.3 0.3 0.2 0.2 1.9 1.9 1.9 1.9 2.9 3.0 3.2 4.0 5.3 5.3 7.6 8.6 11.0 12.1 17.3 24.2 24.2 24.2 30.2 30.2 30.2 30.2 40.3 40.3 40.3 60.5 60.5 OCH2CH2CH2CH2 CH3COCH3 CH3COOCH3 CH3COOCH3 CH3COOC2H5 CH3COOC2H5 CH3COCH2H5 CH3COOCH(CH3)2 CH3COC3H7 CH3COOC3H7 CH3COCH2CH(CH3)2 CH3COOCH2CH(CH3)2 CH3CHNO2CH3 CH3COOC4H9 CH3OCH2CH(CH3)OH CH3COC2H4CH(CH3)2 CH3COOCH(CH3)C4H9 C2H5COOC4H9 CH3COOCH(CH3)CH2OCH3 CH3COOC5H11 CH3COC5H11 (CH3)2CHCOOCH2CH(CH3)2 C2H5OC2H4OH CH2(CH2)2CO C4H9OCH2CH(CH3)OH C3H7OCH2CH(CH3)OH CH3COOC2H4OC2H5 18 7 14 11 17 20 10 22 14 22 19 32 60 30 80 25 54 28 64 40 25 100 73 74 88 95 66 13 8 14 14 15 15 12 17 13 18 15 28 27 28 49 20 0 30 43 31 20 lns 53 77 lns lns 45
《医学化学》 醛和酮

饱和醛酮 不饱和醛酮
脂肪醛酮 按烃基类别分
O
Ar
C
芳香醛酮 O R Ar C
Ar’ Ar
羰基直接连在 芳环上 O
C H
二、命名 (一) 习惯命名法
醛类按分子中碳原子数称某醛(与醇相似)。包含 支链的醛, 支链的位次用希腊字母α,β,γ…表明。
O CH3CHCH2CH2CHO CH3CH CHCH
γ-甲基戊醛 γ-methylpentanal 2-丁烯醛 2-butenal
O R C R'
H OR
+
H OH H NH-NH2 XMg R''
OH RR'C CN OH RR'C SO3Na OH RR'C OR OH RR'C OH OH RR'C NHNH2 OMgX RR'C R''
C=O与C=C在结构上有相似之处,能发生一系列加成反应, 烯烃——亲电加成;羰基——亲核加成
CH3(CH2)3CH(OCH3)2
S的亲核能力比O强, 故硫醇与羰基的加成比醇容易。
R C O R
+
HS HS
H+
R C R
S S
缩硫醛酮很难分解为原来的醛酮, 但可经催化加氢还原 为烃。这是将羰基转变成亚甲基的简便方法。
R C R
S S
Ra(Ni) R H2 R
CH2 + CH3CH3↑ + H2S↑
C O + H2N G (R')H
羰基试剂
R
H+
R (R')H
C
OH NH G
-H2O
R C N G (R')H
有机化学:第十二章 醛和酮

分子量
58
58
58
60
沸点
-0.5
48.8
56.1
97.2
共四十八页
第三节 醛酮的化学性质(huàxuéxìngzhì)
δ δO CC
H
R (H )
酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳
涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应
卤代反应
醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。
机理(jī lǐ):
共四十八页
氨的衍生物能与醛、酮起加成反应,用于鉴别羰基的存在,称为羰基 试剂。
常用试剂:2,4-二硝基苯肼
R C
R'
O + H2NNH
NO 2
NO 2
R
-H2O
C
NNH
R'
NO 2
NO 2
黄色(huángsè)结 晶
反应产物用稀酸水解(shuǐjiě),可生成原来的醛、酮。用与分离和提纯醛或酮。
羰基是醛、酮的官能团。
O
R1
R
CO
CO
R2
H
O
羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质(wùzhì),如甘油
醛
(HOCH2CHOHCHO)和丙酮酸 (HOOCCOCH3)是细胞代谢作用的基本成分,
又是有机合成的重要原料和中间体。
共四十八页
第一节 醛和酮的分类(fēn lèi)和命名
共四十八页
一 、亲核加成反应(jiā chénɡ fǎn yīnɡ)
亲核加成反应是羰基(tānɡ jī)的特征反应,亲核试剂NuA与羰基C=O反应。
有机化工溶剂品种理化特性.
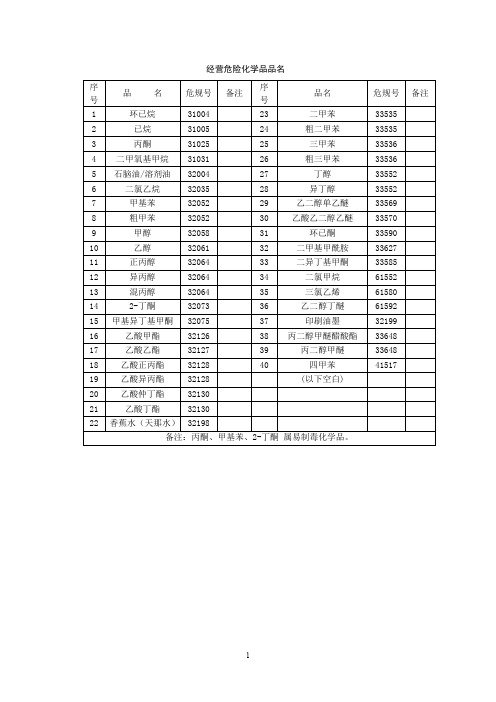
经营危险化学品品名
表1 环己烷理化性质及危险特性
表2 己烷理化性质及危险特性
表3 丙酮理化性质及危险特性
表4 二甲氧基甲烷(甲缩醛)理化性质及危险特性
表5 石脑油理化性质及危险特性
表6 1,1-二氯乙烷理化性质及危险特性
表7 甲基苯理化特性及危险特性
表8 甲醇理化特性及危险特性
表9 乙醇理化特性及危险特性
表10 1-丙醇理化特性及危险特性
表12 2-丁酮理化特性及危险特性
表13 甲基异丁基甲酮理化特性及危险特性
表14 乙酸甲酯理化特性及危险特性
表15 乙酸乙酯理化特性及危险特性
表16 乙酸正丙酯理化性质及危险特性
表17 乙酸异丙酯理化性质及危险特性
表18 乙酸仲丁酯理化特性及危险特性
表19 乙酸丁酯理化特性及危险特性
表20 硝基漆稀释剂理化特性及危险特性
表21 1,2-二甲苯理化性质及危险特性
表22 1,2,4-三甲苯理化性质及危险特性
表23 正丁醇理化性质及危险特性
表24 异丁醇理化性质及危险特性
表26 乙酸乙二醇乙醚理化性质及危险特性
表27 环己酮理化特性及危险特性
表28 N,N-二甲基甲酰胺理化特性及危险特性
表29 二异丁基甲酮理化性质及危险特性
表30 二氯甲烷理化性质及危险特性
表31 三氯乙烯理化性质及危险特性
表32 2-丁氧基二醇理化特性及危险特性。
常见的醛和酮 醛和酮的化学性质

实验现象
有砖红色 沉淀产生
_C_H__3C__H_O__+__2_[_A_g_(_N_H__3)_2]__ C__H_3_C__H_O__+__2_C_u_
△ 化学方程式 _O_H__―__―_→__
△ _(O__H__)2_―__―_→___
_C_H__3C__O_O__N_H__4+ ___2_A_g_↓__+__ C__H_3_C_O__O__H_+__
3_N__H_3_+__H__2O__
_C_u_2_O_↓__+__2_H__2_O__
(2)还原反应:
醛、酮能在铂、镍等催化剂的作用下与 H2 加成,反应的化 学方程式分别为:
催化剂 RCHO+H2 ――→
RCH2OH
;
催化剂 +H2 ――→ ___________。
探究 3 问题探究 问题(1) 如何鉴别醛和酮两种物质? 提示:可用银氨溶液或新制 Cu(OH)2 悬浊液鉴别,前者有银镜 或砖红色沉淀的现象产生。 问题(2) 结合甲醛分子结构特点,甲醛发生银镜反应的化学方 程式是? 提示:甲醛是最简单的醛,通常把它归为饱和一元醛,但它相
△ ――→ RCOONH4 + 3NH3 (OH)2
△ ――→RCOΒιβλιοθήκη H++2Ag↓+H2O
Cu2O↓+2H2O
反应现象
产生光亮银镜
产生砖红色沉淀
R—CHO~2Ag 量的关系
HCHO~4Ag
R—CHO ~ 2Cu(OH)2 ~ Cu2OHCHO~4Cu(OH)2 ~2Cu2O
银镜反应
与新制 Cu(OH)2 悬浊液反应
几种与醛反应的试剂及加成产物如下表:
试剂名称
化学式
δ+ δ- 电荷分布 A—B
醛类与酮类化合物的性质与应用实验

醛类与酮类化合物的性质与应用实验化学实验是化学学习过程中不可或缺的一部分,通过实验我们可以深入了解化合物的性质与应用。
本文将介绍醛类与酮类化合物的性质与应用,并结合实验进行具体探究。
一、醛类与酮类化合物的性质醛类与酮类化合物都是有机化合物的重要类别,它们的共同特点是含有碳氧双键。
1. 醛类化合物的性质醛类化合物的通式为RCHO,其中R可为烷基、烯基或芳香基。
醛类化合物具有以下性质:(1)氧化性:醛类化合物易被氧化为相应的羧酸,在强氧化剂的作用下能发生氧化反应。
(2)还原性:醛类化合物在还原剂的作用下能够被还原为相应的醇。
(3)合成性:醛类化合物可以通过酸催化下的氧化反应或氧化还原反应等途径合成。
2. 酮类化合物的性质酮类化合物的通式为RCOR',其中R和R'可分别为烷基、烯基、芳香基等。
酮类化合物具有以下性质:(1)稳定性:酮类化合物比醛类化合物更稳定,不容易发生氧化反应。
(2)溶解性:酮类化合物在水中的溶解性相对较差,但溶解于有机溶剂。
(3)活性:酮类化合物可通过还原反应将酮基还原为醇基。
二、醛类与酮类化合物的应用实验通过实验,我们可以更加直观地了解醛类与酮类化合物的性质与应用。
下面将介绍两个常见的实验案例。
1. 醛类化合物的氧化反应实验实验目的:探究醛类化合物的氧化性质。
实验步骤:(1)准备试剂:取适量的甲醛(HCHO)溶液和硫酸铜溶液。
(2)将甲醛溶液倒入试管中,加入硫酸铜溶液。
(3)观察并记录结果。
实验结果:甲醛溶液在硫酸铜溶液的作用下发生氧化反应,产生蓝色碳酸铜络合物,观察到溶液颜色的变化。
2. 酮类化合物的还原反应实验实验目的:探究酮类化合物的还原性质。
实验步骤:(1)准备试剂:取适量的丙酮(CH3-CO-CH3)溶液和氢气气体。
(2)将丙酮溶液倒入反应瓶中。
(3)通过导管引入氢气气体。
(4)观察并记录结果。
实验结果:丙酮溶液在氢气气体的还原作用下发生反应,观察到溶液逐渐变为无色,生成丙醇。
有机化学基础知识点整理酮与醛的性质与反应

有机化学基础知识点整理酮与醛的性质与反应【有机化学基础知识点整理】酮与醛的性质与反应一、酮与醛的定义酮和醛都是有机化合物中的一类功能团,酮的通式为R1-CO-R2,醛的通式为R-CO-H。
它们在化学结构上都含有一个碳氧双键,而酮分子中的碳氧双键是接在碳链中的,醛分子中的碳氧双键则是接在碳链的末端。
二、酮与醛的性质1. 沸点和熔点:酮和醛的沸点和熔点相对较高,这是由于它们分子中的极性碳氧双键以及分子间的氢键相互作用所致。
2. 溶解性:酮与醛通常可溶于极性溶剂,如水、醇等。
酮是非常好的溶剂,可溶于一些有机溶剂,如醚、醇等。
而醛则与水反应生成相应的醇,因此溶解性较差。
3. 反应活性:由于酮和醛分子中碳氧双键的存在,它们具有一定的反应活性。
酮中的羰基碳亲电性较强,易于发生亲电取代反应;而醛中的羰基碳和羰基氧都具有亲电性,容易发生亲核加成反应。
4. 氧化性和还原性:酮具有相对较低的氧化性和还原性。
醛则比酮更容易被氧化,可以发生醛的氧化反应生成相应的羧酸。
而酮的羰基碳不能够被氧化。
三、酮与醛的反应1. 加成反应:酮和醛都可以与亲核试剂发生加成反应。
例如,可以与氨或胺发生加成反应,生成相应的亚胺或胺;与水或醇发生加成反应,生成相应的醇。
酮和醛与罗丹明B等亲核试剂的加成反应可用于化学定量分析中。
2. 缩合反应:酮和醛可以与亲核试剂发生缩合反应,生成相应的α-羟基化合物。
例如,与氨或胺发生缩合反应,生成相应的肼;与含氢试剂(如硼氢化钠)发生缩合反应,生成相应的醇。
3. 氧化反应:醛具有较强的氧化性,可以与氧和氧化性试剂反应,生成相应的羧酸。
常用的氧化性试剂有高锰酸钾、过氧化氢等。
4. 还原反应:酮可以通过还原反应转化为相应的醇。
常用的还原试剂有金属钠、金属铝等。
四、应用领域酮和醛广泛应用于医药、农药、染料、香料、合成材料等领域。
例如,酮类化合物多具有良好的生物活性,是许多重要药物的结构骨架;醛类化合物常用于染料和香料的合成。
有机化学-醛酮

例1:
PPh3 + phCHO
?
6、与磷叶立德反应
例2:
CH2
例3:CH3ClH-CH2-OH CH3
CH3ClH-CH=CH2 CH3
7、与Schiff (西夫)试剂的反应
品红(染料)+SO2
无色品红醛试剂( Schiff)
甲醛 无色品红醛试剂 其它醛
硫酸 紫红色
紫红色
无色
酮 无色品红醛试剂 不反应(颜色不变)
Rˊ-CH-R OH
(仲醇)
O Rˊ-C-ˊRˊ+RMgX
OH
①干醚 ②H+, H2O
Rˊ—C—Rˊˊ (叔醇)
R
O RCH
+ HO R'
干燥HCl
OH RCH
半缩醛
H2O
O R'
OH
RCH O R'
HO R' 干燥HCl H2O
O R' R C H + H2O
O R'
缩醛
H2C H2C
H2C
OH O 干燥HCl
ll CH2=CH-CH2-C-CH3
?
CH2=CH2CH2CH2CH3
O ll CH3-CH-CH2-C-CH3 Cl
? CH2-CHCH2CH2CH3
Zn-Hg HCl
Cl
O C CH2CH3
H2N-NH2,NaOH 二缩乙二醇,200oC
CH2CH2CH3
(三)氧化反应
1、醛的氧化(R-CHO 氧化剂 RCOOH)
γ-溴丁醛 γ-bromobutyraldehyde
酮
O
常见的醛酮

AgNO3+NH3·H2O
AgOH↓+NH4NO3
AgOH+2NH3·H2O====[Ag(NH3)2]OH+2H2O
氢氧化二氨合银
[Ag(NH3)2]+——银氨络合离子
第二十二页,共46页。
(2)水浴加热生成银镜:
向银氨溶液中滴几滴乙醛溶液,把试管放在热水 浴中静置。
CH3CHO+2[Ag(NH3)2]OH
几种常见的醛酮结构简式简介用途甲醛乙醛有刺激气味的气体气体易溶于水制造酚醛树脂3540的甲醛水溶液被称作福尔马林有刺激气味的无色hch易溶于水制造酚醛树脂3540的甲醛水溶液被称作福尔马林有刺激气味的无色hchoooo乙醛苯甲醛丙酮液体易溶于水有杏仁气味的液体制染料香料的重要中间体特殊气味的无色液体与水以任意比互溶常用的有机溶剂和重要的有机合成原料液体易溶于水有杏仁气味的液体制染料香料的重要中间体特殊气味的无色液体与水以任意比互溶常用的有机溶剂和重要的有机合成原料ch3cch33ochoch33chcc66hh55choo自主学习
OH
第三十三页,共46页。
一、醛和酮组成和结构的比较
类别 结构 特点
醛 R-CHO
酮
R CO
R'
官能团 醛基
羰基 C O
通式 关系
饱和一元醛 CnH2nO(n≥1)
饱和一元酮 CnH2nO(n≥3)
分子中碳原子数相同的饱和一元醛和饱和一 元酮互为同分异构体
第三十四页,共46页。
二、掌握醛的主要化学性质
官能团:
反应类型
C=O
(H)
加成 反应
官能团中的碳原 子是否饱和: 结构←→性质
氧化
不饱和
d+d-
常用溶剂极性、粘度、密度、紫外吸收、毒性和互溶性表

常用溶剂极性、粘度、密度、紫外吸收、毒性和互溶性表
有机溶剂是指在生活和生产中广泛应用,分子量不大,常温下呈液态,能够溶解多种物质的一大类有机化合物。
有机溶剂的种类较多,按其化学结构可分为以下10大类:
①芳香烃类:甲苯、苯、二甲苯等;
②脂肪烃类:戊烷、己烷、辛烷等;
③脂环烃类:环己烷、环己酮、甲苯环己酮等;
④酮类:丙酮、甲基丁酮、甲基异丁酮等;
⑤醇类:甲醇、乙醇、异丙醇等;
⑥醚类:乙醚、环氧丙烷等;
⑦酯类:醋酸甲酯、醋酸乙酯、醋酸丙酯等;
⑧卤化烃类:氯苯、二氯甲烷、二氯苯等;
⑨二醇衍生物:乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;
⑩其他:乙腈、吡啶、苯酚等。
虽然有机溶剂的种类已达3万多种,不过有机/生物/分析/药学/食品等实验室平时用到的有机溶剂种类并不太多。
笔者结合实际情况,整理了几十种常用有机溶剂(下面统计包括水),并对其相对分子极性、粘度、沸点、相对密度、紫外、毒性进行了简单梳理,分享给各位同仁,希望能够方便大家查阅。
有机溶剂互相之间大多可以互溶,但这也并非绝对。
很多人会对一些常见溶剂的互溶性判断失误,或者对一些溶剂的
互溶性并不确定,例如乙腈能否溶于水?乙腈跟正庚烷是否互溶?等等诸如此类问题。
为了更好的让大家及时准确判断常见溶剂的互溶性,笔者总结梳理了以下表格,仅供大家学习交流之用。
熟悉了解常见溶剂的互溶性问题,对我们在实际生产和科研生活中具有很好的现实指导意义。
有机化学——醛、酮、醌

不溶于饱和NaHSO3 溶液 不溶于饱和
OH H3C H SO3Na
HCl Na2CO3
CH3CHO + NaCl + SO2 + H2O CH3CHO + Na2SO3 + CO2 + H2O
反应用来分离、提纯或鉴别。 反应用来分离、提纯或鉴别。
与醇加成:半缩醛与缩醛的生成 (3) 与醇加成:半缩醛与缩醛的生成
* 醛、酮的化学性质
烯烃亲电加成的特征: 回顾烯烃亲电加成的特征: 亲电试剂、 亲电试剂、π-络合物及碳正离子的形成
羰基进行 加成反应 时,其历程与C=C加 成相同吗?
碳-碳双键及碳-氧双键的比较 碳双键及碳-
δ
C C
+
δ O
-
羰基碳显正电性, 易受亲核试剂的进 攻
1、羰基的亲核加成反应 、
加成( 脂肪族甲基酮和含有8 (1) 与HCN加成(醛、脂肪族甲基酮和含有 加成 以下的环酮) 个C以下的环酮) 以下的环酮
O
+
H H
O
OH
O
+
H
KOH 60%
CH2OH
+
OH
R R R CHO
Ca(OH)2 R
R CH2OH R
R
+
R R
COOH
…然而,交叉的氧化还原反应更有应用价值 然而,
CHO
O H-C-H
CH2OH 30% NaOH
+
OMe
+
OMe 85~90%
HCOO-
不饱和环状共轭二酮,无芳香性) Ⅱ 醌(不饱和环状共轭二酮,无芳香性)p209
NaOH
醛酮结构及化学性质

O– CH3–C–H
CN
H2O
OH
CH3–C–H + OH–
CN
影响亲核加成的因素
亲核试剂 亲核性 同种试剂 C+
加成 加成
空间位阻 大
加成
O
OH
CH3–CH2–C–CH3 + HCN OH– CH3CH2–C–CH3
(R) OH
CH3CH2–C–CH3
CN
浓H2SO4
OH
CH3CH2–C–COOH
稀NaOH
O 2 C6H5–C–CH3
O
A1[OCH(CH3)2]3 100℃ 二甲苯
HO
O
C6H5–C=CH–C–C6H5 CH3 77%
C6H5–C–CH3 + H2C–C–C6H5 A1[OCH(CH3)2]3
100℃ 二甲苯
OH H O
O
C6H5–C – CH– C–C6H5 A1[OCH(CH3)2]3 C6H5–C=CH–C–C6H5
2°
MgX2
O
(1)无水乙醚
CH3-C-CH3 + CH3CH2MgX (2)H2O
CH3
CH3-C-OH
+ MgX2
CH2CH3
3º
试设计用 Grignaro (试剂)制取 2-苯基-2-丁醇
CH3CH2MgX +
O C-CH3
无水乙醚
CH3CH2
OMgX C CH3
H+ H2O
OH CH3CH2 C CH3
CHI3 + RCOONa
OH CH3–C–R(H)
H
NaOH
+ I2
CHI3
有机化学之醛和酮

④,-不饱和羰基化合物的共轭加成。
1.羰基的亲核加成
C O + Nu-
Nu [ C O- ] E+
氧负离子中间体
Nu C OE
第一步(亲核)决定反应速率。
加成反应的活性与试剂亲核性强弱、羰基碳原子亲电性强弱、
羰基所连R基大小,即电子效应、立体效应等因素有关。
羰基化合物发生亲核加成反应的活性顺序:
X OX C C R] X X
X
X
XO
XC C R
X
形成烯醇负离子决定反应速率。碱催化-卤代难停留在一元
取代。
OX C C X + OH-
X
卤仿反应应用
鉴
O
别 CH3 C
、CH3
O- X CC
X HO
X
碳碳键断
OH CH
O -
C OH + CX3
COO- + HCX3 (Haloform)
C CH3 + 3I2 + 3OHO
R OR'
OH-
H C OR' + H2O
no reaction
(2)缩酮的生成 平衡主要逆向。一般得不到半缩酮或缩酮,要不断除水
或用特殊试剂(原甲酸三乙酯)
CH3 CH3
C
O + 2CH3CH2OH
H+
CH3 CH3
C
OCH2CH3 OCH2CH3
+ H2O
(不断除水)
用1,2-二醇或1,3-二醇则易生成环状缩酮
C O+
H2N-NH
NO2
>C=N-NH
NO2
O2N (2,4-二硝基苯肼)
第十一章醛和酮

第十一章醛和酮教学目的:能正确命名醛、酮,掌握羰基亲核加成反应的历程和影响反应速度的因素,了解其在分离、鉴别、有机合成中的应用。
掌握醛、酮的主要化学性质及其在分离、鉴别、有机合成中的应用。
教学重点:羰基亲核加成反应,醛、酮的化学性质教学难点:羰基亲核加成反应历程。
第一节醛、酮的分类,同分异构和命名一、分类根据烃基的不同可以分为脂肪醛、酮和芳香醛、酮。
脂肪醛CH3CH2CHO 脂肪酮CH3COCH3脂环醛CHO脂环酮O=芳香醛CHO芳香酮COCH3根据烃基是否含有重键又可以分为饱和醛、酮和不饱和醛、酮。
不饱和醛CH3CH=CHCHO不饱和酮CH3CH=CHCOCH3根据羰基的个数可以分为一元醛、酮和多元醛、酮。
二元醛CH2CHOCH2CHO二元酮CH3CH2COCH2COCH3二、同分异构现象醛的同分异构---碳链异构引起。
酮的同分异构---碳链异构、碳基位置异构。
同碳数饱和一元醛酮,分子式CnH 2n O ,互为同分异构:三、命名1. 系统命名法:(1)选择含羰基最长碳链作主链,称为某醛或某酮;(2)由于醛基是一价原子团,必在链端,命名时不必用数字标明其位置。
酮基的位置则需用数字标明,写在“某酮”之前,并用数字标明侧链所在的位置及个数,写在母体名称之前。
例如:2- 甲基丙醛 2- 苯基丙醛3-甲基-6-庚炔醛C 6H 5CHCHOCH 37HCCCH 2CH 2CHCH 2CHOCH 3654321CH 3CHCHOCH 3CH 3COCH 3丙酮CH 3COCH 2CH 3丁酮CH 3CO(CH 2)CH 32-己酮CH 3COCH 2COCH 2CH 32,4-己二酮COCH 2CH 31-苯-1-乙酮(苯乙酮)1-环己基-1-丙酮COCH 32. 普通命名法醛的命名与醇的习惯命名法相似,称某醛;脂肪酮则按酮基所连接的两个烃基而称为某(基)某(基)酮。
例如:CH 3CHO 乙醛 CH 3CH (CH 3)CHO 异丁醛甲基乙基酮甲基苯基酮(1-苯基-1-乙酮)CH 3C OCH 3C 2H 5C O另外,醛、酮命名时习惯上还采用希腊字母α、β、γ等,α碳指与醛基或酮基直接相连的碳原子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
部分酮类溶剂理化特征表
序号
名称
沸点℃
凝固点
密度爆Biblioteka 极限%溶解性1丙酮
56.05
-94.7
0.7845
2.6~12.8
能与水、乙醇、N,N-二甲基甲酰胺、氯仿、乙醚及大多数油类混溶。
2
丁二酮
88
-4 ~ -2
0.99
有强烈气味的黄绿色油状液体,一体积的丁二酮溶于四体积的水
部分酮类溶剂理化特征表
序号
名称
沸点℃
凝固点
密度
爆炸极限%
溶解性
1
甲醛
-19.5
-118
1.081~1.085
易溶于水和乙醇,35~40%的甲醛水溶液叫做福尔马林
2
乙缩醛
102.7
-100℃
0.83
低闪点易燃液体
溶解性溶于水、乙醇、乙醚
3
糠醛
-38.7
161.7
1.1594
闪点:60℃
微溶于冷水,溶于热水、乙醇、乙醚、苯
