化学试剂--Weinreb酰胺
weinerb 酰胺反应机理 -回复

weinerb 酰胺反应机理-回复酰胺是一类重要的有机化合物,广泛应用于医药、农药、染料和材料科学等领域。
其中,酰胺合成中的关键反应之一就是weinerb酰胺反应,也被称为weiner反应或weiner合成。
1. 简介weinerb酰胺反应是通过醛酮与酰胺基团发生反应,生成酰胺化合物的一种方法。
该反应以其高效、温和和多样性而闻名。
weinerb酰胺反应可利用不同的底物、催化剂和条件来合成各种具有生物活性和药理学意义的酰胺。
2. 反应机理(步骤1)首先,通过醛或酮的羰基碳与底物中的酰胺氮原子形成n-键。
在酸性条件下,氮和羰基之间的质子转移形成亚胺中间体。
(步骤2)此时,亚胺中间体进一步亲核加成攻击底物中的羰基碳,生成稳定的酮型中间体。
这个步骤类似于一般的亲核加成反应,与亚胺的位置有关。
在此步骤中,酰胺中的氮原子充当亲核试剂。
(步骤3)酮型中间体进一步与醛或酮继续进行第二次亲核加成反应。
这一步骤可以重复多次,直到获得所需的酰胺化合物。
3. 催化剂早期的weinerb酰胺反应需要强酸催化剂,如二氯甲磺酸或三氯甲磺酸等。
然而,现代weinerb酰胺反应已经发展出多种选择的催化剂体系。
一种常见的催化剂体系是酸碱型催化剂,如DNA碱基或天然氨基酸。
这种催化剂体系可以在中性条件下进行反应,避免了使用强酸的副作用。
此外,该催化剂体系对于底物的选择性也具有一定的影响。
另一种催化剂是过渡金属催化剂,如钼、铌、钯、铂等。
这些催化剂可以通过配体的选择来调控反应的速度和选择性。
此外,过渡金属催化剂还具有催化复杂底物和亲核试剂的特点。
4. 应用weinerb酰胺反应在有机合成中具有广泛的应用前景。
由于该反应具有高效、温和和多样性的特点,可以为药物发现、生物活性评估和材料科学提供合适的合成方法。
在药物发现中,weinerb酰胺反应可以用于合成具有生物活性的酰胺化合物。
这些化合物可以用于药物库筛选和结构活性相关性研究。
在生物活性评估中,weinerb酰胺反应可以用于合成化合物库,以评估其生物活性和毒性。
有机合成中碳链上增加一个碳原子的方法

有机合成中碳链上增加⼀个碳原⼦的⽅法⼀、以甲醛或甲醛等价物为底物进⾏反应增加碳链1、羟醛缩合反应(Aldol condensation)醛酮在碱性条件下得到烯醇盐和另⼀个羰基化合物缩合得到β-羟基醛酮的反应。
当利⽤甲醛作为底物时则底物增加⼀个碳。
Evans羟醛缩合反应,Abiko-Masamune羟醛缩合反应,Mukaiyama羟醛缩合反应2、Arens-van Dorp反应烷氧基⼄炔在强碱条件下对醛酮加成得到烷氧基炔甲醇的反应。
3、Stobbe condensation丁⼆酸⼆⼄酯及其衍⽣物和羰基化合物在碱性条件下进⾏缩合的反应。
4、Knoevenagel缩合反应羰基化合物和活泼亚甲基化合物在胺催化下缩合的反应。
5、Stetter反应醛和α,β-不饱和酮在噻唑盐的催化下反应制备1,4-⼆羰基化合物的反应。
噻唑盐是氰离⼦的安全替代试剂。
此反应也被称为 Michael-Stetter反应,机理和安息⾹缩合类似。
此反应直接利⽤甲醛作为底物的报道较少,但是有⽂献报道利⽤糖作为甲醛替代物进⾏反应可以得到多⼀个碳的1,4-⼆羰基化合物。
【J. Am. Chem. Soc. 2013, 135, 8113–8116】6、Barbier反应在有机⾦属试剂存在下,羰基化合物可以迅速与其反应,这类反应被称为Barbier反应。
7、Grignard反应(格⽒反应)格⽒反应有多多种⽅式增加碳链,可以考虑以甲醛为底物和格⽒试剂进⾏反应增加⼀个碳链得到醇,也可以以⼆氧化碳为底物进⾏加成得到羧酸,或者直接利⽤甲基格⽒试剂对其他亲电试剂进⾏延长碳链。
8、Kagan-Molander偶联反应9、贝蒂反应(Betti Reaction)酚与芳⾹醛和伯胺作⽤得到 α-氨基苯甲酚类。
这个反应可以视为苯酚的Mannich反应。
10、Mannich反应1903年,B. Tollens和von Marle发现苯⼄酮和甲醛,氯化铵反应可以⽣成三级胺。
酰胺的合成讲解

经典化学合成反应标准操作酰胺及酰亚胺的合成目录1. 前言 (3)2. 羧酸与胺的缩合酰化反应 (3)2.1活性酯法 (3)2.1.1应用氯甲酸乙酯或异丁酯活性酯法合成酰胺示例 (5)2.1.2应用氯甲酸乙酯或异丁酯活性酯法合成伯酰胺示例 (5)2.1.3应用羰基二咪唑合成Weinreb酰胺示例 (6)2.1.4应用的磺酰氯合成酰胺示例 (6)2.1.5应用Boc酸酐合成伯酰胺示例 (7)2.2碳二亚胺类缩合剂法 (7)2.2.1应用DCC缩合法合成酰胺示例 (9)2.2.2应用DIC缩合法合成酰胺示例 (10)2.2.3应用EDC缩合法合成酰胺示例一(二氯甲烷为溶剂) (10)2.2.4应用EDC缩合法合成酰胺示例二(DMF为溶剂) (11)2.3 鎓盐类的缩合剂法 (11)2.3.1应用HATU/TBTU为缩合剂合成酰胺示例 (13)2.3.2应用BOP为缩合剂合成酰胺示例 (14)2.3.3应用PyBOP为缩合剂合成酰胺示例一(常规) (14)2.3.4应用PyBOP为缩合剂合成酰胺示例二(用于合成伯酰胺) (15)2.4 有机磷类缩合剂 (15)2.4.1应用DPP-Cl为缩合剂合成酰胺示例 (16)2.4.2应用DPPA为缩合剂合成酰胺示例 (16)2.4.3应用BOP-Cl为缩合剂合成酰胺示例 (17)2.5.1应用三苯基磷-多卤代甲烷合成酰胺示例 (18)2.5.2应用三苯基磷-六氯丙酮合成酰胺示例 (18)2.5.3应用三苯基磷-NBS合成酰胺示例 (19)3. 氨或胺与酰卤的酰化反应 (19)3.1酰卤的制备示例 (20)3.5.1应用二氯亚砜合成酰氯示例 (20)3.5.2用草酰氯合成酰氯示例 (21)3.5.3用三氯均三嗪合成酰氯示例 (21)3.5.4用三氟均三嗪合成酰氟示例 (22)3.1应用酰卤的合成酰胺 (22)3.5.1应用酰氯合成酰胺示例(有机碱) (22)3.5.2应用酰氯合成酰胺示例(无机碱) (22)3.5.3应用酰氟合成酰胺示例 (24)4. 氨或胺与酸酐的酰化反应 (24)4.2酸酐合成酰胺示例 (25)5. 其他缩合方法 (25)1. 前言酰胺化是有机合成中最基本,也是最重要的合成方法之一。
weinerb 酰胺反应机理 -回复

weinerb 酰胺反应机理-回复"Weinerb酰胺反应机理"是有关有机合成中的重要反应之一,它是通过以酰胺作为底物进行的一个有机化学反应。
本文将详细解释Weinerb酰胺反应的机理,并一步一步回答这个问题。
首先,我们来了解一下Weinerb酰胺反应的定义。
Weinerb酰胺反应是指一类化合物间的反应,其中一个酰胺分子和一个碳酸酯分子在酸性条件下反应生成一种中间体α-酮酸酯的反应。
这个反应机制被广泛应用于有机合成中的关键步骤和中间体的制备。
Weinerb酰胺反应的机理如下:步骤1:质子化在反应开始时,酸性条件下的质子化是触发Weinerb酰胺反应的第一步。
在该步骤中,酸性条件使得碳酸酯和酰胺分子的酰基氧原子上的氢离子化。
这个质子化过程在一个质子酸(如HCl)的存在下发生,它将生成质子化的酰胺阴离子和质子化的碳酸酯阳离子。
步骤2:核机理的生成当质子化发生后,酰胺阴离子中的负电荷将会使氮原子成为一个强亲核试剂。
这会导致亲电的碳酸酯与酰胺阴离子氮原子之间的核机理的生成。
此时,碳酸酯中的羰基碳原子带有部分正电荷,对氮原子的亲电性质起到了吸引和促进作用。
亲核的酰胺阴离子会攻击碳酸酯中的羰基碳原子,从而形成羰基碳原子与氮原子之间的键合。
步骤3:中间体的形成在酰胺阴离子与碳酸酯之间的核机理反应完成后,将会形成一个新的中间体。
这个中间体是一个带有羰基碳原子、酰胺残基和氧原子的中间体。
这个中间体称为α-酮酸酯。
此时,中间体具有两个可能的反应途径。
它可以通过质子化和缩合反应生成酰胺酯,或通过质子化和断裂反应生成酮化合物。
步骤4:产物的生成当中间体形成后,它会进一步发生转化以生成最终的产物。
这可以通过两种不同的方式实现。
首先,中间体可以通过水分子的加入和加热以形成酰胺酯作为产物。
第二,中间体也可以通过碱性条件下的断裂反应而转化为酮化合物。
总结起来,Weinerb酰胺反应机理涉及到四个主要步骤:质子化、核机理的生成、中间体的形成和产物的生成。
经典合成反应标准操作

经典化学合成反应标准操作药明康德新药开发有限公司化学合成部编写前言有机合成研究人员在做化学反应经常碰到常规的反应手边没有现成的标准操作步骤而要去查文献,在试同一类反应时,为了寻找各种反应条件方法也得去查资料。
为了提高大家的工作效率,因此化学合成部需要一份《经典合成反应标准操作》。
在这份材料中,我们精选药物化学中各类经典的合成反应,每类反应有什么方法,并通过实际经验对每类反应的各种条件进行点评,供大家在摸索合成条件时进行比较。
同时每种反应的标准操作,均可作为模板套用于书写客户的final report,这样可以大大节省研究人员书写final report的时间,也相应减少在报告中的文法错误。
另外本版是初版,在今后的工作中我们将根据需要修订这份材料。
药明康德新药开发有限公司化学合成部2005-6-28目录1.胺的合成a)还原胺化b)直接烷基化c)腈的还原d)酰胺的还原e)硝基的还原f)叠氮的还原g)Hoffman降解h)羧酸通过Cris 重排2.羧酸衍生物的合成a)酰胺化的反应b)酯化反应c)腈转化为酯和酰胺d)钯催化的插羰反应e)酯交换为酰氨3.羧酸的合成a)醇氧化b)酯水解c)酰胺的水解d)腈的水解e)有机金属试剂的羰基化反应f)芳香甲基的氧化4.醛酮的合成a)Weinreb 酰胺合成醛酮b)醇氧化c)酯的直接还原d)有机金属试剂对腈加成合成酮5.脂肪卤代物的合成a)醇转化为脂肪溴代物通过PBr3 转化通过PPh3 与CBr4 转化HBr直接交换通过相应的氯代物或磺酸酯与LiBr交换、b)醇转化为脂肪氯代物通过SOCl2转化通过PPh3 与CCl4 转化HCl直接交换c)醇转化为脂肪碘代物通过PPh3 与I2 转化通过相应的氯代物或磺酸酯与NaI交换6.芳香卤代物的合成a)Sandermyyer 重氮化卤代b)直接卤代c)杂环的酚羟基或醚的卤代7.醇的合成a)羧酸或酯的还原b)醛酮的还原c)卤代烃的水解.d)吡啶的氧化转位8.酚的合成a)Sandermayer 重氮化反应b)醚的水解c)Bayer-vigerlar 氧化d)硼酸的氧化9.腈的合成a)磺酸酯或卤代烃的取代b)酰胺的脱水c)芳卤代烃的氰基取代10.硝化反应11.醚的合成a)芳香醚的合成酚与烷基卤代烃的直接烷基化Mitsunobu 芳香醚化Buckwald芳香醚化b)脂肪醚的合成醇的醚化12.脲的合成a)胺与异腈酸酯的反应b)用三光气合成脲c)羰基二咪唑(CDI)合成脲d)对硝基苯酚碳酰胺合成脲.13.烯烃的合成a)Wittig 反应b)羟基的消除c)Wittig-Horner 反应合成α,β-不饱和酯14.磺酸及磺酰氯的合成a)氯磺化反应合成磺酰氯b)从硫醇合成磺酰氯c)磺化反应15.氨基酸的合成a)Streck 反应合成b)手性氨基酸的合成16.偶联反应a)Suzuki Couplingb)Buckwald 芳胺化,芳酰胺化、c)Heck 反应17.Mitsunobu 反应a)醇的反转b)胺的取代18.脱羟基反应19.酮还原为亚甲基.20.氨的保护及脱保护策略a)用碳酰胺作保护基b)苄基保护21.醇的保护及脱保护策略a)用硅醚进行保护b)其他醚类保护22.羧基的保护Boc脱保护-------------------------------------------------------------------------------------------------------1格氏反应---------------------------------------------------------------------------------------------------------1 还原胺化---------------------------------------------------------------------------------------------------------2卤化反应---------------------------------------------------------------------------------------------------------2 Suzuki coupling-------------------------------------------------------------------------------------------------2 磺化反应---------------------------------------------------------------------------------------------------------3 酯化反应---------------------------------------------------------------------------------------------------------3 水解反应---------------------------------------------------------------------------------------------------------3 硝化反应---------------------------------------------------------------------------------------------------------4 n-BuLi------------------------------------------------------------------------------------------------------------4 LiAlH4还原-----------------------------------------------------------------------------------------------------4 POCl3的杂环氯代----------------------------------------------------------------------------------------------5 NaH---------------------------------------------------------------------------------------------------------------5 NBS---------------------------------------------------------------------------------------------------------------5 氢化反应---------------------------------------------------------------------------------------------------------6 m-CPBA----------------------------------------------------------------------------------------------------------6 EDC---------------------------------------------------------------------------------------------------------------6 用三光气成脲---------------------------------------------------------------------------------------------------7 芳卤用n-BuLi处理后与Weinreb酰胺成酮-----------------------------------------------------------------7Boc 上保护OHH 2NHO OOO OOO OHN HO OHO O A BTo a solution of A (2.72 g, 13.9 mmol) and tetramethylammonium hydroxide pentahydrate (5.62 g, 31.0 mmol) in acetonitrile (270 mL) was added di-tert-butyldicarbonate (3.79 g; 17.4 mmol) and the resulting solution was allowed to stir 18 h at rt and concentrated. The residue was partitioned between Et2O/H2O; the phases were separated and the aqueous phase extracted twice more with Et2O. The aqueous phase was brought to pH 4 with solid citric acid and extracted with CHCl3 (3.x.100 mL). The organic extracts were combined, dried (Na2SO4) and concentrated to afford 2.58 g (63 percent) B as a white foam.ReturnBoc 脱保护OON HOO OOH 2NTert-Butyl 2-(2-methoxyphenoxy)ethylcarbamate (23.8 g, 89 mmol) in dichloromethane (10 ml) was cooled to 0 deg C and stirred as a mixture of trifluoroacetic acid: dichloromethane (1:1, 40 ml) was added dropwise. The mixture was allowed to warm to rt, stirred for 2 hours and concentrated in vacuo. The residue was taken back up in dichloromethane (100 ml) and the solution was washed with saturated aqueous sodium hydrogen carbonate (3*20 ml) and aqueous sodium hydroxide (10percent, 3*20 ml), dried (Na2SO4), filtered and concentrated in vacuo to provide 2-(2-methoxyphenoxy)ethylamine (13 g, 88percent yield) as a light yellow solid.Return格氏反应NCNNOA stirred mixture of magnesium turnings (23.6 g, 0.98 mol) and Et2O (200 mL) under nitrogen is treated with a crystal of iodine and about 5percent of a solution of bromoethane (56.3 ml, 0.75 mol) in Et2O (375 mL). When the reaction starts, the remainder of the bromoethane solution is added, dropwise at a rate sufficient to maintain a gentle reflux. After the addition, stirring is continued for 1 hour. To this solution ofethylmagnesium bromide was slowly added a solution of 4-cyanopyridine (39 g, 0.375 mol) in Et2O (750 ml). The reaction mixture was warmed at reflux for 12 hours, treated with concentrated H2SO4 (125 ml)/H2O (125 ml), and then washed three times with Et2O (250 ml). The aqueous portion was made basic (PH 9) with 15percent NaOH solution and extracted five times with 250 ml portions of Et2O. The combined Et2O extracts were dried (MgSO4), and the solvent was removed under reduced pressure to afford a brown oil (48.4 g, 95percent).Return还原胺化OHO H 2N+HON HA solution of 2-amino-4-ethylphenol (1.00 g. 7.28 mmol), 2-naphthaldehyde (1.13 g, 7.28 mmol), and p-toluenesulfonic acid (0.05 g) in methanol (50 ML) was stirred at room temp for 24 h. To the resultant solution, sodium borohydride (0.82 g, 22 mmol) was added in small portions. After addition was completed, the mixture was stirred at room temperature for 30 min and concentrated under vacuum. The residue was then subjected to column chromatography on silica gel eluted with 10percent ethyl acetate in hexane and followed by recrystallization (aqueous methanol) yielded 450 mg (22percent) of analytically pure product.Return卤化反应O 2NO 2NBrTo a stirred solution of 8-methyl-1-nitro-naphthalene (10.6g, 56.32 mmol) and iron (III) chloride (0.45 g, 2.77 mmo) in CCl4 (150 ml) heated to 60°C was added dropwise (3.0 ml, 58.23 mmol) of bromine. After one hour, the reaction mixture was poured into saturated NaHCO3 solution, and the layers were separated. The aqueous layer was re-extracted with CH2Cl2. The combined organic layers were dried (MgSO4) and the solvent was removed under reduced pressure. The crude residue was recrystallized from ethanol and the mother liquors were concentrated and then flash chromatographed on silica, eluding hexanes:ethyl acetate (12: 1).Return Suzuki couplingBrBOO NH+NH To a mixture of 4-(4,4,5,5-tetramethyl-[1,3,2]dioxaborolan-2-yl)-1H-indole (2 g, 8.2 mnmol) and3-bromobenzene (0.87 ml, 8.3 mmol) in THF (28 ml) were added palladium catalyst Pd(PPh3)4 (284 mg, 0.25 mmol) and the freshly prepared sodium hydroxide solution (984 mg in 9 ml of water).The system was degassed and then charged with nitrogen for three times. The mixture was stirred under nitrogen at 70 °C oil bath for 6 hours. The reaction solution was cooled to room temperature, diluted with ethyl acetate and separated from water layer. The ethyl acetate solution was washed by brine, dried over Na2SO4 and concentrated. The residue was purified on a silica gel column eluding with hexanes: EtOAc 9:1 to give 1.38 g (78%yield) of 4-phenyl-1H-indole as a colorless liquid.Return 磺化反应NOFFFNOFFFSOClOChlorosulfonic acid (4.66g, 40 mmol) is added dropwise to a cold (0°C) solution of2,3-dihydro-2-trifluoroacetyl-1H-Benz[de]isoquinoline (2.9g, 8 mmol) in chloroform (800 ml). The resulting solution is stirred at 0°C for 30 minutes. The cold bath is then removed and the solution is stirred at room temperature for 1 hour then cautiously poured into ice water. The organic layer is separated, dried over magnesium sulfate and concentrated to afford the title compound. The crude product is purified by column chromatography eluted with 10% acetic ether in petroleum ether (2.36 g, 81% yield).Return酯化反应HOHO O HOOOA mixture of 4-hydroxymethylnaphthoic acid (10 g, 50 mmol), methanol (300 ml), and concentrate H2SO4 (2 ml) was refluxed overnight. The insolubles were filtered off and the filtrate was concentrated. The residue was taken up in ethyl acetate and washed with aqueous NaHCO3 (2*), brine, dried over MgSO4, and concentrated to give a yellow oil. Silica gel column chromatography using ethyl acetate/hexane (1/3) gave the desired product as a yellow oil (3.3 g, 35%yield).Return水解反应OO OHOA solution of 1-Methyl-naphthalene-2-carboxylic acid methyl ester (7.20g, 35mmol) and 2N sodium hydroxide (35ml) in tetrahydrofuran (130ml) was stirred under reflux for 18 hours. The mixture was neutralised using 2N hydrochloric acid, and extracted with dichloromethane (3x). The combined organic solutions were dried (MgSO4), and evaporated under reduced pressure. The crude product was purified by column chromatography on silica gelusing an elution gradient of dichloromethane: methanol (100:0 to 97:3) to afford the title compound as a solid (3.11g, 47.8%yield).Return硝化反应2To a cold (0°C) suspension of 1-methylnaphthalene (5 g, 35.2 mmol) in HNO3 was added H2SO4 (5 ml)dropwise. After stirring the reaction for one hour, the solution was diluted with ethyl acetate and washed with water (3*), aqueous saturated NaHCO3 (2*) and brine, dried over MgSO4, and concentrated. The product was purified by silica gel column chromatography using ethyl acetate: hexane (5: 95) and recrystallized from methanol to give yellow needles (0.22g, 33% yield).Returnn-BuLiEtOCF 3O CF 3O NCTo a dry three-necked round-bottomed flask with an addition funnel and at -78°C under inert atmosphere was charged with anhydrous THF (500 ml). A solution of n-butyllithium (2.5 M in hexane, 88 ml, 220 mmol) was added dropwise followed by addition of a solution of acetonitrile (10.43 ml, 200 mmol) in anhydrous THF (100 ml). The internal temperature was maintained below -70°C during the entire addition process. After 2 hr at -78°C a solution of Trifluoro-acetic acid ethyl ester (14.2 g, 100 mmol) in anhydrous THF (30 ml) was added dropwise and the mixture was stirred for 1.5 hr. To the mixture was added acetic anhydride to quench the reaction. The reaction mixture was allowed to warm up to rt. A precipitate was filtered and the filtrate was concentrated to give a brown oil, which was used in the next step without purification.ReturnLiAlH4还原HOHO O HOHOA solution of 2,3-naphthalenedicarboxylic acid (4.6 g, 0.023 mole) in dry THF (135 ml, warmed to 50° to maintain solution) is added dropwise over 15 minutes to a 1.15 M lithium aluminum hydride solution in THF (45 ml, 0.052 mole). The solution is stirred 3 hours after which TLC indicated consumption of diacid and formation of a new major product. The reaction is quenched carefully with THF-water, then 2N hydrochloric acid (40 ml) is added, and the resulting mixture is extracted 3 times with ether. The combined ether extracts are washed with water (2 times), with saturated sodium bicarbonate solution (1 time), with water, and are dried (sodium sulfate), filtered, and concentrated to give a tan solid (3.67 g). The solid isrecrystallized from ethyl acetate giving the title compound (2.91 g, 67.3%yield) as a light tan crystalline material.ReturnPOCl3的杂环氯代NNHOOH NClClTo a suspension of 2,4-dihydroxy-5,6-dimethylpyrimidine (6.2 g, 0.044 mol) in POCl3 (25 ml) was slowly added N,N-dimethylaniline (6.18 ml, 0.049 mol). The mixture was then refluxed at 125 °C for 3 hours. After this time, the starting material completely dissolved indicating that the reaction was completed.The reaction mixture was cooled and then poured slowly onto ice to quench the POCl3(caution[exothermic]). A precipitate formed, which was filtered and washed with ice-cold water. The precipitate was dried under high vacuum overnight to yield 2,4-dichloro-5,6-dimethyl-pyrimidine (7.2 g, 0.041 mol, 92%yield) as a yellow solid.ReturnNaHHSH 2N Cl+SNH 2Sodium hydride (50% in mineral oil, 5.5 g, 0.11 mol) was added portionwise at 0 °C under a nitrogen atmosphere to a solution of 2-aminobenzenethiol (12 ml, 0.1 mol) in DMF (120 ml). After 0.5 h, benzyl chloride (11.5 ml, 0.1 mol) in DMF (80 ml) was added in 0.5 h. The solution was stirred for 3 h while the temperature was allowed to rise to rt, then it was poured into ice/water (1000 g). The precipitate was filtered, dissolved in ethyl acetate and washed with brine. The organic layer was dried over Na2SO4 and evaporated. The solid obtained was ground in pentane (19.3 g, 90% yield).ReturnNBSN NFClCl NBSNNFClClBrA mixture of 2,4-Dichloro-6-ethyl-5-fluoro-pyrimidine (27.46 g,0.14mol), AIBN (1.32 g) and n-bromosuccinimide (27.02 g,0.152mol) in CH2Cl2 (170 ml) was refluxed under a nitrogen atmosphere for 36 h. Then washed by water, the aqueous was extracted by CH2Cl2. The combined organic layer was washed by saturated Na2S2O3 and brine, dried over Na2SO4, and evaporated to give a white solid which was purified by column chromatography eluted with 50% acetic ether in petroleum ether (34 g, 88.6% yield).Return 氢化反应O ONH OONH2Cl ClA mixture of ethyl 3-(N-benzylamino)-3-methylbutyrate hydrochloride (25g, 0.1 mol) and 10percent Pd-C (2g) in 250 ml of dried alcohol was hydrogenated under 55 psi H2 for four days. The reaction medium was then filtered and evaporated under reduced pressure to provide an amber oil which gradually crystallized upon standing (18 g, 100% yield).Returnm-CPBAS NH2SNH2OA solution of 85% m-chloroperoxybenzoic acid (19 g, 94 mmol) in CH2Cl2 (350 ml)was added at –5 –0 °C to a solution of 2-Benzylsulfanyl-phenylamine (19 g, 88 mmol) in CH2Cl2 (400 ml). The mixture wasallowed to warm to rt in 3 h, then it was washed with a 5% Na2S2O3 solution, 10% NaHCO3 solution and brine. The organic layer was dried over Na2SO4, and evaporated. The solid was ground in pentane (19 g, 95% yield).ReturnEDCNH 2O+H OTo a 0°C mixture of Boc-L-tyrosine (2.04 g, 7.26 mmol) and amylamine (0.63 gl, 7.26 mmol) in methylene chloride (30 ml) is added 1-(3-dimethylaminopropyl)-3-ethylcarbodiimide (EDC) (1.53 g, 9.9 mmol). The white mixture is stirred at 0°C for 5 min and at room temp for 23 hrs. The resulting solution is diluted with methylene chloride (30 ml) and washed successively with 0.5 M HCl (40 ml), water (20 ml) and sat aq sodium bicarbonate (25 ml). The organic phase is dried over magnesium sulfate and concentrated to a foam (1.84 g, 72.4%yield), sufficiently pure to carry into the next step. An analytical sample is obtained by HPLC.Return三光气成脲NH 2ONO 2Si O Cl ClO Cl ClO 2NHN H NOHOHNO 2+To a solution of 2-(tert-butyldimethylsilyloxy)-4-nitroaniline (200 mg, 0.75 mmol) in toluene (10 ml) triethylamine (0.13 ml, 1.64 mmol) and triphosgene (88.4 mg, 0.3 mmol) were added. The reaction mixturewas stirred at 70 °C for 2 hours, then cooled to room temperature. Then more 2-(tert-butyldimethylsilyloxy)-4-nitroaniline (200 mg, 0.75 mmol) was added. The resulting mixture was allowed to stir at 70 °C for 48 hours then cooled to room temperature. The reaction mixture was partitioned between water and ethyl acetate. The combined organic phase was washed with brine, dried over MgSO4 and filtered. Removal of solvent at reduced pressure and chromatography of the resulting oil on silica gel (hexane: ethyl acetate, 10:1) gave 1,3-Bis-(2-hydroxy-4-nitro-phenyl)-urea (130 mg, 31%yield).Return芳卤用n-BuLi 处理后与Weinreb 酰胺成酮N F FFN O O+F FF ONFTo a solution of diisopropylamine (17.69 ml, 0.135 mole) in THF (200 ml) at –78°C under argon wasadded n-butyllithium (54.0 ml, 2.5M in hexane, 0.135 mole), followed after 5 min by dropwise a solution of 2-fluoro-4-methylpyridine (10 g, 0.090 mole) in THF (20 ml). After stirring for 15 min at –78°C, a solution of N-methoxy-N-methyl-3-trifluoromethylbenzamide (23.08 g, 0.099 mole) in THF (10 ml) was added dropwise. After stirring for more 5 min, the reaction was allowed to warm to 0°C and quenched by pouring into water (400 ml) and ethyl acetate (400 ml). The layers were separated, and the aqueous layer washed with ethyl acetate (200 ml). The ethyl acetate extracts were combined, dried over anhydrous sodium sulfate, filtered, and concentrated to an oil which was chromatographed on silica gel with 20percent ethyl acetate in hexane to give 21.6 g of 2-(2-Fluoro-pyridin-4-yl)-1-(3-trifluoromethyl-phenyl)-ethanone (84.8%yield).Return。
Weinreb酰胺的制备及应用研究进展

学年论文题目: Weinreb酰胺的制备及应用研究进展学院:化学化工学院专业: 11级化学(师范)指导教师:学生姓名学号:2014年 5月 30日目录摘要------------------------------------------------------------------------------第3页关键字---------------------------------------------------------------------------第3页1.Weinreb酰胺简介------------------------------------------------------第3页2.Weinreb酰胺的合成方法:-------------------------------------------第4页2.1有机锌试剂制备weinreb酰胺的方法------------------------第4页2.2以羧酸为原料的合成法-----------------------------------------第5页2.3以羧酸酯为原料的合成法----------------------------------------第6页2.4以酰氯为原料的合成法-------------------------------------------第6页2.5以酰胺为原料的合成法-------------------------------------------第7页3. weinreb酰胺的应用进展----------------------------------------------第7页3.1用weinreb酰胺合成酮---------------------------------------------第7页3.2weinreb酰胺还原反应--------------------------------------------第7页3.3weinreb酰胺水解反应--------------------------------------------第8页4.总结:-------------------------------------------------------------------------第8页参考文献:---------------------------------------------------------------------第8页Weinreb酰胺的制备及应用研究进展摘要:Weinreb酰胺是一类十分重要的酰基化试剂,在许多天然产物的合成中有着的广泛的应用,其合成的方法有很多种,在此介绍羧酸、羧酸酯、酰氯、酰胺为原料和用有机锌试剂制备weinreb酰胺的方法。
weinreb酰胺的制备

weinreb酰胺的制备
Weinreb酰胺是一种重要的羰基合成试剂,可以用于合成酮和醛化合物。
下面是Weinreb酰胺的制备方法:
1. 材料:
- N,N-二甲基甲酰胺(DMF)
- 三氯甲烷(CHCl3)
- 碳酸二甲胺(DMA)
- 甲酸
- 二甲基氨基乙基氯化铜(CuCl2·2DMF)
2. 实验步骤:
a. 准备一个干净的干燥的反应瓶,用氮气干燥瓶内空气。
b. 向瓶中加入DMF(1.2当量),然后加入三氯甲烷(2.2当量)。
c. 向瓶中加入碳酸二甲胺(1当量)。
d. 将甲酸(1当量)添加到瓶中。
e. 加入二甲基氨基乙基氯化铜(0.1当量)。
f. 将反应瓶密封,并在室温下搅拌反应约24小时。
g. 完成反应后,用水稀释反应混合物,并用氯化钠饱和。
h. 用冷水洗涤有机相,然后使用氯化钠饱和水溶液洗涤,最后用氯化钠饱和溶液洗涤。
i. 使用旋转蒸发仪将有机溶剂蒸发掉,得到Weinreb酰胺产物。
j. 需要根据具体的实验需求进行进一步纯化和抽提等操作。
请注意,这只是Weinreb酰胺的一种制备方法,实际操作中可
能还会有其他变体的方法。
此外,在操作化学试剂时,请严格遵循操作规程和实验室安全指南。
卤代酮的合成-060123

经典化学合成反应标准操作α-卤代酮的合成目录1.前言 (2)2. 直接卤化 (2)3.经重氮酮制备 (4)4.从weinreb 酰胺制备 (6)5.傅克酰基化合成卤代酮 (7)6 其他合成α-卤代酮的方法 (9)1.前言α-卤代酮的合成广泛应用于现代有机合成中, 多用于溴的烷基化、合成咪唑及噻唑等杂环类化合物,其合成方法常用直接卤化、经重氮酮制备、经Weinreb 酰胺制备、傅克酰基化等方法合成。
2. 直接卤化酮的α-氢易被取代,可以直接合成α-卤代酮。
一般操作是将酮与卤素于醋酸、氯仿、DMF 或水中反应。
除卤素外, 硫酰氯、五卤化磷、过溴化吡啶氢溴酸盐(C5H5NH.Br 3)、三卤化三甲基苄基铵盐等也可以做卤化试剂。
对称酮或只有一个取代方向的酮卤代时,可以良好产率(80~90%)生成α-卤代酮。
不对称酮卤代,往往生成α-及α’-卤代酮的混合物。
由于酮卤代的决定步骤是酮的烯醇化,因此,易形成烯醇的方向优先卤代。
例 2-甲基环己酮与亚硫酰氯作用, 多取代的α-氢优先氯代1。
OCH 3OCH 3Cl 2485%若利用双(二甲基乙酰胺基)三溴化氢做溴化剂,可使不对称酮在少取代一边溴代2。
OOBr[(Me 2NCOCH 3)2H]Br 3384%若将不对称酮首先转变成为一定构型的烯醇盐,继而卤代,是区域定向卤代的新方法3。
OH 3COH 3CCl1. i -Pr 2NLi, THFPhCOOEtO CH 3PhOCH 3Br 1. NaH, DMSO另外,甲基酮可用甲基格式试剂与相应的Weinreb 酰胺来制备, 如下例即是先合成甲基酮,后溴化来合成α-溴代酮的4。
NBocO HONBocO NO NBocODCC, D MAP, N HMeOMe MeMgI , e t h er合成实例一 5OOOOOOBrBr 2, AcOH2B 2AA suspension of ketone 2A (700 mg, 2.17 mmol) in acetic acid (15 ml) was heated to 70℃, followed by addition of bromine (347 mg, 2.17 mmol). After the mixture was stirred at 70℃ for 3h, the solvent was evaporated and the residue was purified by column chromatography to give the compound 2B (591 mg, 68%).合成实例二6OMe MeOO Br OMeMeOOBr232C2DBromine (7.99 g, 50 mmol) in CHCl 3 (20 ml) was added in a dropwise manner to a stirred solution of 2, 5-dimethoxy-4-bromoacetophenone 2C (12.95 g, 40 mmol) in CHCl 3 (100 ml) at 5℃. After the addition was completed, the reaction mixture was allowed to warm to room temperature and stirred for an additional 2 h. The mixture was poured onto crushed ice, the organic portion was separated and washed with water, saturated NaHCO 3 solution, and again with water. The solution was dried MgSO 4, and evaporated to dryness under reduced pressure to give a crude product. The product was recrystallized from MeOH to yield 14.70 g (87%) of the desired bromoacetophenone 2D as a white solid.ON NH 2NON NH 2NBr AcOH, 48% aq. HBr and Br 2To a solution of 1-(2-aminopyrimidin-4yl) ethanone (412 mg, 3 mmol) in glacial acetic acid (1 mL) and 48% aq. HBr (0.3 mL), bromine (0.153 mL) in acetic acid (0.4 mL) was added and the resulting orange solution was stirred at RT for1.5 hours. After diluting with ethyl acetate (15 mL), the precipitate was filtered and washed with ethl acetate thus affording the target compound as a whitish solid (580 mg, 65%).合成实例四8O OSiOOSi Br 2E 2FBenzyltrimethylammonium tribromide (4.17 g, 10.7 mmol) was added to a solution of Compound 2E (4.00 g, 10.7 mmol) in CH 2Cl 2-MeOH (5:2, 25 mL). The mixture was stirred at RT for 3 h. At this time the reaction mixture was concentrated in vacuo and H 2O (15 mL) was added. The mixture was extracted with diethyl ether (3 × 20 mL). The combined organic extracts were washed with brine (15 mL), dried over MgSO 4, filtered and concentrated in vacuo. The residue was purified by silica gel chromatography (hexanes:EtOAc, 3:1) to afford to afford Compound 2F (3.97 g, 8.8 mmol, 82%) as a thick yellow oil.3.经重氮酮制备不对称酮卤代时,有时无法得到单卤代产物。
weinreb酰胺与格式试剂反应机理

Weinreb酰胺与格氏试剂反应的机理如下:
1. 格氏试剂的形成:卤代烷(如卤代烃)与金属(如镁)在无水乙醚或四氢呋喃等有机溶剂中反应生成格氏试剂。
这个步骤通常需要在惰性气体(如氮气)下进行,以避免水和氧气的干扰。
2. 格氏试剂的亲核加成:生成的格氏试剂作为亲核试剂与酰胺中的酰基发生亲核加成反应。
格氏试剂中的金属负离子攻击酰基的羰基碳,形成一个暂时的中间体。
3. 中间体的形成:格氏试剂的亲核攻击导致一个负电荷在羰基碳上形成,同时酰胺中的氨基或胺基中的氢离子被金属负离子的氢替换。
这形成了一个中间体,其中羰基碳与金属负离子和新形成的氨基或胺基结合。
4. 中间体的消除:中间体中的负电荷通过质子化来中和。
这可以通过加入水或酸来实现,从而形成相应的酸性介质。
以上机理仅供参考,可以查阅相关文献资料获取更多信息。
推荐:Weinreb酰胺制备和应用总结

推荐:Weinreb酰胺制备和应用总结展开全文自从1981年, Nahm和Weinreb两位科学家发现N-甲氧基-N-甲基酰胺后, Weinreb酰胺(WAs)经二十多年发展, 其作为酰化试剂已被广泛应用于有机合成中. WAs既可与格氏试剂或有机锂试剂反应合成各种结构的酮, 也可经金属氢化物还原得到醛, 且金属试剂过量不会导致产物过度加成, 这些特点使其能大量应用于含羰基化合物的合成策略中, 比如醛、酮、端炔[2]、杂环及天然产物的合成. 另外, WAs 作为反应官能团还可参与Birch还原[3]和Wittig反应[4]等. 如Scheme 1所示, 无论金属有机试剂还是金属氢化物, 均可与WAs形成稳定的假想四面体2 或3, 后者不会立刻转换为醛酮, 从而, 阻止了羰基被进一步加成. 只有加入酸性水溶液进行反应后处理时, 中间体2或3瓦解得到目标产物醛酮. 这样既淬灭了过量的金属有机试剂, 也保证了目标醛酮不会被二次加成. 在有机合成应用中, WAs主要体现出以下四个优点: (1)制备简便. WAs可以通过羧酸或酯原位活化得到; (2)可成功转化为酮. 特别是在全合成复杂天然产物中, 大量文献报道了WAs可与金属有机试剂得到酮; (3)可放大反应; (4) WAs稳定且易贮藏.之前, Aidhen等[5,6]分别在2000年和2008年综述了Weinreb 酰胺的应用. 但近年来, 有关Weinreb酰胺的应用报道热度不减. 2013年, Davies 等[7]还在利用N-酰基手性辅助基团不对称合成手性醛酮的综述文章中, 提到了开发手性WAs替代基团进行不对称催化工作. 鉴于Weinreb酰胺的诸多优点及其在合成上的广泛使用, 结合近年来的发展趋势, 本文综述了当前WAs的主要制备方法、最新应用进展及使用限制, 以期全面介绍WAs, 丰富有机化学家的合成手段.鉴于Weinreb酰胺在合成上频繁被使用, 其各种制备方法已被大量报道, Scheme 2所示. 一般, Weinreb酰胺可以从羧酸及其衍生物为原料, 比如酰氯、酯、内酯、酰亚胺和酸酐等, 与市售的N,O-二甲基羟基胺盐酸盐(DMHA)反应得到. 这其中, 羧酸与DMHA直接转化为WAs的制备策略, 操作最为方便而倍受关注, 因为这样可以避免先将酸转化为反应活性更高的羧酸衍生物(path a). 根据这个策略, 研究者们尝试了各种羧酸活化试剂, 比如: DCC, DEPC, HOBT, CBr4/PPh3, CDI, 烷基氯仿, BOP, EDCI, PPA, CDMT, HOTT, CPMA 及DMT-MM 等肽缩合试剂, 用于WAs的制备, 具体文献可见综述[6], 在此不做复述. 以上反应虽然可以有效制备WAs, 但有时也存在收率低, 反应时间长, 反应剧烈及分离纯化困难等缺点. 最近, 肽缩合剂T3P/DBU[8]被报道用于N-保护氨基酸(肽)WAs 的制备(Eq. 1). 由于, T3P具有低毒、反应温和、廉价及商品化等特点, 与碱DBU配合, 可对各种N-保护的手性氨基酸4, 甚至二肽,与DMHA缩合制备WAs衍生物5, 该反应收率高(>90%), 便于分离且不消旋.此外, COMU®作为第三代脲阳离子肽缩合剂也被成功用于N-保护氨基酸WAs的制备[9]. 不像HATU等苯并三唑类缩合剂, COMU®结构中不含三唑基团, 危险性极低; 在制备WAs反应中, 存在明显的颜色变化, 可裸眼判断反应进程; 反应副产物溶于水, 便于分离, 并且手性氨基酸的消旋化极低. 虽然有以上诸多优点, 但COMU®比较昂贵是一大缺点.在形成酰胺键的反应中, PPh3常与含卤化合物配合使用, 比如: NCS[10], NBS[11], Br2[12], BrCCl3[13], CCl4[14]等, 可以与羧酸反应有效形成酰胺键. 早先, PPh3/ CBr4组合已经用于WAs的制备[15]. 2010年, Kumar等[16]报道了利用PPh3/I2组合, 可活化羧基, 与DMHA缩合成WAs的反应(Scheme 3). 首先, 等物质的量比PPh3与I2 得到碘化鏻盐8, 后者与脱质子的羧酸形成酰鏻盐或酰碘中间体, 再与DMHA缩合制备9. 该反应在0 ℃进行, 便于操作, 收率在70%左右.2009年, Niu 等[17]报道了利用PCl3与DMHA反应得到P[NCH3(OCH3)]3(10), 后者可以在甲苯中直接与各种羧酸(芳香酸、脂肪酸及二元酸), 特别是位阻大的羧酸, 高收率制备WAs (Scheme 4).除了从羧酸直接活化制备WAs, 也可利用酰卤与DMHA缩合成WAs (path b). 可用于制备WAs的酰化试剂分别为SOCl2和Deoxo-Fluor, 它们可将羧酸先分别转化为酰氯和酰氟. 2013 年, Pace 等[18]报道了酰氯可与DMHA在生物溶剂2-MeTHF[19]和碱水组成的两相体系中制备WAs (Eq. 2). 由于2-MeTHF与水不互溶, 反应中生成的13 溶在有机相, 而盐酸以无机盐的形式与副产物溶于水相, 反应结束后只需简单分液、减压蒸出2-MeTHF即可得到纯净的WAs. 整个过程不需额外使用任何其他有机溶剂, 体现出很好的绿色化学特性.与酰氯相比, 酰氟的反应活性更像酯, 比酰氯要更加稳定, 因此反应条件不苛刻. 利用Deoxo-Fluor试剂将羧酸转化为酰氟后, 可用于制备WAs. Deoxo-Fluor试剂14已经用于WAs合成长链脂肪酮[20]. 最近发现, 14甚至可与血浆中的游离脂肪酸形成酰氟, 再与二甲胺反应得到类Weinreb酰胺. 该衍生化方法可用于GC-MS定量检测血浆中游离脂肪酸的含量[21]. 另外, Deoxo- Fluor试剂15也可用于合成4-氟吡咯烷WAs衍生物[22].2014年, Gupta 等[23]报道了从醇或醛合成三氯甲基甲醇16, 后者可经同系化-胺化反应制备多一个碳的WAs 17(path c), 收率达到75%~89% (Eq. 3). 该反应的底物适用性不是特别理想, 当R为除芳基或烷基之外的取代基时, 会出现大量的脱甲氧基副产物18.其反应机理如Scheme 5所示.此外, 经酯与内酯(path d)、酰亚胺(path e)、混酐(path f)及醛(path g)等为原料与DMHA缩合, 均可制备WAs[6], 近几年报道不多, 代表性例子[24~27]可见Scheme 6.近些年, 过渡金属Pd催化合成乙烯基或芳基WAs也有报道(path h 和i), 主要包括以下两种方法: (1)在Heck反应条件下, DMHA 和CO 可分别与芳溴31[28]、内酰胺/内酯的三氟甲磺酸酯32[29]进行甲酰胺化反应, 制备WAs (Eq. 4). 2011年, Wieckowska等[30]对上述反应进行了改进, 采用W(CO)6作为固体CO源, 代替之前往体系中不断通入CO气体, 成功地对芳溴和芳碘进行了甲酰胺化反应, 但反应中存在N—O键断裂的副反应. 此外, 由于芳碘比芳溴更活泼, 可用芳碘代替芳溴作为反应底物, 采用PPh3与Pd(OAc)2配合, 避开使用价格昂贵的含磷配体Xantphos. 可能的反应机理如Scheme 7, PPh3 将Pd还原为0价络合物35, 芳碘与35氧化加成形成中间体36, 后者再激活CO得到末端羰基络合物37, 随后进行CO的插入反应及碱性条件下的还原消除, 得到终产物WAs及Pd络合物35[31]. (2)乙烯基或芳基取代的锡烷39[32]或硼酸40[33]作反应底物, 与甲酰氯41进行Stille-type 交叉偶联反应制备WAs (Eq. 5), 该方法可以顺利制备α,β-不饱和WAs.对于α,β-不饱和WAs的制备, 既可采用传统地缩合成酰胺方法, 通过α,β-不饱和羧酸与DMHA制备, 也可通过Pd催化Stille-type交叉偶联反应制备, 这两种途径在前面已经提到. 另外, 还可以通过各种醛进行Wittig反应[34]、HornerWadsworth-Emmons反应[35]及Julia 成烯反应[36]等制备, 其反应中间体分别为: 44, 45~49, 50~52 (Scheme 8).44参与的Wittig反应均生成E式α,β-不饱和WAs产物, 而Horner-Wadsworth-Emmons反应中, 46, 47及49能控制反应主要生成Z式α,β-不饱和WAs产物. 2012年, Yamada等[35f]利用45经Horner-Wadsworth-Emmons反应得到53, 后者作为新的HWE反应合成砌块, 与醛经多次HWE反应成功合成了花药黄素54(Scheme 9).在Julia成烯反应中, 50[36a]及52[36b]均与各种醛得到E式α,β-不饱和WAs产物. 含氟化合物51在不同反应体系下可以进行立体化学控制. 比如: 在含碳酸钾的DMF中, 51与醛室温反应主要得到Z式产物[36c]; 而在THF溶剂体系中, NaH 作为碱可得Z式产物收率大于98%; 而DBU作为碱可通过控制溶剂极性得到Z式或E式α,β-不饱和WAs作为主要产物[36d]. 另外, 室温搅拌下, 在CsCO3作为碱的二氯甲烷溶液中, 过量多聚甲醛可与51顺利得到含氟端烯WAs, 后者并不涉及顺反异构[36e]. 2014年, Chowdhury等[36f]报道了以51为原料, 经两次Julia成烯反应合成氟代共轭二烯WAs 57 (Scheme 10).最近, Aidhen等[37,38]利用含苯环WAs合成子58与醛进行Julia 成烯合成了末端含WAs的二苯乙烯化合物. 2014年, 他们组[39]还利用59与多聚甲醛Julia成烯反应, 在苯甲酰胺的α位引入乙烯基, 氧化双键后可制备α-乙酰基二苯甲酮类化合物.Weinreb酰胺在合成上的应用是非常广泛的, 包括构建各种合成等价体与合成砌块、杂环、天然产物, 甚至在医药中间体大规模生产[6]等领域, 均有其大量应用. 下面总结了近五年来, Weinreb 酰胺参与的有机合成反应.2.1 成醛酮反应Weinreb酰胺在合成中最重要的应用就是通过它与各种金属有机试剂反应得到结构各异的醛酮, 后者再经一系列变化, 可用于各种复杂结构分子的合成. WAs 的最大特点是, 反应过程中金属离子可与WAs 的羰基氧和甲氧基氧形成稳定的螯合环, 因此不会与过量金属试剂发生过度加成, 从而保证了反应的清洁性. 现今, 此方法已经成为由羧基转化为醛酮最可靠的方法.一般地, 铝试剂可以将WAs还原为醛[40]; 格氏试剂或锂试剂与WAs反应, 可以制备脂肪酮[41]、烯酮[42]、芳香酮[43]及炔酮[44]等, 锂试剂反应活性比格氏试剂高, 一般在更低温下进行反应, 这是WAs最常见的成酮方法(Scheme 11).2010年, Aidhen等[47]报道了含叶立德Weinreb酰胺67先与各种单糖进行wittig反应构建C—C键68, 再将WAs基团与各种芳基格氏试剂反应, 得到单糖修饰的二苯酮衍生物, 即Phenstatin衍生物69. 后者具有重要的抗癌活性(Scheme 14). 之前, 有人报道过利用Wittig试剂与WAs的羰基进行反应, 可以合成酮[48]. 但在此反应条件下, 67的WAs基团并不参与wittig反应.Weinreb酰胺不但可以用于制备普通酮, 还可以制备α 卤代酮. 2012 年,Leadbeater 等[63]报道了利用Rupper-Prakash试剂89与WAs88反应合成三氟甲基酮90 (Eq. 6). 但底物为α,β-不饱和WAs 时, 在该反应条件下会出现迈克尔加成副产物, 即N-甲基-N-甲氧基氨基负离子会进攻双键, 会严重影响三氟甲基酮的产率.2.2 1,4-共轭加成反应α,β-不饱和WAs作为重要的有机合成中间体, 其反应活性主要体现在羰基和双键两个官能团上. 有机金属试剂可与其羰基进行成酮反应, 这在上一节中已经提到. 这里我们介绍其1,4-共轭加成反应[69](Scheme 21).2008年, Olivella等[69a]报道了TiCl4催化乙醇酸衍生物99与N-甲基-N-甲氧基丙烯酰胺100的1,4-共轭加成反应(Scheme 22).2.3 烯烃复分解反应在氯仿中, 己二烯与含WAs基团烯烃在Grubbs二代催化剂钌卡宾配合物111催化下, 可顺利进行双向复分解反应[69c], 微波加热可加速反应进行. 该类金属卡宾催化剂可利用异丙氧基苯乙烯作为配体, 进一步替代卡宾配合物111中的膦配体而提高催化活性. Lee 等[72]发现利用Grubbs二代改良型催化剂112, 烯丙基卤113与α-烷氧基WAs 114可顺利进行复分解反应. 烯基与WAs基的距离并不影响反应收率, 但当用NH(CH3)2代替WAs, 反应几乎不能发生. 当使用116作为反应底物时, 双键与WAs基团距离过近, 会形成稳定的中间体117或118, 不利于烯烃复分解反应的进行.2.4 烯醇式亲核反应α-氨基酸及其衍生物在化学和生物学中扮演着重要角色, 它是构成肽和蛋白质的单体. α-氨基酸在有机化学中也有广泛应用, 比如在不对称合成中可作为重要模板、在全合成中充当合成砌块以及在天然活性物质中常作为亚结构出现等. 近几年, 利用烯醇式WAs酰胺119与手性亚胺120进行亲核加成, 合成手性β-氨基酸衍生物121被报道(Scheme 26). 比如N-膦酰基122[73]和N-手性亚砜123[74,75]均可作为手性辅助基团, 不对称催化合成手性β-氨基酸WAs, 随后可用强酸脱掉这些辅助基团.2.5 C—H活化反应2012年, Zhang等[79]报道了利用Rh或Ru催化丙烯酰胺与烯烃的脱氢偶联反应, 用于合成(Z,E)-二烯酰胺化合物. 其中, 133 作为烯烃底物也能很好的适用于该反应, 反应收率中等, Z/E>98/2 (Eq. 8).2.6 催化氢化反应2013年, Kumaraswamy 等[86]报道了利用过渡金属Ru催化不对称转移氢化反应, 对α-烷基取代-β-酮Weinreb酰胺145进行动态动力学拆分, 即DKR-ATH(dynamic kinetic resolution-asymmetric transfer hydrogenation)反应. 该反应可一步得到两个连续的手性中心、立体构型明确的产物分子146 (Eq. 12). 146可作为重要中间体, 经多步反应全合成天然产物(-)-brevis- amide及其对映异构体.2.7 关环反应Weinreb酰胺也常参与杂环的合成. 通过调研文献发现, WAs可作为分子内亲电基团应用于Parham 环化反应, 反应中生成的芳基锂153[90]进攻分子内的WAs, 形成关环产物.2.8 其他应用Evans 等[93]在2010 年曾经将WAs基团引入Jones-Moss非氮卡宾前体161, 通过光照得到卡宾162.Weinreb酰胺虽然在有机合成上取得巨大成功, 但值得注意的是, 在一些反应中已经出现Weinreb酰胺中的N—O键发生断裂的现象, 即脱甲氧基副反应, 导致WAs分解. 最早报道此现象的是Graham 等[94], 他们发现在-78 ℃下, WA 163与强碱LDA反应会发生脱甲氧基, 形成164为主要产物. 这个分解反应可能是一个释放甲醛的E2消除机理(Eq. 16).Weinreb酰胺脱甲氧基现象的报道, 在Labeeuw早期发表的文章[95]前言中已有总结. 在该文中, 他们也发现WAs 165, 无论如何改变反应温度、溶剂及有机锂试剂的摩尔量, 主产物不是酮167, 而是脱甲氧基产物168. 当用叔丁基166代替甲基后, 脱甲氧基副反应能被很好地抑制, 成酮产物167收率迅速提高到72%, 但由于位阻增大, 反应时间会增长(Eq. 17). 另外, Li/ DTBB[96]和LiSnBu3[97]也可使WAs发生脱甲氧基反应.上述WAs发生脱甲氧基副反应, 均在有机锂及格氏试剂等强碱环境下发生. 在WAs参与的过渡金属催化反应中也会偶尔发生脱甲氧基副反应, 比如前面提到的Pd催化偶联[30]及Ru催化氢化[87]等反应. 2011 年, Fukuzawa等[98]专门研究了Ru催化下的WAs N—O键断裂反应. 该反应不需要任何有机配体, RuCl3与还原剂Cu-Zn配合使用, 可在甲醇中将烷基型、乙烯型及芳香型WAs顺利脱甲氧(Eq. 18). 反应机理涉及Ru的氧化还原催化循环.另外, 非金属的电中性有机超电子给体171[99]和172[100]利用单电子转移过程, 通过自由基机理也可使Weinreb酰胺的N—O键发生断裂.综上所述, Weinreb酰胺因其易制备、便于储藏及特殊的反应性质, 在有机合成中已得到广泛关注. 它既可作为酰化试剂与有机金属试剂反应, 而不会过度加成; 又可作为羰基的等价体参与许多类型反应, 起到保护羰基的作用, 从而表现出很好的官能团耐受性. 鉴于其可靠的成醛酮反应性质, Weinreb 酰胺已在天然产物等各种复杂体系的合成中发挥重要作用, 并成功应用于工业大规模生产中. 然而, Weinreb 酰胺在使用中也暴露出一些问题, 比如: 由于普遍使用有机金属试剂与Weinreb酰胺进行成酮反应, 此苛刻反应条件会限制酰胺底物中其它官能团的多样性; 个别反应条件下, 其N—O键断裂作为副反应会导致自身分解; N-甲氧基-N-甲基基团结构过于简单, 缺乏对反应的立体控制等. 今后, 为了克服上述问题, 寻求温和反应条件提高选择性、探索降低副产物的合成方法及开发Weinreb酰胺手性替代基团将成为又一研究热点[7]. 与此同时, 坚持开发简单高效的Weinreb酰胺合成方法, 探索Weinreb酰胺作为合成砌块或等价体在不同反应体系中的官能团耐受性还将持续下去, 为其在更广泛领域的应用提供保障.声明:。
温勒伯反应

为何选择温勒伯酮合反应?
• 这个方法广泛用于羧酸及其衍生物的官能团转化。用该法 制备醛酮的优点有: • 相对于醛、酮制备中,常用的活泼的羧酸衍生物(如:酰 氯),温勒伯酰胺较为稳定;
• 转化为醛、酮的条件也较温和,操作方便,所用试剂为有 机锂试剂、格氏试剂、金属氢化物等简单易得;
• 反应生成稳定的五元环状过渡态,不会进一步还原,反应 进程可控,水解后得到醛、酮。正因为如此,温勒伯酮合 成法广泛应用于羧酸及其衍生物的官能团转化,合成脂肪 酮,芳香酮,α、β-不饱和烯酮,炔酮,α-氨基(羟基) 酮(醇)等,并且可在固相合成中实现。
拓展:温勒伯酰胺的制备
• 以羧酸为原料的合成法
以羧酸酯为原料的合成法
• 以酰氯为原料的合成法
以酰胺为原料的合成法
由Weinreb和Nahm在1981年发现 的,后人在此基础上发展了温 勒勒伯酮合反应
反应机理
可以使用的亲核试剂有格氏试剂、有 机锂试剂和磷叶立德 等。
温勒伯酰胺
稳定的五元环中间体
Weinreb酰胺一般通过羧酸、酰氯或酯的酰胺化反应来制备,所用试剂 主要包括有机铝试剂,如三甲基铝以及更加方便的二异丁基氢化铝等。 此外,格氏试剂与盐酸甲基甲氧基胺作用,再与酯反应,也可以得到 Weinreb酰胺。
weinerb 酰胺反应机理 -回复

weinerb 酰胺反应机理-回复烃基酰胺反应(weinerb酰胺反应)是有机化学中一类重要的合成方法,可以将氨基酸或其他氨基酸衍生物与羰基化合物在酸催化下进行反应,生成对应的酰胺。
weinerb酰胺反应机理可以分为三个关键步骤:N-羧基加成、酰胺展开和质子转移。
下面我将详细介绍这三个步骤。
首先,我们来看N-羧基加成步骤。
该步骤中,氨基酸或其衍生物的N-羧基与羰基化合物的羰基发生加成反应,生成一个新的碳-碳键。
这个加成反应通常在官能团上具有电负性的硫醇或酚酸催化下进行。
例如,硫醇催化下的反应机理如下:首先,醇络合剂氢键结合到羰基氧上形成羟基羧酸络合物。
然后,氧上的酸质子通过氢键和底物中的氮进行质子化,形成酰氧离子。
随后,酰氧离子被硫醇负离子亲核进攻,形成新碳-硫键。
这个中间体可以通过质子化还原成酰醇,并放出硫醇催化剂。
接下来是酰胺展开步骤。
在这个步骤中,刚生成的酰胺通过与酸进行反应来展开,生成一个具有一个羧酸的新的氨基酸。
这个步骤是通过羧酸与酰胺中的亲核基团进行亲核取代反应实现的。
例如,使用胺为亲核试剂的酰胺展开步骤如下:首先,胺亲核进攻酰胺中的羰基,形成一个新的C-N键。
然后,氧上的酸质子通过质子转移和胺中的氮进行质子化,产生一个氨基离子。
最后,这个氨基离子与负电荷较大的离子反应(通常是胺盐),形成一个具有一个羧酸的新的氨基酸产物。
最后一个关键步骤是质子转移。
这个步骤是为了移除反应中产生的羟基离子,以便继续进行后续的加成反应。
在质子转移过程中,中间产物中的负性氧原子会被质子化,从而形成中性水分子。
这个步骤是通过酸催化进行的。
例如,硫醇催化条件下的质子转移步骤如下:首先,硫醇加成产物中的羟基氧上形成氢键络合。
然后,酸质子化氧,并与硫醇中的硫形成新的硫-氧键,释放出一个质子。
最终,产物络合物脱水,生成一个新的酰胺。
总结起来,weinerb酰胺反应的机理主要包括N-羧基加成、酰胺展开和质子转移三个关键步骤。
weinerb_酰胺反应机理_概述及解释说明

weinerb 酰胺反应机理概述及解释说明1. 引言1.1 概述Weinerb酰胺反应是一种重要的有机合成反应,广泛应用于药物合成、材料科学和生物化学等领域。
该反应以亚磷酸盐为催化剂,在适当的条件下,通过吡咯烷酮与羧酸衍生物的反应生成相应的酰胺产物。
这一反应机理的探索对于揭示有机反应的原理以及开发新型催化剂具有重要意义。
1.2 文章结构本文将从以下几个方面对Weinerb酰胺反应进行概述和解释说明:- 引言:介绍文章内容、目的和结构;- Weinerb酰胺反应机理概述:简要介绍该反应的基本情况,包括反应简介、基本步骤和反应条件;- Weinerb酰胺反应机理解释说明:详细讨论该反应的关键步骤,包括中间体形成、催化剂作用机制以及副产物生成及影响因素;- 应用领域与未来展望:总结该反应在工业上的实际应用,并展望其未来的研究进展和挑战,并提出发展方向建议;- 结论:总结回顾本文的内容,强调该反应的研究价值和意义,并给出对未来研究的建议。
1.3 目的本文旨在全面了解Weinerb酰胺反应的机理,深入探讨其中关键步骤的解释说明。
通过文章阐述,希望能够提供有关这一反应的详尽知识,并为其在实际应用和未来研究方向上提供参考。
2. Weinerb 酰胺反应机理概述:2.1 反应简介Weinerb酰胺反应是一种重要的有机合成方法,通常用于合成酰胺化合物。
该反应以底物中的羧酸和胺为原料,在适当的条件下经过一系列步骤进行,最终生成相应的酰胺产物。
这个反应具有高效、选择性好以及广泛的底物适用性等优点,因此在有机合成领域被广泛应用。
2.2 基本步骤Weinerb酰胺反应涉及三个基本步骤:缩水、缩聚和水解。
首先是缩水步骤,也称为活化步骤。
在这一步中,羧酸底物与缩水剂(例如二甲基亚砜或1-甲基咪唑)反应形成临时结构活化羧酸中间体。
这个中间体对后续反应步骤非常关键。
接下来是缩聚步骤,即活化羧酸与胺底物之间的偶联反应。
通过加入碱性氢氧化物作为催化剂,并控制适当的温度和时间,活化的羧酸中间体与胺底物发生缩聚反应,生成酰胺产物。
Weinreb酰胺的制备方法与主要反应

关于Weinreb酰胺
N-甲基-N-甲氧基酰胺,又称Weinreb酰胺(WAs),是一种被广泛应用于有机合成中的酰基化试剂。
Weinreb酰胺既可与格氏试剂或有机锂试剂反应合成酮,也可经金属氢化物还原成醛,且金属试剂过量不会导致产品过度加成。
此外,Weinreb酰胺具有易制备、稳定易存储,可放大反应的优势。
制备
Weinreb酰胺一般可通过羧酸活化、羧酸衍生物(酰卤、酯、内酯、酰亚胺、酸酐、醛等)与N,O-二甲基羟基胺盐酸盐(DMHA)缩合、三氯甲基醇经同系化-胺化反应等制备。
近年来,也有报道,过渡金属Pd催化合成反应也可合成乙烯基或芳基WAs。
主要反应
Weinreb酰胺在合成中最重要的应用就是通过WAs能与各种金属有机试剂反应得到醛酮,且该反应中金属离子可与WAs的羰基氧和甲氧基氧形成稳定的螯合环,因此不会发生过度加成(反应机理详见下图)。
其中,Weinreb 酰胺还能参与Wittig反应和Shapiro反应制得醛酮。
此外,在一些反应中,WAs会发生脱甲氧基副反应,即N-O键发生断裂的现象,导致WAs分解。
常用Weinreb酰胺。
常用试剂----Weinreb酰胺

常用试剂----Weinreb酰胺
图片链接:/2018/06/17/4-weinreb-amide-1981/
N-甲氧基-N-甲基酰胺俗称Weinreb酰胺、它能与Grignard试剂或有机锂试剂反应生成酮。
酰卤或是酯中加入两倍当量的格式试剂或是有机锂试剂的话会得到醇,而Weinreb酰胺则能够避免这种过度的加成。
Weinreb酰胺和金属还原试剂的加成物由于甲氧基的存在形成一个五元环的螯合物相对稳定,使反应不再继续。
Grignard试剂或有机锂试剂反应生成酮,也类似。
Weinreb酰胺的合成方法见上图,主要分为以下几种:1、由酸直接缩合制备得到;2、由酯进行胺酯交换制备得到,3、由酰氯或酸酐直接反应得到。
具体方法参考:酰胺的制备。
强碱性条件下,E2消除,可能会导致副反应,影响产率,叔丁基醚可以避免此副反应。
图片来源:【EOC化学资讯】 Weinreb酰胺在有机合成中的应用试剂应用(详细内容点击查看)
一、还原Weinreb酰胺制备醛
二、weinreb酰胺制备酮
三、Shapiro reaction
四、Wittig试剂和weinreb酰胺反应
五、作为导向基参与C-H键活化反应【C-H活化反应】
【EOC化学资讯】 Weinreb酰胺在有机合成中的应用。
还原Weinreb酰胺制备醛
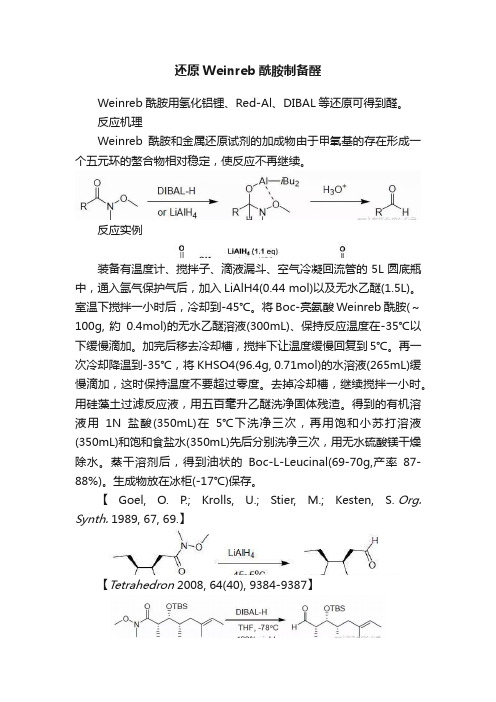
还原Weinreb酰胺制备醛Weinreb酰胺用氢化铝锂、Red-Al、DIBAL等还原可得到醛。
反应机理Weinreb酰胺和金属还原试剂的加成物由于甲氧基的存在形成一个五元环的螯合物相对稳定,使反应不再继续。
反应实例装备有温度计、搅拌子、滴液漏斗、空气冷凝回流管的5L圆底瓶中,通入氩气保护气后,加入LiAlH4(0.44 mol)以及无水乙醚(1.5L)。
室温下搅拌一小时后,冷却到-45℃。
将Boc-亮氨酸Weinreb酰胺(~100g, 約0.4mol)的无水乙醚溶液(300mL)、保持反应温度在-35℃以下缓慢滴加。
加完后移去冷却槽,搅拌下让温度缓慢回复到5℃。
再一次冷却降温到-35℃,将KHSO4(96.4g, 0.71mol)的水溶液(265mL)缓慢滴加,这时保持温度不要超过零度。
去掉冷却槽,继续搅拌一小时。
用硅藻土过滤反应液,用五百毫升乙醚洗净固体残渣。
得到的有机溶液用1N盐酸(350mL)在5℃下洗净三次,再用饱和小苏打溶液(350mL)和饱和食盐水(350mL)先后分别洗净三次,用无水硫酸镁干燥除水。
蒸干溶剂后,得到油状的Boc-L-Leucinal(69-70g,产率87-88%)。
生成物放在冰柜(-17℃)保存。
【 Goel, O. P.; Krolls, U.; Stier, M.; Kesten, S. Org. Synth. 1989, 67, 69.】【Tetrahedron 2008, 64(40), 9384-9387】【Angew. Chem. Int. Ed. 2007, 119(45), 8862-8865】4-[4-(methanesulfonamido)phenyl]butyraldehydeA mixture of 4.20 g (14 mmol) of4-[4-(methanesulfonamido)phenyl]butyric acid, N-methoxy-N-methylamide and 100 mLof anhydrous tetrahydrofuran was stirred under nitrogen with cooling in an icebath as 17.5 mL (17.5 mmol) of 1Mlithium aluminum hydride in tetrahydrofuran was added gradually by syringe. After 0.75 hours, 70 mL of 5percent potassiumhydrogen sulfate solution (aqueous) was added cautiously by syringe. Themixture was then removed from the ice bath, diluted with 150 ML of water, andshaken with 150 mL of ethyl acetate. The milky aqueous phase was extracted withan additional 50 mL of ethyl acetate. The combined organic fractions werewashed successively with 2*100 mL of 1N hydrochloric acid, then 50 ML ofsaturated aqueous sodium bicarbonate solution, and finally 50 ML of saturatedaqueous sodium chloride solution. The organic phase was dried over magnesiumsulfate, filtered, and concentrated in vacuo. Flash chromatography of theresidue on silica gel (elution with 3:2 hexane-EtOAc) yielded 2.47 g (73%) of an oil; homogeneous by TLC in1:1 hexane-EtOAc).Upon storage in the freezer, solidification occurred (mp 41~44oC.).【US5756507】。
weinreb酰胺和锂试剂反应机理

Weinreb酰胺是一类常用的羰基化试剂,常用于合成酮化合物。
下面是Weinreb酰胺与锂试剂(如丁基锂)反应的机理:
1.酰胺负离子生成:首先,Weinreb酰胺(如N,N-二甲基-N-(甲基亚乙基)酰胺)与碱
性锂试剂(如丁基锂)发生反应,生成相应的酰胺负离子。
2.锂试剂脱质子化:碱性锂试剂中的锂离子(Li+)可以与酰胺中的氢离子(H+)发生
反应,形成锂酰胺中间体,同时释放出氢气(H2)。
3.锂酰胺进攻:锂酰胺中间体可以通过亲核进攻反应与碳酰基化合物(如酸氯或酸酐)
反应。
锂酰胺中的锂负离子(Li-)与碳酰基化合物中的羰基碳原子发生反应,形成酰胺中间体。
4.消除脱锂:最后,通过加热或其他条件的处理,从酰胺中间体中消除锂离子(Li+),
生成相应的酮化合物。
总结起来,Weinreb酰胺与锂试剂反应的机理主要包括酰胺负离子生成、锂试剂脱质子化、锂酰胺进攻以及消除脱锂等步骤。
这一反应机理在有机合成中广泛应用,能够高效地合成酮类化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N-甲基-N-甲氧基酰胺,又称Weinreb酰胺(WAs),是一种被广泛应用于有机合成中的酰基化试剂。
Weinreb酰胺既可与格氏试剂或有机锂试剂反应合成酮,也可经金属氢化物还原成醛,且金属试剂过量不会导致产品过度加成。
此外,Weinreb酰胺具有易制备、稳定易存储,可放大反应的优势。
制备
Weinreb酰胺一般可通过羧酸活化、羧酸衍生物(酰卤、酯、内酯、酰亚胺、酸酐、醛等)与N,O-二甲基羟基胺盐酸盐(DMHA)缩合、三氯甲基醇经同系化-胺化反应等制备。
近年来,也有报道,过渡金属Pd催化合成反应也可合成乙烯基或芳基WAs。
主要反应
Weinreb酰胺在合成中最重要的应用就是通过WAs能与各种金属有机试剂反应得到醛酮,且该反应中金属离子可与WAs的羰基氧和甲氧基氧形成稳定的螯合环,因此不会发生过度加成(反应机理详见下图)。
其中,Weinreb酰胺还能参与Wittig反应和Shapiro反应制得醛酮。
此外,在一些反应中,WAs会发生脱甲氧基副反应,即N-O键发生断裂的现象,导致WAs分解。
常用的Weinreb酰胺列表。
