高中化学笔记大全(手写图片版)
高一化学笔记整理手写必修一

高一化学笔记整理手写必修一第一章,化学基本概念。
化学的定义,化学是研究物质的组成、性质、结构、变化规律以及与能量的关系的科学。
物质,物质是组成一切物体的基本单位,具有一定的质量和体积。
元素,由于化学性质相同的原子组成的物质,是构成化合物的基本单位。
化合物,由两种或两种以上不同元素化合而成的物质。
混合物,由两种或两种以上不同物质按一定比例物理混合而成的物质。
分子,由两个或两个以上原子以化学键结合而成的电中性粒子。
离子,在化学反应中失去或获得一个或多个电子而带电的粒子。
原子,构成物质的基本粒子,由质子、中子和电子组成。
化学方程式,用化学符号表示化学反应过程的方程式。
摩尔质量,一个物质的摩尔质量是该物质的相对分子质量或相对原子质量的数值,单位是g/mol。
第二章,化学式和化合价。
化学式,用化学符号表示化合物中各种元素的种类和相对原子数量的式子。
离子化合物,由阳离子和阴离子组成的化合物。
共价化合物,由共用电子对结合形成的化合物。
氧化数,元素在化合物或离子中的电荷数。
化合价,元素在化合物中的氧化数。
第三章,化学计量与化学反应。
摩尔计量,根据化学方程式中各种物质的摩尔比例关系计算物质的数量。
质量计量,根据化学方程式中各种物质的质量比例关系计算物质的质量。
气体的摩尔体积计量,在一定条件下,气体的摩尔体积与摩尔数成正比。
化学反应,物质发生转化的过程,包括物质的生成、消失和结构的改变。
化学平衡,化学反应达到一定条件下,反应物与生成物浓度保持不变的状态。
氧化还原反应,反应中电子的转移称为氧化还原反应。
第四章,原子结构与元素周期律。
原子结构,原子由原子核和围绕核运动的电子组成。
元素周期表,将元素按照原子序数排列,具有相似性质的元素排列在同一垂直列上。
周期律定律,元素的性质随着原子序数的增加而周期性地变化。
主族元素,周期表中IA至VIIIA族的元素,具有相似的化学性质。
副族元素,周期表中IB至VIIIB族的元素,具有相似的化学性质。
高一必修一化学学霸手抄笔记

高一必修一化学学霸手抄笔记高中化学必修一笔记(一)1. 药品存放安全①固体→广口瓶液体→细口瓶或滴瓶见光易分解→棕色瓶②酸性试剂→玻璃塞碱性试剂→橡胶塞③氧化剂和还原剂不能一起存放2. 常见意外事故处理①强碱沾到皮肤——大量水+硼酸②强酸沾到皮肤——大量水+ 3%~5%NaHCO3溶液③有毒有机物沾到皮肤——酒精擦洗④酸或碱流到实验桌上——用NaHCO3或__中和,再用水冲洗3.药品的取用固体:粉末状:纸槽、药匙一斜二送三直立块状:镊子、药匙一横二送三慢立液体:直接倾倒或用滴管取4.实验仪器的注意事项试管:加热不超过1/3,试管夹夹在距试管口1/3处先预热再加热,防止试管骤冷炸裂烧杯:加热时应垫石棉网,使受热均匀溶解物质用玻璃棒搅拌,不能触及杯壁或杯底烧瓶:(圆底烧瓶、蒸馏烧瓶、平底烧瓶)都可以用于装配气体发生装置;蒸馏烧瓶用于蒸馏以分离互溶的沸点不同的物质①圆底烧瓶和蒸馏烧瓶可以用于加热,加热要垫石棉网②液体加入量不能超过容积的1/2蒸发皿:用于蒸发液体或浓缩溶液①可以直接加热,但不能骤冷②盛液量不能超过蒸发皿溶剂的2/3③取放蒸发皿应使用坩埚钳坩埚:用于固体物质的高温灼烧①把坩埚放在三脚架上的泥三角上直接加热②取放坩埚要用坩埚钳③不宜用瓷坩埚熔化烧碱、纯碱及氟化物,它们可和瓷共熔使坩埚造腐蚀④用坩埚钳在夹取高温的坩埚时,应先把坩埚尖端在火焰下预热一下酒精灯:失火时要用湿布盖灭5.混合物的分离和提纯过滤:把不溶于液体的固体物质与液体物质分离一贴二低三靠使分液漏斗上口玻璃塞上的凹槽对准漏斗上的小孔,拧开下口活塞放出下层液体,从上口倒出上层液体实验:用四氯化碳萃取碘水中的碘(碘在水中的溶解度很下而在四氯化碳的溶解度大)现象:原来的碘水呈黄色。
液体在分液漏斗内分层后,上层液体接近无色(水),下层液体呈紫色(碘的四氯化碳溶液)高中化学必修一笔记(二)1.阿伏加德罗定律及其推论:同温同压下,相同体积的任何气体都含相同数目的分子压强之比①同温同压时,P1/P2=n1/n2=N1/N2体积之比②同温同压时,V1/V2=n1/n2=N1/N2质量之比③同温同压同容时,m1/m2=M1/M2密度之比④同温同压等质量时,ρ1/ρ2=V2/V1=n2/n1=N2/N1 (成反比)Ps.阿伏加德罗定律可用于任何气体(纯净的或是互不反应的混合气体),但不适用于液体或固体;只要三个“同”成立,第四个“同”也成立2.1mol物质体积的大小影响因素:物质所含粒子数目的多少、粒子体积的大小和粒子之间的距离固体或液体:主要由粒子的多少和粒子本身的大小决定①注意状况条件,若在非标准状况,如常温常压下,已知气体体积,不能直接应用22.4mol/L计算②已知在标准状况下,而给出的是非气态的物质,不能直接应用22.4mol/L计算③注意双原子分子和单原子分子He Ne例:有0.1mol/LNa2SO4溶液300mL,0.1mol/LMgSO4溶液200ml和0.1mol/L Al2(SO4)3溶液100ml这三种溶液中硫酸根离Na2SO4中硫酸根0.1*0.3=0.03mol 浓度为0.03/0.3=0.1 mol/L MgSO4中硫酸根0.1*0.2=0.02mol 浓度为0.02/0.2=0.1mol/L Al2(SO4)3中硫酸根0.1*0.1*3=0.03mol 浓度为0.03/0.1=0.03mol/L 比为1:1 :3例:在常温常压下,11.2L N2含有的分子数为0.5NA 错误在常温常压下,1mol O2含有的原子数为2NA 正确标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,所含的分子数为NA 正确标准状况下,1L汽油(分子式为C8H18)完全燃烧后,所生成气体产物的分子数为8 NA/22.4 正确质量是否守恒②可拆:只有强酸、强碱和易溶性盐不可拆:单质、氧化物、弱电解质、固体、生成的沉淀或气体、浓硫酸。
高中化学课堂笔记----化学选修4笔记

高中化学课堂笔记----化学选修4笔记work Information Technology Company.2020YEAR化学选修4第一章化学反应与能量一、焓变反应热1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H (2).单位:kJ/mol3.产生原因:化学键断裂——吸热化学键形成——放热放出热量的化学反应。
(放热>吸热) △H 为“-”或△H <0吸收热量的化学反应。
(吸热>放热)△H 为“+”或△H >0☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等小结:1、化学键断裂,吸收能量;化学键生成,放出能量2、反应物总能量大于生成物总能量,放热反应,体系能量降低,△H为“-”或小于0反应物总能量小于生成物总能量,吸热反应,体系能量升高,△H为“+”或大于03、反应热在数值上等于生成物分子形成时所释放的总能量与反应物分子断裂时所吸收的总能量之差二、热化学方程式1.概念:表示化学反应中放出或吸收的热量的化学方程式.2.意义:既能表示化学反应中的物质变化,又能表示化学反应中的能量变化.书写化学方程式注意要点:①热化学方程式必须标出能量变化。
②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)③热化学反应方程式要指明反应时的温度和压强。
④热化学方程式中的化学计量数可以是整数,也可以是分数⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变三、燃烧热1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
高中化学必修1学霸笔记

高中化学必修1学霸笔记高中化学必修一笔记(一)1. 药品存放安全① 固体→广口瓶液体→细口瓶或滴瓶见光易分解→棕色瓶② 酸性试剂→玻璃塞碱性试剂→橡胶塞③ 氧化剂和还原剂不能一起存放2. 常见意外事故处理① 强碱沾到皮肤——大量水+硼酸② 强酸沾到皮肤——大量水+ 3%~5%NaHCO3溶液③ 有毒有机物沾到皮肤——酒精擦洗④ 酸或碱流到实验桌上——用NaHCO3或__中和,再用水冲洗3.药品的取用固体:粉末状:纸槽、药匙一斜二送三直立块状:镊子、药匙一横二送三慢立液体:直接倾倒或用滴管取4.实验仪器的注意事项试管:加热不超过1/3,试管夹夹在距试管口1/3处先预热再加热,防止试管骤冷炸裂烧杯:加热时应垫石棉网,使受热均匀溶解物质用玻璃棒搅拌,不能触及杯壁或杯底烧瓶:(圆底烧瓶、蒸馏烧瓶、平底烧瓶)都可以用于装配气体发生装置;蒸馏烧瓶用于蒸馏以分离互溶的沸点不同的物质①圆底烧瓶和蒸馏烧瓶可以用于加热,加热要垫石棉网②液体加入量不能超过容积的1/2蒸发皿:用于蒸发液体或浓缩溶液①可以直接加热,但不能骤冷②盛液量不能超过蒸发皿溶剂的2/3③取放蒸发皿应使用坩埚钳坩埚:用于固体物质的高温灼烧①把坩埚放在三脚架上的泥三角上直接加热②取放坩埚要用坩埚钳③不宜用瓷坩埚熔化烧碱、纯碱及氟化物,它们可和瓷共熔使坩埚造腐蚀④用坩埚钳在夹取高温的坩埚时,应先把坩埚尖端在火焰下预热一下酒精灯:失火时要用湿布盖灭4.混合物的分离和提纯过滤:把不溶于液体的固体物质与液体物质分离一贴二低三靠蒸发:给液体加热使液体受热汽化挥发玻璃棒要不断搅拌溶液,防止由局部液体温度过高,造成液滴飞溅粗盐提纯:杂质有CaCl2 MgCl2 SO42-NaOH→BaCl2→Na2CO3→HCl蒸馏:利用各混合物中的沸点不同,用蒸馏的方法除去易挥发、难挥发或不挥发的物质注意:① 蒸馏烧瓶中要加少量碎瓷片或沸石,防止液体爆沸② 温度计水银球的位置应与蒸馏烧瓶支管口的下沿齐平,以测出该出蒸汽的温度③ 冷凝管中冷却水从下口进,从上口出④ 蒸馏烧瓶要垫石棉网⑤ 连接顺序由下至上,由左到右⑥ 先通水,后加热,防止冷凝管炸裂⑦ 刚开始收集到的馏分应该弃去(冷凝管脏)(实验室制取蒸馏水的装置可以不用温度计,因为自来水中要出去的杂质都难挥发)沸点低先蒸出,加热温度不能超过混合物中沸点最高的温度蒸馏水中离子检验:Cl- : 稀HNO3+AgNO3(顺序可换)SO42- : HCl + BaCl2(顺序不可换,因为可能有Ag+)注意:不能把HCl换成HNO3 ,不能把BaCl2换成Ba(NO3)2 因为SO32-+HNO3=SO42-萃取:利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来萃取剂的选择:①萃取剂与原溶液中的溶质和溶剂都互不相溶②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度(萃取剂的密度可以比水大,也可以比水小)常见的萃取剂:苯、汽油、煤油难溶于水,密度比水小;CCl4,难溶于水,密度比水大分液:将萃取后良种互不相溶的液体分开的操作操作步骤:① 验漏:在分液漏斗中加入少量水,塞上玻璃塞,倒置看是否漏水,再把玻璃塞旋转180°,再倒置② 装液③ 混合振荡:右手压分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触;振荡后打开活塞,使漏斗内气体放出④ 静置分层(放在铁架台上)⑤ 分液:待液体分层后,将分液漏斗颈上的玻璃塞打开,使分液漏斗上口玻璃塞上的凹槽对准漏斗上的小孔,拧开下口活塞放出下层液体,从上口倒出上层液体实验:用四氯化碳萃取碘水中的碘(碘在水中的溶解度很下而在四氯化碳的溶解度大)现象:原来的碘水呈黄色。
人教版高中化学必修一笔记
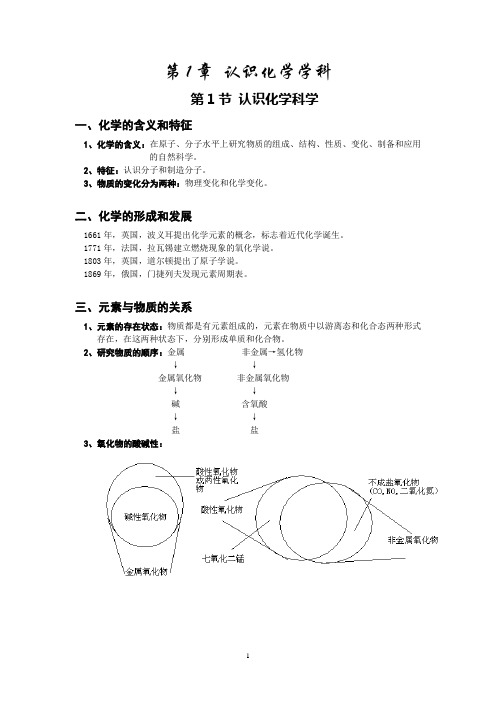
第1节认识化学科学一、化学的含义和特征1、化学的含义:在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
2、特征:认识分子和制造分子。
3、物质的变化分为两种:物理变化和化学变化。
二、化学的形成和发展1661年,英国,波义耳提出化学元素的概念,标志着近代化学诞生。
1771年,法国,拉瓦锡建立燃烧现象的氧化学说。
1803年,英国,道尔顿提出了原子学说。
1869年,俄国,门捷列夫发现元素周期表。
三、元素与物质的关系1、元素的存在状态:物质都是有元素组成的,元素在物质中以游离态和化合态两种形式存在,在这两种状态下,分别形成单质和化合物。
2、研究物质的顺序:金属非金属→氢化物↓↓金属氧化物非金属氧化物↓↓碱含氧酸↓↓盐盐3、氧化物的酸碱性:第2节 研究物质性质的方法和程序一、研究物质的基本方法:观察、实验、分类、比较等方法。
(一)Na 的性质1、物理性质:钠是一种银白色金属,熔点为97.8℃,沸点为882.9℃,密度为0.97g/cm 3。
2、化学性质:容易失去一个电子,形成Na +(稳定结构),还原性极强。
(1)与非金属反应:①4Na+O 2====2Na 2O ②2Na+O 2====Na 2O 2 ③2Na+Cl 2====2NaCl④2Na+S==== Na 2S(2)与水反应:2Na+2H 2O====2NaOH+H 2↑现象:浮:Na 浮在水面上;熔:融化成一个小球;游:四处游动;响:发出咝咝响声;红:试液变红。
(3)与酸反应:2Na+2HCl====2NaCl+H 2↑(4)与盐反应:①2Na+2H 2O+CuSO 4====Cu(OH)2↓+Na 2SO 4+H 2↑ ②6Na+6H 2O+2FeCl 3====2Fe(OH)3↓+6NaCl+3H 2↑ ③4Na+TiCl 4(熔融状)高温Ti+4NaCl (5)Na 在空气中的一系列变化:Na −→−2O Na 2O −−→−O H 2NaOH −−−→−O H CO 22,Na 2CO 3·10H 2O −−→−风化Na 2CO 3 4Na+O 2====2Na 2O → Na 2O+H 2O====2NaOH →2NaOH+9H 2O+CO 2====Na 2CO 3·10H 2O → Na 2CO 3·10H 2O 风化Na 2CO 3+10H 2O ↑3、Na 的保存:钠通常保存在煤油或石蜡油中。
高中化学必修1学霸笔记

高中化学必修1学霸笔记高中化学必修一笔记(一)1. 药品存放安全① 固体→广口瓶液体→细口瓶或滴瓶见光易分解→棕色瓶② 酸性试剂→玻璃塞碱性试剂→橡胶塞③ 氧化剂和还原剂不能一起存放2. 常见意外事故处理① 强碱沾到皮肤——大量水+硼酸② 强酸沾到皮肤——大量水+ 3%~5%NaHCO3溶液③ 有毒有机物沾到皮肤——酒精擦洗④ 酸或碱流到实验桌上——用NaHCO3或__中和,再用水冲洗3.药品的取用固体:粉末状:纸槽、药匙一斜二送三直立块状:镊子、药匙一横二送三慢立液体:直接倾倒或用滴管取4.实验仪器的注意事项试管:加热不超过1/3,试管夹夹在距试管口1/3处先预热再加热,防止试管骤冷炸裂烧杯:加热时应垫石棉网,使受热均匀溶解物质用玻璃棒搅拌,不能触及杯壁或杯底烧瓶:(圆底烧瓶、蒸馏烧瓶、平底烧瓶)都可以用于装配气体发生装置;蒸馏烧瓶用于蒸馏以分离互溶的沸点不同的物质①圆底烧瓶和蒸馏烧瓶可以用于加热,加热要垫石棉网②液体加入量不能超过容积的1/2蒸发皿:用于蒸发液体或浓缩溶液①可以直接加热,但不能骤冷②盛液量不能超过蒸发皿溶剂的2/3③取放蒸发皿应使用坩埚钳坩埚:用于固体物质的高温灼烧①把坩埚放在三脚架上的泥三角上直接加热②取放坩埚要用坩埚钳③不宜用瓷坩埚熔化烧碱、纯碱及氟化物,它们可和瓷共熔使坩埚造腐蚀④用坩埚钳在夹取高温的坩埚时,应先把坩埚尖端在火焰下预热一下酒精灯:失火时要用湿布盖灭4.混合物的分离和提纯过滤:把不溶于液体的固体物质与液体物质分离一贴二低三靠蒸发:给液体加热使液体受热汽化挥发玻璃棒要不断搅拌溶液,防止由局部液体温度过高,造成液滴飞溅粗盐提纯:杂质有CaCl2 MgCl2 SO42-NaOH→BaCl2→Na2CO3→HCl蒸馏:利用各混合物中的沸点不同,用蒸馏的方法除去易挥发、难挥发或不挥发的物质注意:① 蒸馏烧瓶中要加少量碎瓷片或沸石,防止液体爆沸② 温度计水银球的位置应与蒸馏烧瓶支管口的下沿齐平,以测出该出蒸汽的温度③ 冷凝管中冷却水从下口进,从上口出④ 蒸馏烧瓶要垫石棉网⑤ 连接顺序由下至上,由左到右⑥ 先通水,后加热,防止冷凝管炸裂⑦ 刚开始收集到的馏分应该弃去(冷凝管脏)(实验室制取蒸馏水的装置可以不用温度计,因为自来水中要出去的杂质都难挥发)沸点低先蒸出,加热温度不能超过混合物中沸点最高的温度蒸馏水中离子检验:Cl- : 稀HNO3+AgNO3(顺序可换)SO42- : HCl + BaCl2(顺序不可换,因为可能有Ag+)注意:不能把HCl换成HNO3 ,不能把BaCl2换成Ba(NO3)2 因为SO32-+HNO3=SO42-萃取:利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来萃取剂的选择:①萃取剂与原溶液中的溶质和溶剂都互不相溶②溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度(萃取剂的密度可以比水大,也可以比水小)常见的萃取剂:苯、汽油、煤油难溶于水,密度比水小;CCl4,难溶于水,密度比水大分液:将萃取后良种互不相溶的液体分开的操作操作步骤:① 验漏:在分液漏斗中加入少量水,塞上玻璃塞,倒置看是否漏水,再把玻璃塞旋转180°,再倒置② 装液③ 混合振荡:右手压分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触;振荡后打开活塞,使漏斗内气体放出④ 静置分层(放在铁架台上)⑤ 分液:待液体分层后,将分液漏斗颈上的玻璃塞打开,使分液漏斗上口玻璃塞上的凹槽对准漏斗上的小孔,拧开下口活塞放出下层液体,从上口倒出上层液体实验:用四氯化碳萃取碘水中的碘(碘在水中的溶解度很下而在四氯化碳的溶解度大)现象:原来的碘水呈黄色。
高中化学课堂笔记----化学必修2笔记

大越能键
页7第
页 62 共
�子分性极 �� 键价共有只 键价共性极非 键学化无 类种的键学化 �子分性极非为均�H—H、lC—lC、O=O eN、eH�子分子原单�子分体气有稀 例实 物 合化价共 质 单属金非
系关的物合化价共、物合化子离与键价共、键子离 .2 。程过成形的键学化新和裂断的键学化旧是就上质本�程过的应反学化个一 �质实的应反学化 ⑶ 点沸熔 的体晶子分 �强 稍� 弱 。大越 力用作间子分�大越量 式其�子分的似相构结 大越能键�小 越径半子离②�大越能 键�大越数荷电子离① 素因小大能键定决 弱 力引 性电 力引 性电 内体 晶子分和间子分 内体 晶子分和间子分 键氢
页1第
页 62 共
�称互 的子原同不的素元一同的同不数子中而同相数子质�素位同 子原种一的子中的目数定一和子质的目数定一有具�素核 称总的子原类一同的�数子质即�数荷电核同相有具�素元 素位同、素核、素元�念概别区 ⑵ ���数荷电 � 数子质 == 数子电外核的子离阳 �—�数荷电 � 数子质 == 数子电外核的子离阴 �N�数子中 ��Z�数子质 ==�A�数量质 数序子原 == 数子电外核 == �Z�数子质内核 == �Z�数荷电核
页6第
页 62 共
程过成形的物合化价共或子分质单示表式子电用 。的性中电是身本物合化为因�等相数总荷电 子离阳与数总荷电子离阴。荷电负出标角上右在�号括方上加并�子电层外出标要则子离阴 而�荷电正出标角上右号符素元在只�出标再不子电层外的子离阳�式子电价合化子离
。目数对子电用共出标确正�式子电物合化价共或子分
表期周素元
�B�表期周素元 .2
表期周素元 ⑴
写书的图意示构结子原 ⑸ 。层子电的高较量能 入进次依才子电 �后满排层子电的低最量能当 �层子电的低最量能有占先是总子电外核 �个 23 过超不层三第数倒�个 81 过超不多最数子电层外次�个 8 过超不多最数子电层外最 � n2 过超不多最数子电层一每 律规布排子电外核子原 ②
高中化学课堂笔记----化学必修1

mc/g 位单的ρ度密虑考�M/W )液溶(V ρ =)质溶(M/�质溶�m=)质溶(n 而� )液溶(V/)质溶(n=C 据根�断推 【 。C 度
浓量的质物的质溶求�M 为量质尔摩质溶�V 为积体液溶� � mc/g�ρ为度密液溶�W 为数分量质质溶液溶某知已
3
� mc/g 为位单ρ中其�M/Wρ0001=C�系关的 C 度浓量的质物与 W 数分量质
1� 32
�系关的间之量个各、3 。量的 质物 B 质溶某含 所液溶积体位单 积体的有具所体 气量的质物位单 量质的有具所质 物量的质物位单 。数子粒含所 C �度浓量的质物 mV �积体尔摩体气 M �量质尔摩
A
N
�尔摩每作读�lom/ 或 lom�位单有 AN
1�
质 物 何 任 lom1 �数常罗德加伏阿 量理物的体集子 粒目数定一量衡 义定 n �量的质物 号符、念概
液溶
变而少多积体液溶取所随不度浓量的质物的质溶某② 。L1 是不定肯积体液溶�体气 者或质溶解溶水 L1 将 �积体的液溶是须必 V 的中式公① lom/L4.22≈mV�下况状准标在即 L4.22 为约积 体占所体气何任 lom1�aPK101�℃0�下况状准标在② 。强压和度温有素因积体尔摩体气响影① 变而化变量的质物其随不量质尔摩的质物种一② 。等相量质子分对相或子原对相其 与上值数在�时位单为 lom/g 以量质尔摩的质物种一① 。 lom 01×20.6≈AN
。液浊、体胶、液溶为分系散分将以可小大子粒质散分据根�时体液为剂散分当�3�
。式方合组种 9 有以可系散分�态状的处所剂散分和质散分照按�质散分和剂散分 剂散分—质物的中其在布分粒微 质散分—质物的粒微成散分 �成组�2� 。系体的到得所中质物�种多或�种一另在散分式形子粒以质物�种多或�种一 �义定�1� �系散分 �类分其及系散分、2 。法类分状树和法类分叉交�法方类分的见常种两、1
高二化学知识点详细笔记手写

高二化学知识点详细笔记手写一、化学的基本概念和性质1.化学的定义:研究物质的组成、性质、结构、变化规律及其与能量的关系的学科。
2.物质的分类:常见的物质可分为元素和化合物两类。
- 元素:由同一种原子组成的纯物质,如氧气、金属铜等。
- 化合物:由两种或多种不同元素化合而成的纯物质,如水、盐酸等。
3.物质的性质:- 惰性:具有稳定性,不易与其他物质发生反应。
- 活性:易与其他物质发生反应。
- 溶解性:某种物质在溶剂中能否溶解。
4.物质的组成:物质由原子组成,原子由质子、中子和电子构成。
- 质子:带正电荷的粒子,位于原子核内。
- 中子:不带电的粒子,位于原子核内。
- 电子:带负电荷的粒子,绕原子核运动。
5.分子和离子:- 分子:由两个或多个原子通过化学键结合形成的具有独立存在和一定稳定性的粒子。
- 离子:在化学反应过程中,原子失去或获得电子而形成的带电粒子。
二、化学方程式的表示和化学计算1.化学方程式的表示:- 反应物:参与反应并发生变化的物质。
- 生成物:反应后生成的物质。
- 反应条件:反应发生时的条件,如温度、压力等。
- 反应箭头:表示反应方向的箭头。
2.化学计算:- 摩尔质量:物质相对分子质量或原子质量的单位称为摩尔质量。
- 摩尔:物质的质量与其相对原子质量或分子质量之比。
三、常见化学反应1.氧化还原反应:- 氧化:物质失去电子或增加氧原子数的过程。
- 还原:物质获得电子或减少氧原子数的过程。
2.酸碱反应:- 酸:能够产生H+离子的物质。
- 碱:能够产生OH-离子的物质。
- 中和反应:酸和碱反应生成盐和水的反应。
3.置换反应:- 单一置换反应:一个元素替换掉另一个化合物中的原子。
- 双替换反应:两个化合物中的原子互相交换。
四、气体的性质和运动规律1.气体的性质:- 可压缩性:气体的分子间距离较大,可根据压力的变化进行压缩。
- 均匀性:气体在容器中均匀分布。
- 可扩散性:气体分子能够通过小孔扩散到其他区域。
高三化学知识点手写笔记

高三化学知识点手写笔记氧化还原反应1. 氧化还原反应是指发生氧化和还原两个过程的化学反应。
2. 氧化是指物质失去电子,还原则是指物质获得电子。
3. 氧化剂是指能够接受电子的物质,还原剂是指能够提供电子的物质。
4. 氧化还原反应中必须同时存在氧化和还原反应。
5. 氧化还原反应可以通过电子转移或氧原子转移进行。
电解质溶液1. 电解质溶液是指能够在溶液中导电的物质。
2. 电解质溶液可以分为强电解质和弱电解质。
3. 强电解质在水溶液中完全离解成离子。
4. 弱电解质在水溶液中只部分离解成离子。
5. 电解质溶液的导电性与电解质的浓度和电荷数有关。
离子反应1. 离子反应是指以离子为反应物的化学反应。
2. 离子反应中的离子可以分为阳离子和阴离子。
3. 阳离子是带正电荷的离子,阴离子是带负电荷的离子。
4. 离子反应可以通过阴离子交换或阳离子交换进行。
酸碱中和反应1. 酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
2. 在酸碱中和反应中,酸会失去H+离子,碱会失去OH-离子。
3. 生成的盐是由酸的阴离子和碱的阳离子组成的。
4. 酸碱中和反应是一种放热反应,释放能量。
物质的分类1. 物质可以分为纯物质和混合物。
2. 纯物质是指由同一种物质组成的物质。
3. 混合物是指由两种或两种以上的物质组成的物质。
4. 纯物质可以分为元素和化合物。
5. 元素是由同一种原子组成的纯物质,化合物是由不同元素的原子组成的纯物质。
化学键1. 化学键是指原子之间通过相互作用力而结合形成的键。
2. 化学键的类型包括离子键、共价键和金属键。
3. 离子键是由正负电荷之间的吸引力形成的键。
4. 共价键是由原子间电子的共享形成的键。
5. 金属键是金属原子间形成的键,具有电子云的自由运动性。
元素周期表1. 元素周期表是将元素按照原子序数和原子量排列的表格。
2. 元素周期表可以分为周期和族。
3. 周期指的是元素周期表中水平方向的行。
4. 族指的是元素周期表中垂直方向的列。
高中化学知识点总结手写

高中化学知识点总结手写一、基本概念与原理1. 物质的分类- 纯净物:由单一种类的分子或原子组成,如氧气(O2)、铁(Fe)。
- 混合物:由两种或两种以上不同物质混合而成,如空气、果汁。
2. 物质的量- 摩尔(mol):物质的量的单位,1摩尔代表6.022×10^23个基本单位。
- 阿伏伽德罗常数:6.022×10^23 mol^-1,用于计算物质的量。
3. 化学反应- 反应物与生成物:参与化学反应的物质称为反应物,反应后生成的物质称为生成物。
- 化学方程式:用化学符号表示化学反应的式子,如2H2 + O2 → 2H2O。
4. 化学键- 离子键:正负离子间的静电吸引力。
- 共价键:两个或多个原子共享电子对形成的化学键。
- 金属键:金属原子间的电子共享形成的化学键。
5. 酸碱理论- 布朗斯特-劳里酸碱理论:酸是质子(H+)的供体,碱是质子的受体。
- 路易斯酸碱理论:酸是电子对的受体,碱是电子对的供体。
二、元素周期表与元素周期律1. 元素周期表- 周期:水平排列的行,电子层数相同的元素在同一周期。
- 族:垂直排列的列,具有相似化学性质的元素在同一族。
2. 元素周期律- 原子半径:周期表中从左到右减小,从上到下增大。
- 电负性:周期表中从左到右增大,从上到下减小。
- 电离能:周期表中从左到右增大,从上到下减小。
三、化学实验操作与安全1. 实验基本操作- 称量:使用天平精确称量化学物质。
- 混合:正确混合化学物质以避免剧烈反应。
- 溶解:使用溶剂溶解固体物质。
2. 实验安全- 个人防护:穿戴实验服、防护眼镜、手套等。
- 化学品处理:正确标记和存储化学品。
- 事故处理:了解基本的急救措施和事故处理流程。
四、有机化学基础1. 有机化合物- 碳的杂化:sp、sp2、sp3杂化轨道形成的碳原子结构。
- 官能团:决定有机化合物性质的特定原子团,如羟基、羧基。
2. 有机反应类型- 取代反应:一个原子或基团被另一个取代。
