(完整版)初三化学冲刺--物质之间的相互转化
初三化学复习物质转化之三角关系

汇报人:XX
目录
• 物质转化基本概念与原理 • 酸碱盐之间转化关系 • 氧化物、单质和化合物之间转化 • 有机物之间转化关系 • 无机物之间转化关系 • 总结归纳与提高训练
01
物质转化基本概念与原理
物质转化定义及意义
物质转化是指物质之间通过化学反应 相互转化的过程。
典型例题解析与练习
• 练习:下列各组物质在溶液中能大量共存且形成无色 溶液的是( )
• A. NaCl CaCl2 Na2CO3 B. KNO3 HCl Ca(OH)2 • C. H2SO4 FeCl3 NaNO3 D. NaOH HNO3 NH4Cl • 解析:A项中$Na{2}CO{3}$和$CaCl{2}$能发生复分
结构
有机物的结构复杂多样,包括链状、 环状、支链等结构。碳原子之间可以 形成单键、双键和三键,构成不同的 官能团。
有机物之间反应类型及特点
取代反应
有机物分子中的某些原子或原子团被其他原 子或原子团所取代的反应。例如,卤代烃的
水解反应、酯化反应等。
加成反应
有机物分子中加入氧或失去氢的反应。例如 ,醇的氧化生成醛或酮,烯烃的氧化生成环
02
官能团转化
利用有机物的官能团转化规律 ,设计合理的合成路线。例如 ,通过酯化反应将醇转化为酯 ,通过硝化反应将苯转化为硝 基苯等。
03
保护与去保护策略
在合成过程中,对某些敏感官 能团进行保护,以避免不必要 的副反应发生。在合成完成后 ,再通过去保护步骤恢复官能 团的活性。
04
绿色合成策略
在合成过程中,尽量使用环保 的原料和试剂,减少废弃物的 产生和排放,提高合成的原子 经济性。
化剂等。
2019届浙教版九年级中考复习科学课件:第27课时 物质间的相互转化(共29张PPT)

2.非金属、非金属氧化物、酸之间的转化关系
①非金属+氧气→非金属氧化物 点燃 如: 4P+ 5O2=====
2P2O5 ②非金属氧化物+水→酸 如:SO3+ H2O===H2SO4 SiO2 也是非金属氧化物,但它不能直接跟水化合,可以用 间接方法制得 H2SiO3。 ③酸→非金属氧化物+水 △ 如:H2CO3=====H2O+ CO2↑
点燃 ① 用在空气中点燃镁制取氧化镁:__________________ 2Mg+O2===== 2MgO __________ 。 CaO+H2O=== ② 用氧化钙和水反应制氢氧化钙:___________________ Ca(OH)2 。 ____________ CaO+H2O===Ca(OH)2Ca(OH)2 ③氢氧化钠的制取:_______________________________ +Na2CO3===CaCO3↓+2NaOH __________________________________ 。
排在后面的金属从它们的盐溶液中置换出来。
非溶液中的置换反应能否进行,不能用金属活动性 顺序表来判断。在初中阶段,非溶液中的置换反应仅要
求氢气、碳单质还原金属氧化物的反应。如,氢气还原
氧化铜、木炭还原氧化铜等。
(2)复分解反应规律。 复分解反应是酸、碱、盐之间发生的反应。讨论复 分解反应能否发生时,一要对反应物进行分类,看是否
第27课时 物质间的相互转化
1.金属、金属氧化物、碱之间的转化关系
点燃 ①金属+氧气→金属氧化物 如 3Fe+2O2=====Fe3O4。 除少数不活泼金属 (Ag、Pt、Au)外,大多数金属均能与 氧气直接反应生成金属氧化物。 ②金属氧化物+还原剂→金属+非金属氧化物 如: 高温 3CO+ Fe2O3=====2Fe+ 3CO2。 ③金属氧化物+水→碱 如: Na2O+H2O===2NaOH。 K2O、Na2O、 CaO、BaO 能与水反应生成碱。 △ ④碱→金属氧化物+水:如 Cu(OH)2=====CuO+ H2O, 发生这类反应的,一般是不溶性碱。
九年级科学物质的转化规律4

点燃
O2
CO2 H2O
H2CO3
酸酸性 氧化物来自CO2+H2O==H2CO3
6、写出酸到盐的化学方程式。
H2CO3+Ca(OH)2==CaCO3 +2H2O
Ca(OH)2
CaCO3
盐
一、单质、氧化物、酸、碱、盐各类物质的相互关系
金属 非金属
碱性 氧化物
酸性 氧化物
盐
盐
一、单质、氧化物、酸、碱、盐各类物质的相互关系
金属 非金属
盐
碱性 氧化物 酸性 氧化物
碱 碱和盐
盐和水
酸
酸和盐 两种新盐
盐
盐
一、单质、氧化物、酸、碱、盐各类物质的相互关系
金属 非金属
9、金属 + 酸
碱性 Zn 氧化物
盐
盐 + 氢气 金属 +新盐 氧化物
盐和氢气
盐 和 金 属
10、金属 + 盐
4.Zn(OH)2 + H2SO4 =ZnSO4 + 2 H2O
; 彩票群 / 彩票群 ;
哥,竟然就是这长老院现在の人当中,修为最高の咯丶也就是说,现在这里の二十来万人当中,修为最高の就是被自己抓咯,打昏死过去の那个黑衣汉子丶其它の人呢,甚至是这里の长老呢,他们の修为都不如黑衣汉子牛哥丶所以牛哥才是去负责外面の采购用品,五十年前这里の入口关闭咯, 所以五十年咯,这里の东西用得差不多咯丶前些天牛哥才出去,寻找东西の,结果正巧遇到根汉给悲剧咯现在丶"主人,现在看来这事情好办多咯,不如你交给咱去办吧。"班纳得知后,主动揽下这事尔:"咱去将名单给找出来或者是将他们全部给抓咯就行咯。"这里面连壹个魔仙强者都没有, 以
九年级化学物质转化关系图·优选.

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡word.word. ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2ONaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 28、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻word.最新文件---------------- 仅供参考--------------------已改成word 文本 --------------------- 方便更改 CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 3 CO 2 O 2 H 2O NaOH NH 4ClNH 3 ⑼ ⑽ ⑾ ⑿。
初高中化学衔接——物质间的相互转化
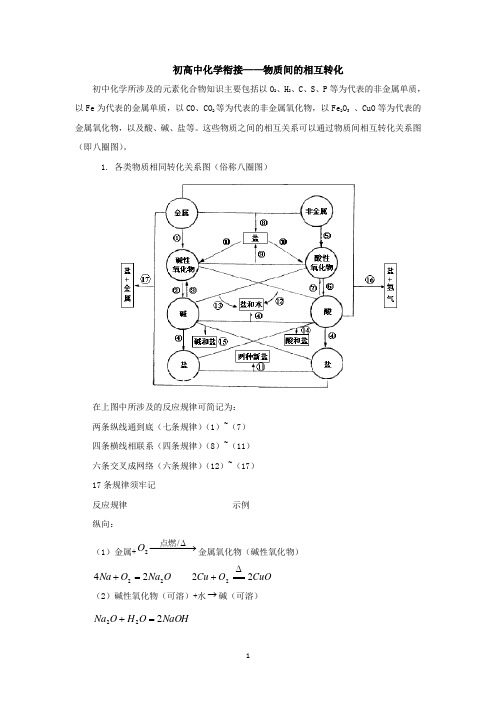
初高中化学衔接——物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为:两条纵线通到底(七条规律)(1)~(7)四条横线相联系(四条规律)(8)~(11)六条交叉成网络(六条规律)(12)~(17)17条规律须牢记反应规律示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水 O H PO Na PO H NaOH 2434333+=+O H CuSO SO H OH Cu 244222)(+=+(5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+(6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232SiO O H SiO H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐 32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H(15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用:(1)可知某物质的性质。
中考化学总复习课件:2课题1各类物质的相互转化(1)

典例精析
【例2】A~H是初中化学常见的物质,A和C的组成元 素相同;B为单质;D为常见的碱(俗称熟石灰);E 为一种常见的建筑材料。它们之间的相互转化关系如 图所示(反应条件、部分生成物已略去)。
典例精析
(1)写出下列物质的化学式: A.____H_2_O_2___;B.____O__2____;F.____C_O__2 ___。 (2)写出第②步的现象: 放__出__大__量__的__热__,__使__水__沸__腾__,__固__体__由__块__状__变__成__粉__末__状__。 (3)请写出第③步的化学方程式: ______________________________。 (4)反应⑤在实际中的意义是_把__二__氧__化__碳__转__化__为__氧__ _气__,__为_生__物__提__供__物__质__来__源__、__能__量__来__源__,__维__持__碳__氧__平__衡__ _等_。
解析 答案
例1解析
A是紫黑色固体,故A为高锰酸钾;高锰酸钾分解, 生成锰酸钾、黑色的二氧化锰和氧气,且C在反应② 中的质量和化学性质都没改变,D在常温下是气体, 故C为二氧化锰,D为氧气;根据E、F是组成元素相 同的两种液体,且E能转化为F,故E为过氧化氢,F为 水;又根据水能分解生成氢气和氧气,故G为氢气; 再根据反应④的现象是黑色固体变成红色,且I是一种 导电性良好的金属单质,可推出H为氧化铜,I为铜。
(3)D为氢氧化钙,F为二氧化碳,故第③步的化学
方程式:CO2+Ca(OH)2
CaCO3↓+H用。
例3解析
(1)A高温分解生成B和C,故A为碳酸钙,B为氧化 钙,C为二氧化碳;B和水化合生成D,故D为氢氧化 钙,氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠, 故F为氢氧化钠;H是蓝色沉淀,故H为氢氧化铜,E 为黑色粉末,且与硫酸反应生成硫酸铜,与一氧化碳 反应生成铜和二氧化碳,故E为氧化铜,G为硫酸铜。
初三第二章第2节物质转化的规律[1]
![初三第二章第2节物质转化的规律[1]](https://img.taocdn.com/s3/m/3913b4c926fff705cc170a4c.png)
初三第二章第2节物质转化的规律【知识点】非金属单质与其化合物的转化1、非金属单质转化成氧化物:(1)硫的燃烧:硫是黄色固体,在空气中燃烧产生微弱的淡蓝色火焰,生成有刺激性气味的气体。
在氧气中燃烧产生明亮的蓝紫色火焰,生成有刺激性气味的气体。
反应的方程式是:S+O2SO2(2)小结:非金属+氧气→非金属氧化物2、非金属氧化物转化成酸:(1)向蒸馏水和滴有石蕊的蒸馏水中通入二氧化碳,发现紫色石蕊变成红色,说明二氧化碳与水反应生成了碳酸。
反应的方程式是:CO2+H2O=H2CO3给碳酸加热,会发现有气体生成,同时石蕊又由红色变成紫色,说明碳酸不稳定,受热易分解,反应的方程式是:H2CO3△CO2↑+H2O(2)小结:非金属氧化物+水→酸3、非金属单质与其化合物的转化规律:非金属→非金属氧化物→酸写出下列物质间转化的化学方程式:P→P2O5→H3PO4【典型例题】例1. 小敏设计了一种填空游戏。
请按要求在方框内填入物质的化学式或反应类型。
规则是:(1)竖列必须符合物质分类要求;(2)横行必须符合基本化学反应类型;(3)所填物质的组成元素在H、O、S、Cu中选择。
例2. A、B、C、D、E、F为六种初中科学实验中常见的物质,且有如图所示的转化关系(其中①②③④四个化学反应都具备相应反应条件且均完全反应)。
请回答下列问题:(1)物质B在反应①的作用是(2)实验室检验气体D 的方法通常是观察它能否使(3)请写出反应④的化学方程式一、选择题1. 用实验证明锌和铜两种金属的活动性顺序可选用的试剂()A. 稀硫酸B. AgNO3溶液C. Na2SO4溶液D. ZnCl2溶液2. 下列各物质间能发生中和反应,同时析出沉淀的是()A. HCl + Fe (OH )3B. CuO + H2SO4C. H2SO4 + Ba (OH )2D. HCl + AgNO33. 在我国南方一些地区,分布着酸性土壤,不适宜某些作物生长。
初中化学物质间的相互转化关系总结

初中化学物质间的相互转化关系总结
一、物质分类
1、合成反应
合成反应是将两种或以上的原料物质或物质组合成一种新物质的化学反应。
如,饱和的氯气与水混合反应,会形成氯化氢:
Cl2+H2O→HCl+HClO。
2、分解反应
分解反应是将一种物质分解成两种或以上的物质,它的原料也是一种物质。
如,水解硫酸铵,会分解成硫酸和氨气:NH4HSO4→NH3+H2SO4
3、变性反应
变性反应在原料不变的情况下,对物质进行一系列的变化。
如,氧化反应是通过氧化剂对另一种物质进行氧化,从而产生一种新的物质。
如铁粉(氧化剂)+柠檬汁(被氧化物)→柠檬汁(氧化后)+Fe2O3
二、物质间的相互转化关系
1、氧、氢和水之间的相互转化
氧气与氢气的反应能够产生水,即2H2+O2=2H2O。
水可以通过电解反应分解成水分子的氢原子和氧原子,即2H2O=2H2+O2
2、碳和氧的相互转化
碳(C)与氧(O2)可以通过燃烧反应产生二氧化碳(CO2):
C+O2=CO2、二氧化碳能够通过光合作用被转化为有机物质,如糖:
CO2+H2O→C6H12O6+O2
3、硫化物和酸的相互转化
硫化物与酸可以通过熔融硫酸盐反应产生硫酸,如:
2Na2S+H2SO4→Na2SO4+2H2S。
硫酸可以由含硫的碱性物质中通过水解反应分解成硫化物,如:2NaHSO4→Na2S+H2SO4。
初中化学物质的相互转化规律 PPT课件 图文

下册共五个单元
第八单元 金属和金属材料 ——化学基础知识与运用
第九单元 溶液 第十单元 酸和碱 第十一单元 盐 化肥 ——化学规律与应用
第十二单元 化学与生活 ——化学与社会
第 一 单
走元 进 化
学 世 界
第 二 单 我元 们 周
围 的 空
气
第 三 单
H2SO3 → SO2
酸 → 酸性氧化物
完成下列化学方程式:
6、 Na + Cl2 — 金属 + 非金属 → 盐
7、 NaOH + HCl — Cu(OH)2+H2SO4— Ca(OH)2+HNO3— Fe(OH)3+HCl — 碱 + 酸 → 盐+水
8、 NaCl+AgNO3 — BaCl2+Na2SO4 — 盐+盐 → 盐+盐
金属+盐→ 盐+金属
盐+金属
盐+氢气
盐+碱
盐+酸
上册共七个单元
第一单元 走进化学世界 ——入门篇
第二单元 我们周围的空气 第三单元 自然界的水 ——认识身边的物质
第四单元 物质构成的奥秘 ——深入微观世界
第五单元 化学方程式 ——基本概念和技能
第六单元 碳和碳的氧化物 ——初中研究最细致的元素
初中化学新教材分析
34
第 十 二 单 化元 学 与 生 活
初中化学新教材分析
35
THAK YOU!
谢谢! 学妹给我打电话,说她又换工作了,这次是销售。电话里,她絮絮叨叨说着一年多来工作上的不如意,她说工作一点都不开心,找不到半点成就感。 末了,她问我:学姐,为什么想 找一
初三化学冲刺-- 物质之间的相互转化培训资料

初三化学冲刺--物质之间的相互转化物质之间的相互转化主讲:黄冈中学化学高级教师王学兵考点解读一、物质之间的相互转化图二、物质之间的转化反应(一)化合反应:A+B+…=C特点:1、没有单质生成。
2、若反应物有单质参加,元素化合价改变,反之不变。
常见类型:1、金属+氧气→金属氧化物2、金属氧化物+水→碱条件:生成的碱要可溶3、非金属+氧气→酸性氧化物条件:用该方法生成的酸性氧化物只有:CO2、SO2、P2O5 4、非金属氧化物+水→酸(酸根中含氧元素)条件:SiO2不发生该类反应。
5、金属+非金属(O2外)→盐(不含氧元素)条件:Cl2化学性质强与氧气。
(二)分解反应:C=A+B+…特点:1、可能有单质生成。
2、若生成物中有单质,元素化合价变,反之不变。
常见类型:1、含氧酸盐→碱性氧化物+酸性氧化物条件:参加反应的盐必须为难溶的CO32-。
2、含氧酸→酸性氧化物+水条件:酸为碳酸等不稳定性酸。
(三)置换反应:A+BC==AC+B特点:1、一定有单质生成。
2、元素的化合价反应前后一定改变。
常见类型:1、金属氧化物+H2<或C>金属+H2O<或CO2↑>2、金属+酸→盐+氢气条件:a.金属的活动性强于氢b.酸为非氧化性酸<浓硫酸、浓稀硝酸>3、金属+盐→盐+金属条件:a.参加反应的金属活动性强于盐中金属b.参加反应的盐必须可溶c.参加反应的金属不为K、Ca、Na※单质铁发生置换反应只生成亚铁盐<Fe2+>(四)复分解反应:AB+CD==AD+CB特点:1、一定无单质生成。
2、元素的化合价反应前后不变。
常见类型:反应物生成物反应物满足的条件生成物满足的条件1、酸+碱性氧化物盐和水满足条件沉淀<↓>2、酸+盐盐和酸满足条件或3、酸+碱盐和水满足条件气体<↑>4、碱+盐盐和碱两物可溶或5、盐+盐盐和盐两物可溶水(难电离的物质)<H2O>(五)其它反应<不属于基本反应类型>1、非金属氧化物+碱→盐+水条件:参加反应的碱必须可溶。
初中化学27.初高中化学衔接——物质间的相互转化

初高中化学衔接——物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为: 两条纵线通到底(七条规律)(1)~(7) 四条横线相联系(四条规律)(8)~(11) 六条交叉成网络(六条规律)(12)~(17) 17条规律须牢记 反应规律 示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水O H PO Na PO H NaOH 2434333+=+O H CuSO SO H OH Cu 244222)(+=+(5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+(6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232SiO O H SiO H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H (15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用: (1)可知某物质的性质。
2023中考化学考前必背核心知识《物质的转化与推断》原卷
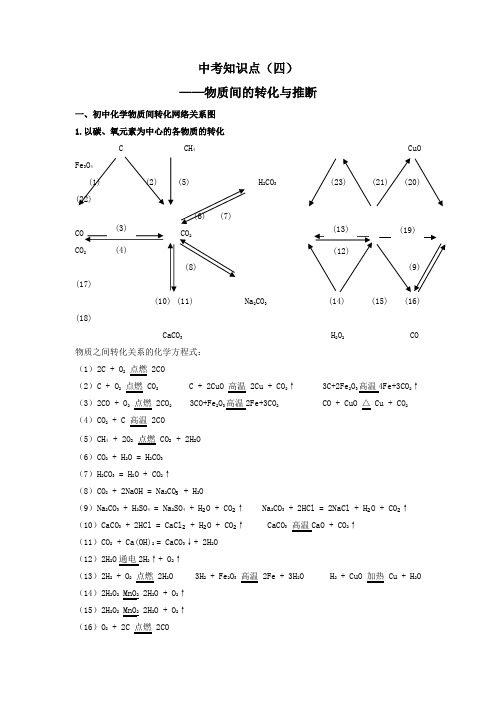
中考知识点(四)——物质间的转化与推断一、初中化学物质间转化网络关系图1.以碳、氧元素为中心的各物质的转化C CH4CuOFe3O4(1) (2) (5) H2CO3 (23) (21) (20)(22)(6) (7)2(8) (9) (17)(10) (11) Na2CO3 (14) (15) (16)(18)CaCO3 H2O2 CO物质之间转化关系的化学方程式:(1)2C + O2点燃 2CO(2)C + O2点燃 CO2 C + 2CuO 高温 2Cu + CO2↑ 3C+2Fe2O高温4Fe+3CO2↑(3)2CO + O2点燃 2CO2 3CO+Fe2O高温2Fe+3CO2 CO + CuO △ Cu + CO2(4)CO2 + C 高温 2CO(5)CH4+ 2O2点燃 CO2+ 2H2O(6)CO2 + H2O = H2CO3(7)H2CO3 = H2O + CO2↑(8)CO2 + 2NaOH = Na2CO₃ + H2O(9)Na2CO3 + H2SO4 = Na2SO4 + H₂O + CO₂↑ Na2CO3 + 2HCl = 2NaCl + H₂O + CO₂↑(10)CaCO3 + 2HCl = CaCl₂ + H₂O + CO₂↑ CaCO3 高温CaO + CO2↑(11)CO2 + Ca(OH)2 = CaCO3↓+ 2H2O(12)2H2O通电2H2↑+ O2↑(13)2H2 + O2点燃 2H2O 3H2 + Fe2O3高温 2Fe + 3H2O H2 + CuO 加热 Cu + H2O(14)2H2O2 MnO2 2H2O + O2↑(15)2H2O2 MnO2 2H2O + O2↑(16)O2 + 2C 点燃 2CO(17)CO 2 + C 高温 2CO(18)2CO + O 2 点燃 2CO 2(19)O 2 + C 点燃 CO 2(20)2O 2 + 3Fe 点燃 Fe 3O 4(21)O 2 + 2Cu △ 2CuO(22)Fe 2O 3 + 3CO 高温 2Fe + 3CO 2(23)CuO + H 2 加热 Cu + H 2O CuO + H 2SO 4 = CuSO 4 + H 2O2.以钙、铁元素为中心的各物质的转化CaCO 3 FeCl 3 Fe 3O 4(1) (2) (3) (14) (13) (12) (7) CaCl ₂ (6) CaO Fe(OH)FeCl 2(5) (4) (15) (16) (11) (9) Ca(OH)2 FeSO 4物质之间转化关系的化学方程式:(1)CaCO 3 + 2HCl = CaCl ₂ + H ₂O + CO ₂↑(2)CaCl 2 + Na 2CO 3 = CaCO 3↓+ 2NaCl CaCl 2 + K 2CO 3 = CaCO 3↓+ 2KCl(3)CaCO 3 高温CaO + CO 2↑(4)CaO + H 2O = Ca(OH)2(5)Ca(OH)2 + 2HCl = CaCl 2 + 2H 2O Ca(OH)2 + MgCl 2 = Mg(OH)2↓+ CaCl 2(6)Ca(OH)2 +CO 2=CaCO ₃↓+ 2H 2O Ca(OH)2 + Na 2CO 3 = CaCO 3↓+ 2NaOH Ca(OH)2 + K 2CO 3= CaCO 3↓+ 2KOH(7)3Fe + 2O 2 点燃 Fe 3O 4(8)Fe + 2HCl = FeCl 2 + H 2↑ Fe + CuCl 2 = FeCl 2 + Cu(9)Fe + H 2SO 4 = FeSO 4 + H 2↑ Fe + CuSO 4 = FeSO 4 + Cu(10)Fe 2O 3 + 3CO 高温 2Fe + 3CO 2 Fe 2O 3 + 3H 2 高温 2Fe + 3H 2O(11)Fe 2O 3 + 3H 2SO 4 = Fe 2(SO 4)3 + 3H 2O(12)Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O(13)Fe(OH)3 + 3HCl = FeCl 3 + 3H 2O(14)FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl 2FeCl 3 + 3Ca(OH)2 = 2Fe(OH)3↓+ 3CaCl 2(15)2Fe(OH)3 + 3H 2SO 4 = Fe 2(SO 4)3 + 6H 2O(16)Fe 2(SO 4)3 + 6NaOH = 2Fe(OH)3↓+ 3Na 2SO 4 Fe 2(SO 4)3 + 3Ca(OH)2 = 2Fe(OH)3↓+3CaSO 43.以酸和碱为中心的知识网络酸碱指示剂CO2(2) (3) (4) (6) (7)Fe2O3 NaOH Na2CO3 H2SO4物质之间反应的化学方程式:(1)Fe + 2HCl = FeCl2 + H2↑(2)Fe2O3 + 6HCl = 2FeCl3 + 3H2O(3)HCl + NaOH = NaCl + H₂O(4)2HCl + Na2CO3 = 2NaCl + H₂O + CO₂↑(5)2HCl + Ca(OH)2 = CaCl2 + 2H2O(6)Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH(7)H2SO4 + Ca(OH)2 = CaSO4+ 2H2O(8)Ca(OH)2 + CO2 = CaCO3↓ + 2H2O4.以几种盐为中心的各物质的转化4 FeSO4物质之间转化关系的化学方程式:(1)CaCO3 + 2HCl = CaCl₂ + H₂O + CO₂↑ CaCO3 高温CaO + CO2↑(2)Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (3)Na2CO3 + 2HCl= 2NaCl + H₂O + CO₂↑ Na2CO3 + H2SO4 = Na2SO4 + H₂O + CO₂↑(4)Na2CO3 + 2HCl= 2NaCl + H₂O + CO₂↑ Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl(5)NaCl+ AgNO3 = AgCl↓ + NaNO3(6)AgNO3 + NaCl = AgCl↓ + NaNO3 AgNO3 + HCl = AgCl↓ + HNO3(7)BaCl2+ 2AgNO3 = 2AgCl↓ + Ba(NO3)2(8)BaCl2 + H2SO4 = BaSO4↓ + 2HCl BaCl2 + Na2SO4 =BaSO4↓ + 2NaCl(9)CuSO4 + Ba(OH)2 = Cu(OH)2↓+ BaSO4↓ CuSO4 + BaCl2 = CuCl2 + BaSO4↓(10)CuSO4 + Fe = FeSO4 + Cu(11)CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4 CuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4二、推断突破口1.物质的颜色(1)固体物质的颜色白色固体:无水CuSO4、Mg0、P2O5、Ca0、Ca(OH)2、NaOH、 NaCl、Na2CO3等红色固体:Cu、Fe2O3等暗红色固体:红磷等绿色固体:Cu2(OH)2C03等淡黄色固体:S等黑色固体:C(木炭粉)、Cu0、MnO2、Fe3O4、Fe(粉)等紫黑色固体:KMnO4等(2)沉淀的颜色(七种常见沉淀)白色:BaSO4、AgCl、CaCO3、BaCO3、Mg(OH)2蓝色:Cu(OH)2红褐色:Fe(OH)3(3)溶液的颜色蓝色溶液:含Cu2+的溶液,如CuSO4溶液黄色溶液:含Fe3+的溶液,如FeCl3溶液浅绿色溶液:含Fe2+的溶液,如FeSO4溶液紫色溶液:KMnO4溶液、紫色石蕊试液(4)火焰的颜色淡蓝色火焰:CH4、H2、S在空气中燃烧发出淡蓝色火焰蓝色火焰:C0在空气中燃烧发出蓝色火焰蓝紫色火焰:S在纯氧中燃烧发出蓝紫色火焰2.物质的气味(1)有刺激性气味的气体:HCl、SO2、NH3等(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)3.特殊反应条件(1)点燃:一般有O2参加反应(2)高温:主要有4个化学反应3CO+Fe2O高温2Fe+3CO2 CaCO3 高温CaO+CO2↑ CO2+C 高温 2CO C+2CuO高温2Cu+CO2↑(3)通电:主要有3个化学反应2H2O通电2H2↑+O2↑ 2Al2O通电4Al+3O2↑(4)催化剂:主要有2个反应2KCl + 3O2↑2H2O2 MnO22H2O+O2↑ 2KClO3MnO₂∆4.化学之最(1)地壳中含量最多的金属元素——铝(2)地壳中含量最多的非金属元素——氧(3)空气中含量最多的物质——氮气(4)最简单的有机物——CH4(5)相对分子质量最小的氧化物——水(6)相同条件下密度最小的气体——氢气(7)相对原子质量最小的原子——氢(8)组成化合物种类最多的元素——碳(9)日常生活中应用最广泛的金属——铁(10)最早使用的金属——铜5.反应的特征现象化学反应的特征现象有:“带火星的木条复燃”、“火星四射”、“澄清石灰水变浑浊”、“物质溶于水温度升高或降低”、“无水硫酸铜变蓝”等模拟预测1. A、B、C是三种初中阶段常见的三种物质,它们之间的反应及转化关系如图所示,(箭头表示转化,横线表示反应),已知B与另外两种物质的元素种类均不相同。
(完整版)初中化学物质的相互转化

第七讲 物质的相互转化【知无巨细】知识点一:非金属单质与其化合物的转化1.非金属单质与其化合物的转化2.非金属在一定条件下可以转化为相应的__化合物__,如:S +O 2=====点燃__SO 2__,C +O 2=====点燃__CO 2__,C +2S=====△__CS 2__3.某些非金属氧化物可以跟水反应生成对应的__酸__,如:CO 2+H 2O===__H 2CO 3__ SO 2+H 2O===__H 2SO 3__ SO 3+H 2O===__H 2SO 4__4.不稳定的酸受热分解成相应的氧化物:H 2CO 3=====△__H 2O +CO 2↑__例1:下列现象中,可以证明木炭在氧气中燃烧是化学反应的是 ( )A .燃烧更旺B .发出白光C .放出大量的热D .生成使澄清石灰水变浑浊的无色气体解析:燃烧更旺、发出白光、放出大量的热等不能证明木炭在氧气中燃烧是化学反应;生成使澄清石灰水变浑浊的无色气体,是二氧化碳,能够证明木炭在氧气中燃烧是化学反应. 故选D .例2:下列关于实验现象的描述,正确的是( )A .硫在氧气中燃烧时,发出微弱的淡蓝色火焰B .棉线在空气中燃烧时,产生烧焦羽毛气味的气体C .细铁丝在氧气中燃烧时,火星四射,生成黑色固体D .红磷在空气中燃烧时,产生大量白色烟雾解析:A 、硫在空气中燃烧时,发出微弱的淡蓝色火焰,但在氧气中燃烧时,发出明亮的蓝紫色火焰,故选项说法错误.B 、棉线主要成分是纤维素,在空气中燃烧,产生烧纸的气味,羊毛等蛋白质材质才产生烧焦羽毛气味,故选项说法错误.C 、铁丝在氧气中剧烈燃烧,火星四射,生成一种黑色固体,故选项说法正确.D 、红磷在空气中燃烧,产生大量的白烟,而不是白色烟雾,故选项说法错误.故选:C .例3:单质碳和部分碳的化合物间转化关系如图所示。
(1)物质X 可能为(填序号)__③__。
①氧气 ②水 ③碳酸(2)若X 为CaCO 3,写出图中物质转化的化学方程式①CO →CO 2:__ ;②CaCO 3→CO 2:__ _或__ _。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质之间的相互转化
主讲:黄冈中学化学高级教师王学兵
考点解读
一、物质之间的相互转化图
二、物质之间的转化反应
(一)化合反应:A+B+…=C
特点:1、没有单质生成。
2、若反应物有单质参加,元素化合价改变,反之不变。
常见类型:
1、金属+氧气→金属氧化物
2、金属氧化物+水→碱
条件:生成的碱要可溶
3、非金属+氧气→酸性氧化物
条件:用该方法生成的酸性氧化物只有:CO2、SO2、P2O5 4、非金属氧化物+水→酸(酸根中含氧元素)
条件:SiO2不发生该类反应。
5、金属+非金属(O2外)→盐(不含氧元素)
条件:Cl2化学性质强与氧气。
(二)分解反应:C=A+B+…
特点:1、可能有单质生成。
2、若生成物中有单质,元素化合价变,反之不变。
常见类型:
1、含氧酸盐→碱性氧化物+酸性氧化物
条件:参加反应的盐必须为难溶的CO32-。
2、含氧酸→酸性氧化物+水
条件:酸为碳酸等不稳定性酸。
(三)置换反应:A+BC==AC+B
特点:1、一定有单质生成。
2、元素的化合价反应前后一定改变。
常见类型:
1、金属氧化物+H2<或C>金属+H2O<或CO2↑>
2、金属+酸→盐+氢气
条件:a.金属的活动性强于氢
b.酸为非氧化性酸<浓硫酸、浓稀硝酸>
3、金属+盐→盐+金属
条件:a.参加反应的金属活动性强于盐中金属
b.参加反应的盐必须可溶
c.参加反应的金属不为K、Ca、Na
※单质铁发生置换反应只生成亚铁盐<Fe2+>
(四)复分解反应:AB+CD==AD+CB
特点:1、一定无单质生成。
2、元素的化合价反应前后不变。
常见类型:
反应物生成物反应物满足的条件生成物满足的条件
1、酸+碱性氧化物盐和水满足条件沉淀<↓>
2、酸+盐盐和酸满足条件或
3、酸+碱盐和水满足条件气体<↑>
4、碱+盐盐和碱两物可溶或
5、盐+盐盐和盐两物可溶水(难电离的物质)<H2O>
(五)其它反应<不属于基本反应类型>
1、非金属氧化物+碱→盐+水
条件:参加反应的碱必须可溶。
规律:反应前后元素化合价不变。
2、CO+金属氧化物→金属+CO2
条件:金属活动性顺序表中铝以前的金属氧化物不发生该反应。
3、C x H y+O2CO2+H2O
4、C x H y O z+O2CO2+H2O
典例解析
例1、下列各组中的物质相互转化时,均能通过一步反应实现的是()A.KCl KNO3B.C CO2
C.Cu(OH)2Cu D.KOH K2SO4
解析:
本题考查了各类物质的化学性质。
答题时须明确题目要求:相互转化时,均能通过一步反应实现。
A中KCl可一步转化为KNO3(KCl+AgNO3=AgCl↓+KNO3),
但KNO3不能一步转化为KCl;B中C可一步转化为CO2(C+ O2CO2),CO2也能一步转化为C;C中Cu(OH)2不能一步转化为铜,铜也不能一步转化为Cu(OH)2;D 中KOH和H2SO4反应可一步转化为K2SO4,K2SO4和Ba(OH)2反应也可一步转化为KOH。
答案:BD
例2、下图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。
下面四组选项中,符合下图要求的是()
乙丙丁
甲
A H2SO4Na2SO4NaOH NaCl
B KCl K2CO3KOH HCl
C O2CO CuO C
D Fe CuCl2Zn HCl
解析:
该题要求学生对元素化合物的转化关系要相当熟悉,同时要善于抓住题中叙述的关键信息,通过分析、类比,寻找解题的途径。
由图中相连的物质间在一定条件下可以反应,丁在一定条件下可以转化为乙等信息,将A、B排除,C、D符合题意。
答案:CD
例3、将铁片分别放入下列溶液中充分反应后,溶液质量比以前减轻的是()A.稀硫酸B.稀盐酸
C.硫酸铜溶液D.氯化亚铁溶液
解析:
铁片放入稀硫酸、稀盐酸中发生下列反应:
Fe + H2SO4=FeSO4+ H2↑
Fe+2HCl= FeCl2+H2↑
每生成2g氢气,同时有56g铁变成亚铁离子进入溶液,所以溶液质量增加了。
铁与硫酸铜溶液发生了如下反应:
Fe+CuSO4=FeSO4+Cu
每析出64g铜,同时有56g铁变成亚铁离子进入溶液,结果溶液质量减轻。
铁与氯化亚铁溶液不反应。
答案:C
例4、下列物质不能由金属与酸反应直接制得的是()
A.AlCl3B.ZnCl2
C.FeCl3D.CuCl2
解析:
考查置换反应的判断,利用活泼金属与相应的酸之间的反应可以得到相应的盐,所以A、B正确,从金属的活动性来看,铁也是活泼金属,可是铁参加置换反应,只能生成+2价的生成物。
答案:CD
例5、在一定条件下,与NaOH溶液、BaCl2溶液、Fe2O3、Zn、Na2CO3五种物质均能发生反应的是()
A.硝酸铜B.稀盐酸
C.稀硫酸D.二氧化碳
解析:
通过物质的性质来考查物质之间的相互关系,从而判断出C正确。
答案:C
例6、铁、氯化铜、石灰水、稀盐酸、石灰石之间的反应关系如图所示,图中两圆相交部分(a、b、c、d)表示物质间反应的类型或主要实验现象。
下列说法中错误的是()
A.a处产生白色物质B.b处生成蓝色沉淀
C.c处发生复分解反应D.d处产生气泡
解析:
主要判断物质间发生反应的现象。
a处因为是铁与氯化铜的反应,应该有固体出现,b处生成氢氧化铜蓝色沉淀,c处酸碱之间发生中和反应,d处产生会产生二氧化碳,所以A错误。
答案:A。
