高中化学物质的量浓度的练习题
高中化学 物质的量浓度计算练习题

物质的量浓度计算一、选择题(每小题有一个或两个正确选项符合题意)1、标准状况下,a L HCl气体溶于1000g水中,得到的盐酸的密度为bg·cm—3,则该盐酸的物质的量浓度为A、a / 22.4摩·升—1B、ab / 22.4摩·升—1C、ab / (22400 + 36.5a )摩·升—1D、1000ab / (22400 + 36.5a )摩·升—12、 100毫升0.3摩·升—1的硫酸钠溶液和50毫升0.2摩·升—1的硫酸铝溶液混合后,溶液中硫酸根的物质的量浓度为A、0.20摩·升—1B、0.25摩·升—1C、0.40摩·升—1D、0.50摩·升—13、密度为d g·cm—3的溶液V毫升,含有式量为M的溶质mg,其物质的量浓度为c摩·升—1,质量分数为W%,下列表示式不正确的是A、c = 1000m / VMB、m=dV W/100C、d= cM/10WD、W%= (cM/1000d)%4、 VmLAl2(SO4)3溶液中含有a g Al3+,取出V/4 mL溶液,加水稀释到4V mL,则稀释后溶液中SO42—的物质的量浓度为A、125 a / 9V摩·升—1B、125 a / 18V摩·升—1C、125 a / 36V摩·升—1D、125 a / 54V摩·升—15、 0.5L 1摩·升—1FeCl3溶液与0.2 L 1摩·升—1的KC1溶液中,Cl—的浓度比为A、15:2B、1:1C、3:1D、1:36、有一未知浓度的硫酸溶液25mL,在加入0.5摩·升—1的Ba (NO3)2溶液25mL后,改加NaOH 溶液,结果用去1.0摩·升—1NaOH溶液50mL恰好完全反应,则硫酸的物质的量浓度为A、0.5摩·升—1B、1.0摩·升—1C、1.5摩·升—1D、2.0摩·升—17、实验室里需用480mL0.1摩·升—1的硫酸铜溶液,现选取容量瓶进行配制,以下操作正确的是A、称取7.68g无水硫酸铜,加入500毫升水B、称取12.0g胆矾配成500毫升溶液C、称取8.0g无水硫酸铜,加入500毫升水D、称取12.5g胆矾配成500毫升溶液8、已知25%的氨水的密度为0.91 g·cm—3,5%氨水的密度为0.98 g·cm—3,若将上述两溶液等体积混合,所得氨水的溶液的质量分数为A、等于15%B、大于15%C、小于15%D、无法确定二、填空题9、某温度下,22%的硝酸钠溶液150毫升,加100克水稀释后浓度为14%,原溶液的物质的量浓度为_________ 。
高中化学必修一一定物质的量浓度溶液的配置专题练习提
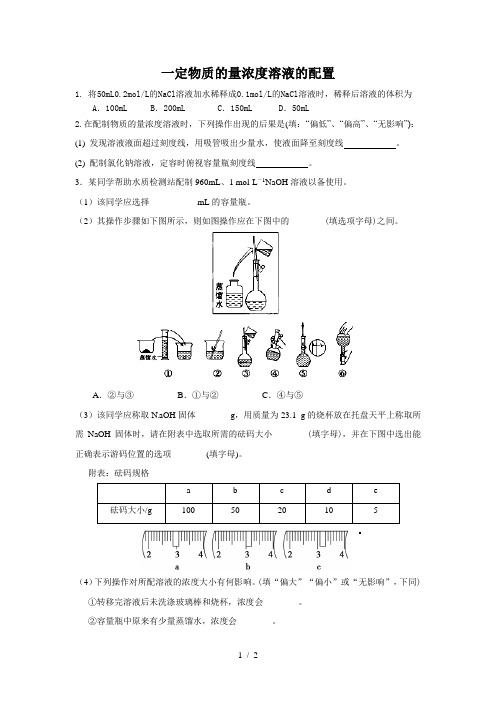
一定物质的量浓度溶液的配置1. 将50mL0.2mol/L的NaCl溶液加水稀释成0.1mol/L的NaCl溶液时,稀释后溶液的体积为A.100mL B.200mL C.150mL D.50mL2.在配制物质的量浓度溶液时,下列操作出现的后果是(填:“偏低”、“偏高”、“无影响”):(1)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。
(2) 配制氯化钠溶液,定容时俯视容量瓶刻度线。
3.某同学帮助水质检测站配制960mL、1 mol·L-1NaOH溶液以备使用。
(1)该同学应选择___________mL的容量瓶。
(2)其操作步骤如下图所示,则如图操作应在下图中的________(填选项字母)之间。
A.②与③B.①与②C.④与⑤(3)该同学应称取N aOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表:砝码规格a b c d e砝码大小/g 100 50 20 10 5(4)下列操作对所配溶液的浓度大小有何影响。
(填“偏大”“偏小”或“无影响”,下同)①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________。
②容量瓶中原来有少量蒸馏水,浓度会________。
③定容摇匀后发现溶液凹面低于刻度线,再补加少量蒸馏水至刻度线,浓度会________。
(5)实际操作过程中,由_____________________________________,会使配置的NaOH溶液的浓度比1 mol·L-1 ____________(填“大”或“小”)。
4.实验室用固体烧碱配制0.1 mol L−1的NaOH溶液500 mL,回答下列问题:(1)计算需要NaOH固体的质量g。
(2)有以下仪器和用品:①烧杯②药匙③250 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平。
高中化学必修一 物质的量浓度 练习解析版)

2.3.3 物质的量浓度练习(解析版)1.下列溶液中,Cl﹣的物质的量浓度最小的是()A.1 L 1 mol•L﹣1的NaCl溶液B.0.1 L 2 mol•L﹣1的KCl溶液C.0.1 L 1 mol•L﹣1的MgCl2溶液D.10 mL 1 mol•L﹣1的AlCl3溶液【答案】A【详解】A. 1 L 1 mol•L﹣1的NaCl溶液中,c(Cl-):c(NaCl)=1:1,则c(Cl-)为1mol/L;B. 0.1 L 2 mol•L﹣1的KCl溶液中,c(Cl-):c(KCl)=1:1,则c(Cl-)为2mol/L;C. 0.1 L 1 mol•L﹣1的MgCl2溶液中,c(Cl-):c(MgCl2)=2:1,则c(Cl-)为2mol/L;D. 10 mL 1 mol•L﹣1的AlCl3溶液中,c(Cl-):c(AlCl3)=3:1,则c(Cl-)为3mol/L;总上所述,氯离子浓度最小的为1mol/L,答案为A。
2.下列各溶液中n(Na+)与100 mL 0.1 mol/L Na2SO4溶液中n(Na+)相同的是A.100 mL 0.1 mol/L NaCl 溶液B.50 mL 0.2 mol/L NaNO3溶液C.100 mL 0.1 mol/L NaHSO4溶液D.200mL 0.2mol/L HCl溶液与100 mL 0.2 mol/L NaHCO3溶液混合【答案】D【详解】100 mL 0.1 mol/L Na2SO4溶液中n(Na+)=0.1 mol/L×100 mL×2=0.02mol。
A.100 mL 0.1 mol/L NaCl溶液中n(Na+) = 0.1 mol/L×100 mL×1=0.01mol。
B.50 mL 0.2 mol/L NaNO3溶液中n(Na+) = 0.2 mol/L×50 mL×1=0.01mol。
高中化学第2讲 物质的量浓度(练)解析版

第2讲物质的量浓度【练基础】1.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是()A.容量瓶用蒸馏水洗净后,必须干燥才能用于配制溶液B.配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量NaCl固体时药品砝码左右位置颠倒,对实验结果无影响C.配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高D.用浓盐酸配制稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高【答案】D【解析】配制溶液时需加水定容,所以容量瓶用蒸馏水洗净后,不需要干燥就能用于配制溶液,A错误;配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量NaCl固体时药品砝码左右位置颠倒,称取食盐的质量偏小,配制溶液的浓度偏低,B错误;配制一定物质的量浓度的溶液时,定容时仰视刻度线,溶液体积偏大,导致所配溶液浓度偏低,C错误;用浓盐酸配制稀盐酸,量取浓盐酸时仰视量筒的刻度线,量取浓盐酸体积偏大,会导致所配溶液浓度偏高,D正确。
2.配制100 mL 1.0 mol·L-1Na2CO3溶液,下列操作正确的是()A.称取10.6 g无水碳酸钠,置于100 mL容量瓶中,加水溶解、定容B.称取10.6 g无水碳酸钠置于烧杯中,加入100 mL蒸馏水,搅拌、溶解C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中D.定容后,塞好瓶塞,反复倒转、摇匀【答案】D【解析】固体不能直接在容量瓶中溶解,A项错误;配制100 mL 1.0 mol·L-1Na2CO3溶液,所用水的体积并不是100 mL,而是加水至100 mL,B项错误;转移液体时,要用玻璃棒引流,C项错误;定容后,塞好瓶塞,要进行摇匀操作,D项正确。
3.用已准确称量的氢氧化钠固体配制0.20 mol·L-1的氢氧化钠溶液250 mL,需要用到的仪器是()①250 mL容量瓶①托盘天平①烧瓶①胶头滴管①烧杯①玻璃棒①试管①药匙A.①①①①B.①①①①C.①①①①①①D.全部【答案】A【解析】用已准确称量的NaOH固体配制0.20 mol·L-1的NaOH溶液250 mL,需要用到的仪器是①①①①,故选A。
高中化学一定物质的量浓度溶液的配制习题(精选)

高中化学一定物质的量浓度溶液的配制习题(精选)1.在容量瓶上无需标记的是()A.温度B.浓度C.刻度线D.容积解析:选B容量瓶上标识着温度、容积、刻度线。
2.实验室配制1 mol·L-1盐酸250 mL,下列不需用的仪器是()A.250 mL容量瓶B.托盘天平C.胶头滴管D.烧杯解析:选B配制250 mL的盐酸溶液,需要使用250 mL的容量瓶、量筒、烧杯、玻璃棒、胶头滴管等。
3.使用胆矾(CuSO4·5H2O)配制0.1 mol·L-1硫酸铜溶液,正确的操作是()A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水中B.称取胆矾25 g溶解在1 L水中C.将25 g胆矾溶于水,然后将此溶液稀释至1 LD.将16 g胆矾溶于水,然后将此溶液稀释至1 L解析:选C胆矾的化学式为CuSO4·5H2O,由于本身含有结晶水,所以应取样品250 g·mol-1×0.1 mol·L-1×1 L=25 g溶于水,然后将溶液稀释至1 L。
4.实验室中需要配制2 mol·L-1的NaOH溶液950 mL,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是()A.950 mL,76.0 g B.500 mL,80.0 gC.1 000 mL,80.0 g D.1 000 mL,76.0 g解析:选C配制950 mL溶液需选用1 000 mL的容量瓶,所需称取NaOH固体的质量为1 L×2 mol·L-1×40 g·mol-1=80.0 g。
5.精确配制250 mL一定物质的量浓度的NaOH溶液,下列实验操作正确的是()A.选择仪器时,使用500 mL容量瓶B.将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解C.在烧杯中溶解氢氧化钠后,立即将所得溶液注入容量瓶中D.将烧杯中的氢氧化钠溶液注入未经干燥的洁净容量瓶中解析:选D A项,容量瓶的规格应与所配制溶液的体积相一致,若要求配制的溶液体积和容量瓶容量不相等,应选择容积略大于要求配制的溶液体积的容量瓶。
高中化学---物质的量浓度例题及解答

课时作业7 物质的量浓度时间:45分钟 满分:100分一、选择题(15×4分=60分)1.一定温度下,某物质在水中的溶解度为S ,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是( )①溶液中溶质的摩尔质量 ②溶液中溶质和溶剂的质量比 ③溶液的密度 ④溶液的体积 A .①② B .②③ C .①③ D .②④ 【解析】 由于该溶液是饱和溶液,当其溶解度已知时,也就是饱和溶液中该溶质的质量分数已知,根据物质的量浓度与质量分数的换算关系c =1000×ρ×S100+SM ,所以至少需要知道该饱和溶液的密度和溶质的摩尔质量。
【答案】 C2.用98%的浓H 2SO 4(密度为1.84 g·cm -3)配制1 mol·L -1的稀H 2SO 4100 mL ,配制过程中需用仪器的先后顺序排列是( )①100 mL 量筒 ②10 mL 量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒 A .①③⑤⑥⑦ B .②③⑦⑤⑥ C .②⑤⑦⑥① D .④③⑦⑤⑥【解析】 本题主要考查一定物质的量浓度溶液的配制、计算及仪器的选择。
首先计算需浓硫酸的体积:依V mL·1.84 g· cm -3×98%=0.1 L ×1 mol·L -1×98 g· mol -1,得V =101.84<10 mL ,所以选择②10 mL 量筒;然后根据顺序进行解答。
【答案】 B3.将1 mol/L H 2SO 4溶液50 mL 与质量分数为10%的NaOH 溶液50 g 混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是( )A .浅紫色B .黄色C .红色D .橙色【解析】 n (H 2SO 4)=1 mol·L -1×0.05 L =0.05 mol ,n (NaOH)=50 g ×10%40 g·mol -1=0.125 mol ,所以反应时NaOH 过量,溶液显碱性,呈黄色。
高中化学练习-物质的量浓度及其有关计算_word版含解析

(4)该同学实际配制得到的浓度为4.5 mol/L,可能的原因是________. A.量取浓H2SO4时俯视刻度B.容量瓶洗净后未经干燥处理C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作D.定容时仰视刻度线练高考——找规律1.(2013·新课标全国卷Ⅱ)N A为阿伏加德罗常数的值.下列叙述正确的是()A.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2N AB.12 g石墨烯(单层石墨)中含有六元环的个数为0.5N AC.25 ℃时pH=13的NaOH溶液中含有OH-的数目为0.1N AD.1 mol的羟基与1 mol的氢氧根离子所含电子数均为9N A2.(2013·四川卷)1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀.下列说法不正确的是()A.该合金中铜与镁的物质的量之比是2:1B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/LC.NO2和N2O4的混合气体中,NO2的体积分数是80%D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL练模拟——明趋势3.(正定中学月考)下列操作能达到目的的是()A.将58.5 g NaCl溶于1 L水中可得1 mol·L-1的NaCl溶液B.将标准状况下22.4 L HCl溶于1 L水中可得1 mol·L-1盐酸C.将25.0 g胆矾溶于水后配成100 mL溶液,所得溶液的浓度为1 mol·L-1 D.将78 g Na2O2溶于水,配成1 L溶液,其浓度为1 mol·L-14.(黑龙江模考)下列说法正确的是()A.现需480 mL 0.1 mol·L-1硫酸铜溶液,则使用容量瓶配制溶液需要7.68 g 硫酸铜固体B.配制1 mol·L-1 NaOH溶液100 mL,用托盘天平称量4 g NaOH固体放入100 mL容量瓶中溶解C.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并继续煮沸至红褐色D.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度的稀硫酸,将浓硫酸转移至烧杯后需用蒸馏水洗涤量筒,并将洗涤液一并转移至烧杯5.(廊坊期中)下列情况会使所配溶液浓度偏低或其他测量值偏低的是()①用稀醋酸和稀氢氧化钠溶液反应测定中和热;②用滴定管量取液体时,开始时平视读数,结束时俯视读数所得溶液的体积;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④在用标准液(已知浓度)滴定未知溶液时,盛标准液的滴定管水洗后未润洗;⑤定容时,仰视容量瓶的刻度线A.①③⑤B.①②⑤C.②③④D.③④⑤6.(安徽模拟)某乙醇水溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为d g·mL-1,1 kg这种溶液中含有的乙醇是()A.46c g B.c/d mol【…、¥.】【…、¥.】。
高中化学一定物质的量浓度溶液的配制练习题

高中化学一定物质的量浓度溶液的配制练习题1.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。
下列图示对应的操作规范的是( )解析:选B 用托盘天平称量物体的质量时,应“左物右码”,A错误;转移溶液时应使用玻璃棒引流,C错误;定容时胶头滴管不能插入容量瓶内部,D错误。
2.温度计、量筒、滴定管的一部分如图所示,下列读数(虚线所指刻度)及说法正确的是( )A.①是量筒,读数为2.5 mLB.②是量筒,读数为2.50 mLC.③是滴定管,读数为2.5 mLD.①是温度计,读数为2.5 ℃解析:选D 量筒上没有0刻度,A错误;量筒读数时保留一位小数,B错误;滴定管读数时应保留两位小数,C错误;温度计的0刻度上下都有数据,D正确。
3.欲配制500 mL 2 mol·L-1的盐酸,需要36.5%的浓盐酸(密度约为1.2 g·cm-3)的体积为( )A.27.4 mL B.83.3 mLC.120 mL D.无法计算解析:选B溶液稀释时溶液的物质的量不变,0.500 L×2 mol·L-1=V×1.2 g·cm-3×36.5%,V=83.3 mL。
36.5 g·mol-14.实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )A.100 mL;21.2 g B.500 mL;100.7 gC.1 000 mL;201.4 g D.1 000 mL;212.0 g解析:选D 容量瓶没有950 mL规格,应用1 000 mL的容量瓶进行配制,则:n(Na2CO3)=1 L×2.0 mol·L-1=2 mol,m(Na2CO3)=2 mol×106 g·mol-1=212.0 g。
5.配制250 mL 0.5 mol·L-1的NaOH溶液,在下列仪器中:①量筒、②250 mL容量瓶、③托盘天平和砝码、④500 mL容量瓶、⑤烧杯、⑥玻璃棒、⑦漏斗、⑧药匙、⑨胶头滴管、⑩250 mL烧瓶,需要用到的仪器按使用先后顺序排列正确的是( )A.⑧③⑤⑥②⑨ B.②③⑦⑤⑥C.②⑤⑦⑥① D.④③⑦⑤⑥解析:选A 一定规格的容量瓶只能配制相应体积的溶液,故应选择250 mL容量瓶;用药匙取用试剂,用托盘天平称量一定质量的试剂(试剂可放在烧杯中称量)后,在烧杯中溶解(可用量筒量取水),并用玻璃棒搅拌,待溶液冷却后转移到250 mL容量瓶中,转移过程中需用玻璃棒引流,用蒸馏水洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶中,当加水至液面距离刻度线1~2 cm时,改用胶头滴管滴加至溶液凹液面恰好与刻度线水平相切,盖好瓶塞,摇匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学物质的量浓度的练习题
1.从1 L物质的量浓度为1 molL-1的氢氧化钠溶液中取出100 mL,下面关于这100 mL溶液的叙述中错误的是( )
A.物质的量浓度为0.1 molL-1
B.物质的量浓度为1 molL-1
C.含氢氧化钠4 g
D.含氢氧化钠0.1 mol
答案 A
解析从一定物质的量浓度的溶液中无论取出溶液多少,其溶质的物质的量浓度、溶质的质量分数、离子浓度都不变,因为溶液属于均匀混合物,但其中所含溶质的量却要发生变化,100 mL NaOH溶液中氢氧化钠的物质的量为0.1 mol,其质量为4 g,所以只有A错误。
2.下列溶液中,溶质的物质的量浓度为1 molL-1的是( )
A.将40 g NaOH溶于1 L水中所得的溶液
B.将22.4 L HCl溶于水配成1 L溶液
C.含K+的物质的量为2 mol的K2SO4溶液1 L
D.将0.5 molL-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
答案 C
解析物质的量浓度的表达式中的体积是溶液的体积而不是溶剂的体积,A 不正确;22.4 L HCl气体的物质的量无法确定,B不正确;将溶液加热蒸发掉50 g 水后溶液的体积无法确定,D不正确。
3.1 molL-1 H2SO4的含义是( )
A.1 L水中含有1 mol H2SO4
B.1 L溶液中含有1 mol H+
C.将98 g H2SO4溶于1 L水中配成溶液
D.指1 L H2SO4溶液中含98 g H2SO4
答案 D
解析根据物质的量浓度的定义,以“单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度”来看,A的说法错误,主要是1 L水不对,应是1 L溶液;B中溶液的体积为1 L时含有2 mol H+,B错误;因为1 mol H2SO4溶于1 L水后溶液的体积不清楚,故溶质的物质的量浓度也说不清楚;D正确,因为硫酸的相对分子质量为98,故1 L溶液中含1 mol H2SO4,其物质的量浓度为1 molL-1。
4.在10 mL 2.4 molL-1的NaOH溶液中加入50 mL水,下列说法正确的是( )
A.稀释后溶液的浓度是0.4 molL-1
B.稀释后溶液的体积是60 L
C.稀释后溶液的浓度为0.33 molL-1
D.以上答案均不正确
答案 D
解析稀释后体积不等于溶液和水的体积之和,稀释后溶液体积不知道。
5.1.0 molL-1的Na2SO4溶液是( )
①溶液中含有1 mol Na2SO4的溶液②1 L溶液中含有142 g Na2SO4的溶液③将1 mol Na2SO4溶于1 mol水中所得的溶液④将322 g Na2SO410H2O溶于水后再稀释成1 000 mL的溶液
A.①③
B.②④
C.③④
D.②③
答案 B
解析物质的量浓度表示在单位体积的溶液中所含溶质的物质的量的多少,因此1 molL-1 Na2SO4溶液是指每升溶液中含1 mol Na2SO4,而1 mol Na2SO4
相当于142 g Na2SO4或322 g Na2SO410H2O。
6.实验中需要2 molL-1的Na2CO3溶液950 mL,配制时,你认为应该选用的容量瓶的规格和称取的碳酸钠质量分别是( )
A.1 000 mL,212 g
B.950 mL,201.4 g
C.500 mL,286 g
D.任意规格,572 g
答案 A
解析没有950 mL的容量瓶,所以只能选择1 000 mL,所需Na2CO3的质量为1 L×2 molL-1×106 gmol-1=212 g。
7.将5 molL-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO-3的物质的量浓度为( )
A.5ab molL-1
B.10ab molL-1
C.b5a molL-1
D.ab molL-1
答案 B
解析[NO-3]=5 molL-1×2×a×10-3 Lb×10-3 L=10ab molL-1。
8.将100 mL 0.30 molL-1的Na2SO4溶液和50 mL 0.20 molL-1的Al2(SO4)3溶液混合后,所得溶液中SO2-4的物质的量浓度为( )
A.0.20 molL-1
B.0.25 molL-1
C.0.40 molL-1
D.0.50 molL-1
答案 C
解析混合前后溶液中SO2-4的物质的量不变,据此可以列出等量关系式。
[SO2-4]=100 mL×0.3 molL-1+50 mL×0.20 molL-1×3100 mL+50 mL=0.40 molL-1。
9.为了配制100 mL 1 molL-1的NaOH溶液,有下列几个操作步骤,其中不正确的是( )
①将NaOH放在纸片上进行称量②选用刚用蒸馏水洗涤过的100mL容量瓶配制③NaOH在烧杯中刚刚溶解,立即把溶液移入容量瓶中④用蒸馏水洗涤烧杯、玻璃棒两次,洗涤液都移入容量瓶中⑤使蒸馏水沿着玻璃棒注入容量瓶直至凹液面最低处与刻度线相切
A.①②③④
B.①③⑤
C.②③⑤
D.①④⑤
答案 B
解析因为NaOH易潮解,故称量时不应放在纸片上,应放在小烧杯中称量,故①错;往容量瓶中转移溶液之前应冷却至室温,故③错;定容时向容量瓶中直接加水至离刻度线1~2 cm时,改用胶头滴管向容量瓶中加水,直至凹液面恰好和刻度线相切为止,故⑤错。
10.在标准状况下,将a L HCl(气)溶于1 000 g水中,得到的盐酸的密度为b gmL-1,则该盐酸的物质的量浓度是( )
A.a22.4 molL-1
B.ab22 400 molL-1
C.ab22 400+36.5a molL-1
D.1 000ab22 400+36.5a molL-1
答案 D
解析n(HCl)=a L22.4 Lmol-1,
V(HCl溶液)=a L22.4 Lmol-1×36.5 gmol-1+1 000 gb gmL-1×10-3 LmL-1,
c(B)= molL-1。
故正确答案为D。
11.判断下列说法是否正确。
(1)从1 L 1 molL-1的NaCl溶液中取出100 mL溶液,其物质的量浓度为0.01 molL-1。
()
(2)将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 molL-1。
( )
(3)1 L 1 molL-1的NaCl溶液和1 L 1 molL-1的蔗糖溶液,所含溶质的物质的量相等。
()
(4)1 molL-1 Na2SO4溶液中含有1 mol Na2SO4。
( )
(5)0.2 molL-1的Ba(NO3)2溶液中NO-3的浓度为0.2 molL-1。
( )
(6)配制一定物质的量浓度的溶液时,所用容量瓶未干燥则导致所配溶液浓度偏低。
()
答案(1)×(2)×(3)√(4)×(5)× (6)×
12.实验室中需要配制500 mL 0.10 molL-1的NaOH溶液,据此实验回答下列问题。
(1)用天平称量NaOH固体________ g。
称量NaOH固体需注意以下两个问题:
①因为NaOH具有腐蚀性,所以称量时,需注意选择________盛装NaOH固体;
②称量必须迅速,原因是_____________________________________________________________________ ___
_____________________________________________________________________ ___。
(2)实验所需要的仪器有容量瓶(规格是________),还有
_____________________________________________________________________ ___。
(3)下列操作对所配制的溶液的浓度没有影响的是( )
A.称量时已观察到NaOH吸水
B.将烧杯中溶解后的溶液迅速注入容量瓶,然后再滴加蒸馏水至刻度线
C.摇匀定容时,用胶头滴管向容量瓶中滴加蒸馏水至刻度线
D.配制溶液前用蒸馏水润洗容量瓶
答案(1)2.0①(小)烧杯②防止称量时间过长,NaOH固体吸水(2)500 mL烧杯、量筒、玻璃棒、胶头滴管、天平、药匙(3)D
13.病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示,利用标签所提供的信息,回答下列问题。
[已知:M(C6H12O6)=180 gmol-1]
5%葡萄糖注射液(500 mL)
性状:本品为无色或几乎无色的透明液体,味甜。
规格:500 mL,25 g
贮藏:密闭保存。
(1)该注射液中葡萄糖的质量分数为________________;
(2)该注射液中葡萄糖的物质的量浓度为________(保留两位有效数字)。
答案(1)5%(2)0.28 molL-1
解析由标签可知5%为葡萄糖的质量分数,由规格可计算物质的量浓度:[C6H12O6]= ≈0.28 molL-1。
