杂化轨道类型试题(2010—2014)
经典杂化试题归纳

(1)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤电子对.①当中心原子无孤电子对时,两者的构型一致;②当中心原子有孤电子对时,两者的构型不一致.(2)当原子成键时,形成与原轨道数相等且能量相同的杂化轨道.杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同.(3)运用价层电子对互斥模型可预测分子或离子的立体结构,但要注意判断其价层电子对数,对AB m型分子或离子,其价层电子对数的判断方法为:n=[例2](2010·海南高考)下列描述中正确的是()A.CS2为Ⅴ形的极性分子B.ClO-3的空间构型为平面三角形C.SF6中有6对完全相同的成键电子对D.SiF4和SO2-3的中心原子均为sp3杂化[名师精析]由价层电子对互斥模型可知,CS2中C原子价电子都用于形成共价键,分子为直线形,为非极性分子;ClO-3中Cl原子含有一对孤对电子,分子为三角锥形;SF6中含有6个S—F 键,完全相同;SiF4和SO2-3的中心原子都含有四对电子对,采用sp3杂化1.在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是A.sp,范德华力B.sp2,范德华力C.sp2,氢键D.sp3,氢键答案:C3. 已知和碳元素同主族的X元素位于周期表中的第1个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4。
试回答:(1)X元素的原子基态时电子排布式为;Y元素原子最外层电子的电子排布图为。
(2)若X、Y两元素电负性分别为2.1和2.85,则XY4中X与Y之间的化学键为(填“共价键”或“离子键”)。
(3)该化合物的立体构型为,中心原子的杂化类型为,分子为(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该化合物中分子间作用力是。
课时作业17:2.2.2 杂化轨道理论

第2课时杂化轨道理论题组一原子轨道杂化与杂化轨道1.下列有关杂化轨道的说法不正确的是()A.杂化前后的轨道数不变,但轨道的形状发生了改变B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°C.四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释D.杂化轨道全部参与形成化学键【考点】杂化轨道理论【题点】杂化轨道理论的理解答案 D解析杂化轨道用于形成σ键和容纳孤电子对。
2.(2018·福建厦门月考)如图是乙烯分子的模型,对乙烯分子中的化学键分析正确的是()A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C.C、H之间是sp2杂化轨道形成的σ键,C、C之间是未能参加杂化的2p轨道形成的π键D.C、C之间是sp2杂化轨道形成的σ键,C、H之间是未能参加杂化的2p轨道形成的π键【考点】杂化轨道理论【题点】杂化轨道理论的理解答案 A解析乙烯分子中存在4个C—H键和1个C==C键,C原子上孤电子对数为0,σ键电子对数为3,则C原子采取sp2杂化,C、H之间是sp2杂化轨道形成的σ键,C、C之间有1个是sp2杂化轨道形成的σ键,还有1个是未参加杂化的2p轨道形成的π键。
3.下列关于原子轨道的说法正确的是()A.杂化轨道形成共价键时,只能形成σ键不能形成π键B.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键C.凡是中心原子采取sp3杂化轨道成键的分子,其立体构型都是正四面体形D.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的【考点】杂化轨道理论【题点】杂化轨道理论的理解答案 A解析中心原子采取sp3杂化,轨道形状可能是正四面体,如果中心原子还有孤电子对,分子的立体构型则不是正四面体;CH4分子中的sp3杂化轨道是C原子的一个2s轨道与三个2p 轨道杂化而成的;AB3型的共价化合物,A原子可能采取sp2杂化或sp3杂化。
课时作业12:2.2.2 杂化轨道理论

第2课时杂化轨道理论1.下列画线的原子的杂化轨道类型属于sp杂化的是()A.H2 O B.NH3C.C6H6D.C2H22.下列分子的空间构型可用sp2杂化轨道来解释的是()①BF3②CH2===CH2③④CH CH ⑤NH3⑥CH4A.①②③B.①⑤⑥C.②③④D.③⑤⑥3.三氯化磷分子中的中心原子以sp3杂化,下列有关叙述正确的是()①3个P—Cl键长、键角均相等②空间构型为平面三角形③空间构型为正四面体④空间构型为三角锥形A.①②B.②③C.③④D.①④4.CO2-3中,碳原子的杂化轨道类型和分子构型分别是()A.sp杂化,平面三角形B.sp2杂化,平面三角形C.sp2杂化,三角锥形D.sp3杂化,三角锥形5.下列描述中正确的是()①CS2的分子为V形②ClO-3的立体构型为平面三角形③SF6中有6对完全相同的成键电子对④SiF4和SO2-3的中心原子均为sp3杂化A.①②B.②③C.③④D.①④6.关于原子轨道的说法正确的是()A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相同的新轨道D.凡AB3的共价化合物,其中心原子A均采用sp3杂化轨道成键7.氨气分子的立体构型是三角锥形,而甲烷是正四面体形,这是因为()A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化B.NH3分子中氮原子形成3个杂化轨道,CH4分子中碳原子形成4个杂化轨道C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强D.氨气分子是四原子化合物,甲烷为五原子化合物8.下列分子中,中心原子采取sp3杂化并形成正四面体空间构型的是()①CH4②NH3③CF4④SiH4⑤C2H4⑥CO2 ⑦CH2Cl2A.①②③⑥B.①③④C.②④⑤⑦D.①③⑤9.在乙烯分子中有5个σ键、1个π键,它们分别是()A.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的σ键D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键10.在中,中间的碳原子和两边的碳原子分别采用的杂化方式是() A.sp2、sp2B.sp3、sp3C.sp2、sp3D.sp1、sp311.(1)BF3分子的立体结构为________,NF3分子的立体结构为________。
高中化学 2.2.2 杂化轨道理论与配合物理论简介同步检测试题 新人教版选修3

杂化轨道理论与配合物理论简介1.能正确表示CH4中碳原子成键方式的示意图为( )解析:碳原子中的2s轨道与2p轨道形成4个等性杂化轨道,因此碳原子最外层上的4个电子分占在4个sp3杂化轨道并且自旋状态相同。
答案:D2.有关乙炔分子中的化学键描述不正确的是( )A.两个碳原子采用sp杂化方式B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未杂化的2p轨道形成π键D.两个碳原子形成两个π键解析:C2H2中心碳原子以1个s轨道和1个p轨道形成sp杂化轨道,故乙炔分子中两个碳原子采用sp杂化方式,且每个碳原子以2个未杂化的2p轨道形成2个π键构成碳碳三键。
答案:B3.关于原子轨道的说法正确的是( )A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形B.CH4分子中的sp3杂化轨道是由4个氢原子的1s 轨道和碳原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键解析:中心原子采取sp3杂化,四个sp3杂化轨道在空间的形状是正四面体形,但如果中心原子还有孤电子对,分子的立体构型不是正四面体形。
CH4分子中的sp3杂化轨道是碳原子的一个2s轨道与三个2p轨道杂化而成的。
AB3型的共价化合物,A原子可能采取sp2杂化或sp3杂化。
答案:C4.向盛有少量CuCl2溶液的试管中滴入少量NaOH溶液,再滴入适量浓氨水,下列叙述不正确的是( )A.开始生成蓝色沉淀,加入过量氨水时,形成无色溶液B.Cu(OH)2溶于浓氨水的离子方程式是Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-C.开始生成蓝色沉淀,加入氨水后,沉淀溶解形成深蓝色溶液D.开始生成Cu(OH)2,之后生成更稳定的配合物解析:向CuCl2溶液中加入少量NaOH溶液,发生反应Cu2++2OH-Cu(OH)2↓,Cu(OH)2沉淀为蓝色,再加入适量浓氨水,发生反应Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-,形成深蓝色溶液,故A错误。
课时作业7:2.2.2 杂化轨道理论

训练4杂化轨道理论[经典基础题]一、原子轨道杂化与杂化轨道1.下列关于价层电子对互斥理论及杂化轨道理论的叙述不正确的是()A.价层电子对互斥理论将分子分成两类:中心原子有孤电子对的和无孤电子对的B.价层电子对互斥理论既适用于单质分子,也适用于化合物分子C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道通过杂化形成的一组能量相近的新轨道D.AB2型共价化合物的中心原子A采取的杂化方式可能不同2.下列关于杂化轨道的叙述正确的是()A.杂化轨道可用于形成σ键,也可用于形成π键B.杂化轨道可用来容纳未参与成键的孤电子对C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H原子的1个s轨道杂化而成的D.在乙烯分子中1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—H σ键二、杂化轨道类型及其判断3.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF-4,则BF3和BF-4中B的原子的杂化轨道类型分别是()A.sp2、sp2B.sp3、sp3C.sp2、sp3D.sp、sp24.在BrCH===CHBr分子中,C—Br键采用的成键轨道是()A.sp-p B.sp2-sC.sp2-p D.sp3-p5.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是()三、杂化轨道类型与分子构型6.下列对于NH 3和CO 2的说法中正确的是( )A .都是直线形结构B .中心原子都采取sp 杂化C .NH 3为三角锥形结构,CO 2为直线形结构D .N 原子和C 原子上都没有孤对电子7.下列推断正确的是( )A .BF 3为三角锥形分子B .NH +4的电子式为,离子呈平面正方形结构C .CH 4分子中的4个C —H 键都是氢原子的1s 轨道与碳原子的2p 轨道形成的sp σ键D .甲醛分子为平面三角形,有一个π键垂直于三角形平面8.甲烷分子(CH 4)失去一个H +,形成甲基阴离子(CH -3),在这个过程中,下列描述不合理的是( )A .碳原子的杂化类型发生了改变B .微粒的形状发生了改变C .微粒的稳定性发生了改变D .微粒中的键角发生了改变9.有机物C ·H 3C ·H===CH —C ·≡CH 中标有“·”的碳原子的杂化方式依次为( ) A .sp 、sp 2、sp 3B .sp 2、sp 、sp 3C .sp 3、sp 2、spD .sp 3、sp 、sp 2[能力提升题]10.如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:(1)甲醛分子中碳原子的杂化方式是__________,作出该判断的主要理由是________________________________________________________________________。
化学键的杂化轨道的练习题

化学键的杂化轨道的练习题化学键的形成是通过原子之间的电子重叠而实现的。
杂化轨道是描述共价化合物中形成的化学键的一个重要概念。
下面是一些关于化学键的杂化轨道的练习题,帮助加深对于这一概念的理解。
练习题1:
以H2O为例,描述其化学键的杂化轨道的形成过程。
练习题2:
选择以下化合物,判断并描述其键的杂化轨道类型:CO2, CH4, NH3, C2H4。
练习题3:
描述一下杂化轨道的形成对于分子形状和键角的影响。
以CH4和NH3为例说明。
练习题4:
分析以下化学式,确定其中原子的杂化轨道并描述键的形成过程:H2CO, C2H2, HCN。
练习题5:
分别用sp, sp2, sp3杂化轨道解释以下分子的形状:BF3, CH2O,
C2H4。
练习题6:
以NH3为例,解释杂化轨道如何影响分子中氮原子的杂化轨道及其键角。
练习题7:
比较CO2和H2O的分子结构及其键角差异,解释其中杂化轨道的差异对于这些性质的影响。
练习题8:
以C2H4为例,描述其化学键的杂化轨道及分子形状的形成过程。
练习题9:
选择以下化合物,解释其分子形状及杂化轨道的类型:SF6, H2O2, SO3。
练习题10:
描述杂化轨道理论的意义和应用。
以上是关于化学键的杂化轨道练习题。
通过解答这些问题,可以进一步加深对于杂化轨道及其在化学键中的应用的理解。
课时作业1:2.2.2 杂化轨道理论

第2课时杂化轨道理论题组一杂化轨道的理解1.下列关于杂化轨道的说法中,错误的是()A.ⅠA族元素成键时不可能有杂化轨道B.杂化轨道既可能形成σ键,也可能形成π键C.s轨道和p轨道杂化不可能有sp4杂化轨道出现D.孤电子对有可能参加杂化答案 B解析ⅠA族元素如果是碱金属,易失电子,如果是H,一个电子在1s能级上,不可能杂化;杂化轨道只能形成σ键,不可能形成π键;p能级只有3个p轨道,不可能有sp4杂化。
2.下列关于原子轨道的说法正确的是()A.凡中心原子采取sp3杂化轨道成键的分子其空间结构都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键答案 C解析中心原子采取sp3杂化的分子,VSEPR模型是四面体,但其空间结构不一定是四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V形,NH3是三角锥形,故A错误;CH4中sp3杂化轨道是由中心碳原子的能量相近的一个2s轨道和3个2p轨道杂化形成,1s 轨道和2p轨道的能量差别较大,不能形成杂化轨道,故B错误;同一个原子中能量相近的s 轨道和p轨道通过杂化可混合起来形成一组能量相同的新轨道,杂化轨道数=孤电子对数+与之相连的原子数,故C正确;BF3中B原子的价层电子对数为3,B原子的杂化类型为sp2杂化,故D错误。
3.水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。
下列对上述过程的描述不合理的是()A.氧原子的杂化类型发生了改变B.微粒的形状发生了改变C.微粒的化学性质发生了改变D.微粒中的键角发生了改变答案 A解析水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A不合理;水分子为V形,H3O+为三角锥形,则微粒的形状发生了改变,故B合理;因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;水分子为V形,H3O+为三角锥形,微粒中的键角发生了改变,故D合理。
高三化学《杂化轨道》专题练习(含答案解析)

高三化学《杂化轨道》专题练习一、单选题1.已知硼砂的构成为[]24542Na B O (OH)8H O ⋅,其阴离子的结构如图所示。
下列说法错误的是A .硼砂中含有氢键B .硼砂中B 原子均采用2sp 杂化C .硼砂中存在离子键和共价键D .硼砂中存在配位键2.下列分子或离子的中心原子为sp 3杂化,且杂化轨道容纳1对孤电子对的是( ) A .CH 4、NH 3、H 2O B .CO 2、BF 3、SO 23-C .C 2H 4、SO 2、BeCl 2D .NH 3、PCl 3、N 2H 43.如图是催化偶联反应的机理,R—为烷烃基或氢原子。
下列说法正确的是A .催化剂只有[Pd 0]B .第②步反应为氧化还原反应C .中碳的杂化类型有sp 2、sp 3D .偶联反应为:+催化剂−−−−−→HX+4.科学家曾合成出具有独特结构的化合物1和2,发现化合物1经加热后可得到化合物2。
以下关于化合物1和2的说法中,不正确的是A.化合物1和2是同分异构体B.化合物1和2中碳成键(杂化)方式不同C.化合物2较稳定D.化合物1和2中六元环的六个碳原子共面5.正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的()A.正硼酸晶体属于分子晶体B.正硼酸分子的稳定性与氢键无关C.1molH3BO3晶体中含有3mol氢键D.B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连6.富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。
富勒烯(C60)的结构如图,下列说法错误的是A.分子中碳原子轨道的杂化类型为sp2杂化B.1molC60分子中σ键的数目为90N AC .1个C 60分子中含有20个五边形和12个六边形D .C 60分子晶胞是分子密堆积 7.下列说法正确的是( )A .n AB (n 2≥,且n 为整数)型分子中,若中心原子没有孤对电子,则n AB 为空间对称结构,属于非极性分子B .水很稳定是因为水中含有大量的氢键C .2H O 、3NH 、4CH 分子中的O N C 、、分别形成2个、3个、4个键,故O N C 、、分别采取1sp 、2sp 、3sp 杂化D .配合物()244Cu H O SO ⎡⎤⎣⎦中,中心离子是2+Cu ,配体是2-4SO ,配位数是18.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是A .氯化棚液态时能导电而固态时不导电B .氯化硼中心原子采用sp 杂化C .氯化硼分子呈平面三角形,属非极性分子D .其分子立体构型类似NH 39.+3CH 、3CH 、3CH -都是重要的有机反应中间体,有关它们的说法正确的是A .碳原子均采取sp 2杂化,且+3CH 中所有原子均共面B .CH 3-与NH 3、H 3O +互为等电子体,几何构型均为三角锥形C .+3CH 与OH -形成离子化合物D .两个3CH 或一个+3CH 和一个3CH -结合可得到不同化合物10.由EDTA 制备食品铁强化剂Na[FeEDTA]的合成路线如图:3FeCl NaOH下列有关说法正确的是A .Na[FeEDTA]中的Fe 元素的化合价为+2价B .[FeEDTA]-中碳原子的杂化类型为sp 2C .1molEDTA 与盐酸反应时最多消耗2molHClD .EDTA 分子间可通过取代反应形成肽键11.苯胺是染料工业的重要原料,因其毒性强,在环境中对苯胺类化合物应严格控制排放。
电子排布式杂化轨道理论判断分子空间构型练习题(附答案)

电子排布式杂化轨道理论判断分子空间构型练习题一、单选题1.下列不属于共价键成键因素的是( ) A.共用电子对在两原子核之间高概率出现 B.共用的电子必须配对C.成键后体系能量降低,趋于稳定D.两原子体积大小要适中2.关于CS 2、SO 2、NH 3三种物质的说法中正确的是( ) A.CS 2在水中的溶解度很小,是由于其属于极性分子 B.SO 2和NH 3均易溶于水,原因之一是它们都是极性分子 C.CS 2为非极性分子,所以在三种物质中熔、沸点最低 D.NH 3在水中溶解度很大只是由于NH 3分子有极性3.下列说法正确的是( )A.若把H 2S 分子写成H 3S 分子,违背了共价键的饱和性B.H 3O +的存在说明共价键不具有饱和性C.所有共价键都有方向性D.两个原子轨道发生重叠后,电子仅存在于两核之间4.374℃、22.1MPa 以上的超临界水具有很强的溶解有机物的能力,并含有较多的H +和OH -,由此可知超临界水( ) A.显中性,pH 等于7 B.表现出非极性溶剂的特性 C.显酸性,pH 小于7D.表现出极性溶剂的特性5.某物质的实验式为43PtCl 2NH ⋅,其水溶液不导电,加入3AgNO 溶液也不产生沉淀,以强碱处理并没有3NH 放出,则关于此化合物的说法中正确的是( )A. 配合物中中心原子的电荷数和配位数均为6B. 该配合物可能是平面正方形结构C. -Cl 和3NH 分子均与4+Pt 配位D. 配合物中-Cl 与4+Pt 配位,而3NH 分子不配位6.下列说法中正确的是( )A.NO 2、SO 2、BF 3、NCl 3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构B.P 4和CH 4都是正四面体形分子且键角都为109°28′C.4NH +的电子式为,离子呈平面正方形结构D.NH 3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强7.下列关于原子轨道的说法正确的是( )A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键8.X、Y为核电荷数小于18的两种元素,元素X的原子的最外层电子数是次外层电子数的一半,元素Y的原子的最外层电子数与最内层电子数之和等于次外层电子数。
杂化轨道理论 加练

杂化轨道理论1.下列有机物分子中的碳原子既有sp 3杂化又有sp 杂化的是A .CH 3CH=CH 2B .CH 3-C≡CHC .CH 3CH 2OHD .CH≡CH2.下列描述中正确的是A .CS 2分子的立体构型为V 形B .ClO -3的立体构型为平面三角形C .NH 3、CO 、CO 2的中心原子都有孤电子对D .SiF 4和SO 2-3的中心原子均采取sp 3杂化3.由短周期前10号元素组成的物质T 和X 有如图所示的转化。
X 不稳定,易分解。
下列有关说法正确的是A .为使该转化成功进行,Y 可以是酸性KMnO 4溶液B .等物质的量的T 、X 分子中含有π键的数目均为N AC .T 分子中含有p-p π键,该键的特征是轴对称,可旋转D .T 分子的空间结构为三角锥形4.在半导体生产或灭火剂的使用中,会向空气逸散气体,如3NF 、3CHClFCF 、38C F ,它们虽是微量的,有些却是强温室气体,下列推测不正确的是A .38C F 在4CCl 中的溶解度比在水中大B .3CHClFCF 存在手性异构C .熔点:338NF C F D .由价层电子对互斥理论可确定3NF 的VSEPR 构型为四面体,N 原子是3sp 杂化5.氯化亚硫(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
下列关于氯化亚硫分子的VSEPR模型、空间结构和中心原子(S)采取何种杂化方式的说法正确的是A.四面体形、三角锥形、sp3B.平面三角形、平面三角形、sp2C.四面体形、平面三角形、sp3D.四面体形、三角锥形、sp26.(1)指出下列中心原子的杂化轨道类型。
①CO2。
②SiF4。
③BCl3。
④NF3。
⑤N。
⑥N2H4。
(2)ClO-、Cl、Cl、Cl中,Cl原子都是以sp3杂化轨道方式与O原子成键,则ClO-的空间结构是;Cl的空间结构是;Cl的空间结构是;Cl的空间结构是。
7.(双选)下列关于原子轨道的说法不正确的是()A.杂化轨道形成共价键时,只能形成σ键不能形成π键B.AB3型的共价化合物,其中心原子A可采用sp2或sp3杂化轨道成键C.凡是中心原子采取sp3杂化轨道成键的分子,其空间结构都是正四面体形D.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的8.下列有关NCl3分子的叙述正确的是()A.NCl3分子中的N原子采取sp2杂化B.NCl3分子为平面三角形C.NCl3分子中Cl—N—Cl键角小于109°28'D.NCl3分子中含有非极性键9.下表中各粒子对应的空间结构及杂化方式均正确的是()选项粒子空间结构杂化方式A SO3平面三角形S原子采取sp杂化B SO2V形S原子采取sp3杂化C C三角锥形C原子采取sp2杂化D C2H2直线形C原子采取sp杂化10.(双选)化合物A是一种新型锅炉水除氧剂,其结构式如图所示:,下列说法正确的是()A.碳、氮原子的杂化类型相同B.氮原子与碳原子分别为sp3杂化与sp2杂化C.1mol A分子中所含σ键的数目为11N AD.编号为a的氮原子和与其成键的另外三个原子在同一平面内11.已知:①红磷在氯气中燃烧可以生成两种化合物——PCl3和PCl5,氮与氢也可形成两种化合物——NH3和NH5。
高中杂化理论试题及答案

高中杂化理论试题及答案一、选择题1. 杂化轨道理论是用于解释分子的几何构型和键合性质的理论,以下哪个选项不是杂化轨道理论的基本概念?A. sp杂化B. sp2杂化C. sp3杂化D. sp4杂化答案:D2. 在sp3杂化中,碳原子的杂化轨道与未杂化的p轨道之间的角度是多少?A. 90°B. 120°C. 109.5°答案:C3. 下列分子中,哪一个分子的中心原子不发生杂化?A. H2OB. NH3C. CH4D. BF3答案:A4. 根据杂化轨道理论,下列哪个分子具有平面三角形的几何构型?A. BF3B. CH4C. SO2D. NH35. 根据杂化轨道理论,下列哪个分子具有四面体的几何构型?A. BF3B. CH4C. SO2D. NH3答案:B二、填空题6. 一个碳原子通过sp3杂化形成四个等价的杂化轨道,这些杂化轨道与碳原子的未杂化p轨道之间的角度是______。
答案:109.5°7. 在乙烷(C2H6)分子中,每个碳原子都采用______杂化。
8. 根据杂化轨道理论,氨分子(NH3)的中心氮原子采用______杂化。
答案:sp39. 在水分子(H2O)中,氧原子采用______杂化。
答案:sp310. 甲烷分子(CH4)的中心碳原子采用______杂化,形成______个σ键。
答案:sp3;4三、简答题11. 解释为什么在乙炔(C2H2)分子中,碳原子采用sp杂化。
答案:在乙炔分子中,每个碳原子与另一个碳原子形成三键,同时与一个氢原子形成单键。
为了形成三键,碳原子需要一个sp杂化的轨道与另一个碳原子的sp杂化轨道重叠形成σ键,同时需要两个p轨道相互平行重叠形成两个π键。
因此,碳原子采用sp杂化。
12. 描述甲烷分子的几何构型,并解释其形成的原因。
答案:甲烷分子的几何构型是正四面体。
这是因为中心碳原子采用sp3杂化,形成四个等价的sp3杂化轨道,这些轨道与四个氢原子的1s轨道重叠形成四个σ键。
最新全国化学竞赛(初赛)试题与答案

2010年全国化学竞赛(初赛)试题第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk 轰击48Ca 靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db 后发生裂变;5个原子则经q 次α衰变得到281Rg 后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。
请依样画出其他所有八面体构型的异构体。
第2题 (5 分) 最近我国有人报道,将0.1 mol L -1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L -1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu 2+/Cu)和φӨ(S/S 2-)分别为0.345 V 和 -0.476 V ,nFE Ө =RT ln K ,EӨ表示反应的标准电动势,n 为该反应得失电子数。
计算25o C 下硫离子和铜离子反应得到铜的反应平衡常数,写出平衡常数表达式。
2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么?2-3 该报道未提及硫离子与铜离子相遇时溶液的pH 。
现设pH = 6,写出反应的离子方程式。
2-4 请对此实验结果作一简短评论。
第3题 ( 7分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
1930年确定了它的理想化学式。
左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。
3-1 该图给出了晶胞中的所有原子,除“三原子”(中心原子和与其相连的2个原子)外,晶胞的其余原子都是B 12多面体中的1个原子,B 12多面体的其他原子都不在晶胞内,均未画出。
2010年全国化学竞赛(初赛)试题与答案
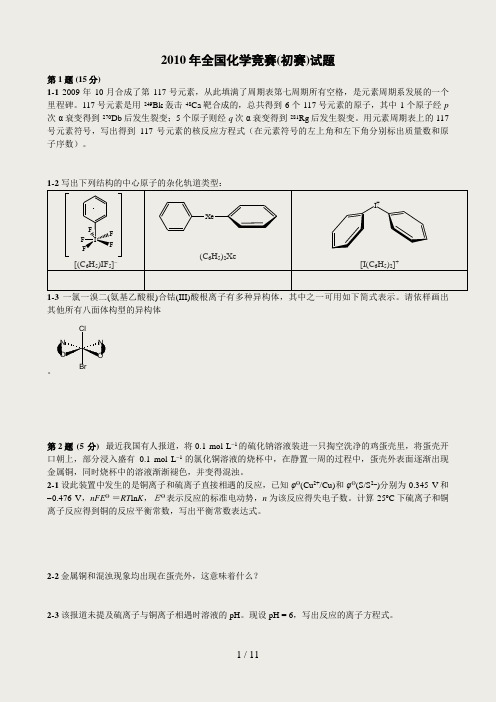
2010年全国化学竞赛(初赛)试题第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk 轰击48Ca 靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db 后发生裂变;5个原子则经q 次α衰变得到281Rg 后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
1-2 写出下列结构的中心原子的杂化轨道类型:F F FFFI[(C 6H 5)IF 5]- Xe(C 6H 5)2XeI +[I(C 6H 5)2]+1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。
请依样画出其他所有八面体构型的异构体。
OOCl BrN N第2题 (5 分) 最近我国有人报道,将0.1 mol L -1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L -1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu 2+/Cu)和φӨ(S/S 2-)分别为0.345 V 和 -0.476 V ,nFE Ө =RT ln K ,EӨ表示反应的标准电动势,n 为该反应得失电子数。
计算25o C 下硫离子和铜离子反应得到铜的反应平衡常数,写出平衡常数表达式。
2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么?2-3 该报道未提及硫离子与铜离子相遇时溶液的pH 。
现设pH = 6,写出反应的离子方程式。
2-4请对此实验结果作一简短评论。
第3题 ( 7分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
2.2.2 杂化轨道理论(备作业)(含答案)高二化学同步备课系列(新教材人教版选择性必修2)

答卷时应注意事项1、拿到试卷,要认真仔细的先填好自己的考生信息。
2、拿到试卷不要提笔就写,先大致的浏览一遍,有多少大题,每个大题里有几个小题,有什么题型,哪些容易,哪些难,做到心里有底;3、审题,每个题目都要多读几遍,不仅要读大题,还要读小题,不放过每一个字,遇到暂时弄不懂题意的题目,手指点读,多读几遍题目,就能理解题意了;容易混乱的地方也应该多读几遍,比如从小到大,从左到右这样的题;4、每个题目做完了以后,把自己的手从试卷上完全移开,好好的看看有没有被自己的手臂挡住而遗漏的题;试卷第1页和第2页上下衔接的地方一定要注意,仔细看看有没有遗漏的小题;5、中途遇到真的解决不了的难题,注意安排好时间,先把后面会做的做完,再来重新读题,结合平时课堂上所学的知识,解答难题;一定要镇定,不能因此慌了手脚,影响下面的答题;6、卷面要清洁,字迹要清工整,非常重要;7、做完的试卷要检查,这样可以发现刚才可能留下的错误或是可以检查是否有漏题,检查的时候,用手指点读题目,不要管自己的答案,重新分析题意,所有计算题重新计算,判断题重新判断,填空题重新填空,之后把检查的结果与先前做的结果进行对比分析。
亲爱的小朋友,你们好!经过两个月的学习,你们一定有不小的收获吧,用你的自信和智慧,认真答题,相信你一定会闯关成功。
相信你是最棒的!第2章分子结构与性质2.2.2 杂化轨道理论一.选择题(共10小题)1.如图所示,在乙烯分子中有5个s键、1个π键,下列表述正确的是( )sp杂化轨道形成的键,C、C之间是未参加杂化的2p轨道形成的π键A.C、H之间是2sp杂化轨道形成的键,C、H之间是未参加杂化的2p轨道形成的π键B.C、C之间是2sp杂化轨道形成σ键,未杂化的2p轨道形成π键C.2sp杂化轨道形成π键,未杂化的2p轨道形成σ键D.2【答案】C【解析】sp杂化轨道形成的σ键,故A错误;A. C、C之间除未参加杂化的2p轨道形成的π键外,还有2sp杂化轨道形成的σ键,故B错误;B. C、H之间2sp杂化轨道形成σ键,未杂化的2p轨道形成π键,故C正确;C. 2sp杂化轨道形成σ键,未杂化的2p轨道形成π键,故D错误;D. 2故选C。
杂化轨道理论——试题

杂化轨道理论【单选题】下列分子中,两个相邻共价键的夹角最小的是•A、BF3••B、CCl4••C、NH3••D、H2O•正确答案:D2【单选题】NCl3分子中,N原子与三个氯原子成键所采用的轨道•A、两个sp轨道,一个p轨道成键••B、三个sp3轨道成键••C、p x、P y 、P z 轨道成键••D、三个sp2轨道成键•正确答案:B3【判断题】CH4分子中,C原子采取sp3等性杂化,在CH3Cl分子中,C原子采取的是sp3不等性杂化。
正确答案:×4【判断题】当分子的中心原子以sp3杂化成键时,分子的空间构型一定为四面体。
正确答案:×5【判断题】CH4分子中的sp3杂化轨道是由C原子的1个2s轨道和3个2p轨道杂化形成的。
正确答案:√6【论述题】为什么BF3是平面三角形的几何构型,但NF3却是三角锥形的几何构型?正确答案:BF3和 NF3空间几何构型的不同是由于它们的中心原子所采取的杂化轨道类型不一样造成的。
在BF3分子中,B原子的电子构型为1 s 2 2 s 2 2 p1,成键时B原子以s p2 杂化轨道上三个成单电子分别与三个F原子的成单p电子配对,形成三条σ键,s p2 杂化轨道的空间构型为平面三角形,所以BF3分子空间构型即是平面三角形。
在NF3分子中,N原子的电子构型为1 s 2 2 s 2 2 p3,成键时N原子以不等性s p3杂化轨道上三个成单电子分别与三个F 原子的成单p电子配对,形成三条σ键,另一条杂化轨道为一对孤对电子占据,s p3杂化轨道的空间构型为四面体形,但因为有一对孤对电子,所以分子的空间构型呈三角锥形。
7【论述题】PCl3的空间几何构型为三角锥形,键角略小于109º28′,SiCl4是四面体形,键角为109º28′,试用杂化轨道理论加以说明。
正确答案:P原子的外层电子为 3 s2 3 p3构型,成键时3 s和3 p轨道杂化形成4个s p3不等性杂化轨道,其中一个轨道上有一对孤对电子,另3个轨道各有一个成单电子。
(完整版)杂化轨道理论练习题

杂化轨道理论练习题
1 (2019年全国卷I)H2NCH2CH2NH2分子中C、N的杂化类型、。
2 (2019年全国卷II)NH4H2PO4中的P的杂化轨道与O的2p轨道形成
键
3 (2019年海南卷)NH3分子的空间构型,N原子的杂化轨道
4 (2018年全国卷III)ZnCO3中阴离子的空间构型,其中C的杂化形式
5 (2018年江苏卷)SO42−中心原子杂化轨道杂化类型
6 (2017年全国卷I)I3+离子的几何构型,中心原子的杂化形式
7 (2017年全国卷II)CO2和CH3OH分子中C的杂化形式分别是、
8 (2016年全国卷I)Ge单晶具有金刚石型结构,其中Ge的杂化方式
9 (2016年全国卷III)AsCl3分子的立体构型,As的杂化轨道类型
10 (2015年全国卷I)CS2分子中共价键的类型,C的杂化轨道类型
11 (2015年全国卷II)PCl3的立体构型为,中心原子的杂化轨道类型
为
12 (2014年全国卷I)乙醛分子中碳原子的杂化轨道类型
13 (2011年全国卷)在BF3分子中,F-B-F的键角是,B原子的杂化轨
道类型为;BF4−的立体构型为
14 指出下列C原子所采用的杂化轨道。
杂化轨道理论 配合物理论练习题

杂化轨道理论配合物理论练习题知识点1杂化轨道1. 下列有关杂化轨道的说法不正确的是()A. 原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道B. 轨道数目杂化前后可以相等,也可以不等C. 杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理D. 杂化轨道可分为等性杂化轨道和不等性杂化轨道2. 关于原子轨道的说法正确的是()A. 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是正四面体B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C. sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化方式成键3. 根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()A. 直线形sp杂化B. 三角形sp2杂化C. 三角锥形sp2杂化D. 三角锥形sp3杂化知识点2利用杂化轨道判断分子的空间构型4. 下列分子中的中心原子杂化轨道的类型相同的是()A. CO2与SO2B. CH4与NH3C. BeCl2与BF3D. C2H2与C2H45. 下列说法中正确的是()A. PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果B. sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道C. 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形D. AB3型的分子空间构型必为平面三角形6. 下列分子的空间构型可用sp2杂化轨道来解释的是()①BF3②CH2===CH2③④CH≡CH ⑤NH3⑥CH4A. ①②③B. ①⑤⑥C. ②③④D. ③⑤⑥7. 下列推断正确的是()A. BF3为三角锥形分子B. NH的电子式为,离子呈平面正方形结构C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的2p轨道形成的s—p σ键D. CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成C—H σ键8. 下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是()A. CH≡CHB. CO2C. BeCl2D. BF3知识点3配位键9. 下列各种说法中错误的是()A. 形成配位键的条件是一方有空轨道,一方有孤电子对B. 配位键是一种特殊的共价键C. 配位化合物中的配体可以是分子也可以是阴离子D. 共价键的形成条件是成键原子必须有未成对电子10. 下列分子或离子中都存在着配位键的是()A. NH3、H2OB. NH、H3O+C. N2、HClOD. [Cu(NH3)4]2+、PCl311. 既有离子键又有共价键和配位键的化合物是()A. NH4NO3B. NaOHC. H2SO4D. H2O知识点4配合物12. 下列过程与配合物的形成无关的是()A. 除去Fe粉中的SiO2可用强碱溶液B. 向一定量的AgNO3溶液中加入氨水至沉淀消失C. 向FeCl3溶液中加入KSCN溶液D. 向一定量的CuSO4溶液中加入氨水至沉淀消失13. 下列不属于配合物的是()A. [Cu(H2O)4]SO4·H2OB. [Ag(NH3)2]OHC. KAl(SO4)2·12H2OD. Na3[AlF6]14. 下列化合物中哪些是配合物()①CuSO4·5H2O②K2PtCl6③KCl·CuCl2④Cu(NH2CH2COO)2⑤KCl·MgCl2·6H2O⑥Cu(CH3COO)2A. ①③④⑥B. ②③⑤C. ①②D. ①③⑤知识点5配合物的结构15. 已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的空间构型为()A. 直线形B. 平面正方形C. 正四面体形D. 正八面体形知识点6配合物的性质16. 向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是()A. [Co(NH3)4Cl2]ClB. [Co(NH3)3Cl3]C. [Co(NH3)6]Cl3D. [Co(NH3)5Cl]Cl217. 某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是()A. 配合物中中心原子的电荷数和配位数均为6B. 该配合物可能是平面正方形结构C. Cl-和NH3分子均与Pt4+配位D. 配合物中Cl-与Pt4+配位,而NH3分子不配位练综合拓展18. 有关乙炔分子中的化学键描述不正确的是()A. 两个碳原子采用sp杂化方式B. 两个碳原子采用sp2杂化方式C. 每个碳原子都有两个未杂化的2p轨道形成π键D. 两个碳原子形成两个π键19. 苯分子(C6H6)为平面正六边形结构,下列有关苯分子的说法错误的是()①苯分子中的中心原子C的杂化方法为sp2杂化②苯分子内的共价键键角为120°③苯分子中的共价键的键长均相等④苯分子的化学键是单、双键相交替的结构A. ①②B. ①③C. ②③D. ③④20. 下列关于苯分子的性质描述错误的是()A. 苯分子呈平面正六边形,六个碳碳键完全相同,键角皆为120°B. 苯分子中的碳原子采取sp2杂化,6个碳原子中未参与杂化的2p轨道以“肩并肩”形式形成一个大π键C. 苯分子中的碳碳键是介于单键和双键之间的一种特殊类型的键D. 苯能使溴水和酸性KMnO4溶液褪色21. 如图是乙烯分子的模型,对乙烯分子中的化学键分析正确的是()A. sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B. sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C. C—H之间是sp2形成的σ键,C—C之间是未能参加杂化的2p轨道形成的π键D. C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键22. 甲醛分子的结构式如图所示,下列描述正确的是()A. 甲醛分子中有4个σ键B. 甲醛分子中的C原子为sp3杂化C. 甲醛分子中的O原子为sp杂化D. 甲醛分子为平面三角形,有一个π键垂直于三角形平面23. 在BrCH===CHBr分子中,C—Br键采用的成键轨道是()A. sp—pB. sp2—sC. sp2—pD. sp3—p24. 对盐类物质可有下列分类:如氯化硝酸钙[Ca(NO3)Cl]是一种混盐,硫酸铝钾KAl(SO4)2是一种复盐,冰晶石(六氟合铝酸钠)Na3AlF6是一种络盐。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
杂化轨道类型试题
(2010——2014)
2010年
19.[选修3——物质结构与性质](20分)
19-I(6分)下列描述中正确的是
A. CS2为V形的极性分子
B. ClO-
的空间构型为平面三角形
3
C. SF6中有6对完全相同的成键电子对
的中心原子均为sp3杂化
D. SiF4和SO2-
3
19-II(14分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
请回答下列问题:
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
③该结构中,碳原子的杂化轨道类型有_______________。
2011年
19.[选修3——物质结构与性质](20分)
19-II(14分)铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如溶液常用作电解液、电镀液等。
请回答以下问题:
(3)SO42-的立体构型是,其中S原子的杂化轨道类型是;2012年
19.[选修3——物质结构与性质](20分)
19-II(14分)铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、
国防等领域。
回答下列问题:
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为。
已知其中一种化合物的化学式为KCuCl3,另一种的化学式为;
2013年
19.[选修3——物质结构与性质](20分)
19-II(14分)图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
回答下列问题:
(3)图A中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为,中心原子的杂化轨道类型为。
(5)k的分子式为,中心原子的杂化轨道类型为,属于分子(填“极性”或“非极性”)。
2014年
19.[选修3——物质结构与性质](20分)
19-II(14分)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
C60石墨金刚石晶胞
回答下列问题:
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为、;。
