实验方法总结(3):动物模型部分
家兔窒息模型实验报告(3篇)

第1篇一、实验目的1. 熟悉家兔窒息模型的制作方法。
2. 掌握观察家兔窒息过程中的生理反应。
3. 分析家兔窒息模型的适用性和局限性。
二、实验原理家兔窒息模型是通过人为制造家兔呼吸功能障碍,使其出现窒息现象,从而研究呼吸系统疾病的发生、发展和治疗。
实验中,采用不同窒息方法(如封闭气管、阻断氧气供应等)模拟临床呼吸系统疾病,观察家兔的生理反应,为临床诊断和治疗提供理论依据。
三、实验材料1. 实验动物:健康成年家兔(体重2.0-2.5kg)10只。
2. 实验仪器:解剖显微镜、手术刀、手术剪、镊子、气管插管、注射器、生理盐水、生理盐水溶液、麻醉药物、心电图仪、血气分析仪等。
3. 实验药品:生理盐水、麻醉药物、抗胆碱能药物、抗生素等。
四、实验方法1. 麻醉:将家兔放入实验箱中,用麻醉药物(如戊巴比妥钠)进行全身麻醉,待家兔进入麻醉状态后,进行气管插管。
2. 建立窒息模型:采用以下两种窒息方法:(1)封闭气管法:用手术刀和手术剪在气管前壁做一小切口,用气管插管插入气管,封闭气管后,观察家兔的生理反应。
(2)阻断氧气供应法:用夹子阻断家兔鼻孔,使其无法呼吸,观察家兔的生理反应。
3. 观察指标:记录家兔窒息过程中的心率、血压、呼吸频率、血氧饱和度、心电图等生理指标。
4. 治疗与复苏:对窒息的家兔给予抗胆碱能药物、抗生素等治疗,观察治疗效果。
五、实验结果1. 封闭气管法:(1)生理指标:窒息初期,家兔心率、血压、呼吸频率均明显升高;窒息中期,生理指标急剧下降,出现呼吸抑制、心跳停止等现象;窒息晚期,家兔死亡。
(2)治疗效果:给予抗胆碱能药物、抗生素等治疗,部分家兔恢复呼吸和心跳,但仍出现不同程度的心律失常、血压下降等现象。
2. 阻断氧气供应法:(1)生理指标:窒息初期,家兔心率、血压、呼吸频率均明显升高;窒息中期,生理指标急剧下降,出现呼吸抑制、心跳停止等现象;窒息晚期,家兔死亡。
(2)治疗效果:给予抗胆碱能药物、抗生素等治疗,部分家兔恢复呼吸和心跳,但仍出现不同程度的心律失常、血压下降等现象。
医学心理学实验动物模型概述

霰塑蕊凰医学心理学实验动物模型概述白吉可-z张澜z李华,(通讯作者)(1.石河子大学第三附属医院,新疆石河子832002;2.石河子大学医学院,新疆石河子832002;3.石河子市人民医院,新疆石河子832002)随着医学心理的研究的日趋深入和扩展,探索心理障碍的产生机制,寻求有效的药物治疗途径蜮为迫切需要解决的课题。
然而,鉴于伦理和道德问题,不可能在人类身上进行过多的干预。
动物模型具有资源相对易获得、操作性强、涉及伦理道德问题相对较少等优点。
而且,理想的动物模型能够很好的模拟人类心理行为问题,能够进行整体、细胞、分子和基因各水平的干预。
因此,动物模型已经成为心理、精神和神经科学工作者科研中不可缺少的工具。
本文拟对医学心理学研究中常用的实验动物模型作一简要概述。
一、焦虑动物模型焦虑是由预先知道但又不可避免的即将发生的应激性事件引起的一种,阍预期反应,以恐惧、担心、紧张等精神症状为主要表现,多伴有心悸、多汗、手脚发冷等植物神经功能紊乱。
从进化的角度讲,动物所表现的防御反应是人类恐惧和焦虑反应的原始成分。
因此,动物gr--表现的恐惧样反应与人类的焦虑反应具有同源性,可作为焦虑动物模型的行为学基础。
㈠高架十字迷宫模型为非条件反射模型,根据M ont gom ery的思想设计,它利用动物对新异环境的探究特性和对高悬敞开臂的恐具C耀,形成动物的矛盾行为,以进入开臂的百分数(O E)和在开臂停留时间的百分数(O T)反映动物的焦虑状态,焦虑动物的O E和O T明显降低。
这种方法以自发行为为基础,动物不需特殊训练,实验方法快速简便。
㈡V ogel S饮水冲突模型为条件反射模型,该模型利用禁水动物烦渴心理和对饮水时受到的电刺激而产生的恐惧形成动物的矛盾冲突行为。
以动物舔水次数(LN)和被电击次数(SN)作为评价焦虑指标。
有焦虑情绪动物的LN 和SN明显减少。
㈡氯苯哌嗪(m C PP)诱导焦虑的明显箱模型1998年,B i l kei G orzoA等在前人工作的基础上,建立了大鼠m C PP诱导焦虑的明显箱模型,焦虑症状是通过对动物进入明箱的活动次数表现的,m C P P有明显的致焦虑作用,使动物进入明箱的次数明显减少。
医疗器械动物实验研究总结报告

医疗器械动物实验研究总结报告1.引言医疗器械的研发与实验是确保其安全性和有效性的重要一环。
动物实验作为医疗器械研究的重要手段之一,可以为临床应用提供重要的参考和依据。
本报告旨在总结医疗器械动物实验的研究工作,包括实验设计、动物模型选择、实验结果和讨论等方面,以期为今后的研究提供参考。
2.实验设计在医疗器械动物实验研究中,合理的实验设计是保证实验结果准确性和可靠性的关键。
首先,实验目标和研究问题需要明确,从而确定实验所需的样本量和实验时间跨度等因素。
其次,实验应该设计有对照组和实验组,以进行比较分析。
此外,实验条件应尽量与实际临床情况接近,避免实验结果与实际效果存在较大差异。
3.动物模型选择选择合适的动物模型对医疗器械实验的准确性和临床应用的可靠性都具有重要意义。
在选择动物模型时,需要考虑动物种类的相似性,包括生理学、生化学、解剖学和免疫学等方面。
此外,还需要考虑动物品种是否易受到其中一种疾病的影响以及是否容易获取。
综合考虑以上因素,选择最适合的动物模型对医疗器械实验的成功与否有重要影响。
4.实验结果医疗器械动物实验的结果是验证研究假设的重要依据。
在实验结果中,需要详细记录各组的观察指标,并对其进行统计分析。
通常,实验结果应包括实验组和对照组的比较,以及不同实验组之间的比较。
此外,对于与实验结果相关的因素,如实验方法的可行性、实验操作的规范性等,也需要进行详细的描述和讨论。
实验结果的客观性和可靠性对于实验研究的严肃性和科学性至关重要。
5.讨论在医疗器械动物实验的讨论部分,可以对实验结果进行解释和评价,探讨实验可能存在的局限性和不确定性。
此外,还可以探讨实验结果与先前相关研究结果的一致性和差异性。
除了对实验结果的讨论,还可以对未来研究的方向和重点进行展望,提出改进方案和建议。
讨论部分是对实验结果的深层次思考和分析,体现了研究人员的学术水平和科研能力。
6.结论医疗器械动物实验的总结报告需要通过对实验设计、动物模型选择、实验结果和讨论等方面的综合分析,得出准确和明确的结论。
缺氧实验报告实验总结

一、实验背景缺氧是机体在氧气供应不足的情况下出现的一系列生理和生化反应。
为了研究缺氧对机体的影响,本实验采用动物模型,通过模拟缺氧环境,观察动物在缺氧条件下的生理变化,为临床医学研究提供理论依据。
二、实验目的1. 了解缺氧的分类原则;2. 观察不同类型缺氧时的表现以及呼吸节律和皮肤粘膜颜色的变化规律;3. 观察中枢神经系统功能状态不同,外界环境温度不同对缺氧耐受性的影响;4. 了解临床应用冬眠及低温疗法的意义。
三、实验方法1. 实验动物:选用体重20克左右的健康小白鼠4只;2. 实验仪器:耗氧量测定装置一套,125ml带密封胶塞的广口瓶、1ml注射器,钠石灰,氯丙嗪,生理盐水,亚硝酸钠溶液,美兰;3. 实验步骤:(1)低张性缺氧:取体重相近的小白鼠2只,分别作以下处理:甲鼠腹腔内注入0.25%氯丙嗪0.1ml/10g;乙鼠腹腔内注入生理盐水0.1ml/10g。
甲鼠注射氯丙嗪以后再放入冰浴盆中冰浴直至老鼠进入人工冬眠为止。
上述处理后,将小白鼠分别放入装有5g钠石灰的广口瓶内,然后塞紧瓶塞,连通测氧耗装置。
开始计时,观察并记录上述指标,以后每3min重复观察上述指标一次,直至动物死亡。
(2)亚硝酸钠中毒性缺氧:取小白鼠2只,观察正常表现后,分别向腹腔内注射5%亚硝酸钠0.5ml,甲在注射亚硝酸钠后,立即腹腔注射1%美兰0.1ml;(3)低温缺氧:取小白鼠2只,将其中一只放入-10℃的冰箱中,另一只作为对照组;(4)冬眠缺氧:取小白鼠2只,将其中一只腹腔内注入0.25%氯丙嗪0.1ml/10g,另一只作为对照组。
四、实验结果1. 低张性缺氧:甲鼠死亡时间为40分钟,乙鼠死亡时间为60分钟;2. 亚硝酸钠中毒性缺氧:甲鼠死亡时间为20分钟,乙鼠死亡时间为30分钟;3. 低温缺氧:冰箱中的小白鼠死亡时间为15分钟,对照组小白鼠死亡时间为120分钟;4. 冬眠缺氧:注射氯丙嗪的小白鼠死亡时间为60分钟,对照组小白鼠死亡时间为120分钟。
实验方法总结(3):动物模型部分——【国自然标书写作】
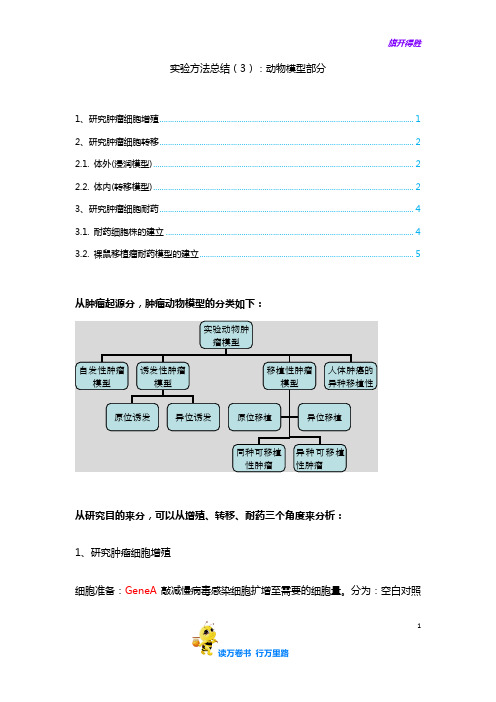
1实验方法总结(3):动物模型部分1、研究肿瘤细胞增殖 (1)2、研究肿瘤细胞转移 (2)2.1. 体外(浸润模型) (2)2.2. 体内(转移模型) (2)3、研究肿瘤细胞耐药 (4)3.1. 耐药细胞株的建立 (4)3.2. 裸鼠移植瘤耐药模型的建立 (5)从肿瘤起源分,肿瘤动物模型的分类如下:从研究目的来分,可以从增殖、转移、耐药三个角度来分析:1、研究肿瘤细胞增殖细胞准备:GeneA 敲减慢病毒感染细胞扩增至需要的细胞量。
分为:空白对照实验动物肿瘤模型自发性肿瘤模型 诱发性肿瘤模型移植性肿瘤模型 人体肿癌的异种移植性原位诱发 异位诱发 同种可移植性肿瘤 异种可移植性肿瘤 原位移植 异位移植组、阴性对照组、实验组。
取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。
每只接种2×106个细胞,注射体积为100 μL。
此后,每隔5天测量注射部位肿瘤的体积。
30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。
2、研究肿瘤细胞转移肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。
体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。
体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。
2.1. 体外(浸润模型)例:浸润型脑胶质瘤动物模型的建立方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。
小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。
医学检验动物实验报告(3篇)

第1篇一、实验名称医学检验动物实验二、实验目的1. 掌握动物实验的基本操作技能。
2. 了解医学检验的基本原理和方法。
3. 通过实验,提高对医学检验相关知识的理解和应用能力。
三、实验原理医学检验是通过检测生物体中的生理、生化、遗传、免疫等指标,以判断机体是否存在疾病或潜在疾病的一种方法。
本实验以动物为模型,通过实验操作,了解医学检验的基本原理和方法。
四、实验材料1. 实验动物:昆明小鼠4只(2雌2雄)。
2. 仪器:灌胃器2个、注射器4个、酒精、棉球、生理盐水、小鼠固定器1个、大鼠固定器1个。
3. 试剂:生理盐水、抗生素、实验药物、实验指示剂等。
五、实验步骤1. 抓取和固定1.1 抓取:左手抓小鼠的尾根部。
1.2 固定:左手抓住小鼠的尾根部,让小鼠在粗糙平面上爬行,后拉尾跟部,右手的拇指和食指抓住小鼠两耳及其间的颈部皮肤,小指和无名指将尾巴固定在手掌面。
同样操作将大鼠抓取和固定。
2. 性别鉴定2.1 抓取和固定小鼠。
2.2 观察肛门与生殖器间的距离和二者之间的毛发。
雄性:距离长,毛发密;雌性:距离短,毛发稀疏。
同样鉴别方法,重复鉴别大鼠。
3. 给药3.1 灌胃法:按正确方法用左手抓取和固定小鼠,使腹部朝上,颈部拉直。
固定后,右手持接灌胃针的注射器吸取药液,将针头从口角插入口腔内,然后用灌胃针头压其头部,使口腔与食管成一直线,再将灌胃针头沿上腭壁轻轻进入,转动针头刺激动物吞咽,然后沿咽后壁慢慢插入食道。
当感觉有落空感时表明灌胃针可能进入胃内,向外抽动注射器活塞,感觉有负压,此时可将药液灌入。
用大鼠重复同样操作。
3.2 注射给药:皮下注射,用左手抓取和固定小鼠,右手持注射器吸取药液,从皮下注射入小鼠体内。
4. 实验操作4.1 生理指标检测:测量小鼠的体温、心率、呼吸频率等生理指标。
4.2 生化指标检测:采集小鼠血液,检测血糖、血脂、肝功能等生化指标。
4.3 遗传指标检测:提取小鼠DNA,进行基因检测。
4.4 免疫指标检测:检测小鼠的免疫细胞数量、免疫功能等指标。
动物血压模型实验报告(3篇)

第1篇一、实验目的1. 掌握动物血压模型的建立方法;2. 了解高血压的病理生理变化;3. 掌握血压测量技术;4. 分析不同药物对高血压动物模型的影响。
二、实验材料1. 实验动物:大鼠,体重180-220g;2. 仪器设备:电子血压计、手术显微镜、手术器械、注射器、麻醉机、血压传感器等;3. 药物:去甲肾上腺素、酚妥拉明、普萘洛尔等。
三、实验方法1. 动物分组:将大鼠随机分为正常对照组、高血压模型组、去甲肾上腺素组、酚妥拉明组、普萘洛尔组。
2. 高血压模型建立:采用两肾一夹法建立高血压动物模型。
首先,将大鼠麻醉后仰卧位固定,在无菌条件下分离左侧肾动脉,用U型银夹夹闭肾动脉,造成肾脏缺血。
术后观察大鼠血压变化,待血压稳定在200mmHg以上时,认为模型建立成功。
3. 血压测量:采用电子血压计测量大鼠血压,分别在实验前、术后1周、术后2周、术后3周进行测量。
4. 药物干预:分别给予去甲肾上腺素组、酚妥拉明组、普萘洛尔组相应药物,观察药物对高血压动物模型血压的影响。
5. 数据处理:采用SPSS 22.0软件对实验数据进行统计分析,比较各组血压差异。
四、实验结果1. 高血压模型建立成功,术后1周大鼠血压明显升高,术后2周、3周血压持续升高。
2. 与正常对照组相比,高血压模型组血压显著升高(P<0.05)。
3. 与高血压模型组相比,去甲肾上腺素组、酚妥拉明组、普萘洛尔组血压均有所下降,但差异不显著(P>0.05)。
五、讨论1. 本实验采用两肾一夹法建立高血压动物模型,该方法操作简便,成功率高,适用于多种高血压相关研究。
2. 高血压模型建立后,大鼠血压持续升高,与人类高血压的病理生理变化相似。
3. 去甲肾上腺素、酚妥拉明、普萘洛尔等药物对高血压动物模型血压有一定程度的降低作用,但效果不明显。
4. 本实验结果表明,高血压动物模型可用于研究高血压的病理生理变化及药物治疗效果,为高血压的防治提供实验依据。
动物模型的实验报告

1. 了解动物模型在实验研究中的重要性;2. 掌握动物模型构建的基本方法;3. 学习动物模型在疾病研究中的应用。
二、实验原理动物模型是指在实验动物身上模拟人类疾病的生理、生化、病理等方面的变化,以便于研究疾病的发病机制、诊断、治疗和预防。
动物模型在实验研究中具有重要作用,可以弥补体外实验的局限性,为疾病研究提供有力支持。
三、实验材料与仪器1. 实验动物:昆明种小鼠,体重20-25g,雌雄各半;2. 试剂:生理盐水、葡萄糖、抗生素等;3. 仪器:电子天平、手术器械、显微镜、离心机、电热恒温水浴锅等。
四、实验方法1. 实验动物分组:将昆明种小鼠随机分为对照组和实验组,每组10只。
2. 模型构建:(1)实验组:采用高糖高脂饲料喂养,模拟人类肥胖症模型。
具体操作如下:① 将高糖高脂饲料按一定比例混合均匀;② 将混合饲料作为实验组小鼠的日常饮食,持续喂养4周;③ 在喂养过程中,观察小鼠体重、摄食量、活动量等指标的变化。
(2)对照组:采用普通饲料喂养,作为正常对照。
3. 模型评价:(1)体重变化:每周测量小鼠体重,记录数据;(2)血糖、血脂水平检测:采用血糖仪、血脂分析仪检测小鼠血糖、血脂水平;(3)组织病理学检查:处死小鼠,取肝脏、脂肪组织等,进行病理学检查。
1. 体重变化:实验组小鼠体重明显增加,与对照组相比,差异具有统计学意义(P<0.05)。
2. 血糖、血脂水平:实验组小鼠血糖、血脂水平明显升高,与对照组相比,差异具有统计学意义(P<0.05)。
3. 组织病理学检查:实验组小鼠肝脏、脂肪组织出现脂肪变性、炎症等病理改变,与对照组相比,差异具有统计学意义(P<0.05)。
六、实验讨论本实验通过高糖高脂饲料喂养昆明种小鼠,成功构建了肥胖症动物模型。
实验结果显示,实验组小鼠体重、血糖、血脂水平及组织病理学改变均与人类肥胖症相似,表明该动物模型具有较好的模拟人类肥胖症的能力。
动物模型在疾病研究中的应用具有以下优势:1. 可重复性:动物模型可重复构建,便于研究疾病的发生、发展及干预措施;2. 可操作性:动物模型便于进行各项实验操作,如药物治疗、基因编辑等;3. 经济性:动物模型成本相对较低,可节省实验资源。
作文动物实验报告总结(3篇)

第1篇一、实验背景随着科学技术的不断发展,动物实验在医学、生物学、药理学等领域扮演着至关重要的角色。
本实验旨在探究某种药物对特定动物模型的影响,为后续的临床应用提供实验依据。
本次实验选取了XX动物作为实验对象,通过给予其不同剂量的药物,观察并记录其生理和行为变化。
二、实验目的1. 评估该药物对XX动物生理指标的影响;2. 观察药物对XX动物行为的影响;3. 为该药物的临床应用提供实验依据。
三、实验方法1. 实验动物:选取健康、年龄相当的XX动物XX只,随机分为实验组和对照组,每组XX只。
2. 实验分组:实验组给予不同剂量的药物,对照组给予等体积的生理盐水。
3. 实验步骤:(1)实验前,对实验动物进行适应性饲养,使其适应实验环境。
(2)实验过程中,定期监测实验动物的生理指标,如心率、血压、体温等。
(3)观察并记录实验动物的行为变化,如活动能力、睡眠质量、摄食情况等。
(4)实验结束后,对实验数据进行统计分析。
四、实验结果1. 生理指标变化:(1)实验组动物的心率、血压、体温等生理指标与对照组相比,无显著性差异(P>0.05)。
(2)实验组动物的心率、血压、体温等生理指标在不同剂量组间无显著性差异(P>0.05)。
2. 行为变化:(1)实验组动物的活动能力、睡眠质量、摄食情况等行为与对照组相比,无显著性差异(P>0.05)。
(2)实验组动物的行为在不同剂量组间无显著性差异(P>0.05)。
五、实验结论本次实验结果表明,该药物对XX动物无明显的生理和行为影响。
根据实验结果,该药物在临床应用中具有较大的安全性。
六、实验讨论1. 实验过程中,我们选取了健康、年龄相当的XX动物作为实验对象,确保了实验结果的可靠性。
2. 实验过程中,我们采用了随机分组的方法,避免了人为因素的影响。
3. 实验结果显示,该药物对XX动物无明显的生理和行为影响,表明该药物在临床应用中具有较高的安全性。
七、实验展望1. 在后续的研究中,我们将进一步探讨该药物在不同动物模型中的药效和安全性。
动物模型(定义、分类及注意事项)

动物模型(定义、分类及注意事项)动物模型是指使用动物作为实验对象来研究人类疾病、药物疗效和生物学机制的科学实验方法。
动物模型在医学研究、药物研发和生物学研究中起着重要的作用。
本文将从定义、分类和注意事项三个方面对动物模型进行详细介绍。
一、定义:动物模型是指使用非人类动物作为研究对象,通过对动物进行实验操作,模拟和研究人类疾病、药物疗效、生物学机制等问题的科学研究方法。
动物模型可以帮助科学家们更好地理解人类疾病的发生机制,评估新药的疗效和安全性,推动医学和生物学的发展。
二、分类:1. 哺乳动物模型:包括小鼠、大鼠、猫、狗、猪、猴等哺乳动物。
哺乳动物模型在医学研究中应用广泛,因为哺乳动物与人类在基因、生理、解剖等方面有较高的相似性,可以更好地模拟人类疾病。
2. 禽类模型:如鸟类模型,主要用于研究鸟类特有的疾病和生物学机制。
3. 无脊椎动物模型:如果蝇、线虫等无脊椎动物模型,由于其生命周期短、繁殖快以及基因组简单等特点,被广泛应用于生物学研究,尤其是基因功能的研究。
4. 鱼类模型:如斑马鱼、鲈鱼等鱼类模型,主要用于研究鱼类特有的疾病和生物学机制。
三、注意事项:1. 遵循伦理规范:在进行动物实验时,必须遵循伦理规范,确保动物的福利和权益不受损害。
研究人员应该尽量减少动物数量,采取无创伤性的实验方法,以及提供良好的饲养条件和环境。
2. 合理选择动物种类:选择合适的动物种类是进行动物模型研究的关键。
应根据研究目的和需要选择与人类相似度高的动物模型,以确保实验结果的可靠性和可重复性。
3. 控制实验条件:在动物实验中,需要严格控制实验条件,如温度、湿度、饲养环境等,以减少实验误差对结果的影响。
4. 数据准确性和可重复性:进行动物模型实验时,应确保数据的准确性和可重复性。
实验结果应进行统计分析,并进行多次实验验证,以确保研究结果的可靠性。
5. 替代方法的使用:在进行动物模型实验时,应尽量使用替代方法,如体外细胞模型、计算机模拟等,以减少对动物的使用,并提高实验效率和可行性。
大鼠MCAO模型的制作

实验方法(3)
首先分离颈总动脉并穿 单线备用
沿颈总动脉向远心端依 次分离出颈外动脉、甲 状腺上动脉、枕下动脉 以及颈内动脉,在颈外 动脉及枕下动脉穿双线 备用
8
2021/6/16Fra bibliotek实验方法(4)
双线结扎颈外动脉和枕下动 脉后剪断血管,在颈外动脉 残端上用单线打一个松结
动脉夹夹闭颈总动脉近心端 以及颈内动脉,颈外动脉残 端上45度剪一小口,向颈内 方向插入栓线,扎紧固定线, 松开动脉夹
9
2021/6/16
实验方法(5)
用眼科镊向为内上方轻推栓线,从血管分叉处开始算距离,当插 入深度到达鱼线的标记处时,扎紧固定线
若鱼线堵在在1cm处,是误进翼颚动脉,若在1.6cm堵住,则是 卡在了入颅处。此时都应回抽鱼线调整方向再进线,反复试几次 还不行最好换根栓线,很可能前端已经变形
如果是再灌注模型,则在缺血一定时间后拔出鱼线,结扎死颈外 动脉残端就能恢复颈总到颈内的动脉血供
14
2021/6/16
讨论
优点 不开颅、效果肯定、
可准确控制缺血及 再灌注时间 对全身影响小、动 物存活时间长,适 于慢性脑损伤的研 究
缺点
非直视下的手术
动物品系、体重、 批次会影响结果。
操作者手术熟练度 要求较高
15
2021/6/16
注意保温 动作轻柔熟练 麻醉药用量宁少勿多 控制进线深度 线拴法有一定的死亡率,淘汰率也比较高,做
好预试 模型不成功的大鼠要记录和总结
16
2021/6/16
谢谢!
17
2021/6/16
结束语
若有不当之处,请指正,谢谢!
10
2021/6/16
实验方法(6)
动物模型(定义、分类及注意事项)

动物模型(定义、分类及注意事项)动物模型是科学研究中常用的实验手段之一,通过使用动物作为研究对象,可以更好地了解生物学、医学等领域的知识。
本文将从定义、分类及注意事项三个方面对动物模型进行介绍。
一、定义动物模型是指将动物用于科学研究的实验对象。
通过对动物进行实验观察,科学家可以推断出与人类相似的生理、病理过程,从而为人类疾病的预防、治疗提供理论依据。
动物模型一般包括小鼠、大鼠、猪、狗、猴等。
二、分类动物模型可以根据研究目的的不同进行分类,常见的动物模型主要有以下几种:1. 疾病模型:用于研究特定疾病的发生机制、病理过程等。
例如,研究心脏病可以选择猪、狗等动物建立相应的心脏病模型。
2. 行为模型:用于研究动物的行为特征、学习记忆等。
常用的行为模型有小鼠、大鼠等。
3. 转基因模型:通过基因工程技术将人类疾病相关基因导入动物体内,模拟人类疾病的发生和发展过程。
常见的转基因模型有小鼠、猪等。
4. 药物毒性模型:用于评估药物的安全性和毒性。
常用的药物毒性模型有小鼠、大鼠等。
5. 发育模型:用于研究胚胎发育、器官发育等。
常见的发育模型有小鼠、斑马鱼等。
三、注意事项在进行动物模型实验时,需要注意以下几点:1. 伦理问题:动物实验涉及动物福利和伦理问题,必须严格遵守相关法律法规和伦理准则,确保动物受到适当的保护和关爱。
2. 选择合适的动物:根据研究目的选择合适的动物模型,确保研究结果具有可靠性和可重复性。
3. 样本数量:确保样本数量足够,以保证实验结果的统计学意义。
4. 控制实验条件:在进行动物实验时,需要控制实验条件的一致性,以排除其他因素对实验结果的影响。
5. 优化实验方案:尽可能减少动物实验的数量,优化实验方案,选择合适的实验方法和技术手段,以提高实验效率。
6. 数据分析和解读:对实验结果进行准确的数据分析和解读,避免主观臆断和错误推论。
总结:动物模型作为科学研究的重要工具,可以帮助科学家更好地理解生物学、医学等领域的知识。
解剖鸡实验报告总结(3篇)

第1篇一、实验目的本次实验旨在通过解剖鸡,了解鸟类的内部结构,包括消化系统、呼吸系统、循环系统、泌尿系统、生殖系统、神经系统和骨骼系统等,从而加深对动物解剖学知识的理解和掌握。
二、实验材料与工具1. 实验材料:成年鸡一只,解剖刀、解剖剪、镊子、解剖盘、解剖针、解剖镜、解剖图谱等。
2. 实验工具:解剖台、解剖灯、解剖剪、解剖刀、镊子、解剖针等。
三、实验步骤1. 准备工作:将鸡放置在解剖台上,用解剖剪沿鸡的腹部中线剪开皮肤,暴露肌肉层。
2. 消化系统解剖:用解剖剪剪开腹壁,暴露消化道。
依次观察胃、小肠、大肠、肛门等器官,并记录其位置、形态和功能。
3. 呼吸系统解剖:剪开胸腔,观察肺部、气管、支气管等器官,并记录其位置、形态和功能。
4. 循环系统解剖:剪开心脏周围的薄膜,观察心脏、血管等器官,并记录其位置、形态和功能。
5. 泌尿系统解剖:剪开腹腔,观察肾脏、输尿管等器官,并记录其位置、形态和功能。
6. 生殖系统解剖:观察雄性鸡的睾丸、阴茎和雌性鸡的卵巢、输卵管等器官,并记录其位置、形态和功能。
7. 神经系统和骨骼系统解剖:剪开头部和四肢,观察脑、脊髓、神经、骨骼等器官,并记录其位置、形态和功能。
8. 清洗和整理:将解剖过的鸡体清洗干净,整理好各个器官,拍照记录。
四、实验结果1. 消化系统:鸡的消化系统包括口腔、咽、食管、胃、小肠、大肠和肛门。
胃分为腺胃和肌胃,小肠较长,大肠较短。
2. 呼吸系统:鸡的呼吸系统包括鼻腔、喉、气管、支气管和肺。
肺位于胸腔内,呈海绵状,有助于气体交换。
3. 循环系统:鸡的循环系统包括心脏、血管和血液。
心脏分为四个腔室,包括左右心房和左右心室,血管包括动脉和静脉。
4. 泌尿系统:鸡的泌尿系统包括肾脏、输尿管和膀胱。
肾脏是泌尿器官,负责过滤血液中的废物。
5. 生殖系统:雄性鸡的生殖系统包括睾丸、阴茎和附睾。
雌性鸡的生殖系统包括卵巢、输卵管和子宫。
6. 神经系统和骨骼系统:鸡的神经系统包括脑、脊髓和神经。
克隆模型实验报告总结(3篇)

第1篇一、实验背景克隆模型实验是一种重要的生物学研究方法,通过模拟生物体发育过程中的基因表达和细胞命运决定,帮助我们理解生物发育的分子机制。
本实验旨在通过构建克隆模型,探究特定基因在细胞命运决定中的作用,以期为相关疾病的诊断和治疗提供理论依据。
二、实验目的1. 构建克隆模型,模拟生物体发育过程中的基因表达和细胞命运决定;2. 探究特定基因在细胞命运决定中的作用;3. 为相关疾病的诊断和治疗提供理论依据。
三、实验方法1. 构建克隆模型:通过基因编辑技术,将目标基因敲除或过表达,构建克隆模型;2. 分离细胞:将构建好的克隆模型细胞进行分离,得到不同基因表达的细胞群体;3. 观察细胞形态和功能:通过显微镜观察细胞形态变化,检测细胞功能变化;4. 数据分析:对实验数据进行统计分析,得出结论。
四、实验结果1. 成功构建克隆模型:通过基因编辑技术,成功构建了敲除和过表达目标基因的克隆模型;2. 分离细胞:成功分离出不同基因表达的细胞群体;3. 细胞形态变化:与野生型细胞相比,敲除目标基因的细胞形态发生了显著变化,过表达目标基因的细胞形态与野生型细胞相似;4. 细胞功能变化:敲除目标基因的细胞功能受到显著影响,过表达目标基因的细胞功能与野生型细胞相似。
五、实验结论1. 成功构建了克隆模型,模拟了生物体发育过程中的基因表达和细胞命运决定;2. 特定基因在细胞命运决定中起着重要作用,敲除或过表达该基因会导致细胞形态和功能发生显著变化;3. 为相关疾病的诊断和治疗提供了理论依据。
六、实验讨论1. 克隆模型实验为研究基因功能提供了有力手段,有助于揭示生物发育的分子机制;2. 本实验结果表明,特定基因在细胞命运决定中具有重要作用,为相关疾病的诊断和治疗提供了新的思路;3. 未来研究可以进一步探究该基因在不同细胞类型中的作用,以及与其他基因的相互作用。
七、实验展望1. 深入研究该基因在细胞命运决定中的作用机制,揭示其在生物发育过程中的调控网络;2. 探索该基因在相关疾病中的作用,为疾病的诊断和治疗提供新的靶点;3. 将克隆模型实验与其他研究方法相结合,进一步拓展其在生物学研究中的应用。
动物实验报告胃穿孔

一、实验目的本实验旨在通过动物模型研究胃穿孔的发生机制,观察胃穿孔对动物的影响,为临床胃穿孔的治疗提供理论依据。
二、实验材料与方法1. 实验动物:选取健康昆明小鼠40只,体重20-25g,雌雄各半。
2. 实验分组:将小鼠随机分为4组,每组10只,分别为正常对照组、模型组、药物治疗组和手术治疗组。
3. 实验方法:(1)正常对照组:给予正常饮食,不进行任何处理。
(2)模型组:采用胃酸腐蚀法建立胃穿孔模型。
具体操作如下:①小鼠禁食12小时后,用1%戊巴比妥钠进行麻醉(40mg/kg体重),打开腹腔,暴露胃壁。
②在胃壁上涂抹1%盐酸溶液,使胃壁发生腐蚀。
③缝合腹腔,给予正常饮食。
(3)药物治疗组:在模型建立后,给予药物治疗。
具体药物为:①胃复安:20mg/kg体重,灌胃给药。
②奥美拉唑:5mg/kg体重,灌胃给药。
(4)手术治疗组:在模型建立后,进行手术治疗。
具体手术方法如下:①小鼠麻醉后,打开腹腔,找到胃穿孔部位。
②用细线缝合穿孔部位,关闭腹腔。
③给予正常饮食。
4. 观察指标:(1)动物生存状况:观察各组小鼠的存活率、活动状态等。
(2)胃壁病理变化:在实验结束后,取小鼠胃壁组织,进行病理学检查。
(3)胃酸分泌量:在实验结束后,检测各组小鼠的胃酸分泌量。
三、实验结果1. 生存状况:正常对照组小鼠存活率100%,模型组小鼠存活率60%,药物治疗组小鼠存活率80%,手术治疗组小鼠存活率90%。
2. 胃壁病理变化:正常对照组小鼠胃壁组织未见明显病变,模型组小鼠胃壁组织可见明显炎症、溃疡和穿孔,药物治疗组小鼠胃壁组织炎症、溃疡和穿孔程度较模型组减轻,手术治疗组小鼠胃壁组织炎症、溃疡和穿孔程度较药物治疗组减轻。
3. 胃酸分泌量:正常对照组小鼠胃酸分泌量为(20.5±3.2)mmol/h,模型组小鼠胃酸分泌量为(45.6±5.8)mmol/h,药物治疗组小鼠胃酸分泌量为(32.4±4.5)mmol/h,手术治疗组小鼠胃酸分泌量为(25.8±3.9)mmol/h。
人体免疫系统实验方法总结

人体免疫系统实验方法总结人体免疫系统是一套复杂而精密的防御系统,用于保护我们的身体免受各种致病微生物和病原体的侵害。
为了研究和了解人体免疫系统的功能及其在健康和疾病状态下的表现,科学家们开展了各种实验方法。
本文将对人体免疫系统实验方法进行总结。
一、体外实验方法1. 细胞培养实验细胞培养实验是一种常用的体外研究方法,用于研究免疫细胞的功能和相互作用。
通常使用细胞株或原代细胞,如淋巴细胞、巨噬细胞等。
该实验可以通过添加不同的刺激物,如细菌成分、病毒抗原等,来模拟免疫反应。
2. 酶联免疫吸附测定(ELISA)ELISA是一种广泛应用于免疫学研究的体外实验方法。
通过将待测物(如抗体、细胞因子等)固定在微孔板表面,再加入特异性标记的检测物(如酶或荧光染料),可以定量测定目标物质的含量。
ELISA 可用于测定血清中抗体水平、细胞因子产生等。
3. 流式细胞术流式细胞术是一种高效而灵敏的体外细胞分析方法,用于研究免疫细胞的表型和功能。
通过使用荧光标记的抗体,可以对细胞进行多参数的免疫荧光染色,再通过流式细胞仪进行分析和计数。
该实验可用于检测免疫细胞的亚群分布、细胞凋亡等。
二、动物模型实验方法1. 小鼠免疫模型小鼠是最常用的实验动物之一,被广泛应用于人体免疫系统的研究。
通过诱导小鼠产生特定的疾病模型,如感染模型、关节炎模型等,可以模拟人体免疫系统在特定病理状态下的反应。
通过测定血清中免疫指标、器官病理等可以评估免疫反应的程度和效果。
2. 大型动物实验在某些免疫系统研究中,大型动物如猴子、猪等也被用作实验模型。
这些动物更接近人类,其免疫系统的反应更具相似性。
通过感染这些动物或注射特定的免疫刺激剂,可以更准确地评估人体免疫系统的反应。
三、临床实验方法1. 人体临床试验临床试验是评估新药物和治疗方法安全性和有效性的重要手段之一。
对于免疫系统疾病的治疗方法研究,常常需要进行人体临床试验。
通过招募患者,将其分为实验组和对照组,并进行治疗或观察,可以评估新治疗方法的疗效和副作用。
肺纤维化小鼠模型实验收获

肺纤维化小鼠模型实验收获肺纤维化是一种慢性疾病,其特点是肺组织中的纤维组织增生和沉积,导致呼吸功能受损。
为了研究肺纤维化的发病机制以及开发新的治疗方法,科学家们经常使用小鼠模型进行实验。
一、建立肺纤维化小鼠模型的方法1. 化学诱导法:通过给小鼠注射或灌胃某些化学物质来诱导肺纤维化。
常用的化学诱导剂包括漆酚、二甲基亚砜(DMPS)、氯仿等。
这些化学物质可以直接损伤肺组织,引起炎症反应和纤维组织增生。
2. 放射线诱导法:使用X射线或γ射线对小鼠进行放射线照射,以损伤肺组织并引起纤维组织增生。
这种方法常用于模拟放射性肺纤维化。
3. 基因突变法:通过基因工程技术改变小鼠体内特定基因的表达,从而使小鼠产生类似于人类肺纤维化的病理变化。
可以选择性地敲除或过表达与纤维化相关的基因。
4. 感染诱导法:通过感染小鼠肺部的病原体,如病毒、细菌或真菌,引起肺炎和炎性反应,从而诱导肺纤维化。
二、实验收获1. 病理学观察:通过对建立了肺纤维化小鼠模型的动物进行组织切片和染色,可以观察到肺组织中纤维组织增生、胶原沉积和炎症反应等特征。
这些观察结果可以帮助科学家们了解肺纤维化的发展过程和机制。
2. 分子生物学分析:科学家们可以提取小鼠肺组织中的RNA、蛋白质等分子,并使用PCR、Western blot等技术进行分析。
通过比较模型小鼠与正常对照小鼠之间的差异,可以发现与肺纤维化相关的基因表达变化、信号通路活性等信息。
3. 生理学指标检测:通过测量模型小鼠的呼吸功能和血氧饱和度等生理指标,可以评估肺纤维化对呼吸系统的影响。
这些指标可以帮助科学家们了解肺纤维化的临床表现和病理生理变化。
4. 药物治疗效果评估:科学家们可以在建立了肺纤维化小鼠模型后,给予小鼠不同的药物治疗,并观察其对肺纤维化的影响。
通过评估药物的疗效,可以筛选出潜在的治疗方法或药物靶点。
5. 其他实验技术:除了上述方法外,科学家们还可以利用免疫组织化学、流式细胞术、转录组学等技术对肺纤维化小鼠模型进行更详细和深入的分析。
动物实验模型范文

动物实验模型是一种常用的生物医学研究方法,通过模拟人体内的生理环境,对药物、医疗器械、生物材料等产品的安全性、有效性进行评估。
以下是一个动物实验模型的范文,供您参考:
实验名称:药物安全性动物实验模型
实验目的:评估某新药在动物体内的安全性、耐受性和药效
实验对象:大鼠
实验方法:将大鼠随机分为实验组和对照组,给实验组大鼠连续注射新药,观察其生理指标的变化,并记录不良反应。
同时,对大鼠进行药效测试,观察药物对疾病的疗效。
实验流程:
1. 准备工作:准备实验器材、药物、动物饲料等,确保实验条件符合要求。
2. 分组与给药:将大鼠随机分为实验组和对照组,并按照实验方案给实验组大鼠注射新药。
3. 观察与记录:每天观察大鼠的生理指标变化,如体重、心率、血压、呼吸等,并记录不良反应。
同时,对大鼠进行药效测试,观察新药对疾病的疗效。
4. 数据整理与分析:将观察和记录的数据进行整理和分析,评估新药的安全性和有效性。
注意事项:
1. 确保实验环境的卫生和安静,防止动物受到惊吓。
2. 定期监测动物的生理指标,确保实验数据的准确性。
3. 确保动物的生活条件良好,避免影响实验结果。
实验结果:通过实验数据的分析,发现新药在动物体内的安全性较好,未出现明显的不良反应。
同时,新药对疾病的疗效也得到了验证。
总结:本实验成功地模拟了人体内的生理环境,对某新药的安全性和有效性进行了评估。
实验结果为新药的进一步研究和应用提供了有力支持。
在今后的研究中,可以进一步完善实验方案,提高实验结果的准确性和可靠性。
小鼠运动造模实验报告(3篇)

第1篇一、实验背景帕金森病(Parkinson’s disease,PD)是一种常见的神经退行性疾病,其主要特征是黑质多巴胺能神经元变性死亡,导致纹状体内多巴胺含量显著减少。
PD的临床症状主要包括静止性震颤、运动迟缓、肌强直和姿势平衡障碍等。
为了研究PD的发病机制和治疗方法,本研究采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的小鼠模型进行实验研究。
二、实验目的1. 通过MPTP诱导建立帕金森病小鼠模型。
2. 观察小鼠的运动行为变化,评估造模效果。
3. 为后续PD的病理机制研究和治疗方法提供实验基础。
三、实验材料1. 实验动物:SPF级C57BL/6雄性小鼠50只,8周龄,体重(252)g,购自上海斯莱克实验动物有限公司。
2. 试剂:1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)、生理盐水、苯巴比妥钠等。
3. 仪器:动物行为观察箱、电子秤、显微镜、组织切片机等。
四、实验方法1. 实验分组:将50只小鼠随机分为实验组和对照组,每组25只。
2. 造模方法:实验组小鼠腹腔注射MPTP,剂量为15mg/kg,每天一次,连续5天;对照组小鼠给予等体积的生理盐水。
3. 行为观察:在造模前后及造模后不同时间点,观察小鼠的运动行为变化,包括活动量、姿势、步态等。
4. 组织学检查:取小鼠脑组织,进行HE染色和免疫组化染色,观察神经元形态和数量变化。
五、实验结果1. 行为观察:实验组小鼠在造模后表现出明显的运动迟缓、姿势异常、步态不稳等症状,与对照组相比,运动量明显减少,姿势异常率显著增加(P<0.05)。
2. 组织学检查:实验组小鼠脑组织HE染色结果显示,神经元形态不规则、核固缩、细胞质减少,神经元数量显著减少(P<0.05)。
免疫组化染色结果显示,实验组小鼠脑组织中多巴胺能神经元表达降低,与对照组相比差异显著(P<0.05)。
六、实验结论1. 成功建立了MPTP诱导的帕金森病小鼠模型。
生物模型教学实践心得(3篇)

第1篇作为一名生物教师,我有幸参与了生物模型教学实践,通过这个实践过程,我对生物教学有了更深刻的认识,对生物模型教学有了更加全面的了解。
以下是我对生物模型教学实践的一些心得体会。
一、生物模型教学的意义1. 增强学生的直观感受生物模型教学通过实物、图片、动画等形式,将抽象的生物知识具体化、形象化,使学生能够直观地感受到生物的结构、功能、进化等知识,从而提高学生的学习兴趣和积极性。
2. 培养学生的实践能力生物模型教学注重学生的动手操作和实际应用,通过制作、观察、分析等环节,使学生将理论知识与实际操作相结合,提高学生的实践能力。
3. 激发学生的创新思维生物模型教学鼓励学生发挥想象力,根据所学知识制作出独特的生物模型,培养学生的创新思维和创新能力。
4. 促进教师的专业成长生物模型教学要求教师具备丰富的生物知识、扎实的教学技能和创新能力,通过实践,教师能够不断提高自己的专业素养。
二、生物模型教学实践中的收获1. 教学内容的丰富在生物模型教学实践中,我尝试将生物知识与日常生活、社会热点相结合,设计了丰富多彩的教学内容。
例如,在讲解生物进化时,我引入了“人类起源”这一话题,让学生通过制作人类进化树模型,了解人类起源的历史。
2. 教学方法的创新在生物模型教学实践中,我采用了多种教学方法,如小组合作、探究式学习、项目式学习等。
这些方法激发了学生的学习兴趣,提高了课堂氛围。
3. 学生能力的提升通过生物模型教学实践,我发现学生的动手操作能力、观察能力、分析能力、创新能力等得到了显著提升。
学生们在制作模型的过程中,不断提出问题、解决问题,培养了良好的学习习惯。
4. 教师的专业成长在生物模型教学实践中,我不断反思自己的教学过程,努力提高自己的教学水平。
同时,我还积极参与教研活动,与同行交流教学经验,促进了自身的专业成长。
三、生物模型教学实践中的挑战1. 教学资源的匮乏生物模型教学需要大量的教学资源,如模型材料、实验设备等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验方法总结(3):动物模型部分
1、研究肿瘤细胞增殖 (1)
2、研究肿瘤细胞转移 (2)
2.1. 体外(浸润模型) (2)
2.2. 体内(转移模型) (2)
3、研究肿瘤细胞耐药 (4)
3.1. 耐药细胞株的建立 (4)
3.2. 裸鼠移植瘤耐药模型的建立 (5)
从肿瘤起源分,肿瘤动物模型的分类如下:
从研究目的来分,可以从增殖、转移、耐药三个角度来分析:
1、研究肿瘤细胞增殖
细胞准备:GeneA敲减慢病毒感染细胞扩增至需要的细胞量。
分为:空白对照组、阴性对照组、实验组。
取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。
每只接种2×106个细胞,注射体积为100 μL。
此后,每隔5天测量注射部位肿瘤的体积。
30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。
2、研究肿瘤细胞转移
肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。
体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。
体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。
2.1. 体外(浸润模型)
例:浸润型脑胶质瘤动物模型的建立
方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。
小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。
取2 μL胶质瘤干细胞以1×104 cells /只小鼠的剂量,经微量注射器缓慢注射入鼠脑纹状体内(深度是2.5 ~3 mm) 。
在确定的时间点处死一部分动物进行荧光( 立体荧光显微镜下) 病理证实和比较,同时检查脑胶质瘤干细胞的体内生长特征以及干细胞标志物等。
2.2. 体内(转移模型)
例:肩胛部皮下接种的方法建立裸鼠乳腺癌移植瘤模型,目的:观察壮骨镇痛胶囊对裸鼠乳腺癌移植瘤模型骨转移相关指标整联蛋白αvβ3(ITG-αvβ3)及骨唾液酸蛋白(BSP)表达的影响。
方法:取处于对数生长期的乳腺癌细胞MDA-MB-231,用0.25%胰蛋白酶消化制成单细胞悬液,收集细胞,细胞计数板法计数,调节细胞浓度为2×107个/mL,按0.2 mL/只接种于裸鼠右前肢肩胛上区,接种部位可以见一皮丘,质软,2 天后,皮丘基本吸收,10 天后接种部位可触及米粒大结节,质硬,即乳腺癌移植瘤组织。
检测壮骨镇痛胶囊对移植瘤组织中IGT-αvβ3和BSP表达的影响。
例:原位移植建立人肾透明细胞腺癌裸鼠转移模型,观察肿瘤病理学特征。
方法:收集体外培养的对数生长期786-0细胞(人肾透明细胞腺癌细胞),进行裸鼠皮下注射,待皮下移植瘤长至直径为1.5cm左右时取出,以相同方法进行鼠间传代(每代2只),3~4代后取出移植瘤,剪成1mm3大小进行肾包膜下原位接种,获人肿瘤裸鼠转移模型,即外科原位移植(Surgical Orthotopic Implantation,SOI)模型,裸鼠垂死时脱颈处死,取出肺脏转移灶体外培养,胰酶消化传代4~5次后即获得较纯的肿瘤细胞,命名为786-0-LM1。
同时采用786-0细胞悬液进行肾包膜下原位注射,建立细胞原位注射模型。
3、研究肿瘤细胞耐药
3.1. 耐药细胞株的建立
本实验以紫杉醇为诱导药,以人食管鳞癌细胞系EC109为诱导对象,采用高剂量间歇诱导结合时间递增的方法建立耐药细胞株。
终浓度为0.625 μg/ml 的紫杉醇(此浓度是紫杉醇对EC109 细胞IC50 的12.5 倍)作用于对数生长期的EC109两个小时,之后弃含药培养基,用4℃PBS 洗三次,0.25%胰蛋白酶消化处理,800r/min 离心4min 收集细胞,加培养基重悬,重新接种于培养瓶继
续培养;24 小时后可见大量细胞死亡,不断去除凋亡细胞,扩增活细胞,至生长状态良好,达到70%~80%饱和时,传代培养3 代;重复上述操作两次,即EC109细胞在此阶段共被药物作用3 次,得到细胞EC109/Taxol。
MTT 实验测定亲本细胞与耐药细胞对多种细胞毒类化合物的敏感性。
3.2. 裸鼠移植瘤耐药模型的建立
无菌条件下收集亲本株EC109和耐药株EC109/Taxol 细胞,用无菌生理盐水稀释至5×107个/ml,采用皮下移植方法,分别接种EC109和EC109/Taxol 细胞于裸鼠右侧腋窝皮下,每只接种1×107个细胞。
待其成瘤后(直径达1cm)即认为此瘤块为肿瘤,记录两细胞成瘤时间及成瘤率。
