物理化学-化学动力学基础
物理化学11章化学动力学基础一

N2O4
1 2
O2
r k[N 2O5 ]
上一内容 下一内容 回主目录
返回
7/14/2020
一级反应的微分速率方程
反应:
A P
t 0 cA,0 a
0
t t cA a x x
r
dcA dt
k1cA
r
dx dt
k1(a
x)
上一内容 下一内容 回主目录
返回
7/14/2020
一级反应的积分速率方程
(2) 2A P r k2[A]2
上一内容 下一内容 回主目录
返回
7/14/2020
二级反应的微分速率方程
(1) A B P
t 0 a b 0
t t a-x b-x x
dx dt
k2 (a
x)(b
x)
当a b 时
dx dt
k2 (a
x)2
上一内容 下一内容 回主目录
(2) 2A P
t0 a
例如:
R P
速度
速率
d[R] 0 dt
d[P] 0 dt
d[R] d[P] 0 dt dt
上一内容 下一内容 回主目录
返回
7/14/2020
平均速率
rR
([R]2 [R]1) t2 t1
上一内容 下一内容 回主目录
rp
([P]2 [P]1) t2 t1
不能确切反映速率的变
化情况,只提供了一个平
上一内容 下一内容 回主目录
返回
7/14/2020
质量作用定律
对于基元反应,反应速率与反应物浓度的幂乘积 成正比。幂指数就是基元反应方程中各反应物的系数。 这就是质量作用定律,它只适用于基元反应。
大学物理化学第12章 化学动力学基础(二)(1)

第12章化学动力学基础(二)1.在简单碰撞理论中,有效碰撞的定义是: ( )A、互撞分子的总动能超过EcB、互撞分子的相对总动能超过EcC、互撞分子联心线上的相对平动能超过EcD、互撞分子的内部动能超过Ec2.简单碰撞理论属基元反应速率理论,以下说法不正确的是: ( )A、反应物分子是无相互作用的刚性硬球B、反应速率与分子的有效碰撞频率成正比C、从理论上完全解决了速率常数的计算问题D、反应的判据之一是联线上的相对平动能大于某临界值3. 根据碰撞理论,温度增加反应速率提高的主要原因是: ( )A、活化能降低B、碰撞频率提高C、活化分子所占比例增加D、碰撞数增加4.化学反应的过渡态理论的要点是: ( )A、反应物通过简单碰撞就变成产物B、在气体分子运动论的基础上提出来的C、反应物首先形成活化络合物,反应速率决定于活化络合物分解为产物的分解速率D、引入了方位因子的概念,并认为它与熵变化有关5. 过渡态理论对活化络合物的假设中,以下说法不正确的为: ( )A、是处在鞍点时的分子构型B、正逆反应的过渡态不一定相同C、存在着与反应物间化学平衡D、生成的过渡态不能返回反应始态6. Lindemann 单分子反应机理是假定反应分子经碰撞激发后 ( )A、立即分解B、有一时滞C、发出辐射D、引发链反应7. 电解质溶液中的反应速率受离子强度影响的规律,下述说法中正确的应是: ( )A、离子强度I越大,反应速率越大;B、I越大,反应速率越小C、同号离子间反应,原盐效应为正;D、电解质与中性反应物作用,原盐效应为负[Co(NH3)5Br]2++OH-→[Co(NH3)5OH]2++Br-CH2ICOOH+SCN-→CH2(SCN)COOH+I-8. 除多光子吸收外,一般引起化学反应的光谱,其波长范围应是: ( )A、可见光(400 - 800 nm)及紫外光(150 - 400 nm)B、X射线 (5 -10-4nm)C、远红外射线D、微波及无线电波9.对光化学第二定律的认识下述说法正确的是:( )A、对初级,次级过程均适用B、对任何光源均适用C、对激光光源及长寿命激发态不适用D、对大、小分子都适用10. 与光化学基本定律有关的说法中正确的是:( )A、凡是被物质吸收了的光都能引起光化学反应;B、光化学反应所得到的产物数量与被吸收的光能的量成正比;C、在光化学反应中,吸收的光子数等于被活化的反应物微粒数;D、在其它条件不变时,吸收系数越大,透过溶液的光强度也越大11. 已知 HI 的光分解反应机理是:HI + h→ H·+ I·H·+ HI→ H2 + I·I·+ I·+ M→I2 + M 则该反应,反应物消耗的量子效率为: ( )A、 1B、 2C、 4D、 10612. 光化反应与热反应(黑暗反应)的相同之处在于 ( )A、反应都需要活化能;B、温度系数小;C、反应都向G(恒温恒压,W'=0时)减小的方向进行;D、平衡常数可用通常的热力学函数计算13. 温度对光化学反应速率的影响为:()A、与热反应大致相同;B、与热反应大不相同,温度增高,光化学反应速率下降;C、与热反应大不相同,温度增高,光化学反应速率不变;D、与热反应大不相同,温度的变化对光化学反应速率的影响较小14. 催化剂能极大地改变反应速率,以下说法不正确的是: ( )A、催化剂改变了反应历程B、催化剂降低了反应的活化能C、催化剂改变了反应的平衡,以致使转化率大大地提高了D、催化剂能同时加快正向和逆向反应速率15. 称为催化剂毒物的主要行为是: ( )A、和反应物之一发生化学反应;B、增加逆反应的速度;C、使产物变得不活泼;D、占据催化剂的活性中心;16.乙醛的光解机理拟定如下:(1)CH3CHO + hνCH3· + CHO·(2)CH3· + CH3CHO CH4 + CH3CO·(3) CH3CO·CO + CH3·(4) CH3· + CH3· C2H6试推导出CO的生成速率表达式和CO的量子产率表达式。
物理化学第9章 化学动力学基础

速率方程必须由实验来确定
四、反应级数 若反应的速率方程可以表示为浓度的幂乘积形式:
r = k[A][B]…
则各浓度项的方次、、…分别称为组分A、B …的
例 1、P165例题
某金属钚的同位素进行β放射,14 d 后,同位
素活性下降了6.85%。试求该同位素的:
(1) 蜕变常数,(2) 半衰期,(3) 分解掉90%所需时间
解:
(1)
k1
=
1 t
ln
a
a
x
=
1 14d
ln
100 100 6.85
=
0.00507d-1
(2) t1/2 = ln 2 / k1 = 136.7d (3) t = 1 ln 1 = 1 ln 1 = 454.2d
例如:
例如,恒容反应器中,氯代甲酸三氯甲酯分解为光气
ClCOOCCl(g) 2COCl2(g)
t = 0 p0
0
t = t p酯
p光气=2( p0 – p酯)
p总 = p酯 + p光气 = 2 p0 –p酯
∴ p酯 = 2p0 – p总
或 p光气 = 2(p总– p0)
三、反应速率 r 的经验表达式
2、适用范围
ln k = Ea B RT
k = AeEa / RT
3、A意义:称指前因子
二、活化能的概念 1、对简单反应:
那些能量高到能发生反应的分子称为“活化分子” 活化能:活化分子的平均能量与反应物分子平 均能量之差值。
物理化学(第五版傅献彩)第12_化学动力学基础2

k
=ν
K
≠ c
=
kBT h
f fA
≠'
fBC
exp
−
E0 RT
一般基元反应 k 的计算式为
k
=
kBT h
f ≠' ΠfB
exp
−
E0 RT
常温
kBT ≈ 1013 s−1 h
36
A (单原子) + B(单原子) ‡ˆˆˆ†ˆ[ALB]≠ (双原子)
( ) k = kBT ( ) ( ) h
25
势能面
Ep
OT ≠
rAB
A+RBC
D
P
rBC
AB+C
A+B+C
26
R点:是反应物A+BC分子的基态。随A原子靠近, 势能沿RT 升高,到T点形成活化络合物 随C原子离去,势能沿TP线下降
P点:是生成物AB+C分子 的基态
D点:是离解为A,B,C原 子时的势能
OEP一侧是原子间 的相斥能,很高
f
3 t
fr2
≠
f
3 t
A
f
3 t
B
exp
−
E0 RT
1个振动自由度用于活化络合物的分解
37
A
(
N
,非线型多原子分子
A
)
+
B
(
N
,非线型多原子分子
B
)
‡ˆˆˆ†ˆ[ALB]≠ ( NA + NB,非线型多原子分子)
( ) k = kBT
( ) ( ) h
物理化学12章_化学动力学基础(二)
Eb。Eb。是活化络合物与反应物最 低势能之差,E0是两者零点能
之间的差值。
这个势能垒的存在说明了实验活化能的实质。
上一内容 下一内容 回主目录
返回
2021/1/16
势能面剖面图
上一内容 下一内容 回主目录
返回
2021/1/16
三原子系统振动方式
式中r0是分子中双原子分子间的平衡核间 距,De是势能曲线的井深,a为与分子结构有 关的常数.
上一内容 下一内容 回主目录
返回
2021/1/16
双原子分子的莫尔斯势能曲线
AB双原子分子根据该公式 画出的势能曲线如图所示。
当r>r0时,有引力,即化学键力。 当r<r0时,有斥力。 0时的能级为振动基态能级,E0为零点能。
物理化学12章_化学动力学基础(二 )
上一内容 下一内容 回主目录
返回
物理化学电子教案—第十二章
上一内容 下一内容 回主目录
返回
2021/1/16
第十二章 化学动力学基础(二)
§12.1 碰撞理论 *§12.2 过渡态理论
§12.3 单分子反应理论 * §12.4 分子反应动态学简介
§12.5 在溶液中进行的反应 * §12.6 快速反应的几种测试手段
Ea≈ E
上一内容 下一内容 回主目录
返回
2021/1/16
概率因子(probability factor)
由于简单碰撞理论所采用的模型过于简单, 没有考虑分子的结构与性质,所以用概率因子 来校正理论计算值与实验值的偏差。
P=k(实验)/k(理论)
概率因子又称为空间因子或方位因子。
上一内容 下一内容 回主目录
物理化学 12章_化学动力学基础(二)

他们认为由反应物分子变成生成物分子,中 间一定要经过一个过渡态,而形成这个过渡态必 须吸取一定的活化能,这个过渡态就称为活化络 合物,所以又称为活化络合物理论。
用该理论,只要知道分子的振动频率、质量、 核间距等基本物性,就能计算反应的速率常数,所 以又称为绝对反应速率理论。
Ea
RT2
dlnk(T) dT
已知 ksct(T)dA 2BL 8RTexp(R ET c)
将与T无关的物理量总称为B,取对数:
有 lnksct(T)R E T c1 2lnTlnB
对T微分,得:
dlndkTsct(T)RETc2
1 2T
代入活化能定义式,得:
Ea
ቤተ መጻሕፍቲ ባይዱ
Ec
1 RT 2
Egr1 2(m Am B )ug 21 2ur2
Egr1 2(m Am B )ug 21 2ur2
两个分子在空间整体运动的动能 g 对化学
反应没有贡献
而相对动能 r 可以衡量两个分子相互趋近
时能量的大小,有可能发生化学反应。 碰撞参数
描述粒子碰撞激烈的程度的物理量,用字母b表示
物理化学电子教案—第十二章
第十二章 化学动力学基础(二)
§12.1 碰撞理论 §12.2 过渡态理论 §12.3 单分子反应理论 * §12.4 分子反应动态学简介 §12.5 在溶液中进行的反应 * §12.6 快速反应的几种测试手段 §12.7 光化学反应 * §12.8 化学激光简介 §12.9 催化反应动力学
r
1
物理化学讲稿第十二章化学动力学基础二

物理化学讲稿第十二章化学动力学基础(二)(10学时)物理化学教研室第十二章化学动力学基础(二)(教学方案)第十二章 化学动力学基础(二)人们在测量了大量反应的速率常数,并对反应速率常数于温度的依赖关系有了相当了解以后,对于为什么会有这些宏观规律存在必须从理论给予回答。
在反应速率理论的发展过程中,先后形成了碰撞理论、过渡态理论和单分子反应理论等。
动力学理论与,发展较迟。
先后形成的碰撞理论、过渡态理论都是20世纪后建立起来的。
而且与热力学的经典理论相比尚有明显不足之处。
速度理论是研究化学反应的速率系数与温度的关系,描述反应过程的动力学性质。
速率理论的共同点:首先选定一个微观模型,用气体分子运动论(碰撞理论)或量子力学(过渡态理论)的方法,并经过统计平均,导出宏观动力学中速率系数的计算公式。
由于所采用模型的局限性,使计算值与实验值不能完全吻合,还必须引入一些校正因子,使理论的应用受到一定的限制。
§12.1 碰撞理论(Simple Collision theory )(SCT )碰撞理论是接受了阿伦尼乌斯关于“活化状态”和“活化能”概念的基础上,利用已经建立起来的气体分子运动论的基础上,在20世纪初由路易斯建立起来的。
路易斯把气相中的双分子反应看作是两个分子激烈碰撞的结果。
在这里只学习简单的硬球碰撞理论(SCT )。
气相双分子简单反应如A + B → 产物,2A → 产物。
一、碰撞理论1、微观模型(1) 反应物分子可看作简单的刚球,无内部结构; (2) 分子间除碰撞间外无其它相互作用;(3) 在反应过程中,反应分子的速率分布遵守麦克斯韦-玻耳兹曼分布。
2、碰撞理论的基本要点(1) 分子必须通过碰撞才能发生反应,反应物分子间的接触碰撞是发生反应的前提。
即要反应,先碰撞;(2) 不是任何两个反应物分子碰撞都能发生反应,只有当两个反应物碰撞分子的能量超过一定的数值ε0时,并满足一定的空间配布几何条件的碰撞反应才能发生反应;(3)活化分子的能量较普通能量高,它们碰撞时,松动并部分破坏了反应物分子中的旧键,并可能形成新键,从而发生反应,这样的碰撞称为有效碰撞或非弹性碰撞,活化分子愈多,发生化学反应的可能性就愈大。
傅献彩《物理化学》(第5版)(下册)章节题库-化学动力学基础(一)(圣才出品)

【解析】活化焓相等,则活化能也近似相等,活化熵相差 30 J gK −1 gmol −1 ,则根据
k = P exp( S )exp( − Ea )
R
RT
k2
( S2 − S1 )
= exp R R
30
= exp8.314
= 37
k1
8. 某化学反应,当温度每升高 1K 时,该反应的速率常数 k 增加 1%,则该反应的活化
k = Aexp( − Ea ) RT
1 / 74
圣才电子书 十万种考研考证电子书、题库视频学习平台
得
k2
( E1 − E2 )
= exp RT RT
80000
= exp8.314298
= 1014
k1
3.某二级反应,反应物消耗 1/3 需时间 10min,若再消耗 1/3 还需时间为( )。
应的半衰期为 t1/2=1/(kCA,0)=100s。
10.在简单硬球碰撞理论中,有效碰撞的定义是( )。 A.互撞分子的总动能超过 EC B.互撞分子的相对动能超过 EC C.互撞分子的内部动能超过 EC D.互撞分子的相对平动能在连心线上的分量超过 EC 【答案】D 【解析】能导致旧键破裂的碰撞成为有效碰撞。只有相对平动能在分子连心线上的分量 超过临界值的分子对,才能把平动能转化为分子内部的能量,使旧键破裂而发生原子间的重 新组合。
速率常数的温度系数较小。
12.某反应,无论反应物初始浓度为多少,在相同时间和温度时,反应物消耗的浓度为 定值,此反应是( )。
A.负级数反应 B.一级反应 C.零级反应 D.二级反应 【答案】C
【解析】零级反应速率方程式为:cA,0 − cA = kt ,一定温度下,k 为定值,时间也一定 时,等式右边是常数,所以, cA,0 − cA 即反应物消耗的浓度为定值
化学反应动力学的物理化学基础

化学反应动力学的物理化学基础化学反应动力学是研究化学反应速率随时间、温度、浓度和压力等因素的变化规律的科学。
它不仅关注反应速率的大小,还研究了反应机理和反应速率方程等问题。
动力学的研究对于认识和控制化学反应过程、实现反应的高效、可控性具有重要的理论和应用价值。
在本文中,我们将从物理化学的角度,介绍化学反应动力学的基本概念、理论基础和实验方法。
一、反应速率及其影响因素反应速率是化学反应从起始物质到最终物质转化所需时间的倒数,通常用摩尔浓度的变化率来表示。
反应速率与反应物浓度、温度、压力、催化剂和表面积等因素密切相关。
反应物浓度越高,反应速率通常越快;温度升高,反应速率也会增大;压力的增加对于气相反应具有促进作用;催化剂能够降低活化能,提高反应速率;表面积较大的固体反应物,反应速率会加快。
二、反应的速率方程反应速率方程是描述反应速率与各种影响因素之间关系的数学表达式。
常见的反应速率方程有零级反应、一级反应、二级反应和伪一级反应等。
零级反应速率与反应物浓度无关,一级反应速率正比于反应物浓度,二级反应速率正比于反应物浓度的平方,伪一级反应是指多个反应物中一个物质浓度远远超过其他物质浓度的情况。
速率方程常用来表示反应物浓度对于反应速率的影响关系,它可以通过实验测定求得。
在反应动力学的研究中,常采用的实验方法有初始速率法、等温混合法、半衰期法等。
这些方法可以通过改变反应条件,测定产物的生成量和浓度的变化来研究反应速率的规律。
三、活化能与反应机理反应动力学不仅关注反应速率的大小,还要研究反应的机理和速率常数。
反应机理是指反应发生的详细步骤和中间产物的生成消失过程。
速率常数是一个反映反应速率的量,它与反应机理有关。
在反应机理中,起始物质首先通过一个过渡态,进而转变为产物。
反应的速率决定于反应物分子之间的碰撞频率和反应的选择性。
反应物分子之间的碰撞频率与温度、浓度等因素有关。
反应的选择性是指分子在碰撞时,具有足够的能量和正确的碰撞几何构型,使得反应可以进行。
物理化学答案——第九章-化学动力学基础
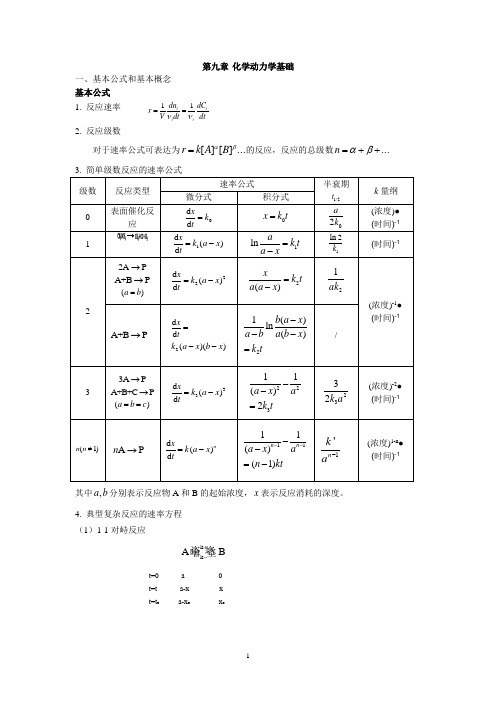
第九章 化学动力学基础一、基本公式和基本概念 基本公式 1. 反应速率 11i ii i dn dC r V dtdtνν==2. 反应级数对于速率公式可表达为...][][βαB A k r =的反应,反应的总级数...++=βαn 3. 简单级数反应的速率公式 级数 反应类型 速率公式半衰期 1/2tk 量纲微分式积分式0 表面催化反应0d d x k t =0x k t = 02a k (浓度)● (时间)-1 11d ()d x k a x t=-1lna k t a x=-1ln 2k(时间)-122A P→A +B P →()a b =22d ()d x k a x t=-2()x k t a a x =-21ak(浓度)-1●(时间)-1A +B P →2d d ()()xtk a x b x =--21()ln()b a x a b a b x k t---=/33A P→A +B +C P→()a b c ==33d ()d x k a x t=-22311()2a x a k t --=2332k a(浓度)-2● (时间)-1(1)n n ≠A P n →d ()d nx k a x t=-1111()(1)n n a x an kt----=-1'n k a-(浓度)1-n ● (时间)-1其中,a b 分别表示反应物A 和B 的起始浓度,x 表示反应消耗的深度。
4. 典型复杂反应的速率方程 (1)1-1对峙反应k k A B +-t=0 a 0 t=t a-x x t=t e a-x e x e速率方程: ()kk te e x x x e +--+-=(2)平行反应最简单的平行反应是由两个一级基元反应组成的平行反应:x=x 1+x 2速率方程:tk k aex a )(21+-=-产物B 和C 的浓度比由竞争反应的速率决定:2121k k x x = (3)连续反应最简单的连续反应是两个单向连续的一级反应:C B A kk −→−−→−21t=0 a 0 0 t=t x y z 速率方程:1k tx ae-=)(21121tk tk eek k a k y ----=]1[21121122tk tk ek k k ek k k a z ---+--=中间产物B 的浓度在反应过程中出现极大值:122)(21k k k m k k a y -=,出现极大值的时间为:2121)ln(k k k k tm-=5. 温度对反应速率的影响 (1)阿累尼乌斯经验公式2ln RTE dTk d a =阿累尼乌斯公式的指数函数式: RTE a Aek -=k 1k 2A a-xCx 2 B x 1(2)阿累尼乌斯活化能基元反应的活化能是活化分子的平均能量与所有分子平均能量之差。
物理化学第十一章 化学动力学基础

对(2)式,如果两反应物寝浓度与计量系数成正比 即 C A, 0 =a
C B,0 b
那么反应过程中,每一瞬间 2 此时 dC A = kC A C B = kC A (b )C A = k `C A
dt a
t= 1 1 1 k ` C A C A, 0
CA
CB
=a
b
同样有 这就是二级反应的速率方程的积分形式。 二级反应的动力学特征: (1)以 (2)当反应物消耗一半时,即 C A = 2 ,则半衰期 半衰期与反应物的初始浓度成正比。
HI
dt
2
2
dt
§10—2 化学反应的速率方程 1 d [HBr ] k [H 2 ][Br2 ]2 再如 H2 +Br2 = 2 HBr VHI = = [HBr ] dt 1+ k` [Br2 ] 以上三个反应虽然都是合成卤化氢的反应,但由于它们有着完全 不同的反应机理,因而速度方程完全不同。
dt = kC A
§10—3 速率方程的积分形式 整理
dC A = kdt CA
CA
dC A 1 C A, 0 定积分:t = ∫C A, 0 v = k ln C A A
或; 1 C A, 0 或: k = t ln C A 一级反应的动力学特征: dC (1)从式子 k= C
C A = C A.0 e kt
k c [I 2 ]
k c 为动力学平衡常数
若以HI的生成速率来表示反应的速率 d [HI ] 2 = k 2 [H 2 ][I ] = k 2 [H 2 ] k c [I 2 ] = k [H 2 ][I 2 ]
dt
这就是由该非基元反应得出来的速率方程,与实验相符合。 四、化学反应速率方程的一般形式 对于某一个化学反应,一般说来,不能根据其化学反应式来 预言,其速率方程而是要通过实验测定其具体形式: d [HI ] 例如:H2 + I2 = 2 HI V HI = = k [H 2 ][I 2 ] dt 而对于H2 +Cl2 = 2 HCl 1 d [HCl ] V HI = = k [H 2 ][Cl 2 ]2 d [HCl ] V = ≠ k [H ][Cl ]
物理化学第十一章 化学动力学基础练习题

第十一章化学动力学(1)练习题一、填空题1、某反应物得转化率分别达到50%,75%,87、5% 所需时间分别为t1/2,2t1/2,3t1/2,则反应对此物质得级数为。
2、某二级反应,反应消耗1/3需时间10min,若再消耗1/3还需时间为分钟。
3、两个活化能不相同得反应,如果E1<E2,且都在相同得升温区内升温,则(填“>”或“<”或“=”)4、只有一种反应物得二级反应得半衰期与反应得初始浓度得关系为。
5、(浙江大学考研试题)反应A→Y+Z中,反应物A得初始浓度为1mol·dm-3,初始速率为0、01 mol·dm-3·s1,假定该反应为二级反应,则其速率系数k A为,半衰期为。
6、(西北工业大学考研试题)反应2A→3B,则之间得关系就是。
7、(西北工业大学考研试题)一级反应以对时间作图为一直线,速率系数等于直线得。
8、(浙江大学考研试题)丁二烯得液相聚合反应,实验已确定对丁二烯为一级,并测得在323K时得速率系数为3、3×102min1,当丁二烯得转化率为80%时,反应时间为。
9.某反应A+B Y+Z,加催化剂后正反应速率系数与不加催化剂时正反应速率系数比值,则逆反应速率系数比值____。
10、某复杂反应得表观速率常数与各基元反应速率常数之间得关系为,则表观活化能与各基元反应活化能之间得关系为____。
二、单选题:1.反应3O22O3,其速率方程d[O2]/d t = k[O3]2[O2] 或d[O3]/d t = k'[O3]2[O2],那么k 与k'得关系就是:(A) 2k = 3k' ; (B) k = k' ;(C) 3k = 2k' ; (D) ½k= ⅓k' 。
2.有如下简单反应a A + b B dD,已知a <b < d,则速率常数k A、k B、k D得关系为:(A) ;(B) k A < k B < k D ;(C) k A > k B > k D ;(D) 。
物理化学化学动力学知识点总结

物理化学化学动力学知识点总结一、化学动力学的基本概念1.1 化学动力学的定义化学动力学是研究化学反应速率和反应机理的科学领域,它关注化学反应发生的速度和影响反应速率的因素。
1.2 反应速率的定义反应速率指的是单位时间内反应物消耗或生成物产生的量,通常用摩尔/升或克/升来表示。
1.3 反应速率的计算反应速率可以通过观察反应物浓度随时间的变化来计算,也可以根据剩余物质浓度的变化率来求得。
二、反应速率与浓度变化的关系2.1 反应速率与浓度的关系一般来说,反应速率与反应物的浓度成正比,可以用速率定律来描述。
2.2 速率定律的表达式速率定律可以通过实验得到,一般形式为v = k[A]^m[B]^n,其中v为反应速率,k为速率常数,[A]和[B]分别为反应物的浓度,m和n分别为反应物的反应级别。
2.3 速率常数的影响因素速率常数受温度、催化剂等因素的影响,温度升高可以增加速率常数,催化剂可以降低活化能,从而提高反应速率。
三、反应动力学的研究方法3.1 反应速率的实验测定通过实验测定反应物浓度随时间的变化,可以得到反应速率与时间的关系,从而得到速率常数和反应级数。
3.2 反应机理的研究通过实验测定不同反应条件下的反应速率,可以推断反应机理,进而提出反应的准确机理方程。
3.3 反应活化能的测定通过测定不同温度下的反应速率常数,可以利用阿伦尼乌斯方程计算反应的活化能,从而了解反应的热力学特性。
四、反应平衡和平衡常数4.1 反应的正向和逆向反应在一个封闭的系统中,当正向反应和逆向反应达到动态平衡时,反应速率相等,但各反应物浓度不再改变。
4.2 平衡常数的定义平衡常数(Kc)描述了反应在平衡时各反应物浓度的关系,可以通过实验测定得到。
4.3 平衡常数的计算平衡常数可以根据反应的化学方程式来确定,如果反应中有气体,也可以用分压来表示平衡常数。
五、影响平衡常数的因素5.1 温度的影响温度升高可以改变反应的平衡常数,一般来说,温度升高会使平衡常数偏向热力学不利的方向。
考研《物理化学》考点精讲教程(第10讲 化学动力学基础)

k (cA,0
y)(cB,0
y)
t 0:
t=t:
A + BD + …
≠ cA ,0
cB ,0
cA
cB
= =
cA,0 - y cB,0 - y
1
ln cB,0 (cA,0 y) kt
(cA,0 cB,0 ) cA,0 (cB,0 y)
Ø k 的量纲: (浓度) - 1 (时间) - 1
k
1
ln cB,0 cA
3. 半衰期法
t1/ 2
2n1 1
(n
1)k
cn1 A,0
令B 2n1 1 , (n 1)k
则:t1/2 BcA1,0n
lg tˊ1/ 2 = (1 - n) lgˊcA,0 + lg B
lg t1〞/ 2 = (1 - n) lg cA〞,0 + lg B
lg
t1/ 2 t1/ 2
k 1 ln pA,0 t pA
Ø半衰期: cA=cA,0 /2 所需的时间
t1/ 2
1 k
ln
cA,0 cA,0 /2
t1/ 2
ln 2 k
0.693 k
kp kc
《物理化学》考点精讲教程
n级反应
A + ······ P
微分式:
A
dpA dt
kpAn
dpA pAn
kdt
积分式:
pA dpA
1 n
lg
cA ,0 cA,0
n
1
lg(t1 / 2 lg (cA,0
t1/ 2 ) cA ,0 )
《物理化学》考点精讲教程
10.3 温度对反应速率的影响
物理化学第十一章化学动力学基础练习题

物理化学第十一章化学动力学基础练习题 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第十一章 化学动力学(1)练习题一、填空题1.某反应物的转化率分别达到 50%,75%,87.5% 所需时间分别为t 1/2,2t 1/2,3t 1/2,则反应对此物质的级数为 。
2.某二级反应,反应消耗1/3需时间10min ,若再消耗1/3还需时间为 分钟。
3.两个活化能不相同的反应,如果E 1<E 2,且都在相同的升温区内升温,则1ln d k dT2ln d k dT (填“>”或“<”或“=”) 4.只有一种反应物的二级反应的半衰期与反应的初始浓度的关系为 。
5.(浙江大学考研试题)反应A →Y+Z 中,反应物A 的初始浓度为1 mol·dm -3,初始速率为0.01 mol·dm -3·s -1,假定该反应为二级反应,则其速率系数k A 为 ,半衰期为 。
6.(西北工业大学考研试题)反应2A →3B ,则 之间的关系是 。
7.(西北工业大学考研试题)一级反应 以 对时间作图为一直线,速率系数等于直线的 。
8.(浙江大学考研试题)丁二烯的液相聚合反应,实验已确定对丁二烯为一级,并测得在323K 时的速率系数为3.3×10-2min -1,当丁二烯的转化率为80%时,反应时间为 。
9.某反应A+B Y+Z,加催化剂后正反应速率系数'1k 与不加催化剂时正反应速率系数1k 比值'41110k k =,则逆反应速率系数比值'11k k =____。
10.某复杂反应的表观速率常数k 与各基元反应速率常数之间的关系为11224()2k k k k =,则表观活化能a E 与各基元反应活化能之间的关系为____。
二、单选题:1.反应3O 2 2O 3,其速率方程-d[O 2]/d t = k [O 3]2[O 2] 或 d[O 3]/d t =k '[O 3]2[O 2],那么k 与k '的关系是:(A) 2k = 3k ' ; (B) k = k ' ; (C) 3k= 2k ' ; (D) ½k = ⅓k ' 。
中科大物理化学ch10-化学动力学基础一

§10.1 引言
一、化学(反应)动力学
• 研究一个实际的化学反应过程,往往 需考察热力学和动力学两个方面:
1. 热力学:
• 反应的方向、限度、外界对平衡的影响; • 给出反应发生的可能性、平衡点即体系可 能的能量最低点。 • 它不考虑反应所需用的时间和中间历程。
2. 动力学:
H2 + Cl2 2 HCl (2)
虽然计量式相同,各自的反应机理却不同。 反应(1)I2 + M ⇌ 2I· +M (M为反应壁或其他惰性物) H2 + 2 I· 2 HI
反应 (2) Cl2 + M 2 Cl· +M H2 + Cl· HCl + H·
(链引发) (链增长)
Cl2 + H· HCl + Cl·
• 反应速率、反应历程(机理),给出反应 若可能发生,能否转化为现实(即考虑反 应速率)。
化学动力学定义: “化学动力学是研究化学反应速率、反应 历程的学科。”
在 “反应速率” 、“反应历程” 两个 概念中,“反应速率”比较不难理解 (严格的定义后述); 而新提出的概念 “反应历程” 指什么呢?
t1= x1/v = 5 cm /1000 cm/s = 0.005 s c1 可测量;
t2= x2/v =10 cm /1000 cm/s = 0.01 s c2 可测量;
……
t1= x1/v = 5 cm /1000 cm/s = 0.005 s c1 可测量; t2= x2/v =10 cm /1000 cm/s = 0.01 s
或:
rP RT rc
1 dPi 定义: rP (恒容理气) i dt
物理化学11章 化学动力学基础(一)
反应进度(extent of reaction)
设反应为: R P
t 0 nR (0) nP (0)
t t nR (t) np (t)
nR (t) nR (0) np (t) nP (0)
d dnB B
转化速率(rate of conversion)
反应机理(reaction mechanism)
反应机理又称为反应历程。在总反应中,连续 或同时发生的所有基元反应称为反应机理,在有些 情况下,反应机理还要给出所经历的每一步的立体 化学结构图。
同一反应在不同的条件下,可有不同的反应机 理。了解反应机理可以掌握反应的内在规律,从而 更好的驾驭反应。
(1) 蜕变常数,(2) 半衰期,(3) 分解掉90%所需时间
解:
(1)
k1
1 t
ln
a
a
x
1 14d
ln
100 100 6.85
0.00507d-1
(2) t1/2 ln 2 / k1 136.7d (3) t 1 ln 1 1 ln 1 454.2d
k1 1 y k1 1 0.9
反应级数是由实验测定的。
例如:
r k0
r k[A]
零级反应
一级反应
r k[A][B] 二级,对A和B各为一级
r k[A]2[B] 三级,对A为二级,对B为一级
r k[A][B]2
负一级反应
r k[A][B]1/2
1.5级反应
r k[A][B]/(1[B]1/2 ) 无简单级数
反应分子数
§11.1 化学动力学的任务和目的
化学热力学的研究对象和局限性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11.2 具有简单级数的反应
11.2 具有简单级数的反应
对峙反应
11.3 几种典型的复杂反应
平行反应
11.3 几种典型的复杂反应
11.3 几种典型的复杂反应
பைடு நூலகம்连续反应(重要,考题)
11.3 几种典型的复杂反应
11.3 几种典型的复杂反应
真题例题
写出反应AK1B
K2
C的动力学方程式和积分式
K3
KK121
K3
11.4 阿伦尼乌斯公式与活化能
实验活化能(简称活化能):一个具有平均能量的反应物分子要变成具有平均能量的活化 分子所必须获得的能量。 表观活化能:是组成该总包反应的各基元反应活化能的特定组合,没有确切的意义。
11.2 具有简单级数的反应
11.2 具有简单级数的反应
11.2 具有简单级数的反应
三级反应(P170) 关键就是两步:1.写微分方程 2.做积分(定积分最重要) 积分自己一定要动手积一遍!!!三级反应积分相对复杂一点。
11.2 具有简单级数的反应
11.2 具有简单级数的反应
真题例题 某化合物A在反应容器中反应1小时后,消耗了75%,试问反应2小时后还剩多少? 假定反应为:
第11章 化学动力学基础
11.1 基础概念 11.2 具有简单级数的反应 11.3 几种典型的复杂反应 11.4 阿伦尼乌斯公式与活化能
11.1 基础概念
11.1 基础概念
11.1 基础概念
一级反应
11.2 具有简单级数的反应
11.2 具有简单级数的反应
二级反应
11.2 具有简单级数的反应
