常见的金属离子
常见的离子和常见物质的化学式

常见的离子和常见物质的化学式常见的金属离子:锂离子:Li+钾离子:K+钠离子:Na+钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+铝离子:Al3+锌离子:Zn2+铁离子:Fe3+亚铁离子:Fe2+铜离子:Cu2+亚铜离子:Cu+银离子:Ag+汞离子:Hg2+铅离子:Pb2+常见的非金属离子:氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—硫离子:S2—氧离子O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子:ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+亚硫酸氢根离子:HSO3—偏铝酸根离子:AlO2—过氧根离子:O22—硫氰根离子:SCN—碘酸根离子:IO3—草酸根离子:C2O42—乙酸根离子:CH3COO—次氯酸根离子:ClO—硅酸根离子:SiO32—三、化学式1.单质:非金属:氢气:H2氧气:O2臭氧:O3氮气:N2氯气:Cl2碳:C 硫:S 磷:P 碘:I2溴单质:Br2稀有气体:氦气:He 氖气:Ne 氩气:Ar金属:钠:Na 钾:K 镁:Mg 铝:Al 钙:Ca 锌:Zn 铁:Fe 铜:Cu 金:Au 银:Ag 汞:Hg锰:Mn 铅:Pb2.氧化物:非金属氧化物:一氧化碳、二氧化碳、二氧化硫、三氧化硫、一氧化氮、CO 、CO2 、SO2 、SO3 、NO二氧化氮、五氧化二氮、五氧化二磷、水、过氧化氢、二氧化硅、NO2、N2O5、P2O5、H2O、H2O2、SiO2金属氧化物:氧化钠、氧化镁、氧化钙、氧化铜、氧化汞、二氧化锰、Na2O 、MgO 、CaO 、CuO 、HgO 、MnO2氧化铝、氧化铁、氧化亚铁、四氧化三铁、氧化亚铜、过氧化钠Al2O3、Fe2O3、FeO、Fe3O4、Cu2O Na2O2 3.酸:盐酸、硝酸、硫酸、碳酸、醋酸(乙酸)、亚硫酸、硅酸HCl、HNO3、H2SO4、H2CO3、CH3COOH、H2SO3、H2SiO3、草酸:H2C2O4次氯酸:HClO4.氢氧化物:氢氧化钠、氢氧化镁、氢氧化钙、氢氧化铜、氢氧化铝、氢氧化铁、氢氧化亚铁NaOH、Mg(OH)2、Ca(OH)2、Cu(OH)2、Al(OH)3、Fe(OH)3 、Fe(OH)2 5.氯化物:氯化钠、氯化镁、氯化钙、氯化铜、氯化锌、氯化铝、氯化铁、氯化亚铁NaCl、MgCl2、CaCl2、CuCl2、ZnCl2、AlCl3、FeCl3、FeCl2氯化银:AgCl氯化钡:BaCl26.硝酸盐:硝酸钾、硝酸镁、硝酸钙、硝酸铜、硝酸银、硝酸铝、硝酸铁、硝酸汞KNO3、Mg(NO3)2、Ca(NO3)2、Cu(NO3)2、AgNO3、Al(NO3)3、Fe(NO3)3、Hg(NO3)2 7.硫酸盐:硫酸钠、硫酸镁、硫酸钙、硫酸铜、硫酸锌、硫酸铝、硫酸铁、硫酸亚铁Na2SO4、MgSO4、CaSO4、CuSO4、ZnSO4、Al2(SO4)3、Fe2(SO4)3、FeSO4 8.碳酸盐:碳酸钠、碳酸镁、碳酸钙、碳酸铜、碳酸锌、碳酸钡、碱式碳酸铜Na2CO3、MgCO3、CaCO3、CuCO3、ZnCO3、BaCO3、Cu2(OH)2CO39.其它:氯酸钾、高锰酸钾、锰酸钾、甲烷、酒精、氨气、氯化氢、硫化氢KClO3、KMnO4、K2MnO4、CH4、C2H5OH、NH3、HCl、H2S亚硫酸钠:Na2SO3、亚硫酸钡:BaSO3、硅酸钠:Na2SiO3硅酸钙:CaSiO3次氯酸钠:NaClO 次氯酸钙:Ca(ClO)2硫氰化钾:KSCN 偏铝酸钠:NaAlO2碘酸钾:KIO3亚硫酸氢钠:NaHSO3碳酸氢钠:NaHCO3碳酸氢钙:Ca(HCO3)2碳酸氢胺:NH4HCO3乙酸钠:CH3COONa 乙酸钙:(CH3COO)2Ca 硫化钠:Na2S 硫化钾:K2S 草酸钙:CaC2O4。
下列金属离子氧化性排行

下列金属离子氧化性排行
《下列金属离子氧化性排行》
金属离子氧化性是指金属离子在给定温度下可以被氧化的能力。
根据金属离子的氧化性,可以将它们按照从强到弱的顺序排列。
下面是一些常见金属离子的氧化性排行:
1、钾离子(K+):最强;
2、铜离子(Cu2+):次之;
3、铝离子(Al3+):稍弱;
4、铁离子(Fe2+):更弱;
5、锌离子(Zn2+):最弱。
从上面的排行中可以看出,钾离子的氧化性最强,锌离子的氧化性最弱。
这是因为各种金属离子的氧化性受其电子结构和电负性的影响,钾离子具有最高的电负性,因此其氧化性最强;而锌离子具有最低的电负性,因此其氧化性最弱。
从上面的排行可以看出,金属离子的氧化性从强到弱依次是:钾离子(K+)、铜离子(Cu2+)、铝离子(Al3+)、铁离子(Fe2+)和锌离子(Zn2+)。
常见的金属离子的颜色
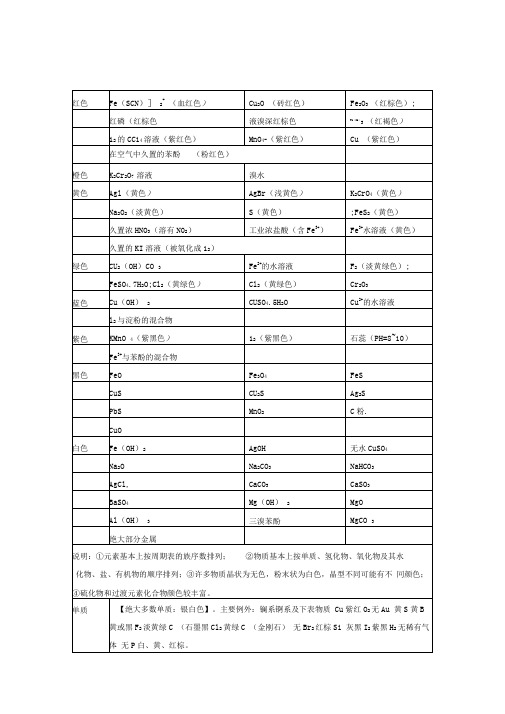
【LiH 等金属氢化物:白】NH 3等非金属氢化物:无Cl0 2黄大多数主族金属的氧化物:白主要例外:Na 2O 2浅黄PbO 黄K 20黄Pb 3O 4红K 2O 2橙Rb 20亮黄 Rb 2O 2棕Cs 20橙红 CS 2O 2黄 大多数过渡元素 氧化物有颜色 MnO 绿CuO 黑MnO 2黑Ag 2O 棕黑FeO 黑ZnO 白Fe 3O 4黑 Hg 2O 黑Fe 2O 3红棕 HgO 红或黄 Cu 2O 红 V 2O 5橙黄Fe (OH )3红褐HNO 2溶液亮蓝 Cu (OH ) 2蓝Hg (OH ) 2桔红黄 Ag 2S 黑 MnS 浅红 CdS 黄FeS 黑棕 SnS 棕FeS 2黄Sb 2S 3黑或橙红 CoS 黑 HgS 红 NiS 黑 PbS 黑 CuS 、CU 2S 黑 Bi 2S 3 黑 FeCl 3 6H 2O 棕黄 Na 3P 红FeSO 4 9H 2O 蓝绿 NaBiO 3 黄 Fe 2 (SO 4)3 9H 2O 棕黄 MnCl 2 粉红 Fe 3C 灰 MnSO 4 淡红 FeC03 灰 Ag 2CO 3 黄 Fe (SCN ) 3 暗红 Ag 3PO 4 黄 CuCl 2 棕黄 AgF 黄 CuCl 2 •7H 2O 蓝绿 AgCl 白 CuSO 4 白 AgBr 浅黄 CuSO 4 5H 2O 蓝 AgI黄C U 2(0H ) 2CO 3暗绿 盐溶液中离子特色:NO 2-浅黄Cu 2+或[Cu (H 2O )4]2+蓝MnO 4-紫红[CuCl 4]2-黄 MnO 42-绿[Cu (NH 3) 4]2+深蓝 Cr 2O 72-橙红Fe 2+浅绿CrO 42-黄Fe 3+棕黄非金属互化物 PCI 3无XeF 2、XeF 4、XeF 6无PCl 5浅黄氯水 黄绿CCl 4无 溴水 黄一橙CS 2无 碘水 黄褐SiC 无或黑 溴的有机溶液 橙红一红棕SiF 4无I 2的有机溶液 紫红Li 紫红Ca 砖红Na 黄Sr 洋红K 浅紫(通过蓝色钴玻璃)Ba 黄绿Rb 紫Cu绿稀有气体放电颜色 He 粉红Ne 鲜红Ar 紫氢化物 氧化物【大多数非金属氧化物:无】主要例外:N02棕红N 2O 5和P 205白N 2O 3暗蓝氧化物【大多数:白色或无色 其中酸:无色为主 碱:白色为主】主要例外: CsOH 亮的水化【大多数白色或无色】主要例外:as 棕黄 CuFeS 2 黄 KHS 黄 ZnS 白 AI 2S 3其它甲基橙橙 C X H Y (烃)、C X H Y O Z 无 (有些固体白色) 石蕊试液紫大多数卤 代烃 无(有些固体白色) 石蕊试纸蓝或红果糖 无石蕊遇酸变红葡萄糖 白石蕊遇碱变蓝蔗糖无酚酞 无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓 HNO 3变黄 纤维素 白I 2遇淀粉变蓝 TNT 淡黄 Fe 3+遇酚酞溶焰色反常见的金属离子的说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧 化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白 色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
离子符号

离子符号
离子符号:在元素符号右上角表示出离子所带正、负电荷数的符号。
例如,钠原子失去一个电子后成为带一个单位正电荷的钠离子用“Na+”表示。
硫原子获得二个电子后带元素符号:统一采取该元素的拉丁文名称第一个字母来表示元素的符号。
(往往正负电的数子写在正负号的前面)
1、常见离子符号:
钾离子 K+ 钙离子 Ca2+ 钠离子 Na+ 镁离子 Mg2+ 铝离子 Al3+
锌离子 Zn2+ 铁离子 Fe3+ 亚铁离子Fe2+ 氢离子 H+ 铜离子 Cu2+
汞离子 Hg2+ 银离子 Ag+ 钡离子 Ba2+ 氧离子 O2- 氯离子 Cl-
硫酸根离子 SO42- 氢氧根 OH- 氯酸根 ClO3- 硝酸根 NO3- 碳酸根CO32- 铵根 NH4+
2、常见的金属离子有:
锂离子:Li+ 钾离子:K+ 钠离子:Na+
钙离子:Ca2+
镁离子:Mg2+ 钡离子:Ba2+ 铝离子:Al3+
锌离子:Zn2+
铁离子:Fe3+ 亚铁离子:Fe2+ 铜离子:Cu2+
亚铜离子:Cu+
银离子:Ag+ 汞离子:Hg2+
3、常见的非金属离子有:
氟离子:F- 氯离子:Cl- 溴离子:Br-
碘离子:I- 硫离子:S 2- 氢离子:H+
4、常见的离子团:
碳酸根:CO3 2- 硫酸根:SO4 2- 硝酸根:NO3- 氢氧根:OH- 磷酸根:PO4 3- 碳酸氢根:HCO3- 亚硫酸根:SO3 2-
硫酸氢根:HSO4- 亚硫酸氢根:HSO3- 醋酸根:CH3COOH-
次氯酸根:ClO- 硅酸根:SiO3 2- 偏铝酸根:AlO2 -。
常见离子的化学性质总结

常见离子的化学性质总结一、钠离子(Na+)钠离子是常见的有机及无机化合物中的主要阳离子之一。
它的化学性质主要表现为:1. 钠离子具有很强的氧化性,常与氧化剂发生反应,如与氯气反应生成氯化钠。
2. 钠离子可与酸反应生成相应的盐类,如与硫酸反应生成硫酸钠。
3. 钠离子与水反应放出大量热并发生剧烈的氢气生成,产生强碱性溶液。
二、铜离子(Cu2+)铜离子是一种重要的过渡金属离子,广泛存在于自然界中。
它的化学性质包括:1. 铜离子具有氧化性,可以氧化一些易被氧化的物质。
2. 在一些条件下,铜离子可以被还原为铜金属,如与锌发生置换反应生成锌离子和铜金属。
3. 铜离子与氨反应生成蓝色的配合物,如氰化铜配合物。
三、氯离子(Cl-)氯离子是一种常见的阴离子,也是盐类化合物中最常见的一种。
它的化学性质主要表现为:1. 氯离子具有较强的还原性,常与容易被氧化的物质发生反应,如与二氧化锰发生反应生成氯气和锰离子。
2. 氯离子可与银离子反应生成白色的氯化银沉淀。
3. 氯离子溶于水时会形成氯水,具有杀菌消毒的作用。
四、铁离子(Fe3+)铁离子是一种常见的过渡金属离子,广泛存在于自然界中。
它的化学性质包括:1. 铁离子具有较强的氧化性,可以氧化一些易被氧化的物质。
2. 铁离子可与硫氰酸盐反应形成红色的配合物。
3. 铁离子可与酸反应生成相应的盐类,如与硫酸反应生成硫酸亚铁。
五、氢氧根离子(OH-)氢氧根离子是一种常见的阴离子,它常与阳离子形成盐类。
它的化学性质主要表现为:1. 氢氧根离子具有碱性,它能与酸反应生成相应的盐和水。
2. 氢氧根离子可参与一些置换反应,如与铜离子反应生成氢氧化铜沉淀。
3. 氢氧根离子可溶解在水中形成氢氧化物,使水的pH值增大。
综上所述,常见离子具有各自独特的化学性质,包括氧化性、还原性、酸性、碱性等。
它们在不同的化学反应中起着重要的作用,对于理解和应用化学知识具有重要意义。
常见的离子符号,化学式

2.酸: 盐酸HCl 硫酸 H2SO4 硝酸 HNO3 碳酸 H2CO3 亚硫酸 H2SO3 醋酸 CH3COOH 3.碱 氢氧化钠 氢氧化钙 氢氧化铜 氢氧化铁
NaOH Ca(OH)2 Cu(OH)2 Fe(OH)3 氢氧化钾 氢氧化钡 氢氧化镁 KOH Ba(OH)2 Mg(OH)2
4.盐
硫酸亚铁
氯化铁 氯化钡 氯化亚
AlCl3
c.碳酸盐
碳酸钙
CaCO3
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
Байду номын сангаас
碳酸钡
BaCO3
碳酸钾
K2CO3
碳酸氢铵
NH4HCO3
d.硝酸盐
硝酸银 硝酸钠 硝酸铜 硝酸钡
AgNO3 NaNO3 Cu(NO3)2 Ba(NO3)2 硝酸钾 硝酸铵 硝酸镁 硝酸铝
KNO3 NH4NO3 硝酸铁 Mg(NO3)2 Al(NO3)3
常见的离子符号
氢氧根离子 硫酸根离子、 硝酸根离子 OHSO42- 、 NO3-、
常见物质的化学式
一.单质 1.金属单质: 钾 K 钙 Ca 钠 Na 镁 Mg 铝Al 锌 Zn 铁Fe 锡 Sn 铅 Pb 铜 Cu 汞Hg 银 Ag 铂 Pt 金Au 2、稀有气体:氦气 He 氖气 Ne 氩气Ar 3、固态非金属单质: 碳 C 硅 Si 硫S 磷 P 4、气态(液态)非金属单质: 氢气H2 氧气 O2 氮气 N2 氯气 Cl2 溴Br2
硝酸亚铁
Fe(NO3)3 Fe(NO3)2
钾盐: 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾KClO3
二.化合物 1.氧化物:
水 H2O 双氧水H202 二氧化碳 CO2 一 氧化碳 CO 二氧化硫SO2 二氧化氮 NO2 二氧化硅SiO2 五氧化二磷 P2O5 氧化 钾K2O 氧化钙 CaO 氧化钠 Na2O 氧化 镁 MgO 氧化锌ZnO 氧化亚铁FeO 四 氧化三铁Fe3O4 氧化铜 CuO 氧化亚铜 Cu2O氧化汞 HgO 二氧化锰MnO2 氧化铁 (又叫三氧化二铁) Fe2O3 氧化铝(又叫 三氧化二铝)Al2O3
金属离子及其对生物体的影响

金属离子及其对生物体的影响金属离子是指金属元素失去电子后形成的带电离子,常见的金属离子如铁离子、铜离子、锌离子、镁离子等。
这些金属离子在生物体内存在着重要的生物学功能。
但是,金属离子在某些情况下也会对生物体产生负面影响。
1. 金属离子的生物学功能1.1 铁离子的作用铁是人体必需的微量元素,是血红蛋白和肌红蛋白的重要组成部分。
铁离子参与了氧气在血液中的输送,同时也参与了许多生化反应,如细胞呼吸和DNA合成等。
1.2 锌离子的作用锌离子是体内许多酶的重要组成部分,同时也参与了许多生化反应,如DNA合成、蛋白质合成以及免疫反应等。
1.3 铜离子的作用铜离子参与了氧气在细胞中的利用,同时也参与了免疫系统的正常功能和胆色素的合成等。
2. 金属离子对生物体的影响2.1 金属离子的毒性在某些情况下,金属离子会对生物体产生毒性。
例如,铅离子会累积在人体内,影响神经系统的正常功能,导致儿童智力发育受到影响;镉离子会在体内造成肝和肾等多个器官的损害,甚至会导致癌症等疾病。
2.2 金属离子的过多或过少在体内,金属离子的存在需要一个平衡状态。
如果某一种金属离子存在于过多或过少的状态,就会对生物体产生影响。
例如,过多的铁离子会导致血红蛋白病或铁过载;过少的铁离子会导致贫血等疾病。
3. 检测金属离子的方法现代检测技术使得检测金属离子成为可能。
例如,原子吸收光谱法可以用来检测体内铜、铁、锌、镉等金属离子的浓度。
同时,检测也可以通过实验室技术,如生物传感器技术等,快速、准确地进行。
4. 金属离子的应用金属离子在医学、生物学和化学等领域有广泛的应用。
例如,铁离子可以用于治疗贫血;锌离子可以用于提高免疫力和增强抗氧化能力;铜离子可以用于治疗某些病症和杀灭细菌等。
总体而言,金属离子对生物体有着重要的功能,但是在某些情况下也会对生物体产生负面影响。
因此,在应用金属离子时,需要进行严格的检测和控制,以确保其安全性和有效性。
金属阳离子

金属阳离子金属阳离子指的是以某种金属元素为中心原子,周围结合有特定数量的其他原子或分子的原子组合,能够构成化合物的结构单位。
它具有一定的化学性质和功能性特征。
常见的金属阳离子包括铵离子(NH4+)、氢氧根离子(H3O+)、硫酸根离子(HSO4-)、硝酸根离子(NO3-)等。
金属阳离子可以分为氢化物离子和溶解性离子两大类。
氢化物离子是由金属原子和氢原子组成的离子,又称金属氢化物,例如碳酸根离子(HCO3-)、氢氧根离子(H2O2)等。
它们的结构可以用共价键的形式表示,即金属原子的外层电子与氢原子的电子结合。
由氢化物离子可以形成的溶液具有单质离子行为,能够发生电离反应,产生带正电荷的阳离子和带负电荷的阴离子。
溶解性离子是由金属原子与其他原子或分子结合而成的金属阳离子,例如硝酸根离子(NO3-)、硫酸根离子(HSO4-)等。
它们可以用共价键(covalent bond)和离子键(ionic bond)的形式表示,即金属原子的外层电子和其他近原子的电子结合。
与氢化物阳离子相比,溶解性离子具有更高的溶解度和电荷守恒,可以发生复分解反应,释放出更多阳离子和阴离子,从而生成更容易溶解的组合物。
金属阳离子的性质不仅取决于其结构,还取决于金属中心原子的质子数。
质子数越高,离子的电荷就越大,离子的化学活性也越高。
例如,铵离子的质子数是+1,而氢氧根离子的质子数是+2,因此氢氧根离子的电子容量要大于铵离子,这也使得氢氧根离子比铵离子更易溶解,更易发生化学反应。
由于金属阳离子的多样性,它们在化学反应中扮演着重要的角色,并能够解决许多重大的科学问题。
例如,金属阳离子可以用来制备各种催化剂,用于燃料电池和太阳能电池中,从而提高电池的效率。
此外,它们还可以用于治疗某些疾病,如高血压、贫血、心梗等疾病。
因此,金属阳离子不仅对化学反应有着重要的作用,对科学和技术发展也有着不可思议的贡献。
综上所述,金属阳离子是一类以金属元素为中心原子的离子,可以分为氢化物离子和溶解性离子两大类,它们的结构可以用共价键和离子键的形式表示,金属阳离子的性质取决于其结构以及金属中心原子的质子数,它们在化学反应中扮演着重要的角色,能够解决许多重大的科学问题,从而对科学和技术发展有着不可思议的贡献。
常见的金属离子的颜色

常见的金属离子的颜色1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化成I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8~10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
一、单质绝大多数单质:银白色。
主要例外:镧系锕系及下表物质Cu 紫红O2无Au 黄S 黄B 黄或黑F2淡黄绿C(石墨黑Cl2黄绿C(金刚石)无Br2红棕Si 灰黑I2紫黑H2无稀有气体无P 白、黄、红棕。
二、氢化物LiH等金属氢化物:白NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外:NO2棕红N2O5和P2O5白N2O3暗蓝ClO2黄大多数主族金属的氧化物:白主要例外:Na2O2浅黄PbO 黄K2O 黄Pb3O4红K2O2橙Rb2O 亮黄Rb2O2棕Cs2O 橙红Cs2O2黄大多数过渡元素氧化物有颜色MnO 绿CuO 黑MnO2黑Ag2O 棕黑FeO 黑ZnO 白Fe3O4黑Hg2O 黑Fe2O3红棕HgO 红或黄Cu2O 红V2O5橙四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外:CsOH 亮黄Fe(OH)3红褐HNO2溶液亮蓝Cu(OH)2 蓝Hg(OH)2桔红五、盐大多数白色或无色主要例外:K2S 棕黄CuFeS2黄KHS 黄ZnS 白Al2S3黄Ag2S 黑MnS 浅红CdS 黄FeS 黑棕SnS 棕FeS2黄Sb2S3黑或橙红CoS 黑HgS 红NiS 黑PbS 黑CuS、Cu2S 黑Bi2S3 黑FeCl3·6H2O 棕黄Na3P 红FeSO4·9H2O 蓝绿NaBiO3黄Fe2(SO4)3·9H2O 棕黄MnCl2粉红Fe3C 灰MnSO4淡红FeCO3灰Ag2CO3黄Fe(SCN)3暗红Ag3PO4黄CuCl2棕黄AgF 黄CuCl2·7H2O 蓝绿AgCl 白CuSO4白AgBr 浅黄CuSO4·5H2O 蓝AgI 黄Cu2(OH)2CO3 暗绿盐溶液中离子特色:NO2-浅黄Cu2+或[Cu(H2O)4]2+蓝MnO4-紫红[CuCl4]2-黄MnO42-绿[Cu(NH3)4]2+深蓝Cr2O72-橙红Fe2+浅绿CrO42-黄Fe3+棕黄非金属互化物PCl3无XeF2、XeF4、XeF6 无PCl5浅黄氯水黄绿CCl4无溴水黄—橙CS2无碘水黄褐SiC 无或黑溴的有机溶液橙红—红棕SiF4无I2的有机溶液紫红六.其它甲基橙橙CXHY(烃)、CXHYOZ 无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白I2遇淀粉变蓝TNT 淡黄Fe3+遇酚酞溶液紫焰色反应Li 紫红Ca 砖红Na 黄Sr 洋红K 浅紫(通过蓝色钴玻璃)Ba黄绿Rb 紫Cu 绿稀有气体放电颜色He 粉红Ne 鲜红Ar 紫。
初中化学常见的离子符号(全)

初中化学常见的离子符号(全)
初中化学中常见的离子符号有很多,其中金属离子和非金属离子都有。
金属离子包括带一个、两个和三个单位正电荷的离子,例如Li+、K+、Na+、Ag+、Cu+、Ca2+、Mg2+、
Ba2+、Zn2+、Fe2+和Cu2+。
非金属离子包括带一个和两个单位负电荷的离子,例如F—、Cl—、Br—、I—、S2—和O2—,以及带一个单位正电荷的氢离子H+。
此外,还有一些常见的
原子团,也称为酸根离子,例如NO3—、OH—、ClO3—、
PO43—、HCO3—、MnO4—、CO32—、SO42—、SO32—和MnO42—,除了NH4+之外。
需要注意的是,离子不可能单独存在,必须有阴离子和阳离子共同存在,构成离子化合物。
离子所带的电荷数与其在化合物中元素表现的化合价数值和正负一致,例如硫离子S2—
中S的化合价为—2.离子团所带的电荷数与其整体表现化合价
数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于
其中N显—3价,H显+1价决定的。
化学中常用的化合价口诀是:单价元素单价取,多价元素多价配。
金属离子沉淀ph范围

金属离子沉淀ph范围
金属离子在溶液中的沉淀pH范围取决于金属离子的溶解度产物和溶液的条件。
不同金属具有不同的沉淀pH范围。
以下是一些常见金属离子的沉淀pH范围的示例:
1.银离子(Ag+):银离子的沉淀pH范围为3.5-5.5之间,主
要以AgCl和Ag2S形式沉淀。
2.铜离子(Cu2+):在中性或碱性条件下,铜离子主要以
Cu(OH)2的形式沉淀。
因此,铜离子的沉淀pH范围较宽,大约在8.0-10.5之间。
3.铁离子(Fe2+和Fe3+):铁离子的沉淀pH范围取决于其
氧化态。
Fe2+在中性或碱性条件下以Fe(OH)2的形式沉淀,其沉淀pH范围约为6.0-9.0。
Fe3+则在较低的pH值下以
Fe(OH)3或Fe2O3的形式沉淀,其沉淀pH范围约为2.0-
3.5。
4.镉离子(Cd2+):镉离子在碱性条件下主要以Cd(OH)2的
形式沉淀。
沉淀pH范围约为9.0-13.0之间。
需要注意的是,以上是简要介绍常见金属离子的沉淀pH范围,实际情况受到多种因素的影响,如金属离子的浓度、络合剂的存在以及其他离子的相互作用等。
因此,在实际实验中,应详细研究特定金属离子的溶解度产物和具体条件下的沉淀pH范围。
水中的金属离子含量标准

水中的金属离子含量标准水是人类生活中不可或缺的重要资源,而水质的安全性直接关系到人们的健康和生活质量。
水中金属离子的含量是衡量水质的重要指标之一,不同金属离子的含量标准也是保障水质安全的重要依据。
本文将就水中的金属离子含量标准进行详细介绍。
首先,我们需要了解什么是金属离子。
金属离子是指金属原子失去一个或多个电子而形成的带电离子。
在水中,常见的金属离子包括铁离子、锰离子、铜离子、镍离子等。
这些金属离子的存在对水质和生态环境都有一定的影响,因此需要对其含量进行严格控制。
针对不同金属离子,国家和国际上都有相应的标准进行规范。
以中国为例,中国《地表水环境质量标准》(GB 3838-2002)规定了水中重金属离子的限量标准。
其中,对于铁离子的限量标准为0.3mg/L,对于锰离子的限量标准为0.1mg/L,对于铜离子的限量标准为0.05mg/L,对于镍离子的限量标准为0.02mg/L。
这些标准的制定是基于对金属离子对人体健康和环境的影响进行了充分的科学研究和评估,是保障水质安全的重要依据。
除了国家标准外,国际上也有一些组织和机构对水中金属离子含量进行了规范。
例如,世界卫生组织(WHO)和美国环境保护局(EPA)都对水中金属离子的安全含量进行了规定。
这些国际标准通常是参考国家标准的基础上,结合全球环境和健康情况而制定的,对于跨国企业和国际合作具有重要意义。
在实际水质监测和管理中,对水中金属离子含量的监测和控制是非常重要的。
只有严格按照相关标准进行监测和管理,才能有效地保障人们饮用水的安全,保护生态环境的健康。
因此,各级环保部门和相关企业都应当高度重视水中金属离子含量的监测工作,确保水质安全。
综上所述,水中金属离子含量标准是保障水质安全的重要依据,国家和国际上都有相应的标准进行规范。
对于不同金属离子,其含量标准也有所不同,需要根据实际情况进行严格控制和监测。
只有做好水质监测和管理工作,才能有效地保障人们的健康和生活质量。
亚铁离子,钴离子,镍离子

亚铁离子,钴离子,镍离子
亚铁离子(Fe^2+)、钴离子(Co^2+)和镍离子(Ni^2+)是三种常见的金属离子,它们具有以下特点:
亚铁离子:亚铁离子通常呈现出绿色或浅绿色。
它在生物化学和环境科学中具有重要意义,例如在植物的光合作用中起到关键作用。
亚铁离子也常用于补铁剂和一些冶金过程中。
钴离子:钴离子的颜色可以是粉红色或蓝色。
它在电池、催化剂和磁性材料等领域有广泛应用。
钴离子还与人体的维生素B12 代谢有关。
镍离子:镍离子一般为绿色。
它在不锈钢制造、电镀和催化剂等方面有重要用途。
镍离子也存在于一些生物体内,但过量的镍摄入可能对健康产生负面影响。
这些离子的化学性质和用途取决于它们的化合价、配位环境以及与其他化合物的相互作用。
它们在化学、材料科学、生物学等领域都有特定的研究和应用。
初中化学常见离子符号

初中化学常见的离子符号(一)常见的金属离子:锂离子:Li+ 钾离子:K+ 钠离子:Na+ 钙离子:Ca2+ 镁离子:Mg2+ 钡离子:Ba2+ 铝离子:Al3+ 锌离子:Zn2+ 铁离子:Fe3+ 亚铁离子:Fe2+ 铜离子:Cu2+ 亚铜离子:Cu+银离子:Ag+常见的非金属离子:氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—硫离子:S2—氧离子 O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子 ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+说明:1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S的化合价为—23、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH 4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
一、默写。
(每空1分,共15分)1、关关雎鸠,在河之洲。
,。
2、求之不得,。
悠哉悠哉。
3、,。
所谓伊人,在水一方。
4、溯洄从之,。
,宛在水中坻。
5、李贺《雁门太守行》一诗中分别从听觉和视觉两方面铺写阴寒惨烈的战地气氛的两句是,。
6、,受上赏;,受中赏;,,受下赏。
二、课内文言文阅读(70分)(一)生于忧患,死于安乐(16分)舜发于畎亩之中,傅说举于版筑之中,胶鬲举于鱼盐之中,管夷吾举于士,孙叔敖举于海,百里奚举于市。
常见的金属离子的颜色
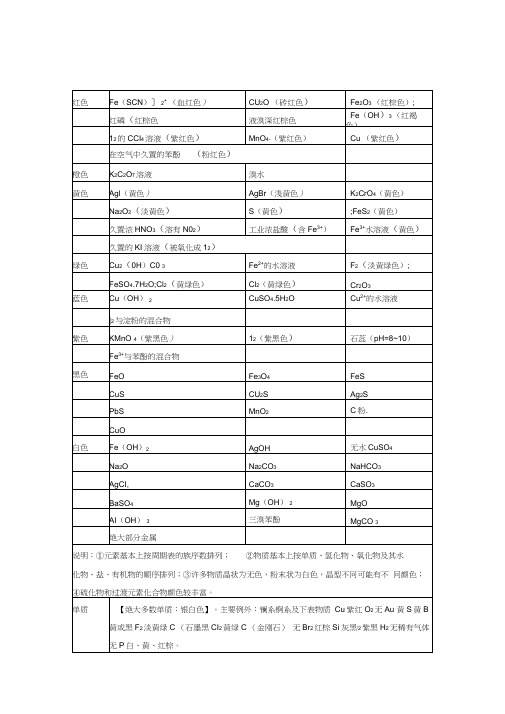
NaHCO3
AgCI,
CaCO3
CaSO3
BaSO4
Mg(OH)2
MgO
AI(OH)3
三溴苯酚
MgCO3
绝大部分金属
说明:①元素基本上按周期表的族序数排列;②物质基本上按单质、氢化物、氧 化物及其水化物、盐、有机物的顺序排列;③许多物质晶状为无色,粉末状为白 色,晶型不同可能有不同颜色;④硫化物和过渡元素化合物颜色较丰富。
S(黄色)
;FeS2(黄色)
久置浓HNO3(溶有N02)
工业浓盐酸(含Fe3+)
Fe3+水溶液(黄色)
久置的KI溶液(被氧化成12)
绿色
Cu2(0H)C03
Fe2+的水溶液
F2(淡黄绿色);
FeSO4.7H2O;Cl2(黄绿色)
Cl2(黄绿色)
Cr2O3
蓝色
Cu(OH)2
CuSO4.5H2O
Cu2+的水溶液
Hg2O黑Fe2O3红棕HgO红或黄Cu2O红V2O5橙
氧化物
的水化
物
【大多数:白色或无色 其中酸:无色为主 碱:白色为主】主要例外:CsOH亮
黄Fe(OH)3红褐HNO2溶液亮蓝Cu(OH)2蓝Hg(OH)2桔红
盐
【大多数白色或无色】主要例外:as棕黄CuFeS2黄KHS黄ZnS白AI2S3
黄Ag2S黑MnS浅红CdS黄FeS黑棕SnS棕FeS2黄Sb2S3黑或橙红CoS黑HgS红NiS黑PbS黑CuS、CU2S黑Bi2S3黑FeCl36H2O棕黄Na3P红FeSO49H2O蓝绿NaBiO3黄Fe2(SO4)39H2O棕黄MnCl2粉红FesC灰MnSO4淡红FeCO3灰Ag2CO3黄Fe(SCN)3暗红Ag3PO4黄CuCl2棕黄AgF黄CuCl27H2O蓝绿AgCl白CuSO4白AgBr浅黄CuSO45H2O蓝AgI黄CU2(OH)2CO3暗绿 盐溶液中离子特色:NO2-浅黄Cu2+或[Cu(H2O)4]2+蓝
初中化学常见离子符号

初中化学常见的离子符号常见的金属离子:锂离子:Li+钾离子:K+钠离子:Na+钙离子:Ca2+镁离子:Mg2+钡离子:B a2+铝离子:Al3+锌离子:Zn2+铁离子:F e3+亚铁离子:Fe2+铜离子:Cu2+亚铜离子:Cu+银离子:Ag+常见的非金属离子:氟离子:F—氯离子:Cl —溴离子:Br—碘离子:I—硫离子:S2—氧离子O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH —氯酸根离子ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+说明:1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S 的化合价为—2 3、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显一3价,H显+1 价决定的。
常用化合价口诀:一价氢氯(-1 )钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
一、默写。
(每空1分,共15分)1、关关雎鸠,在河之洲。
,。
2、求之不得,。
悠哉悠哉。
3、,。
所谓伊人,在水一方。
4、溯洄从之,。
,宛在水中坻。
5、李贺《雁门太守行》一诗中分别从听觉和视觉两方面铺写阴寒惨烈的战地气氛的两句是。
6、受上赏;内文言文阅读(70分),受中赏;(一)生于忧患,死于安乐(16分),受下赏。
二、课舜发于畎亩之中,傅说举于版筑之中,胶鬲举于鱼盐之中,管夷吾举于士,孙叔敖举于海,百里奚举于市。
故天将降大任于是人也,必先苦其心志,劳其筋骨,饿其体肤,空乏其身,行拂能乱其所为。
常见金属离子的

常见金属离子的常见金属离子列表1、铝离子(Al3+):铝离子是金属离子中最常见的一种,它以Al3+形式存在,结构为六角八面体,直径约为0.074nm。
这种常见的金属离子属于有机根离子。
它有一个正电荷,可以与水中各种分子结合,这也是它在水中可以很容易移动的原因。
2、铁离子(Fe2+):铁离子是另一种常见的金属离子,它也以Fe2+的形式存在,结构呈六角形,直径为0.063nm 。
它也有一个正电荷,相比于铝离子,它的结构更加紧凑,在水中的移动也比铝离子要快得多。
3、钾离子(K+):钾离子是金属离子中最常见的一种,它以K+形式存在,结构呈六面体,直径为0.138nm 。
它有一个正电荷,其变性率很低,几乎不能与水分子结合,因此在水中移动比较慢。
4、锂离子(Li+):锂离子是另一种常见的金属离子,它以Li+形式存在,结构呈六面体,直径为0.071nm 。
它是一种质量极小的金属离子,但具有很强的溶氧能力,可以有效的抑制水体中的细菌繁殖,因此常用于水处理过程。
5、铜离子(Cu2+):铜离子是金属离子中最常见的一种,它以Cu2+的形式存在,结构呈六方体,直径大约为0.064nm 。
它有一个正电荷,可以与水分子结合,而且它易溶解,因此能够有效地改善水的质量。
它也可以与有机物发生化学反应,从而被用作水处理剂。
6、钠离子(Na+):钠离子是另一种常见的金属离子,它以Na+形式存在,结构呈六方体,直径约为0.096nm 。
它也有一个正电荷,它的密度比其他金属离子都要高,因此在水中移动速度也比较快。
7、钙离子(Ca2+):钙离子是另一种常见的金属离子,它以Ca2+形式存在,结构呈正八面体,直径约为0.099nm 。
它是一种带有相对较大正电荷的金属离子,因此能够与溶液中的其他离子或分子结合,从而有效地改善水质。
以上就是金属离子的7种常见类型,它们的用途也不一样,但是它们的作用机理都是一样的,即由于它们都具有正电荷,所以它们能够将离子或分子从一处移动到另一处,从而实现对水的净化或调节。
