TLR及信号通路(Toll样受体及其信号转导)课件
先天性免疫信号通路

.
4
防御素的结构及其杀菌机制
.
5
2)溶菌酶
一种专门作用于致病微生物细胞壁的水解酶。它能有效地水解细 菌细胞壁的肽聚糖,其水解位点是N-乙酰胞壁酸(NAM)的1位碳 原子和N-乙酰葡萄糖胺(NAG)的4位碳原子间的β-1,4糖苷键, 结果使细菌细胞壁变得松弛,失去对细菌的保护作用,最后细菌溶解 死亡。
.
18
二、TLRs的活化和信号传导
.
19
.
20
三、NLRs的活化和信号传导
.
21
Hale Waihona Puke 四、RLRs的活化和信号传导
.
22
五、CLR受体的信号传导
C 型凝集素受体(CLR)是模式识别受体中一类重要的家族,具有一个或多 个C 型凝集素样结构域(C-type lectin-like domains,CTLDs),也即位于C 型凝集素受体上,含有序列同源的碳水化合物识别域(carbohydrate recognition domain, CRD)。
细胞因子局部效应全身效应il1激活血管内皮细胞淋巴细胞加速效应细胞穿越血管引起局部组织损伤发热产生il6tnf激活血管内皮细胞增加血管通透性更多的ig补体和细胞进入组织发热动员代谢产物引起休克激活的巨噬细胞分泌的细胞因子及其效应更多的igg补体和细胞进入组织休克il6激活淋巴细胞增加抗体产量发热诱导产生急性期蛋白il8作为趋化因子将中性粒细胞嗜碱性粒细胞和t细胞招募至炎症部位il12激活nk细胞诱导cd4t细胞分化成th1细胞4
视黄酸诱导基因(retinoic acid inducible gene-1,RIG-1)
黑色素瘤分化相关分子(MDA-5) 都有CARD(胱天蛋白酶招募结构域)
toll样受体信号通路

Toll 样受体(TLRs)是一个模式识别受体家族,它们在进化上高度保守,从线虫到哺乳动物都存在TLRs,目前在哺乳动物中已发现 12 个成员[1].TLRs 主要表达于抗原递呈细胞及一些上皮细胞,为玉型跨膜蛋白,胞外区具有富含亮氨酸的重复序列,能够特异识别病原微生物进化中保守的抗原分子———病原相关分子模式 (pathogen-associatedmolecular patterns, PAMPs)[2].为了有效地抵抗入侵的病原体,机体需要对多种 PAMPs产生适当的免疫应答,TLRs 可以通过识别 PAMPs诱发抵抗病原体的免疫反应.而且 TLRs 也参与识别有害的内源性物质.TLRs 的激活可诱导很强的免疫反应,有利于机体抵抗病原体感染或组织损伤,但是过度的免疫反应也会带来不利影响,如产生内毒素休克、自身免疫性疾病等.为了保证 TLRs 介导正确的免疫应答,机体存在精密的负调控机制,及时抑制 TLRs 信号,维持机体的免疫平衡[3]TLR 家族成员(TLR3 除外)诱导的炎症反应都经过一条经典的信号通路(图 1),该通路起始于TLRs的一段胞内保守序列———Toll/IL-1 受体同源区(Toll/IL-1 receptor homologousregion,TIR).TIR可激活胞内的信号介质———白介素 1 受体相关蛋白激酶(IL-1R associated kinase, IRAK) IRAK-1 和IRAK-4、肿瘤坏死因子受体相关因子 6(TNFR-associated factor 6, TRAF-6)、促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和 I资B激酶 (I资B kinase, I资K ),进而激活核因子资B(nuclear factor 资B,NF-资B),诱导炎症因子的表达.TLRs 信号通路上的许多接头蛋白都具有 TIR结构域:髓系分化因子 88(myeloid differentiationfactor 88, MyD88)、 MyD88- 接头蛋白相似物(MyD88-adaptor like,Mal)、含有 TIR 结构能诱导干扰素茁的接头分子 (TIR domain-containingadaptor inducing interferon茁,TRIF)、TRIF 相关接头分子(TRIF-related adaptor molecule,TRAM)和SARM (sterile 琢 and armadillo motif-containingprotein)[4].它们参与 TLRs 所介导的信号转导,其中 MyD88最重要,参与了除 TLR3 外所有 TLRs介导的信号转导.MyD88首先通过 TIR 与 TLRs 相结合,接着募集下游信号分子 IRAK-4,IRAK-4 磷酸化激活IRAK-1,随后活化 TRAF6.活化的 TRAF6具有泛素连接酶(E3)的活性,能够结合泛素结合酶(E2),进而泛素化降解 IKK-酌.这种泛素化降解可以活化TGF-茁激酶(TGF-茁activated kinase 1, TAK1) 和TAK1结合蛋白 (TAK1 binding protein,TAB1、TAB2、TAB3).活化的 TAK1 会催化 IKK-茁磷酸化,最终激活 NF-资B,促使炎症因子的表达.除了共同的 NF-资B 激活通路,不同的 TLRs 还存在着其特有的信号通路,一些 TLRs 具有募集 Mal、TRAM 和 TRIF 的作用.不同的接头分子在信号传导中发挥的作用不同[5],TRIF 在脂多糖(LPS)激活的 TLR4 途径和 Poly(I∶C)激活的 TLR3 途径中都起到了重要的作用,而 TRAM 仅在 TLR4 的途径中发挥作用.TLRs 的激活是一把双刃剑,它可以通过刺激先天性免疫应答和提高获得性免疫反应来保护机体,但是它所引起的持续性炎症反应也会对机体产生损伤,自身免疫、慢性炎症和感染性疾病都与它有一定关系.例如 LPS 持续刺激 TLR4 就可以引起严重的败血病和感染性休克,此外,类风湿性关节炎、慢性阻塞性肺心病、结肠炎、哮喘、心肌病、狼疮和动脉粥样硬化的发生也与 TLRs 的激活有关.因此 TLRs 的激活必须受到严格的负调控,以保持免疫系统的稳定.对于负调控机理的研究是近几年免疫学的热点,以下将介绍 TLRs 负调控的研究进展(图 1).。
Toll样受体

TLRs在肿瘤细胞的表达
• 研 究 表明,肿瘤细胞表达 TLRs ,并且 TLRs 信号有助于肿瘤的免疫逃逸和发展。 用 RT-PCR 筛选了不同组织来源的鼠源肿 瘤 细 胞株中 TLRs 的表达,包括 MC26 ( 肠 癌), 4T1( 乳腺癌 ) , RM1( 前列腺 癌 ) , B16( 黑色素瘤 ) , LLC1 (肺癌), 这 些 肿瘤细胞系都表达多种 TLRs 。一些 有 关 人胃癌细胞、前列腺癌TLR 能结合机体自 身产生的一些内源性分子 ( 即内源 性配体 ) 。免疫佐剂可增强抗肿瘤 免疫,其分子和细胞机制得到进一 步阐明 TLR 也在其中扮演重要角色。 由于肿瘤发展过程中可以产生一些 能被 TLR 识别的内源性配体,所以 TLR 在肿瘤免疫监视中可能发挥了 一定作用
• 定义1:果蝇Toll受体同源物,属固有免疫中的 模式识别受体(PRR)。胞外结构域由多个亮氨酸 重复序列组成,识别病原体相关分子模式;胞内 段为TIR结构域,参与启动信号转导。 • 定义2:果蝇Toll受体同源物。是一类细胞表面 和细胞内受体。可识别各种微生物产物,与配体 结合后可起始信号传递途径,因不同细胞而引起 不同反应。
Toll样受体的分布
TLRs分布的细胞多达20余种, 在对人类白细胞的研究中发现, TLR1能在包括单核细胞,多形核细 胞,T、B淋巴细胞及NK细胞等多种 细胞中表达,TLR2、TLR4、TLR5 只在髓源性细胞(如单核巨噬细胞) 上表达,而TLR3只特异性表达于树 突状细胞
Toll样受体的结构
Toll样受体在获得性免疫系统中作用
• 首先, Toll 样受体在获得性免疫中 的具有识别作用。机体最强的抗原 呈递细胞——树突细胞可表达 TLR 。 借助 TLR ,使树突细胞被活化而成熟, 提供获得性免疫的共刺激信号。因 此 TLR 是微生物成分引起树突细胞活 化的桥梁。
tlr信号转导原理

tlr信号转导原理引言:tlr信号转导是指Toll样受体(Toll-like receptor,TLR)家族在免疫系统中起到信号传导的重要作用。
TLR是一类跨膜受体,主要存在于免疫细胞表面,能够识别和结合到病原体的分子模式,并启动相应的免疫应答。
本文将介绍TLR的结构特点、信号转导机制以及其在免疫应答中的重要作用。
一、TLR的结构特点TLR是一类由多个跨膜蛋白组成的受体家族,目前已经发现了十多种不同的TLR。
这些TLR的结构特点有以下几个方面:1. 跨膜结构:TLR大部分由一个跨膜蛋白组成,跨膜区域具有保守的氨基酸序列。
2. 外显区域:TLR的外显区域分为N端和C端两部分,N端是TLR 家族的保守结构域,能够识别和结合到病原体的分子模式。
3. 受体配体:不同的TLR能够识别和结合到不同的病原体分子模式,如TLR2能够识别和结合到细菌的脂多糖,TLR3能够识别和结合到病毒的双链RNA等。
二、TLR的信号转导机制TLR的信号转导机制主要包括三个关键步骤:识别和结合、信号传导和免疫应答。
1. 识别和结合:TLR的外显区域能够识别和结合到病原体的分子模式,如细菌的脂多糖、病毒的双链RNA等。
2. 信号传导:识别和结合后,TLR能够激活下游信号分子,启动信号传导通路。
TLR主要通过两条信号传导通路进行信号转导:MyD88依赖通路和TRIF依赖通路。
a. MyD88依赖通路:大部分TLR通过MyD88依赖通路传递信号。
在这条通路中,TLR与MyD88蛋白结合,激活下游信号分子,最终激活核转录因子NF-κB和IRF,促进炎症因子和抗病毒因子的产生。
b. TRIF依赖通路:少数TLR通过TRIF依赖通路传递信号。
在这条通路中,TLR与TRIF蛋白结合,激活下游信号分子,最终激活IRF和NF-κB,促进抗病毒因子的产生。
3. 免疫应答:信号传导通路的激活会引起一系列的免疫应答,包括炎症反应、抗病毒应答和抗肿瘤应答等。
炎症相关的信号转导通路PPT精品课程课件讲义

一、介导炎症启动和炎细胞激活的模 式识别受体及其信号转导通路
Signalings mediated by pattern recognition
receptors activate inflammatory cells and
initiate inflammation
致炎因子总体上可分为两大类:
Toll-like receptors (TLRs, 膜受体)
清道夫受体(Scavenger Receptors, 膜受体)
C型凝集素(lectin ) receptors (CLRs,膜受体) RIG-I like receptors (RLRs,为胞质的RNA解旋酶) NOD-like receptors (NLRs; cytoplasmic sensors)
激活信号转导,促进转录,启动炎症反应 Figure 2.Initiation of Inflammation Usually Requires Signals from Both Microbes and Injured Tissue
(一)模式识别受体的分类 (Classes of pattern recognition receptors)
钙信号通路
激活磷脂酶A2(PLA2),产生花生四烯酸 及其衍生 物脂质炎症介质:
前列腺素( Prostaglandins, PGs)
白三烯(Leukotrienes, LTs) 血栓素(TXA2)
血小板激活因子(PAF)等。
LPS PMN
LPS TLR4 MyD88
Hale Waihona Puke IRAKTRAF6
PI3K
TAK-TAB-TAB2
for advanced glycation end products, RAGE)等
第四章 TLRs和免疫识别模式.ppt

图4.1 (A) IL-1R/TLR的超家族成员(包 括:哺乳动物、果蝇、植物和青蛙, 分别以蓝、红、绿和紫色表示)。所有 这些成员都含有保守的胞浆结构域, 亦即TIR结构域。亚组-1的成员:也就 是Ig亚组,都含有细胞外的Ig结构域, 并包括受体及其结合IL-1,IL-8的附件蛋 白,还有单独和T1/ST2结合的受体。 亚组-2,也就是LRR亚组,包括LPS (TLR- 4)的信号传递受体和革兰氏阳性 菌的分子受体,如肽聚糖和脂蛋白受 体(TLR-2)。一些植物的成员也属于该 亚组(用绿色表示)。接头分子亚组包括: MyD88、Mal和TRIF,该亚组专门是 作胞浆中的接头分子。MyD88是IL-1、 RI、IL-18R、TLR-2和TLR-4信号传递 接头分子,而Mal 则是TLR-2和TLR-4 信号传递的接头分子。 (B)TIR结构域 中的三个非常保守的区域(框1、框2和 框3),该图列出的是来自31个家族的 数据。其整个结构域大约200个氨基酸 残基,氨基酸数目在保守框之间可能
凝集素,细胞巨化病毒和单纯疱疹病毒的结构蛋白等。另外,原生动物,如 原虫枯氏锥虫、刚地弓形虫、硕大利什曼原虫和恶性疟原虫也含有TLR2的 配体,如GPI锚定物。
(3). TLR5
很多病原体都能运动,用鞭毛作为其运动的动力。鞭毛 的主要组成是鞭毛蛋白,它是一种TLR5重要的激活因子。 TLR5识别鞭毛蛋白的D1结构域,该结构域在多个不同的种 中都是共同的。上皮细胞的TLR5是在基底面一侧 (basolateral side,BL)表达的,因此鞭毛蛋白只有当生有鞭毛 的病原体跨过上皮入侵时才能识别。最近的报道证明有沙门 氏菌所产生的单体鞭毛蛋白在感染小肠上皮细胞时,不仅产 生了鞭毛相关的多聚体成分,而且直接激活宿主细胞,合成 和分泌了溶血磷脂(lysophospholipids)。
信号转导教学课件ppt

G蛋白偶联受体信号转导的通路
01
GPCR与配体结合后,引起G蛋白的活化,释放出GDP并替换为GTP,进而引起 下游效应分子的激活。
02
G蛋白可激活多种效应分子,如AC、PLC等,进而产生第二信使分子,如cAMP 和DAG,进一步调节细胞的生物学效应。
03
GPCR信号转导通路还包括抑制性通路和非抑制性通路,抑制性通路通过降低细 胞内cAMP水平来抑制细胞活动,而非抑制性通路则通过激活PLC并产生DAG和 IP3来促进细胞活动。
分类
根据结构和功能,细胞因子可分为白细胞介素(IL)、干扰素 (IFN)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)等。
细胞因子受体的结构与功能
结构
细胞因子受体是一类跨膜蛋白,由胞内区和胞外区组成,胞内区具有酪氨酸 激酶活性。
功能
细胞因子受体通过与相应配体结合,传递信号至细胞内,触发一系列生物学 反应,如增殖、分化、凋亡等。
磷酸化
激活的受体通过磷酸化修饰,进一 步激活下游信号分子。
酶联型受体信号转导的通路
MAPK通路
酶联型受体激活后,通过MAPK通路传递信号,引发细胞反应。
JAK-STAT通路
酶联型受体激活后,通过JAK-STAT通路传递信号,调节细胞增殖和分化。
04
细胞因子信号转导
细胞因子的定义与分类
定义
细胞因子是由免疫细胞和非免疫细胞产生的一类小分子可溶 性蛋白,具有调节免疫应答和炎症反应等多种生物学功能。
信号转导与药物研发
了解信号转导的机制有助于开发新的药物,针对异常的信号转导过程进行干预和 治疗。
06
信号转导研究方法
基因敲除与敲入技术
基因敲除技术
利用同源重组或转座子等技术,将特定基因从染色质中剔除 ,以研究基因功能。
toll样受体信号通路

Toll 样受体(TLRs)是一个模式识别受体家族,它们在进化上高度保守,从线虫到哺乳动物都存在TLRs,目前在哺乳动物中已发现 12 个成员[1].TLRs 主要表达于抗原递呈细胞及一些上皮细胞,为玉型跨膜蛋白,胞外区具有富含亮氨酸的重复序列,能够特异识别病原微生物进化中保守的抗原分子———病原相关分子模式 (pathogen-associatedmolecular patterns, PAMPs)[2].为了有效地抵抗入侵的病原体,机体需要对多种 PAMPs 产生适当的免疫应答,TLRs 可以通过识别 PAMPs 诱发抵抗病原体的免疫反应.而且 TLRs 也参与识别有害的内源性物质.TLRs 的激活可诱导很强的免疫反应,有利于机体抵抗病原体感染或组织损伤,但是过度的免疫反应也会带来不利影响,如产生内毒素休克、自身免疫性疾病等.为了保证 TLRs 介导正确的免疫应答,机体存在精密的负调控机制,及时抑制 TLRs 信号,维持机体的免疫平衡[3]TLR 家族成员(TLR3 除外)诱导的炎症反应都经过一条经典的信号通路(图 1),该通路起始于TLRs 的一段胞内保守序列———Toll/IL-1 受体同源区(Toll/IL-1 receptor homologous region,TIR).TIR可激活胞内的信号介质———白介素 1 受体相关蛋白激酶 (IL-1R associated kinase, IRAK) IRAK-1 和IRAK-4、肿瘤坏死因子受体相关因子 6(TNFR-associated factor 6, TRAF-6)、促分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和 I资B激酶 (I资B kinase, I资K ),进而激活核因子资B(nuclear factor 资B,NF-资B),诱导炎症因子的表达.TLRs 信号通路上的许多接头蛋白都具有 TIR结构域:髓系分化因子 88(myeloid differentiationfactor 88, MyD88)、MyD88- 接头蛋白相似物(MyD88-adaptor like,Mal)、含有 TIR 结构能诱导干扰素茁的接头分子 (TIR domain-containingadaptor inducing interferon 茁,TRIF)、TRIF 相关接头分子(TRIF-related adaptor molecule,TRAM)和SARM (sterile 琢 and armadillo motif-containingprotein)[4].它们参与 TLRs 所介导的信号转导,其中MyD88 最重要,参与了除 TLR3 外所有 TLRs介导的信号转导.MyD88 首先通过 TIR 与 TLRs 相结合,接着募集下游信号分子 IRAK-4,IRAK-4 磷酸化激活IRAK-1,随后活化 TRAF6.活化的 TRAF6 具有泛素连接酶(E3)的活性,能够结合泛素结合酶(E2),进而泛素化降解 IKK-酌.这种泛素化降解可以活化TGF-茁激酶(TGF-茁 activated kinase 1, TAK1) 和TAK1 结合蛋白 (TAK1 binding protein, TAB1、TAB2、TAB3).活化的 TAK1 会催化 IKK-茁磷酸化,最终激活 NF-资B,促使炎症因子的表达.除了共同的 NF-资B 激活通路,不同的 TLRs 还存在着其特有的信号通路,一些TLRs 具有募集 Mal、TRAM 和 TRIF 的作用.不同的接头分子在信号传导中发挥的作用不同[5],TRIF 在脂多糖(LPS)激活的 TLR4 途径和 Poly(I∶C)激活的 TLR3 途径中都起到了重要的作用,而 TRAM 仅在 TLR4 的途径中发挥作用.TLRs 的激活是一把双刃剑,它可以通过刺激先天性免疫应答和提高获得性免疫反应来保护机体,但是它所引起的持续性炎症反应也会对机体产生损伤,自身免疫、慢性炎症和感染性疾病都与它有一定关系.例如LPS 持续刺激TLR4 就可以引起严重的败血病和感染性休克,此外,类风湿性关节炎、慢性阻塞性肺心病、结肠炎、哮喘、心肌病、狼疮和动脉粥样硬化的发生也与 TLRs 的激活有关.因此 TLRs 的激活必须受到严格的负调控,以保持免疫系统的稳定.对于负调控机理的研究是近几年免疫学的热点,以下将介绍 TLRs 负调控的研究进展(图 1).。
Toll样受体_TLRs_的信号转导与免疫调节

生物化学与生物物理进展ProgressinBiochemistryandBiophysics,2006,33(9):820 ̄827www.pibb.ac.cn*国家自然科学基金资助项目(30470878,30570678).**通讯联系人.Tel:010-65296457,Fax:010-65296466E-mail:daishu@public.bta.net.cn收稿日期:2006-04-05,接受日期:2006-06-15天然免疫是机体免疫重要的组成部分,但是长期以来被认为是免疫应答的一种低等形式,不具有免疫特异性和免疫记忆的特征.随着对免疫系统的深入认识,特别是模式识别受体的发现,意识到天然免疫并不是简单地发挥非特异吞噬、清除作用,而是涉及复杂的抗原识别机制,与获得性免疫一样能够正确区分“自己”和“非己”,并且进一步调控获得性免疫.十几年前,免疫学家Janeway前瞻性地提出了模式识别理论,认为机体存在模式识别受体(patternrecognitionreceptor,PRR),特异地识别病原微生物进化中保守的抗原分子,即病原相关分子模式(pathogen-associatedmolecularpattern,PAMP),从而有效地监测病原微生物的入侵以及诱导机体免疫应答反应[1].Toll样受体(Toll-likereceptor,TLRs)就是一种模式识别受体,识别病原微生物进化中保守分子,如脂多糖(LPS)、肽聚糖、酵母多糖以及病原微生物的核酸等等.脂多糖受体TLR4是发现的第一个TLRs,目前已经陆续发现十余种TLRs.TLRs不仅在天然免疫系统中发挥重要的作用,而且还调节获得性免疫,是近年来免疫学一项重大进展.本文将综述这一领域的最新进展.1TLRs的发现Toll是在昆虫中发现的一个受体蛋白,参与昆虫胚胎发育时背腹极性的建立.进一步研究发现,Toll胞内区与哺乳动物中白介素-1受体(IL-1R)的胞内区具有很高的同源性,下游的信号转导通路通过NF-κB样因子发挥作用.IL-1R是免疫相关分子,而且昆虫中抗微生物的多肽基因上游大多有NF-κB样因子结合位点,是否Toll蛋白也参与昆虫的天然免疫反应调控?研究证实Toll参与昆虫的抗真菌免疫.真菌感染时果蝇Toll通路被激活,诱导大量的抗真菌肽Drosomycin,Toll的突变导致果蝇极易受到真菌的感染[2].哺乳动物存在Toll的同源分子,即TLRs.TLRs是一个受体家族,在人中已经发现10个成员,即TLR1~10,小鼠中不表达TLR10但发现了人没有的TLR11~13[3].2TLRs信号转导2.1TLRs的结构TLRs是Ⅰ型跨膜蛋白,胞外区均有19~25个富含亮氨酸的重复序列(LRRmotif)XLXXLXLXX(X代表任何氨基酸,L为亮氨酸),每个LRR由24~29个氨基酸组成,为β折叠-环-α螺旋的结构.整个LRR结构域形成一个马蹄型的结构,参与识别各种病原体.TLRs的胞内区含有Toll/IL-1受体同源区(Toll/IL-1receptorhomologousregion,Toll样受体(TLRs)的信号转导与免疫调节*王海坤韩代书**(中国医学科学院基础医学研究所,中国协和医科大学基础医学院细胞生物学系,北京100005)摘要Toll样受体(Toll-likereceptors,TLRs)是进化中比较保守的一个受体家族,至少包括10个成员.TLRs能特异地识别病原相关的分子模式(PAMPs),不仅在激活天然免疫中发挥重要的作用,而且还调节获得性免疫,是连接天然免疫和获得性免疫的桥梁.近年来,TLRs信号转导的研究,特别是在负调控研究领域,进展非常迅速.对TLRs信号通路新进展以及TLRs在抗感染免疫中的作用进行了综述.关键词Toll样受体,天然免疫,获得性免疫,信号转导学科分类号Q939.91综述与专论王海坤等:Toll样受体(TLRs)的信号转导与免疫调节2006;33(9)2.3TLRs信号通路TLRs/IL-1受体识别配体后,发生二聚化,进而发生构像变化募集下游的信号分子.下游的信号分子包括髓样分化因子88(MyD88)、IL-1相关蛋白激酶(IRAKs)、β转化生长因子激活的蛋白激酶(TAK1)、TAK1结合蛋白1和2(TAB1,TAB2)、肿瘤坏死因子受体活化因子6(TRAF6)、NF-κB抑制蛋白激酶(IKKs)以及NF-κB、AP-1、IRFs等Table1TLRsandtheirligands[4,5]表1TLRs的主要配体及其来源[4,5]受体配体配体来源TLR1三脂酰脂肽(triacyllipopeptides)细菌,分枝杆菌TLR2肽聚糖革兰氏阳性菌胞壁酸革兰氏阳性菌非典型的脂多糖(atypicalLPS)革兰氏阴性菌糖肌醇磷脂(glycoinositolphospholipids)锥形虫脂蛋白分枝杆菌酵母多糖(zymosan)真菌热休克蛋白70宿主TLR3双链RNA病毒PolyⅠ:C合成化合物TLR4LPS革兰氏阴性菌紫杉醇植物F蛋白呼吸道合胞病毒TLR5TLR6热休克蛋白60热休克蛋白70透明质酸的寡糖硫酸肝素的多糖成分纤粘连蛋白纤维蛋白原鞭毛二脂酰脂肽胞壁酸宿主宿主宿主宿主宿主宿主细菌支原体革兰氏阳性菌TLR7TLR8TLR9TLR10TLR11(小鼠)酵母多糖咪唑并喹啉(imidazoquinoline)洛索立宾(loxoribine)单链RNA咪唑并喹啉单链RNACpG-DNA未知尿路致病菌来源蛋白真菌合成化合物合成化合物病毒合成化合物病毒细菌或病毒未知尿路致病菌TLR12(小鼠)TLR13(小鼠)肌动蛋白抑制蛋白profilin样蛋白未知未知寄生虫未知未知TIR),其中包括3个保守盒(conservedboxes),参与信号转导.TIR是一保守结构,TLRs信号转导通路上的许多蛋白质,如MyD88、IL-1相关蛋白激酶(IRAK)、肿瘤坏死因子受体相关因子6(TRAF6)等都具有TIR结构域[4].2.2TLRs配体TLRs配体按来源可分为外源性和内源性配体(表1).外源性配体主要来自病原微生物,是微生物进化过程中的保守成分,如细菌的脂多糖、胞壁酸、肽聚糖以及细菌和病毒的核酸等.内源性配体来自宿主细胞,如热休克蛋白、细胞外基质降解成分等等,内源性配体在机体应激或是组织损伤时释放.821··生物化学与生物物理进展Prog.Biochem.Biophys.2006;33(9)Fig.1TLR-signalingpathways[8,9]图1TLRs信号通路[8,9]除TLR3外所有的TLRs都可以通过MyD88介导下游的信号转导,通过MyD88和IRAK家族相互作用而募集TRAF6,最终导致NF-κB,或MAPK如P42/44,或JNK的激活,此信号通路称为MyD88依赖信号通路,可诱导一些细胞因子如TNF及其他前炎症因子的产生.MyD88还可通过干扰素调节因子7(IRF7)诱导α干扰素的分泌.MyD88依赖信号通路中TLR2和TLR4信号通路需要特殊的接头分子MAL以帮助MyD88的募集.TLR3的信号通路是MyD88非依赖的信号通路,通过TRIF(Toll/IL-1domaincontainingadaptorproteininducingIFN-β)激活TBK1(TRAF-family-member-associatedNF-κBactivator-bindingkinase),进而促进IRF3的激活,诱导IFN-β等基因的表达.TRIF还可与RIP1(receptor-interactingprotein1)相互作用,激活IKK1-IKK2-NEMO复合体,进而激活NF-κB.TLR4的MyD88非依赖信号通路需要接头分子TRAM帮助募集TRIF.图中简写分别是:UEV1A和UBC13,泛素连接酶;AP1,激活因子1;BTK,Bruton酪氨酸激酶;ECSIT,Toll信号通路中进化保守的连接蛋白(evolutionarilyconservedsignalingintermediateinTollpathway);ISRE,干扰素刺激反应元件;MKK,MAPK激酶;TAB2,转化生长因子激活激酶(TAK)的结合蛋白2.MyD88MyD88MyD88MyD88MALMALBTKTRAMTRIFTRIFTLR5-TLR9TLR2-TLR1orTLR6TLR4TLR3TLR7-TLR8-TLR9MembraneCytosolIRAK4IRAK1IRAK2RIP1TRAF3IRAK1IRAK1TRAF6TBK1IKK!IRF3TBK1TRAF6UEV1AUBC13TAB2ECSITTAB1TAB1IKK1IKK2NEMOMEKMKK3/6MKK4/7p42/p44p38JNKp50p65I!BNF-!BELK1AP1NF-!BIRF3IRF7ISREIFN-"promoterNucleus(图1).MyD88分子是大多数TLRs信号转导中的接头分子,它的C端含TIR结构域与TLRs胞内区的TIR结合,N端通过死亡结构域(deathdomain,DD)募集下游含有DD结构域的信号分子使信号下传,可激活NF-κB和AP-1,控制炎症因子的分泌.TLR7/8/9还可通过MyD88-TRAF3通路激活干扰素调节因子7(IRF7),诱导Ⅰ型干扰素的分泌[6].MyD88的缺陷导致许多TLRs功能受损,包括TLR2、TLR5、TLR7和TLR9[3,7].不过,MyD88功能缺陷并不能完全终止所有的TLRs信号,如脂822··王海坤等:Toll样受体(TLRs)的信号转导与免疫调节2006;33(9)Table2NegativeregulatorsofTLRs[8]表2TLRs的负性调节[8]负调节分子受调节的TLRs可能的机制*sTLR2TLR2拮抗TLR2*sTLR4TLR4阻碍TLR4与MD2的相互作用RP105TLR4竞争TLR4的配体[12]MyD88s**TLR4拮抗MyD88IRAKMTLR4、9抑制IRAK1的磷酸化SOCS1TLR4、9抑制IRAK活性加速MAL的降解[13]NOD2TLR2抑制NF-κBPI3KTLR2、4、9抑制p38、JNK、NF-κBTOLLIPTLR2、4抑制IRAK1的自我磷酸化A20TLR2、3、4、9TRAF6去泛素化βarrestinTLR4抑制TRAF泛素化[14]ST2LTLR2、4、9抑制MyD88和MALSIGIRRTLR4、9与TRAF6和IRAK相互作用TRAILRTLR2、3、4稳定IκBαTRIAD3ATLR4、9泛素化TLRs*s:可溶性的;s**:分子质量较小的剪接体.多糖(LPS,TLR4的配体)仍然能够激活NF-κB和AP-1[10].所以,TLRs信号转导除了MyD88依赖途径外还存在MyD88非依赖信号途径.目前认为,TLR3和TLR4可以通过接头分子Trif介导下游的信号转导,其中Trif-RIP1或者Trif-TRAF6通路激活NF-κB诱导炎症因子的分泌,而Trif-TBK1/IKK!通路激活IRFs,诱导Ⅰ型干扰素分泌[11].2.4TLRs信号通路的负调控TLRs的激活可诱导很强的免疫应答反应,有利于机体抗病原微生物感染或组织损伤,但是过强的免疫反应也会带来不利影响,如产生内毒素休克、自身免疫性疾病等.稳态下,机体存在TLRs的负性调节,适时终止TLRs信号,避免过强的免疫反应.具体可归结5种不同机制(表2):可溶性的TLRs竞争相应的配体,如可溶性TLR4、TLR2;通过跨膜负调节分子调节;利用细胞内的负调控分子;下调TLRs的表达;诱导TLRs信号过强细胞的凋亡.3TLRs与免疫调节3.1TLRs在免疫系统的表达由于目前缺乏有效的抗体从蛋白质水平上检测TLR家族不同成员在不同细胞中的表达,TLRs表达研究主要基于mRNA水平的研究.TLR在免疫系统广泛存在,不仅表达于各种免疫细胞,还大量表达于各种上皮和内皮细胞等天然免疫的第一道防线,如肠上皮、呼吸道、泌尿道生殖上皮及血管内皮等.虽然TLRs在免疫系统广泛分布,但是不同细胞的TLRs表达水平并不相同.单核细胞/巨噬细胞以及中性粒细胞是表达TLRs种类最多的细胞,表达除TLR3外的所有TLRs[15,16];B淋巴细胞也较为丰富,但不表达TLR3及TLR8[16];嗜酸性粒细胞表达TLR1、TLR4、TLR7、TLR9和TLR10[17];而T细胞只表达TLR1及TLR4,是否表达TLR3存在异议[18].TLRs在树突状细胞(DC)的分布较为复杂(表3和表4),并在某种程度反映了DC亚群相应的功能.人浆细胞样的DC(pDC)是近年来较受关注的一类特殊的细胞群,表达TLR7和TLR9,双链DNA和单链RNA病毒能诱导此类细胞分泌大量的Ⅰ型干扰素[19,20].pDC不表达TLR2、TLR4、TLR5,所以对细菌产物如LPS、肽聚糖、鞭毛没有反应,而CD11c+的人髓系DC或者单核细胞却可以识别这些来自菌体TLR的配体.另外CD11c+表达TLR3,可能在抗双链RNA病毒发挥重要作用.823··生物化学与生物物理进展Prog.Biochem.Biophys.2006;33(9)Table3TLRexpressionbyhumanDCsubsets[21]表3人不同亚型DC的TLR表达[21]TLR1+++++TLR2++++-TLR3-++-TLR4++--TLR5+++-TLR6++++++TLR7+/-+/-++TLR8++++-TLR9--++TLR10-+++++++++++/-++-++-体内分离的细胞单核细胞*mDC**pDC体外诱导分化的DCGM-CSF+IL-4TLR1++++TLR2++++TLR3--TLR4++/-++/-TLR5+++TLR6+++TLR7++++TLR8++++TLR9++++++++体内分离的DCsCD4+**pDC体外诱导分化的DCGM-CSF+IL-4++++++++++++++/-++/--++++++-++++++++++CD8+双阴性Table4TLRexpressionbymouseDCsubsets[21]表4小鼠不同亚型DC的TLR表达[21]**浆细胞样的DC.3.2TLRs调节感染部位免疫细胞的募集免疫系统一个显著的特征是免疫细胞的迁移,通过迁移有效地监视、攻击和清除入侵的病原体.免疫细胞的迁移有两种类型:一是稳态下的细胞迁移,另一种是通过诱导发生的迁移.诱导迁移通常由PRR活化而激发,使免疫细胞到达感染部位.当病原体入侵时,机体的天然免疫系统可通过TLRs识别病原体保守的TLRs配体促进细胞的迁移.首先,感染时内皮细胞受TLRs刺激,上调选择素的表达,促进白细胞出脉管过程[22].其次,通过TLRs识别PAMP诱导大量的趋化因子的分泌,以及上调趋化因子受体基因的表达.炎症反应中关键的趋化因子包括IL-8(CXCL8)、GRO-α(growth-relatedoncogene-α,CXCL1)、MCP-1(monocytechemoattractantprotein1)、MCP-2、MCP-3、MCP-4、MIP-1α(macrophageinflammatoryprotein-1α)、MIP-β以及RANTES.这些趋化因子结合在脉管内表面激活白细胞,并诱导白细胞表面整合素构象的改变,使白细胞牢固结合于内皮表面[23].整合素配体(如ICAM分子)的表达也受TLRs的调节,这种调节可以是直接的,或者TLRs先激活巨噬细胞,其分泌的TNF和IL-1间接上调内皮细胞的整合素配体.脉管内皮细胞TLRs的表达可直接调节细胞的迁移,在TLR4缺陷的嵌合小鼠(白细胞的TLR4功能缺陷或是内皮细胞的TLR4功能缺陷)中,注射LPS诱导中性粒细胞快速肺浸润需要内皮细胞TLR4表达,而不是中性粒细胞的TLR4[21].所以,TLRs在调节免疫细胞募集中扮演重要的角色.3.3TLRs激活天然免疫细胞天然免疫的细胞,如单核细胞、中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞,NK细胞等,都不同程度地表达TLRs.病原体入侵时,TLRs被相应的PAMP所激活,除了通过刺激天然免疫细胞分泌大量的细胞因子、趋化因子诱导炎症反应外,还可直接增强天然免疫系统对病原微生物的清除能*髓系DC;**浆细胞样的DC.824··王海坤等:Toll样受体(TLRs)的信号转导与免疫调节2006;33(9)力.一方面,TLRs增强吞噬细胞的吞噬能力,如TLRs激活后中性粒细胞、巨噬细胞的吞噬能力明显增强[15,24],相反的抑制TLRs的信号通路,吞噬功能降低[25].实验表明,TLRs能上调MACRO、SR-A、CD36、LOX-1等与吞噬相关的基因表达[24].另一方面,TLRs的激活增强天然免疫细胞的杀伤能力,如TLR2诱导小鼠巨噬细胞产生一氧化氮杀死胞内的结核杆菌[26],TLRs还可以激活维生素D介导的杀菌反应[27].3.4TLR激活上皮细胞上皮层如肠道、呼吸道、泌尿道上皮是天然免疫防线的第一道屏障,也表达许多类型的TLRs[28,29].通过TLRs识别病原体,诱导上皮细胞产生细胞因子、趋化因子以及抗微生物多肽.上皮细胞分泌的趋化因子能够扩散至周围局部组织以及淋巴组织脉管内皮表面,参与细胞的募集.抗微生物多肽是进化过程中保守的天然免疫分子,从昆虫到人甚至是植物都有这类多肽的存在.抗微生物多肽能够直接杀死细菌或者真菌,在宿主的天然免疫中起重要作用,在果蝇中存在抗真菌肽Drosomycin或抗革兰氏阴性菌肽Diptericin,两者分别受Toll和IMD途径调控,若Sp!tzle/IMD突变,果蝇将易于被微生物感染[2].在哺乳动物中也发现了许多抗微生物多肽,如α-defensin、β-defensin等,这些多肽表达于肠道上皮、呼吸道、泌尿生殖道上皮细胞[30].有研究表明,LPS或者细菌能够刺激胃肠道lieberkühn隐窝深部的潘氏细胞表达α-defensin[31],而细菌的脂蛋白通过激活TLR2能诱导肺上皮细胞系A549分泌β-defensin[32].所以,通过TLRs能够诱导上皮细胞分泌抗微生物多肽,直接参与清除病原体.3.5TLRs调节获得性免疫TLRs不仅在天然免疫中发挥重要的作用,而且还可以调节获得性免疫[23,33,34].TLRs主要通过DC及其分泌的细胞因子来调节获得性免疫.DC可以激活T淋巴细胞分化成TH1、TH2、CTL等各种不同的效应细胞.DC摄取抗原、活化、迁移到次级淋巴组织,激活初始T细胞,这一过程涉及抗原吞噬、共刺激分子的表达、不同趋化因子受体的开关表达、细胞因子和趋化因子的分泌以及抗原递呈等复杂的事件.所有这些事件都受DC表面的PRR对病原微生物识别信号以及所处相应的微环境调控.DC表面的PRR有很多,如C型选择素,甘露糖受体、清道夫受体、TLRs等等,其中TLR家族代表了一组在抗感染免疫反应中最重要的PRR.3.6TLRs对T细胞和B细胞的激活获得性免疫始于DC细胞捕获病原微生物抗原,捕获抗原的DC迁移至次级淋巴组织将抗原呈递给初始T细胞,介导T细胞的激活.不成熟的DC受TLRs配体刺激导致炎症趋化因子受体如CCR6的下调[35,36],而归巢受体如CCR7上调[37,38],有利于DC的迁移.不成熟DC在迁移过程中逐步转变为成熟,获得刺激T细胞能力,在淋巴结的T细胞区,诱导抗原特异的T细胞激活并分化为相应的效应细胞.DC细胞激活T细胞需要两种信号:第一种是抗原肽-MHC分子复合物提供的抗原特异信号;第二种是共刺激分子,如B7-1(CD80)、B7-2(CD86)、CD40提供的共刺激信号.第一种信号的提供跟TLRs密切相关,近期《Nature》的文章报道DC吞噬抗原后是否能够有效地将抗原肽递呈给T细胞和B细胞,取决于抗原中是否存在TLR有效配体,DC有选择地递呈病原微生物抗原,而不递呈不含TLRs配体的凋亡细胞抗原[39].在抗感染免疫中,第二种信号主要由TLRs提供,TLRs识别PAMPs使DC表达共刺激分子.DC活化T细胞还需要抑制周围调节型T细胞(Treg)的活性,TLRs能够刺激DC细胞分泌IL-6等细胞因子作用于调节型T细胞,从而抑制它们的活性[40,41].在获得性免疫中B细胞的激活同样需要TLRs的刺激.研究表明,单纯的CD4+T细胞激活还不足以诱导B细胞产生抗原特异的T细胞依赖型抗体,需要TLRs对B细胞的激活[42].3.7TLRs诱导Ⅰ型干扰素(IFN)表达Ⅰ型干扰素包括IFN-α、IFN-β、IFN-ε和IFN-λ,是连接天然免疫和获得性免疫关键的枢纽分子,除了在抗病毒方面起着重要的作用外,还在促进获得性免疫方面发挥重要的功能.TLRs可诱导DC产生Ⅰ型干扰素,进而促进DC的成熟及分泌TH1型的细胞因子[43,44].不同的TLRs诱导产生Ⅰ型干扰素能力并不相同,TLR3/4/7/9能诱导产生IFNα/β,而TLR1/2/5/6却不能.Ⅰ型干扰素的产生跟DC亚群有密切的关系,pDC是Ⅰ型干扰素分泌细胞(type1interferon-producingcells,IPC),高表达TLR7和TLR9,受到相应配体刺激时诱导大量的IFN-α[45],而mDC虽然也表达TLR7和TLR9,但是受体被激活后产生的细胞因子是IL-12.在生理情况下,一种病原体往往带有多种TLRs配体的组825··生物化学与生物物理进展Prog.Biochem.Biophys.2006;33(9)合,理论上TLRs应该能够识别其中一种配体,诱导Ⅰ型干扰素(IFN)的产生来调节天然免疫或获得性免疫.3.8TLRs调节TH1/TH2免疫反应的平衡TH0细胞激活后向何种效应T细胞分化受很多因素的控制,如DC亚群、细胞所处的微环境.TLR4和TLR9能够诱导DC分泌IL-12,使TH0偏向TH1细胞分化.相应地使用LPS、CpGDNA和完全弗氏佐剂(含多种TLRs的配体)为佐剂免疫小鼠,可诱导TH1型免疫反应和产生TH1依赖的抗体[46].然而,两种LPS,一种来自大肠杆菌(TLR4的配体),另一来自牙龈卟啉单胞菌(Porphylomonasgingivalis)(被认为是TLR2配体),诱导不同的反应,前者诱导TH1型反应,而后者诱导TH2型反应.造成两者差别的原因在于E.coliLPS能够诱导CD8+DC分泌IL-12,而来自P.gingivalis的则不能[47].所以,DC的TLRs信号在决定TH1和TH2免疫反应平衡中起了重要的作用.在MyD88缺陷小鼠中,完全弗氏佐剂不能诱导TH1型免疫反应,相反的出现了TH2型免疫反应[33,48].还有文献报道,低剂量的LPS吸入可刺激肺DC诱导TH2型免疫反应和过敏性的炎症反应,而相同情况下高剂量的LPS却诱导TH1免疫反应[49].TLRs对TH1/TH2分化的调节非常复杂,有待于进一步的研究.总之,TLRs对免疫系统具有重要的调节作用,可以说它的发现是免疫学发展的一个重要里程碑.它不仅在观念上改变了以往对天然免疫的看法,而且在实际应用中也展示其广阔的应用前景,如佐剂的应用、临床上内毒素休克的治疗、自身免疫性疾病的治疗等.相信随着研究的深入,将推动免疫学理论的进一步发展.参考文献1JanewayCAJr.Approachingtheasymptote?Evolutionandrevolutioninimmunology.ColdSpringHarbSympQuantBiol,1989,54Pt1,1~132LemaitreB.TheroadtoToll.NatRevImmunol,2004,4(7):521~5273TakedaK,KaishoT,AkiraS.Toll-likereceptors.AnnuRevImmunol,2003,21:335~3764AkiraS,TakedaK.Toll-likereceptorsignalling.NatRevImmunol,2004,4(7):499~5115O!NeillLA.TLRs:ProfessorMechnikov,sitonyourhat.TrendsImmunol,2004,25(12):687~6936HackerH,RedeckeV,BlagoevB,etal.SpecificityinToll-likereceptorsignallingthroughdistincteffectorfunctionsofTRAF3andTRAF6.Nature,2006,439(7073):204~2077AdachiO,KawaiT,TakedaK,etal.TargeteddisruptionoftheMyD88generesultsinlossofIL-1-andIL-18-mediatedfunction.Immunity.1998,9(1):143~1508LiewFY,XuD,BrintEK,etal.Negativeregulationoftoll-likereceptor-mediatedimmuneresponses.NatRevImmunol,2005,5(6):446~4589KaishoT,AkiraS.Toll-likereceptorfunctionandsignaling.JAllergyClinImmunol,2006,117(5):979~98710KawaiT,AdachiO,OgawaT,etal.UnresponsivenessofMyD88-deficientmicetoendotoxin.Immunity,1999,11(1):115~12211KawaiT,AkiraS.TLRsignaling.CellDeathDiffer,2006,13(5):816~82512DivanovicS,TrompetteA,AtabaniSF,etal.NegativeregulationofToll-likereceptor4signalingbytheToll-likereceptorhomologRP105.NatImmunol,2005,6(6):571~57813MansellA,SmithR,DoyleSL,etal.Suppressorofcytokinesignaling1negativelyregulatesToll-likereceptorsignalingbymediatingMaldegradation.NatImmunol,2006,7(2):148~15514WangY,TangY,TengL,etal.Associationofbeta-arrestinandTRAF6negativelyregulatesToll-likereceptor-interleukin1receptorsignaling.NatImmunol,2006,7(2):139~14715HayashiF,MeansTK,LusterAD.Toll-likereceptorsstimulatehumanneutrophilfunction.Blood,2003,102(7):2660~266916HornungV,RothenfusserS,BritschS,etal.Quantitativeexpressionoftoll-likereceptor1-10mRNAincellularsubsetsofhumanperipheralbloodmononuclearcellsandsensitivitytoCpGoligodeoxynucleotides.JImmunol,2002,168(9):4531~453717NagaseH,OkugawaS,OtaY,etal.ExpressionandfunctionofToll-likereceptorsineosinophils:activationbyToll-likereceptor7ligand.JImmunol,2003,171(8):3977~398218ZaremberKA,GodowskiPJ.TissueexpressionofhumanToll-likereceptorsanddifferentialregulationofToll-likereceptormRNAsinleukocytesinresponsetomicrobes,theirproducts,andcytokines.JImmunol,2002,168(2):554~56119LundJ,SatoA,AkiraS,etal.Toll-likereceptor9-mediatedrecognitionofHerpessimplexvirus-2byplasmacytoiddendriticcells.JExpMed,2003,198(3):513~52020DieboldSS,KaishoT,HemmiH,etal.InnateantiviralresponsesbymeansofTLR7-mediatedrecognitionofsingle-strandedRNA.Science,2004,303(5663):1529~153121IwasakiA,MedzhitovR.Toll-likereceptorcontroloftheadaptiveimmuneresponses.NatImmunol,2004,5(10):987~99522HuangQ,LiuD,MajewskiP,etal.Theplasticityofdendriticcellresponsestopathogensandtheircomponents.Science,2001,294(5543):870~87523MantovaniA.Thechemokinesystem:redundancyforrobustoutputs.ImmunolToday,1999,20(6):254~25724DoyleSE,O"ConnellRM,MirandaGA,etal.Toll-likereceptorsinduceaphagocyticgeneprogramthroughp38.JExpMed,2004,199(1):81~9025BlanderJM,MedzhitovR.Regulationofphagosomematurationbysignalsfromtoll-likereceptors.Science,2004,304(5673):1014~101826Thoma-UszynskiS,StengerS,TakeuchiO,etal.Inductionofdirectantimicrobialactivitythroughmammaliantoll-likereceptors.826··王海坤等:Toll样受体(TLRs)的信号转导与免疫调节2006;33(9)*ThisworkwassupportedbyagrantfromTheNationalNaturalScienceFoundationofChina(30470878,30570678).**Correspondingauthor.Tel:86-10-65296457,Fax:86-10-65296466,E-mail:daishu@public.bta.net.cnReceived:April5,2006Accepted:June15,2006Toll-likeReceptorsSignalingandRegulationofImmuneResponse*WangHai-Kun,HanDai-Shu**(DepartmentofCellBiology,InstituteofBasicMedicalSciences,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100005,China)AbstractToll-likereceptors(TLRs),alargefamilyconsistingofatleast10members,areevolutionarilyconservedtorecognizepathogen-associatedmolecularpatterns(PAMPs).TLRsactivationnotonlyinitiatesinnateimmunity,butalsoregulatesenhanceantigen-specificacquiredimmunity,andthusassociatesinnateandadaptiveimmunity.Inrecentyears,studiesontheTLRssignaling,especiallytheirnegativeregulation,rapidlyprogressed.TLRssignalingpathwayandtheirrolesinregulatingimmuneresponsesagainstinvadingpathogenswerereviewed.KeywordsToll-likereceptor,innateimmunity,adaptiveimmunity,signaltransductionScience,2001,291(5508):1544~154727LiuPT,StengerS,LiH,etal.Toll-likereceptortriggeringofavitaminD-mediatedhumanantimicrobialresponse.Science,2006,311(5768):1770~177328AshkarAA,BauerS,MitchellWJ,etal.LocaldeliveryofCpGoligodeoxynucleotidesinducesrapidchangesinthegenitalmucosaandinhibitsreplication,butnotentry,ofherpessimplexvirustype2.JVirol,2003,77(16):8948~895629ZhangD,ZhangG,HaydenMS,etal.Atoll-likereceptorthatpreventsinfectionbyuropathogenicbacteria.Science,2004,303(5663):1522~152630ZasloffM.Antimicrobialpeptidesofmulticellularorganisms.Nature,2002,415(6870):389~39531AyabeT,SatchellDP,WilsonCL,etal.Secretionofmicrobicidalalpha-defensinsbyintestinalPanethcellsinresponsetobacteria.NatImmunol,2000,1(2):113~11832BirchlerT,SeiblR,BuchnerK,etal.HumanToll-likereceptor2mediatesinductionoftheantimicrobialpeptidehumanbeta-defensin2inresponsetobacteriallipoprotein.EurJImmunol,2001,31(11):3131~313733SchnareM,BartonGM,HoltAC,etal.Toll-likereceptorscontrolactivationofadaptiveimmuneresponses.NatImmunol,2001,2(10):947~95034AkiraS,TakedaK,KaishoT.Toll-likereceptors:criticalproteinslinkinginnateandacquiredimmunity.NatImmunol,2001,2(8):675~68035SallustoF,SchaerliP,LoetscherP,etal.Rapidandcoordinatedswitchinchemokinereceptorexpressionduringdendriticcellmaturation.EurJImmunol,1998,28(9):2760~276936DieuMC,VanbervlietB,VicariA,etal.Selectiverecruitmentofimmatureandmaturedendriticcellsbydistinctchemokinesexpressedindifferentanatomicsites.JExpMed,1998,188(2):373~38637ForsterR,SchubelA,BreitfeldD,etal.CCR7coordinatestheprimaryimmuneresponsebyestablishingfunctionalmicroenvironmentsinsecondarylymphoidorgans.Cell,1999,99(1):23~3338GunnMD,KyuwaS,TamC,etal.Micelackingexpressionofsecondarylymphoidorganchemokinehavedefectsinlymphocytehominganddendriticcelllocalization.JExpMed,1999,189(3):451~46039BlanderJM,MedzhitovR.Toll-dependentselectionofmicrobialantigensforpresentationbydendriticcells.Nature,2006,440(7085):808~81240PasareC,MedzhitovR.Tollpathway-dependentblockadeofCD4+CD25+Tcell-mediatedsuppressionbydendriticcells.Science,2003,299(5609):1033~103641YangY,HuangCT,HuangX,etal.PersistentToll-likereceptorsignalsarerequiredforreversalofregulatoryTcell-mediatedCD8tolerance.NatImmunol,2004,5(5):508~51542PasareC,MedzhitovR.ControlofB-cellresponsesbyToll-likereceptors.Nature,2005,438(7066):364~36843HoshinoK,KaishoT,IwabeT,etal.DifferentialinvolvementofIFN-betainToll-likereceptor-stimulateddendriticcellactivation.IntImmunol,2002,14(10):1225~123144HoebeK,JanssenEM,KimSO,etal.Upregulationofcostimulatorymoleculesinducedbylipopolysaccharideanddouble-strandedRNAoccursbyTrif-dependentandTrif-independentpathways.NatImmunol,2003,4(12):1223~122945ColonnaM,TrinchieriG,LiuYJ.Plasmacytoiddendriticcellsinimmunity.NatImmunol,2004,5(12):1219~122646TrinchieriG.Interleukin-12andtheregulationofinnateresistanceandadaptiveimmunity.NatRevImmunol,2003,3(2):133~14647PulendranB,KumarP,CutlerCW,etal.Lipopolysaccharidesfromdistinctpathogensinducedifferentclassesofimmuneresponsesinvivo.JImmunol,2001,167(9):5067~507648KaishoT,HoshinoK,IwabeT,etal.EndotoxincaninduceMyD88-deficientdendriticcellstosupportT(h)2celldifferentiation.IntImmunol,2002,14(7):695~70049EisenbarthSC,PiggottDA,HuleattJW,etal.Lipopolysaccharide-enhanced,toll-likereceptor4-dependentThelpercelltype2responsestoinhaledantigen.JExpMed,2002,196(12):1645~1651827··。
信号转导教学课件ppt

信号转导与疾病
许多疾病的发生与信号转导异常有关,如肿瘤、自身免疫 性疾病、神经退行性疾病等。
针对信号转导途径的治疗策略已成为许多药物研发的重要 方向,包括抑制剂、激动剂、拮抗剂等。
02
信号转导基本元件
细胞膜受体
定义
01
细胞膜受体是指能够接受外界信号分子,并将其转化为细胞内
信号分子的跨膜蛋白。
种类
肿瘤细胞信号转导与血管生成和侵袭
1 2
肿瘤细胞血管生成与信号转导
详细阐述肿瘤细胞通过哪些信号转导通路促进 血管生成以及血管生成的信号转导机制。
肿瘤细胞侵袭与信号转导
介绍与肿瘤细胞侵袭相关的信号转导通路,如 基质金属蛋白酶(MMPs)及其抑制剂等。
3
肿瘤细胞的转移与信号转导
阐述肿瘤细胞转移过程中涉及的信号转导通路 及机制,包括转移前后的变化及转移过程中的 关键分子作用。
PLC通路的生物学功 能
PLC通路主要参与调节细胞增殖、分 化、凋亡等生物学过程,并在多种疾 病中发挥重要作用。
要点三
PLC通路与其他信号 通路的交叉互动
PLC通路与其他信号通路如MAPK、 PI3K等存在交叉互动,共同调节细胞 生理功能。
04
信号转导与免疫
固有免疫
01
固有免疫应答
是生物体在长期进化过程中形成的、对多种病原体具有防御作用的天
02
细胞膜受体可分为离子通道型受体、G蛋白偶联型受体和酶偶
联型受体等。
功能
03
细胞膜受体在感知外部环境刺激、调节细胞反应和通讯方面起
着重要作用。
G蛋白
定义
G蛋白是指与细胞膜受体结合并被激活的一类蛋 白,其在信号转导中起着关键作用。
TLR信号通路传导示意图及讲解
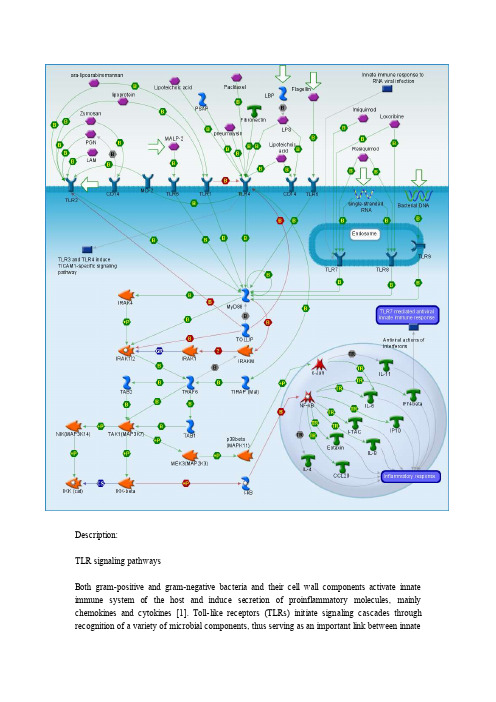
Description:TLR signaling pathwaysBoth gram-positive and gram-negative bacteria and their cell wall components activate innate immune system of the host and induce secretion of proinflammatory molecules, mainly chemokines and cytokines [1]. Toll-like receptors (TLRs) initiate signaling cascades throughrecognition of a variety of microbial components, thus serving as an important link between innateand adaptive immune responses. Each TLR recognizes distinct ligands [2]. TLR2 agonists include peptidoglycan, lipoproteins, and lipopeptides from Gram-positive bacteria, mycobacterial lipoarabinomannan, mycoplasma lipopeptides [3], but only when present as a heterodimer in combination with either TLR1 or TLR6 [4]. TLR3 and TLR5 mediate cell activation by double-stranded viral RNA and bacterial flagellin, respectively [3]. TLR9 responds to unmethylated CpG motif in bacterial DNA [3], [4]. TLR4 is essential in the respective recognition of lipopolysaccharide ( LPS ) [4], lipoteichoic acid [5] and some other substrates [6], [7], [8]. A number of microbial substrates are known for TLR7 and TLR8 [9], [8], [10].The main TLR-mediated immune response pathway, which is common for all TLRs, is Myeloid differentiation primary response gene 88 ( MyD88 )-dependent activation of Nuclear factor of kappa light polypeptide gene enhancer in B-cells inhibitor ( NF-kB ) and c-Jun, transcription regulators of number of chemokines and cytokines responsible for cellular immune response. The main steps of NF-kB activation involve MyD88/ Interleukin-1 receptor-associated kinases ( IRAK )/ TNF receptor-associated factor 6 ( TRAF6 )/ Mitogen-activated protein kinase kinase kinase 14 ( NIK )/ Inhibitor of kappa light polypeptide gene enhancer in B-cells ( IKK )/ NF-kB signal transduction [1]. C-Jun activation proceeds throw MyD88/ IRAK/ TRAF6/ Mitogen-activated protein kinase kinase kinase 7 interacting protein 1 ( TAB )/ Mitogen-activated protein kinase kinase kinase 7 ( TAK ) cascade [4], [11]. Besides MyD88, some TLR s use alternative adaptor proteins to induce NF-kB and c-Jun activation, such as Toll-interleukin 1 receptor domain containing adaptor protein ( TIRAP ) [4], [12]. Certain types of TLRs (for example, TLR3 and TLR4 ) demonstrate also other response pathways, which are specific for them.TLR启动的信号转导参与胞内信号转导的主要有三类分子:蛋白激酶、衔接蛋白和转录因子,在固有免疫、适应性免疫以及凋亡信号转导中,三类分子及其发挥作用的顺序不完全相同,但三类分子的结构特点和功能却是相似的。
Toll样受体介导的细胞内信号通路及其免疫调节功能

Toll样受体介导的细胞内信号通路及其免疫调节功能Toil样受体(TLR)通过富亮氨酸重复序列识别不同病原体表面共有且进化高度保守的特定分子结构,引发细胞内信号传导及炎症递质释放,启动宿主的免疫反应,而TLR介导的牙髓细胞内信号通路对机体的免疫反应具有重要的调控作用。
本文就TLR在牙髓组织中的表达,TLR信号通路,TLR在牙髓炎症治疗中的应用前景等研究进展作一综述,以期丰富牙髓炎的发生机制,为牙髓炎的临床药物研发提供新的思路。
标签:Toll样受体;免疫调节;牙髓炎【文献标志码】AToll样受体(Toll-likereceptor,TLR)是一类重要的天然免疫识别受体,属于I型跨膜糖蛋白,由富含亮氨酸重复片段的细胞外区(leucine-richrepeat,LRR)、跨膜区和细胞内区(Toll/inter-leukin-1receptor domain,TIR)三部分组成。
TLR通过LRR识别不同病原体表面共有且进化高度保守的病原相关分子模式,如细菌胞壁成分脂磷壁酸(lipoteichoic acid,LTA)和脂多糖(lipopolysac-charide,LPS)等,引发细胞内信号传导及炎症递质释放,启动宿主的免疫反应。
TLR一旦与特异的病原相关分子模式结合后,将会改变自身的异构形态,以利于TIR 结合衔接分子。
TLR通过磷酸化和遍在蛋白化或蛋白质与蛋白质间的交互作用激活下游信号通路,最大程度地激活炎性转录因子,调节炎性基因表达,参与介导宿主炎症或免疫防御反应。
迄今为止,已发现10个TLR家族成员。
1TLR在牙髓组织中的表达人体各器官包括口腔组织均存在着TLR,且TLR与牙髓炎密切相关。
Staquet 等通过反转录聚合酶链反应和基因测序证实,TLR-2、3和4均表达于牙髓组织内的成牙本质样细胞和成纤维细胞,其表达水平与LTA、双链RNA和LPS等特异性细菌产物相关。
牙髓细胞受革兰阳性细菌感染后,细胞内TLR-2mRNA 表达上调,在9h达最高水平,至72h表达水平持续降低,故TLR-2在牙髓炎症早期发挥调控作用。
TLR信号通路

Toll样受体(TLR)家族成员能识别保守的微生物结构,如细菌脂多糖(LPS)和病毒双链RNA,并且能够激活一些信号通路,引起抗微生物感染的免疫应答。
所有的TLRs都能够激活MyD88依赖性的通路诱发炎症反应。
但是,不同个体的TLRs也能诱导只对特定微生物感染的免疫应答。
因此,TLRs既参与了先天性免疫又参与了获得性免疫.这些反应的机制和组成成分现在了解的还不是很清楚.已知TLRs在宿主防御中起重要作用,因此对它们激活通路的研究就变成了一个研究的焦点.TLR家族是一个受体家族,参与免疫系统对微生物的识别。
TLRs识别病原体相关分子模式,这种模式体现了特定种类微生物的保守分子特征。
例如,革兰氏阴性细菌的脂多糖是TLR4配体,而双链RNA(病毒侵染过程中产生)是TLR3配体.这个微生物识别系统的最重要的特征就是TLRs能够激活一些信号通路,这些信号通路对诱导特定微生物侵染产生的免疫应答来说是十分重要的。
TLRs将微生物的识别与抗原递呈细胞、参与T淋巴细胞活化和引起获得性免疫的分化细胞的活化联系起来. 现在很热门的一个领域就是由TLRs诱导的信号通路。
尽管有一些通路在所有的TLRs中都是一样的,现在已知还是有不同个体的TLR家族成员刺激产生的信号通路以及基因表达模式是有很大的不同的.所有的TLRs激活一种共同的信号通路,最终引起NF-κB(核转录因子)、MAPKs(丝裂原活化蛋白激酶)、ERK(胞外信号调节激酶)、p38和JNK(c-Jun N端激酶)活化[见TLR通路(2)和图1]。
与这个信号通路最接近的事件部分依赖于模式信号结构域的一系列相互反应。
其中的一个结构域就是TIR(Toll/IL—1受体)结构域,存在于所有TLRs和IL—1受体家族的胞内区.TIR结构域除控制TLRs之间的异源二聚化和同源二聚化外,还控制TLRs和含TIR结构域接头蛋白之间的结合。
这种蛋白模式会让人联想起其它的信号通路,例如调亡和有丝分裂信号通路。
炎症相关的信号转导通路PPT精品课程课件讲义

利用新兴技术推动抗炎药物研发
如人工智能、基因编辑、高通量筛选等技术在抗炎药物研发中的应用前景。
THANKS
感谢观看
生理意义
炎症是机体的一种自我保护机制,有助于清除有害物质和修复受损组织。
调控机制
机体通过神经、体液和免疫等多种机制对炎症进行调控,以维持内环境稳定。
02
信号转导通路基本概念
Chapter
信号分子与受体介绍
信号分子
包括激素、神经递质、生长因子等, 具有传递信息、调节细胞功能的作用。
受体
位于细胞膜或细胞内,能特异性识别 并结合信号分子,引发细胞响应。
NF-κB家族成员及结构特点
NF-κB家族成员
包括RelA(p65)、RelB、c-Rel、p50/p105(NF-κB1)和p52/p100(NF-κB2)等
结构特点
含有Rel同源结构域(RHD),负责DNA结合和二聚化;不同成员之间通过RHD相互结合形成同源或异源 二聚体
NF-κB激活途径和调控机制
信号终止
通过受体脱敏、内吞、降解等方式,使信号传递得到终止,避免过度反应。
功能异常与疾病关系
01
信号转导异常与多种疾病密切相关,如癌症、心血管疾病、神经退行性疾病等。
02
深入研究信号转导通路,有助于揭示疾病发生发展机制,为药物研发和治疗提供 新靶点。
03
NF-κB信号转导通路在炎症中 作用
Chapter
信号转导途径类型
1 2
G蛋白偶联受体信号转导途径 通过G蛋白介导,传递细胞外信号至细胞内,调 节多种生理过程。
酶联受体信号转导途径 受体本身具有酶活性,通过催化作用将信号传递 至细胞内。
Toll样受体与尖锐湿疣-PPT课件

mRNA
TLR4 /CD14 /MD22复合物
LPS 紫杉酚(小鼠) 纤连蛋白III型重复外结构A 透明质酸寡糖 硫酸乙酰肝素多糖片段 呼吸道合胞病毒融合蛋白 小鼠乳房肿瘤病毒衣壳蛋白 热休克蛋白60 (HSP60) 热休克蛋白70 (HSP70) 热休克蛋白Gp96 (Gp96)
组别 患者组 对照组
t值 p值
例数 34 30
TLR3 1.23士0.69 1.09士0.57
1.287 ﹥0.05
TLR4 21.55士7.74 16.16士5.06
2.403 ﹤0.05
TLR9 95.62士3.81 91.14士3.41
2.659 ﹤0.05
本研究中我们发现尖锐湿疣初发患者外周血单核 细胞TLR4和TLR9的表达比正常人显著增高, 提 示TLR4和TLR9可能为人乳头瘤病毒(HPV)的 识别受体,在抗HPV免疫反应中发挥了重要的 识别和保护作用。
Yang R等在对鼠的研究中发现乳头瘤病毒刺激 树突细胞产生的干扰素和Th1免疫应答,主要是通 过MyD88蛋白通路来表达的,并证实TLR的识别 对HPV16的识别是至关重要的。
Simth KJ等证实目前治疗尖锐湿疣有效的5% 咪喹莫特软膏,它能通过与细胞表面的TLR相结 合诱导多种细胞分泌多种细胞因子,进而活化 机体的天然和获得性免疫,发挥抗病毒、抗肿
Toll样受体与尖锐湿疣
一 、Toll样受体概况
1988 年Hashimoto C 等在研究果蝇的胚胎发育时 发现的一种由果蝇背腹侧分化基因(dToll) 所编码的 属于Ⅰ型跨膜蛋白的受体,具有介导抗菌感染易感 性信号转导的功能, 在抗真菌、细菌等病原体中有 重 要 意 义 , 称 为 Toll 样 受 体 (Toll-like receptors , TLRs )。
Toll样受体的信号转导与免疫调节

Toll样受体的信号转导与免疫调节一、本文概述Toll样受体(Toll-like receptors,TLRs)是一类在免疫系统中起着至关重要作用的蛋白质受体。
自发现以来,TLRs已成为生物学和医学研究领域的一个热点。
它们能够识别多种病原体相关的分子模式(Pathogen-Associated Molecular Patterns,PAMPs),从而启动先天免疫反应,并在适应性免疫应答中发挥关键作用。
本文旨在深入探讨TLRs的信号转导机制以及它们在免疫调节中的重要作用,从而为理解人体免疫防御体系提供新的视角和思路。
我们将概述TLRs的基本结构和特性,包括它们的分布、配体识别能力以及信号转导通路。
随后,我们将重点讨论TLRs信号转导的具体过程,包括配体与受体结合后的信号传递、关键信号分子的激活以及下游基因的表达调控。
在此基础上,我们将进一步探讨TLRs在免疫调节中的功能,包括它们在炎症反应、免疫细胞活化和分化以及适应性免疫应答中的作用。
我们将总结TLRs在免疫系统中的重要性,以及它们在疾病发生和发展过程中的潜在作用。
通过深入研究TLRs的信号转导与免疫调节机制,我们有望为开发新型免疫疗法和药物提供理论依据和实践指导,为改善人类健康水平做出贡献。
二、Toll样受体的结构与分类Toll样受体(Toll-like receptors,TLRs)是一类在进化上高度保守的模式识别受体,它们在免疫系统中起着至关重要的作用。
TLRs通过识别微生物特有的病原体相关分子模式(Pathogen-Associated Molecular Patterns,PAMPs)来启动和调节先天免疫反应。
它们还能识别损伤相关分子模式(Damage-Associated Molecular Patterns,DAMPs),从而在组织损伤和炎症反应中发挥作用。
结构上,TLRs是一类跨膜蛋白,由胞外区、跨膜区和胞内区三部分组成。
胞外区富含亮氨酸重复序列(Leucine-Rich Repeats,LRRs),这些重复序列使得TLRs能够识别多种不同类型的PAMPs和DAMPs。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•病原体赖以生存、变化较小的主要部分(如病 毒的双链RNA和细菌的脂多糖), 因此病原体 很难发生突变逃逸固有免疫的作用。
PAMP分类:
PAMP
糖类/脂类 细菌胞壁
病毒/细菌 胞核/产物
脂多糖:革兰阴性菌 肽聚糖:革兰阳性菌
糖 脂:分枝杆菌 甘露糖Cp:G酵DN母A菌
• 细胞表面模式识别受体
---甘露糖受体 (巨噬细胞) ---清道夫受体 (巨噬细胞): LPS;脂蛋白;氧化LDL等 ---Toll样受体 (TLR 1/2/4/5/6/10)
识别PAMP的甘露糖受体(A)和清道夫受体(B)
模式识别受体种类与分布:
细胞内模式识别受体
---Toll样受体 (TLR3/7/8/9)
---NOD样受体 ---RIG-1样受体
NLR: MDP系吞噬溶酶体中解离的革兰阳性菌胞壁肽聚糖相关成分,属PAMP
NLR
TLR
RLR
Toll样受体( TLR ):
• TLR发现; • TLR的分子结构与配体; • TLR的胞内分布和定位; • TLR信号转导与调控; • TLR的生物学功能; • 靶向TLR的疾病治疗
M\088
TIRAP
HF-«B
TRAM TRJ F
HF-«B Ty[w I IFLI
NF-<B
•••@• klyDBB•dependo‹›I pet:hway Inflammatory cytokines
TLR
Virus-infected cells
Plesma membrane
Endolysosome
• LPS还是固有免疫信号转导研究的突破口之一,由此发现 了相应的受体TLR4,及一些当初未知的炎症基因信号转 导和激活方式,开拓了研究固有免疫识别的新局面。
模式识别受体 Pattern recognition receptor,PRR
•模式识别受体是主要由免疫系统细胞 表达的、识别微生物特定分子结构即 病原相关分子模式的免疫受体。
Toll样受体及其信号转导
Toll like receptor (TLR) and its cell signaling
内 容:
• 病源体相关的分子模式(PAMP) 与模式识别受体(PRR)
• Toll样受体( TLR )
社会有机体的:
病源体相关的分子模式(PAMP) 模式识别受体(PRR)
小偷小摸 交通违规
模式识别受体特点:
•胚系基因编码; •组成性地持续表达; •快速应答; •识别各种病原体表达的PAMP。
模式识别受体种类与分布:
• 体液中的模式识别分子:PRR的游离形式
---五聚体蛋白: 识别PAMP成分中的磷酸胆碱。 ---甘露糖结合凝集素:识别PAMP的碳水化合物。 ---脂多糖识别蛋白
模式识别受体种类与分布:
单链RNA 双链RNA
PAMP主要成分脂多糖(A)和肽聚糖(B)的结构 Mur(MurNac):乙酰胞壁酸;Glc(GIcNac):乙酰葡糖胺。
认识脂多糖 (LPS)
• 脂多糖是PAMP的一个典型代表。对脂多糖的识别在固有 免疫中有特殊的地位。
• 首先,脂多糖为革兰阴性菌的胞壁成分,免疫刺激作用最 强,全身感染会引起内毒素休克。这一致命的综合征是全 身细菌感染后大量细胞因子特别是TNF~a的分泌所引起, 可导致脑、心、肾、肝等要害器官的衰竭,因而LPS又称 内毒素。
LRR
23 LRR ; Dimer: LRR12 /20 LRR20: 参与配体结合
TLR3 ectodomain
TIR 结构域介导的细胞互作 TIR
TIR 结构域介导的信号传递与调控
TLR的胞内分布和定位
TLR的组织分布
• TLR广泛分布于免疫器官和心、脑、肺、肝、肾 等器官组织内;
• TLR主要表达在免疫细胞,在某些上皮细胞和成 纤维细胞也有表达;
治安联防/片警 交通警察 铁
违章摆摊
血城管
官员腐败
中纪委 防
劫持人质
暴警察
外敌入侵
陆海空三军
Health-threatening pathogens
a
I PAMP
HO
HO
HO
|
OH
HO
HO._ H O —P— O
H
HM '
‘ O — P— O H HO
病源体相关的分子模式(PAMP)的特点
•结构恒定,进化保守;
hTLR1
hTLR6
hTLR10
hTLR2
* dToll9
hTLR9
人类
hTLR7
hTLR8
hTLR5
hTLR3
hTLR4
dToll6
dToll8
dToll7
18Wheeler 果蝇
dToll dToll5
dToll3
dToll4
果蝇:9Toll; 人类:10TLR;
鼠:9TLR;
II: TLR的分子结构与配体
• 不同的TLR可表达于不同细胞上;
• 同一细胞可表达多种TLR。
Expression patterns and PAMP specificities
TLR胞内定位: 细胞膜配体; 内体、溶酶体和内质网TLR
@$gTLR TLR /2/4/5/6/1
Trlacyl LPS
TLR2-TLR1
Endosorne
TLR 的配体:
a
TLR8If¶?o(??l}?½?@'[A
配体(PAMP)介导TLR的活化
TLR结构示意图
胞外区
跨膜区:富含Cys 胞内区:TIR,蛋白
相互作用区
•TLR 二聚化: 比如TLR3/4二聚体,TLR2/ TLR1异二聚体等。
TLR结构简图
富含亮氨酸 重复序列
(TLR/IL-1R)
TLR发现
Discovery of Toll / T在应用:
TLR基因克隆和功能鉴定; TLR信号传导通路鉴定; TLR在发育、抗感染免疫和 其他生物学过程中的作用; TLR: 疾病干预的靶点。
人类与果蝇Toll / TLR进化树比较
dsRNA
poly(I:C) dsRNA
Autophagosome
(TLR3/7/8/9):
Bacteria
MyDB8
DNA TLRB
IRF3
ER UNC93B1
TLRs
Inflammatory cytokines T , ÷ ‹••‹
IRF7 Inflammatory cytokines T„ » I lFN
TLR信号转导与调控
LPS
配体 受体
TLR通路组成
接头蛋白:MyD88 衔接蛋白
