反应工程计算题
反应工程计算题
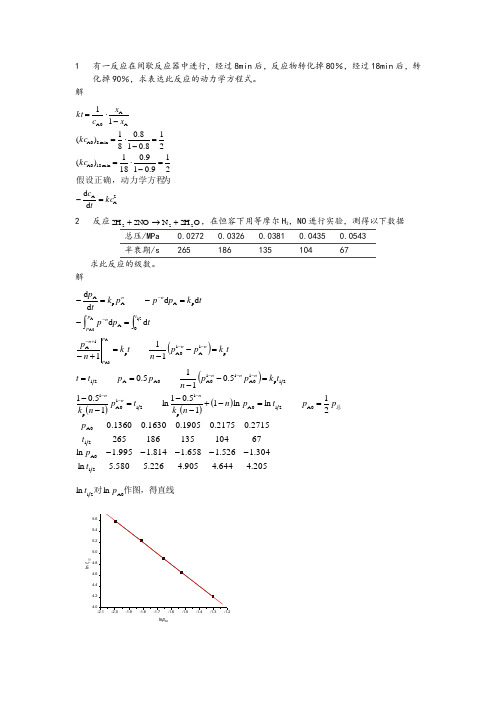
1 有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
解 2A A min 18A0min 8A0AA A0d d 219.019.0181)(218.018.081)(11kc tc kc kc x x c kt =-=-⋅==-⋅=-⋅=为假设正确,动力学方程 2反应O 2H N 2NO 2H 222+→+,在恒容下用等摩尔H 2,NO 进行实验,测得以下数据总压/MPa 0.0272 0.0326 0.0381 0.0435 0.0543 半衰期/s26518613510467求此反应的级数。
解()()()()()205.4644.4905.4226.5580.5ln 304.1526.1658.1814.1995.1ln 671041351862652715.02175.01905.01630.01360.021ln ln 115.01ln 15.015.0115.0111d d d d d d 21A021A0A0210A p 12110A p 121p 1A0110A A0A 21p 1A10A p 1AA p A A p A AA0AA 21t p t p p p t p n n k t p n k t k p p n p p t t t k p p n tk n p tp p tk p p p k tp n nn nn n nn p pn p p t n n n-----==-+--=--=--===--=+-=-=-=---------+---⎰⎰总作图,得直线对A021ln ln p tl n t 1/2ln p A0Y=A+B*X ParameterValue Error A 1.60217 0.01399 B -1.99460.00834三级反应斜率319946.19946.1≈-=--n n3A 和B 在水溶液中进行反应,在25℃下测得下列数据,试确定该反应反应级数和反应速度常数。
化学反应工程试题及答案

化学反应工程试题及答案一、选择题(每题2分,共10分)1. 化学反应工程中,反应速率常数k与温度的关系遵循()。
A. Arrhenius方程B. Van't Hoff方程C. Le Chatelier原理D. Nernst方程2. 在固定床反应器中,流体通过催化剂床层的流动方式是()。
A. 并流B. 逆流C. 交叉流D. 层流3. 以下哪种催化剂不属于均相催化剂?()A. 酸B. 碱C. 金属D. 酶4. 反应器的体积效率是指()。
A. 反应器体积与所需反应体积的比值B. 反应器体积与实际反应体积的比值C. 反应器体积与理论反应体积的比值D. 反应器体积与催化剂体积的比值5. 在反应器设计中,为了提高反应速率,通常采取的措施是()。
A. 增加反应物浓度B. 提高反应温度C. 增加催化剂用量D. 以上都是二、填空题(每空1分,共10分)1. 在化学反应工程中,反应速率的表达式通常为__________。
2. 反应器的类型主要包括__________、__________和__________。
3. 催化剂的作用是__________反应速率,而不影响__________。
4. 反应器设计时,需要考虑的主要因素包括__________、__________和__________。
5. 根据反应器内物料流动的特点,可以将反应器分为__________流动和__________流动。
三、简答题(每题5分,共20分)1. 简述反应速率和反应速率常数的区别。
2. 描述固定床反应器和流化床反应器的主要区别。
3. 解释为什么在某些情况下需要使用催化剂。
4. 讨论温度对化学反应速率的影响及其在工业应用中的意义。
四、计算题(每题10分,共20分)1. 已知某化学反应的速率常数k=0.05 s^-1,反应物A的初始浓度为1 mol/L,求10秒后A的浓度。
2. 假设一个完全混合反应器中进行一级反应,反应物B的初始浓度为2 mol/L,反应速率常数k=0.02 min^-1,求5分钟后B的浓度。
新乡学院《化学反应工程》试题及答案

《化学反应工程》试题二、计算分析题1. 在恒容条件下,反应A+2B==R ,原料气组成为C A0=C B0=100kmol /m 3,计算当C B =20 kmol /m 3时,计算反应转化率x A 、x B 及各组分的浓度。
解:在恒容条件下:x B =( C B0- C B )/ C B0=0.8由C A0- C A =( C B0- C B )/2得到:C A =20 kmol /m 3=60 kmol /m 3x A =( C A0- C A )/ C A0=0.42. 在恒压条件下,反应A+2B==R ,原料气组成为C A0=C B0=100kmol /m 3,计算当C B = 20 kmol /m 3时,反应转化率x A 、x B 及各组分的浓度。
解:δB =(1-1-2)/2=-1;y B0=0.5 n =n 0(1+ y B0δB x B ) = n 0(1-0.5 x B )在恒压条件下:V =V 0 n /n 0= V 0(1-0.5x B )C B =n B /V= n B0(1- x B )/[V 0(1-0.5x B )]= C B0(1- x B )/ (1-0.5x B ) x B =8/9n A0- n A =( n B0- n B )/2 x A =( n A0- n A )/ n A0=( n B0- n B )/(2 n A0)= ( n B0- n B )/(2 n B0)=0.5 x B =4/93. 串联-平行反应A+B==R ,A+R==S ,原料中各组分的浓度为C A0=2.0mol /L ,C B0=4.0 mol /L ,C R0=C S0=0,在间歇反应器中恒容操作一定时间后,得到C A =0.3mol /L ,C R =1.5 mol /L ,计算此时组分B 和S 的浓度。
解:在恒容条件下:ΔC A1= C B0-C B ;ΔC A2= C S ;C R = (C B0-C B )-C S ;C A0-C A =ΔC A1+ΔC A2得到:C S =( C A0-C A - C R )/2=(2.0-0.3-1.5)/2=0.1 mol /L C B = C B0- C R -C S =4.0-1.5-0.1=2.4 mol /L 4. 在间歇反应器中进行等温2级、1级、0级均相反应,分别求出转化率由0至0.9所需的时间与转化率由0.9至0.99所需时间之比。
化学反应工程计算题

1. 某催化反应:C D B A +→+,动力学方程为2)1(D D B B A A BA p K p K p K p kp r +++=。
试写出其反应机理、控制步骤并进行验证。
解:反应机理为)4()3()2()1(σσσσσσσσσσ+⇔++→+⇔+⇔+D D C D B A B B A A其中第(3) 步为控制步骤,根据理想吸附模型的假定,除控制步骤以外的其余步骤均达到平衡,所以B A s V D D D V B B B V A A A k r p K p K p K θθθθθθθθ====;;;将 , 代入到第(3)步的计算式中,2V B A B A s p p K K k r θ= 因为1=+++V D B A θθθθ,所以 DD B B A A V p K p K p K +++=11θ最后求得反应速率方程为2)1(D D B B A A B A B A s p K p K p K K K p p k r +++==2)1(D D B B A A BA p K p K p K p kp +++ 其中B A s K K k k =2. 在等温间歇反应器中进行液相反应A+B →R +C ,该反应对反应物A 和B 均为一级反应,反应速率常数)/(2h mol l k ⋅=,进料中A 和B 的摩尔浓度均为l mol /0.3,要求A 的转化率8.0=A X 。
若每天生产产物C 为240 mol ,且每批生产的辅助时间为0.5 h ,试求反应器的有效体积。
解: 因为l mol c c B A /0.300==,B A c c =所以反应速率方程202)1(A A A B A A X kc kc c kc r -=== 反应时间⎰⎰-==A Ax A A AA x A A A X kc dx C r dx C t 020000)1(,其中)/(2h mol l k ⋅=,8.0=A X 解得h t 66.0=进料中A 的摩尔流量为h mol F A /5.128.0242400=⨯=体积流量h l c F Q A A A /17.435.12000===反应器的有效体积)(00t t Q V A r +=,其中辅助时间h t 5.00=l V r 5)5.066.0(17.4=+⨯=3. 两个串联的全混流反应器进行某液相复合反应)/()/(21h l mol C k r SA h l mol C k r P A A S A P ⋅=→⋅=→ ,已知l mol C h h A /5,6.0,4.0021===ττ,第一釜出口处A 的浓度l mol /3,产物P 的浓度为l mol /5.1,求第二个釜出口处Sf Pf Af C C C ,,各为多少。
合工大反应工程期末考试计算题部分

(0)今有变摩尔气相反应A +B →C ,求膨胀因子δA 。
另,假如进行等压反应,初始物料中A 与B 的摩尔比为1:2,试计算,当A 物质的转化率达到60%时,反应体系的体积变为初始体积的多少倍? 解:δA =1-(1+1)=-1 由公式00(1)A A A V V y x δ=+可知:00111(1)0.6=0.812A A A V y x V δ=+=+⨯-⨯+ 即,变为初始体积的0.8倍。
(1)某反应 2A=B+C ,测得的实验结果如下:时间/min 9.82 59.60 93.18 142.9 294.8 589.410002000 B 生成量 4.223.6434.849.0880.64106.68 120120求该反应的反应级数及速率常数。
解:将数据加以处理如下表,从而可作0()A A ln C /C ~t 图,如下图。
图中得到一条直线,可见,该反应为1级不可逆。
时间/min9.82 59.60 93.18 142.9 294.8 589.4 0()A A C /C /% 96.580.371.059.132.811.10()A A ln C /C-0.0356 -0.2194 -0.3425 -0.5259 -1.1147 -2.1982从图中可以求得其斜率为:230612.- 于是,0230=612A A C .lnt C -⋅ 可见:31230=37610()612.k .min --=⨯(2)在某反应器中进行等温恒容一级不可逆反应,脉冲实验数据如下:1,用表格的形式给出E(t) 及F(t);2,求停留时间介于10min ~15min 之间的物料所占的分率; 3,试求平均停留时间t 、空时、空速、及方差2σt 、2θσ。
4,假设在同样的空时下,用全混流反应器,转化率可达0.8,试用多级模型计算该反应器能达到的转化率。
解:11()()()∆¥=åi i i i C t E t C t t =()()(03554210)5100i i C t C t =+++++++?(min -1) 111()()()20()i it t ii i C t C t F t C t ¥==邋å数据计算结果如下:2、0.65-0.4=0.253、平均停留时间:()15(min)()tC t t C t ==åå方差及无因次方差分别为:2222()47.5(min )()tt C t t C t σ=-=åå 2220.211t tθσσ==空时=15分钟,空速=0.067分-1,或0.0011秒-1 4,模型参数:214.76m θσ==对于全混流反应器:111A x k τ-=+ ,即:110.8115k -=+,故415k ==0.267;或4k =τ转化率 : 4.7611110.945415(1)(1)15 4.76A mx k τ=-=-=++?(3)某气固相非催化反应,固体呈活塞流。
化学反应工程习题库(计算题举例及详细解答))

a
Kp
p H 2 pO 2
0.5
p H 2O
令k1 k1 K p b0,O2 K p
a
, k2 k2
b
0.5
0,O2
K p ;由实验测得 a 0.5, 最后可得
0.5
a
p H 2O r k1 pCO p H2
pH2 k 2 pCO p H 2O
x Af ,c x Af , f c A0 e 2k e2 0.135kmol/ m3 , x A,e x A, f 0.865
(g)平推流反应器与全混流反应器并联,
c Af , g
c A0 1 1 1 (c A0 e 2 k ) e 2 0.234 , x A, g 0.776 2 1 2k 2 3
60 0.62m 3 960 368 0.496 m 3 740
该反应为液相反应,反应过程中体积比不变,且每次投料体积为:
3 V 0.0625 0.496 0.559m
计算结果表明,转化率从0.9提高到0.99,反应时间从 4.81h延长到52.9h,说明大量反应时间花在高转化率。
9.纯苯氯化为串联反应,生成物为一氯苯,副产物为二氯苯反应方程式为
1 bN 2 p N 2 bNH 3 p NH 3
3
0.5 1.5 1 bN 2 PN 2 bNH 3 k p PN PH 2 2
2.Temknh等提出铁催化剂上氨合成反应为下列步骤所组成 3 式中X代表活性位。若过程 NX H 2 NH 3 X N 2 2 X 2 NX
化学反应工程考试试题及答案

化学反应工程考试试题及答案一. 选择题1. 在进行化学反应工程设计时,以下哪个因素不属于考虑的主要因素?a) 反应速率b) 反应动力学c) 原料成本d) 温度控制答案:c) 原料成本2. 化学反应工程中,以下哪种反应类型属于放热反应?a) 氧化反应b) 加氢反应c) 氢化反应d) 生成酸反应答案:a) 氧化反应3. 执行化学反应时,下列哪个条件对于控制选择性反应非常重要?a) 压力b) 流速c) 反应物比例d) 温度答案:c) 反应物比例4. 下列哪种反应类型在进行反应工程设计时需要考虑催化剂的使用?a) 酯化反应b) 氧化反应c) 反应物分解反应d) 酸碱中和反应答案:a) 酯化反应5. 在进行化学反应工程设计时,下列哪种参数是必须考虑的?a) 反应器材料b) 搅拌速率c) 产品收率d) 反应器体积答案:d) 反应器体积二. 简答题1. 请简述酸碱中和反应的基本原理及过程。
答案:酸碱中和反应是指酸和碱在一定的条件下,以化学反应形式相互中和,生成盐和水。
这种反应的基本原理是酸和碱互相转化为盐和水的化学反应。
酸和碱分别具有H+离子和OH-离子,当它们混合时,H+离子和OH-离子结合生成水分子,并生成相应的盐。
2. 请简要描述化学反应速率的定义及影响因素。
答案:化学反应速率是指单位时间内反应物消失或生成物产生的量。
影响化学反应速率的因素有:- 反应物浓度:反应物浓度越大,反应速率越快。
- 温度:温度升高会加快反应速率,因为高温会增加反应物分子的热运动速度。
- 催化剂:催化剂能够降低化学反应的活化能,从而加速反应速率。
- 反应物粒径:反应物粒径越小,表面积越大,反应速率越快。
- 反应物浓度:反应物浓度越大,反应速率越快。
三. 计算题1. 某化学反应的反应方程式为A + 2B -> C + D,已知初始时A和B的摩尔浓度分别为2mol/L和3mol/L,经过一定时间后,测得C的摩尔浓度为4mol/L。
《化学反应工程》试题及答案

《化学反应工程》试题及答案一、选择题(每题5分,共25分)1. 以下哪个选项不属于化学反应工程的研究范畴?A. 化学反应速率B. 反应器设计C. 催化剂制备D. 产品分离和提纯答案:D2. 以下哪种反应器类型不属于理想反应器?A. 平推流反应器B. 全混流反应器C. 非理想反应器D. 等温反应器答案:C3. 以下哪个因素对化学反应速率影响最小?A. 反应物浓度B. 温度C. 催化剂D. 反应时间答案:D4. 在全混流反应器中,以下哪个参数表示反应器的时空产率?A. 空时B. 时空产率C. 反应时间D. 反应速率答案:B5. 以下哪个选项描述的是化学反应工程的主要任务?A. 研究化学反应机理B. 设计和优化反应器C. 分析和解决生产过程中的问题D. 所有以上选项答案:D二、填空题(每题5分,共25分)6. 化学反应工程的主要研究内容包括____、____、____。
答案:化学反应动力学、反应器设计、反应器操作7. 在间歇操作反应器中,反应物的浓度随时间变化的关系为____。
答案:指数衰减8. 反应器的设计和操作过程中,需要考虑的主要因素有____、____、____。
答案:反应速率、反应温度、反应压力9. 以下反应器类型中,属于连续操作反应器的是____、____。
答案:平推流反应器、全混流反应器10. 在反应器操作过程中,以下哪个参数表示反应物的转化率?答案:转化率三、计算题(每题25分,共50分)11. 某一级反应在间歇操作反应器中进行,已知反应速率常数为k=0.1 min^-1,反应物初始浓度为C0=1 mol/L。
求反应进行1 min后,反应物的浓度。
解:根据一级反应的动力学方程,反应物浓度随时间的变化关系为:ln(C/C0) = -kt代入已知数据:ln(C/1) = -0.1 1C = 1 e^(-0.1)C ≈ 0.9048 mol/L答案:反应进行1 min后,反应物的浓度为0.9048 mol/L。
反应工程习题

(4) P=P0 (1+ yA0xA)=10.393atm
对于反应速率方程为旳液相反应,为到达一定旳生产 能力,试讨论当n>0、n=0和n<0时,怎样选择型式 (平推流或全混流)使反应器体积最小,并简朴阐明 理由,并在图上表达反应器旳体积。
• 解:当n=0时,反应速率与反应物浓度无关,故与反应器 型式无关。
解:(1)Vm
FA0 kC A0
• xA 1 xA
VP
FA0 kC A0
ln 1 Vm 1 xA VP
xA 1 xA
1 / ln
1 xA
2.94
(2)Vm/Vp=1,一样得到:
km xA / ln 1 2.94 kP 1 xA 1 xA
km
k e
E RTm
0
kp
k e
E RT p
0
e 2.94 E R
ln(1 0.75) ln(1 0.5)
10 min
• 二级反应:
t
C
A0
xA 0
kC
2
A0
dx A (1
xA
)2
1 kC A0
• xA 1 xA
t0.75
t0.5
0.75 1 0.75
• 1 0.5 0.5
15 min
对于气相反应:A→3P 其反应速率方程为-rA=kCA,在一平推 流反应器中进行等温恒压反应。已知反应器体积为V,原料体积 流量为v0,初始浓度为CA0。试推导:其反应器设计方程,并以 A组分转化率xA表达成易积分旳形式。假定原料为纯A,气体符 合理想气体。
CB = CB0- CR-CS=4.0-1.5-0.1=2.4 mol/L
在等温恒容条件下进行下列气相反应:A→2R其反应速率方程
【免费下载】反应工程计算题

化学工程基础(武汉大学第二版)1、在间歇反应器中进行等温一级反应A →R+S,已知反应进行30S 时反应物A 的转化率为90%,求转化率达到99%时还需要多少时间?计算结果说明了什么?2、在间歇反应器中进行等温液相反应A+B→R 已知(-r A )=kC A C B molL -1min -1,k=0.3Lmol-1min-1, C A0=C B0=0.2molL -1,试计算反应物A 的转化率分别达到90%和99%时所需要的时间,并做比较。
3、在间歇反应器中用乙酸和丁醇生产乙酸丁酯,其反应式为:3493492CH COOH+C H OH CH COOC H +H O A B C D →反应在100℃等温进行,进料物质的量比为A:B=1:4.97,并以少量硫酸为催化剂。
由于丁醇过量,其动力学方程为(-r A )=kC 2A ,式中k 为1.74×10-2m 3kmol -1min -1。
已知反应物密度ρ为750kg/m 3(反应前后基本不变),若每天生产乙酸丁酯2450kg (不考虑分离过程损失),每批物料的非生产时间取0.5h ,求乙酸转化率为55%时所需间歇反应器的体积(装料系数φ=0.75)。
()3433492A0CH COOH+C H OH CH COOC H +H O F 0.0326/min.kmol →=⨯⨯解:2450由化学反应方程可知:=24601161-05533A0011.753/60174 4.97750F 0.03260.0186/min1.753AO AO C kmol m v m C ==⨯+⨯∴===()()()222020()10.5540.07min 1 1.7410 1.75310.55A A A A A A rA kC kC x x t kC x --==-⇒===-⨯⨯- ()()3030.018640.0730 1.301.301.730.75R RRT V v t t m V V m ϕ'∴=+=+====答:略。
化学反应工程_习题集(含答案)

《化学反应工程》课程习题集一、单选题1.某反应的速率常数k=0.0462-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为:(A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分 (D) 1/(4.62×102×0.1)分2.某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则:(A ) t1﹥t2 (B) t1=t2(C) t1﹤t2 (D) 不能确定二者关系3.某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是:(A) 零级 (B) 一级反应 (C) 三级反应 (D) 二级反应4.若两个相同类型的气相双分子反应的△H⊙值相等, 又在400k时,它们的活化熵之差△S1⊙-△S2⊙=10 J.mol-1,则两反应的速率常数之比为:(A) K1/K2=0.300 (B) K1/K2=0.997(C) K1/K2=1.00 (D) K1/K2=3.335.对反应A+B→C, 由下列数据C A0/mol.dm-3 C B0/mol.dm-3 r0/ mol.dm-31.0 1.0 0.152.0 1.0 0.301.02.0 0.15则该反应的速率方程为:(A) r=K C B (B) r=K C A C B(C) r=K C A (D) r=K C A C B26.一个反应的活化能是33kJ·mol-1, 当 T = 300K 时,温度每增加1K,反应速率常数增加的百分数约是___。
A. 4.5%B. 90%C. 11%D. 50%7.下列叙述正确的是_ 。
A. 吸热反应的活化能比放热反应的活化能高B. 一个反应的反应速率与化学方程式中出现的所有作用物浓度都有关C. 催化反应的速率与催化剂的浓度无关D. 反应速率常数与作用物浓度无关8.关于催化剂的使用,下列叙述中不正确的是_ 。
化学反应工程试题及答案

化学反应工程试题及答案一、单项选择题(每题2分,共20分)1. 化学反应工程主要研究的是()。
A. 化学反应的速率B. 化学反应的机理C. 化学反应的平衡D. 化学反应的设备答案:A2. 反应速率常数k与温度的关系可以用()来描述。
A. 阿伦尼乌斯方程B. 范特霍夫方程C. 吉布斯自由能方程D. 牛顿冷却定律答案:A3. 在固定床反应器中,催化剂的表面积对反应速率的影响是()。
A. 增加催化剂表面积可以提高反应速率B. 增加催化剂表面积可以降低反应速率C. 催化剂表面积对反应速率无影响D. 催化剂表面积与反应速率成反比答案:A4. 以下哪种反应器属于非均相反应器()。
A. 管式反应器B. 搅拌槽反应器C. 流化床反应器D. 所有选项都是答案:C5. 反应器设计时,如果希望提高反应物的转化率,应该考虑()。
A. 提高反应温度B. 增加反应物浓度C. 增加催化剂用量D. 所有选项都是答案:D二、填空题(每题2分,共20分)1. 阿伦尼乌斯方程中,温度每升高10℃,反应速率常数k大约增加______倍。
答案:2-32. 反应器的停留时间分布可以通过______来描述。
答案:停留时间分布曲线3. 流化床反应器中,颗粒的流态化状态可以通过______来实现。
答案:鼓泡或喷动4. 反应器的体积传质系数通常用______表示。
答案:kLa5. 在反应器设计中,如果需要提高反应速率,可以采用______的方法。
答案:增加催化剂活性三、简答题(每题10分,共30分)1. 简述反应器的类型及其特点。
答案:反应器的类型包括管式反应器、搅拌槽反应器、流化床反应器等。
管式反应器适用于气体与固体催化剂的反应,优点是结构简单,易于放大;搅拌槽反应器适用于液体或液固反应,优点是混合均匀,反应速率快;流化床反应器适用于气固或液固反应,优点是传热传质效率高,反应速率快。
2. 描述如何通过实验测定反应速率常数k。
答案:通过改变反应物浓度或温度,测量反应速率的变化,然后利用阿伦尼乌斯方程或实验数据拟合,可以求得反应速率常数k。
反应工程计算及推导考试题目

2.在银催化剂上进行甲的醇应:2CH3OH+O2→2HCHO+2H2O 2CH3OH+3O2→2CO2+4H2O进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%。
甲醇的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为S=Y/X=0.692/0.720=0.9611=96.11%(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料为100mol时,则反应器的进料组成为组分摩尔分率yi0摩尔数ni0(mol)CH3OH0.27427.4空气0.547954.79(O2:11.51,N2:43.28)水0.178117.81总计1100设甲醇的转化率为为XA,甲醇的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇,甲醛和二氧化碳摩尔数nA,np,nC,分别为nA=nA0(1-XA)=7.672mol np= nA0YP=18.96molnC= nA0(XA-YP)=0.7672 mol综上所述反应的化学计量式水(nW),氧气(nO,和氮气(nN)的摩尔数为nW= nW0+ nP+2 nC=38.30 mol nO= nO0-1/2 np-3/2nC=0.8792mol nN=nN0=43.28mol所以,反应器出口气体组成为....3.在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为9.629×104J/mol,如果不考虑逆反应,在反应物料组成相同的情况下,试问反应温度为550℃时的速率比反应温度为400℃时的反应速率大多少倍?解:从题中可知,反应条件除了温度不同外,其他条件都相同,而温度的影响表现在反应速率常数k上,故可用反应速率常数之比来描述反应速率之比。
r550/r400=k550/k400=Aexp(-E/RT550)/ Aexp(-E/RT400)=exp[E/R(1/T400-1/T550)]=23(倍)4.甲烷与水蒸气在镍催化剂及750℃等温下的转化反应为:原料气中甲烷与水蒸气的摩尔比为1:4,若是这个反应对各反应物均为1级。
反应工程题库

化学反响工程?试题一、填空题1. 质量传递 、 热量传递 、 动量传递 和化学反响 称为三传一反. 1. 物料衡算和能量衡算的一般表达式为 输入-输出=累积 。
2. 着眼组分A 转化率x A 的定义式为 x A =(n A0-n A )/n A0 。
3. 总反响级数不可能大于 3 。
4. 反响速率-r A =kC A C B 的单位为kmol/(m 3·h),速率常数k 的因次为 m 3/(kmol ·h ) 。
5. 反响速率-r A =kC A 的单位为kmol/kg ·h ,速率常数k 的因次为 m 3/kg ·h 。
6. 反响速率2/1A A kC r =-的单位为mol/L ·s ,速率常数k 的因次为 (mol)1/2·L -1/2·s 。
7. 反响速率常数k 与温度T 的关系为2.1010000ln +-=Tk ,其活化能为。
8.某反响在500K 时的反响速率常数k 是400K 时的103倍,那么600K 时的反响速率常数k 时是400K 时的 105 倍。
9.某反响在450℃时的反响速率是400℃时的10倍,那么该反响的活化能为〔设浓度不变〕。
10. 非等分子反响2SO 2+O 2==2SO 3的膨胀因子2SO δ等于 -0.5 。
11. 非等分子反响N 2+3H 2==2NH 3的膨胀因子2H δ等于 –2/3 。
12. 反响N 2+3H 2==2NH 3中〔2N r -〕= 1/3 〔2H r -〕= 1/2 3NH r13. 在平推流反响器中进展等温一级不可逆反响,反响物初浓度为C A0,转化率为x A ,当反响器体积增大到n 倍时,反响物A 的出口浓度为 C A0(1-x A )n ,转化率为 1-(1-x A )n 。
14. 在全混流反响器中进展等温一级不可逆反响,反响物初浓度为C A0,转化率为x A ,当反响器体积增大到n 倍时,反响物A 的出口浓度为A Ax n x )1(11-+-,转化率为AA x n nx )1(1-+。
化学反应工程计算题

化学反应工程计算题1、80℃时氯乙醇的皂化反应为:CH 2Cl-CH 2OH+NaHCO 3→CH 2OHCH 2OH+NaCl+CO 2 属基元反应,其反应速度常数k =5.2L/mol ·h 现拟用15%(质量)的NaHCO 3水溶液30%(质量)的氯乙醇水溶液为原料,建立一个日产480Kg 的乙二醇的中间工厂,今使用等摩尔比原料,要求氯乙醇转化率为95%,试计算:采用间歇反应器,非生产时间为0.5小时/批时所需有效体积。
反应为等温等容过程,混合物料比重为1.02。
解:V =υ0(t+t 0)投料中氯乙醇量为:2495.0624800.34 kmol/h氯乙醇水溶液量为:23.9130.05.8034.0 kg/h碳酸氢钠水溶液量为:4.19015.08434.0 kg/hυ0=02.14.19023.91 =276.1 l/h t =01kCa XafXaf 1进料中氯乙醇量的浓度:C Ao =1023.11.27634.0 -3kmol/l =1.23 mol/lt =95.0195.023.12.51 2.97 h V =276.1×(2.97+0.5)=958.07 l2、已知氯乙醇2.97的皂化反应为:CH 2Cl-CH 2OH+NaHCO 3→CH 2OHCH 2OH+NaCl+CO 2 属基元反应,其反应速度常数k=5.2L/mol ·h ,现拟用15%(质量)的NaHCO 3水溶液30%(质量)的氯乙醇水溶液为原料,建立一个日产480Kg 的乙二醇的中间工厂,今使用等摩尔比原料,要求氯乙醇转化率为95%,反应为等温等容过程,混合物料比重为1.02,试计算: 采用理想管式流动反应器时所需体积。
解:V =υ0t投料氯乙醇的量为:2495.0624800.34 kmol/hCH 2CL -CH 2OH 的水溶液量为:23.9130.05.8034.0 kg/hNaHCO 3水溶液量为:4.19015.08434.0 kg/hυ0=02.14.19023.91 =276.1 l/h t =01kCa XafXaf 1进料中C Ao =1.2761034.0 =1.23 mol/l∴t =95.0195.023.12.51 2.97 h ∴V =2.97×276.1=820.02 l3、已知基元反应:CH 2Cl-CH 2OH+NaHCO 3→CH 2OHCH 2OH+NaCl+CO 2,其反应速度常数k =5.2L/mol ·h ,现拟用15%(质量)的NaHCO 3水溶液30%(质量)的CH 2Cl-CH 2OH 水溶液为原料,建立一个日产480Kg 的CH 2OHCH 2OH 的中间工厂,反应可视为等温等容过程,混合物料比重为1.02。
反应工程计算题资料

1. 某工厂在间歇反应器中进行两次试验,初始浓度相同并达到相同的转化率,第一次试验在20℃下进行8天,第二次试验在120℃下进行10分钟,试估算该反应的活化能。
2. 一般情况下,反应温度上升10℃,反应速率增大一倍(即为原来的2倍)。
为了使这一规律成立,活化能与温度间应保持关系?并求出下列温度下的活化能。
温度(K ):300,400,600.3. 醋酸和乙醇的反应为二级反应,在间歇反应器中进行,转化率达到50%时需要5min ,问,转化率为75%时需要增加多长时间?4. 证明一级反应在等温条件下转化率99.9%所需要的反应时间为转化率为50%所需时间的10倍。
5. 现有0.5级反应A→P ,10min 后转化率为0.75,问半小时后转化率为多少?6. 在等温间歇反应器中进行下列液相反应:P B A →+ )/(23h m kmol c r A P ⋅=R A →2)/(5.032h m kmol c r A R ⋅=A 和B 的初始浓度均为2 kmol /m 3,P 为目标产物,试计算反应2 h 时A 的转化率和产物P 的收率。
7. 在一理想管式反应器中进行二级反应,当进料初始浓度从0.3降到0.04,而要求反应器出口的残余浓度维持在0.001。
请问进料体积流率应作如何调整?8. 四氟乙烯是生产聚四氟乙烯所用的单体,可以将一氯二氟甲烷进行热分解得到,反应方程为:HCl F C CHClF 22222+→若在0.10133Mpa ,700℃的等温条件下,用直径为100 mm 的管式反应器进行分解纯的一氯二氟甲烷,原料流量为0.4 kmol/min 。
试计算分解率为0.8时所需管长。
已知反应为一级,700℃时反应的速率常数k =0.97 s -1.9. 在理想管式反应器中进行反应P A →,反应温度555 K 、压力0.294 Mpa 。
已知进料中含有30%的A (摩尔分率),其余为惰性气体。
A 的加料流率为6.3 mol/s ,动力学方程为A A kc r =-)(为了达到转化率95%,试求该反应器的体积。
反应工程期末考试试题及答案解析

反应工程期末考试试题及答案解析# 反应工程期末考试试题及答案解析一、选择题(每题2分,共20分)1. 反应工程中,反应速率常数与温度的关系遵循以下哪个方程?A. Arrhenius方程B. Van't Hoff方程C. Le Chatelier原理D. Nernst方程答案:A2. 在恒温恒压条件下,下列哪种反应的速率表达式是线性的?A. 零级反应B. 一级反应C. 二级反应D. 三级反应答案:A3. 反应器中,若反应物A的浓度由C0降至Ct,对于一级反应,反应物A的转化率Xt是多少?A. Xt = C0 - CtB. Xt = C0 / CtC. Xt = 1 - Ct / C0D. Xt = ln(C0 / Ct)答案:C4. 以下哪种类型的反应器是理想混合反应器?A. 连续搅拌槽反应器(CSTR)B. 填充床反应器(PBR)C. 管式反应器(PFR)D. 固定床反应器答案:A5. 以下哪个参数不是描述反应器性能的?A. 转化率B. 选择性C. 产量D. 停留时间分布答案:C6. 催化剂的作用是什么?A. 提高反应物浓度B. 改变反应的平衡位置C. 降低反应的活化能D. 增加反应物的摩尔质量答案:C7. 反应动力学参数通常通过哪种方法获得?A. 理论计算B. 实验测定C. 经验公式D. 反应平衡常数答案:B8. 在反应器设计中,为什么需要考虑反应器的体积?A. 为了控制成本B. 为了确保足够的反应时间C. 为了提高反应物的转化率D. 为了增加反应器的使用寿命答案:B9. 以下哪个不是影响反应速率的因素?A. 温度B. 压力C. 催化剂D. 反应物的摩尔质量答案:D10. 在反应工程中,哪个参数与反应速率成正比?A. 反应物浓度B. 反应物的摩尔质量C. 反应器的体积D. 反应器的表面积答案:A二、简答题(每题10分,共20分)1. 简述连续搅拌槽反应器(CSTR)的工作原理。
答案解析:连续搅拌槽反应器(CSTR)是一种理想混合反应器,其工作原理是反应物连续不断地进入反应器,同时产物也连续不断地从反应器排出。
化学反应工程试题及答案

化学反应工程试题及答案一、选择题(每题2分,共10分)1. 以下哪个不是化学反应工程研究的范畴?A. 反应器设计B. 反应动力学C. 反应过程控制D. 有机化学合成2. 反应器中,催化剂的作用是什么?A. 提高反应速率B. 改变反应平衡C. 降低反应温度D. 增加产物产量3. 在工业生产中,连续搅拌槽式反应器(CSTR)与间歇搅拌槽式反应器(BSTR)相比,以下哪个描述是正确的?A. CSTR的体积通常比BSTR大B. CSTR的物料停留时间是固定的C. BSTR可以处理更复杂的反应体系D. CSTR的操作成本通常低于BSTR4. 以下哪种反应器类型适用于快速反应?A. 填充床反应器B. 管式反应器C. 流化床反应器D. 脉冲反应器5. 反应动力学中的“零级反应”指的是什么?A. 反应速率与反应物浓度无关B. 反应速率与反应物浓度成正比C. 反应速率与反应物浓度成反比D. 反应速率与反应物浓度的平方成正比二、简答题(每题10分,共30分)6. 简述反应器设计中的主要考虑因素。
7. 描述连续搅拌槽式反应器(CSTR)与间歇搅拌槽式反应器(BSTR)的主要区别。
8. 解释什么是反应器的停留时间分布(RTD)。
三、计算题(每题15分,共30分)9. 假设一个零级反应A → B,反应速率常数k=0.1 min^-1。
如果初始时刻[A]0=1 mol/L,求5分钟后[A]的浓度。
10. 给定一个反应A + B → C,反应速率表达式为r = k[A][B],其中k=0.05 L/mol·min。
初始时刻[A]0=1 mol/L,[B]0=2 mol/L。
如果反应在CSTR中进行,且反应器体积V=10 L,进料流速F_in=1 L/min,求稳态时[A]和[B]的浓度。
四、论述题(每题30分,共30分)11. 论述在实际工业生产中,如何根据反应特性选择合适的反应器类型。
答案一、选择题1. D(有机化学合成)2. A(提高反应速率)3. D(CSTR的操作成本通常低于BSTR)4. D(脉冲反应器)5. A(反应速率与反应物浓度无关)二、简答题6. 反应器设计中的主要考虑因素包括:反应类型、反应速率、反应物和产物的性质、操作条件(如温度、压力)、安全性、成本效益、环境影响等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 反应2NO + 2H 2= N 2+ 2H 2O ,实验测得速率方程为:222H NO NC kC =γ。
试设定能满足实验结果的反应机理。
解:机理(1):222212O H N H NO k +−→−+ (慢) ① O H H O H k 222222−→−+ (快)②22211HNO N C C k ==γγ所以与实验结果相同机理(2):222O N NO ⇔ (快速)③2222225O H N H O N k +−→−+ (慢速)④OH H O H k 222226−→−+ (快) ⑤③达拟平衡态,④为速控步骤222255H O N N C C k ==γγ由③得23422NOO N C k C k =24322NO O N C k k C =代入22222435H NO H NO N C kC C C k k k ==γ此机理与实验结果相同,选机理(2),因其无叁分子反应,而机理(1)是。
2. 由A 和B 进行均相二级不可逆反应αA A+αBB = αSS ,速率方程:A γ-==-dtdC AB AC kC 。
求: (1)当BAB AC C αα=00时的积分式(2)当B AAB B A C C ααλ≠=0时的积分式解:(1)C A 与C B 之比保持恒定B ABAB AC C C C αα==0所以A BA B C C αα=⎰=0A AC C BA AC C dC kt⎰⎰=⇒=02'2A AA AC C C C AAA AB AC dC t k C dC kt ααkk A Bαα='积分得'11A A C C t k -=写成转化率时)1(10'A A A C t k χχ-=(2))1(0A A A C C χ-=)1()1(1000A B A B A B A B B C C C C C χαχαα-=-=式中: ABAB B A A BC C λααααα==001积分得⎥⎦⎤⎢⎣⎡---=A AB Ckt χχαα11ln )1(11013.反应A → B 为n 级不可逆反应。
已知在300K 时要使A 的转化率达到20%需12.6分钟,而在340K 时达到同样的转化率仅需3.20分钟,求该反应的活化能E 。
解:nA A A kC dt dC r =-=-⎰⎰=-A A C C t n AA t dt C dC 0即kt C C n n A n A =⎥⎦⎤⎢⎣⎡----1011111达20%时,08.0A A C C =t M t C n k n n A 11)125.1()1(111⨯=⨯--=-- 式中M 为常数 ∴6.121300⨯=M k 2.31340⨯=M k)34013001(314.86.12/2.3/ln ln300340-==E M M k kE=29.06(kJ/mol )4.考虑下述连串反应:C k B k A −→−−→−21,已知上述反应中每一步均为一级反应,试求A 、B 和C 的浓度随间变化的函数式。
解:对于反应物A ,应有:A AC k dt dC 1=-积分得 )ex p(10t k C C A A-=对于B,应有 B A B A BC k t k C k C k C k dt dC 210121)exp(--=-= 将上式两端乘以)ex p(2t k 可得dtt k k C k dt t k C k dC t k A B B ])ex p[()ex p()ex p(1201222-=+即dt t k k C k t k C d A B ])ex p[()ex p([12012-=将上式积分得,}1]){ex p[()ex p(1201212---=t k k C k k k t k C A B)}ex p(){ex p(210121t k t k C k k k C A B ----=0A C B A C C C C =++)(0B A A C C C C C +-=∴)]ex p()ex p(1[212111220t k k k k t k k k k C A --+---=5.在间歇釜中一级不可逆反应,液相反应A → 2R ,A AkC r =-kmol/m 3·h ,k=9.52×109exp[-7448.4/T] h -1,=0A C 2.3 kmol/m 3,=R M 60,=0R C 0若转化率=A x 0.7,装置的生产能力为50000 kg 产物R/天。
求50℃等温操作所需反应器的有效容积?(用于非生产性操作时间t 0=0.75 h ) 解:反应终了时R 的浓度为)/(22.3230m kmol x C C A A R ==A x A A x AA A x k x dx k kC dx C t A A-=-==⎰⎰11ln111000 92.0502734.7448ex p 1052.99=⎥⎦⎤⎢⎣⎡+-⨯=k)(31.17.011ln 92.01h t =-= 24500000=+t t M VC R R)(2.226022.32406.2500003m V =⨯⨯⨯=6.CH 2 = CH CH = CH 2(A) + CH 2 = CHCOOCH 3(B)COOCH 3(C)该反应在全混流反应器中进行,以AlCl 3为催化剂,反应温度20℃,液料的体积流速为0.5 m 3/h ,丁二烯和丙烯酸甲酯的初始浓度分别为=0A C 96.5 mol/m 3,=0B C 184 mol/m 3,催化剂的浓度为=D C 6.6mol/m 3。
速率方程D A A C kC r =-,式中k=1.15×10-3m 3/mol ·ks ,若要求丁二烯转化率为40%。
求:1)反应器的体积V ; 2)容积效率η。
解:1) A + B → CD A A D A AA C x kC C kC dt dC r )1(0-==-=-对于全混流反应器 ∵D A AD A A A A A A A C x k x C x kC x C r x C )1()1(000-=-=-=τ ∴)(28.24)(4.8763.6)4.01(1015.14.03h ks ==⨯-⨯⨯=-τ∵0v V=τ h m v /5.030= ∴3014.125.028.24m v V =⨯==τ 2)在分批式反应器内的反应时间为)(67114.000ks x dx kC r dx C t Ax AADA A A =-=-=⎰⎰766.04.8767===τηt7. 在全混流反应器中一级不可逆反应,液相反应A → 2R ,A A kC r =-kmol/m 3·h ,k=9.52×109exp[-7448.4/T] h -1,=0A C 2.3 kmol/m 3,=R M 60=0R C 0,若转化率=A x 0.7,装置的生产能力为50000 kg 产物R/天。
求50℃等温操作所需反应器的有效容积和它的容积效率η?(用于非生产性操作时间t 0=0.75 h )解:(1)进料速度v 0A A R x C C 02=R A A R M x v C C v ⨯==∴24500002000 60,7.0,3.20===R A A M x C 以h m v /78.10)7.03.226024/(5000030=⨯⨯⨯⨯=(2)反应器有效容积V)1(00A A A AA x k x kC x C v V -===τ3034.27)1(m x k x v V A A=-=∴(3)A x A A x A A A x k x dx k kC dx C t A A-=-==⎰⎰11ln111000 92.0502734.7448ex p 1052.99=⎥⎦⎤⎢⎣⎡+-⨯=k)(31.17.011ln 92.01h t =-=516.054.213.1===τηt8. 现有一有效容积为0.75m 3的搅拌釜反应器,其内设置有换热面积为5.0m 2的冷却盘管。
欲利用改反应器来进行A →R 的一级不可逆的液相反应,其速率常数)(9.5525ex p 100788.119-⎥⎦⎤⎢⎣⎡-⨯=h T k ,反应热molA J H r /20921)(=∆-,原料液中A 的浓度l mol C A /2.00=,但不含反应产物R 。
此原料液的密度ρ=1050g/l ;定压比热929.2=P C (J/g ·℃)。
要求原料液的进料流率为h m v /330=,反应器出口的反应液中lmol C A /04.0=。
总传热系数U=209.2(KJ/m 2·h ·℃)。
所用的冷却介质的温度为25℃。
试求满足上述反应要求所需的反应温度以及料液的起始温度T 0。
解:1)计算反应温度Tτk C C A A +=1118)375.0()104.022.0()1(=-=-=τAA C C k根据 ]9.5525exp[100788.19T k -⨯=K T 6.308= 2)])())((00P m r A c v T T UA H r V T T ρ--∆---=KT 4.297929.210503)16.2986.308(52.2092092175.004.0186.3080=⨯⨯-⨯⨯+⨯⨯⨯-=9. (CH 3CO)2 (A) + H 2O(B)2CH 3COOH(C)乙酸酐发生水解,反应温度25℃,k=0.1556 min -1,采用三个等体积的串联全混流釜进行反应每个釜体积为1800 cm 3,求使乙酸酐的总转化率为60%时,进料速度0v 。
解:初始浓度为0A C ,离开第一釜为1A C ,依次为2A C 、3A C 。
∵1101)(A A A r C C --=τ 11)(A A kC r =- ∴11101110111111τττk x k C C kC C C A A A A A A +-=⇒+=⇒-=对第二釜21211τk C C A A +=对于等体积釜串联τττ==2122202)1(11)1(1ττk x k C C A A A +-=⇒+=同理 33)1(11τk x A +-= ∴τ=2.3(min )min)/(6.7823.2180030cm Vv ===τ10. 串联全混流反应器进行一级不可逆反应,假定各釜容积、温度相同,,9.0,10),(92.0301===-A x h m h k γ试计算N 为1,2,3的反应有效容积,如不考虑非生产性操作时间的条件下分批式反应器的有效容积。
解:利用 Ni N A k x )1(11,τ+-=N(个) 1 2 3V (3m ) 97.8 47.0 37.6 若采用分批式=t h k A 503.29.011ln 92.0111ln 1=-=-χ 时为其中1N ,==ττV V t Bh78.9108.97==τ 303.258.9778.9503.2m V B =⨯=∴11.应用两个按最优容积比串联的全混流釜进行不可逆的一级液相反应,假定各釜的容积和操作温度都相同,已知此时的速率常数k=0.92h -1,原料液的进料速度0v=10m 3/h ,要求最终转化率=A x 0.9,试求V 1、V 2和总容积V 。
