【强烈推荐】晶体原子堆积模型模型与计算(绝对精品)
金属晶体的原子堆积模型PPT多媒体教学课件

一.古代希腊的自然地理环境:
1.自然地理环境: (1)地理环境:地处地中海东部,连绵不绝的山岭沟壑将陆地隔
成小块;没有肥沃的大河流域和开阔平原;但海洋资源得天独厚。
(2)自然地理环境对民主政治的影响:自然环境促使希腊人进行 海外工商业贸易和殖民活动,逐渐形成宽松自由的社会环境,接 受了平等互利的观念,为民主政治的产生提供基本历史条件。
高中《化学》新人教版 选修3系列课件
物质结构与性质
3.3.2《金属晶体的原子 堆积模型》
金属晶体的原子堆积模型
(1)几个概念 紧密堆积:微粒之间的作用力使微粒间尽
可能的相互接近,使它们占有最小的空间
配位数:在晶体中与每个微粒紧密相邻的 微粒个数
空间利用率:晶体的空间被微粒占满的体积 百分数,用它来表示紧密堆积的程度
(1)图中正方形边长 a, (2)铜的金属半径 r
r
提示:
数出面心立方中的铜的个数:
r o
a
r
r
a
古代希腊罗马史
希腊雅典卫城
罗马圆形剧场
考纲范围
(一) 古代希腊、罗马的政治制度 1.雅典民主政治 2.罗马法
(二) 西方人文精神的起源
(三) 古代西历史人物
亚里士多德
考试说明
• 1.古代希腊、罗马的政治制度 • (1)雅典民主政治 • 地理环境与城邦制度对希腊文明的影响 • 雅典民主政治的内容及其意义 • (2)罗马法 • 罗马法的内容与作用 • 2.西方人文精神的起源 • (1)智者学派 • 普罗塔哥拉的思想主张 • (2)苏格拉底 • 苏格拉底的思想主张
1917年—?
古希腊——公元前800年 - 公元前146年
古希腊的地理范围,除了现在的希腊半岛外, 还包括整个爱琴海区域和北面的马其顿和色雷 斯、亚平宁半岛和小亚细亚等地。公元前5、6 世纪,特别是希波战争以后,经济生活高度繁 荣,产生了光辉灿烂的希腊文化,对后世有深 远的影响。古希腊人在文学、戏剧、雕塑、建 筑、哲学等诸多方面有很深的造诣。这一文明 遗产在古希腊灭亡后,又被古罗马延续下去, 从而成为整个西方文明的精神源泉。
金属晶体堆积模型复习及计算上.pptx
上图甲、乙、丙分别为体心堆积、面心立方堆积、六方堆积的结构单元,则甲、乙、丙三种结构单元中,金属原子个数比为—————————。
1:2:3
乙晶胞中所含金属原子数为8×1/8+6×1/2=4
晶胞中所含金属原子数为12×1/6+2×1/2+3=6
练3:
第31页/共40页
堆积方式
晶胞类型
空间利用率
配位数
实例
面心立方最密堆积
堆积方式及性质小结
简单立方堆积
体心立方密堆积
六方最密堆积
面心立方
六方
体心立方
简单立方
74%
74%
68%
52%
12
12
8
6
Cu、Ag、Au
Mg、Zn、Ti
Na、K、Fe
Po
第32页/共40页
第33页/共40页
体心立方堆积
配位数:8
第34页/共40页
面心(铜型)堆积方式的空间利用率计算
复习1pm=10-12m
第29页/共40页
现有甲、乙、丙、丁四种晶胞,可推知甲晶体中与的粒子个数比为——————;乙晶体 的化学式为—————— ————;丙晶体的化学式为—————— ;丁晶体的化学式为——————。
A
B
C
D
F
E
Z
X
Y
1:1
DC2
或C2D
EF或FE
XY2Z
甲
乙
丙
丁
练2:
第30页/共40页
以体心立方晶胞为例,计算晶胞中原子的空间占有率。
第21页/共40页
配位数:8
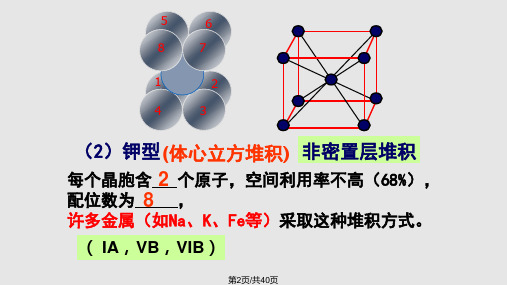
小结:(2)钾型
(体心立方堆积)
高中化学 《金属晶体的原子堆积模型》课件

通过金属键形成的 晶体
共价键
范德华力
金属键
原子 很高 很大
分子 很低 很小
金属阳离子和自由 电子
差别较大
差别较大
无(硅为半导体)
无
导体
实例
金刚石、二氧化硅、 晶体硅、碳化硅
Ar、S等
Au、Fe、Cu、钢 铁等
第一层小球形成的空穴
(1)简单立方堆积
Po
简 单 立 方 晶 胞
①简单立方晶胞平均占有的原子数目:
1率:
③配位数: 6
同层4,上下层各1
2
1
3
4
6
2
1
3
4
5
(2)体心立方堆积(钾型) 碱金属
体 心 立 方 晶 胞
①体心立方晶胞平均占有的原子数目:
1 8
×8
+
1=
2
②空间利用率:
③配位数: 8
上下层各4
56
87 12 43
第二层 对第一层来讲最紧密的堆积方式 是将球对准1,3,5 位。 ( 或对准 2,4 ,6 位,其情形是一样的 )
12
6
3
54
12
6
3
54
关键是第三层,对第一、二层来说,第三层 可以有两种最紧密的堆积方式。
配位数 空间利用率
12 74%
晶胞的体积
晶体的空间被微粒所占的体积百分 数,用它来表示紧密堆积的程度。
﹪
1、二维空间金属原子的排列方式
非密置层
2
1
3
4
密置层
23
1
4
65
行列对齐 四球一空
配位数: 4
行列相错 三球一空
(完整版)金属晶体堆积模型及晶胞相关计算资料篇

V球 V晶胞
三、面心立方和六方密堆积模型晶胞获取示意图
100%
74.05%
高山不爬不能到顶,竞走不跑不能取胜,永恒的幸福不争取不能获得。
想成为一名成功者,先必须做一名奋斗者。
高二化学人教版选修Ⅲ 导学案 编排 蓬安中学化学备课组 2012 年 11 月使用
金属晶体堆积模型及晶胞相关计算资料篇
高二 班 第 组 姓名
组内评价
教师评价 _______
一、原子空间利用率的计算
1、空间利用率: 指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。
计算公式:
空间利用率 = 球体积 / 晶胞体积
100%
2、空间利用率的计算步骤:
( 1)计算晶胞中的微粒数
( 2)计算晶胞的体积
二、各种金属晶体堆积方式计算
( 1)简单立方
在立方体顶点的微粒为 8 个晶胞共享, 微粒数为: 8× 1/8 = 1
合作探究 共同进步 帮助他人 温暖自己 默默大师 . 杨忠
( 3)面心立方 (铜型) 在立方体顶点的微粒为 8 个晶胞共有,在面心的为 1 个晶胞所含微粒数为: 8× 1/8 + 6× 1/2 = 4
2 个晶胞共有。
ቤተ መጻሕፍቲ ባይዱ
( 4)六方密堆积 (镁型)
( 2)体心立方 在立方体顶点的微粒为 8 个晶胞共享,处于体心的金属原子全部属于该晶胞。 1 个晶胞所含微粒数为: 8× 1/8 + 1 = 2
在立方体顶点的微粒为 8 个,中心还有 1 个。 1 个晶胞所含微粒数为: 8× 1/8 +1= 2
V球
2 4 r 3 (晶胞中有 2个球 ) 3
高中化学鲁科版 选修三 3.2 第2课时金属晶体的原子堆积模型(共21张PPT)

C)
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
2.金A.属金能属导晶电体的中原金因属是阳(离子B)与自由电子间的
相互作用较弱 B.金属晶体中的自由电子在外加电场作用下 可发生定向移动 C.金属晶体中的金属阳离子在外加电场作用 下可发生定向移动 D.金属晶体在外加电场作用下可失去电子
空间利用率
= 晶胞含有原子的总体积 / 晶胞体积 100%
解:体心立方晶胞:中心有1个原子, 8个顶点各1个原子,每个 原子被8个 晶胞共享。每个晶胞含有几个原子:1 + 8 × 1/8 = 2
学.科.网
设原子半径为r 、晶胞边长为a ,根据勾股定理,
得:2a 2 + a 2 = (4r) 2
12
6
3
54
12
6
3
54
12
6
3
54
第三层的一种排列方式,是将球对准第一 层每一个球,于是每两层形成一个周期, 即 AB AB 堆积方式。
六方最密堆积
下图是镁型紧密堆积的前视图
A
12
6
3
B
54
A
B A
7 1 9
6
5
8 2
3 4
10
11
12
这种堆积晶胞空间利用率高(74%),属于最 密置层堆积,配位数为 ,12许多金属(如Mg、 Zn、Ti等)采取这种堆积方式。
金属晶体---金属晶体的原子堆积模型
(第二课时)
复习回顾:
❖ 1.何谓金属键?成键微粒是什么?有何特 征?
❖ 2.哪些因素会影响金属键的强弱?
❖ 3.如何用金属键解释金属的导热性、导电 性?
3.3金属晶体 堆积模型

堆积方式一: 简单立方堆积 ------钋型 只有金属钋(Po)采取这种堆积方式
配位数? 晶胞? 空间利用率?
每个晶胞含原子数?
晶胞的抽取
简单立方晶胞的空间利用率计算:
边长为a
a=2r
V晶胞=Байду номын сангаас3
V球=4πr3/3 4πr3/3 空间利用率= a3 ≈52% ×100%
(2) 密置层在三维空间堆积
第二层 对第一层来讲最紧密的堆积方式是将球对准 1,3,5 位。 ( 或对准 2,4,6 位,其情形是一样的 )
1 6 5 4 2 3 6 5 4
1
2
3
关键是第三层,对第一、二层来说,第三层
可以有两种最紧密的堆积方式。
堆积方式一: 将球对准第一层的球。
1 6 5 4 下图是此种六方 紧密堆积的前视图
Mg 、Zn 、Ti采用这种堆积方式
配位数? 晶胞? 空间利用率?
每个晶胞含原子数?
堆积方式二:
第三层的另一种排列 方式,是将球对准第一层 1 6 5 4
2
3
的 2,4,6 位,不同于
AB 两层的位置,这是 C 层。
1 6 5
2 3 4
1 6
5
2
3
4
第四层再排 A,于是形 成 ABC ABC 三层一个周
1、金属原子在平面上堆积模型
围剩余空隙最小?
(a)非密置层
(b)密置层 配位数:6
配位数:4
金属晶体可以看成金属原子在三 维空间中堆积而成.那么,非密置层 和密置层在三维空间里堆积有分别 有几种方式?请比较不同方式堆积 时金属晶体的配位数、原子的空间 利用率、晶胞的区别。
《金属晶体的原子堆积模型》精品课件

合作学习四
4.面心立方最密堆积
5
1
3
14
2
6
C
10
4
B
13
9
7
A
11
8
12
(1)平均每个晶胞占有的原子数:
8x1/8+6x1/2=2
(2)配位数: 12
(3)代表金属:Cu Ag Au
课堂总结
金属晶体中原子的四种基本堆积模型
金属原子的 平面排列方式
金属原子的 空间堆积方式
配位数
非密置层
球心对球心
n × V(金属原子)×100% V(晶胞)
合金
根据金属晶体原子堆积方式,有目的有 选择的掺杂其它原子或物质,改进金属材料的性能
Thyoaunk
End
方法指导: 将16个乒乓球一排4个,分成4排紧 密排列在桌面上
二维空间堆积:
非密置层
球对球
行列对齐 四球一空
密置层
球对缝
行列交错 三球一空
二维空间堆积:
配 位
数 非密置层
为
4 球对球
行列对齐 四球一空
配
密置层
位 数
球对缝
为
6
行列交错
三球一空
合作探究二 三维空间
探究内容: 非密置层在三维空间有__种 堆积方式,配位数分别为___
2.金属锰晶体在不同温度下有两种堆积方式,晶胞如 图所示。面心立方晶胞和体心立方晶胞中实际含原 子数之比是_____,锰原子配位数之比是__________。
课后作业
1、根据对金属晶体四种基本堆积模型的分析, 结合所学数学几何知识,利用以下计算公式,计 算四种堆积方式空间利用率
空间利用率计算公式:
金属晶体堆积模型及计算公式

----体心立方堆积:
5 8 1
6 7 2
4
3
这种堆积晶胞是一个体心立方,每个晶胞含 2 个原子,属于非密置层堆积,配位数 为 8 ,许多金属(如Na、K、Fe等)采取这种 堆积方式。
空间利用率的计算
(2)体心立方:在立方体顶 点的微粒为8个晶胞共享,处 于体心的金属原子全部属于 该晶胞。 微粒数为:8×1/8 + 1 = 2
1200
平行六面体
每个晶胞含 2 个原子
铜型(面心立方紧密堆积)
7 6 5 1 8 9 4 2 3
12
10 11
这种堆积晶胞属于最密置层堆集,配位数 为 12 ,许多金属(如Cu、Ag、Au等)采取这 种堆积方式。
(3)面心立方:在立方体顶点的微粒为8 个晶胞共有,在面心的为2个晶胞共有。 微粒数为: 8×1/8 + 6×1/2 = 4 空间利用率: 4×4лr3/3 (2×1.414r)3
分子间以范德 通过金属键形成的 华力相结合而 晶体 成的晶体
作用力
构成微粒 物 理 性 质 实例 熔沸点
共价键
原子 很高
范德华力
分子 很低
金属键
金属阳离子和自由 电子 差别较大
硬度
导电性
很大
无(硅为半导体) 金刚石、二氧化硅、 晶体硅、碳化硅
很小
无 Ar、S等
差别较大
导体 Au、Fe、Cu、钢 铁等
= 74.05%
堆积方式及性质小结
堆积方式 晶胞类型 空间利 配位数 用率 简单立 方堆积 简单立方 52% 68% 74% 74% 6 8 12 实例
Po Na、K、Fe
体心立方 体心立方 堆积 六方最 密堆积 六方
第3节金属晶体之金属晶体的原子堆积模型

2.1
面心立方最密堆积(A1)和六方最密堆积(A3)
第一层球排列
46
从上面的等径圆球密堆积图中可以看出:
1. 只有1种堆积形式;
2. 每个球和周围6个球相邻接,配位数位6,形 成6个三角形空隙;
3. 每个空隙由3个球围成;
4. 由N个球堆积成的层中有2N个空隙,
即球数:空隙数=1:2。
两层堆积情况分析
②该晶胞称为________(填序号)。
A.六方晶胞 C.面心立方晶胞 B.体心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质 量为64 g· mol-1,金属铜的密度为ρ g/cm3,则阿伏 加德罗常数为________(用a、ρ表示)。
解析: (1)由图中直接相邻的原子数可以求得 a、 b 中两类原子数之比分别为 1∶2、1∶3,求出化学式 分别为 AX2、AX3,故答案为 b。(2)①用“均摊法” 1 1 求解,8× +6× =4;②该晶胞为面心立方晶胞; 8 2 4 256 3 ③ · 64=ρ· a ,NA= 3。 NA ρ· a
必须把球放在第一层的空隙上。这样,仅有半数 的三角形空隙放进了球,而另一半空隙上方是第 二层的空隙。
1. 在第一层上堆积第二层时,要形成最密堆积,
2. 第一层上一半的三角形空隙被第二层球堆积,
被 4 个球包围,形成四面体空隙;另一半其上方
是第二层球的空隙,被 6 个球包围,形成八面体
空隙。
48
三层球堆积情况分析
(2)堆积特点
层的垂直方向为三次象转轴。
既是立方体的空间对角线。 原胞当中包含一个粒子,是 布拉菲格子。
c
120o
a
a
b、面心立方最密堆积
金属晶体的原子堆积模型.ppt

金属晶体的原子堆积模型.ppt金属晶体的原子堆积模型金属晶体原子平面排列方式有几种?非密置层探究A143213642A5密置层配位数为4配位数为6金属晶体的堆积方式──简单立方堆积非密置层层层堆积情况1:相邻层原子在同一直线上的堆积简单立方堆积配位数:晶胞含金属原子数16例:(Po)体心立方堆积非密置层层层堆积情况2:相邻原子层上层原子填入下层原子的凹穴中体心立方堆积配位数:28晶胞含金属原子数:金属晶体的堆积方式──钾型123456思考:第二层对第一层来讲最紧密的堆积方式有几种?123456AB,思考:对第一、二层来说,第三层可以最紧密的堆积方式有几种?密置层堆积方式不存在两层原子在同一直线的情况,只有相邻层紧密堆积方式,类似于钾型。
123456一种是将球对准第一层的球。
123456123456另一种排列方式,是将球对准第一层的2,4,6位下图是此种六方紧密堆积的前视图ABABA一种是将球对准第一层的球。
123456于是每两层形成一个周期,即ABAB堆积方式,形成六方紧密堆积。
六方密堆积配位数:12。
(同层6,上下层各3)晶胞含金属原子数:6金属晶体的堆积方式──镁型第三层的另一种排列方式,是将球对准第一层的2,4,6位,不同于AB两层的位置,这是C层。
123456123456123456123456此种立方紧密堆积的前视图ABCAABC第四层再排A,于是形成ABCABC三层一个周期。
配位数:12(同层6,上下层各3)面心立方BCA晶胞含金属原子数:4金属晶体的堆积方式──铜型堆积模型采纳这种堆积的典型代表配位数晶胞镁型MgZnTi12简单立方Po6钾型NaKFe8铜型CuAgAu12总结思考:4中模型单位体积容纳原子数大小关系?52%68%74%74%空间利用率1.空间占有率等径球两种最密堆积具有相同的堆积密度,晶胞中圆球体积与晶胞体积之比称空间占有率,六方最密堆积(hcp)与立方最密堆积(ccp)空间占有率均为74.05%。
金属晶体的堆积模型

精品课件
金属晶体原子平面排列方式有几种?
探究
2 1A3
4
2
1
3
A
6
4
5
配位数为4 非密置层
精品课件
配位数为6 密置层
非密置层层层堆积情况1: 相邻层原子在同一直线上的堆积
金属晶体的堆积方式──简单立方堆积
精品课件
简单立方堆积
配位数:6 晶胞含金属原子数 1
例: (Po) 精品课件
精品课件
2).立方面心结构 立方面心结构的配位数=12(即每个圆球有12个最
近的邻居,同一层有六个,上一层三个,下一层三 个)。立方密堆积中可以取出一个立方面心的单位 来,每个单位中有四个圆球,球心的位置是000;0 1/2 1/2;1/2 0 1/2;1/2 1/2 0。
等径圆球的最紧密堆积方式,在维持每个球的周围 的情况等同的条件下,就只有上述两种,它们的空 间利用率最高(74.05%)。
精品课件
立方体边长=a';
立方体对角线=
a';
四面体边长=
a';
精品课件
精品课件
设圆半径为R,晶胞棱长为a,晶胞面对角
线长
则
晶胞体
积
立方面心晶胞中含4个圆球,每个球体积
为:
立方最密堆积虽晶胞大小不同,每个晶胞中 含球数不同。但计算得到空间占有率相同。
精品课件
而体心立方堆积(bcp)则空间占有率低一些。 体对角线长为 晶胞体积 体心立方晶胞含2个球
精品课件
2、某些金属晶体(Cu、Ag、Au)的原子按面心 立方的形式紧密堆积,即在晶体结构中可以 划出一块正立方体的结构单元,金属原子处 于正立方体的八个顶点和六个侧面上,试计 算这类金属晶体中原子的空间利用率。
高中化学课件【金属晶体中原子的基本堆积模型和晶胞】

【活学活用】
▪ 1.如下图所示为某晶体的一个晶胞,该晶体 由A、B、C三种基本粒子组成。试根据图示 判断,该晶体的化学式是________。
2. NaCl的晶胞如下图,每个NaCl晶胞中含有的Na+ 子和Cl-离子的数目分别是
A. 14 13
B. 1 1
C. 4 4 D. 6 6
晶胞中微粒个数推断晶体化学式
原子在晶胞的棱上:
1 4
原子在晶胞的顶点处:
1 8
▪ ②六方紧密堆积晶胞平均占有的原子数目:
1 8
×8
+1
=2
(2)A1型最密堆积方式
——面心立方最密堆积(铜)
ABC
▪ ①配位数: 12 同层 6,上下层各 3
2 13 64
5
1
2
7
8
6
9
3
5
4
12 10 11
▪ ②面心立方紧密堆积晶胞平均占有的原子数目:
1 8
×8 +
1 2
×6 =
4
三维空间里非密置层金属原子的堆积方式
▪ 先将两组小球以非密置层的排列方式排列在 一个平面上:
▪ 在其上方再堆积一层非密置层排列的小球, 使相邻层上的小球紧密接触,有哪些堆积方 式?
三维空间里非密置层的 金属原子的堆积方式
(1) 第二层小球的球心
正对着 第一层小球的球心
六方最密 堆积(A3 型)
结构示意图
晶胞
配位数 常见金属
6
8
12
12
Li、Na、K、 Ca、Al、Cu、Ag、
Po
Mg、Zn、Ti
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
请您指导! 欢迎批评!
总结
堆积模 采纳这种堆积的典 空间利
型
型代表
用率
配位数
晶胞
简单
立方
Po
52% 6
钾型 Na K Fe 68% 8
镁型 Mg Zn Ti 74% 12
铜型 Cu Ag Au 74% 12
思考:4中模型单位体积容纳原子数大小关系?
h 2边长为a的四面体高
2 6 a 2 6 a
3
3
V球
2
4
3
r3
(晶胞中有2个球)
V球 V晶胞 100% 74.05%
2、铜型
12
3
54
12
6
3
54
12
6
3
54
第三层的另一种排列方式,是将球 对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
铜型
A C B A
C B A 此种立方紧密堆积的前视图
请计算:空间利用率?
面心立方堆积方式的空间利用率计算
a a
面心
面心立方堆积方式的空间利用率计算
a a
面心
面心立方空间利用率:
属于1个晶胞微粒数为: 8×1/8 + 6×1/2 = 4
空间利用率: 4×4πr3/3
(2×1.414r)3
= 74.05%
堆积方式及性质小结
堆积方式 晶胞类型 空间利 配位数 用率
1个晶胞所含微粒数为:8×1/8 + 1 = 2
请计算:空间利用率?
二、金属晶体的两种最密堆积方式──镁型和铜 型(六方紧密堆积和面心立方堆积)
镁型(六方最密) 铜型(面心立方)
1、镁型[六方密堆积(] Be Mg ⅢB ⅣB ⅦB )
12
6
3
54
12
6
3
54
12
6
3
54
A B A B A
晶体的微观模型
以金属晶体中原子的堆积模型为例
Ti
将金属原子抽象成为小球,小球的平面 排列方式有几种?
2 1 A3
4
2
1
3
A
6
4
5
配位数为4
配位数为6
非密置层
密置层
非密置层在三维空间里堆积有几种方式?
金属晶体基本构型: 一、非最紧密堆积的两种构型 1、简单立方堆积:
配位数是 6 个。
非最紧密堆积,空间利用率低
空间利用率的计算
1、空间利用率:指构成晶体的原子、离子或 分子在整个晶体空间中所占有的体积百分比。
球体积
空间利用率 =
100%
晶胞体积
2、空间利用率的计算步骤: (1)计算晶胞中的微粒数 (2)计算晶胞的体积
简单立方:在立方体顶点的微粒为8个晶 胞共享,
微粒数为:8×1/8 = 1
4πr3/3 空间利用率:(2r)3
甲
DC
乙
F
E
丙
Z X
Y
丁
练3: 甲
乙
丙
上图甲、乙、丙分别为体心堆积、面心立方堆积、 六方堆积的结构单元,则甲、乙、丙三种结构单
元中,金属原子个数比为——1—:—2:—3————。
乙晶胞中所含金属原子数为8×1/8+6×1/2=4 晶胞中所含金属原子数为12×1/6+2×1/2+3=6
课外练习
1、已知金属铜为面心立方晶体,如图所示,
质量为183.9,半径为0.137nm。
a
求⑴晶胞的边长;⑵计算金属钨的密度。
晶胞中每个顶角金各有属一钨个的钨晶原子胞,与这已个钨原子为8个晶胞 共原用子,,每 那个 么钨 ,原 这经子 个有 晶学胞1过/8中属的含于哪钨该原种晶子胞晶为,型2体个心,有一个金属 则ρ=2×183.9/6.02×类10似23×?(0.316×10-7)3
找镁型的晶胞
1200
每个晶胞含原子数: 2 配位数: 12
空间占有率:
六方密堆积(镁型)的空间利用率计算:
四点间的夹角均为60°
先求S
在镁型堆积中取出六方晶胞,平行六面体的底是
平行四边形,各边长a=2r,则平行四边形的面积:
S a a sin 60 3 a2 2
平行六面体的高: 再求h
铜的相对原子质量为63.54,密度为8.936g/cm3,
试求
(1)图中正方形边长 a, (2)铜的原子半径 R
r
R
R o
a
R
R
r
a
1、已知金属铜为面心立方晶体,如图所 示,铜的相对原子质量为63.54,密度为 8.936g/cm3,试求 (1)图中正方形边长 a, (2)铜的原子半径 R
晶胞中每个顶角各有1个铜原子,这个铜原子为8个晶胞 共用,每个铜原子有1/8属于该晶胞,面心有6个金属 原子,有1/6属于该晶胞,1个晶胞中含铜原子4 个,
7 1 9
6
5
8 2
3 4
10
11
12
属于最密置层堆集,配位数为 12 ,这种堆积 晶胞空间利用率高,许多金属(如Cu Ag Au 等)采取这种堆积方式。
找铜型的晶胞
C B A
面心立方(铜型)空间利用率计算: 在立方体顶点的微粒为8个晶胞共有,在面 心的为2个晶胞共有。
属于1个晶胞微粒数为: 8×1/8 + 6×1/2 = 4
实例
简单立 简单立方 方堆积
体心立方 密堆积
体心立方
六方最 密堆积
六方
面心立方 面心立方 最密堆积
52% 68% 74% 74%
6
Po
8
Na、K、Fe
12 Mg、Zn、Ti
12 Cu、Ag、Au
练1:金属钨晶胞是一个立方体,在该晶胞 钾型 中每个顶角各有一个钨原子,中心有一个 体心立方晶胞
钨原子,实验测得金属钨原子的相对原子
= 52.36%
2、钾型(体心立方堆积)( IA碱金属,VB,VIB)
5
6
8
7
1
2
4
3
每个晶胞含 2 个原子,配位数为 8 ,空间利用
率不高 许多金属(如Na、K、Fe等)采取这种堆积方式。
( IA,VB,VIB)
体心立方:在立方体顶点的微粒为8个晶胞 共享,处于体心的金属原子全部属于该晶 胞。
则ρ= 4×63.54/6.02×1023×(R×10-7)3 =8.936g/cm3
R= nm
1nm=10-9m=10-7cm
复习1pm=10-12m
课后作业
1、某些金属晶体(Cu、Ag、Au)的原子 按面心立方的形式紧密堆积,即在晶体结 构中可以划出一块正立方体的结构单元, 金属原子处于正立方体的八个顶点和六个 侧面上,试计算这类金属晶体中原子的空 间利用率。
=19.36g/cm3 1nm=10-9m=10-7cm
复习1pm=10-12m
练2:
现有甲、乙、丙、丁四种晶胞,可推知甲
晶体化体学的中式化与为学的—式—粒—为—子—E——个—F—D或;数—C—F丁比2—E晶为—或—体———C的—1—2:;D1—化—丙学—晶;式体乙为的晶— —————X。Y2Z
BA
