物质溶解度表讲解
常见酸碱盐溶解表℃

21.5
+溶K
溶112
31.6
溶
11.1
溶
34.7
溶
111.5
+溶Rb
117溶
53
溶
48
溶
91
溶
450
+溶Cs
330溶
23
溶
179
溶
186
溶
﹥500
2+难Be
溶
107
溶
39
溶
﹥500
2+难Mg
0.009溶
70
溶
33
溶
54.2
微
2+微Ca
0.165溶
129
微
0.21
溶
74.5
难
2+微Sr
溶0.8
71
3+In
微
0.04
溶
500﹥
——
——
+Tl
溶
18.6
微
0.05
难
0.0006
3+Tl
——
——
溶
溶
2+Ge
微
0.24
溶
——
——
溶
4+Ge
——
——
——
——
——
——
2+Sn
难
溶
溶
微
0.98
4+Sn
溶
500﹥
——
——
——
——
2+Pb
难
微
0.064
微
0.084
微
0.063
3+As
物质的溶解度

t1
t2
t
2.会用溶解度曲线 已知温度求溶解度 或已知溶 会用溶解度曲线:已知温度求溶解度 会用溶解度曲线 已知温度求溶解度,或已知溶 解度求温度,交点的意义。 解度求温度,交点的意义。 3.气体物质的溶解度随压强变化或随温度变化的规律 3.气体物质的溶解度随压强变化或随温度变化的规律 。
想一想: 想一想:
气体溶解度由于受压强和温度两者的影响,它的曲 线我们不多做讨论。见书 P79
应用2:用今天学到的知识解释为什么夏天鱼塘容易“泛塘”? 将冷水煮沸前也会看到有气泡产生,这时看到的是什么? 为什么 ?
本课小结
1.固体物质的溶解度随温度变化的规律 1.固体物质的溶解度随温度变化的规律
s
A P B C
a b
1. 增大二氧化碳在水中的溶解度的方法( C ) 增大二氧化碳在水中的溶解度的方法( A. 升温增压; B. 升温减压; C. 降温增压; D. 降温减压 升温增压; 升温减压; 降温增压; 降温减压。 2.下列几种物质①硝酸钾②熟石灰③氧气④二氧化碳 溶解度 下列几种物质①硝酸钾②熟石灰③氧气④ 下列几种物质 随温度的升高而增大的是( D ) 随温度的升高而增大的是( A.①② B.③④ C.①③④ D.只有① 只有① ①② ③④ ①③④ 只有
/
190 180
g/ 1 0.10 0 0 0.05 g 水 0
讨论: 讨论:
固体物质溶解度受温度变化影响情况: 固体物质溶解度受温度变化影响情况: 大多数固体物质溶解度随温度升高而增大, 大多数固体物质溶解度随温度升高而增大, 硝酸钠、氯化铵等 例如 硝酸钠、氯化铵等。 少数固体物质溶解度受温度影响不大, 少数固体物质溶解度受温度影响不大, 例如食盐。 例如食盐。 极少数固体物质溶解度随温度升高反而减小, 极少数固体物质溶解度随温度升高反而减小, 例如熟石灰。 例如熟石灰。
溶解度及溶解度曲线图

a 30g 100g ×14 130g ×14
的饱和溶液中,
b 40g 100g ×13 140g ×13 C 30g 100g ×14 130g ×14
谁的溶解度大 所含水就少
右图是a、b、c三种物质的溶解度曲线, 溶解度(g)
a
a与c的溶解度曲线相交于P点。据图回答:
b
.................. ..........
3、溶解度的表示方法: (1)列表法: 硝酸钾在不同温度时的溶解度:
温度/℃ 溶解度
0 10
20 30
. 40 50 60 70 80 90 100
/g
13.3 20.9 31.6 45.8 63.9 85.5 110 138 168 202 246
(2) 溶解度曲线
()
溶 解 度
200 190 180 170
D 50oC时,10gKNO3中加入20g水,充分溶解后
再降温到30oC,有KNO3固体析出
B、列表法中,判定两种物质溶解度相同的温度范围方法:看
低温时低的溶解度与相邻该物质高温的溶解度之间是否包含
另一物质高温是的溶解度,若包含则符合题意。
40oC时 KCL的溶解度为40g,即在100g水中最多溶解KCl
(5)稀释问题套入稀释公式:m浓液×P%浓= m稀液 ×P%稀
100g
20g 20g+100g
(100+50)g
X
X=11.1%
右图是a、b、c三种物质的溶解度曲线, 溶解度(g)
a
a与c的溶解度曲线相交于P点。据图回答:
.................. ..........
1.将t1oC a、c的饱和溶液升温至t2oC
初中化学 “酸、碱、盐溶解性表”的解读和应用

“酸、碱、盐溶解性表”的解读和应用余通权一、“酸、碱、盐溶解性表”的解读。
该表的横行是一组阴离子,纵行是一组阳离子,由阴、阳离子可以构成一种化合物,对应的方框中的文字或符号表示这种化合物的溶解性。
通过阅读该表可以发现有这样一些规律:(1)钾盐、钠盐、铵盐、硝酸盐及常见的酸都溶于水;(2)盐酸盐和硫酸盐绝大部分溶于水(盐酸盐中只有AgCl 不溶;硫酸盐只有BaSO 4不溶,CaSO 4微溶);(3)碱、碳酸盐大部分不溶,只有少数溶于水(含+++4NH Na K 、、的化合物溶于水)。
二、“酸、碱、盐溶解性表”的应用 对此表的应用可简单概括为以下几点: 1. 判断离子(或物质)能否在溶液中大量共存根据物质溶解性表,如果溶液中的某些离子间能够相互发生反应生成不溶性的物质或生成气体或生成水等,则这些离子在溶液中不能大量共存。
例1. 下列各组离子在pH =1的溶液里能大量共存的是( ) A. --++OH Cl Ba Na 2、、、B. -++-23224CO Ca K S O 、、、C. ++--23Cu Ag Cl NO 、、、D. --++Cl NO Na K 3、、、解析:题给条件是“在pH =1的溶液里”,即是含有大量的+H 的溶液。
选项A 中的-OH与+H 反应生成水而不能大量共存;选项B 中的-23CO 与+H 反应生成水和CO 2而不能大量共存;选项C 中的-Cl 和+Ag 因反应生成不溶于水也不溶于酸的AgCl 而不能大量共存;选项D 中各离子之间不反应,因而可以大量共存,选项D 正确。
2. 判断化学反应方程式是否正确运用物质溶解性表判断酸、碱、盐等化合物之间能否发生复分解反应,从而可以判断化学方程式是否正确;另外还可以判断一些在溶液中进行的置换反应能否发生。
例2. 下列方程式中,正确的是( )Ag2CuCl AgCl 2Cu .D SO H )NO (Ba HNO 2BaSO .C CO O H NaCl 2HCl 2CO Na .B KOH NaNO KNO NaOH .A 2422334223233+=++=+↑++=++=+解析:A 方程式中生成物NaNO 3、KOH 均溶于水,此反应不满足复分解反应发生的条件,因而错误。
《溶解度》PPT教学课件

烧杯溶液中有未溶解固 体
未溶解的固体又溶解了
结论
20mL水能完全溶解 20mL水不能完全溶解
5gNaCl
10gNaCl
增加溶剂的量可将未 溶物质溶解
分析
NaCl不能无限制地溶解在一定量水中
一、饱和溶液
加热烧杯,剩余的KNO3固体会有什么变化?
加热
再加5g硝酸钾
冷却至室温
有固体剩余 剩余固体全部溶解 固体全部溶解
10 0 10 20 30 40 50 60 70 80 90 100
温度/℃
硝酸铵
溶解度/
200
190
g 180
170
160
固体的溶解度曲线:
150
140
133
B.
1.两曲线交点B表示:
130
硝酸钠
120
在_6_8_℃__时__,_硝__酸__钾__与__硝__酸_钠__的__溶__解__度__相_等__,___
熟石灰的溶解度随温度升 高而降低
1、概念:溶解度随温 度变化的曲线。
2、点的含义
①曲线上的点A: 表示t1℃时,Ca(OH)2
溶 解 度
的溶解度为S1g。
/g
S1 A
②曲线的交点B: S2
B
表示t2℃时,Ca(OH)2
和KNO3的溶解度相等,
为S2g。
t1 t2
KNO3
NaCl Ca(OH)2
温度/℃
01.课堂导入
02.新课讲授 03.课堂小结 04.典型例题
在我国西部地区分布着许多美丽而奇特的盐碱湖,其中蕴藏着 极其丰富的食盐和纯碱。有趣的是,当地人在生活实践中总结了一 条规律,就是“冬天捞碱,夏天晒盐”。你知道为什么“冬天捞 碱,夏天晒盐”吗? 这其中蕴含着什么科学道理呢?
《溶解性表详解》课件

溶解性表的分类与使用
分类
根据不同的标准,溶解性表可以分为 多种类型,如按物质类型、溶解度测 量方法、应用领域等。
使用
在使用溶解性表时,需要根据具体需 求选择合适的表型,并正确解读表中 数据,以指导实验操作或生产过程。
溶解性表的优缺点分析
优点
方便快捷地获取物质的溶解度数据,有助于实验和生产的顺 利进行;数据全面,覆盖范围广,可满足多种需求;具有一 定的可靠性和准确性。
缺点
不同表型的数据可能存在差异和误差;某些物质的溶解度数 据可能存在缺失或不完整;需要不断更新和修正以适应新的 研究和生产需求。
03
溶解性表的应用
在化学实验中的应用
判断物质溶解性
优化实验结果
溶解性表提供了各种物质在水中的溶 解度数据,有助于实验者判断物质是 否可溶,从而选择适当的实验方法。
通过了解物质的溶解度,实验者可以 优化实验条件,如温度、压力等,以 提高实验效果。
目前,互联网上已经有许多在线溶解性表可供查询,也有许多专业数据库提供更为 详细和准确的数据。
02
溶解性表详解
溶解性表的结构与特点
结构
溶解性表通常以表格形式呈现, 包含了不同物质在不同条件下的 溶解度数据。
特点
具有系统性、全面性和实用性, 能够为科学研究、工业生产、实 验操作等领域提供重要的参考依 据。
溶解性表的重要性
溶解性表在化学、制药、食品、环保 等领域具有广泛的应用价值。
它有助于了解物质的基本物理性质, 预测物质之间的相容性和分离难度, 为工艺流程设计、产品配方优化等方 面提供重要的参考依据。
溶解性表的起源与发展
溶解性表的历史可以追溯到19世纪,当时科学家开始系统地研究物质的溶解性。
溶解度及溶解度曲线

4、在20ºC时,在100克水中最多能溶解NaCl 36.0克,则氯化钠在20ºC时的溶解度为36.0 克( 对 )
例2.
溶解度/g
1、20℃时,A的溶解 80 度是_____1_0_克___ 2、 70
A
10g
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是_难__溶物质。
3、20℃时氯化钠的溶解度是36g,则氯化钠属于(A )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
二、溶解度的表示方法
1.表格法
例:KCl的溶解度 温度/℃ 10 20 30 40 50 溶解度/g 31.0 34.0 37.0 40.0 42.6 温度/℃ 60 70 80 90 100 溶解度/g 45.5 48.3 51.1 54.0 56.7
应达到饱和状态
比较溶解能力,应控制的条件有:
同温 等量的同种溶剂 达到饱和状态
一定温度 100克溶剂
溶解达到饱和状态时 所溶解的质量来比较
一、固体溶解度
1、定义:在一定温度下,某固态物质在100溶剂 里达到饱和状态时所溶解的质量。
2、四要素:
条件:一定温度 状态:饱和状态(最多)
水
100
标准:100克溶剂 单位:克
11、如图是A、B、C三种物质在水中的溶解度曲线, 请回答:
C可能表示哪种物质:__C__a_(_O_H__)_2_或__C__O_2_等__气_ 体
谢 谢 大 家 !
作业: P41 第8和10题
钠的饱和溶液降温到30ºC时,
溶解度ppt课件

24
Q P
A的 不饱和溶液,ω(C)= 20g/120g×100%
20 15
B ② 在t2℃时,将25gA放入到100g
C 水中,充分溶解后得到的是A物质
的 饱和 溶液,ω(A)=20g/120g×100%
0
t1 t2 t3 温度/℃
③ t3℃时,C物质的饱和溶液的溶质质量分数是: 15g/115g×100% 在230gB物质的饱和溶液中含有B 物质__3_0___g
采取措施
降低温度
升高温度 恒温蒸发溶剂或加入溶质 加入溶剂 升高温度同时加溶质
70 KNO3饱和溶液的W/%
60 M
50
40
N P
30
Q
Y 20
10 温度/℃
10 20 30 40 50 60 70 80
⑥沿曲线向下移动
降低温度
如上的六种操作中,能从溶液中析出固体的是第⑥种情况。
如何使溶液 从P点Q点?
D
大册P17 基础测评 1.2.3
D A C
大册P18 基础测评 4.5.6
A
C C
大册P18 拓展提升7
AB D B
C 不能
大册P18 自主梳理
大册P19 合作探究 问题1
31.6
100
131.6
饱和
C
(1)已知20℃时,S(蔗糖)=204g,将200g蔗糖放入100g水 中,充分溶解后得到的是蔗糖的 不饱和 溶液,其ω= 66.7%。 (2)已知20℃时,S(氢氧化钙)=0.2g,将1gCa(OH)2放入100g 水中,充分溶解后得到的是Ca(OH)2的 饱和 溶液,其ω= 0.2%。 (3)已知20℃时,S(氢氧化钙)=0.2g,将0.15gCa(OH)2放入100g 水中,充分溶解后得到的是Ca(OH)2的不饱和 溶液,其ω=0.15。% (4)已知75℃时,S(氢氧化钙)=0.1g,将0.1gCa(OH)2放入100g 水中,充分溶解后得到的是Ca(OH)2的 饱和 溶液,其ω=0.1%。
常见物质的溶解度表.pdf

16.1
0.189 9×10 -2 64.6
0.182
102
115
63.9
9.73 0.223
9.77 0.244
143 7.753 ×10 -4 6.170 ×10 -4 209 2.25 1.8
1.83
0.518 16.6 4.303 ×10 -3 0.173 0.24 66 4.099 ×10 -3 129
乙酸钡
Ba(C2H3O2)2
58.8
62
72
75
78.5
75
74
74.8
砷酸钡
Ba3(AsO4)2
2.586 ×10 -9
叠氮化钡
Ba(N3)2
12.5
16.1
17.4
溴酸钡
Ba(BrO3)2
0.29
0.44
0.65
0.95
1.31
2.27
3.52
溴化钡
BaBr2
98
101
104
109
114
123
135
264
291
301
硝酸钡
Ba(NO3)2
4.95
6.67
9.02
11.5
14.1
20.4
27.2
34.4
亚硝酸钡 草酸钡
Ba(NO2)2 BaC2O·4 2H2O
50.3
60
72.8 3×10 -3
102
151
222
261
325
氧化钡
BaO
3.8
高氯酸钡
Ba(ClO4)2
239
336
416
495
575
(完整版)初中化学酸碱盐溶解性表以及口诀(最新整理)

碳酸盐
CO32-
H2CO3 溶、挥 (NH4)2CO3
溶 K2CO3 溶 Na2CO3 溶 BaCO3 ☆不 CaCO3 ☆不 MgCO3 微 —— —— MnCO3 不 ZnCO3 不 FeCO3 不 —— —— CuCO3 不 Ag2CO3 不 碳酸某
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
-
Cu2+
不
溶
溶
溶
不
Ag+
-
溶
不
微
不
部分酸碱盐溶解性表(20℃)
℃
记忆口诀:钾钠铵硝酸盐全溶,
盐酸盐只有 AgCl 不容,硫酸盐只有 BaSO4 不容, 碳酸盐只溶 K+、Na+、NH4+,碱类只溶 K+、Na+、NH4+和 Ba2+ Ca(OH)2、CaSO4、Ag2SO4 微溶.
3
Ca(NO3) CaCO3
3
CaSO4
阳离子 阴离子
OH-
NO3-
Cl-
SO42-
CO32-
Commented [eke1]:
H+
溶、挥 溶、挥 溶 溶、挥
NH4
溶、挥 溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
溶解度曲线及溶解度表

溶解度曲线及溶解度表1. 引言溶解度是指在一定条件下,溶质在溶剂中的最大溶解量。
溶解度曲线和溶解度表是研究物质在不同温度和压力下的溶解性质的重要工具。
本文将详细介绍溶解度曲线和溶解度表的概念、应用以及其相关实验方法。
2. 溶解度曲线溶解度曲线描述了物质在不同温度下的溶解性变化规律。
通常,我们会固定一种物质作为溶质,将其逐渐加入到一定量的溶剂中,并测量其在不同温度下的饱和浓度。
通过将测得的饱和浓度与相应温度进行绘制,就得到了该物质的溶解度曲线。
2.1 曲线形态根据物质在不同温度下的溶解性变化规律,可以得到以下几种常见的曲线形态:•升高型:随着温度升高,物质的溶解性增强。
•下降型:随着温度升高,物质的溶解性减弱。
•不变型:温度的变化对物质的溶解性几乎没有影响。
2.2 影响因素溶解度曲线受多种因素的影响,其中最主要的两个因素是温度和压力。
•温度:温度对溶解度的影响是最为显著的。
一般来说,随着温度升高,溶质分子吸收热能增多,分子间距离增大,从而使溶质易于与溶剂分子相互作用,溶解度增加。
•压力:压力对溶解度的影响相较于温度来说较小。
但某些物质在高压下会出现明显的溶解度变化。
3. 溶解度表溶解度表是一种将物质在不同温度下的饱和浓度进行整理和归纳的表格。
它提供了各种物质在不同条件下(通常是常见温度)的溶解性信息。
3.1 表格内容典型的溶解度表包含以下信息:•物质名称:列出所研究物质的名称。
•温度范围:列出测量或记录的温度范围。
•溶解度值:列出物质在相应温度下的饱和浓度。
3.2 制作方法制作溶解度表需要进行一系列实验,并测量物质在不同温度下的溶解度。
一般的实验步骤如下:1.准备一定量的溶剂,并加热至所需温度。
2.将溶质逐渐加入溶剂中,直到达到饱和状态。
3.记录所添加的溶质量以及所得到的饱和浓度。
4.重复以上实验步骤,直到覆盖所需温度范围。
5.将测得的数据整理并制作成表格。
4. 应用与意义溶解度曲线和溶解度表在科学研究和工程应用中具有广泛的意义和应用价值。
溶解性表口诀

溶解性表口诀
溶解性表,让我们一起学习!
总则:
凡是多数盐,盐化物,碱的一般,
都是水中溶解度现象出现。
前置知识:
若是离子强弱,电负性统帅,
定有阴阳离子在水中玩耍。
若是离子电荷,多数贯通,
定有更多离子溶于水中。
溶解性表:
亲水离子强势,无机盐小家伙。
Ⅰ族,硫酸钠瘦小巧,铵盐和硝酸钾有例,烷基别出心裁,异构体随意,
溶度不等缘由很多,可适当考虑气压和温度。
Ⅱ族,色彩斑斓多多,
氯化钙冰霜白,硫酸钙罕见佳华,
碳酸钙再涨一丝,氢氧化镁稳居首。
Ⅲ族,盐酸氢物皆草木皆兵,
氢氧化物无一例外失宠,
氯化铝改变我们看法,七水合物失涨。
Ⅳ族,与生俱来的酸性,
硫酸和硫酸锰有歧视,
硫酸镍最难达巅峰,氢氧化锡独树一帜。
Ⅴ族,化合物缤纷多彩,
铜盐不可等闲视之,硫酸合金不如碳酸亲切,
氮磷的败退和氢氧化物同行。
Ⅵ族,硫酸钨抢眼闪耀光芒,
碳酸钨也不应该等闲视之,
硫代硫酸钴则令人无语,多多应用予丙酮合成。
Ⅶ族,非金属较为重要,
氟化物及其盐化合物多有珍藏,
元素金属只有钌和铂,莫极端评价。
结束语:
学习溶解性表,要记得勤思考,
哪怕有疑虑不甘心放弃,
彻底了解化合物规律性,化学系数不再misunderneath。
常见物质溶解度表大全

常见物质溶解度表大全
一些物质的溶解度随温度的升高而增大,也有物质随温度的升高而降低,也有先升高,后降低的,今天小编整理了常见物质溶解度表大全,希望能帮助大家学习溶解度的知识!
1、氯化钠溶解度
2、氢氧化钙溶解度
3、硫酸钠溶解度
4、碳酸钠溶解度
5、碳酸氢钠溶解度
6、氯化钙溶解度
7、硫酸钙溶解度
8、氯化钾溶解度
9、硫酸铵溶解度
10、氯化铵溶解度
12、硫酸铜溶解度
13、氢氧化钾溶解度
以上就是我们常见以及常考到的一些物质的溶解度了,通过溶解度表,大家可以更加直观地判断物质的溶解度随温度升高而发生的变化。
常见物质的溶解度表.pdf

16.1
0.189 9×10 -2 64.6
0.182
102
115
63.9
9.73 0.223
9.77 0.244
143 7.753 ×10 -4 6.170 ×10 -4 209 2.25 1.8
1.83
0.518 16.6 4.303 ×10 -3 0.173 0.24 66 4.099 ×10 -3 129
38.6
44.2
47.6
51.3
亚磷酸氢钡 BaHPO3
0.687
氢氧化钡
Ba(OH)2·8H2O
1.67
2.48
3.89
5.59
8.22
20.9
101
碘酸钡
Ba(IO3)2
-2
3.5 ×10
-2
-2
4.6 ×10 5.7 ×10
碘化钡 钼酸钡
BaI2 BaMoO4
182
201
223
250
6×10 -3
CaC2O4
高氯酸钙
Ca(ClO4)2
高锰酸钙
磷酸钙
硒酸钙
硫酸钙 钨酸钙 氟化锆
硫酸锆
Ca(MnO4)2
Ca3(PO4)2
CaSeO·4 2H2O CaSO·4 2H2O CaWO4 ZrF4
Zr(SO4)2·4H2O
砷酸镉
Cd3(AsO4)2
苯甲酸镉
Cd(C7H5O2)2来自1251324.5
8.575 ×10 -
18.6 87.9 150
188
6.235 ×10 -6 64 76.6 1.292 ×10 -12 4.642 ×10 -2
130
195 58.9
化学物质溶解度表及常见物质颜色
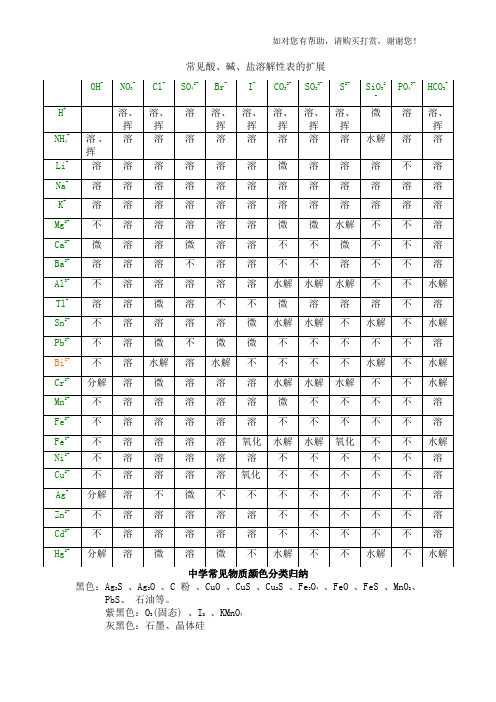
常见酸、碱、盐溶解性表的扩展黑色:Ag2S 、Ag2O 、C粉、CuO 、CuS 、Cu2S 、Fe3O4、FeO 、FeS 、MnO2、PbS、石油等。
紫黑色:O3(固态) 、I2、KMnO4灰黑色:石墨、晶体硅灰色:As 、Fe3C 、Se、Sn 银灰色:Ge白色:AgCl 、AgOH 、Al(OH)3、 Al2O3、BaCO3、BaSO4、CaCO3、CaSO3、无水CuSO4、Fe(OH)2、Fe(略带灰色) 、KClO3、 KCl 、K2SO4、MgO、Mg(OH)2、MgCO3、 NH4HCO3、 NH4NO3、(NH4)2SO4、Na2O、 NaOH、Na2CO3、NaHCO3、 P2O5、P 4(白磷)、 ZnSO4、C6H12O6(葡萄糖)、 (C6H10O5)n(淀粉)、 (C6H10O5)n(纤维素)、三溴苯酚等。
银白色:K、 Na、 Mg、 Al、 Sn 、Sb 、Bi 、Te 、Ti 、Hg 、Li 、Rb、Cs(略带金色)等。
青白色:Zn蓝白色:Pb红色:[FeSCN]2+(血红色) 、Cu2O(砖红色)红棕色:P(红磷)、NO2、Fe2O3紫红色:Cu 、MnO4-红褐色:Fe(OH)3、碘酒(褐色)深红棕色:Br2黄色:AgI 、P4(黄磷) 、Au 、Ag3PO4、FeS2、Al2S3、K2CrO4淡黄色:Na2O2、AgBr 、TNT 、S、PCl5、混有NO2的浓HNO3、混有Fe3+的浓HCl、溶有NO2的硝基苯灰黄色:Mg3N 2棕黄色:FeCl3、CuCl2橙色:溴水、K2Cr2O7溶液绿色:Cu(OH)2CO3、 Cr2O3浅绿色:Fe2+、FeSO4·7H2O黄绿色:Cl2浅黄绿色:氯水、F2蓝色:CuSO4·5H2O 、Cu(OH)2、Cu2+的稀溶液淡蓝色:O3(气体)深蓝色:O3(液态)常见与Cu有关的颜色:Cu紫红色; Cu2O红色; CuO黑色;CuF2白色; CuCl2黄棕色; CuBr2棕黑色;CuI白色; Cu(OH)2淡蓝色; Cu2S黑色;CuS黑色; CuSO4·5H2O蓝色;无水CuSO4白色;含Cu2+溶液:浓度很浓显黄绿色,浓度浓显绿色,浓度稀显蓝色。
溶解度表

溶解度表
这是各种元素在水中的溶解度列表,以化学品中特征元素的拼音顺序排列。
所有数据都为1atm下的数据,单位为g/100cm3。
(1)锕、氨、铵 (1)
(2)钯、钡、铋、铂、钚 (2)
(3)氮、镝 (3)
(4)铒 (4)
(5)钒 (4)
(6)钆、钙、锆、镉、铬、汞、钴、硅 (4)
(7)铪、氦、钬 (7)
(8)镓、钾、金 (7)
(9)钪 (9)
(10)镧、锂、硫、镥、铝 (9)
(11)镁、锰 (11)
(12)钠、镍、钕 (12)
(13)硼、铍、钋、镨 (14)
(14)氢、铅 (14)
(15)铷 (16)
(16)铯、钐、砷、铈、锶 (16)
(17)铊、碳、铽、锑、铁、铜、钍 (18)
(18)锡、氙、锌、溴 (21)
(19)氩、氧、铟、钇、镱、银、铀、铕 (21)
(20)有机化合物 (23)
(1)锕、氨、铵
(2)钯、钡、铋、铂、钚
(3)氮、镝
(4)铒
(5)钒
(6)钆、钙、锆、镉、铬、汞、钴、硅
(7)铪、氦、钬
(8)镓、钾、金
(9)钪
(10)镧、锂、硫、镥、铝
(11)镁、锰
(12)钠、镍、钕
(13)硼、铍、钋、镨
(14)氢、铅
(15)铷
(16)铯、钐、砷、铈、锶
(17)铊、碳、铽、锑、铁、铜、钍
(18)锡、氙、锌、溴
(19)氩、氧、铟、钇、镱、银、铀、铕
(20)有机化合物。
10.溶解度,溶质质量分数

溶解度、溶质质量分数一、物质的溶解度1.溶解度的定义:在一定温度下,某物质在100 g溶剂(通常为水)里达到饱和状态时,所溶解该溶质的质量,叫做这种物质在这种溶剂里的溶解度,用字母S表示。
例:20℃,食盐的溶解度是36g/100g水,就是指在20℃,食盐在100g水里达到饱和时溶解36g 2.溶解度概念五要素:(1)一定温度;(2)指明溶质和溶剂;(3)100g溶剂;(4)达到饱和状态;(5)溶解度的单位为g/100g水。
3.物质的溶解度表:【练一练】1.正误判断:(1)l00g水中最多溶解38g氯化钠,所以氯化钠在水中的溶解度是38g/100g水。
(2)在10℃时,烧杯内水中最多溶有140g硝酸铵,故硝酸铵在水中的溶解度是140g/100g水。
(3)在60℃,100g水中溶有75g硝酸钾,所以60℃时硝酸钾的溶解度为75g/100g水。
(4)60℃,100g水中最多溶解124g硝酸钾,所以硝酸钾在这温度下的溶解度是124。
2.“60℃时,硝酸钾的溶解度是110 g/100 g水”这句话含义是什么?4.溶解度的影响因素【思考】下列两表分别列出硝酸钾、氢氧化钙在不同温度下的溶解度。
若在坐标系上用线把物质在各个温度下溶解度的点连接起来,就得到了该物质的溶解度曲线。
比较硝酸钾和氢氧化钙溶解度,并在下列坐标系上作出溶解度曲线。
大多数固体物质在水中的溶解度随温度随温度升高而增大,少数固体物质的溶解度随温度升高而减小气体物质在水中的溶解度随温度升高而减小。
气体物质的溶解度,不仅要标明一定温度,还要标明一定压强。
如:在20℃、101kPa 时,氧气在水中的溶解度为4.34×10-3g/100g 水。
(气体的溶解度也可用1体积水中溶解气体体积的最大量来表示)二、有关溶解度的简单计算1.计算公式(只适用于饱和溶液): 基础等量关系:m 溶溶液 = m 溶质+ m 溶剂公式1:=100m Sm 溶质溶剂 变形:100m S m =⨯溶质溶剂公式2:=100+m Sm S溶质溶液2.基础计算题型:题型1:求溶质、溶剂的质量:根据某物质在某温度时的溶解度,可以求出该温度时一定量饱和溶液里所含溶质和溶剂的质量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溴化铊TlBr25°C4×10–6
氯化铊TlCl25°C 2.65×10–4
硫酸铊Tl2SO425°C 3.6×10–4
硫氰化铊TlSCN25°C; 2.25×10–4
物质水溶液溶解度表
以化学品中特征元素的拼音顺序排列。
所有数据都为1atm下水溶液溶解度的数据,单位为g/100cm3
1.锕、氨、铵 (2)
2.钯、钡、铋、铂、钚 (3)
3.氮、镝 (4)
4.铒 (4)
5.钒 (4)
6.钆、钙、锆、镉、铬、汞、钴、硅 (4)
7.铪、氦、钬 (7)
8.镓、钾、金 (7)
9.钪 (8)
10.镧、锂、硫、镥、铝 (9)
11.镁、锰 (9)
12.钠、镍、钕 (10)
13.硼、铍、钋、镨 (12)
14.氢、铅 (12)
15.铷 (13)
16.铯、钐、砷、铈、锶 (14)
17.铊、碳、铽、锑、铁、铜、钍 (15)
18.锡、氙、锌、溴 (17)
19.氩、氧、铟、钇、镱、银、铀、铕 (19)
20.有机化合物 (22)
21.酸碱盐溶解性表 (23)
1.锕、氨、铵
2.钯、钡、铋、铂、钚
3. 氮、镝
4.铒
5.钒
6.钆、钙、锆、镉、铬、汞、钴、硅
7.铪、氦、钬
8.镓、钾、金
9.钪
10.镧、锂、硫、镥、铝
11.镁、锰
12.钠、镍、钕
13.硼、铍、钋、镨
14.氢、铅
15.铷
16.铯、钐、砷、铈、锶
17.铊、碳、铽、锑、铁、铜、钍
18.锡、氙、锌、溴
19.氩、氧、铟、钇、镱、银、铀、铕
20.有机化合物
化学基础数据-物质溶解度表21.酸碱盐溶解性表
- 21 -。
