北京航空航天大学大一大学化学习题参考答案
大学化学课后习题参考答案

第1章 化学热力学参考答案:(一)选择题1.A 2.A 3.C 4.B 5.D 6.C 7.C 8.C 9. A 10. C 11. A 12.C (二)填空题1.40;2.等温、等容、不做非体积功,等温、等压,不做非体积功; 3.>,<,=,> 4.增大、不变 5.不变 6.3.990 kJ·mol -1(三)判断题1. ×2. ×3. ×4. ×5. √6. ×7. ×8. ×9. × 10. × (四)计算题1.解:(g)O N (l)H 2N 4242+O(l)4H (g)3N 22+(l)H N 42摩尔燃烧热为2.解:)mol ·(kJ 28.254166.963.502)84.285(401f B r --=-⨯--⨯+=∆=∆∑HH ν)mol ·(kJ 14.627211r-Θ-=∆=H Q pK1077.3109.9824.37333mr r ⨯=⨯--=∆∆=-S T 转)mol ·(kJ 78.34357.86)15.137(36.3941f B r --=---=∆=∆∑G ν)K ·mol ·(J 9.9865.21056.1975.191216.21311B r ---=--⨯+==∆∑νNO(g )CO(g )+(g)N 21(g)CO 22+)mol ·(kJ 24.37325.90)52.110(5.3931f B r --=----=∆=∆∑H ν此反应的 是较大的负值,且)(,)(-∆-∆S H 型反应,从热力学上看,在 T 转的温度以内反应都可自发进行。
3.解:外压kPa 50e =p ,11p nRT V =,22p nRTV =,2e p p = 系统所做功:定温变化,0=∆U0=+=∆W Q U ,所以Q =1 247.1(J ) 定温过程pV =常数 ∆(pV )=0 所以 0)(=∆+∆=∆pV U H 4.解:查表知CaO(s) + SO 3(g) = CaSO 4(s)求得同理求得 因为 所以根据经验推断可知,反应可以自发进行。
《大学化学》复习学习材料、试题与参考答案

《大学化学》习题答案复习学习材料、试题与参考答案一、单选题1.江、河水中含的泥沙悬浮物在出海口附近都会沉淀下来,原因有多种,其中与胶体化学有关的是(B)A.盐析作用B.电解质聚沉作用C.溶胶互沉作用D.破乳作用2.下列各组量子数合理的是(C)A.B.C.D.3.下列各物质的分子间只存在色散力的是(A)A.B.C.D.4.下列物质中不属于毒品的是(B)A.吗啡B.黄曲霉素C.海洛因D.冰毒5.下列物质中,属于致癌物质的是:(B)A.谷酰胺B.苯并芘C.谷氨酸D.谷胱甘肽6.稀溶液依数性中心的核心性质是(D)A.溶液的沸点升高B.溶液的凝固点下降C.溶液是有渗透压D.溶液的蒸气压下降7.盖斯定律适用条件是(B)A.定温或定压B.定压或定容C.定温或定容D.不确定8.下列各种与爱滋病人接触途径中不会感染爱滋病的是(C)A.共用注射器B.性接触C.握手D.母婴传播9.导电性能最好的金属是(A)10.在定温定压条件下,某反应的,这表明该反应(B)A.正向自发进行B.逆向自发进行C.视具体情况而定D.不能确定11.下列哪种现象不属于稀溶液的依数性:(D)A.凝固点降低B.沸点升高C.渗透压D.蒸气压升高12.真实气体行为接近理想气体性质的外部条件是:(B)A.低温高压B.高温低压C.低温低压D.高温高压13下列分子中键角最大的是:(C)A.B.C.D.14.已知氢氧化合反应:,反应,要有利于取得的最大转化率,可采取的措施是(A)A.低温高压B.高温低压C.低温低压D.高温高压15.下列对于功和热叙述中正确的是(A)A.都是途径函数,无确定的变化途径就无确定的数值B.都是途径函数,对应于某一状态有一确定值C.都是状态函数,变化量与途径无关D.都是状态函数,始终态确定,其值也确定16.试指出下列物质中何者不含有氢键(B)A.B.HIC.D.17.在下列溶液中AgCl的溶解度最小的是(B)A.0.1mol/L的NaCl溶液B.0.1mol/L的溶液C.0.1mol/L的溶液D.0.5mol/L的溶液18.下列常用的能源中,属于新能源的是(C)A.石油B.天然气C.氢能D.水能19.下列各物质的化学键中,只存在键的是(C)A.B.C.D.无法确定20.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A)A.沸点升高B.熔点升高C.蒸气压升高D.都不对21.以电对与组成原电池,已知,则反应物是(A)A.B.C.D.22.下面的叙述中违背平衡移动原理的是(C)A.升高温度平衡向吸热方向移动B.增加压力平衡向体积缩小的方向移动C.加入惰性气体平衡向总压力减少的方向移动D.降低压力平衡向增加分子数的方向移动23.电镀工艺是将欲镀零件作为电解池的(A)A.阴极B.阳极C.阴阳两极D.无法确定24.已知下列反应的平衡常数:(1)A=B;;(2)B+C=D;;则反应:A+C=D的平衡常数是下列中的(B)A.B.C.D.25.下列各物质中,含有氢键的是(A)A.HFB.NaClC.D.26.在定温定压条件下,某反应的ΔG>0,这表明该反应(A)A正向自发进行B逆向自发进行C视具体情况而定D不能确定27.试指出下列物质中何者不含有氢键(B)A.B(OH)3B.HIC.CH3OHD.H2NCH2CH2NH228.电镀工艺是将欲镀零件作为电解池的(A)A阴极B阳极C阴阳两极D无法确定29.在稀醋酸溶液中,加入等物质量的固态NaAc,在混合溶液中不变的量是A.PhB.电离度C.电离常数D.OH-离子的浓度31.下列各物质结构中,含有叁键的是 (C)A.乙烯B.H2OC.N2D.BF332.一支充满氢气的气球,飞到一定高度即会爆炸,这主要取决于一定高度上的(D)A.外压B.温度C.湿度D.外压和温度二、多选题33.下列各种与爱滋病人接触途径中会感染爱滋病的是 (ABD)A.共用注射器B.性接触C.握手D.母婴传播34.下列对于功和热叙述中错误的是 (BCD)A.都是途径函数,无确定的变化途径就无确定的数值B.都是途径函数,对应于某一状态有一确定值C.都是状态函数,变化量与途径无关D.都是状态函数,始终态确定,其值也确定35.下面的叙述中违背平衡移动原理的是 (ABD)A.升高温度平衡向吸热方向移动B.增加压力平衡向体积缩小的方向移动C.加入惰性气体平衡向总压力减少的方向移动D.降低压力平衡向增加分子数的方向移动三、判断题36.在晶态高聚物中,通常可同时存在晶态和非晶态两种结构。
北航大学化学习题参考答案-前4章

班级学号____________
姓名____________
分数________
1.9 10 11 ln 3.9 10 19 8.314 1500.15 1000.15 J mol -1 1500.15 1000.15
441.6 103 J mol -1 441.6kJ mol -1
K 6.29 1018
4 解 由公式
ΔrG mӨ = 2.303RTlgK Ө ΔrG mӨ(T) =ΔrH mӨ (T)-TΔrS mӨ(T)
可得
H K2 T T2 ln r m 1 R K1 T2T1
依题意 K 2 3.9 10 19 1.9 10 11 , K1
2
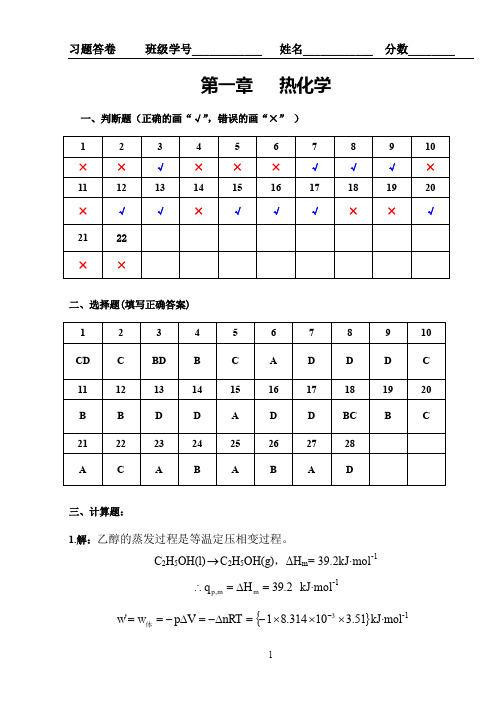
习题答卷
班级学号____________
姓名____________
分数________
ΔrHm,4Ө (298.15K)=ΔrHm,1Ө (298.15K)+2ΔrHm,2Ө (298.15K)-ΔrHm,3Ө (298.15K) = 393.5 2 285.8 890.4kJ mol -1
74.7kJ mol -1
4 解 2N2H4 (l) + N 2O 4 (g)= 3N 2 (g) + 4H 2O(l) fHӨm(298.15K)/kJmol-1 50.63 9.16 0 -285.83
则该反应的HӨm(298.15K) = -1253.74 kJmol-1 -1253.74×1000 / 2×32 = 1.96×10 PV=nRT
B
4 1999.1 11 285.83 3 484.5
北航大学化学习题册参考答案

起始时物质的量 /mol 平衡时物质的量 /mol
8.0 8.0-x
4.0 4.0-x/2
0 x
在恒温恒容条件下,系统总压与系统的总物质的量成正比。 故
根据分压定律,各气体平衡时的分压分别为
2、解: (1) f
H m (298.15k)
(KJ)
(298.15k) m (KJ)
SiO2(s) -910.94
8 √ 18 √ 28 × 38 ×
9 × 19 √ 29 × 39 ×
10 √ 20 × 30 × 40 √
二、选择题(填写正确答案A、B或……)
1 C 11 B 21 A 31 D 41 B
2 A 12 C 22 A 32 D 42 C
3 C 13 A 23 AC 33 A 43 B
4 A 14 C 24 BC 34 B 44 D
21
×
22
√
23
×
24
√
25
×
26
×
27
×
28
×
二、选择题(填写正确答案A、B或……) 1 D 11 A 21 2 C 12 D 22 3 C 13 C 23 4 D 14 C 24 5 C 15 C 25 6 C 16 D 26 7 A 17 C 27 8 D 18 A 28 9 B 19 C 29 10 B 20 C 30
大学化学
习题册(1-4章) 参考答案
第一章 热化学
一、判断题(正确的画“√”,错误的画“×”)
1 × 11 ×
2 × 12 ×
3 × 13 ×
4 × 14 √
5 × 15 √
6 √ 16 √
7 √ 17 ×
大学化学课后习题答案第四章.

当pH=5.00,其他有关物质均处于标准条件时:
=1.033V
11.由镍电极和标准氢电极组成原电池。若c(Ni 2+=0.0100mol·dm -3时,原电池的电动势为0.315V ,其中镍为负极,计算镍电极的标准电极电势。
12.由两个氢电极H 2(101.325kPa|H +(0.10mol · dm -3|Pt和
(4计算c(I -=1.0×10-2mol·dm -3以及c(Fe 3+=c(Fe 2+/10时,原电池的电动势。
解:(1查阅教材附录10可知:32(Fe /Fe θφ++=0.771V ,
-
2(I /I θ
φ=0.5355 V
E θ=_θθφφ+-=32(Fe /Fe θφ++–-
2
(I
/I θφ=0.771 V – 0.5355 V=0.236 V
第四章电化学与金属腐蚀
1.是非题(对的在括号内填“+”,错的填“-”号
(1取两根铜棒,将一根插入盛有0.1mol·dm-3CuSO4溶液的烧杯中,另一根插入盛有1mol·dm-3CuSO4溶液的烧杯中,并用盐桥将两只烧杯中的溶液连结起来,可以组成一个浓差原电池。(
北航大学化学习题参考答案-前4章汇编
∴ K1 Ө (<464.5K) >1
5
习题答卷 班级学号____________ 姓名____________ 分数________
(3) ΔG Ө (564.5K) ≈ -46.11×103 – (564.5K)×(-99.27) = 9.93 kJ·mol-1 ln K2 Ө (564.5K) = -ΔG Ө (564.5K) / RT = - 9.93×103 / 8.314×564.5= -2.12
74.7kJ mol-1
4解 fHӨm(298.15K)/kJmol-1
2N2H4 (l) + N 2O 4 (g)= 3N2 (g) + 4H 2O (l)
50.63
9.16
0
-285.83
则该反应的HӨm(298.15K) = -1253.74 kJmol-1
-1253.74×1000 / 2×32 = 1.96×104 kJ
习题答卷 班级学号____________ 姓名____________ 分数________
第一章 热化学
一、判断题(正确的画“√”,错误的画“×” )
1
2
3
4
5
6
7
8
9
10
×
×
√
×
×
×
√
√
√
×
11
12
13
14
15
16
17
18
19
20
×
√
√
×
√
√
√
×
×
√
21
22
×
×
二、选择题(填写正确答案)
大学化学课后习题答案第123章

第1章化学反应基本规律习题及详解一.判断题1. 状态函数都具有加和性。
(×)2. 系统的状态发生改变时,至少有一个状态函数发生了改变。
(√)3. 由于CaCO3固体的分解反应是吸热的,故CaCO3的标准摩尔生成焓是负值。
(×)4. 利用盖斯定律计算反应热效应时,其热效应与过程无关,这表明任何情况下,化学反应的热效应只与反应的起,始状态有关,而与反应途径无关。
(×)5. 因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的ΔS大大增加。
(×)6. ΔH, ΔS受温度影响很小,所以ΔG受温度的影响不大。
(×)7. 凡ΔG大于零的过程都不能自发进行。
(×)8. 273K,下,水凝结为冰,其过程的ΔS<0, ΔG=0。
(√)9.反应Fe3O4(s)+4H2(g) → 3Fe(s)+4 H2O(g)的平衡常数表达式为。
(√)10.反应2NO+O2→2NO2的速率方程式是:,该反应一定是基元反应。
(×)二.选择题1. 某气体系统经途径1和2膨胀到相同的终态,两个变化过程所作的体积功相等且无非体积功,则两过程( B )A.因变化过程的温度未知,依吉布斯公式无法判断ΔG是否相等B.ΔH相等C.系统与环境间的热交换不相等D.以上选项均正确2. 已知CuCl2(s)+Cu(s)→2CuCl(s) Δr H mΘ(1) =170KJ?mol-1Cu(s)+Cl2(g) → CuCl2(s) Δr H mΘ(2) =-206KJ?mol-1则Δf H mΘ(CuCl,s)应为( D )B. -363. 下列方程式中,能正确表示AgBr(s)的Δf H mΘ的是( B )A.Ag(s)+1/2Br2(g)→ AgBr(s)B.Ag(s)+1/2Br2(l)→AgBr(s)C.2Ag(s)+Br2(l)→ 2AgBr(s)D.Ag+(aq)+Br-(aq)→ AgBr(s)4. 298K下,对参考态元素的下列叙述中,正确的是( C )A.Δf H mΘ≠0,Δf G mΘ=0,S mΘ=0B.Δf H mΘ≠0,Δf G mΘ≠0,S mΘ≠0C.Δf H mΘ=0,Δf G mΘ=0,S mΘ≠0D.Δf H mΘ=0,Δf G mΘ=0,S mΘ=05. 某反应在高温时能自发进行,低温时不能自发进行,则其( B )A.ΔH>0, ΔS<0 ;B. ΔH>0,ΔS>0C.ΔH<0, ΔS<0 ;D.ΔH<0, ΔS>06. 1mol气态化合物AB和1mol气态化合物CD按下式反应:AB(g)+CD(g)→AD(g)+BC(g),平衡时,每一种反应物AB 和CD都有3/4mol转化为AD和BC,但是体积没有变化,则反应平衡常数为( B )9 97. 400℃时,反应3H2(g)+N2(g)→2NH3(g)的K673Θ=×10-4。
《大学化学》课后习题答案大全

第一章课后作业答案1-4.判断下列几种说法是否正确,并说明理由。
(1)原子是化学变化中最小的微粒,它由原子核和核外电子组成;正确原子是化学变化中的最小粒子。
原子是由居于原子中心的原子核和核外电子构成,原子核又由质子和中子两种粒子构成的。
构成原子的基本粒子是电子、质子、中子。
(2)相对原子质量就是一个原子的质量;错误相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一个原子的真实质量与一个碳-12原子质量的1/12的比值。
(3)4g H2和4g O2所含分子数目相等;错误4g H2含有2mol氧气分子。
氢气相对分子质量2,4g/(2g/mol)=2mol。
4g O2含有0.125mol氧气分子。
氧气相对分子质量32,4g/(32g/mol)=0.125mol。
所以分子数目不相等。
(4)0.5mol的铁和0.5mol的铜所含原子数相等;正确铁和铜都是由原子构成的金属,摩尔是物质的量的单位,物质的量相同,即摩尔数相同,就表示原子数相同。
(5)物质的量就是物质的质量;错误物质的量:表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。
物质的量是一个物理量,它表示含有一定数目粒子的集体,符号为n。
物质的量的单位为摩尔,简称摩,符号为mol。
物质的质量:质量不随物体的形状和空间位置而改变,是物质的基本属性之一,通常用m表示物质的量=物质的质量/物质的摩尔质量(6)化合物的性质是元素性质的加合。
错误化合物的性质是由组成该化合物的微观结构决定的,例如CO和CO2,组成元素相同,性质却不同。
1-5.硫酸铵(NH4)2SO4、碳酸氢铵NH4HCO3和尿素CO(NH2)2三种化肥的含氮量各是多少?哪种肥效最高?答:①硫酸铵(NH4)2SO4,含氮量为(14*2)/(14*2+1*8+32*1+16*4)≈0.212②碳酸氢铵NH4HCO3,含氮量为14/(14+1*5+12+16*3)≈0.177③尿素CO(NH2)2,含氮量为(14*2)/(12+16+14*2+1*4)≈0.467综上,0.177<0.212<0.467,这三种肥料中,尿素的含氮量最高,所以尿素的肥效最高。
大学普通化学习题1-5参考答案

大学普通化学习题1-5参考答案习题参考答案习题一一、判断题(对的,在括号内填“√”,错的填“×”)1. ===和===的相同。
( × )2. 功和热是在系统和环境之间的两种能量传递方式,在系统内部不讨论功和热。
(√ )3. 反应的就是反应的热效应。
(× )4. Fe(s)和的都为零。
( × )5. 盖斯定律认为化学反应的热效应与途径无关,是因为反应处在可逆条件下进行的缘故。
( × )6. 同一系统不同状态可能有相同的热力学能。
(× )7. 由于=,是状态函数,的数值只与系统的始、终态有关,而与变化的过程无关,故也是状态函数。
(×)8. 由于固体的分解反应是吸热的,故它的标准摩尔生成焓是负值。
( × )9. 当热量由系统传递给环境时,系统的内能必然减少。
(× )10. 因为,不是系统所具有的性质,而与过程有关,所以热力学过程中()的值也应由具体的过程决定。
(× )二、选择题(将正确的答案的标号填入空格内)1. 对于封闭体系,体系与环境间 ( B )A. 既有物质交换,又有能量交换B. 没有物质交换,只有能量交换C. 既没物质交换,又没能量交换D. 没有能量交换,只有物质交换2. 热力学第一定律的数学表达式只适用于 ( C )A. 理想气体B. 孤立体系C. 封闭体系D. 敞开体系3. 环境对系统作10kJ的功,且系统又从环境获得5kJ的热量,问系统内能变化是多少? ( D )A. kJB. kJC. +5kJD. +15kJ4. 已知2PbS(s) + 3=== 2PbO(s) + 2的=,则该反应的值是多少? ( D )A. 840.9B. 845.9C.D.5. 通常,反应热的精确实验数据是通过测定反应或过程的哪个物理量而获得的。
( D )A. B. C. D.6. 下列对于功和热的描述中,正确的是哪个? ( A )A. 都是途径函数,无确定的变化途径就无确定的数值B. 都是途径函数,对应于某一状态有一确定值C. 都是状态函数,变化量与途径无关D. 都是状态函数,始终态确定,其值也确定7. 在温度的标准状态下,若已知反应A→2B的标准摩尔反应焓,与反应2A→C的标准摩尔反应焓,则反应C→4B的标准摩尔反应焓与及的关系为=?( D )A. B.C. D.8. 对于热力学可逆过程,下列叙述不正确的是哪个? ( C)A. 变化速率无限小的过程B. 可做最大功的过程C. 循环过程D. 能使系统与环境都完全复原的过程9. 下述说法中,不正确的是哪个? ( D )A. 焓只有在某种特定条件下,才与系统吸热相等B. 焓是人为定义的一种具有能量量纲的热力学量C. 焓是状态函数D. 焓是系统能与环境进行热交换的能量10. 封闭系统经过一循环过程后,其下列哪组参数是正确的? ( C )A. =0,=0,=0,=0B. ≠0,≠0,=0,=C. =,=,=0D. ≠,=,=011. 以下说法正确的是哪个? ( B )A. 状态函数都具有加和性B. 系统的状态发生改变时,至少有一个状态函数发生了改变C. 因为=,=,所以恒容或恒压条件下,都是状态函数D. 虽然某系统分别经过可逆过程和不可逆过程都可达到相同的状态,但不可逆过程的熵变值不等于可逆过程的熵变值。
6,7,8,9章测试题三及答案

共 8 页:3/8
北京航空航天大学 应用化学专业 分析化学试题 3
二.填空题(28 分) 1. (本题 4 分)丁酸在苯-水体系中的分配系数 KD=3, 当 100 mL 0.10 mol· -1 丁酸溶液用 25 mL L 苯 萃 取 时 , 在 pH=4.00 丁 酸 在 苯 中 , 分 配 比 D 为 _________________, 其 浓 度 为 ____________________. (丁酸根离子不被萃取,丁酸的 pKa=4.8) -1 答案: D=2.6; 0.16 mol·L p277-278
北京航空航天大学 应用化学专业 分析化学试题 3 班级: 学号: 姓名: 成绩:
一、选择题 ( 30 分. 每题 1.5 分,共 21 个题, 选作 20 个题) 1. 一有色溶液对某波长光的吸收遵守比尔定律, 当选用 2.0 cm 的比色皿时, 测得透射率为 T, 若改用 1.0 cm 的吸收池, 则透射率为----------------------------------------------------------- ( ) 2 1/2 (A): 2T (B): T/2 (C): T (D): T 答案: D,p238 习题 3 由-lgT=A=Kbc,当 b 由 2.0cm 改变为 1.0cm 时,A 变为原先的 1/2,即 lgT2=1/2lgT1,因此透光率 变为 T1/2 2. 使用磺基水杨酸分光光度法测定微量 Fe3+时, 光度计检测器直接测定的是-------- ( (A): 入射光的强度 (B): 吸收光的强度 (C): 透过光的强度 (D): 散射光的强度 答案: C p220d 3. 在螯合物萃取体系中, 当水相的 H+浓度越大时, 其萃取效率-------------------------- ( (A): 越低 (B): 越高 (C): 取决于萃取剂的浓度 (D): 取决于萃取常数 + 答案: A . H 浓度大,金属离子容易进入有机相.p280 页下 )
大学化学习题与答案

第一章化学反应基本规律1、在标准态的规定中,下述表达不正确的是( )A、标准压力P=B、T=C、b=mol·kg-1D、纯固体或纯液体处于标准压力。
2、在标准条件下,下列反应式中能表示CO2的Δf H m的反应式为( )A、C(金刚石)+ O2(g)= CO2(g)B、C(石墨)+O2(g)= CO2(g)C、CO(g)+1/2O2(g)= CO2(g)D、CO2(g)=CO(g)+1/2O2(g)3、已知下列反应在一定温度下的热效应:4Fe2O3(s)+Fe(s)=3Fe3O4(s), Δr H m=-74 kJ·mol-14Fe(s)+3O2(g)=2Fe2O3(s), Δr H m=-1664kJ·mol-1则可计算出Fe3O4(s)的标准摩尔生成焓等于( )4、等压过程,高温非自发,低温自发的条件是( )5、等温条件下,某反应Δr G m=10kJ·mol-1,这表示该反应在标准状态下( )A、自发进行B、非自发进行C、自发与否,需具体分析6、汽车尾气中的CO,可用加入催化剂催化其热分解的方法消除。
已知热分解反应CO(g)= C(s)+O2(g)的Δr H m=·mol-1,Δr S m=·mol-1·K-1这一方法正确与否解释其原因:7、(1)U,S,H,G均为( )(2)Δr H m>0为( )(3)Δr G m <0为( )(4)K为( )8、反应的Δr H m<0,温度升高时(T2>T1)则平衡常数( )当Δr H m>0,温度升高时则( )9、碳燃烧反应为基元反应,其方程式为C(s)+O2 (g)→CO2 (g)则其反应速率方程式为( )A、υ=kc(C)c(CO2)B、υ=kc(O2)c(CO2)C、υ=kc(CO2)D、υ=kc(O2)10、升高温度,可增加反应速度,主要因为( )A、增加了分子总数B、增加了活化分子百分数C、降低了活化能D、促进平衡向吸热方向移动11、已测得高温时焦炭与二氧化碳反应C+CO2→2CO的活化能为167kJ·mol-1。
大学化学(第二版)部分习题参考答案

(PNH3/Pө)2
(PN2/Pө)1 ·(PH2/Pө)3
ΔrGm(T) = ΔrGmө(T)+2.303RT lgQ
Sn(s)+O2(g)= SnO2(s)
[P34:8题] 设汽车内燃机内温度因燃料燃烧反应达到1300℃, 试计算该反应: N2 (g) + O2 (g) = 2NO(g) 在1300℃时的标准摩尔吉布斯函数变和标准平衡常数Kө。
p(O2) = 101.325Kpa×21% = 21.28Kpa
P(O2)
Pө
1
P(O2)/Pө
21.28Kpa
100Kpa
解: 查表可知: Sn(s) + O2(g) = SnO2(s) ΔfGmө (298.15K)/( kJ·mol-1) 0 0 -519.7
(1) 在标准态下自发进行的温度T的计算:
△rSmө(298.15K) =∑viSmө(生成物) -∑viSmө(反应物) =[ 1×106.7] –[1×39.75 + 1×248.22 + 1/2×205.14] = -283.84J·mol-1·K-1
(1000/100)1 ·(1000/100)3
(1000/100)2
ΔrGm(T) = ΔrGmө(T) + 2.303RTlgQ = -21.63 + 2.303×8.314×10-3×573.15×lg(100) = 0.318(kJ·mol-1)
ΔrGm(T) =ΔrGmө(T) +2.303RTlgQ = -145.28 + 2.303×8.314×10-3×1250×lg(22.37) = -112.98kJ·mol-1<0
大学化学课后习题参考答案(DOC)

第1章 化学热力学参考答案:(一)选择题1.A 2.A 3.C 4.B 5.D 6.C 7.C 8.C 9. A 10. C 11. A 12.C (二)填空题1.40;2.等温、等容、不做非体积功,等温、等压,不做非体积功; 3.>,<,=,> 4.增大、不变 5.不变 6.3.990 kJ·mol -1(三)判断题1. ×2. ×3. ×4. ×5. √6. ×7. ×8. ×9. × 10. × (四)计算题1.解:(g)O N (l)H 2N 4242+O(l)4H (g)3N 22+(l)H N 42摩尔燃烧热为 2.解:)mol ·(kJ 28.254166.963.502)84.285(401f B r --=-⨯--⨯+=∆=∆∑HH ν)mol ·(kJ14.627211r-Θ-=∆=H Q pK 1077.3109.9824.37333mr r ⨯=⨯--=∆∆=-S T 转)mol ·(kJ 78.34357.86)15.137(36.3941f B r --=---=∆=∆∑G ν)K ·mol ·(J 9.9865.21056.1975.191216.21311B r ---=--⨯+==∆∑νNO(g)CO(g)+(g)N 21(g)CO 22+)mol ·(kJ 24.37325.90)52.110(5.3931f B r --=----=∆=∆∑H ν此反应的 是较大的负值,且)(,)(-∆-∆S H 型反应,从热力学上看,在 T 转的温度以内反应都可自发进行。
3.解:外压kPa 50e =p ,11p nRT V =,22p nRTV =,2e p p = 系统所做功:定温变化,0=∆U0=+=∆W Q U ,所以Q =1 247.1(J ) 定温过程pV =常数 ∆(pV )=0 所以 0)(=∆+∆=∆pV U H 4.解:查表知CaO(s) + SO 3(g) = CaSO 4(s)求得同理求得 因为 所以根据经验推断可知,反应可以自发进行。
大学化学习题及答案

第一章化学反应基本规律1、在标准态的规定中,下述表达不正确的是()A、标准压力PӨ=100.00KPaB、T=298.15KC、bӨ=1.00mol·kg-1D、纯固体或纯液体处于标准压力。
的Δf H mӨ(298.15K)的2、在标准条件下,下列反应式中能表示CO2反应式为()A、C(金刚石)+ O2(g)= CO2(g)B、C(石墨)+O2(g)= CO2(g)C、CO(g)+1/2O2(g)= CO2(g)D、CO2(g)=CO(g)+1/2O2(g)3、已知下列反应在一定温度下的热效应:4Fe2O3(s)+Fe(s)=3Fe3O4(s),Δr H mӨ=-74 kJ·mol-14Fe(s)+3O2(g)=2Fe2O3(s),Δr H mӨ=-1664kJ·mol-1则可计算出Fe3O4(s)的标准摩尔生成焓等于()4、等压过程,高温非自发,低温自发的条件是()5、等温条件下,某反应Δr G mӨ=10kJ·mol-1,这表示该反应在标准状态下()A、自发进行B、非自发进行C、自发与否,需具体分析6、汽车尾气中的CO,可用加入催化剂催化其热分解的方法消除。
已知热分解反应CO(g)= C(s)+O2(g)的Δr H mӨ=110.5kJ·mol-1,Δr S mӨ=-0.089kJ·mol-1·K-1这一方确与否?解释其原因:7、(1)U,S,H,G均为()(2)Δr H m>0为()(3)Δr G m <0为()(4)KӨ为()8、反应的Δr H mӨ<0,温度升高时(T2>T1)则平衡常数()当Δr H mӨ>0,温度升高时则()9、碳燃烧反应为基元反应,其方程式为C(s)+O2 (g)→CO2 (g)则其反应速率方程式为()A、υ=kc(C)c(CO2)B、υ=kc(O2)c(CO2)C、υ=kc(CO2)D、υ=kc(O2)10、升高温度,可增加反应速度,主要因为()A、增加了分子总数B、增加了活化分子百分数C、降低了活化能D、促进平衡向吸热方向移动11、已测得高温时焦炭与二氧化碳反应C+CO2→2CO的活化能为167kJ·mol-1。
(完整版)大学化学课后习题答案解析..

第一章化学反应热教学内容1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热效应。
教学要求掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。
知识点与考核点1.系统(体系)被划定的研究对象。
化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。
2.环境(外界)系统以外与之密切相关的部分。
系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。
系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换);封闭体系(系统与环境之间没有..能量交换);..物质交换,只有孤立系统(体系与环境之间没有物质交换,也没有能量交换)系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为的边界,目的是确定研究对象的空间范围。
3.相系统中物理性质和化学性质完全相同的均匀部分。
在同一个系统中,同一个相可以是连续的,也可以是不连续的。
例如油水混合物中,有时水是连续相,有时油是连续相。
4.状态函数状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些宏观性质描述的,这些宏观性质又称为系统的状态函数。
状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。
5*.过程系统状态的变化(例如:等容过程、等压过程、等温可逆过程等)6*.途径完成某过程的路径。
若系统的始、末态相同,而途径不同时,状态函数的变量是相同的。
7*.容量性质这种性质的数值与系统中的物质的量成正比,具有加合性,例如m(质量)V、U、G等。
8*.强度性质这种性质的数值与系统中的物质的量无关,不具有加合性,例如T、 (密度)、p(压强)等。
9.功(W)温差以外的强度性质引起的能量交换形式 [W=W体+W有]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
参考答案
王宁
第一章 热化学
一、判断题(正确的画“√”,错误的画“×”)
1 × 11 ×
2 × 12 ×
3 × 13 ×
4 × 14 √
5 × 15 √
6 √ 16 √
7 √ 17 ×
8 √ 18 ×
9 √ 19 √
10 × 20 ×
二、选择题(填写正确答案)
少选得分, 多选无分
2 CD B 16 17 B C
中
碱
H2PO4 , H2O , HS-
3、 4
4、(1)基本不变 (2)减小 (3)减小 (4)降低
=10
填空题
1.HCl是强酸,在水溶液中完全电离,故H+浓度等于酸的 浓度;HAc是弱酸,其溶于水时只能部分电离, 解离常数Ka=1.76×10-5
C eq ( H ) Ka c 1.76 105 0.2 1.9 103 mol L1
0.361(KJ/mol.k)
△ G
r
θ m =689.89-298.15×0.361=582.258(KJ/mol)>0
不能自发进行。
(2) 自发反应时△rGmθ<0且△rSmθ>0 得T>1911.80K
T>
r H m (298.15K ) r Sm (298.15K )
(3) △rGmθ(T) = △H mθ(298.15k) -T△Smθ (298.15k)
第二章 化学反应的基本原理
一、判断题(正确的画“√”,错误的画“×”)
1 √ 11 × 21 × 31 ×
2 × 12 × 22 √ 32 ×
3 √ 13 × 23 × 33 ×
4 × 14 × 24 √ 34 √
5 × 15 × 25 √ 35 ×
6 × 16 × 26 × 36 √
7 √ 17 × 27 × 37 ×
2.
() Sn Sn2 (aq) Ag (aq) Ag ()
() Zn Zn 2 (aq) Cl (aq) Cl2 ( g ) Pt ( ) () Ni Ni 2 (aq) Br (aq), Br2 (l ) Pt ()
() Ag AgBr (s) Br (aq) Ag (aq ) Ag ( )
第四章
1 √ 11 √ 21 × 2 × 12 × 22 √ 3 × 13 √ 23 × 4 √ 14 × 24 √ 5 √ 15 √ 25 ×
电化学
6 √ 16 × 26 × 7 × 17 × 27 × 8 × 18 × 28 × 9 √ 19 × 10 × 20 √
一、判断题(正确的画“√”,错误的画“×”)
1
3 A 18 C
4 D 19 A
5 D 20 D
6 D 21 D
7 8 9 10 D BC A D 22 23 24 25 B B A B
11 C 26 B
12 B 27 B
13 B 28 D
14 C 29 B
15 A 30 A
三、计算题 1、解: C6H6(l) + 15/2O2(g) = 6CO2(g) + 3H2O(l) Cv(H2O)=4.18J/(g.k) C总=1230J.K-1
= 3.256 ×103(KJ)
2、解:
△fHmθ(KJ.mol-1)
C2H2(g) + 5/2O2(g)→ 2CO2(g) + H2O(l)
226.73 0 -393.509 -285.83
△rHmθ=∑νB △fHmθ=(-285.83)+(-393.509) ×2-226.73=-1299.578 (KJ.mol-1)
5 A 15 B 25 C 35 D 45 BC
6 B 16 C 26 B 36 B 46 A
7 C 17 B 27 B 37 D
8 A 18 A 28 C 38 D
9 B 19 A 29 D 39 D
10 B 20 C 30 D 40 BC
三、填空题
1、0.2mol/L 2、HCl , H2S
1.9 ×10-3mol/L AC- , NO2- , CO32-
把等量的NaOH加入HCl时,强酸、强碱刚好中和呈中性; 把等量的NaOH加入HAc时,反应生成强碱弱酸盐,该盐电 离成碱性.
2.酸碱质子理论认为:凡能给出质子的物质都是酸;凡能 与质子结合的物质都是碱.
5 pH 5 c 10 3. (H )
4 c 10 pH 4 氢离子增加到原来的10倍, ( H )
二、选择题(填写正确答案A、B或……)
1 D 11 A 21
2 C 12 D 22
3 C 13 C 23
4 D 14 C 24
5 C 15 C 25
6 C 16 D 26
7 A 17 C 27
8 D 18 A 28
ABC
9 B 19 C 29
10 B 20 C 30
D
B
C
D
B
C
C
A
C
三、原电池图示练习 1.
填空题
1. A.判断铁为正极;
G nFE B. r m
ln K nFE C.
RT c G / c c D / c D. E E ln nF c A / c a c B / c b
g
d
2.
25 26 27 28 29 30 31 32 33 34
× √
√
√
√
√
√
√
√
√
二、选择题(填写正确答案A、B或„„)
1 A 11 B 21 B 31 C 41 A
2 3 C B 12 13 C C 22 23 B C 32 33 A C 42 43 CD AD
4 A 14 A 24 AD 34 D 44 B
起始时物质的量 /mol 平衡时物质的量 /mol
8.0 8.0-x
4.0 4.0-x/2
0 x
在恒温恒容条件下,系统总压与系统的总物质的量成正比。 故
根据分压定律,各气体平衡时的分压分别为
2、解: (1) f
H m (298.15k)
(KJ)
(298.15k) m (KJ)
SiO2(s) -910.94
() Pt I 2 ( s) I (aq) Fe 2 (aq), Fe3 (aq) Pt ()
() Pt Sn2 (aq), Sn 4 (aq) Cr 3 (aq), CrO72 (aq), H Pt ()
()Co Co2 (aq) Cl (aq) Cl2 ( g ) Pt ()
B
C2H4(g) + 3O2(g)→ 2CO2(g) + 2H2O(l)
△fHmθ(KJ.mol-1) 52.26 0 -393.509 -285.83
△rHmθ=∑νB △fHmθ=(-393.509) ×2+(-285.83) ×2-52.26
B
=-1410.938 (KJ.mol-1)
负号,放热: ︱乙烯△rHmθ ︱ >︱乙炔△rHmθ ︱ 所以同物质的量的乙炔和乙烯充分燃烧生成液态水时乙烯放出的热量多。
pH+pOH=14
pOH=10
4.(1)盐酸是强酸,加入NH4Cl后基本不影响溶液的pH值; (2)氨水溶液呈弱碱性,电离出NH4+,加入NH4Cl后因加 入的NH4+产生同离子效应,故NH3的解离度降低; (3)在纯水中加入NH4Cl后,形成强酸弱碱盐溶液,pH值 减小; (4)PbCl2溶解性较差,加入的Cl-产生同离子效应,使得 PbCl2溶解度降低.
+
2C(石墨) == Si(s) 0 0
+ 2CO -110.525
S
41.84
5.740
18.83
197.674
△rGmθ=△rH mθ -T△rSmθ △rH mθ =2×(-110.525)+0-0-(-910.94)=689.89(KJ)
△rSmθ=2×197.674+18.83-2×5.740-41.84
依题意知道反应前后温差△T=23.43-21.30=2.13(K)
0.500g苯燃烧释放的热量 q1 =[Cv(H2O).m(H2O)+ C总] △T =[4.18×2050+1230] ×2.13 =20871.87(J)=20.87(KJ) 已知 M(C6H6)=78g/mol
78 78 0.500g C6H6 燃烧时,qv = q1 × =20871.87 × 0.500 0.500
8 √ 18 √ 28 × 38 ×
9 × 19 √ 29 × 39 ×
10 √ 20 × 30 × 40 √
二、选择题(填写正确答案A、B或„„)
1 C 11 B 21 A 31 D 41 B
2 A 12 C 22 A 32 D 42 C
3 C 13 A 23 AC 33 A 43 B
4 A 14 C 24 BC 34 B 44 D
5 B 15 B 25 B 35 A 45 B
6 D 16 A 26 D 36 B 46 D
7 D 17 D 27 A 37 A 47 B
8 B 18 A 28 A 38 A 48 A
9 B 19 BC 29 B 39 D 49 C
10 D 20 A 30 B 40 B 50 A
三、计算题
1、解: 设平衡时SO3的物质的量为x mol
G m (T ) = -39.57 ln K RT
Kθ=6.5×10-18
