蛋白质含量测定方法比较
蛋白质的测定方法比较

蛋白质的测定方法比较一、分光光度法1、测定原理:食品中的蛋白质在催化加热条件下被分解,分解产生的氨与硫酸结合生成硫酸铵,在pH 4.8 的乙酸钠-乙酸缓冲溶液中与乙酰丙酮和甲醛反应生成黄色的3,5-二乙酰-2,6-二甲基-1,4-二氢化吡啶化合物。
在波长400 nm 下测定吸光度值,与标准系列比较定量,结果乘以换算系数,即为蛋白质含量。
2、测定步骤:①试样消解:称取经粉碎混匀过40目筛的固体试样0.1g~0.5g(精确0.001g)、半固体试样0.2g~1g(精确至0.001g)或液体试样1g~5g(精确0.001g),移入干燥的100 mL 或250 mL 定氮瓶中,加入0.1 g硫酸铜、1 g 硫酸钾及5 mL 硫酸,摇匀后于瓶口放一小漏斗,将定氮瓶以45°角斜支于有小孔的石棉网上。
缓慢加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清透明后,再继续加热半小时。
取下放冷,慢慢加入20 mL 水,放冷后移入50 mL 或100 mL容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻度,混匀备用。
按同一方法做试剂空白试验。
②试样溶液的制备:吸取2.00 mL~5.00 mL 试样或试剂空白消化液于50 mL 或100 mL 容量瓶内,加1 滴~2 滴对硝基苯酚指示剂溶液,摇匀后滴加氢氧化钠溶液中和至黄色,再滴加乙酸溶液至溶液无色,用水稀释至刻度,混匀。
③标准曲线的绘制:吸取0.00 mL、0.05 mL、0.10 mL、0.20 mL、0.40 mL、0.60 mL、0.80 mL 和1.00 mL 氨氮标准使用溶液(相当于0.00μg、5.00μg、10.0μg 、20.0μg、40.0μg、60.0μg、80.0μg 和100.0μg 氮),分别置于10 mL 比色管中。
加4.0 mL 乙酸钠-乙酸缓冲溶液及4.0 mL 显色剂,加水稀释至刻度,混匀。
蛋白质含量测定方法

蛋白质含量测定方法
一、Lowry法。
Lowry法是一种经典的蛋白质含量测定方法,其原理是利用蛋白质与铜离子和
碱性试剂在碱性条件下发生蓝色化合物的形成,然后通过比色法来测定蛋白质的含量。
这种方法的优点是灵敏度高,适用于各种类型的蛋白质样品,但需要注意的是,样品中的其他成分可能对测定结果产生干扰。
二、Bradford法。
Bradford法是一种快速、简便的蛋白质含量测定方法,其原理是利用共轭蛋白
质与染料结合后产生吸收峰的变化来测定蛋白质的含量。
相比于Lowry法,Bradford法对于样品中存在的干扰物质的耐受性更强,因此在实际应用中更为广泛。
三、BCA法。
BCA法是一种基于铜离子的蛋白质含量测定方法,其原理是利用蛋白质与铜
离子和BCA试剂在碱性条件下发生紫色化合物的形成,然后通过比色法来测定蛋
白质的含量。
与Lowry法相比,BCA法对于一些常见的干扰物质的耐受性更好,
因此在实际应用中也得到了广泛的应用。
四、UV吸收法。
UV吸收法是一种利用蛋白质在280nm处的吸收峰来测定蛋白质含量的方法。
这种方法不需要添加试剂,操作简便,但对于一些特定类型的蛋白质可能存在灵敏度不足的问题。
以上介绍的几种蛋白质含量测定方法各有优缺点,选择合适的方法需要根据具
体的实验要求和样品特性来进行。
在进行蛋白质含量测定时,还需要注意样品的制备、操作的规范性以及仪器的准确性,以确保获得可靠的实验结果。
希望本文介绍的内容能对相关研究工作者有所帮助。
两种测定蛋白质含量方法的比较(精)

其中,Y为标准曲线查得ห้องสมุดไป่ตู้白质得浓度(mg/mL),N为稀释倍数, V为血清样品所取的体积(mL),c为样品原浓度(mg/mL)。
注意事项
(1)须于显色后30min内比色测定。各管由显色到比色的 时间应尽可能一致。 (2)有大量脂肪性物质同时存在时,会产生浑浊的反应混 合物,这时可用乙醇或石油醚使溶液澄清后离心,取上清液 再测定。 (3)由于各种蛋白质含有不同量的酪氨酸和苯丙氨酸,显 色的深浅往往随不同的蛋白质而变化。因而本测定法通常只 适用于测定蛋白质的相对浓度(相对于标准蛋白质)。此外 蛋白溶液中存在核酸或核苷酸时也会影响紫外吸收法测定蛋 白质含量的准确性。
• 试剂:
双缩脲试剂:
试剂和器材
• 材料
1. 标准蛋白溶液 两种浓度的结晶牛血清白蛋白
溶液(BSA)。
2. 待测蛋白质溶液 人血清(稀释适当倍数,使其浓 度在标准曲线测试范围内。)
操作方法
一、制作标准曲线 二、样品测定
三、计算 取两组测定的平均值计算:
YxN 血清样品蛋白质含量(mg/100mL)=
紫外线吸收法测定蛋白质含量的优点是迅速,简便,不消耗样品, 低浓度盐类不干扰测定。因此,广泛应用在柱层析分离中蛋白质洗 脱情况的检测。
此法的缺点是:(1)对于测定那些与标准蛋白质中酪氨酸和色 氨酸含量差异较大的蛋白质,有一定的误差;(2)若样品中核酸 等吸收紫外线的物质,会出现较大的干扰。
不同的蛋白质和核酸的紫外线吸收是不同的,即使经过校正,测 定结果也还存在一定的误差。但是可作为初步定量的依据。该法可 测定蛋白范围应在0.1~1.0mg /mL。
思考题
1.干扰双缩脲实验的因素有哪些? 2.若样品中含有核酸类杂质,应该如何校正实验结
生化综合实验报告--测定蛋白质含量的三种方法及其比较

①容量瓶②试管及试管架
③恒温水浴槽④吸量管
⑤分光光度计⑥电热套
⑦锥形瓶⑧比色皿
(3)紫外吸收法
试剂:
样品蛋白溶液:准确称样品蛋白质,配制成一定浓度的溶液。
器材:
①紫外分光光度计②容量瓶
③试管、试管架④吸量管
⑤锥形瓶⑥比色皿
4.实验方法步骤及注意事项
双缩脲法
标准曲线的绘制:
取12支试管分成两组,按下表平行操作,绘制标准曲线。
实验远没有我想象的那样简单,要想做好一个实验,容不得半点马虎。综合实验正是这培养了我们的耐心、恒心和信心,让我们的思维和创造力得到了大幅度的提高,让我们的科学素养有了很大的飞越。真真正正变学生的被动学习为主动学习,激发了我们的学习热情,不管实验成功或是失败,我们都能从中获得很多从其它地方得不到的知识,让我们获益匪浅!
若样品中含有大量吸收紫外线的物质,会出现较大的干扰。
5.实验数据处理方法
双缩脲法
试
剂
0
1
2
3
4
5
样品1
样品2
O.D540
0
0.021
0.052
0.160
0.316
0.345
0.08
0.029
标准蛋白质浓度(mg/ml)
0
1
2
3
4
5
X
Y
考马斯亮蓝染色法
试
剂
0
1
2
3
4
5
样品1
样品2
蛋白质浓度(ug/ml)
样品测定:
①制备样品的蛋白质提取液。
②取出两份1.0 ml样品液。操作同标准曲线,测定样品的OD值,平行两份
计算:
蛋白质含量测定方法及优缺点

蛋白质含量测定方法及优缺点嘿,咱先说说凯氏定氮法吧!这方法就是把蛋白质里的氮给测出来,然后再换算成蛋白质含量。
步骤呢,先把样品消解,让蛋白质里的氮变成铵盐,再用碱把铵盐变成氨气,用硼酸吸收氨气,最后用酸滴定硼酸里的氨。
哇塞,听起来是不是超厉害?注意事项嘛,消解的时候一定要小心,别让样品溅出来烫伤自己。
这方法安全不?只要操作得当,还是挺安全的。
稳定性也不错,只要仪器状态好,结果就比较准。
那它应用场景可多了去了,像食品检测、饲料分析啥的都能用。
优势就是比较经典,大家都认可。
比如说检测牛奶的蛋白质含量,用凯氏定氮法就很靠谱,结果准确得很呢!再讲讲双缩脲法。
这方法是利用蛋白质和双缩脲试剂反应产生颜色变化来测含量。
步骤就是把样品和双缩脲试剂混合,然后看颜色深浅。
简单吧?注意不能有干扰物质哦,不然颜色就不准了。
安全性那是杠杠的,没啥危险。
稳定性也还行,只要试剂没问题。
应用场景呢,像生物制品检测就常用。
优势就是快速方便呀!想象一下,这就像你一下子找到了宝藏,又快又准。
比如检测蛋白质溶液,双缩脲法几分钟就能出结果,多爽!最后说说考马斯亮蓝法。
这个是靠蛋白质和考马斯亮蓝结合变色来测。
把样品加进考马斯亮蓝溶液里,颜色一变就知道含量了。
注意溶液的浓度要合适哦。
安全得很,没啥风险。
稳定性也不错。
应用在生物化学实验里很多。
优势就是特别灵敏。
这就好比你有一双超级厉害的眼睛,啥都能看得清清楚楚。
比如检测蛋白质提取物,考马斯亮蓝法能检测出微量的蛋白质,厉害吧!总之,不同的蛋白质含量测定方法都有自己的特点和优势,咱得根据实际情况选择合适的方法,这样才能准确又高效地测出蛋白质含量。
蛋白质含量测定方法比较
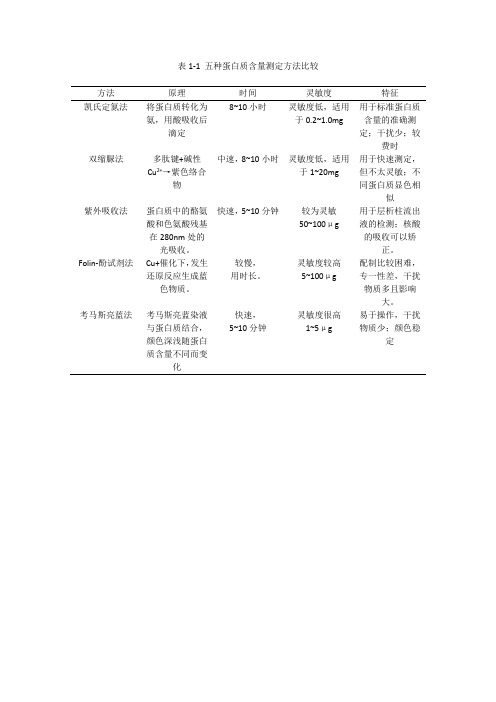
表1-1 五种蛋白质含量测定方法比较
方法原理时间灵敏度特征
凯氏定氮法将蛋白质转化为
氨,用酸吸收后
滴定8~10小时灵敏度低,适用
于0.2~1.0mg
用于标准蛋白质
含量的准确测
定;干扰少;较
费时
双缩脲法多肽键+碱性
Cu2+→紫色络合
物中速,8~10小时灵敏度低,适用
于1~20mg
用于快速测定,
但不太灵敏;不
同蛋白质显色相
似
紫外吸收法蛋白质中的酪氨
酸和色氨酸残基
在280nm处的
光吸收。
快速,5~10分钟较为灵敏
50~100μg
用于层析柱流出
液的检测;核酸
的吸收可以矫
正。
Folin-酚试剂法Cu+催化下,发生
还原反应生成蓝
色物质。
较慢,
用时长。
灵敏度较高
5~100μg
配制比较困难,
专一性差,干扰
物质多且影响
大。
考马斯亮蓝法考马斯亮蓝染液
与蛋白质结合,
颜色深浅随蛋白
质含量不同而变
化
快速,
5~10分钟
灵敏度很高
1~5μg
易于操作,干扰
物质少;颜色稳
定。
四种蛋白质含量测定方法的比较研究

四种蛋白质含量测定方法的比较研究蛋白质是生物体内的重要成分,其含量的测定对于生物学、医学、食品科学等领域具有重要意义。
目前常用的蛋白质含量测定方法主要有四种,包括生物素-亲和法、BCA法、Lowry法和Bradford法。
下面将对这四种方法进行比较研究。
一、生物素-亲和法生物素-亲和法是一种基于亲和层析原理的蛋白质含量测定方法。
该方法利用生物素与亲和基团之间的非共价作用,将生物素标记的探针与目标蛋白质结合,通过洗脱和检测来测定蛋白质的含量。
该方法具有高灵敏度、高特异性和高重复性等优点,但需要使用生物素标记的试剂,成本较高。
二、BCA法BCA法是一种基于铜离子还原能力的蛋白质含量测定方法。
该方法利用蛋白质与铜离子的络合作用,还原离子中的铜离子,生成紫色络合物,通过比色法测定蛋白质的含量。
该方法具有灵敏度高、线性范围广、操作简便等优点,但受到还原剂和蛋白质成分的影响,结果易受到误差。
三、Lowry法Lowry法是一种基于蛋白质与酸性铜离子的还原反应的蛋白质含量测定方法。
该方法利用蛋白质与酸性铜离子的还原反应,生成紫色络合物,通过比色法测定蛋白质的含量。
该方法具有灵敏度高、线性范围广、重复性好等优点,但需要多个试剂的配制和操作,较为繁琐。
四、Bradford法Bradford法是一种基于染料结合的蛋白质含量测定方法。
该方法利用染料与蛋白质之间的非共价作用,形成蓝色复合物,通过比色法测定蛋白质的含量。
该方法具有灵敏度高、操作简便、适用于多种蛋白质的测定等优点,但受到盐离子和其他成分的影响,结果易受到误差。
综上所述,四种蛋白质含量测定方法各有优缺点,选择合适的方法需要根据实际需求和实验条件进行综合考虑。
蛋白质含量的测定方法

蛋白质含量的测定方法
蛋白质的含量是指在样品中蛋白质的质量或浓度。
测定蛋白质含量是许多生物学和生化实验中常用的实验方法之一,以下是一些常见的测定方法:
1. 布拉德福德法(Bradford法):该方法利用布拉德福德蛋白
质染料与蛋白质形成复合物,并产生特定的颜色,通过比色法测定颜色强度从而确定含量。
2. 低里氏法(Lowry法):该方法基于在碱性条件下,蛋白质
与碱性铜离子复合生成紫色产物的原理,通过比色法定量测定。
3. BCA法(Bicinchoninic Acid法):该方法利用BCA试剂与
蛋白质中的蛋白质产生螯合,形成紫色到蓝色的产物,并通过光度计测定吸光度从而测定含量。
4. 还原硝酸银法:该方法是通过硝酸银与蛋白质中的氨基酸中的硫原子反应产生黑色沉淀,通过沉淀的重量或者比色法测定吸光度来确定蛋白质含量。
5. 紫外吸收法:蛋白质具有特定的紫外吸收峰,在特定波长下进行测定,可以通过比较样品吸光度与标准曲线来计算蛋白质含量。
以上只是一些常见的测定方法,根据具体需要和实验条件的不同,可以选择适合的方法进行蛋白质含量的测定。
几种蛋白质含量测定方法的比较

几种蛋白质含量测定方法的比较蛋白质含量测定方法,是生物化学【摘要】:研究中最常用、最基本的分析之一。
目前常用的方法有凯氏定氮法、双缩脲法(Biuret)、紫外吸收法、考马斯亮蓝法(Bradford),Folin—酚试剂法(Lowry)杜马斯燃烧法。
其中Bradford 法灵敏度颇高,比紫外吸收法灵敏10~20 倍,比Biuret法灵敏100 倍以上。
凯氏定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。
过去Folin—酚试剂法法是应用最广泛的一种方法,由于其试剂乙的配制较为困难(现在已可以在本公司订购),近年来逐渐被考马斯亮兰法所取代。
测定农产品中全氮的凯氏定氮法在许多国家已被杜马斯然烧定氮法所代替,杜马斯燃烧法是基于在高温下(大约900 ℃),通过控制进氧量、氧化消解样品的原理而进行氮测定的。
这6种方法并不能在任何条件下适用于任何形式的蛋白质,每种方法都有其优缺点,在选择方法时应考虑:⑴实验对测定所要求的灵敏度和精确度;⑵蛋白质的性质;⑶溶液中存在的干扰物质;⑷测定所要花费的时间【关键词】:凯氏定氮法双缩脲法紫外吸收法考马斯亮蓝法Folin—酚试剂法杜马斯燃烧法一、凯氏定氮法原理凯氏定氮法测定蛋白质分为样品消化、蒸馏、吸收和滴定4 个过程。
其原理是样品中含氮有机化合物与浓硫酸在催化剂作用下共热消化,含氮有机物分解产生氨,氨又与硫酸作用,变成硫酸铵。
然后加碱蒸馏放出氨, 氨用过量的硼酸溶液吸收,再用盐酸标准溶液滴定求出总氮量换算为蛋白质含量。
特点凯氏定氮法是目前分析有机化合物含氮量常用的方法,是测定试样中总有机氮最准确和最简单的方法之一,被国际国内作为法定的标准检验方法。
凯氏定氮法样品的最佳消化条件为硫酸铜2.50 g, 硫酸钾0.10 g,浓硫酸mL;硫酸铜的用量为影响消化时间的主要因素,硫酸钾和浓硫酸用量为第二和第三主要因素;用此最佳条件做实验, 消化时间仅为12 min;与其他硫酸铜、硫酸钾、浓硫酸用量方法对比,该法所需消化时间最短,试剂用量减少,可降低实验成本,也降低了对环境的污染。
生化综合实验报告--测定蛋白质含量的三种方法及其比较

若样品中含有大量吸收紫外线的物质,会出现较大的干扰。
5.实验数据处理方法
双缩脲法
试
剂
0
1
2
3
4
5
样品1
样品2
O.D540
0
0.021
0.052
0.160
0.316
0.345
0.08
0.029
标准蛋白质浓度(mg/ml)
0
1
2
3
4
5
X
Y
考马斯亮蓝染色法
试
剂
0
1
2
3
4
5
样品1
样品2
蛋白质浓度(ug/ml)
考马斯亮蓝染色法
标准曲线的制作
1取12支试管,按下表加入试剂
2混匀,室温静置3min,以第1管为空白,于波长595nm处比色,测定OD值,
以的OD值为纵坐标,各标准液浓度为横坐标作标准曲线。
未知样品蛋白质含量的测定
准确吸取0.5 ml所制备的蛋白质样品稀释液,加入3.0 ml考马斯亮蓝G-250试剂后,所有的操作完全与标准曲线相同,测定样品的OD值。平行两份。从标准曲线上查出其蛋白质浓度,再根据稀释倍数计算样品的蛋白质含量。
蛋白质测定标准

蛋白质测定标准
蛋白质测定是生物化学和分子生物学中常见的实验操作,用于确定样品中蛋白质的含量。
以下是常见的蛋白质测定标准:Lowry法:Lowry法是最常用的蛋白质定量方法之一,基于蛋白质与某些重铜络合物的相互作用产生的颜色变化。
该方法灵敏度高,适用于含有大量蛋白质的样品。
Bradford法:Bradford法利用考马斯亮蓝G-250与蛋白质之间的相互作用产生的颜色变化来测定蛋白质含量。
与Lowry法相比,Bradford法的操作更简单,但灵敏度略低。
Biuret法:Biuret法利用蛋白质与铜离子形成的络合物产生的紫色来测定蛋白质含量。
该方法比较粗略,适用于快速测定蛋白质含量。
BCA法:BCA(Bicinchoninic Acid)法是一种比较常用的蛋白质定量方法,利用蛋白质与铜离子和BCA试剂的反应产生的紫色螯合物来测定蛋白质含量。
光谱法:光谱法通过测量蛋白质在特定波长下的吸光度来确定其浓度。
UV-Vis分光光度计是常用的测量设备,通常在280 nm波长下进行测量。
荧光法:荧光法利用蛋白质在特定激发波长下发射荧光信号的特性来测定蛋白质含量。
例如,荧光素蛋白(fluorescamine)可与蛋白质中的氨基结合产生荧光,用于蛋白质的定量。
这些方法各有优缺点,选择合适的方法取决于样品的特性、实验条件以及所需的灵敏度和准确性。
通常,根据实验的具体要求和可用的设备,科学家可以选择最适合其实验目的的蛋白质测定方法。
1。
比较常用的几种蛋白质测定方法的优缺点

比较常用的几种蛋白质测定方法的优缺点引言蛋白质是生物体中重要的组成成分之一,也是许多生物学和生化学研究的重要对象。
因此,准确测定蛋白质的含量对于研究生物学和医学等领域具有重要意义。
随着科技的进步,出现了许多不同的蛋白质测定方法,每种方法都具有其独特的优缺点。
本文将对常用的几种蛋白质测定方法进行比较,探讨它们的优缺点。
1. Bradford法Bradford法是常用且经典的蛋白质测定方法之一。
该方法利用染料共价结合蛋白质,形成染色复合物。
该染色复合物与蛋白质浓度呈线性关系,可以通过比色测定来确定蛋白质的含量。
Bradford法具有简单、快速、操作方便的优点,可以测定低至微克级别的蛋白质含量。
然而,Bradford法对于某些化合物的干扰较为敏感,且结果受蛋白质组成的影响较大。
2. BCA法BCA法是一种基于铜离子和蛋白质的还原反应的蛋白质测定方法。
该方法通过还原剂将蛋白质中的两个或四个近似残基之间的硫键断裂,生成含有可溶性铜离子的蛋白质。
铜离子与特定染料在碱性条件下形成染色复合物,可通过光密度测定来确定蛋白质的含量。
BCA法具有灵敏度高、结果稳定、重复性好的优点,并且能够有效抵抗一些常见的干扰物质。
然而,BCA法对于某些还原剂和胶体含量较高的样品可能存在一定的干扰。
3. Lowry法Lowry法是一种经典的蛋白质测定方法,也是Bradford法的改进版。
该方法利用酸性条件下染料与蛋白质产生复合物,并在碱性条件下产生显色反应。
Lowry法具有较高的测定灵敏性和较宽的测定范围,能够测定低至纳克级别的蛋白质含量。
然而,Lowry法操作相对较为复杂,需要多个步骤,花费的时间较长。
此外,该方法对于一些离子存在较高的样品可能存在干扰。
4. UV吸收法UV吸收法是一种简单、快速的蛋白质测定方法。
该方法利用蛋白质中特定的氨基酸在紫外光区域的特定波长下吸收光线,可以测定蛋白质的含量。
UV吸收法具有操作简便、测定时间短、无需使用染料的优点,并且对于大多数蛋白质都适用。
测定蛋白质含量方法

测定蛋白质含量方法
1. 布里亚蛋白定量法:利用蛋白质与荧光素的发光作用。
首先将不同浓度的标准蛋白质与荧光素混合后测定发光强度,制作标准曲线。
然后将待测蛋白质与荧光素混合后测定发光强度,根据标准曲线计算出蛋白质的含量。
2. 低里德蛋白定量法:根据蛋白质中色氨酸、酪氨酸、苯丙氨酸等芳香族氨基酸的特定吸收波长进行测量。
直接或间接测定蛋白质的含量。
3. 比色法:利用蛋白质与染料中亲合基团之间的反应测定蛋白质含量。
如利用布拉德福德染料,将蛋白质溶液与染料反应后测定吸光度,根据标准曲线计算出蛋白质含量。
4. 尿素/巯基乙醇(Urea/ME)法:将蛋白质加入含有尿素和巯基乙醇的缓冲液,等待蛋白质的还原和解离,根据吸光度测定巯基乙醇的浓度,再根据巯基乙醇与蛋白质的比例计算出蛋白质的含量。
5. Kjeldahl法:是一种常用的蛋白质含量分析方法。
将样品加入强酸,使其分解出所有氮,然后用强碱滴定测定氮酸的含量,最后计算出样品中蛋白质的含量。
蛋白质定量方法的比较与优缺点分析

蛋白质定量方法的比较与优缺点分析蛋白质定量是生物学研究中非常重要的一项技术。
通过定量分析蛋白质,可以揭示许多生物学问题和生物化学反应机理。
但是,不同的蛋白定量方法有各自的优缺点,因此,选择适合的蛋白质定量方法是非常重要的。
下面,我们将分别介绍蛋白质定量的几种常见方法,并比较它们的优缺点。
1. Bradford法Bradford法是一种常用的蛋白质定量方法。
它是通过将一种特殊的染色剂Bradford与蛋白质结合,然后利用比色法来定量蛋白的含量。
Bradford法使用简单,快速,且具有较高的灵敏度。
但是,这种方法对于蛋白质的种类和质量要求较高,因此,在使用Bradford法进行蛋白质定量之前,需要进行标准曲线的制备和检测。
同时,Bradford法不太适用于含有一些干扰物质的样品。
2. BCA法BCA法是通过还原剂将蛋白质上的铜离子还原成铜离子,并在还原过程中与一种染色剂Bicinchoninic Acid(BCA)发生反应,然后根据比色法进行测定蛋白质含量的一种常见方法。
BCA法有较高的灵敏度,适用于不同种类的蛋白质。
但是,这种方法对于蛋白质的样品有较高的要求,同时也需要进行标准曲线的制备和测定。
3. Lowry法Lowry法是一种蛋白质定量的经典方法。
这种方法首先将蛋白质与碱式铜离子形成蛋白质和铜络合物,然后使用Folin-Ciocalteu试剂进行比色法测定蛋白质含量。
Lowry法在测定种类和样品方面都非常广泛。
但是,这种方法操作步骤较多,比较繁琐,同时与其他方法比较,这种方法的灵敏度较低。
4. UV-Vis吸收光谱定量法UV-Vis吸收光谱定量法是通过测定蛋白质在波长280nm处的吸收光谱,从而进行蛋白质定量的一种方法。
这种方法具有灵敏度较高,且对蛋白质的种类没有特殊要求的特点。
但是,这种方法只适用于含有色氨酸或苯丙氨酸等芳香族氨基酸的蛋白质。
在比较以上几种方法的优缺点后,我们可以得出结论:选择适合的蛋白质定量方法需要我们综合考虑所测蛋白质的种类和质量,实验室设备,操作步骤等因素。
测定蛋白质含量的方法有哪些

测定蛋白质含量的方法有哪些测定蛋白质含量是生物化学实验中常见的一项工作,目的在于确定给定样品中蛋白质的含量。
这样的测定对于许多领域的研究和应用都是至关重要的,包括分子生物学、生物医学研究、食品科学和营养学等。
蛋白质含量的测定方法根据原理和技术的不同可以分为多种类型,下面将详细介绍其中常用的方法。
1. 低里斯法(Lowry法):这是一种常用的测定蛋白质含量的光度法。
在这个方法中,样品中的蛋白质与Folin-Ciocalteu试剂中的碱性铜离子形成络合物,这些络合物在碱性条件下在750 nm附近吸收光线。
通过与蛋白质浓度相关的标准曲线进行比较,可以确定样品中蛋白质的含量。
2. BCA法(双异硫氰酸铜法):BCA法也是一种常用的光度法,它与低里斯法原理类似。
在这个方法中,蛋白质的还原性氨基酸(主要是赖氨酸、组氨酸和半胱氨酸)与BCA试剂中的铜离子反应生成紫色的络合物,这些络合物在560 nm 处吸收光线。
通过与蛋白质浓度相关的标准曲线进行比较,可以确定样品中蛋白质的含量。
3. 线性校正法(Coomassie蓝法):这也是一种常用的光度法。
在这个方法中,蛋白质与Coomassie Brilliant Blue G-250试剂反应生成蓝色络合物,这些络合物在595 nm处吸收光线。
通过与蛋白质浓度相关的标准曲线进行比较,可以确定样品中蛋白质的含量。
4. 尿素法:这是一种测定总蛋白质含量的化学方法。
在尿素法中,样品中的蛋白质与硝酸铜溶液反应生成紫色络合物,测定其吸光度从而计算蛋白质的含量。
5. Biuret法:这是一种经典的测定蛋白质含量的光度法。
这个方法利用了蛋白质中的肽键和某些氨基酸(特别是赖氨酸和组氨酸)与碱性铜离子形成紫色络合物的性质。
测定络合物的吸光度从而计算蛋白质的含量。
6. Kjeldahl法:这是一种测定总氮含量的化学方法,因为蛋白质中含有氮元素,所以可以通过测定氮含量来推算蛋白质的含量。
这个方法需要将样品中的蛋白质进行分解、提取和转化,最终测定氮含量,并换算为蛋白质含量。
简述四种测定蛋白质含量的方法及其原理

简述四种测定蛋白质含量的方法及其
原理
蛋白质是生命活动中不可缺少的重要物质,因此测定蛋白质含量对于生命科学研究和医学诊断等领域具有重要的意义。
目前,常用的测定蛋白质含量的方法有四种:浊度法、酶测定法、比色法和免疫测定法。
下面我们将简述这四种方法的原理和基本流程。
1.浊度法
浊度法是利用蛋白质的吸光度特性测定蛋白质含量的方法。
该方法的基本原理是,蛋白质具有较强的吸光性,在紫外到可见光谱范围内均有吸光度。
因此,在适当的光谱范围内测定样品的吸光度,就可以推算出蛋白质的含量。
浊度法的基本流程是:将样品加入溶剂,在适当的光谱范围内测定样品的吸光度,然后按照蛋白质吸光度与蛋白质浓度之间的关系计算出蛋白质的浓度。
2.酶测定法
酶测定法是利用蛋白质所含的氨基酸的特性测定蛋白质含量的方法。
该方法的基本原理是,蛋白质所含的氨基酸中有一类叫做可氧化氨基酸,如组氨酸、苯丙氨酸。
3.硫氰酸法:这种方法利用蛋白质中的硫氰酸氨基酸,将其与特定的试剂反应,产生的反应产物再与染料反应,通过测量吸收光的强度来测定蛋白质含量。
4.光度法:这种方法利用蛋白质与染料反应,产生的反应产物吸收特定波长的光,再通过测量吸收光的强度来测定蛋白质含量。
蛋白质各种定量方法的优缺点的比较

蛋白质各种定量方法的优缺点的比较1.蛋白质的常规检测方法1.1 凯氏(Kjeldahl)定氮法一种最经典的蛋白质检测方法。
原理:样品中含氮有机化合物与浓硫酸在催化剂作用下共热消化,含氮有机物分解产生氨,氨又与硫酸作用变成硫酸铵。
然后加碱蒸馏放出氨,氨用过量的硼酸溶液吸收,再用盐酸标准溶液滴定求出总氮量换算为蛋白质含量。
优点:范围广泛、测定结果准确、重现性好缺点:操作复杂费时、试剂消耗量大1.2 双缩脲法常用于需要快速但并不需要十分精确的蛋白质检测。
原理:双缩脲(NH3CONHCONH3)是 3 分子的脲经180℃左右加热,放出1分子氨后得到的产物。
在强碱性溶液中,双缩脲与硫酸铜形成紫色络合物(肽键中的氮原子和铜离子配价结合),称为双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,因此可用来测定蛋白质含量。
测定范围:1~10mg(有的文献记载为1~20mg)优点:较快速,干扰物质少,不同蛋白质产生的颜色深浅相近缺点:①灵敏度差;②三羟甲基氨基甲烷、一些氨基酸和EDTA等会干扰该反应。
1.3 Folin-酚试剂法原理:Folin-酚法的原理与双缩脲法大体相同,利用蛋白质中的肽键与铜结合产生双缩脲反应。
同时也由于Folin-酚试剂中的磷钼酸-磷钨酸试剂被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深蓝色的钼蓝和钨蓝的混合物。
在一定的条件下,蓝色深度与蛋白的量成正比,由此可测定蛋白质的含量。
测定范围:20~250ug优点:灵敏度高,对水溶性蛋白质含量的测定很有效缺点:①费时,要精确控制操作时间;②Folin -酚法试剂的配制比较繁琐,且酚类和柠檬酸、硫酸铵、Tris缓冲液、甘氨酸、糖类、甘油、还原剂(二硫代苏糖醇、巯基乙醇)、EDTA和脲素均会干扰反应。
1.4 紫外吸收法原理:蛋白质分子中的酪氨酸、苯丙氨酸和色氨酸残基使其在 280nm 处具有紫外吸收,其吸光度与蛋白质含量成正比)。
此外,蛋白质溶液在280nm的吸光度值与肽键含量成正比,利用一定波长下蛋白质溶液的吸光度值与蛋白质浓度的正比关系可以测定蛋白质含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质含量测定主要有五种方法,分别是凯式定氮法、双缩脲法、紫外吸收法、酚试剂法和考马斯亮蓝法。
这五种方法各有特点,优缺点明确。
凯氏定氮法
蛋白质是含氮的化合物。
食品与浓硫酸和催化剂共同加热消化,使蛋白质分解,产生的氨与硫酸结合生成硫酸铵,留在消化液中,然后加碱蒸馏使氨游离,用硼酸吸收后,再用盐酸标准溶液滴定,根据酸的消耗量来乘以蛋白质换算系数,即得蛋白质含量。
因为食品中除蛋白质外,还含有其它含氮物质,所以此蛋白质称为粗蛋白。
优点:重现性好,是目前分析有机化合物含氮量常用的方法,是一种蛋白质测定的经典方法, ,测试结果准确。
缺点:操作比较繁复,费时,试剂消耗量大。
且此法测定的蛋白质含量实际上包括了核酸,生物碱,含氮类脂,卟啉,含氮色素等非蛋白质含氮化合物。
双缩脲定氮法双缩脲(NH3CONHCONH 3)是两个分子脲经180 C左右加热,放出一个分子氨后得到的产物。
在强碱性溶液中,双缩脲与CuSO4 形成紫色络合物,称为双缩脲反应。
凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
测定范围为1~10mg 蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。
优点:较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点
是灵敏度差。
因此双缩脲法常用于需要快速,但并不需要十分精确的蛋
白质测定。
缺点:不太灵敏;不同蛋白质显色相似。
紫外吸收定氮法
双缩脲法是传统的分光光度法测定蛋白质的方法,当含有两个或者两个以上肽键的
物质和碱性的硫酸铜反应时,形成紫色的络合物,这个颜色产物是肽键中的氮原子和铜离子配价结合的结果。
蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。
形成颜色产物的量取决于蛋白质的浓度。
实际测定时,必须预先用标准蛋白质溶液制作一个标准校正曲线,通常用牛血清白蛋白水溶液做蛋白质标准溶液。
不同浓度的标准蛋白质溶液加入双缩脲试剂后,反应生成的颜色产物用紫外- 可见分光光度计在540nm 波长下测定吸光度,以双缩脲试剂加缓冲或水作空白对照。
然后将测得的值分别对蛋白浓度(mg/ ml) 作图,得标准曲线。
未知蛋白样品用双缩脲试剂做同样处理, 根据测得吸光度值在标准曲线上直接查得未知蛋白质样品中得蛋白质浓度。
优点:对各种蛋白质呈色基本相同;特异性和准确度好,精密度好;呈色稳定性好,试剂单一,方法简便。
快速,不消耗样品,测定后仍能回收使用。
缺点:准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。
故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。
若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。
核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。
但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。
此外,进行紫外吸收法测定时,由于蛋白质吸收高峰常因pH 的改变而有变化,因此要注意溶液
的pH 值,测定样品时的pH 要与测定标准曲线的pH 相一致
酚试剂法
此法的显色原理与双缩脲方法是相同的,只是加入了第二种试剂,即Folin —酚试剂,以增加显色量,从而提高了检测蛋白质的灵敏度。
这两种显色反应产生深蓝色的原
因是:在碱性条件下,蛋白质中的肽键与铜结合生成复合物。
Folin —酚试剂中的磷钼酸盐—磷钨酸盐被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深蓝色(钼兰和钨兰的混合物)。
在一定的条件下,蓝色深度与蛋白的量成正比。
优点:灵敏度高,比双缩脲法灵敏约100 倍。
操作简单,不需要特殊仪器设备。
缺点:费时间较长,要精确控制操作时间,标准曲线也不是严格的直线形式,且专一性较差,干扰物质较多。
对双缩脲反应发生干扰的离子,同样容易干扰Lowry 反应。
而且对后者的影响还要大得多。
酚类、柠檬酸、硫酸铵、Tris 缓冲液、甘氨酸、糖类、甘油等均有干扰作用。
浓度较低的尿素(0.5% ),硫酸纳(1% ),硝酸纳(1%),三氯乙酸(0.5% ),乙醇(5% ),乙醚(5% ),丙酮(0.5% )等溶液对显色无影响,但这些物质浓度高时,必须作校正曲线。
含硫酸铵的溶液,只须加浓碳酸钠—氢氧化钠溶液,即可显色测定。
若样品酸度较高,显色后会色浅,则必须提高碳酸钠—氢氧化钠溶液的浓度1~2 倍。
进行测定时,加F olin —酚试剂时要特别小心,因为该试剂仅在酸性pH 条件下稳定,但上述还原反应只在pH=10 的情况下发生,故当Folin 一酚试剂加到碱性的铜—蛋白质溶液中时,必须立即混匀,以便在磷钼酸—磷钨酸试剂被
破坏之前,还原反应即能发
考马斯亮蓝法
考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置(max ),由465nm变为595nm ,溶液的颜色也由棕黑色变为兰色。
经研究认为,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。
在595nm下测定的吸光度值A595,与蛋白质浓度成正比。
优点:灵敏度高,据估计比Lowry法约高四倍,其最低蛋白质检测量可达1乜。
这是因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高的消光系
数,因而光吸收值随蛋白质浓度的变化比Lowry法要大的多。
测定快速、简便,只需加一种试剂。
完成一个样品的测定,只需要5分钟左右。
由于染料与蛋白质结合的过程,大约只要2分钟即可完成,其颜色可以在1小时内保持稳定,且在5分钟至20分钟之间,颜色的稳定性最好。
因而完全不用像Lowry法那样费时和严格地控制时间。
干扰物质少。
如干扰Lowry法的K+、Na +、Mg2+离子、Tris缓冲液、糖和蔗糖、甘油、巯基乙醇、EDTA等均不干扰此测定法。
缺点:由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此Bradford法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用—球蛋白为标准蛋白质,以减少这方面的偏差。
仍有一些物质干扰此法的测定,主要的干扰物质有:去污剂、
Triton X-100、十二烷基硫酸钠(SDS)和0.1N
的NaOH。
(如同0.1N的酸干扰Lowary法一样。
)标准曲线也有轻微的非线性,因而不能用Beer定律进行计算,而只能用标准曲线来测定未知蛋白质的浓度。
应用范围
凯氏定氮法
适用样品广泛是国家标准第一法。
适合于各种食品中蛋白质的测定以及各
类动植物蛋白测定。
适用于0.2~ I.Omg氮,误差为-2% 双缩脲定氮法适用于1〜20mg氮。
紫外吸收定氮法
适用于柱层析洗脱液的快速连续检测,因为此时只需测定蛋白质浓度的变化, 而不需知道其绝对值。
适用于50〜100切氮。
酚试剂法
可检测的最低蛋白质量达5弋。
通常测定范围是20~250 J g。
考马斯亮蓝法
适用于1〜5七氮。
生物15-3班彭师韬150501330。
