临沂大学2014—2015学年第二学期
2014-2015学年第二学期期末考试安排

时间课程班级教室药学方向1-2、(重修)药学方向3-4药学方向5-6药理方向1-2-312-1314-1516-17-1819-20、(重修)21-2223-2425-26-27中药药理方向28-2930-3132\89食品添加剂33-34药物经济学35-36药剂学37-38\8845-4647-48-49中药制药方向1-2中药制药方向3-41.学校要求必修课考试需安排在考试周内考试,如有特殊情况需提前考试,可由院部系出具书面申请,经教务处审核通过。
2.请各院部仔细核对考试课程和班级,如有疑问请在4月20日前和教务科联系,20日后教务科将安排重修和教室。
3.同一门课有不同考卷,需安排不同教室,请提前说明。
谢谢工程制图2014-2015学年2012级(11级5年制)第二学期期末考试安排临床医学概论生物药剂与药代动力学细胞与分子生物学制药工程自动化中药炮制学6月30日上午中药分析方向1-2中药分析方向3-459-60药用植物栽培学61-62-63国际税收64-65-6667-68-6970-7172-73经济思想史74-75现代社会调查方法76-77药厂三废处理8212英语药学方向01-0312语言文学方向01-02药物不良反应与药物警戒11535-11536药学方向1-2、(重修)药学方向3-4药学方向5-6药理方向1-2-316-17-1819-2021-2223-2425-2627-2829-3031-32\88-8912-13药物光谱分析与解析微生物学国际市场营销管理信息系统笔 译(二)中药炮制学日上午月14-15食品微生物学33-34医学遗传学35-36、(重修)现代药学Ⅱ(药物质量控制)37-3839-40、(重修)43-4445-4647-48-4959-60、(重修)中药制药方向1-2中药制药方向3-4中药分析方向1-2、(重修)中药分析方向3-4药用植物生物技术61-62-63、(重修)外贸英语精读64-65-66、(重修)67-68-6976-7770-7172-73环境工程基础8212英语药学方向01-0312语言文学方向01-02临床药物治疗学11535-115361-2、(重修)药学方向1-2药学方向3-4药学方向5-6药理方向1-2-312-13中国药事法规中药显微鉴定市场营销学药物光谱分析与解析药物化学高级英语(二)生物制药工艺学中药制药工艺设备与应用7月2日上午14-1516-17-1828-2930-31-3235-36现代食品安全控制技术33-3439-40、(重修)海洋药物化学41-4243-4445-4647-4849\90药品工业化生产技术8919-2021-2223-2425-2627\88中药制药方向1-2中药制药方向3-459-60(重修)药物代谢动力学中药药理方向1中药分析方向1-2中药分析方向3-4世界经济概论64-65-6667-68-6970-7172-73经济史74-75消费行为学仪器分析免疫学药用高分子材料药物化学7月4日上午生物制药设备运筹学(下)行政法76-77环境微生物学8278-7980-81药学英语(二)12英语药学方向01-03英美文学选读(二)12语言文学方向01-02临床药代动力学11535-115361-2、(重修)药学方向1-2药学方向3-4药学方向5-6药理方向1-2-312-1314-1519-20\(重修)21-2223-2425-26-27食品分析33-34内科学35-36、(重修)39-40、(重修)41-4243-4445-4647-4849/90中药制药方向1-2中药制药方向3-4中药药理方向1中药制剂学药物分析遗传学药学英语(二)发酵工艺原理药物色谱分析7月6日上午中药分析方向1-2中药分析方向3-459-6061-62-63外贸运输与保险64-65-66、(重修)67-68-6970-7172-73证券投资74-75药品质量管理(GXP)76-7778-7980-81环境影响评价82GMP标准88-89-9012英语药学方向01-0312语言文学方向01-02医院药学11535-11536时间课程1-228-2930-3132/89药学方向1-2、(重修)药学方向3-4药学方向5-6药理方向1-2-312-1314-1535-36中药制剂学天然药物化学生药学医药商品学电子商务项目管理高级写作(一)6日上午食品毒理学33-34、(重修)19-20、(重修)21-2223-2425-26-2716-1718\82抗生素39-40海洋药用生物资源学41-42生物工程43-4445-4647-4849/90药物制剂工程学/88中药制药方向1-2中药制药方向3-4中药药理方向1、(重修)中药分析方向1-2中药分析方向3-459-6061-6263/6768-69外贸英文函电64-65-66、(重修)70-7172-7374-75人力资源管理学76-7778-7980-81专业外语7月8日上午化工原理工业药剂学市场调查与预测免疫学技术计算机网络12英语药学方向01-0312语言文学方向01-02医院药事法规与GCP 11535-11536药学方向1-2药学方向3-4药学方向5-6药理方向1-2-312-1314-1516-17-1819-2021-2223-2425-26-2735-3637-3839-4041-42中药制药方向1-2中药制药方向3-4中药药理方向1中药分析方向1-2中药分析方向3-461-62-63重修制剂工艺与设计/88制药工程技术概论/89食品环境学33-341-2、(重修)43-4445-46高级听力(一)药理学分子生物学制药生物技术7月10日上午47-4849/9067-68-69财政学74-7578-7980-81生物制药8212英语药学方向01-0312语言文学方向01-02妇科学11535-11536时间课程班级教室1-212-1314-1528-2930-31-32化工原理(下)88-89-90动植物检验检疫33-34财务管理67-68-69生理药理12英语药学方向01-03日语(三)、法语(三)12语言文学方向01-02医患沟通技巧11535-11536化工原理(上)口译(二)Java程序设计组织行为学制药生物技术药事法规7月4日下午。
2014—2015学年第二学期期末考试安排 .doc

青岛大学教务处〔2011〕10 号青岛大学2011年春季学期开学初教学工作安排意见一、上学期期末考试情况总结二、开学准备工作三、上学期成绩归档、考试试卷检查整理和补考等工作四、2011届毕业生工作五、教师信息维护工作六、实践教学工作七、语言文字工作一、上学期期末考试情况总结上学期期末考试共安排3354个考场,共有132948人次本专科生参加了考试。
学校高度重视考试环节的工作,利用多渠道齐抓共管考风考纪。
校领导、督学、教务处和各学院(教学部)相关人员组成各种考试巡视组,巡视时间涵盖整个考试过程,巡视范围涉及全校各校区、各考场。
对于发现的问题,各教学单位均能做到及时发现、及时处理,各学院均对考试违纪作弊的学生做出了快速、严肃处理,并将学院处理决定及时报送教务处。
教务处编发了8期考试情况通报,及时向全校通报存在的问题和各学院的处理决定,并提出改进考试工作的意见。
本次考试,共有27名学生受到留校察看处分、1名学生受到严重警告处分,受处分学生占全日制本专科学生总数的0.09%。
二、开学准备工作2011年春季学期教学安排总周数为20周,其中课程教学18周,期末复习考试2周,2011年7月18日至8月26日为暑假(共6周)。
2011年2月26日(星期六)和2月27日(星期日)学生报到注册,2月28日(星期一)正式上课;5月12日(星期四)和13日(星期五)召开学校春季运动会;2011届毕业生教学安排总周数为16周,应于2011年6月18日前结束所有教学、考试、答辩等工作。
请各教学单位据此安排好各教学环节进度。
(一)课表审核与调整各教学单位应再次对本学期课表进行全面认真核查,若发现问题须在2月27日下午17:00之前在调课管理模块发布。
各教学单位的日常调停课信息务必在调课管理模块发布,若未发布,一经查实将按教学事故处理。
本学期课表第三周不再调整,学生评教前为确保评价学生与教师的一致性,个别课程可进行微调,具体时间另行通知。
关于2014-2015学年第二学期期末考试的

关于2014-2015学年第二学期期末考试的工作安排各教学单位:为做好我校2014-2015学年第二学期本、专科学生的期末考试工作,现将有关事宜安排如下:一、公共考试课课程:2014级(一年级):本科:《大学英语》、《中国近现代史纲要》、《马克思主义基本原理》专科:《大学英语》、《毛泽东思想和中国特色社会主义理论体系》、《心理学》2013级(二年级):本科:《大学英语》、《教育学》专科:《大学英语》专业课考试课程由各学院按照人才培养方案决定。
专业课和公修课考试课程原则上不少于5门。
考查课在第16周进行,2015年6月22日—6月26日考查结束(包括全校公选课)。
二、考试时间:2015年6月29日—7月3日(上午8:30—10:20, 下午3:00—4:50)。
本学期双学位学生期末考试时间安排在6月20日-6月21日进行,由相关承担单位安排。
本学期重修课程随期末考试同时进行,如需集中安排,请安排在2015年6月27日-6月28日(或由课程承担单位根据需要择期安排)。
公共课承担单位需提前将重修课程考试安排通知各学院(包括教务处),以便各单位准确统计考试人数。
三、考试相关材料送交时间:各学院专业课考试时间、试卷登记表和试卷审查表请于6月19日前将电子版与纸质版交教务科,考试试卷模版在教务处网页中下载(今年考试试卷模版暂不做更改,仍采用之前版本)。
请各单位于6月5日前将公共考试课试卷印刷数量统计表交教务科。
各科考试试卷由各学院与平原路校区文印室联系印刷。
四、试卷评阅与成绩登录时间:各学院(部)要成立试卷评阅领导组,各门课程要成立2-3人的阅卷小组,继续实行在办公室集体阅卷的制度。
试卷评阅要认真,要严格按学校考试工作管理规程的要求执行。
各学院(部)老师务必于2015年7月4日-7月14日期间通过教务管理系统完成考试成绩的网上登录。
五、公共课试卷领取与送交安排:本学期公共考试课试卷仍采取由文印室负责印刷、装订并按各学院考场安排进行密封,试卷印刷完毕后交由课程承担单位保管。
临沂大学教务处

临沂大学教务处临大教字〔2015〕12号关于进一步加强通识选修课建设的通知各学院:通识选修课程是我校高素质应用型人才培养课程体系的重要组成部分,在促进大学生创新创业能力、综合素质提升等方面发挥着重要作用,为进一步加强我校通识选修课程建设,现就有关事宜通知如下:一、基本思路和主要目标(一)基本思路坚持以学生综合素质与创新创业能力培养为出发点,践行“创新创业”教育理念,进一步加大通识选修课程建设力度,建立能够引导学生广泛涉猎不同学科领域知识,拓宽视野,优化学生知识结构,提升人文素养与科学素质,促进学生全面发展的素质教育课程体系,进一步完善通识选修课程建设、更新和淘汰机制。
(二)主要目标我校通识选修课程分为七类,分别是自然科学类、体育健康类、人文社科类、教师教育类、计算机提高类、艺术教育类、外国语言文化类。
拟建设200门通识选修课程,每一类别拟立项建设3-5门核心课程。
二、申报条件(一)开课资格1.课程负责人应具有讲师及以上职称;对申请开设的课程有较深入的理解与研究,具有相近课程的讲授经验。
2.本学期(2014-2015-2)已开出的通识任选课程原则上滚动开出,此类课程只需在附件1备注栏确认后报送教务处即可,不需要另外提报材料。
对授课地点、课程开设次数等有特殊需求的,请在备注栏注明。
(二)开课要求1.申报教师要明确课程开设目的,科学设定授课内容,确定课程所属类别。
2.课程学时、学分。
每门课程的学时数原则上不超过32学时(2学分)。
3.符合学校通识选修课程管理办法相关要求,并能够于2015-2016学年第一学期开出的课程,由课程负责人将申报书(附件2)、课程教学大纲、教学实施方案、等材料提报所在学院,学院初评通过后将有关材料报送教务处。
三、课程评审(一)学院初评学院组织专家对本单位新申报教师的授课资格、课程内容、教学准备、教学材料等方面进行严格审查。
机关单位人员申报材料报相关学院进行评审。
以学院为单位于2015年5月25日下午5点前将课程申报书、教学大纲、教学方案、汇总表,以及开出课程确认表一同报送教务处,电子版发至jwc@,逾期不再受理。
2014~2015学年度第二学期期末补(缓)考工作安排

2014~2015学年度第二学期期末补(缓)考工作安排校内各教学单位:现就我校2014-2015学年度第二学期期末补(缓)考工作安排通知如下。
请各单位根据本通知精神安排好相关工作。
一、本学期学生2015年9月6日返校报到,9月7日正式上课。
二、对所有专接本、专科学生安排补考和缓考;对所有本科学生实行学分制管理,不及格课程须重修,缓考课程随本学期补(缓)安排进行。
需要重修课程的修读方式按照《唐山师范学院本科生课程重修实施办法(试行)》(可在教务处主页规章制度栏中查询)施行。
三、补(缓)考:(一)补考和缓考工作严格按照《考试工作规范》进行,考试的实施由教务处统一负责。
请各系院分别将补考和已办理缓考手续学生的汇总名单的电子版报教务处教务科王悦老师(基本格式见附件一)。
(二)2014—2015学年度第二学期期末补(缓)考定于2015年9月19—20日(周六、周日)进行,考试地点统一安排到大学道校区南院3号楼、6号楼阶梯教室(1-8阶梯),每天安排5场(包括重修课程的缓考)。
第一场:8:00—10:00,第二场:10:10—12:10第三场:14:00—16:00,第四场:16:10—18:10第五场:19:00—21:00(三)课程补(缓)考时间、地点安排1.公共课补(缓)考时间安排如下:9月19日8:00—10:00:毛泽东思想和中国特色社会主义理论体系概论(14专科)马克思主义基本原理(14本科)9月19日10:10—12:10:大学英语二(14专科)(14专接本)(14本)大学英语四(13本科)9月19日14:00—16:00:现代教育技术基础(13本科)9月20日8:00—10:00:(候补)9月20日10:10—12:10:(候补)9月20日14:00—16:00:(候补)参加公共体育课补(缓)考的学生,于9月22日(周二)下午15:30-17:30参加考试。
大学道校区的学生考试地点设在南院田径场,学院路校区的学生考试地点设在学院路校区田径场,逾期不候。
临沂大学外国语学院度第二学期期末考试组织方案.doc

临沂大学外国语学院2013-2014学年度第二学期期末考试组织方案一、基本情况根据本学期教学安排,我院期末考试安排在2014年6月30日至2014年7月11日进行,2011级本科、2012级本专科和2013级本专科及2012、2013级本科双学位等共7个不同层次年级的学生参加考试,参加考试学生人数1700多人;考试门数达到93门,51个班级,监考教师人数多达百余人。
二、指导原则及组织分工本次期末考试时间紧、任务重,为确保本次考试工作的顺利进行和万无一失,需采取“统一调度、分工协作、责任到人”的原则进行,根据工作需要,成立了学院考试领导小组,考试领导小组下设考务办公室。
教学科研办公室、行政办公室、团学办公室、各教研室等相关人员相互协作,共同完成此项工作。
1、考试领导小组组长:副组长:成员:2、考务办公室主任:考务:3、试卷保密:4、巡视组:组长:副组长:成员:5、专业考试工作小组:组长:成员:6、大学英语考试工作小组:组长:成员:7、主要工作职责:(1)考试领导小组对参与考试的所有人员实施领导。
(2)考务办公室负责考试工作各项相关事宜,负责监考教师的调度及考场监考安排,考场准备、教师考前培训,负责整个考试过程的组织。
(3)保密员负责试卷保密工作,教学办公室负责试卷的接送,各种材料的整理及回收。
(4)团学、辅导员负责考试前学生考风考纪的宣传教育。
(5)巡视人员负责对本院考点考试工作的检查和督导。
(6)专业考试工作小组对专业外语、大学英语考试工作小组对大学英语考试相关工作负责。
三、考试组织1、考前教育考试前,组织全体监考师认真学习临沂师范学院有关考试规定和外国语学院监考行为规范;组织学生学习《临沂大学外国语学院考场规则》。
充分发挥团学及辅导员队伍的作用,加大宣传力度,强化诚信教育,确保全体师生明确要求,遵守考纪,保证考试、考核工作的顺利进行。
考试期间,学院一律不得安排影响考试工作的会议或其它活动。
凡有考试工作任务者,必须坚守工作岗位,恪尽职守,不得自行找人代替工作,不得请假、迟到或早退。
第二学期考试安排

2014~2015学年第二学期一年级(14级)考试日程表(渭水校区)
表1
2014~2015学年第二学期一年级(14级)考试日程表(渭水校区)
表2
2014~2015学年第二学期一年级(14级)考试日程表(渭水校区)
3
表4
2014~2015学年第二学期一年级(14级)考试日程表(渭水校区)
5
2014~2015学年第二学期一年级(14级)考试日程表(渭水校区)
2014~2015学年第二学期一年级(14级)考试日程表(渭水校区)
7
表8
2014~2014学年第二学期一年级(14级)考试日程表(渭水校区)
2014~2015学年第二学期二年级(13级)考试日程表(渭水校区)
表11 2014~2015学年第二学期二年级(13级)考试日程表(渭水校区)表12
2014~2015学年第二学期年级(13级)考试日程表(渭水校区)表13
2014~2015学年第二学期年级(13级)考试日程表(渭水校区)
2014~2015学年第二学期二年级(13级)考试日程表(渭水校区)
2014~2015学年第二学期二年级(13级)考试日程表(渭水校区)
表17
2014~2015学年第二学期二年级(13级)考试日程表(渭水校区)
2014~2015学年第二学期三年级(12级)考试日程表(渭水校区)
2014~2015学年第二学期三年级(12级)考试日程表(渭水校区)
表21
2014~2015学年第二学期三年级(12级)考试日程表(渭水校区)
2014~2015学年第二学期三年级(12级)考试日程表(渭水校区)。
2014—2015学年第二学期期末考试安排

2014—2015学年第二学期期末考试安排一、2014—2015学年第二学期期末考试安排在17—18周(7月3日—7月8日)二、监考教师必须提前二十分钟到教务处领取试卷;检查学生证件;按照学号顺序安排学生,不得由学生随意就坐。
认真填写《考场情况报告单》,并随试卷交回教务处。
三、监考教师必须严格考场纪律,要求学生将书包、书籍、笔记、手机和其它与考试有关的资料集中放到教室前面的指定位置,严禁考生座位周围有与考试内容有关的文字资料等。
若开考发现学生带有手机,一律按作弊处理。
教务处2015年6月30日专业班级人数考场7月6日(星期一)10:40—12:402013采矿(本)34 阶—104 大学英语(四)2013工业设计(本)22 阶—101 大学英语(四)2013机械(本)34 阶—101 大学英语(四)2013土木(本)31 阶—106 大学英语(四)2013自动化(本)32 阶—106 大学英语(四)2013电气(本)35 阶—105 大学英语(四)2013计算机(本)32 阶—105 大学英语(四)2013测绘(本)36 阶—103 大学英语(四)2013国贸(本)33 阶—102 大学英语(四)2013会计(本)34 阶—102 大学英语(四)注:1、参加考试的学生进入考场须携带有效证件(身份证或学生证);无证者不得参加考试;不准把任何书籍讲义、笔记本及通讯工具等带入考场;严禁任何形式的作弊行为。
2、考生须带2B铅笔和橡皮,填涂答题卡。
教务处2015年6月30日专业班级考场7月3日(星期五)8:00—10:002013采矿(本)阶—202 《材料力学》2013土木(本)阶—202 《材料力学》2013工业设计(本)主—101 《材料力学》2013机械(本)主—110 《材料力学》2014深加工1 (专科) 阶—101 《工程制图》2014深加工2 (专科) 阶—101 《工程制图》2014煤矿开采 (专科) 阶—401 《工程制图》2014通风 (专科) 阶—401 《工程制图》2014供用电 (专科) 阶—302 《工程制图》2014电气1 (专科) 阶—103 《工程制图》2014电气2 (专科) 阶—304 《工程制图》2014电气3 (专科) 阶—406 《工程制图》2014电气4 (专科) 阶—406 《工程制图》2013专科非机电类(重修)阶—303 《工程制图》注:参加考试的学生进入考场须携带有效证件;无证者不得参加考试;不准把任何书籍讲义、笔记本及通讯工具等带入考场;严禁任何形式的作弊行为。
2014—2015学年度下学期期末考试秩序册

说明:
1、各班级考场安排要求单人单桌单行,桌洞朝前,桌面不留任何物品,做到一场一清理,保持考场干净卫生,排列整齐。
2、监考教师请于每场考试前10分钟到教导处领取试卷,到达考场组织考试,避免拖延分发和提前收卷情况发生。
3、第一场2013、2014级各班15:00—17:00考试《语文》;2015级各班15:30—17:00考试《语文》。
未开考的班级(底纹标注)由安排的监考老师靠班组织复习待考。
4、第二场13级餐饮、旅游、会计、商贸、种植、建筑、计算机专业14级商贸、种植、建筑、旅游、计算机专业8:10—10:10考试《专业一》;13机械、汽车、电力电子、化工专业;14级机械、汽车、电子、机电一体化、餐饮、化工、财经专业及15级各班9:10—10:10考试《专业一》,未开考的班级(底纹标注)由安排的监考老师靠班组织复习待考。
5、考试结束后请尽快阅卷,各班主任将本班考试成绩汇总后报级部主任。
6、无监考任务的老师,随时接受教导处临时工作安排。
临沂大学2014年本科质量报告

临沂大学2014年本科教学质量报告临沂大学二〇一五年六月目录概述 (1)第一部分定位与目标 (2)一、办学定位 (2)(一)学校办学方向、办学定位 (2)(二)办学定位在学校发展规划中的体现 (2)二、培养目标 (2)(一)学校人才培养总目标及确定依据 (2)(二)专业培养目标、标准及确定依据 (2)三、教学中心地位落实情况 (2)(一)学校领导对本科教学的重视情况 (2)(二)落实学校人才培养中心地位的政策与措施 (3)(三)教学中心地位的体现与效果 (3)(四)科学研究、社会服务、文化传承创新促进人才培养措施与成效.4第二部分师资队伍 (5)一、数量与结构 (5)(一)教师队伍的数量与结构 (5)(二)教师队伍建设规划及发展态势 (5)二、教育教学水平 (6)(一)专任教师的专业水平与教学能力 (6)(二)学校师德师风建设措施与效果 (6)三、教师教学投入 (6)(一)教授、副教授为本科生上课情况 (6)(二)教师开展教学研究、参与教学改革与建设情况 (7)四、教师发展与服务 (7)(一)提升教师教学能力和专业水平的政策措施 (7)(二)服务教师职业生涯发展的政策措施 (7)(三)专业带头人和中青年骨干教师队伍建设的措施与效果 (8)第三部分教学资源 (9)一、教学经费投入 (9)(一)教学经费投入及保障机制 (9)(二)学校教学经费年度变化情况 (9)(三)教学经费分配方式、比例及使用效益 (9)二、教学设施 (10)(一)教学设施满足教学需要情况 (10)(二)教学、科研设施的开放程度及使用效益 (10)(三)教学信息化条件及资源建设 (11)三、专业设置与培养方案 (11)(一)专业建设规划与执行 (11)(二)专业设置与结构调整 (11)(三)优势专业与新建专业情况 (12)(四)培养方案的制定、执行与调整 (13)四、课程资源 (13)(一)课程建设规划与执行情况 (13)(二)课程的数量、结构及优质课程资源建设 (14)(三)教材建设与选用 (14)五、社会资源 (14)(一)合作办学、合作育人的措施与效果 (14)(二)共建教学资源 (15)(三)社会捐赠 (15)第四部分人才培养过程 (16)一、教学改革 (16)(一)总体思路与政策措施 (16)(二)扎实推进人才培养模式和培养体制、机制改革 (16)(三)教学及教学管理信息化 (17)(四)教学改革成果及推广应用 (17)二、课堂教学 (18)(一)课程教学大纲制定与执行 (18)(二)科研成果转化为教学内容 (19)(三)教师教学方法、学生学习方式 (19)(四)考试考核方式方法及管理 (19)三、实践教学 (20)(一)实践教学体系的构建 (20)(二)实践教学内容和教学方法的更新 (21)(三)校企合作、联合开展实习实训 (21)(四)实验室开放 (21)(五)毕业论文(设计)及专业综合训练 (21)四、第二课堂 (21)(一)第二课堂育人体系建设与措施 (21)(二)社团建设与校园文化、科技活动 (22)(三)外出访学 (22)第五部分学生发展 (23)一、招生及生源情况 (23)(一)学校总体生源状况 (23)(二)各专业生源数量及特征 (23)(三)提高生源质量的措施及成效 (23)二、学生指导与服务 (23)(一)学生指导与服务的内容及效果 (23)(二)学生指导与服务的组织与条件保障 (25)(三)学生对指导与服务的评价 (25)三、学风与学习效果 (25)(一)学风建设的措施与成效 (25)(二)学生学业成绩及综合素质表现 (26)(三)学生对自我学习与成长的满意度 (26)四、就业与发展 (26)(一)毕业生就业率与职业发展情况 (26)(二)毕业生创业情况 (26)(三)用人单位对毕业生评价 (27)第六部分质量保障 (28)一、教育质量保障体系 (28)(一)质量标准建设 (28)(二)质量保障体系模式及体系结构 (28)(三)组织建设与制度建设 (28)(四)管理队伍建设 (29)二、质量监测 (29)(一)自我评估及质量监控的内容与方式 (29)(二)自我质量监测与评估实施的效果 (30)三、质量信息及利用 (30)(一)数据库监测系统建设 (30)(二)质量信息统计、分析、反馈机制 (30)(三)质量信息公开及年度质量报告 (30)四、质量改进 (30)(一)质量改进的途径与方法 (30)(二)质量改进的效果与评价 (30)第七部分特色项目 (32)一、坚持立德树人,强化地方特色文化对人才培养的滋养效应 (32)二、创新人才培养机制,实行校地、校校、校企协同育人 (32)第八部分存在的问题及整改情况 (33)一、需要进一步提高师资队伍水平 (33)二、需要进一步加强学科专业建设 (33)三、需要进一步密切师生关系,促进教学相长 (33)概述临沂大学是山东省政府直属管理的综合性大学,也是沂蒙革命老区唯一一所本科高校。
2014-2015学年度第二学期期末考试安排
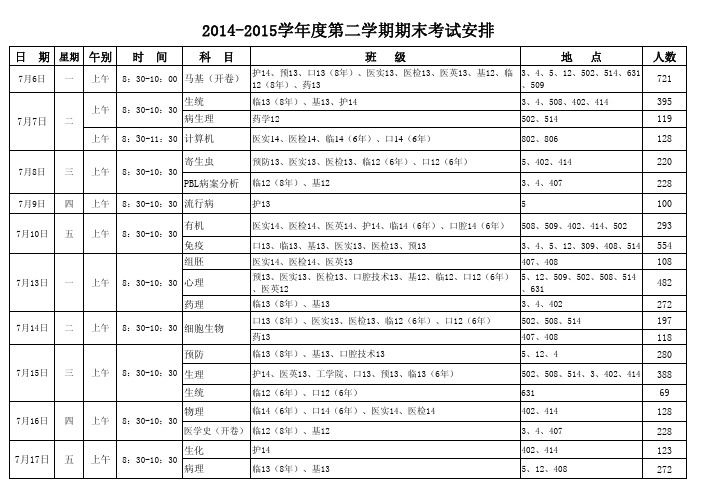
日 期星期午别时 间科 目班 级地 点人数生统临13(8年)、基13、护143、4、508、402、414395病生理药学12502、514119上午8:30-11:30计算机医实14、医检14、临14(6年)、口14(6年)802、806128寄生虫预防13、医实13、医检13、临12(6年)、口12(6年)5、402、414 220PBL病案分析临12(8年)、基123、4、4072287月9日四上午8:30-10:30流行病护135100有机医实14、医检14、医英14、护14、临14(6年)、口腔14(6年)508、509、402、414、502293免疫口13、临13、基13、医实13、医检13、预133、4、5、12、309、408、514554组胚医实14、医检14、医英13407、408108心理预13、医实13、医检13、口腔技术13、基12、临12、口12(6年)、医英125、12、509、502、508、514、631482药理临13(8年)、基133、4、402272口13(8年)、医实13、医检13、临12(6年)、口12(6年)502、508、514197药13407、408118预防临13(8年)、基13、口腔技术135、12、4280生理护14、医英13、工学院、口13、预13、临13(6年)502、508、514、3、402、414388生统临12(6年)、口12(6年)63169物理临14(6年)、口14(6年)、医实14、医检14402、414128医学史(开卷)临12(8年)、基123、4、407228生化护14402、414123病理临13(8年)、基135、12、408272细胞生物2014-2015学年度第二学期期末考试安排7月6日一上午8:30-10:00马基(开卷)护14、预13、口13(8年)、医实13、医检13、医英13、基12、临12(8年)、药133、4、5、12、502、514、631、5097217月8日三上午8:30-10:307月7日二上午8:30-10:307月13日一上午8:30-10:307月10日五上午8:30-10:307月15日三上午8:30-10:307月14日二上午8:30-10:307月16日四上午8:30-10:307月17日五上午8:30-10:30注1:各班具体考试教室由各系、室按教室容纳人数隔两个座位安排,并通知到各班。
20142015学年第二学期补考∕重修考试安排(院系部)

2014/2015学年第二学期补考∕重修考试安排(院系部)各教学院、系、部:根据学校本学期教学安排,定于2015年3月14—19日期间进行补考∕重考。
具体安排如下:一、考试课程的安排:考试时间为3月14日—19日。
各门考试课程的考试时间安排见下列附表。
具体考试时间、考试地点详见教务处网站—下载中心—考试工作“14-15-2补考∕重考考场安排1—19”;学生补考名单见“教务处网站—下载中心—考试工作”。
各门课程的考试形式请在3月9日下午向学生公布,二、由开课院、系、部负责组织的考试,请各相关院、系、部将考试安排在3月9日下午向学生公布,在3月20日前结束。
三、缓考学生的考试安排,与其他补考学生安排在一起,各院、系、部在填写“试题袋”时,不要漏填考试地点和份数。
四、交“试题袋”安排:1.请以院系(部)为单位在3月9日上午10:00前交到校部110办公室,同时履行签字手续。
2.因试卷印刷时间紧张,所以请各院、系、部按照教务处要求,及时将“试题袋”在规定的时间内交到教务处或印刷厂。
为提高收卷效率,请院、系、部交卷人将“试题袋”按照考试时间及各时间段的年级顺序整理后再上交。
请各院、系、部务必注意不要漏交命题,也不要将考题答案封在“试题袋”中。
五、大学英语课程有听力。
英语听力放音时间安排:大学英语(一)3月14日上午10:10开始大学英语(三)3月15日下午13:10开始六、试卷领取时间:3月16上午8:30—11:00以院、系、部为单位到教学C207办公室领取。
七、成绩单报送时间:试卷领取后的3天内。
八、“补考∕重考”工作量,用“万用表”一式1份(人事代理、集体、外聘三份),按照工资卡序号做表,不写名头,在3月23日前报到教务处。
九、监考教师及通勤车安排:见“教务处网站—下载中心—考试工作”。
教务处2015年3月7日附表:2014/2015学年第二学期补考∕重考安排2014/2015学年第二学期补考∕重考安排2014/2015学年第二学期补考∕重考安排2014/2015学年第二学期补考∕重考安排2014/2015学年第二学期补考∕重考安排。
2014——2015学年度第二学期期末考试 打印

2014——2015学年度第二学期期末考试一、1. 笼罩奢侈冶炼奥秘啄食降临凋零间隔 2.窥kuī视遐xiá想堤dī岸战车千乘shèn g 鸟瞰kàn 贷dài款跛bǒ脚千里迢迢tiáo√3. 调整调节调动调离音调凋零凋落凋谢稠密浓稠粘稠稀稠jǐng颈部头颈交颈gěng脖颈预备预先语言预告jìn干劲有劲冲劲jìng劲风劲草劲旅强劲掏钱掏枪掏心掏出掏宝掏底淘气淘米淘金淘货淘宝陶器陶瓷陶罐彩陶陶瓦陶土陶泥 4.(1)试验证实(2)推测(3)检测 5. 照样子写词语(1)恋恋不舍琅琅上口依依不舍斤斤计较落落大方头头是道闷闷不乐泱泱不乐井井有条格格不入孜孜不倦(2)三心二意三长两短五颜六色五光十色五湖四海五花八门一唱一和一呼百应一干二净一举两得一清二白一落千丈一模一样一暴十寒十全十美一心一意七手八脚七嘴八舌七零八落七上八下九死一生九牛一毛九牛二虎之力千头万绪百发百中(3)东奔西走古为今用大同小异苦尽甘来冷嘲热讽今非昔比(4)龙飞凤舞马到成功猴年马月放虎归山画龙点睛画蛇添足万马奔腾亡羊补牢闻鸡起舞抱头鼠窜小试牛刀龙腾虎跃车水马龙胆小如鼠气壮如牛藏龙卧虎守株待兔望子成龙打草惊蛇千军万马顺手牵羊杀鸡吓猴呆若木鸡狗急跳墙狼吞虎咽狼心狗肺6.崇山峻岭若隐若现(若有若无)名不虚传欣喜若狂神清气爽五彩缤纷行走在秦岭的崇山峻岭之间,远处山间若隐若现的云雾笼罩当中,时而露出些五彩缤纷的野花杂树,令人观之神清气爽。
这山间的美景真是名不虚传,不由得人欣喜若狂。
(言之有理即可)7. (1)荷花满池塘还来就菊花(2)西出阳关无故人莫愁前路无知己,天下谁人不识君。
海内存知己,天涯若比邻。
桃花潭水深千尺,不及汪伦送我情。
江南无所有,聊赠一枝春。
孤帆远影碧空尽,唯见长江天际流。
春草明年绿,王孙归不归?洛阳亲友如相问,一片冰心在玉壶。
(言之有理即可)(3)不知细叶谁裁出,二月春风似剪刀。
2014-2015学年校历

31 7 14 21 28 5 12 19 26 2 9 16 23 30 7 14 21 28 4 11 18 25
28 1 2 3 10 17 24 31 1 6 7 14 21 28 5 12 19 26 2 9 16 23 30 1 2 9 16 3 10 17 4 11 18 5 12 19 7 14 8 15 8 15 22 29 6 13 20 27 3 10 17 24 2 9 16 23 30 1 4 7 14 21 28 4 11 18 25 8 15 22 29 5 12 19 26 2 9 16 23 30 6 13 20 27 3 10 17 24 31 7 14 21 28 3 10 17 24 4 11 18 25 5 12 19 26 4 11 18 25 5 12 19 26 6 13 20 27 7 14 21 28 8 15 22 29 9 16 23 30
三月
十月
13 20 27
四月
13 20 27
十一月
10 17 24 1 8
五月
11 18 25 1 8
十二月
15 22 29 5 12 19
六月
15 22 29
元月
7 13
蚌 埠 学 院
2014~2015学年第一学期校历
星期 月日 八月 周 一 周 二 周 三 周 四 周 五 周 六 周 日 周次
说 明
蚌 埠 学 院
2014~2015学年第二学期校历
星期 月日 二月 周 一 周 二 周 三 周 四 周 五 周 六 周 日 周次
说 明
30 1 8 2 9 16 23 30 1 6 7 14 21 28 4 11 18 25 2 9 16 23 30 6 13 20 8 15 22 29 5 12 19 26 3 10 17 24 31 1 2 9 16 23 3 10 17 24 2 9 16 23 30 6 13 20 27 4 11 18 25 3 10 17 24 31 1 3 7 14 21 28 5 12 19 26 8 15 22 29 6 13 20 27 4 11 18 25 3 10 17 24 4 11 18 25 5 12 19 26 6 13 20 27
2014—2015学年度第二学期教学工作计划【精品范文】

2014—2015学年度第二学期教学工作计划2014—2015学年度第二学期教学工作计划新的一学期开始了,本学期我担任五(5)、五(6)、五(7)班的综合实践活动教学工作和图书室的管理工作。
为了使自己的工作顺利有序的进行,现将工作计划制定如下:教学工作:本册教课书有五个单元,根据教学大纲的要求,以本地区的自然、历史、人文为研究背景,以学生的直接经验或实验为基础,以教师指导下的学生综合实践活动为载体,加强学科有效整合和教师文化沟通,帮助学生学习、掌握和运用现代教育技术,注重培养学生的创新意识和实践能力。
教材分析:一、教学内容:1、自我成长---小学生课外阅读情况的调查2、现代科技---汽车总动员3、学校生活---走进学校的历史4、社会生活---珍爱生命,远离吸烟5、地方特色---山西皮影戏二、课程目标1、亲近周围的自然环境,结合学科课程的学习,有效进行学科知识的整合与沟通,教育和引导学生以科学发展观统领全局,走进自然、主动实践,热爱自然,保护自然,初步形成自觉保护和合理开发周围自然环境的意识和能力。
2、考察周围的社会环境,自觉遵守社会行为规范,增长社会见识和行为辨析能力,初步养成服务社会意识和对社会负责的态度。
3、逐步掌握基本的生活技能,形成生活自理的习惯。
初步具有认识自我、发展自我的积极的、科学的人生观。
4、激发学生的好奇心和求知欲,初步养成从事探究问题的能力。
三、实施要点1、自我成长---小学生课外阅读情况的调查(1)关注小学生自身的学习和生活,并从中发现有意义的问题。
(2)能够设计简单的研究方案。
(3)了解小学生的阅读情况,培养阅读兴趣,并且根据发现的问题,提出自己的建议。
2、现代科技---汽车总动员。
(1)通过了汽车这一运输工具的内部运作和加工流程,关注现代社会的科技发展与安全。
(2)学习了解简单的汽车组要零部件的作用及安全乘车的注意事项。
(3)体验团队合作完成任务的工作方式。
3、学校生活---走进学校的历史(1)尝试通过多种渠道收集信息,并且依据时间顺序或主题进行分类整理。
20142015学年度第二学期教学计划
2014/2015学年度第二学期教学计划开课计划与上课时间表(2014/2015学年度第二学期)注:总学时分配、学分分配中理论是指理论教学,实践是指实践教学。
实践教学是相对理论教学以技能和操作能力为主的教学环节或形式,其内容包括实验、实习(见习)、实训、社会调查、课程设计、学年论文、毕业设计(论文)、军训、创业活动等,也包括课堂教学中实践技能。
开课计划与上课时间表(2014/2015学年度第二学期)注:总学时分配、学分分配中理论是指理论教学,实践是指实践教学。
实践教学是相对理论教学以技能和操作能力为主的教学环节或形式,其内容包括实验、实习(见习)、实训、社会调查、课程设计、学年论文、毕业设计(论文)、军训、创业活动等,也包括课堂教学中实践技能。
开课计划与上课时间表(2014/2015学年度第二学期)注:总学时分配、学分分配中理论是指理论教学,实践是指实践教学。
实践教学是相对理论教学以技能和操作能力为主的教学环节或形式,其内容包括实验、实习(见习)、实训、社会调查、课程设计、学年论文、毕业设计(论文)、军训、创业活动等,也包括课堂教学中实践技能。
开课计划与上课时间表(2014/2015学年度第二学期)注:总学时分配、学分分配中理论是指理论教学,实践是指实践教学。
实践教学是相对理论教学以技能和操作能力为主的教学环节或形式,其内容包括实验、实习(见习)、实训、社会调查、课程设计、学年论文、毕业设计(论文)、军训、创业活动等,也包括课堂教学中实践技能。
开课计划与上课时间表(2014/2015学年度第二学期)注:总学时分配、学分分配中理论是指理论教学,实践是指实践教学。
实践教学是相对理论教学以技能和操作能力为主的教学环节或形式,其内容包括实验、实习(见习)、实训、社会调查、课程设计、学年论文、毕业设计(论文)、军训、创业活动等,也包括课堂教学中实践技能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临沂大学2014—2015学年第二学期
《分析化学》试题(C卷)
题号一二三四五总分合分人复核人
得分
得分一、选择题(共20题,每题2分,共40分,请将答案填入下
面的方框内,否则不给分)
阅卷人
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
1.铝盐药物的测定常采用配位滴定法,做法是:加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定,该法的滴定方式是。
A.直接滴定B.置换滴定C.返滴定D.间接滴定
2.用KMnO4溶液滴定C2O42-时,选择的滴定方式是。
A.慢-快-慢B.快-慢-慢C.始终缓慢滴定D.始终较快滴定3.在含有Fe3+和Fe2+的溶液中,加入下列何种溶液,Fe3+/Fe2+电对的电位将明显降低(不考虑离子强度的影响)?。
A.NaCl B.HCl C.HNO3D.NaF
4.用洗涤方法可除去的沉淀杂质是。
A.混晶共沉淀杂质B.包藏共沉淀杂质
C.吸附共沉淀杂质D.后沉淀杂质
5.指示剂变色而终止滴定的这一点,称为________。
A.化学计量点B.滴定终点C.等量点D.其他
6.关于精密度与准确度的说法正确的是________。
A.精密度用误差表示B.好的精密度是高准确度的前提
C.精密度越好则准确度越高D.准确度用偏差表示
7.单一金属离子可被准确滴定的判据是________。
A.cK 'f≥ 106B.cK 'f≤ 106C.cK 'f≥ 108D.cK 'f ≤ 108
8.以吸附指示剂法测定Cl-时,应选择的指示剂是________。
A.K2CrO4B.NH4Fe(SO4)2C.K2Cr2O7D.荧光黄
9.引起滴定分析终点误差的主要原因是。
A.指示剂不在化学计量点时变色B.有副反应发生
C.滴定管最后估读不准D.反应速度过慢
10.下列违反无定型沉淀的生成条件的是。
A.沉淀作用宜在较浓溶液中进行B.沉淀作用宜在热溶液中进行
C.在不断搅拌下,迅速加入沉淀剂D.沉淀宜放置过夜,使沉淀陈化
11.一般情况下,EDTA与金属离子形成配位化合物的配位比是。
A.1:1 B.2:1 C.1:3 D.1:2
12.对于电极反应,MnO2 + 4H+ + 2e = Mn2+ + 2H2O,如果增大溶液的pH值,则该电极的电极电势将________。
A.增大B.减小C.不变D.不能判断
13.根据酸碱质子理论,HPO42-的共轭碱是________。
A.H3PO4B.H2PO4-C.PO43-D.OH-
14.AgCl在NaCl溶液中的溶解度比在纯水中小的原因是_________。
A.同离子效应B.酸效应C.盐效应D.多种效应
15.用重氮化法测定的化合物是_________。
A.芳伯胺类化合物B.芳仲胺类化合物C.硼砂D.胆矾
16.配制Na2S2O3溶液时,加入少量Na2CO3的目的是_________。
A.作抗氧剂B.增强Na2S2O3的还原性
C.中和Na2S2O3溶液的酸性D.防止嗜硫细菌生长和Na2S2O3分解
17. 用HCl溶液滴定某碱液,量取两份碱液。
一份以甲基橙为指示剂,消耗HCl体积
为V1;另一份以酚酞为指示剂,消耗HCl体积为V2。
若V1=V2,则该碱液为_________。
A.Na2CO3 B.NaHCO3 C.NaOH D.NaOH与Na2CO3
18. 用已知浓度的NaOH滴定相同浓度的不同弱酸时,若弱酸的Ka越大,则_________。
A.消耗的NaOH越多B.滴定突跃越大
C.滴定突跃越小D.指示剂颜色变化越不明显
19. 在下列何种溶剂中醋酸、苯甲酸、盐酸及高氯酸的酸强度都相同________。
A.纯水B.浓硫酸C.液氨D.甲基异丁酮
20. 某酸碱指示剂的K HIn=1×10-5,其理论变色范围是pH________。
A.4-5 B.5-6 C.4-6 D.5-7
1.滴定管读数时,最后一位估计不准引起的误差属于系统误差。
()
2.对于两种难容强电解质,可根据K spθ判断两者溶解度大小。
()
3.酸碱指示剂的变色范围越大,酸碱滴定法测定的结果越准确。
()
4.偶然误差是由某些难以控制的偶然因素造成的,因此是无规律可循的。
()
5.滴定管读数时,最后一位估计不准引起的误差属于系统误差。
()
6.碘量法的测定对象既可为还原剂,有可为氧化剂。
( )
7.对于两种难容强电解质,可根据K spθ判断两者溶解度大小。
()
8.为了使某种离子沉淀得很完全,所加沉淀剂越多,则沉淀得越完全。
()
9.为使沉淀损失减少,洗涤BaSO4沉淀时不用蒸馏水,而用稀H2SO4。
()
10.精密度高的一组数据,其准确度一定高。
()
1.直接法配位滴定过程中,滴定终点前溶液所呈现的颜色是的颜色。
2.电对氧化态发生沉淀副反应,将使电对电极电位。
3.重氮化滴定法中,被测物苯环上,特别是胺基的对位上有吸电子基团取代,会使反应速度。
4.高锰酸钾法的指示剂是,调节酸度常用。
5.加入滴定剂后不能立即定量完成的滴定反应可采用进行滴定。
6.Na2HPO4的质子平衡式为。
7.铬酸钾指示剂法测定NH4Cl时,若pH>7.5,会引起Ag(NH3)2+的形成,使测定结果偏。
8.标准溶液就是。
9.配制碘液时,为了助溶和降低I2挥发性,应加入适当过量的。
四、计算题(共3题,每题10分,共30分)
1. 欲测定奶粉中的钙含量,先通过灰化处理1.500g试样,然后用EDTA溶液滴定Ca2+。
用去浓度为0.05000mol/L的EDTA滴定剂1
2.10mL,求奶粉中钙的含量。
(已知M Ca 40.08)
2. 氯霉素的化学式为C11H12O5N2Cl2,现有氯霉素眼膏试样1.03g,在密闭管中用金属钠共热以分解有机物并释放出氯化物,将灼烧后的混合物溶于水,过滤除去碳的残渣,用AgNO3沉淀氯化物,得0.0129g AgCl,计算试样中氯霉素的质量分数(M氯霉素323,M AgCl=14
3.3)
3. 计算分析浓度为0.10mol·L–1的Na3PO4溶液的pH。
(已知H3PO4的pKa1=2.12,
pKa2=7.20,pKa3=12.36)
五、问答题(共2题,每题5分,共10分)
1.用淀粉做指示剂,直接碘量法中何时加入,如何判断终点?间接碘量法中何时加入,
如何判断终点?
2. 重铬酸钾标准溶液配制常用什么方法?原因如何?。
