测序常用名词解释整理
高通量测序,名词解释

高通量测序基础知识汇总一代测序技术:即传统的Sanger测序法,Sanger法是根据核苷酸在待定序列模板上的引物点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生以A、T、C、G结束的四组不同长度的一系列核苷酸,每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNTP缺乏延伸所需要的3-OH 基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,通过检测得到DNA碱基序列。
二代测序技术:next generation sequencing(NGS)又称为高通量测序技术,与传统测序相比,二代测序技术可以一次对几十万到几百万条核酸分子同时进行序列测定,从而使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序(Deep sequencing)。
NGS主要的平台有Roche(454 &454+),Illumina(HiSeq 2000/2500、GA IIx、MiSeq),ABI SOLiD等。
基因:Gene,是遗传的物质基础,是DNA或RNA分子上具有遗传信息的特定核苷酸序列。
基因通过复制把遗传信息传递给下一代,使后代出现与亲代相似的性状。
DNA:Deoxyribonucleic acid,脱氧核糖核酸,一个脱氧核苷酸分子由三部分组成:含氮碱基、脱氧核糖、磷酸。
脱氧核糖核酸通过3',5'-磷酸二酯键按一定的顺序彼此相连构成长链,即DNA链,DNA链上特定的核苷酸序列包含有生物的遗传信息,是绝大部分生物遗传信息的载体。
RNA:Ribonucleic Acid,,核糖核酸,一个核糖核苷酸分子由碱基,核糖和磷酸构成。
高通量测序科研入门常用名词意义整理

⾼通量测序科研⼊门常⽤名词意义整理微⽣物⾼通量测序相关名词概念解析作者:happy⽬录⼀、OTU分类和统计 (2)⼆、⽣物信息分析 (2)三、16SrRNA (3)四、Alpha多样性 (4)五、稀疏性分析(rarefaction analysis)和稀疏性曲线(rarefaction curve) (7)六、Shannon-Weiner指数 (8)七、Rank Abundance 曲线 (9)⼋、微⽣物种属鉴定及相关分析 (10)九、OTU群落聚类及相关分析 (14)⼗、Rank Abundance 曲线 (15)⼗⼀、韦恩图(Venn) (16)⼀、OTU分类和统计OTU(operationaltaxonomicunits)是在系统发⽣学研究或群体遗传学研究中,为了便于进⾏分析,⼈为给某⼀个分类单元(品系,种,属,分组等)设置的同⼀标志。
通常按照97%的相似性阈值将序列划分为不同的OTU,每⼀个OTU通常被视为⼀个微⽣物物种。
相似性⼩于97%就可以认为属于不同的种,相似性⼩于93%-95%,可以认为属于不同的属。
样品中的微⽣物多样性和不同微⽣物的丰度都是基于对OTU的分析。
Coverage是指各样品⽂库的覆盖率,其数值越⾼,则样本中序列没有被测出的概率越低。
该指数实际反映了本次测序结果是否代表样本的真实情况。
计算公式为:C=1-n1/N其中n1=只含有⼀条序列的OTU的数⽬;N=抽样中出现的总的序列数⽬。
分类⽔平统计表主要是对每个样本在分类学⽔平上的数量进⾏统计,并且在表格中列出了在每个分类学⽔平上的物种数⽬(只显⽰前10个样本,如果样本超过10个,请查看结果中taxon_all.txt⽂件)其中SampleName表⽰样本名称;Phylum表⽰分类到门的OTU数量;Class表⽰分类到纲的OTU数量;Order表⽰分类到⽬的OTU数量;Family表⽰分类到科的OTU数量;Genus表⽰分类到属的OTU数量;Species表⽰分类到种的OTU数量。
相关专业名词解析 (1)

相关专业名词解析1.SBS:边合成边测序,通过技术创新,用不同颜色的荧光标记四种不同的dNTP,当DNA聚合酶合成互补链时,每添加一种dNTP就会释放出不同的荧光,根据捕捉的荧光信号并经过特定的计算机软件处理,从而获得待测DNA的序列信息。
2.Read:测序的读长,测序反应的最小单位,碱基的最小片段3.Tig:测序从两端开始,测通的两个read.4.Contig:基于reads拼接获得的中间没有gap的区域。
(gap:断裂)5.Scafford:测序后期继续拼接,contig连接,有gap。
6.测序深度:所测碱基总量与待测基因组大小的比值。
7.测序数据量:测序所得的总数据量。
8.De-novo测序:从头测序,不依赖于现有的测序资料,直接对某个基因组进行测序。
9.SE:单端测序10.PE:双末端测序11.NGS(Next-generation sequencing):二代测序。
12.HTS (High-throughpot sequencing):高通量测序。
13.call rate:检出率。
14.Mate pair:大片段文库,测序时建立的库。
Single-read、Paired-end和Mate-pair主要区别在测序文库的构建方法上。
单端测序(Single-read)首先将DNA样本进行片段化处理形成200-500bp的片段,引物序列连接到DNA片段的一端,然后末端加上接头,将片段固定在flow cell上生成DNA簇,上机测序单端读取序列。
Paired-end方法是指在构建待测DNA 文库时在两端的接头上都加上测序引物结合位点,在第一轮测序完成后,去除第一轮测序的模板链,用对读测序模块(Paired-End Module)引导互补链在原位置再生和扩增,以达到第二轮测序所用的模板量,进行第二轮互补链的合成测序。
Mate-pair文库制备旨在生成一些短的DNA片段,这些片段包含基因组中较大跨度(2-10 kb)片段两端的序列。
高通量测序 名词解释

高通量测序基础知识汇总一代测序技术:即传统的Sanger测序法,Sanger法是根据核苷酸在待定序列模板上的引物点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生以A、T、C、G结束的四组不同长度的一系列核苷酸,每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNTP缺乏延伸所需要的3-OH 基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,通过检测得到DNA碱基序列。
二代测序技术:next generation sequencing(NGS)又称为高通量测序技术,与传统测序相比,二代测序技术可以一次对几十万到几百万条核酸分子同时进行序列测定,从而使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序(Deep sequencing)。
NGS主要的平台有Roche(454 & 454+),Illumina(HiSeq 2000/2500、GA IIx、MiSeq),ABI SOLiD等。
基因:Gene,是遗传的物质基础,是DNA或RNA分子上具有遗传信息的特定核苷酸序列。
基因通过复制把遗传信息传递给下一代,使后代出现与亲代相似的性状。
DNA:Deoxyribonucleic acid,脱氧核糖核酸,一个脱氧核苷酸分子由三部分组成:含氮碱基、脱氧核糖、磷酸。
脱氧核糖核酸通过3',5'-磷酸二酯键按一定的顺序彼此相连构成长链,即DNA链,DNA链上特定的核苷酸序列包含有生物的遗传信息,是绝大部分生物遗传信息的载体。
RNA:Ribonucleic Acid,,核糖核酸,一个核糖核苷酸分子由碱基,核糖和磷酸构成。
(完整版)测序常用名词解释整理
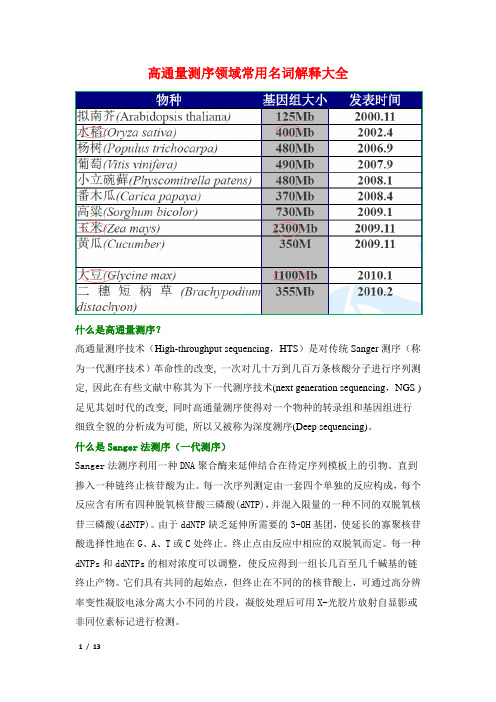
高通量测序领域常用名词解释大全什么是高通量测序?高通量测序技术(High-throughput sequencing,HTS)是对传统Sanger测序(称为一代测序技术)革命性的改变, 一次对几十万到几百万条核酸分子进行序列测定, 因此在有些文献中称其为下一代测序技术(next generation sequencing,NGS )足见其划时代的改变, 同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能, 所以又被称为深度测序(Deep sequencing)。
什么是Sanger法测序(一代测序)Sanger法测序利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。
直到掺入一种链终止核苷酸为止。
每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNTP缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。
终止点由反应中相应的双脱氧而定。
每一种dNTPs和ddNTPs的相对浓度可以调整,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。
什么是基因组重测序(Genome Re-sequencing)全基因组重测序是对基因组序列已知的个体进行基因组测序,并在个体或群体水平上进行差异性分析的方法。
随着基因组测序成本的不断降低,人类疾病的致病突变研究由外显子区域扩大到全基因组范围。
通过构建不同长度的插入片段文库和短序列、双末端测序相结合的策略进行高通量测序,实现在全基因组水平上检测疾病关联的常见、低频、甚至是罕见的突变位点,以及结构变异等,具有重大的科研和产业价值。
什么是de novo测序de novo测序也称为从头测序:其不需要任何现有的序列资料就可以对某个物种进行测序,利用生物信息学分析手段对序列进行拼接,组装,从而获得该物种的基因组图谱。
第一代dna测序技术名词解释

第一代dna测序技术名词解释第一代DNA测序技术是指在1970年代末至2000年代初开发的DNA测序方法。
下面是一些常见的第一代DNA测序技术及其解释:1. Sanger测序:由Frederick Sanger于1977年发明的测序方法。
通过将DNA链延伸反应分为四个反应管,每个管中只加入一种特定的ddNTP(二氢基链终止核苷酸),从而在DNA合成中引入特定的终止位置。
通过将四个反应管中的DNA片段分别分离并进行电泳分析,可以确定DNA的顺序。
2. Maxam-Gilbert测序:由Allan Maxam和Walter Gilbert于1977年发明的测序方法。
该方法通过将DNA链分割成多个片段,并在每个片段上引入特定的化学修饰(如酶消化、酸酐化、碱性断裂等),然后通过电泳分析来确定DNA序列。
3. Pyrosequencing(火花测序):由Pl Nyrén和Mostafa Ronaghi 于1996年发明的测序方法。
该方法利用DNA合成过程中释放的焦磷酸(PPi)被硫酸供体和火花酶催化分解产生反应,在特定的荧光探针存在下,通过检测荧光信号的强弱来确定DNA序列。
4. Dideoxy chain termination sequencing(链终止测序):是Sanger测序方法的常用名。
通过在DNA合成过程中引入链终止核苷酸(ddNTP),从而限制新合成链的延伸,然后利用电泳分析来确定DNA序列。
5. Gel electrophoresis(凝胶电泳):是一种将DNA片段按照大小进行分离的常用技术。
在第一代DNA测序中,通过在聚丙烯酰胺凝胶中进行电泳,根据DNA片段的大小差异来确定DNA序列。
这些第一代DNA测序技术为后续的高通量测序技术的发展奠定了基础,虽然在吞吐量和成本效益上存在一些局限性,但仍然是基因组学和生物学研究中的重要工具。
测序常用名词解释整理
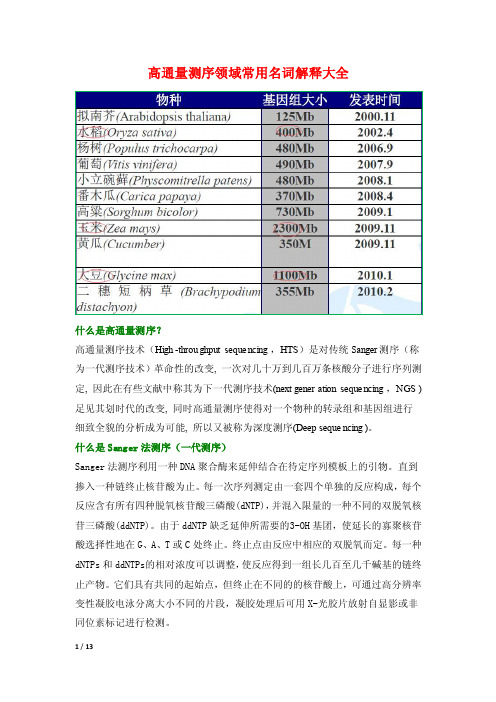
高通量测序领域常用名词解释大全什么是高通量测序?高通量测序技术(High-throug hputsequen cing,HTS)是对传统Sa nger测序(称为一代测序技术)革命性的改变, 一次对几十万到几百万条核酸分子进行序列测定, 因此在有些文献中称其为下一代测序技术(next genera tionsequen cing,NGS )足见其划时代的改变, 同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序(Deep sequen cing)。
什么是San ger法测序(一代测序)Sanger法测序利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。
直到掺入一种链终止核苷酸为止。
每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNT P缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。
终止点由反应中相应的双脱氧而定。
每一种dNT Ps和dd NTPs的相对浓度可以调整,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。
什么是基因组重测序(Genome Re-sequen cing)全基因组重测序是对基因组序列已知的个体进行基因组测序,并在个体或群体水平上进行差异性分析的方法。
随着基因组测序成本的不断降低,人类疾病的致病突变研究由外显子区域扩大到全基因组范围。
通过构建不同长度的插入片段文库和短序列、双末端测序相结合的策略进行高通量测序,实现在全基因组水平上检测疾病关联的常见、低频、甚至是罕见的突变位点,以及结构变异等,具有重大的科研和产业价值。
下一代测序技术名词解释

下一代测序技术名词解释下一代测序技术(Next Generation Sequencing,NGS)是一种高通量测序技术,能够同时对大量的DNA或RNA进行测序。
相比传统的测序技术,下一代测序技术具有更高的测序速度、更低的成本以及更强的分辨能力。
以下是一些常见的下一代测序技术名词解释:1. Illumina测序(Illumina Sequencing):Illumina公司开发的一种基于桥式扩增(Bridge Amplification)的测序技术。
它通过光反应和荧光检测原理,将DNA片段扩增成固定桥结构,再通过碱基逐个加入的方式进行测序。
2. 454测序(454 Sequencing):Roche Diagnostics公司开发的一种基于聚合酶链式反应(Polymerase Chain Reaction,PCR)和微滴化技术的测序技术。
它通过将DNA片段扩增成微滴并进行逐个碱基加入的方式进行测序。
3. Ion Torrent测序(Ion Torrent Sequencing):Ion Torrent Systems公司开发的一种基于核苷酸测序的技术。
它通过检测DNA串联上新生链中释放的质子来确定DNA序列。
4. PacBio测序(Pacific Biosciences Sequencing):Pacific Biosciences公司开发的一种基于DNA聚合酶反应的测序技术。
它利用单分子实时测序原理,通过测量聚合酶在 DNA模板上运动的时间来确定序列。
5. Nanopore测序(Nanopore Sequencing):Oxford Nanopore Technologies公司开发的一种基于纳米孔技术的测序技术。
它通过电流信号检测DNA/RNA分子通过纳米孔时的不同电流变化,从而实现对序列的测定。
这些下一代测序技术在基因组学、转录组学、表观遗传学等领域中广泛应用,对于生物医学研究、疾病诊断和个体化医疗等方面具有重要意义。
高通量测序-名词解释

高通量测序基础知识汇总一代测序技术:即传统的Sanger测序法,Sanger法是根据核苷酸在待定序列模板上的引物点开始,随机在某一个特定的碱基处终止,并且在每个碱基后面进行荧光标记,产生以A、T、C、G结束的四组不同长度的一系列核苷酸,每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNTP缺乏延伸所需要的3-OH 基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳别离大小不同的片段,通过检测得到DNA碱基序列。
二代测序技术:next generation sequencing〔NGS〕又称为高通量测序技术,与传统测序相比,二代测序技术可以一次对几十万到几百万条核酸分子同时进行序列测定,从而使得对一个物种的转录组和基因组进行细致全貌的分析成为可能,所以又被称为深度测序〔Deep sequencing〕。
NGS主要的平台有Roche〔454 & 454+〕,Illumina〔HiSeq 2000/2500、GA IIx、MiSeq〕,ABI SOLiD等。
基因:Gene,是遗传的物质基础,是DNA或RNA分子上具有遗传信息的特定核苷酸序列。
基因通过复制把遗传信息传递给下一代,使后代出现与亲代相似的性状。
DNA:Deoxyribonucleic acid,脱氧核糖核酸,一个脱氧核苷酸分子由三部分组成:含氮碱基、脱氧核糖、磷酸。
脱氧核糖核酸通过3',5'-磷酸二酯键按一定的顺序彼此相连构成长链,即DNA链,DNA链上特定的核苷酸序列包含有生物的遗传信息,是绝大部分生物遗传信息的载体。
RNA:Ribonucleic Acid,,核糖核酸,一个核糖核苷酸分子由碱基,核糖和磷酸构成。
测序相关名字注解

1、链特异性建库测序:(mRNA-Seq library(Strand-Specific) construction,ssRNA-Seq)可以确定转录本来自正链还是负链,以便更加准确的获得基因的结构以及基因表达信息,并且可以更好的发现新的基因;但链特异建库在read的随机性分布上略差,而其所得结果其他指标都是比较优秀的,其结果是准确可信的。
测序数据质量评估与预处理:质量控制Quality Control:FastQC、Fastx-toolkit 拼接Aligner:BWA,Bowtie, Tophat, SOAP2 Mapper:Tophat, Cufflinks基因定量Gene Quantification: Cufflinks, Avadis NGS质量改进Quality improvement:?Genome Analysis Toolkit(GATK)SNP: Unified Genotyper,Glfmultiple, SAMtools, Avadis NGSCNV: CNVnator Indel: Pindel, Dindel, Unified Genotyper, Avadis NGSMapping to a gene: Cufflinks, Rsamtools,?Genomic FeaturesQC分析:QUALITY CONTROL,检查表、层别法、柏拉图、因果图、散布图、直方图、管制图2、差异整合分析:Meta-analysis,对若干独立研究的统计结果进行综合差异的定量分析表达模式分析:分析基因如何表达的。
就是从DNA到蛋白质的过程,这个过程是如何进行的就是它的模式GO富集分析:可分为分子功能(Molecular Function),生物过程(biological process)和细胞组成(cellular component)三个部分。
蛋白质或者基因可以通过ID对应或者序列注释的方法找到与之对应的GO号,而GO号可对于到Term,即功能类别或者细胞定位。
高通量测序常用名词解释

什么是高通量测序?高通量测序技术(High-throughput sequencing,HTS)是对传统Sanger测序(称为一代测序技术)革命性的改变, 一次对几十万到几百万条核酸分子进行序列测定, 因此在有些文献中称其为下一代测序技术(next generation sequencing,NGS )足见其划时代的改变, 同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能, 所以又被称为深度测序(Deep sequencing)。
什么是Sanger法测序(一代测序)Sanger法测序利用一种DNA聚合酶来延伸结合在待定序列模板上的引物。
直到掺入一种链终止核苷酸为止。
每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNTP缺乏延伸所需要的3-OH基团,使延长的寡聚核苷酸选择性地在G、A、T或C处终止。
终止点由反应中相应的双脱氧而定。
每一种dNTPs和ddNTPs的相对浓度可以调整,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。
什么是基因组重测序(Genome Re-sequencing)全基因组重测序是对基因组序列已知的个体进行基因组测序,并在个体或群体水平上进行差异性分析的方法。
随着基因组测序成本的不断降低,人类疾病的致病突变研究由外显子区域扩大到全基因组范围。
通过构建不同长度的插入片段文库和短序列、双末端测序相结合的策略进行高通量测序,实现在全基因组水平上检测疾病关联的常见、低频、甚至是罕见的突变位点,以及结构变异等,具有重大的科研和产业价值。
什么是de novo测序de novo测序也称为从头测序:其不需要任何现有的序列资料就可以对某个物种进行测序,利用生物信息学分析手段对序列进行拼接,组装,从而获得该物种的基因组图谱。
高通量测序常用名词

外显子组测序
• 是指利用序列捕获技术将全基因组外显子区域DNA捕捉并富集后进行高通量测序的 基因组分析方法。外显子测序相对于基因组重测序成本较低,对研究已知基因的 SNP、InDel等具有较大的优势。
目标区域测序
• 应用相关试剂盒对基因组上感兴趣的目标区域进行捕获富集后进行大规模测序,一 般需要根据目标区域专门定制捕获芯片。
ChIp-Seq
• Chromatin Immunoprecipitation sequencing,即染色质免疫共沉淀-测序技术,即通过
染色质免疫共沉淀技术特异性地富集目的蛋白结合的DNA组范围内可以与 目的蛋白相互作用的DNA片段的方法叫做ChIP-Seq。
(rRNA)分子对应的DNA序列,16S rDNA是原核生物编码核糖体小亚基16S rRNA的
基因。 • 细菌rRNA(核糖体RNA)按沉降系数分为3种,分别为5S、16S和23S rRNA。16S rDNA是细菌染色体上编码16S rRNA相对应的DNA序列,存在于所有细菌染色体基因
中。16S rRNA普遍存在于原核生物中。16S rRNA分子,其大小约1540bp,既含有高
高通量测序常用名词
三代测序
• • Pacific Biosciences 公司研发的 PacBio RS II 单分子实时测序系统, 革命性地推出了 单分子实时(Single Molecule Real Time, SMRT)DNA测序技术,在测序历 史上首次实现 了人类观测单个DNA聚合酶合成过程的 梦想。SMRT Sequencing具有超长的测 序读长、对基因组组装和基因组变异的 检测具有极高的准确率、极度的敏感性、 直接检测广泛的碱基修饰、最小的GC偏 好性(GC bias)和无PCR扩增偏好性等 技术特点.
核酸测序的加减法名词解释

核酸测序的加减法名词解释
核酸测序是一种用于确定DNA或RNA分子中碱基序列的技术。
这种技术的发展对于生物学、医学和遗传学等领域具有重要的意义。
在核酸测序中,有一些常用的术语和方法,本文将对其中的加减法进行解释。
加法测序是一种通过逐渐扩增DNA或RNA的方法来进行测序的技术。
其基本原理是利用DNA或RNA聚合酶在已知序列的引物的作用下,从DNA或RNA模板上合成新的DNA或RNA链。
这一过程可以重复进行多次,从而扩增目标序列。
在每一次扩增的过程中,可以加入一种特殊的标记物,如荧光染料或放射性核素,以便在测序的过程中进行检测和识别。
减法测序则是一种通过进行不断的化学修饰和切割的方法来进行测序的技术。
常用的减法测序方法包括“Sanger测序法”和“Maxam-Gilbert测序法”。
在Sanger测序法中,利用一种特殊的合成寡核苷酸引物和DNA聚合酶进行DNA链延伸,同时还加入了一种特殊的
二进制链终止剂,使得在合成过程中随机停止。
然后,通过电泳分离这些不同长度的DNA片段,可以确定序列。
在核酸测序中,以上的加减法是非常重要的方法。
通过这些方法,可以对DNA或RNA的序列进行准确的确定,从而揭示生物体的遗传信息和基因功能。
总结起来,核酸测序的加减法是两种重要的测序技术,分别通过扩增和切割的方式来确定DNA或RNA的序列。
这些方法为我们研究生物体的遗传信息和基因功能提供了重要的工具和手段。
在使用这些方法时,我们需要遵守科学道德和法律法规,确保文章内容的真实性和合法性。
同时,也要注意文章的结构和流畅度,以确保读者能够清晰地理解和理解所述的概念和方法。
sanger测序法名词解释

sanger测序法名词解释Sanger测序法是一种常用的DNA测序技术。
下面是一些相关名词的解释:1. 测序:测序是指确定DNA序列的过程。
Sanger测序法是一种历史悠久且经典的测序方法,通过测量DNA链延伸反应中的DNA碱基,逐个确定DNA序列。
2. DNA:脱氧核糖核酸(Deoxyribonucleic Acid),是构成生物基因的分子,携带着生物遗传信息。
3. 碱基:DNA分子的组成单位,有四种碱基:腺嘌呤(Adenine)、鸟嘌呤(Guanine)、胸腺嘧啶(Thymine)、胞嘧啶(Cytosine)。
DNA的序列是由这四种碱基的不同排列组合而成。
4. 末端标记:Sanger测序法中,DNA的一条链被标记,通常使用荧光染料标记DNA的3'末端。
5. 核酸酶:酶是一种催化生化反应的蛋白质。
Sanger测序法中使用核酸酶,在特定条件下,通过特异性水解特定的核酸链,以确定DNA的碱基序列。
6. Dideoxy链终止法:Sanger测序法又称为dideoxy链终止法,它利用特殊的二进制去氧核糖核苷酸(dideoxynucleotide)来终止DNA链的延伸反应。
不同的二进制去氧核糖核苷酸通过荧光染料标记,然后通过凝胶电泳分离和检测,最终确定DNA的碱基序列。
7. 凝胶电泳:一种分离生物大分子(如DNA)的方法,通过将DNA放置于聚丙烯酰胺凝胶中,通过电流进行分离,根据DNA片段的大小来分析和确定DNA的碱基序列。
8. 自动测序:自动测序技术是对Sanger测序法的改进,使用高效的电泳和光学系统、电脑控制等技术来加快测序速度和提高测序质量。
与传统的手工测序相比,自动测序更准确、高通量。
Solexa与Hiseq测序技术中常见术语名词解释

Solexa与Hiseq测序技术中常见术语名词解释第二代测序技术中Solexa以及它的升级版Hiseq,目前使用最多。
为了帮助PLoB网友进一步了解Solexa相关的概念。
与大家分享一篇网上看到的文章《Solexa测序技术中常见术语解释》,文章后面有参考来源链接。
更多相关信息欢迎加入PLoB 2000人的生物信息QQ群(群号:235461986)来讨论,有相关测序以及生物信息学问题需要解答欢迎前来。
下面直接附上相关的解释。
大家同时可以结合上面的示意图,了解Solexa与Hiseq的基本结构。
SBS:边合成边测序反应,每次SBS会延伸一个碱基,大约耗时70分钟。
Run:单次上机测序反应,可以产生4G-75G测序通量不等。
Lane:单泳道,每条泳道可以直接物理区分测序样品,1次run 最多可以同时上样8条Lane。
Channel:Lane的同义词。
Tile:小区,每条Lane中排有2列tile,合计120个小区。
每个小区上分布数目繁多的簇结合位点。
Cluster:簇,在Solexa测序技术中会采用桥式PCR方式生产D NA簇,每个DNA簇才能产生亮度达到CCD可以分辨的荧光点。
Index:标签,在Solexa多重测序(Multiplexed Sequencing)过程中会使用Index来区分样品,并在常规测序完成后,针对Ind ex部分额外进行7个循环的测序,通过Index的识别,可以在1条L ane中区分12种不同的样品。
Barcode: Index同义词Fasta:一种序列存储格式。
一个序列文件若以FASTA格式存储,则每一条序列的第一行以“>”开头,而跟随“>”的是序列的ID号(即唯一的标识符)及对该序列的描述信息;第二行开始是序列内容,序列短于61nt的,则一行排列完;序列长于61nt的,则每行存储6 1nt,最后剩下小于61nt的,在最后一行排列完;第二条序列另起一行,仍然由“>”和序列的ID号开始,以此类推。
基因组测序术语解释

DNA关键词:WG-BSA (全基因组重测序 BSA)对已有参考基因组序列的物种的所有作图群体( F1、 F2、 RIL、 DH 和 BC1等),对亲本进行个体重测序,对某个极端性状材料混池测序,检测 SNP,获得与性状紧密关联的分子标记和精细定位区域,是目前最高效的基因定位方法。
通过选取某个极端性状,利用高效率低成本的混池测序技术,勿需开发分子标记进行遗传图的构建,快速定位与性状相关的候选 QTL。
MP-Reseq (多混池全基因组重测序)针对特有的优良地方品种中的不同品种/品系,通过群体内 pooling 建库的方法,进行全基因组重测序,采用生物信息学方法全基因组范围内扫描变异位点,能快速的定位不同混池样品基因组中明显经过人工或自然选择的区域,检测与性状相关的基因区域及其功能基因。
全基因组个体重测序基于全基因组重测序的变异图谱通过测序手段结合生物信息分析研究同一物种不同个体之间的变异情况,获得大量的变异信息,如 SNP、 Indel、 SV 等。
主要可以快速地获得大量的分子标记以及不同个体在基因组水平上的差异。
全基因组关联分析-GWAS通过重测序对动植物重要种质资源进行全基因组基因型鉴定,与关注的表型数据进行全基因组关联分析,找出与关注表型相关的SNP位点,定位数量性状基因,与数量性状相关的基因紧密连锁的SNP标记,后续可用于分子标记辅助育种,助力育种进程。
全基因组重测序-遗传进化通过对来自全国各地、具有代表性的 XX 份 XX 材料进行全基因组重测序,检测 SNP、 Indel、 SV,并利用获得的 SNP 与 SV 数据进行群体多样性分析,包括连锁不平衡分析、群体进化分析、群体结构分析、群体主成分分析等。
全基因组重测序-遗传图谱基于全基因组重测序技术对已有参考基因组序列的物种进行个体或群体的全基因组测序,利用高性能计算平台和生物信息学方法,检测单核苷酸多态性位点( SNP),并计算多态性标记间的遗传连锁距离,绘制高密度的遗传图谱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高通量测序领域常用名词解释大全什么是高通量测序?高通量测序技术(High-throughput sequencin,g HTS)是对传统Sanger测序(称为一代测序技术)革命性的改变, 一次对几十万到几百万条核酸分子进行序列测定, 因此在有些文献中称其为下一代测序技术(next generation sequencin,g NGS )足见其划时代的改变, 同时高通量测序使得对一个物种的转录组和基因组进行细致全貌的分析成为可能, 所以又被称为深度测序(Deep sequencing。
)什么是Sanger法测序(一代测序)Sanger法测序利用一种DNA 聚合酶来延伸结合在待定序列模板上的引物。
直到掺入一种链终止核苷酸为止。
每一次序列测定由一套四个单独的反应构成,每个反应含有所有四种脱氧核苷酸三磷酸(dNTP),并混入限量的一种不同的双脱氧核苷三磷酸(ddNTP)。
由于ddNTP 缺乏延伸所需要的3-OH 基团,使延长的寡聚核苷酸选择性地在G、A、T 或C 处终止。
终止点由反应中相应的双脱氧而定。
每一种dNTPs 和ddNTPs 的相对浓度可以调整,使反应得到一组长几百至几千碱基的链终止产物。
它们具有共同的起始点,但终止在不同的的核苷酸上,可通过高分辨率变性凝胶电泳分离大小不同的片段,凝胶处理后可用X-光胶片放射自显影或非同位素标记进行检测。
什么是基因组重测序(Genome Re-sequencin)g全基因组重测序是对基因组序列已知的个体进行基因组测序,并在个体或群体水平上进行差异性分析的方法。
随着基因组测序成本的不断降低,人类疾病的致病突变研究由外显子区域扩大到全基因组范围。
通过构建不同长度的插入片段文库和短序列、双末端测序相结合的策略进行高通量测序,实现在全基因组水平上检测疾病关联的常见、低频、甚至是罕见的突变位点,以及结构变异等,具有重大的科研和产业价值。
什么是de novo 测序de novo 测序也称为从头测序:其不需要任何现有的序列资料就可以对某个物种进行测序,利用生物信息学分析手段对序列进行拼接,组装,从而获得该物种的基因组图谱。
获得一个物种的全基因组序列是加快对此物种了解的重要捷径。
随着新一代测序技术的飞速发展,基因组测序所需的成本和时间较传统技术都大大降低,大规模基因组测序渐入佳境,基因组学研究也迎来新的发展契机和革命性突破。
利用新一代高通量、高效率测序技术以及强大的生物信息分析能力,可以高效、低成本地测定并分析所有生物的基因组序列。
测序名词关系图什么是fragmentsfragments 就是打成的片段,而测序测的就是这些fragments,测出来的结果就是reads,又可以分为单端侧和双端侧,单端测序的话,只是从fragments的一端测序,测多长read就多长,双端测序就是从一个fragments的两端测,就会得出两个reads什么是Reads高通量测序平台产生的序列就称为reads。
(测序读到的碱基序列片段,测序的最小单位;)什么是Contig拼接软件基于reads之间的overlap 区,拼接获得的序列称为Contig(重叠群)。
(由reads通过对overlap区域拼接组装成的没有gap的序列段;)什么是Contig N50Reads拼接后会获得一些不同长度的Contigs。
将所有的Contig 长度相加,能获得一个Contig 总长度。
然后将所有的Contigs 按照从长到短进行排序,如获得Contig 1,Contig 2,Contig 3... Contig 25。
将Contig 按照这个顺序依次相加,当相加的长度达到Contig 总长度的一半时,最后一个加上的Contig 长度即为Contig N50。
举例:Contig 1+Contig 2+ Contig 3 +Contig 4=Contig 总长度*1/2 时,Contig 4 的长度即为Contig N50。
Contig N50 可以作为基因组拼接的结果好坏的一个判断标准。
什么是Scaffold基因组de novo 测序(没有参考基因组的测序,需要研究人员从头拼接得到的序列),通过reads拼接获得Contigs后,往往还需要构建454 Paired-end库或Illumina Mate-pair库,以获得一定大小片段(如3Kb、6Kb 、10Kb、20Kb)两端的序列。
基于这些序列,可以确定一些Contig 之间的顺序关系,这些先后顺序已知的Contigs 组成Scaffold。
(通过pair ends信息确定出的contig 排列,中间有gap)什么是Scaffold N50Scaffold N50与Contig N50 的定义类似。
Contigs 拼接组装获得一些不同长度的Scaffolds。
将所有的Scaffold长度相加,能获得一个Scaffold总长度。
然后将所有的Scaffolds按照从长到短进行排序,如获得Scaffold 1,Scaffold 2,Scaffold 3... Scaffold 25。
将Scaffold按照这个顺序依次相加,当相加的长度达到Scaffold总长度的一半时,最后一个加上的Scaffold长度即为Scaffold N50。
举例:Scaffold 1+Scaffold 2+ Scaffold 3 +Scaffold 4 +Scaffold 5=Scaffold总长度*1/2 时,Scaffold 5的长度即为Scaffold N50。
Scaffold N50可以作为基因组拼接的结果好坏的一个判断标准。
什么是测序深度和覆盖度测序深度:是指测序得到的总碱基数与待测基因组大小的比值。
假设一个基因大小为2M,测序深度为10X,那么获得的总数据量为20M。
覆盖度:是指测序获得的序列占整个基因组的比例。
Gap:由于基因组中的高GC、重复序列等复杂结构的存在,测序最终拼接组装获得的序列往往无法覆盖有所的区域,这部分没有获得的区域就称为。
例如一个细菌基因组测序,覆盖度是98%,那么还有2%的序列区域是没有通过测序获得的。
什么是RPKM、FPKMRPKM,Reads Per Kilobase of exon model per Million mapped reads, is defined in thisway [Mortazavi etal., 2008]:每1 百万个map 上的reads中map 到外显子的每1K 个碱基上的reads个数。
假如有1 百万个reads映射到了人的基因组上,那么具体到每个外显子呢,有多少映射上了呢,而外显子的长度不一,那么每1K 个碱基上又有多少reads映射上了呢,这大概就是这个RPKM 的直观解释。
如果对应特定基因的话,那么就是每1000000 mapped到该基因上的reads中每kb有多少是mapped到该基因上的exon 的readTotal exon reads:This is the number in the column with header Total exonreads in the row for the gene. This is the number of reads that have beenmapped to a region in which an exon is annotated for the gene or across theboundaries of two exons or an intron and an exon for an annotated transcript ofthe gene. For eukaryotes, exons and their internal relationships are defined byannotations of type mRN映A.射到外显子上总的reads个数。
这个是映射到某个区域上的reads个数,这个区域或者是已知注释的基因或者跨两个外显子的边界或者是某个基因已经注释的转录本的内含子、外显子。
对于真核生物来说,外显子和它们自己内部的关系由某类型的mRNA 来注释。
Exonlength: This is the number in the column with the header Exon length inthe rowfor the gene, divided by 1000. This is calculated as the sum of thelengths of all exons annotated for the gene. Each exon is included only once inthis sum, even if it is present in more annotated transcripts for the gene.Partly overlapping exons will count with their full length, even though theyshare the same regi外o n显. 子的长度。
计算时,计算所有某个基因已注释的所有外显子长度的总和。
即使某个基因以多种注释的转录本呈现,这个外显子在求和时只被包含一次。
即使部分重叠的外显子共享相同的区域,重叠的外显子以其总长来计算。
Mapped reads: The sum of all the numbers in the column with header Totalgene reads. The Total gene reads for a gene is the total number ofreads that after mapping have been mapped to the region of the gene. Thus thisincludes all the reads uniquely mapped to the region of the gene as well asthose of the reads which match in more places (below the limit set in thedialog in figure 18.110) that have been allocated tothis gene's region. A gene's region is that comprised of the flanking regions(if it was specified in figure 18.110), the exons, the introns andacross exon-exon boundaries of all transcripts annotated for the gene. Thus,the sum of the total gene reads numbers is the number of mapped reads for thesample (you can find the number in the RNA-Seq report).ma的p reads总和。
