初中化学方程式汇总(整理)
初中必须掌握的化学方程式90条

2KMnO4=△K2MnO4+MnO2+O2↑2H2O2=MnO22H2O+O2↑2KClO3=△MnO22KCl+3O2↑CaCO3+2HCl=CaCl2+H2O+CO2↑Zn+H2SO4=ZnSO4+H2↑4P+5O2=点燃2P2O5S+O2=点燃SO24Al+3O2=2Al2O33Fe+2O2=点燃Fe3O42Cu+O2=△2CuO2Mg+O2=点燃2MgO2Hg+O2=△2HgO2H2+O2=点燃2H2OS+O2=点燃SO22CO+O2=点燃2CO2C+O2(充足)=点燃CO22C+O2(不充足)=点燃2CO2HgO=△2Hg+O2↑CH4+2O2=点燃CO2+2H2O 252点燃22实验室制取气体有氧气参加的反应H2CO3=H2O+CO2↑NH4HCO3=△NH3↑+H2O+CO2↑2HgO=△2Hg+O2↑Cu2(OH)2CO3=△2CuO+H2O+CO2↑CaCO3=高温CaO+CO2↑2H2O=通电2H2↑+O2↑Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Mg+2HCl=MgCl2+H2↑2Al+6HCl=2AlCl3+3H2↑2Al+3CuSO4=Al2(SO4)3+3Cu Fe+CuSO4=FeSO4+Cu Zn+CuSO4=ZnSO4+Cu Cu+Hg(NO3)2=Cu(NO3)2+Hg Cu+2AgNO3=Cu(NO3)2+2AgCO2+C=高温2CO3CO+Fe2O3=高温2Fe+3CO24CO+Fe3O4=高温3Fe+4CO2分解反应金属与酸反应置换反应还原反应3C+2Fe 2O 3=高温4Fe+3CO 2↑ 2C+Fe 3O 4=高温3Fe+2CO 2↑ Fe 2O 3+3H 2=△2Fe+3H 2O Fe 3O 4+4H 2=△3Fe+4H 2O 2CuO+C =高温2Cu+CO 2↑ CuO+CO =△Cu+CO 2CuO+H 2=△Cu+H 2O 2Al+Fe 2O 3=高温2Fe+Al 2O 3 2Mg+CO 2=点燃2MgO+C 4Na+3CO 2=点燃2Na 2CO 3+C Fe 2O 3+6HCl =2FeCl 3+3H 2O Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O CuO+2HCl =CuCl 2+H2O CuO+H 2SO 4=CuSO 4+H 2O MgO+H 2SO 4=MgSO 4+H 2O MgO+2HCl =MgCl 2+H 2O CaO+2HCl =CaCl 2+H 2O CaO+H 2SO 4=CaSO 4↓+H 2O CO 2+H 2O =H 2CO 3 2Na+2H 2O =2NaOH+H 2↑ CaO+H 2O =Ca(OH)2 Na 2O+H 2O =2NaOH SO 3+H 2O =H 2SO 4 氧化物与酸反应 还原反应与水化合CuSO4+5H2O=CuSO4·5H2O CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 H2SO4+2NaOH=Na2SO4+2H2O H2SO4+2KOH=K2SO4+2H2OH2SO4+Cu(OH)2=CuSO4+2H2O 3H2SO4+2Fe(OH)3=Fe2(SO4)3+6H2OHNO 3+NaOH=NaNO3+H2O CaCO3+2HCl=CaCl2+H2O+CO2↑Na2CO3+2HCl=2NaCl+H2O+CO2 AgNO3+HCl=AgCl↓+HNO3Na2CO3+H2SO4=Na2SO4+H2O+CO2↑Na2CO3+Ca(OH)2=CaCO3↓+2NaOH3NaOH+FeCl3=Fe(OH)3↓+3NaCl NaCl+AgNO3=AgCl↓+NaNO32NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+CO2=CaCO3↓+H2OCa(OH)2+SO2=CaSO3↓+H2OHCl+NaOH=NaCl+H2OHCl+KOH=KCl+H2O2HCl+Cu(OH)2=CuCl2+2H2O2HCl+Ca(OH)2=CaCl2+2H2O3HCl+Fe(OH)3=FeCl3+3H2O3HCl+Al(OH)3=AlCl3+3H2O其它酸碱盐反应。
初中化学方程式大全(整理打印版)

初中化学方程式大全(整理打印版) 化学方程式:一、氧气的性质1.制取氧气:a。
在过氧化氢溶液中加入二氧化锰:2H2O2 + MnO2 → 2H2O + O2↑b。
用氯酸钾制氧气:2KClO3 → 2KCl + 3O2↑c。
加热高锰酸钾:2KMnO4 → K2MnO4 + MnO2 + 3O2↑2.单质与氧气的反应(化合反应):a。
氢气在空气中燃烧:2H2 + O2 → 2H2Ob。
硫在空气中燃烧:S + O2 → SO2c。
磷在空气中燃烧:4P + 5O2 → 2P2O5d。
铁在氧气中燃烧:3Fe + 2O2 → Fe3O4e。
铜在空气中受热:2Cu + O2 → 2CuOf。
铝耐腐蚀的原因:4Al + 3O2 → 2Al2O33.化合物与氧气反应:a。
红磷燃烧:4P2O5 + 10O2 → P4O10↑b。
氧化铁剧烈燃烧:4Fe3O4 + 3O2 → 6Fe2O3↑c。
氧化铜变成黑色:2CuO + C → 2Cu + CO2↑二、自然界中的水1.水在直流电的作用下分解:2H2O → 2H2↑ + O2↑2.制取氢气:Zn + H2SO4 → ZnSO4 + H2↑ 或 Zn + 2HCl → ZnCl2 + H2↑(无稀硫酸才用)3.生石灰与水反应:CaO + H2O → Ca(OH)2三、质量守恒定律1.铁与硫酸铜溶液反应:Fe + CuSO4 → Cu + FeSO42.用氢气还原氧化铜:H2 + CuO → Cu + H2O四、碳和碳的氧化物1.碳的化学性质:a。
碳在空气充分中燃烧:C + O2 → CO2b。
碳在空气不充分中燃烧:2C + O2 → 2COc。
木炭还原氧化铜:C + 2CuO → 2Cu + CO2↑d。
焦炭还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑e。
焦炭还原四氧化三铁:2C + Fe3O4 → 3Fe + 2CO2↑2.二氧化碳的制取和性质:a。
初中全部化学方程式汇总

初中全部化学方程式汇总1、氧化铝:2Al+3O2→2Al2O32、氧化钠:2Na+O2→2Na2O3、氧化钙:Ca+O2→CaO4、氯化钠的生成:2Na+Cl2→2NaCl5、氯化钾的生成:2K+Cl2→2KCl6、碳酸钠的生成:Na2CO3+HCl→2NaCl+H2O+CO27、氢氧化钾的生成:2K+2H2O+O2→2KOH+H28、硝酸钾的生成:2KCl+HNO3→KNO3+2HCl9、氰化钾的生成:2KCl+H2O2→KOH+Cl2+H2O10、氯化氢的生成:H2+Cl2→2HCl11、二氧化碳的生成:C+O2→CO212、氢氧化钠的生成:2Na+2H2O→2NaOH+H213、硫酸钠的生成:2Na+S+O2→Na2SO414、硝酸铵的生成:2NH4Cl+HNO3→2NH4NO3+2HCl15、氯氢氧盐的生成:NaCl+AgNO3→AgCl+NaNO316、硫酸铜的生成:2Cu+O2+2H2SO4→2CuSO4+2H2O17、硫酸银的生成:3Ag+H2SO4→3AgHSO418、氢氟酸的生成:HF+H2O→H3O+F19、硝酸铜的生成:Cu+4HNO3→Cu(NO3)2+2NO2+2H2O20、氢氧化钙的生成:2Ca+2H2O→2Ca(OH)2+H221、硫酸镁的生成:2Mg+O2+2H2SO4→2MgSO4+2H2O22、氯化钾的溶解:2KCl+2H2O→2KOH+HCl+H223、铝酸铁的溶解:Fe3O4+4Al→4Fe+4AlO224、氯化钠的溶解:NaCl+H2O→HCl+NaOH25、硫酸银溶解:3AgHSO4+H2O→3Ag+H2SO426、硝酸钙的溶解:Ca(NO3)2+H2O→Ca(OH)2+2H NO327、硝酸锌的溶解:Zn(NO3)2+H2O→Zn(OH)2+2HNO328、硝酸钠的溶解:NaNO3+H2O→NaOH+HNO329、二氧化硅的溶解:SiO2+2HCl→2H2O+SiCl4。
初中必背化学方程式汇总(最全)整理

初中必背化学方程式汇总(最全)整理学校必背化学方程式汇总(最全)中学的阶段中,学校生要想学好化学,总是免不得要娴熟的把握化学方程式,为了便利大家学习借鉴,下面我细心预备了学校必背化学方程式汇总内容,欢迎使用学习!学校必背化学方程式汇总1化合反应1、镁在空气中燃烧:2Mg + O2 点燃2MgO现象:(1)发出刺眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O4现象:(1)猛烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体留意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
4、铜在空气中受热:2Cu + O2 △ 2CuO现象:铜丝变黑。
6、铝在空气中燃烧:4Al + 3O2 点燃2Al2O3 现象:发出刺眼的白光,放热,有白色固体生成。
7、氢气中空气中燃烧:2H2 + O2 点燃2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁消失水雾。
8、红(白)磷在空气中燃烧:4P + 5O2 点燃2P2O5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧:S + O2 点燃SO2现象:A、在纯的氧气中发出光明的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
10、碳在氧气中充分燃烧:C + O2 点燃CO2 现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊2复分解反应1、碱性氧化物+酸→盐+H2O Fe2O3+6HCl==2FeCl3+3H2O;Fe2O3+3H2SO4==Fe2(SO4)3+3H2O;CuO+H2SO4==CuSO4+H2O;ZnO+2HNO3==Zn(NO3)3+H2O;2、碱+酸→盐+H2O Cu(OH)2+2HCl==CuCl2+2H2OCu(OH)2+H2SO4==CuSO4+2H2O;NaOH+HCl==NaCl+H2O;2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O;Mg(OH)2+2HNO3==Mg(NO3)2+2H2O; Ba(OH)2+H2SO4==BaSO4↓+2H2O33、酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑Na2CO3+2HCl==2NaCl+H2O+CO 2↑ HCl+AgNO3==AgCl↓+HNO3;H2SO4+BaCl2==BaSO4↓+2HCl;Ba(NO3)2+H2SO4==BaSO4↓+2HNO3NaHCO3+HCl==NaCl+H2O+C O2↑其它反应:1、二氧化碳通入澄清石灰水:CO2+Ca(OH)2==CaCO3↓+ H20现象:澄清石灰水变浑浊。
初中必背100个化学方程式

初中必背100个化学方程式化学方程式是学习化学的重要工具,它能够简洁明了地表达化学反应的本质。
对于初中生来说,掌握一些常见的化学方程式是学好化学的基础。
以下为大家整理了初中必背的 100 个化学方程式。
一、氧气的性质1、镁在空气中燃烧:2Mg + O₂点燃 2MgO现象:发出耀眼的白光,生成白色固体。
2、铁在氧气中燃烧:3Fe + 2O₂点燃 Fe₃O₄现象:剧烈燃烧,火星四射,生成黑色固体。
3、铜在空气中受热:2Cu + O₂加热 2CuO现象:红色固体变黑。
4、铝在空气中燃烧:4Al + 3O₂点燃 2Al₂O₃现象:发出耀眼的白光,生成白色固体。
5、氢气在空气中燃烧:2H₂+ O₂点燃 2H₂O现象:产生淡蓝色火焰,放出热量。
6、红磷在空气中燃烧:4P + 5O₂点燃 2P₂O₅现象:产生大量白烟,放出热量。
7、硫粉在空气中燃烧: S + O₂点燃 SO₂现象:在空气中发出淡蓝色火焰,在氧气中发出蓝紫色火焰,生成有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O₂点燃 CO₂现象:发出白光,放出热量。
9、碳在氧气中不充分燃烧:2C + O₂点燃 2CO二、制取氧气10、过氧化氢在二氧化锰催化下分解:2H₂O₂二氧化锰 2H₂O +O₂↑现象:有气泡产生,带火星的木条复燃。
11、加热氯酸钾(有少量的二氧化锰):2KClO₃二氧化锰、加热2KCl + 3O₂ ↑12、加热高锰酸钾:2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑三、水的相关反应13、水在直流电的作用下分解:2H₂O 通电 2H₂↑ + O₂ ↑14、生石灰和水反应:CaO + H₂O = Ca(OH)₂现象:放出大量的热。
四、碳和碳的氧化物15、碳还原氧化铜:C + 2CuO 高温 2Cu + CO₂↑现象:黑色粉末逐渐变成红色,产生的气体能使澄清石灰水变浑浊。
16、碳还原氧化铁:3C + 2Fe₂O₃高温 4Fe + 3CO₂↑17、二氧化碳通过灼热的碳层:CO₂+ C 高温 2CO18、一氧化碳在氧气中燃烧:2CO + O₂点燃 2CO₂19、二氧化碳和水反应:CO₂+ H₂O = H₂CO₃现象:二氧化碳通入紫色石蕊试液,溶液变红。
初中必背化学方程式汇总(最全)

初中必背化学方程式汇总(最全)下面是初中化学方程式的汇总:1.酸碱中和反应方程式:酸+碱→盐+水例如:HCl+NaOH→NaCl+H₂O2.金属与非金属氧化物的反应方程式:金属+氧气→金属氧化物例如:2Na+O₂→2Na₂O3.酸与金属的反应方程式:酸+金属→盐+氢气例如:2HCl+Zn→ZnCl₂+H₂4.金属与酸的反应方程式:金属+酸→盐+氢气例如:Mg+2HCl→MgCl₂+H₂5.非金属与氧气的反应方程式:非金属+氧气→非金属氧化物例如:C+O₂→CO₂6.金属与非金属的氧化还原反应方程式:金属+非金属氧化物→盐+水例如:Na+Cl₂O→NaCl+H₂O7.非金属与酸的反应方程式:非金属+酸→氧化物+水例如:2H₂SO₃+C→CO₂+2H₂O8.金属与非金属的酸碱中和反应方程式:金属氢氧化物+酸→盐+水例如:NaOH+HCl→NaCl+H₂O9.酸与酸碱指示剂的反应方程式:酸+碱性指示剂→锥色盐例如:HCl+NaOH+碱性指示剂→NaCl+H₂O+锥色盐10.非金属氧化物和水的反应方程式:非金属氧化物+水→酸例如:SO₃+H₂O→H₂SO₄11.非金属酸与金属碱的反应方程式:非金属酸+金属氢氧化物→盐+水例如:HCl+NaOH→NaCl+H₂O12.碱与金属氧化物的反应方程式:碱+金属氧化物→锹色盐+水例如:KOHa+CuO→Cu(OH)₂+K₂O13.铜与稀硫酸反应的反应方程式:Cu+H₂SO₄→CuSO₄+H₂14.金属与水的反应方程式:金属+水→金属氢氧化物+氢气例如:2Na+2H₂O→2NaOH+H₂15.铁与酸的反应方程式:Fe+2HCl→FeCl₂+H₂16.铁与水蒸气的反应方程式:3Fe+4H₂O→Fe₃O₄+4H₂17.碳酸氢盐分解反应方程式:碳酸氢盐→二氧化碳+水+相应金属氧化物例如:NaHCO₃→CO₂+H₂O+Na₂O18.金属氢氧化物分解反应方程式:金属氢氧化物→金属氧化物+水例如:Ca(OH)₂→CaO+H₂O以上是初中化学方程式的汇总,涵盖了酸碱中和、金属与非金属氧化物的反应、金属与酸的反应、非金属与氧气的反应、金属与非金属的氧化还原反应等常见反应类型。
初中常见50个化学方程式

初中常见50个化学方程式1、2H₂+ O₂→2H₂O(氢气与氧气生成水)2、2Na + Cl₂→2NaCl(钠与氯气生成氯化钠)3CH₄+ 2O₂→CO₂+ 2H₂O(甲烷燃烧生成二氧化碳和水)4、CaCO₃→CaO + CO₂(碳酸钙分解生成氧化钙和二氧化碳)5、HCl + NaOH →NaCl + H₂O(盐酸与氢氧化钠中和生成氯化钠和水)6、Fe + S →FeS(铁与硫化合生成硫化铁)7、2H₂O →2H₂+ O₂(水分解生成氢气和氧气)8、CuSO₄+ Zn →ZnSO₄+ Cu(硫酸铜与锌反应生成硫酸锌和铜)9、C₃H₈+ 5O₂→3CO₂+ 4H₂O(丙烷燃烧生成二氧化碳和水)10、2AgNO₃+ Cu →2Ag + Cu(NO₃)₂(硝酸银与铜反应生成银和硝酸铜)11、2Na + 2H₂O →2NaOH + H₂(钠与水反应生成氢氧化钠和氢气)12、Fe + CuSO₄→FeSO₄+ Cu(铁与硫酸铜反应生成硫酸亚铁和铜)13、H₂SO₄+ 2NaOH →Na₂SO₄+ 2H₂O(硫酸与氢氧化钠中和生成硫酸钠和水)14、Zn + 2HCl →ZnCl₂+ H₂(锌与盐酸反应生成氯化锌和氢气)15、Ca(OH)₂+ 2HCl →CaCl₂+ 2H₂O(氢氧化钙与盐酸反应生成氯化钙和水)16、2Mg + O₂→2MgO(镁与氧气反应生成氧化镁)17、C + O₂→CO₂(碳与氧气反应生成二氧化碳)18、2Al + 6HCl →2AlCl₃+ 3H₂(铝与盐酸反应生成氯化铝和氢气)19、2NaHCO₃→Na₂CO₃+ CO₂+ H₂O(碱式碳酸氢钠分解生成碳酸钠、二氧化碳和水)20、2K + 2H₂O →2KOH + H₂(钾与水反应生成氢氧化钾和氢气)21、2HCl + Ca(OH)₂→CaCl₂+ 2H₂O(盐酸与氢氧化钙反应生成氯化钙和水)22、2Na + 2H₂O →2NaOH + H₂(钠与水反应生成氢氧化钠和氢气)23、CH₃COOH + NaHCO₃→CH₃COONa + CO₂+ H₂O(醋酸与碱式碳酸氢钠反应生成乙酸钠、二氧化碳和水)24、H₂O + CO₂→H₂CO₃(二氧化碳溶解在水中生成碳酸)25、CuO + H₂→Cu + H₂O(氧化亚铜与氢气反应生成铜和水)26、2HgO →2Hg + O₂(氧化汞分解生成汞和氧气)27、4Fe + 3O₂→2Fe₂O₃(铁与氧气反应生成氧化铁)28、2H₂O₂→2H₂O + O₂(过氧化氢分解生成水和氧气)29、Ca + 2H₂O →Ca(OH)₂+ H₂(钙与水反应生成氢氧化钙和氢气)30、2AgNO₃+ Na₂S →Ag₂S + 2NaNO₃(硝酸银与硫化钠反应生成硫化银和硝酸钠)31、Al + Cl₂→AlCl₃(铝与氯气反应生成氯化铝)32、C₃H₈+ 5O₂→3CO₂+ 4H₂O(丙烷燃烧生成二氧化碳和水)33、2HNO₃+ Ba(OH)₂→Ba(NO₃)₂+ 2H₂O(硝酸与氢氧化钡反应生成硝酸钡和水)34、Zn + H₂SO₄→ZnSO₄+ H₂(锌与硫酸反应生成硫酸锌和氢气)35、2Mg + 2HCl →MgCl₂+ H₂(镁与盐酸反应生成氯化镁和氢气)36、2C₄H₁₀+ 13O₂→8CO₂+ 10H₂O(戊烷燃烧生成二氧化碳和水)37、Na₂O + H₂O →2NaOH(氧化钠与水反应生成氢氧化钠)38、CaO + H₂O →Ca(OH)₂(氧化钙与水反应生成氢氧化钙)39、2Fe + 3Cl₂→2FeCl₃(铁与氯气反应生成氯化铁)40、NH₃+ HCl →NH₄Cl(氨气与盐酸反应生成氯化铵)41、Mg + 2H₂O →Mg(OH)₂+ H₂(镁与水反应生成氢氧化镁和氢气)42、C₂H₅OH + O₂→CO₂+ H₂O(乙醇燃烧生成二氧化碳和水)43、2Ag + S →Ag₂S(银与硫反应生成硫化银)44、2Al + 3CuCl₂→2AlCl₃+ 3Cu(铝与氯化亚铜反应生成氯化铝和铜)45、2NH₄NO₃→2N₂+ 4H₂O + O₂(硝酸铵分解生成氮气、水和氧气)46、KClO₃→KCl + O₂(高氯酸钾分解生成氯化钾和氧气)47、C₆H₁₂O₆→2C₂H₅OH + 2CO₂(葡萄糖发酵生成乙醇和二氧化碳)48、Ca + 2HCl →CaCl₂+ H₂(钙与盐酸反应生成氯化钙和氢气)49、2H₂O + O₂→2H₂O₂(水和氧气反应生成过氧化氢)50、4NH₃+ 5O₂→4NO + 6H₂O(氨气与氧气反应生成一氧化氮和水)。
初中化学方程式大全
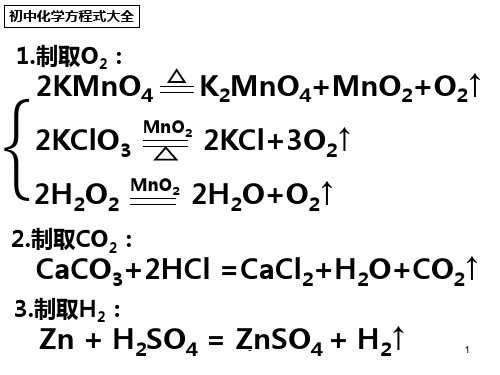
等等。。。
-
13
15、碱与铵盐反应: Ca(OH)2+2NH4Cl =CaCl2+2NH3↑+2H2O
Ca(OH)2+2NH4NO3=Ca(NO3)2+2NH3↑+2H2O
Ca(OH)2+(NH4)2SO4 =CaSO4+2NH3↑+2H2O Ca(OH)2+(NH4)2CO3 =CaCO3+2NH3↑+2H2O
7、还原反应:(C、CO、H2具有还原性)
Fe2O3+3CO 高温 2Fe +3CO2 (炼铁原理)
2Fe2O3+3C 高温 4Fe +3CO2 Fe2O3+3H2 高温 2Fe +3H2O
CuO+CO △ Cu +CO2 CuO+H2 △ Cu +H2O
2CuO+C 高温 2Cu +CO2 (两种黑色固体反
-
7
活泼金属与稀盐酸或稀硫酸的反应:
Mg+2HCl =MgCl2+H2↑
Zn+2HCl =ZnCl2+H2↑ Fe+2HCl =FeCl2+H2↑ 2Al+6HCl =2AlCl3+3H2↑ Mg+H2SO4 =MgSO4 +H2↑ Zn+H2SO4 =ZnSO4 +H2↑ Fe+H2SO4 =FeSO4 +H2↑ 2Al+3H2SO4 =Al-2(SO4)3+3H2↑ 8
-பைடு நூலகம்
10
(完整版)初中所有化学方程式总汇

初中化学方程式总汇一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O43. 铜在空气中受热:2Cu + O2=加热= 2CuO4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O35. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O57. 硫粉在空气中燃烧: S + O2 =点燃= SO28. 碳在氧气中充分燃烧:C + O2=点燃= CO29. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO211. 甲烷在空气中燃烧:CH4 + 2O2=点燃=CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO =加热= Hg+ O2↑14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 (MnO2催化剂)=2H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O =通电= 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 =点燃= CO224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3=高温= 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 =点燃= CO227.煤炉的中层:CO2 + C =高温= 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO235.一氧化碳的可燃性:2CO + O2 =点燃= 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO41.铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O442. 铜在空气中受热:2Cu + O2 =加热=2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (4)金属铁的治炼原理:55.3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ (3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
九年级所有化学方程式总汇全

九年级所有化学方程式总汇全一、化学反应类型1. 置换反应金属置换反应:例如,铁与硫酸铜反应硫酸亚铁和铜。
Fe + CuSO₄ → FeSO₄ + Cu非金属置换反应:例如,氯气与溴化钠反应氯化钠和溴。
Cl₂ + 2NaBr → 2NaCl + Br₂2. 复分解反应中和反应:例如,氢氧化钠与盐酸反应氯化钠和水。
NaOH + HCl → NaCl + H₂O盐与盐的反应:例如,硫酸钠与氯化钡反应硫酸钡和氯化钠。
Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl3. 分解反应热分解:例如,碳酸钙在高温下分解氧化钙和二氧化碳。
CaCO₃ → CaO + CO₂↑光解:例如,氯酸钾在光照下分解氯化钾和氧气。
2KClO₃ → 2KCl + 3O₂↑4. 合成反应燃烧反应:例如,碳与氧气反应二氧化碳。
C + O₂ → CO₂氢化反应:例如,氮气与氢气反应氨气。
N₂ + 3H₂ → 2NH₃二、化学方程式实例1. 氢气与氧气反应水2H₂ + O₂ → 2H₂O2. 铁与硫酸铜反应硫酸亚铁和铜Fe + CuSO₄ → FeSO₄ + Cu3. 氢氧化钠与盐酸反应氯化钠和水NaOH + HCl → NaCl + H₂O4. 碳酸钙在高温下分解氧化钙和二氧化碳 CaCO₃ → CaO + CO₂↑5. 氯酸钾在光照下分解氯化钾和氧气2KClO₃ → 2KCl + 3O₂↑6. 氮气与氢气反应氨气N₂ + 3H₂ → 2NH₃7. 碳与氧气反应二氧化碳C + O₂ → CO₂8. 氯气与溴化钠反应氯化钠和溴Cl₂ + 2NaBr → 2NaCl + Br₂9. 硫酸钠与氯化钡反应硫酸钡和氯化钠 Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl 10. 氢气与氯气反应氯化氢H₂ + Cl₂ → 2HCl九年级所有化学方程式总汇全三、氧化还原反应1. 氧化反应例如,铁在氧气中燃烧四氧化三铁。
3Fe + 2O₂ → Fe₃O₄2. 还原反应例如,氧化铜在氢气中还原铜和水。
初中化学方程式汇总(整理)

初中化学方程式汇总(整理)(一)氧化还原反应1.铜与硫酸溶液反应Cu+S2O3(2-──>Cu2++SO422.氢氧化钠与硝酸反应NaOH+HNO3──>NaNO3+H2O3.硫酸铜与氢氧化铝反应CuSO4+2Al(OH)3──>Al2(SO4)3+2Cu(OH)24.铝与稀硫酸反应2Al+3H2SO4──>Al2(SO4)3+3H25.激发氢氧化钠反应2NaOH+2H2O2──>2NaOH+O26.氢氧化钾与过氧化氢反应KOH+H2O2──>K2O+2H2O7.氯水与过氧化氢反应HCl+H2O2──>HClO+H2O8.铜与溴水反应Cu+Br2──>CuBr29.铜与溴酸反应Cu+HBr──>CuBr2+H210.过氧化钠与硝酸反应Na2O2+HNO3──>NaNO3+H2O11.铝与稀盐酸反应2Al+6HCl──>2AlCl3+3H212.钙与醋酸反应Ca+HC2H3O2──>Ca(C2H3O2)2+H2 13.铝粉与硫酸反应Al+H2SO4──>Al2(SO4)3+2H214.氢氧化钠与过氧化氢反应2NaOH+H2O2──>Na2O2+2H2O (二)沉淀反应1.氯化钠与铜粉反应Cu+2NaCl──>CuCl2+2Na2.硫酸铵与氢氧化铜反应NH4HSO4+Cu(OH)2──>CuSO4+NH4OH 3.氯化钙与氯化钠反应CaCl2+2NaCl──>CaCl2•2NaCl+2Na 4.氯化钠与氯化钙反应NaCl+CaCl2──>CaCl2•2NaCl+2Na 5.铝与氯化钠溶液反应2Al+6NaCl──>2Na3AlF6+3H26.氢氧化铝与铁粉反应2Al(OH)3+3Fe──>Fe2O3+6H2O 7.硫酸铜与氢氧化钠反应CuSO4+2NaOH──>Cu(OH)2+Na2SO4 8.硫酸锡与氢氧化钠反应。
(完整版)初中化学方程式大全

初中化学知识总结(化学方程式) 一、化合反应1、镁在空气中燃烧:2Mg + O 2 ==2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末 2、铁在氧气中燃烧:3Fe + 2O 2 ====Fe 3O 4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体 注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底. 4、铜在空气中受热:2Cu + O 2 ==== 2CuO 现象:铜丝变黑. 6、铝在空气中燃烧:4Al + 3O 2 ====2Al 2O 3 现象:发出耀眼的白光,放热,有白色固体生成.7、氢气中空气中燃烧:2H 2 + O 2 === 2H 2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾. 8、红(白)磷在空气中燃烧:4P + 5O 2==== 2P 2O 5 现象:(1)发出白光(2)放出热量(3)生成大量白烟。
9、硫粉在空气中燃烧: S + O 2 ===SO 2现象:A 、在纯的氧气中 发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体. B 、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体. 10、碳在氧气中充分燃烧:C + O 2 === CO 2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊 11、碳在氧气中不充分燃烧:2C + O 2 === 2CO12、二氧化碳通过灼热碳层: C + CO 2 ==== 2CO(是吸热的反应) 点燃点燃点燃点燃△点燃点燃点燃 点燃高温13、一氧化碳在氧气中燃烧:2CO + O 2 ==== 2CO 2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊. 14、二氧化碳和水反应(二氧化碳通入紫色石蕊试液): CO 2 + H 2O === H 2CO 3 现象:石蕊试液由紫色变成红色。
注意: 酸性氧化物+水→酸如:SO 2 + H 2O === H 2SO 3 SO 3 + H 2O === H 2SO 415、生石灰溶于水:CaO + H 2O === Ca (OH)2(此反应放出热量) 注意: 碱性氧化物+水→碱氧化钠溶于水:Na 2O + H 2O =2NaOH 氧化钾溶于水:K 2O + H 2O =2KOH氧化钡溶于水:BaO + H 2O ==== Ba (OH )216、钠在氯气中燃烧:2Na + Cl 2===2NaCl17、无水硫酸铜作干燥剂:CuSO 4 + 5H 2O ==== CuSO 4•5H 2O 二、分解反应:17、水在直流电的作用下分2H 2O =====2H 2↑+ O 2 ↑ 现象:(1)电极上有气泡产生.H 2:O 2=2:1 正极产生的气体能使带火星的木条复燃.负极产生的气体能在空气中燃烧,产生淡蓝色火焰18、加热碱式碳酸铜:Cu 2(OH)2CO 3 ===== 2CuO + H 2O + CO 2↑ 现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。
(完整版)初中化学方程式汇总(整理)

初中化学方程式汇总、基本反应类型(一)、化合反应2Mg + O2 点燃2MgO3Fe + 202 Fe3O44Al + 30 2 2A12O32H2 + O2 些2H2O4P + 5O2 点燃2P2O5S + O2 SO2C + O2 CO22C + O2 点燃2COC + CO2 2CO 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液)12、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO 4 5H2O14、钠在氯气中燃烧:2Na + Cl2 座夏2NaCl15、氧化钠溶于水:Na2O + H2O === 2NaOH16、三氧化硫溶于水:SO3 + H2O === H 2SO4(二)、分解反应17、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +。
2,18、加热高镒酸钾:2KMnO4 △ K2MnO4 + MnO2 + O2 f19、水在直流电的作用下分解:2H2O 2H2f + O2 f20、碳酸不稳定而分解:H2CO3 H2O + CO2f21、高温燧烧石灰石(二氧化碳工业制法):CaCO3回!CaO + CO2?22、加热碱式碳酸铜:Cu2(OH)2CO3 △2CuO + H 2。
+ CO2T23、加热氯酸钾(有少量的二氧化猛):2KC1O 3 MnC_2和八2KC1 + 3O 2 f24、硫酸铜晶体受热分解:CuSO4 5H2O 八CuSO4 + 5H2O(三)、置换反应25、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 26、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 === ZnSO 4 + H2 f27、镁和稀盐酸反应: Mg + 2HC1 === MgCl 2 + H2 f28、氢气还原氧化铜:H2 + CuO Cu + H2O29、木炭还原氧化铜: C + 2CuO 2Cu + CO 2 f30、水蒸气通过灼热碳层:H2O + C 也L H2 + CO31、焦炭还原氧化铁:3C + 2Fe2O34Fe + 3CO2?(四)、复分解反应一32、盐酸和烧碱起反应:HCl + NaOH === NaCl + H 2O33、盐酸和氢氧化钾反应:HCl + KOH === KCl + H 2O34、盐酸和氢氧化铜反应:2HCl + Cu (OH) 2 === CuCl 2 + 2H2O35、盐酸和氢氧化钙反应:2HCl + Ca (OH) 2 === CaCl2 + 2H2O36、盐酸和氢氧化铁反应:3HCl + Fe(OH) 3 === FeCl 3 + 3H 2O37、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH) 3 === AlCl 3 + 3H2O38、硫酸和烧碱反应: H 2SO4 + 2NaOH === Na 2SO4 + 2H 2O39、硫酸和氢氧化钾反应:H2SO4 + 2KOH === K 2SO4 + 2H 2O40、硫酸和氢氧化铜反应:H2SO4 + Cu(OH) 2 === CuSO 4 + 2H 2O41、硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3 === Fe2(SO4)3 + 6H2O42、硝酸和烧碱反应:HNO3 + NaOH === NaNO 3+H2O43、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl 2 + H 2O + CO 2 f44、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H 2O + CO2 f45、碳酸镁与稀盐酸反应:MgCO 3 + 2HCl === MgCl 2 + H2O + CO2T46、盐酸和硝酸银溶液反应:HCl + AgNO 3 === AgCl $ + HNO47、硫酸和碳酸钠反应: Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2 f48、硫酸和氯化根溶液反应:H 2SO4 +BaCl 2 === BaSO 4 $ + 2HCl + CuSO 4=== Cu(OH) 2 $ + NOSO4+ FeCl 3 === Fe(OH) 3 $ + 3NaCl+ MgCl 2 === Mg(OH) 2 $ + 2NaCl+ CuCl 2 === Cu(OH) 2 $ + 2NaCl2 + Na2CO3 === CaCO3 $ + 2NaOH54、氯化钠溶液和硝酸银溶液:NaCl + AgNO 3 === AgCl $ + NaNO55、硫酸钠和氯化彻: Na2SO4 + BaCl 2 === BaSO 4 $ + 2NaCl1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧:10、一氧化碳在氧气中燃烧: 2CO + O2 2CO2:CO2 + H2O === H2CO349、氢氧化钠与硫酸铜:2NaOH50、氢氧化钠与氯化铁:3NaOH51、氢氧化钠与氯化镁:2NaOH52、氢氧化钠与氯化铜:2NaOH53、氢氧化钙与碳酸钠:Ca56、甲烷在空气中燃烧: CH4 + 2O2 CO2 + 2H2O(五)、其它2Mg + O2 点燃2MgO3Fe + 2O2 Fe3O42Cu + O2 2CuO4Al + 3O2 2Al2O32H2 + O2 2H2O4P + 5O2 点燃2P2O5 S + O2 SO28、碳在氧气中充分燃烧:C + O2CO29、碳在氧气中不充分燃烧:2C + O2点燃2CO(二)、化合物与氧气的反应3、镁和稀硫酸:Mg + H 2SO4 === MgSO 4 + H2 f4、铝和稀硫酸:2AI + 3H 2SO4 === Al 2(SO4)3 + 3H2 f5、锌和稀盐酸: Zn + 2HC1 === ZnCl 2 + H2 f6、铁和稀盐酸: Fe + 2HCl === FeCl 2 + H2 f7、镁和稀盐酸:Mg + 2HCl === MgCl 2 + H2T 8、铝和稀盐酸:2Al + 6HCl === 2AlCl 3 + 3H2?(二)、金属单质+盐(溶液)—另一种金属+另一种盐9、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu10、锌和硫酸铜溶液反应:Zn + CuSO 4=== ZnSO 4 + Cu11、铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO 3)2 + Hg(三)、碱性氧化物+酸K盐+水Fe2O3 + 6HCl === 2FeCl 3 + 3H 2OFe2O3 + 3H 2SO4 === Fe2(SO4)3 + 3H 2OCuO + 2HCl === CuCl 2 + H 2OCuO + H 2SO4 === CuSO4 + H 2OMgO + H 2SO4 === MgSO 4 + H2OCaO + 2HCl === CaCl 2 + H2O1、氢气还原氧化铜:H2 + CuO △ Cu + H 2。
初中化学方程式汇总(打印版)

初中化学方程式汇总(打印版) 初中化学方程式汇总一、物质与氧气的反应:1.镁在空气中燃烧:2Mg + O2 → 2MgO2.铁在氧气中燃烧:3Fe + 2O2 → Fe3O43.铜在空气中受热:2Cu + O2 → 2CuO4.铝在空气中燃烧:4Al + 3O2 → 2Al2O35.氢气中空气中燃烧:2H2 + O2 → 2H2O6.红磷在空气中燃烧:4P + 5O2 → 2P2O57.硫粉在空气中燃烧:S + O2 → SO28.碳在氧气中充分燃烧:C + O2 → CO29.碳在氧气中不充分燃烧:2C + O2 → 2CO2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 → 2CO211.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O二、几个分解反应:13.水在直流电的作用下分解:2H2O → 2H2↑+ O2↑14.加热碱式碳酸铜:Cu2(OH)2CO3 → 2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KCl O3MnO2 → 2KCl + 3O2↑16.加热高锰酸钾:2KMnO4 → K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 → H2O + CO2↑18.高温煅烧石灰石:CaCO3 → 高温CaO + CO2↑18-1.双氧水(过氧化氢)催化分解:2H2O2MnO2 →2H2O + O2↑三、几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO → Cu + H2O20.木炭还原氧化铜:C + 2CuO → 2Cu + CO2↑21.焦炭还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C + Fe3O4 → 3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO + CuO → Cu + CO2↑24.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 → BaSO4↓ + 2HCl。
初三常用化学方程式 100个

初三常用化学方程式1.氢气与氧气发生化合反应:2H2 + O2 → 2H2O2.镁与氧气发生化合反应:2Mg + O2 → 2MgO3.铁与氧气发生化合反应:3Fe + 2O2 → Fe3O44.碳与氧气发生化合反应:C + O2 → CO25.一氧化碳与氧气发生化合反应:2CO + O2 → 2CO26.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O7.乙醇在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O8.氢氧化钠与稀硫酸发生中和反应:NaOH + H2SO4 → Na2SO4 +H2O9.氢氧化钙与稀盐酸发生中和反应:Ca(OH)2 + 2HCl → CaCl2 +2H2O10.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O11.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O12.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH13.碳酸钙高温分解:CaCO3 → CaO + CO2↑14.氧化钙与水反应:CaO + H2O → Ca(OH)215.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO416.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl17.氯化钡与硫酸钠反应:BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl18.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO319.硫酸与氯化钡反应:H2SO4 + BaCl2 → BaSO4↓ + 2HCl20.硫酸与氢氧化钠反应:H2SO4 + 2NaOH → Na2SO4 + 2H2O21.氧化铁与盐酸反应:Fe2O3 + 6HCl → 2FeCl3 + 3H2O22.氧化铜与硫酸反应:CuO + H2SO4 → CuSO4 + H2O23.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O24.氢氧化钙与稀盐酸反应:Ca(OH)2 + 2HCl → CaCl2 + 2H2O25.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O26.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH27.氢氧化钠与氯化铁反应:3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl28.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O29.硝酸银与稀盐酸反应:AgNO3 + HCl → AgCl↓ + HNO330.硝酸银与稀氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO331.锌与稀硫酸反应:Zn + H2SO4 → ZnSO4 + H2↑32.镁与稀盐酸反应:Mg + 2HCl → MgCl2 + H2↑33.铝与稀硫酸反应:2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑34.铁与稀盐酸反应:Fe + 2HCl → FeCl2 + H2↑35.铜与硝酸银反应:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag36.铁与硫酸铜反应:Fe + CuSO4 → FeSO4 + Cu37.氧化钙与水反应:CaO + H2O → Ca(OH)238.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O39.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O40.二氧化碳与水反应:CO2 + H2O → H2CO341.氢气还原氧化铜:H2 + CuO → Cu + H2O42.碳还原氧化铜:C + 2CuO → 2Cu + CO2↑43.一氧化碳还原氧化铜:CO + CuO → Cu + CO244.碳还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑45.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO246.碳酸钙与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑47.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑48.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑49.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑50.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + H2O + CO2↑51.氨气与氯化氢反应:NH3 + HCl → NH4Cl52.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O53.氢氧化钠与氯化铵反应:NaOH + NH4Cl → NaCl + NH3↑ + H2O54.碳酸氢钠受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O55.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O56.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO357.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O58.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + CO2↑ +H2O59.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O60.硝酸与氢氧化铁反应:3HNO3 + Fe(OH)3 → Fe(NO3)3 + 3H2O61.氧化铁与氢气反应:Fe2O3 + 3H2 → 2Fe + 3H2O62.氧化铁与一氧化碳反应:Fe2O3 + 3CO → 2Fe + 3CO263.氧化铜与氢气反应:CuO + H2 → Cu + H2O64.氧化铜与一氧化碳反应:CuO + CO → Cu + CO265.氧化钙与水反应:CaO + H2O → Ca(OH)266.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O67.二氧化硫与水反应:SO2 + H2O → H2SO368.二氧化硫与氢氧化钠反应:SO2 + 2NaOH → Na2SO3 + H2O69.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO270.一氧化碳还原四氧化三铁:4CO + Fe3O4 → 3Fe + 4CO271.一氧化碳还原氧化铜:CO + CuO → Cu + CO272.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O73.水在直流电的作用下电解:2H2O → 2H2↑ + O2↑74.石灰石与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑75.小苏打受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O76.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑77.双氧水在二氧化锰催化下分解:H2O2 → H2O + O2↑78.氯酸钾在二氧化锰催化下分解:KClO3 → KCl + O2↑79.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO480.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl81.硝酸铵受热分解:NH4NO3 → N2O↑ + 2H2O82.硝酸钾受热分解:KNO3 → KNO2↑ + O2↑83.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O84.氢氧化钠与稀硫酸反应:NaOH + H2SO4 → Na2SO4 + 2H2O85.硫酸与氢氧化铜反应:H2SO4 + Cu(OH)2 → CuSO4 + 2H2O86.硫酸与氢氧化铁反应:Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O87.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO388.盐酸与碳酸钠反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑89.氯化钡与稀硫酸反应:BaCl2 + H2SO4 → BaSO4↓ + 2HCl90.硝酸与氢氧化钠反应:HNO3 + NaOH → NaNO3 + H2O91.氯化铵受热分解:NH4Cl → NH3↑ + HCl↑92.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑93.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO494.硝酸银与氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO395.一氧化碳还原氧化亚铁:FeO + CO → Fe + CO296.一氧化碳还原氧化银:Ag2O + CO → 2Ag + CO297.二氧化碳与氢氧化钡反应:CO2 + Ba(OH)2 → BaCO3↓ + H2O98.二氧化硫与氢氧化钾反应:SO2 + 2KOH → K2SO3 + H2O99.一氧化氮与氧气反应:NO + O2 → NO2100.二氧化氮与水反应:NO2 + H2O → HNO3。
初中常见的化学方程式(全)

初中常见的化学方程式(全) 初中化学方程式汇总一、化合反应:A+B→AB1.镁在空气中燃烧:2Mg + O2 → 2MgO(白色)2.铁在氧气中燃烧:4Fe + 3O2 → 2Fe2O3(黑色)3.铝在空气中燃烧:4Al + 3O2 → 2Al2O3(白色)4.氢气和空气混合燃烧:2H2 + O2 → 2H2O5.红磷在空气中燃烧:4P + 5O2 → 2P2O5(白色)6.硫粉在空气中燃烧:S + O2 → SO27.碳在氧气中充分燃烧:C + O2 → CO28.碳在氧气中不充分燃烧:2C + O2 → 2CO9.铜在空气中受热:2Cu(紫红色)+ O2 → 2CuO(黑色)10.一氧化碳在氧气中燃烧:2CO + O2 → 2CO211.二氧化碳溶解于水:CO2 + H2O → H2CO312.二氧化硫溶于水:SO2 + H2O → H2SO3(亚硫酸)13.三氧化硫溶于水:SO3 + H2O → H2SO4(硫酸)14.生石灰溶于水:CaO + H2O → Ca(OH)215.氧化钠溶于水:Na2O + H2O → 2NaOH16.无水硫酸铜作干燥剂:CuSO4(白色)+ 5H2O → CuSO4·5H2O(蓝色)17.二氧化碳通过炽热的炭层:CO2 + C → 2CO二、几个分解反应:AB→A+B18.水在直流电的作用下分解:2H2O → 2H2↑+ O2↑19.双氧水分解:2H2O2 → 2H2O + O2↑20.加热氯酸钾(有二氧化锰):2KClO3(白色)→2KCl(白色)+ 3O2↑21.加热高锰酸钾:2KMnO4(紫黑色)→ K2MnO4 + MnO2(黑色)+ O2↑22.碳酸不稳定而分解:H2CO3 → H2O + CO2↑23.高温煅烧石灰石:CaCO3 → CaO + CO2↑1.氢氧化铜的热分解:通过加热,Cu(OH)2可以分解成CuO和H2O。
2.氢氧化铁的热分解:通过加热,2Fe(OH)3可以分解成Fe2O3和3H2O。
初中化学方程式汇总(打印版)

初中化学方程式汇总一、物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧: 2Mg + O2点燃 2MgO2. 铁在氧气中燃烧: 3Fe + 2O2点燃 Fe3O43. 铜在空气中受热: 2Cu + O2加热 2CuO4. 铝在空气中燃烧: 4Al + 3O2点燃 2Al2O35. 氢气中空气中燃烧: 2H2 + O2点燃 2H2O6. 红磷在空气中燃烧: 4P + 5O2点燃 2P2O57. 硫粉在空气中燃烧: S + O2点燃 SO28. 碳在氧气中充分燃烧: C + O2点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2点燃 2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧: 2CO + O2点燃 2CO211.甲烷在空气中燃烧: CH4 + 2O2点燃 CO2 + 2H2O12.酒精在空气中燃烧: C2H5OH + 3O2点燃 2CO2 + 3H2O二、几个分解反应:13.水在直流电的作用下分解: 2H2O 通电 2H2↑+ O2 ↑14.加热碱式碳酸铜: C u2(OH)2CO3加热2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KClO3Mn O2 2KCl + 3O2↑16.加热高锰酸钾: 2KMnO4加热K2MnO4 + MnO2 +O2↑17.碳酸不稳定而分解: H2CO3 === H2O + CO2↑18.高温煅烧石灰石: CaCO3高温CaO + CO2↑18-1.双氧水(过氧化氢)催化分解:2H2O2Mn O22H2O + O2↑三、几个氧化还原反应:19.氢气还原氧化铜: H2 + CuO加热 Cu + H2O20.木炭还原氧化铜: C + 2CuO 高温2Cu + CO2↑21.焦炭还原氧化铁: 3C + 2Fe2O3高温4Fe + 3CO2↑22.焦炭还原四氧化三铁: 2C + Fe3O4高温3Fe + 2CO2↑23.一氧化碳还原氧化铜: CO + CuO 加热Cu + CO224.一氧化碳还原氧化铁: 3CO + Fe2O3高温2Fe + 3CO225.一氧化碳还原四氧化三铁: 4CO + Fe3O4高温3Fe + 4CO2四、单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸┈┈┈┈盐 + 氢气(置换反应)26.锌和稀硫酸 Zn + H2SO4 === ZnSO4 + H2↑27.铁和稀硫酸 Fe + H2SO4 === FeSO4 + H2↑28.镁和稀硫酸 Mg + H2SO4 === MgSO4 + H2↑29.铝和稀硫酸 2Al +3H2SO4 === Al2(SO4)3 +3H2↑30.锌和稀盐酸 Zn + 2HCl=== ZnCl2 + H2↑31.铁和稀盐酸 Fe + 2HCl=== FeCl2 + H2↑32.镁和稀盐酸 Mg+ 2HCl=== MgCl2 + H2↑33.铝和稀盐酸 2Al + 6HCl === 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液)┈┈┈┈ 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应: Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应: Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应: Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸┈┈┈┈ 盐 + 水37.氧化铁和稀盐酸反应: Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应: Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39.氧化铜和稀盐酸反应: CuO + 2HCl === CuCl2 + H2O40.氧化铜和稀硫酸反应: CuO + H2SO4 === CuSO4 + H2O41.氧化镁和稀硫酸反应: MgO + H2SO4 === MgSO4 + H2O42.氧化钙和稀盐酸反应: CaO + 2HCl === CaCl2 + H2O(4)酸性氧化物 +碱┈┈┈┈ 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质: Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 47. 消石灰吸收二氧化硫: Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱┈┈┈┈ 盐 + 水48.盐酸和烧碱起反应: HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应: HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应: 2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应: 3HCl + Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O54.硫酸和烧碱反应: H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应: H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应: H2SO4 + Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应: 3H2SO4 + 2Fe(OH)3=== Fe2(SO4)3 +6H2O58. 硝酸和烧碱反应: HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐┈┈┈┈ 另一种酸 + 另一种盐59.大理石与稀盐酸反应: CaCO3 + 2HCl == CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl == MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应: Na2CO3 + H2SO4 === Na2SO4 + H2O +CO2↑64.硫酸和氯化钡溶液反应: H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(7)碱 + 盐┈┈┈┈ 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐┈┈┈┈ 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 === AgCl↓ + NaNO3 71.硫酸钠和氯化钡: Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五、其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476. 硫酸铜晶体受热分解,不同温度下分解产物不同。
初中化学方程式大全(整理打印版)

化学方程式: 一.氧气的性质 ⒈制取氧气:⑴过氧化氢溶液中添加入二氧化锰:2H 2O 22H 2O+O 2↑⑵氯酸钾制氧气:2KClO 32KCl+3O 2↑⑶加热高锰酸钾:2KMnO 4MnO 2+K 2MnO 4+O 2↑⒉单质与氧气的反应(化合反应): ⑴氢气在空气中燃烧:2H 2+O 22H 2O 淡蓝色火焰、放热、罩干冷的烧杯有水雾(2)硫在空气中燃烧:S+O 2SO 2 淡蓝色火焰、放热、有刺激性气味。
(氧气中为蓝紫色)(3)磷在空气中燃烧:4P+5O 22P 2O 5 红磷燃烧、发光放热、黄色火焰、大量白烟 (4)铁在氧气中燃烧:3Fe+2O 2Fe 3O 4 剧烈燃烧 火星四射、放出大量热、生成黑色固体(5)铜在空气中受热:2Cu+O 22CuO 红色固体变成黑色 (6)铝耐腐蚀的原因:4Al+3O 22Al 2O 3⒊化合物与氧气反应:⑴一氧化碳在空气中燃烧:2CO+O 22CO 2⑵甲烷在空气中燃烧:CH 4+2O 2CO 2+2H 2O⑶酒精在空气中燃烧:C 2H 5OH+3O 22CO 2+3H 2O二.自然界中的水⑴水在直流电的作用下分解:2H 2O 2H 2↑+O 2↑⑵制取氢气:Zn+H 2SO 4ZnSO 4+H 2↑或Zn+2HClZnCl 2+H 2↑(无稀硫酸才用)⑶生石灰与水反应:CaO+H 2O Ca(OH)2三.质量守恒定律(1)铁与硫酸铜溶液反应:Fe+CuSO 4Cu+FeSO 4 有亮红色固体生成,溶液由蓝色变为浅绿色(2)用氢气还原氧化铜:H 2+CuOCu+H 2O△电解点燃点燃点燃△ 点燃 点燃点燃点燃△ △ MnO 2MnO 2四.碳和碳的氧化物 ⒈碳的化学性质:⑴碳在空气充分中燃烧:C+O 2CO 2⑵碳在空气不充分中燃烧:2C+O 22CO⑶木炭还原氧化铜:C+2CuO2Cu+CO 2↑⑷焦炭还原氧化铁:3C+2Fe 2O 32Fe+3CO 2↑⑸焦炭还原四氧化三铁:2C+Fe 3O 43Fe+2CO 2↑2.二氧化碳的制取和性质:⑴大理石(或石灰石)与稀盐酸反应(实验室制取二氧化碳):CaCO 3+2HCl CaCl 2+H 2O+CO 2↑⑵正常雨水呈酸性原因:H 2O+CO 2H 2CO 3⑶高温煅烧石灰石(工业制取二氧化碳):CaCO 3CO 2↑+CaO(4)澄清石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2+CO 2CaCO 3↓+H 2O (5)氢氧化钠与二氧化碳的反应(去除二氧化碳):2NaOH+CO 2Na 2CO 3+H 2O⒋一氧化碳的性质:⑴一氧化碳在空气中燃烧:2CO+O 22CO 2⑵一氧化碳还原氧化铜:CO+CuOCu+CO 2 ⑶一氧化碳还原氧化铁:3CO+Fe 2O 3Fe+3CO 2⑷一氧化碳还原四氧化三铁:4CO+Fe 3O 43Fe+4CO 2五.燃料及其运用⑴碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ ⑵碳酸氢钠受热易分解(干粉灭火器的原理):2NaHCO 3Na 2CO 3+H 2O+CO 2↑六.金属⒈金属与氧气的反应: ⒉酸+金属盐+氢气(置换反应):△高温高温△ 点燃高温高温高温高温点燃点燃⑴锌与稀硫酸反应:Zn+H 2SO 4ZnSO 4+H 2↑⑵铁与稀硫酸反应:Fe+H 2SO 4FeSO 4+H 2↑ 有气泡产生,溶液由无色变为浅绿色(3)铝与稀硫酸反应:2Al+3H 2SO 4Al 2(SO 4)3+3H 2↑⒊金属+盐新盐+新金属:⑴铁与硫酸铜溶液反应:Fe+CuSO 4FeSO 4+Cu ⑵锌与硫酸铜溶液反应:Zn+CuSO 4ZnSO 4+Cu ⑶铜与硝酸银溶液反应:Cu+2AgNO 3Cu(NO 3)2+2Ag⒋铁的炼制: ⑴高炉上层:3CO+Fe 2O 32Fe+3CO 2}⑵高炉中层:CO 2+C 2CO (产生CO ,提供还原剂) ⑶高炉下层:C+O 2CO 2 (放热,提供热量)七.酸、碱、盐⒈酸的化学性质: ⑴酸+金属盐+氢气(见上)⑵酸+金属氧化物盐+水:②氧化铁与稀硫酸反应:Fe 2O 3+3H 2SO 4Fe 2(SO 4)3+3H 2O (红棕色固体消失,溶液由无色变为黄色)③氧化铜与稀盐酸反应:CuO+2HCl CuCl 2+H 2O⑶酸+碱盐+水(中和反应):①盐酸与烧碱反应:HCl+NaOHNaCl+H 2O③氢氧化铝与盐酸反应(治疗胃酸过多):3HCl+Al(OH)3AlCl 3+3H 2O⑷酸+盐新酸+新盐:②碳酸钠与稀盐酸反应:Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ ③碳酸氢钠与稀盐酸反应:NaHCO 3+HClNaCl+H 2O+CO 2↑ ④硫酸与氢氧化钡溶液反应:H 2SO 4+BaCl 2BaSO 4↓+2HCl⒉碱的化学性质:点燃 高温高温⑴碱+非金属氧化物盐+水:①氢氧化钠溶液暴露在空气中变质:2NaOH+CO2Na2CO3+H2O②氢氧化钠溶液吸收二氧化硫气体:2NaOH+SO2+Na2SO3+H20③氢氧化钠溶液吸收三氧化硫气体:2NaOH+SO3Na2SO4+H2O④氢氧化钙暴露在空气中变质:Ca(OH)2+CO2CaCO3↓+H2O⑤消石灰吸收二氧化硫:Ca(OH)2+SO2CaCO3↓+H2O⑵碱+酸盐+水(见上)⑶碱+盐新碱+新盐:①纯碱制烧碱:Ca(OH)2+Na2CO32NaOH+CaCO3↓②氢氧化钙与硫酸铜反应(制取波尔多液):Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓⒊盐的化学性质:⑴盐+金属新金属+新盐(见上):①铁与硝酸汞反应:Fe+Hg(NO3)2Fe(N O3)2+Hg⑵盐+酸新酸+新盐(见上):①硝酸银溶液与盐酸反应:AgNO3+HCl AgCl↓+HNO3⑶盐+碱新碱+新盐:①硫酸铜溶液与盐酸反应:CuSO4+2NaOH Cu(OH)2↓+Na2SO4②氯化铁溶液与氢氧化钠溶液反应:FeCl3+3NaOH Fe(O H)3↓+3NaCl⑤氢氧化钠溶液与氯化铵溶液反应:NaOH+NH43↑+H2O⑷盐+盐新盐+新盐:①氯化钠与硝酸银反应:NaCl+AgNO3AgCl↓+NaNO3②硫酸钠与氯化钡反应:Na2SO4+BaCl2BaSO4↓+2NaCl八、化学与生活:⑴葡萄糖在酶的作用下缓慢氧化:C6H12O6+6O26CO2+6H2O酶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学方程式汇总一、基本反应类型(一)、化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铝在空气中燃烧:4Al + 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 + O2点燃2H2O5、红磷在空气中燃烧:4P + 5O2点燃2P2O56、硫粉在空气中燃烧:S + O2点燃SO27、碳在氧气中充分燃烧:C + O2点燃CO28、碳在氧气中不充分燃烧:2C + O2点燃2CO9、二氧化碳通过灼热碳层:C + CO2高温2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl15、氧化钠溶于水:Na2O + H2O === 2NaOH16、三氧化硫溶于水:SO3 + H2O === H2SO4(二)、分解反应17、实验室用双氧水制氧气:2H2O2MnO22H2O + O2↑18、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑19、水在直流电的作用下分解:2H2O 通电2H2↑ + O2↑20、碳酸不稳定而分解:H2CO3△H2O + CO2↑21、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑22、加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O + CO2↑23、加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2和△2KCl + 3O2↑24、硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O(三)、置换反应25、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu26、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 === ZnSO4 + H2↑27、镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑28、氢气还原氧化铜:H2 + CuO △Cu + H2O29、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑30、水蒸气通过灼热碳层:H2O + C 高温H2 + CO31、焦炭还原氧化铁:3C + 2Fe2O高温4Fe + 3CO2↑(四)、复分解反应32、盐酸和烧碱起反应:HCl + NaOH === NaCl + H2O33、盐酸和氢氧化钾反应:HCl + KOH === KCl + H2O34、盐酸和氢氧化铜反应:2HCl + Cu (OH)2 === CuCl2 + 2H2O35、盐酸和氢氧化钙反应:2HCl + Ca (OH)2 === CaCl2 + 2H2O36、盐酸和氢氧化铁反应:3HCl + Fe(OH)3 === FeCl3 + 3H2O37、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 === AlCl3 + 3H2O38、硫酸和烧碱反应:H2SO4 + 2NaOH === Na2SO4 + 2H2O39、硫酸和氢氧化钾反应:H2SO4 + 2KOH === K2SO4 + 2H2O40、硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 === CuSO4 + 2H2O41、硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3 === Fe2(SO4)3 + 6H2O42、硝酸和烧碱反应:HNO3 + NaOH === NaNO3 +H2O43、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑44、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑45、碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑46、盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO347、硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑48、硫酸和氯化钡溶液反应:H2SO4 + BaCl2 === BaSO4↓+ 2HCl49、氢氧化钠与硫酸铜:2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO450、氢氧化钠与氯化铁:3NaOH + FeCl3 === Fe(OH)3↓ + 3NaCl51、氢氧化钠与氯化镁:2NaOH + MgCl2 === Mg(OH)2↓ + 2NaCl52、氢氧化钠与氯化铜:2NaOH + CuCl2 === Cu(OH)2↓ + 2NaCl53、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH54、氯化钠溶液和硝酸银溶液:NaCl + AgNO3=== AgCl↓ + NaNO355、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓ + 2NaCl (五)、其它56、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O57、酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O58、一氧化碳还原氧化铜:CO + CuO △Cu + CO259、一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO260、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O61、氢氧化钠和二氧化碳反应(吸收二氧化碳):2NaOH + CO2 === Na2CO3 + H2O二、物质与氧气的反应(一)、单质与氧气的反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铜在空气中受热:2Cu + O2△2CuO4、铝在空气中燃烧:4Al + 3O2点燃2Al2O35、氢气在空气中燃烧:2H2 + O2点燃2H2O6、红磷在空气中燃烧:4P + 5O2点燃2P2O57、硫粉在空气中燃烧:S + O2点燃SO28、碳在氧气中充分燃烧:C + O2点燃CO29、碳在氧气中不充分燃烧:2C + O2点燃2CO(二)、化合物与氧气的反应10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211、甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12、酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O三、几个氧化还原反应1、氢气还原氧化铜:H2 + CuO △Cu + H2O2、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑3、焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑4、焦炭还原四氧化三铁:2C + Fe3O4高温3Fe + 2CO2↑5、一氧化碳还原氧化铜:CO + CuO △Cu + CO26、一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO27、一氧化碳还原四氧化三铁:4CO + Fe3O4高温3Fe + 4CO2四、单质、氧化物、酸、碱、盐的相互关系(一)、金属单质 + 酸盐 + 氢气(置换反应)1、锌和稀硫酸:Zn + H2SO4 === ZnSO4 + H2↑2、铁和稀硫酸:Fe + H2SO4 === FeSO4 + H2↑3、镁和稀硫酸:Mg + H2SO4 === MgSO4 + H2↑4、铝和稀硫酸:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑5、锌和稀盐酸:Zn + 2HCl === ZnCl2 + H2↑6、铁和稀盐酸:Fe + 2HCl === FeCl2 + H2↑7、镁和稀盐酸:Mg + 2HCl === MgCl2 + H2↑8、铝和稀盐酸:2Al + 6HCl === 2AlCl3 + 3H2↑(二)、金属单质 + 盐(溶液)另一种金属 + 另一种盐9、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu10、锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu11、铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg (三)、碱性氧化物 + 酸盐 + 水12、氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O13、氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O14、氧化铜和稀盐酸反应:CuO + 2HCl === CuCl2 + H2O15、氧化铜和稀硫酸反应:CuO + H2SO4 === CuSO4 + H2O16、氧化镁和稀硫酸反应:MgO + H2SO4 === MgSO4 + H2O17、氧化钙和稀盐酸反应:CaO + 2HCl === CaCl2 + H2O(四)、酸性氧化物 + 碱盐 + 水18、苛性钠暴露在空气中变质:2NaOH + CO2 === Na2CO3 + H2O19、苛性钠吸收二氧化硫气体:2NaOH + SO2 === Na2SO3 + H2O20、苛性钠吸收三氧化硫气体:2NaOH + SO3 === Na2SO4 + H2O21、消石灰放在空气中变质:Ca(OH)2 + CO2 === CaCO3↓ + H2O22、消石灰吸收二氧化硫:Ca(OH)2 + SO2 === CaSO3↓ + H2O (五)、酸 + 碱盐 + 水23、盐酸和烧碱反应:HCl + NaOH === NaCl + H2O24、盐酸和氢氧化钾反应:HCl + KOH === KCl + H2O25、盐酸和氢氧化铜反应:2HCl + Cu (OH)2 === CuCl2 + 2H2O26. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 === CaCl2 + 2H2O27. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 === FeCl3 + 3H2O28、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 === AlCl3 + 3H2O29、硫酸和烧碱反应:H2SO4 + 2NaOH === Na2SO4 + 2H2O30、硫酸和氢氧化钾反应:H2SO4 + 2KOH === K2SO4 + 2H2O31、硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 === CuSO4 + 2H2O32、硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3 === Fe2(SO4)3 + 6H2O33、硝酸和烧碱反应:HNO3 + NaOH === NaNO3 + H2O(六)、酸 + 盐另一种酸 + 另一种盐34、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑35、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑36、碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑37、盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO338、硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑39、硫酸和氯化钡溶液反应:H2SO4 + BaCl2 === BaSO4↓ + 2HCl(七)、碱 + 盐另一种碱 + 另一种盐40、氢氧化钠与硫酸铜:2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO441、氢氧化钠与氯化铁:3NaOH + FeCl3 === Fe(OH)3↓ + 3NaCl42、氢氧化钠与氯化镁:2NaOH + MgCl2 === Mg(OH)2↓ + 2NaCl43、氢氧化钠与氯化铜:2NaOH + CuCl2 === Cu (OH)2↓ + 2NaCl44、氢氧化钙与碳酸钠:Ca (OH)2 + Na2CO3 === CaCO3↓ + 2NaOH(八)、盐 + 盐两种新盐45、氯化钠溶液和硝酸银溶液:NaCl + AgNO3=== AgCl↓ + NaNO346、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓ + 2NaCl(九)、其它反应47、二氧化碳溶解于水:CO2 + H2O=== H2CO348、生石灰溶于水:CaO + H2O === Ca(OH)249、氧化钠溶于水:Na2O + H2O === 2NaOH50、三氧化硫溶于水:SO3 + H2O === H2SO451、硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O52、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4·5H2O五、化学方程式反应现象应用1、2Mg + O2点燃或Δ 2MgO 剧烈燃烧、耀眼白光、生成白色固体、放热、产生大量白烟白色信号弹2、2Hg + O2点燃或Δ 2HgO 银白液体、生成红色固体拉瓦锡实验3、2Cu + O2点燃或Δ 2CuO 红色金属变为黑色固体4、4Al + 3O2点燃或Δ 2Al2O3银白金属变为白色固体5、3Fe + 2O2点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热6、4Fe + 3O2高温2Fe2O37、C + O2点燃CO2剧烈燃烧、白光、放热、使澄清石灰水变浑浊8、S + O2点燃SO2剧烈燃烧、放热、刺激性气味气体、空气中淡蓝色火焰、氧气中蓝紫色火焰9、2H2 + O2点燃2H2O 淡蓝色火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料10、4P + 5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量11、CH4 + 2O2点燃2H2O + CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧12、2C2H2 + 5O2点燃2H2O + 4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属13、2KClO3 MnO2和Δ 2KCl + 3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气14、2KMnO4△K2MnO4 + MnO2 + O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气15、2HgO △2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验16、2H2O 通电2H2↑ + O2↑ 水通电分解为氢气和氧气电解水17、Cu2 (OH)2 CO3△2CuO+ H2O + CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热18、NH4HCO3△NH3↑ + H2O + CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失19、Zn + H2SO4 === ZnSO4 + H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气20、Fe + H2SO4 === FeSO4 + H2↑ 有大量气泡产生、金属颗粒逐渐溶解21、Mg + H2SO4 === MgSO4 + H2↑ 有大量气泡产生、金属颗粒逐渐溶解22、2Al + 3H2SO4 === Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解23、Fe2O3 + 3H2△2Fe + 3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性24、Fe3O4 + 4H2△3Fe + 4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性25、WO3 + 3H2△W + 3H2O 冶炼金属钨、利用氢气的还原性26、MoO3+3H2△Mo +3H2O 冶炼金属钼、利用氢气的还原性27、2Na + Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成28、H2 + Cl2点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸29、CuSO4 + 2NaOH === Cu(OH)2↓ + Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验30、2C + O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因31、2CO + O2点燃2CO2蓝色火焰煤气燃烧32、C + CuO 高温2Cu + CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属33、2Fe2O3 + 3C 高温4Fe + 3CO2↑ 冶炼金属34、Fe3O4 + 2C 高温3Fe + 2CO2↑ 冶炼金属35、C + CO2高温2CO36、CO2 + H2O === H2CO3碳酸使石蕊变红证明碳酸的酸性37、H2CO3△CO2↑ + H2O 石蕊红色褪去38、Ca(OH)2 + CO2 === CaCO3↓ + H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁39、CaCO3 + H2O + CO2 === Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成、石头的风化40、Ca(HCO3)2△CaCO3↓ + H2O + CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成、钟乳石的形成41、2NaHCO3△Na2CO3 + H2O + CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头42、CaCO3高温CaO + CO2↑ 工业制备二氧化碳和生石灰43、CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢44、Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理45、Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理46、MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体47、CuO + CO △Cu + CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属48、Fe2O3 + 3CO 高温2Fe + 3CO2冶炼金属原理49、Fe3O4 高温3Fe + 4CO2冶炼金属原理50、WO3 高温W + 3CO2冶炼金属原理51、CH3COOH + NaOH === CH3COONa + H2O52、2CH3OH + 3O2点燃2CO2 + 4H2O53、C2H5OH + 3O2点燃2CO2 + 3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧54、Fe + CuSO4 === Cu + FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜55、Mg + FeSO4 === Fe + MgSO4溶液由浅绿色变为无色56、Cu + Hg(NO3)2 === Hg + Cu(NO3)257、Cu + 2AgNO3 === 2Ag + Cu(NO3)2红色金属表面覆盖一层银白色物质镀银58、Zn + CuSO4 === Cu + ZnSO4青白色金属表面覆盖一层红色物质镀铜59、Fe2O3 + 6HCl === 2FeCl3 + 3H2O 铁锈溶解、溶液呈黄色铁器除锈60、Al2O3 + 6HCl === 2AlCl3 + 3H2O 白色固体溶解61、Na2O + 2HCl === 2NaCl + H2O 白色固体溶解62、CuO + 2HCl === CuCl2 + H2O 黑色固体溶解、溶液呈蓝色63、ZnO + 2HCl === ZnCl2 + H2O 白色固体溶解64、MgO + 2HCl === MgCl2 + H2O 白色固体溶解65、CaO + 2HCl === CaCl2 + H2O 白色固体溶解66、NaOH + HCl === NaCl + H2O 白色固体溶解67、Cu(OH)2 + 2HCl === CuCl2 + 2H2O 蓝色固体溶解68、Mg(OH)2 + 2HCl === MgCl2 + 2H2O 白色固体溶解69、Al(OH)3 + 3HCl === AlCl3 + 3H2O 白色固体溶解胃舒平治疗胃酸过多70、Fe(OH)3 + 3HCl === FeCl3 + 3H2O 红褐色沉淀溶解、溶液呈黄色71、Ca(OH)2 + 2HCl === CaCl2 + 2H2O72、HCl + AgNO3 === AgCl↓ + HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理73、Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O 铁锈溶解、溶液呈黄色铁器除锈74、Al2O3 + 3H2SO4 === Al2(SO4)3 + 3H2O 白色固体溶解75、CuO + H2SO4 === CuSO4 + H2O 黑色固体溶解、溶液呈蓝色76、ZnO + H2SO4 === ZnSO4 + H2O 白色固体溶解77、MgO + H2SO4 === MgSO4 + H2O 白色固体溶解78、2NaOH + H2SO4 === Na2SO4 + 2H2O79、Cu(OH)2 + H2SO4 === CuSO4 + 2H2O 蓝色固体溶解80、Ca(OH)2 + H2SO4 === CaSO4 + 2H2O81、Mg(OH)2 + H2SO4 === MgSO4 + 2H2O 白色固体溶解82、2Al(OH)3 + 3H2SO4 === Al2(SO4)3 + 3H2O 白色固体溶解83、2Fe(OH)3 + 3H2SO4 === Fe2(SO4)3 + 3H2O 红褐色沉淀溶解、溶液呈黄色84、Ba(OH)2 + H2SO4 === BaSO4↓ + 2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理85、BaCl2 + H2SO4 === BaSO4↓ + 2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理86、Ba(NO3)2 + H2SO4 === BaSO4↓ + 2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42—的原理87、Na2O + 2HNO3 === 2NaNO3 + H2O 白色固体溶解88、CuO + 2HNO3 === Cu(NO3)2 + H2O 黑色固体溶解、溶液呈蓝色89、ZnO + 2HNO3 === Zn(NO3)2 + H2O白色固体溶解90、MgO + 2HNO3 === Mg(NO3)2 + H2O 白色固体溶解91、CaO + 2HNO3 === Ca(NO3)2 + H2O 白色固体溶解92、NaOH + HNO3 === NaNO3 + H2O93、Cu(OH)2 + 2HNO3 === Cu(NO3)2 + 2H2O 蓝色固体溶解94、Mg(OH)2 + 2HNO3 === Mg(NO3)2 + 2H2O 白色固体溶解95、Al(OH)3 + 3HNO3 === Al(NO3)3 + 3H2O 白色固体溶解96、Ca(OH)2 + 2HNO3 === Ca(NO3)2 + 2H2O97、Fe(OH)3 + 3HNO3 === Fe(NO3)3 + 3H2O 红褐色沉淀溶解、溶液呈黄色98、3NaOH + H3PO4 === 3H2O + Na3PO499、3NH3 + H3PO4 === (NH4)3 PO4100、2NaOH + CO2 === Na2CO3 + H2O 吸收CO、O2、H2中的CO2、101、2NaOH + SO2 === Na2SO3 + H2O2NaOH + SO3 === Na2SO4 + H2O 处理硫酸工厂的尾气(SO2)102、FeCl3 + 3NaOH === Fe(OH)3↓ + 3NaCl 溶液黄色褪去、有红褐色沉淀生成103、AlCl3 + 3NaOH === Al(OH)3↓ + 3NaCl 有白色沉淀生成104、MgCl2 + 2NaOH === Mg(OH)2↓ + 2NaCl105、CuCl2 + 2NaOH === Cu(OH)2↓ + 2NaCl 溶液蓝色褪去、有蓝色沉淀生成106、CaO + H2O === Ca(OH)2白色块状固体变为粉末生石灰制备石灰浆107、Ca(OH)2 + SO2 === CaSO3↓ + H2O 有白色沉淀生成初中一般不用108、Ca(OH)2 + Na2CO3 === CaCO3↓ + 2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱109、Ba(OH)2 + Na2CO3 === BaCO3↓ + 2NaOH 有白色沉淀生成110、Ca(OH)2 + K2CO3 === CaCO3↓ + 2KOH 有白色沉淀生成111、CuSO4 + 5H2O === CuSO4·5H2O 白色粉末变为蓝色晶体检验物质中是否含有水112、CuSO4·5 H2O △CuSO4 + 5H2O 蓝色晶体变为白色粉末113、AgNO3 + NaCl === AgCl↓ + NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子114、BaCl2 + Na2SO4 === BaSO4↓ + 2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子115、CaCl2 + Na2CO3 === CaCO3↓ + 2NaCl 有白色沉淀生成116、MgCl2 + Ba(OH)2 === BaCl2 + Mg(OH)2↓ 有白色沉淀生成117、CaCO3 + 2HCl === CaCl2 + H2O + CO2↑118、MgCO3 + 2HCl === MgCl2 + H2O + CO2↑119、NH4NO3 + NaOH === NaNO3 + NH3↑ + H2O 生成使湿润的红色石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子120、NH4Cl + KOH === KCl + NH3↑ + H2O 生成使湿润的红色石蕊试纸变蓝色的气体。
