转录组高通量测序转录组数据分析差异表达基因分析 PPT
生物信息学中转录组数据分析方法与差异表达基因鉴定

生物信息学中转录组数据分析方法与差异表达基因鉴定近年来,随着高通量测序技术的快速发展,生物信息学成为了生物学研究不可或缺的一部分。
而转录组数据分析作为生物信息学的重要方法之一,在研究生物体内基因表达变化、差异表达基因的鉴定以及功能注释等方面发挥着重要作用。
转录组数据分析的第一步是将测序得到的原始数据进行质控与清洗。
在这个步骤中,需要运用一系列的质量评估工具来评估原始数据的质量,并且对数据中的低质量序列、接头污染等进行去除,以保证后续分析的准确性和可靠性。
之后,对于清洗后的测序数据,可以进行基因定量分析。
基因定量可以通过统计数据中每个基因的发现数目来实现,以探究不同样本中基因的表达量差异。
最常见的基因定量方法是将每个样本的测序数据比对到参考基因组,然后使用一些特定的算法来计算每个基因的读数。
最常用的算法包括RPKM(reads per kilobase million)和TPM(transcripts per million)等。
在基因定量的基础上,可以进行差异表达基因的鉴定。
差异表达分析旨在找出在不同条件下表达水平发生显著变化的基因。
常用的差异表达分析方法包括DESeq2、edgeR和limma等。
这些方法基于统计学原理,通过对基因表达进行归一化、方差稳定化和模型的拟合来找出差异表达基因。
除了差异表达基因的鉴定,还可以进行富集分析,以确定差异表达基因的功能。
富集分析是一种将某一特定基因集与已知功能注释的基因集相比较的方法,可以帮助研究人员了解差异表达基因在生物学过程和通路中的功能变化。
在这个步骤中,通常会使用一些公共数据库,如GO(Gene Ontology),KEGG(Kyoto Encyclopedia of Genes and Genomes)和Reactome等,来获得基因功能注释信息。
除了上述提到的方法,还有一些其他的转录组数据分析方法可供选择。
例如,可以使用聚类分析方法对样本进行聚类,以寻找具有类似表达模式的基因组。
基于转录组数据的差异表达基因分析

基于转录组数据的差异表达基因分析转录组(transcriptome)是指一个生物在一定时间和环境下其全体细胞内的RNA转录产物的总和,即所有可以转录的基因产物,包括编码RNA和非编码RNA。
转录组分析(transcriptome analysis)是一种研究基因表达级别、结构和调控机制的手段,通过对RNA测序数据的研究,可以更好地理解生物体内基因的调控规律和生命活动的本质。
其中,差异表达基因(differentially expressed genes,DEGs)分析是转录组分析的一种重要方法,可以帮助我们研究基因的功能和作用,深入探究生物组织和功能间的关系。
一、差异表达基因的概念差异表达基因是指在相同条件下两种或多种样本中差异表达的基因,即其表达水平在不同样本中差异显著,这种差异有时也称为基因表达的变化或调控。
常用的方法是对不同样本中的转录组进行测序,获得每个基因的表达量,再通过各种差异分析方法,筛选出差异表达的基因,这些基因可能具有重要的生物学功能,可以在不同种类的研究中得到应用。
二、差异表达基因分析的步骤差异表达基因分析一般包括以下步骤:1. 数据处理:包括数据清洗、对齐和定量等步骤。
转录组测序数据从测序平台获取后需要进行数据清洗,包括去除低质量的序列、去除污染序列和引物序列等。
然后需要将原始序列数据对齐到参考基因组或类似序列上,例如转录本、参考转录本或参考基因组等。
最后,需要计算每个基因或转录本在各样本中的表达量,可以通过HTSeq、Cufflinks、RSEM等软件或者简单的读数对齐统计表达量。
2. 差异表达基因筛选:筛选出在不同样本间表达量差异显著的基因。
差异表达基因筛选是转录组分析的重要步骤之一,它可以将表达水平差异显著的基因筛选出来,对于研究基因的生物学功能、分子机制以及生物学意义都非常重要。
目前,常用的差异分析方法包括DESeq2、EdgeR、Limma、Cuffdiff等。
通过统计学方法和多重检验校正,可以筛选出不同样本中具有显著表达水平差异的基因。
基因组和转录组高通量测序数据分析流程和分析平台

基因组和转录组高通量测序数据分析流程和分析平台基因组和转录组高通量测序数据分析是生物信息学领域中的一个重要研究方向。
随着高通量测序技术的发展,获取大规模基因组和转录组数据已经成为可能。
通过对这些数据的分析,可以深入了解生物体内基因的表达和功能等相关信息。
本文将介绍基因组和转录组高通量测序数据分析的基本流程和常用的分析平台。
数据预处理是分析流程的第一步,主要包括测序数据的质控和去除低质量序列。
常用的质控工具包括FastQC和Trim Galore等,它们可以评估测序数据的质量和检测可能的污染。
在质控的基础上,可以使用Trimmomatic等工具去除低质量序列和适配体序列,保证后续分析的准确性和可靠性。
基因定量是分析流程的第二步,用于评估基因的表达水平。
常用的基因定量工具包括kallisto、Salmon和STAR等。
这些工具可以根据测序数据和已知的转录组序列,计算基因的表达水平。
基因定量的结果一般以表达矩阵的形式输出,该矩阵包含了每个样本中每个基因的表达值。
差异表达基因分析是分析流程的第三步,用于寻找基因表达水平在不同样本中存在显著差异的基因。
常用的差异表达基因分析工具包括DESeq2、edgeR和limma等。
这些工具可以对表达矩阵进行统计学分析,找出在不同样本之间具有显著差异的基因。
差异表达基因分析的结果一般以差异表达基因列表的形式输出。
富集分析是分析流程的第四步,用于寻找差异表达基因中富集的生物学功能或通路。
常用的富集分析工具包括GOseq、KEGG和enrichR等。
这些工具可以根据差异表达基因列表,基于GO注释和KEGG通路等数据库,计算差异表达基因在特定功能或通路上的富集度。
生物学注释是分析流程的最后一步,用于解释基因的功能和相关信息。
常用的生物学注释工具包括DAVID、GSEA和STRING等。
这些工具可以根据差异表达基因列表,提供关于基因功能、互作关系和代谢通路等信息。
除了上述基本流程外,还有一些附加的分析步骤,如差异剪接分析、外显子计数等。
转录组分析(RNA-Seq)-PPT文档资料

Random hexamer primed cDNA synthesis
Paired-end
Solexa Sequencing
-6- dT微珠纯化mRNA ������ mRNA片段化处理 ������ 反转录反应合成合成双链cDNA ������ 双链DNA末端修复及3’末端加‘A’ ������ 使用特定的测序接头连接DNA片 段两端
转录组分析(RNA-Seq)
• 李江攀
RNA-Seq 的技术背景 RNA-Seq 的应用领域 RNA-Seq 面临的挑战及发展前景
RNA-Seq 的技术背景
RNA-Seq又称转录组高通量测序(transcriptome sequencing)或称为全转录组鸟枪法测序(Whole Transcriptom Shotgun Sequencing WTSS)
数字表达谱与芯片的比较
特点
数字化信号 高通量 可重复性高 无需重复实验 检测低丰度基因 检测新转录本 检测反义链转录本
数字表达谱
√ √ √ √ √ √ √
芯片
√
Unigene12000个以上,但转录组大小受基因数目和基因丰度双 重影响,组织差异、状态和实验处理也会影响转录组组成。Βιβλιοθήκη RNA-Seq 的发展前景
转录组测序原理.pptx

激发碱基荧光并收集荧光信号
去除阻断基团和荧光基团
Cycle 2-n:
重复前面的步骤
第16页/共40页
ห้องสมุดไป่ตู้基片段杂交
OH
diol
P7 P5
Flow Cell接头
diol diol
模板杂交
diol diol
延长
diol diol
变性
第17页/共40页
Cluster station
• 剩下的复制链其一端“固定”在芯片上,
Throughput : up to 25 Gb per day
Output 26-35 Gb 75-100 Gb 150-200 Gb
第15页/共40页
基于SBS测序技术
3’-
…-5’
5’-
GTATTTTCGGCACAG
A
G
A
C
T
T
C TG
Cycle 1:按顺序加入反应试剂
合成第一个碱基
清除未反应的碱基和试剂
第25页/共40页
鉴定基因可变剪接
exon1
common reads
exon2
exon3
mRNA
exon1
junction reads
exon3
exon1
exon2
exon3
第26页/共40页
鉴定融合基因
第27页/共40页
Paired Reads distribution
Reads cluster
主要内容• 样品检测 • 制备 • Cluster Station • Illumina Sequencing • 生物信息分析
第14页/共40页
新一代测序技术
转录组测序数据分析流程
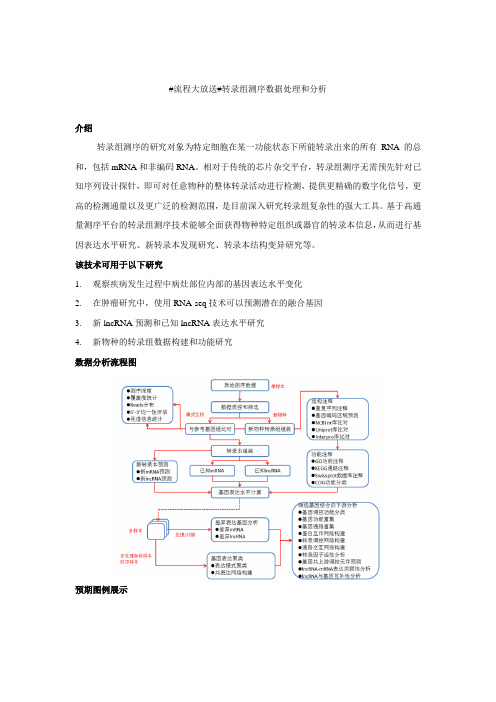
#流程大放送#转录组测序数据处理和分析
介绍
转录组测序的研究对象为特定细胞在某一功能状态下所能转录出来的所有RNA的总和,包括mRNA和非编码RNA。
相对于传统的芯片杂交平台,转录组测序无需预先针对已知序列设计探针,即可对任意物种的整体转录活动进行检测,提供更精确的数字化信号,更高的检测通量以及更广泛的检测范围,是目前深入研究转录组复杂性的强大工具。
基于高通量测序平台的转录组测序技术能够全面获得物种特定组织或器官的转录本信息,从而进行基因表达水平研究、新转录本发现研究、转录本结构变异研究等。
该技术可用于以下研究
1.观察疾病发生过程中病灶部位内部的基因表达水平变化
2.在肿瘤研究中,使用RNA-seq技术可以预测潜在的融合基因
3.新lncRNA预测和已知lncRNA表达水平研究
4.新物种的转录组数据构建和功能研究
数据分析流程图
预期图例展示
示例图1 差异表达基因筛选示例2 基因聚类分析heatmap图
示例3 差异基因互作网络图示例4 lncRNA、基因与上游共有miRNA网络图。
转录组测序数据分析(有参考基因组)

转录组测序数据分析(有参考基因组)一、数据分析流程二、数据分析内容1. 数据预处理目的:对原始测序数据进行一定程度的过滤。
原理:根据测序接头以及测序质量对原始的测序数据进行预处理,其中,测序质量Q与测序错误E之间的关系如下:结果:对预处理后质量以及碱基分布统计进行统计2. 比对基因组目的:将经过预处理的测序数据与参考基因组进行相似性比对。
原理:Burrower-Wheeler转换算法与splicing比对算法。
1)Burrower-Wheeler转换算法:由于测序数据量非常大,与整条基因组比对所需资源与时间是较为巨大的。
目前,我们采用Burrower-Wheeler(BWT)算法对基因进行建立索引、碱基压缩等过程,这样可以很大程度上加快比对速度,减少比对过程中所需资源。
2)splicing比对算法:即分段比对算法,当某条测序序列位于转录本剪切位点时,也就是这条序列同时属于两个外显子,如果将它与参考基因组进行比对,由于基因组两个外显子之间含有intron区,那么它将无法找到它合适的位置;但是应用分段比对算法就可以将这条测序序列分割变成多段子序列,然后应用这些段子序列与基因组进行比对,这样就可以找到它们真正的位置。
Vps28基因的一个分段比对的结果,蓝线连接的两端即为被分割的子序列,可见此种算法非常的适用于转录组测序。
结果展示:应用比对结果进行一些相关mapping统计,测序饱和度及测序5’,3’ bias统计。
Multi mapping,Unique mapping及Unique gene-body mapping统计。
饱和度分析,当reads达到一定测序量后,基因覆盖率基本达到饱和。
测序3’,5’偏好性统计,测序主要集中于基因bady区,两端偏向性较轻。
3. 基因表达水平研究目的:应用基因组比对结果进行基因定量。
原理:从指定物种基因模型(基因结构)中得到gene、exon、intron以及UTR等位置信息,通过基因组比对结果计算出在不用区域富集片段数目,然后应用RPKM/FPKM标准化公式对富集片段的数量进行归一化。
转录组测序技术原理及应用PPT课件

Total RNA
Eukaryon
Procaryon
Enrich mRNA by OligoT
Remove rRNA
RNA fragmentation (200nt~700nt)
Random hexamer primed cDNA synthesis
Size selection, then PCR amplification
Eukaryon
Procaryon
Enrich mRNA by OligoT
Remove rRNA
RNA fragmentation
Random hexamer primed cDNA synthesis
Size selection, then PCR amplification
HiSeq 2000 sequencing
Size selection, then PCR amplification
HiSeq 2000llumina Sequencing 生物信息分析
.
16
Applications of RNA-Seq
Application
Expression-profiling Alternative Splicing Fusion Gene SNP detection
RT ds cDNA
.
13
末端修复(防止自连) cDNA 3′末端加A Adapter连接
.14第一天制备第二天第三天消化DNA
↓
mRNA的分离
↓
mRNA的打断
↓
cDNA的合成
末端修复
↓
3’端↓ 加A
↓
加接头↓胶回收质量检测: Aligent 2100:片段大小、纯度、浓度 qPCR:片段大小、浓度 手工检测:跑胶验证。
转录组测序技术原理及应用 ppt课件

转录组测序技术原理及应用
Applications of RNA-Seq
Application
Expression-profiling Alternative Splicing Fusion Gene SNP detection
真核mRNA的纯化
mRNA的纯化主要通过的磁珠与 生物素吸附原理从而分离纯化
Oligo(dT)25磁珠纯化原理主要 是mRNA的3′的poly A与磁珠在 bindingbuffer的作用下相结合。磁 珠通过MPC(磁分离器)从溶液 中分离出来。
mRNA与磁珠结合后,再用Tris-
HCL在加热条件下解离洗脱到溶
加入1µl的stop buffer终止 反应。
加入沉淀剂(NaAc 糖原 无水乙醇)沉淀产物。
RT ds cDNA
转录组测序技术原理及应用
末端修复(防止自连) cDNA 3′末端加A Adapter连接
转录组消化DNA
↓
mRNA的分离
↓
mRNA的打断
Size selection, then PCR amplification
HiSeq 2000n Illumina Sequencing 生物信息分析
转录组测序技术原理及应用
系统生物学-第三讲-转录组学PPT课件

.
18
• 第一个被确认的miRNA——在线虫中首次发现的lin-4 和 let-7 ,可以通过部分互补结合到目的mRNA靶的3’非编 码区(3’UTRs),以一种未知方式诱发蛋白质翻译抑制, 进而抑制蛋白质合成,通过调控一组关键mRNAs的翻译 从而调控线虫发育进程。
继线虫之后,随后多个研究小组在包括人类、果蝇、植物等多 种生物物种中鉴别出数百拼接和注释表达与分类功能分析作用机理分析qpcr验证est软件平台est序列库序列的质量检查测序量监控聚类和拼接检查借助于基因组信息全长orf寻找发现全长基因研究表达基因概况的主要实验手段dnachipproteomics的先驱功能分类表达量分析交替剪接检测est特有信息microarray和genechip大规模表达谱或全景式表达谱globalexpressionprofile
.
40
表达序列标签(EST)测定及分析
1、什么是EST? 2、EST的应用 3、EST序列测定及分析过程
.
41
1、表达序列与表达序列标签概念
(1) 什么是表达序列?
基因组表达为RNA的序列: mRNA和功能RNA
(2) 什么是表达序列标签?
(expressed sequence tag, EST)
• 转录组研究是基因功能及结构研究的基础和 出发点,是解读基因组功能原件和揭示细胞 及组织分子组成所必需的。
.
34
• 转录组的特点:受到内外多种因素的调节,因而是 动态可变的。能够揭示不同物种、不同个体、不同 细胞、不同发育阶段及不同生理病理状态下的基因 差异表达信息。
.
35
• 转录组学(Transcriptomics):研究细胞在某 一功能状态下所含mRNA的类型与拷贝数;比较不
高通量测序技术及实用数据分析ppt课件

第三代测序:单分子测序
不同于第二代测序依赖于DNA模板与固体表面相结合然后边合成边测序,第三代 分子测序,不需要进行PCR扩增。
早在2008年,HelicoBio Science 公司的Harris等在Science上报道了他们开发的 TIRM(total internal reflection microscopy)测序技术。
;.
18
Ion Torrent测序技术:
使用半导体技术将生化反应与电流强度直接联系。在聚合酶反应时,每聚合 一个碱基会释放出相应的质子,引起周围环境PH的变化,将PH变化转化为 电流的变化,最终记录电流信号,获得测序序列。读长约200bp,根据芯片 不同可以一次产生10M-20G的数据。
;.
19
物上每一个dNTP的聚合与一次荧光信号的释放偶联起来,通过检测荧光的释放和强度,达到
实时测定DNA序列的目的。
;.
14
;.
15
Hiseq2000/Hiseq1000(HIseq2500/Hiseq1500)平台简介: 原理:基于DNA单分子簇边合成 ➢ 将基因组DNA的随机片段附着到光学透明的玻璃表面(即Flow cell),这些DNA片段经过延伸
;.
7
常见的高通量测序测序平台
;.
8
;.
9
;.
10
;.
11
;.
12
;.
13
焦磷酸测序技术:引物与模板DNA退火后,在dna聚合酶(DNA polymerase)、ATP硫酸化酶(ATP
sulfurytase)、荧光素酶(1uciferase)和三磷酸腺苷双磷酸酶(Apyrase)4种酶的协同作用下,将引
• 每一个k-mer作为图中一个节点,两 个k-mer如果在同一read中相邻,则 形成一个边。
基因转录组的测定及分析ppt课件

● 与编码区具有很强的保守性不同,3’UTRs序列的保守性 较差,因此很容易将单个基因与编码序列关系非常紧密的相 似基因家族成员分开。 (精J选aPmPT课e件s Sikela等,1991年) 9
EST的应用 3
ESTs与基因预测SAGE的测序: 单向测序。精选PPT课件
15
Serial analysis of gene expression (SAGE) 分析流程
在双标签多聚体序列中定位NlaIII酶切位点(即CATG); 提取CATG位点之间的20-22bp长的双标签序列; 去除重复出现的双标签序列,包括反向互补方向上重复的双
EST数量排名前10的物种
Organism Homo sapiens (human) Mus musculus + domesticus (mouse) Zea mays (maize) Bos taurus (cattle) Arabidopsis thaliana (thale cress) Danio rerio (zebrafish) Glycine max (soybean) Xenopus tropicalis (western clawed frog) Oryza sativa (rice) Ciona intestinalis
精选PPT课件
3
大规模EST序列测定的开始
1983年:Costanzo等提出EST概念的雏形
1991年:Adams测定了三种人脑组织共609条EST,宣布
了cDNA大规模测序的时代的开始代
1991年:Okubo等提出大规模cDNA测序的研究战略
1993年:Venter等创立现在的EST技术
生物信息学基因表达数据分析ppt学习课件

(2)k近邻法
选择与具有缺失值基因的k个邻居基因 用邻居基因的加权平均估计缺失值 参数
• 邻居个数 • 距离函数
(3)回归法
(五)数据标准化
1.为什么要进行数据标准化:存在不同来源的系统误差 染料物理特性差异(热光敏感性,半衰期等) 染料的结合效率 点样针差异 数据收集过程中的扫描设施 不同芯片间的差异 实验条件差异
四、聚类算法
(一)层次聚类
层次聚类算法将研究对象按照它们的相似性关系用 树形图进行呈现,进行层次聚类时不需要预先设定 类别个数,树状的聚类结构可以展示嵌套式的类别 关系。
在对含非单独对象的类进行合并或分裂时,常用的 类间度量方法。
类间相似性度量方法
2000年Alizadeh 等运用基因芯片 数据,基于层次 聚类算法证实了 DLBCL肿瘤病人 在mRNA层面确 实存在两种亚型
第一步:导入芯片数据
使用“import data”下的“General Format Importer”导入基因芯片数据,数据间用Tab键分隔 (或使用Excell文件),也可使用“Data Import Wizard”进行导入 。
导入芯片数据
第二步:选择文件类型
每张芯片用单独的文件存储,多个文件保存在一个文 件夹
疾病相关基因表达数据库
数据库名称
数据库内容
GENT
肿瘤组织与正常组织的表达数据
ParkDB
帕金森病的基因表达数据库
cMAP
小分子化合物对人细胞基因表达的影响
Anticancer drug gene 抗癌化合物的基因表达数据 expression database
CGED
癌症基因表达数据库(包括临床信息)
转录组测序数据分析流程

#流程大放送#转录组测序数据处理和分析
介绍
转录组测序的研究对象为特定细胞在某一功能状态下所能转录出来的所有RNA的总和,包括mRNA和非编码RNA。
相对于传统的芯片杂交平台,转录组测序无需预先针对已知序列设计探针,即可对任意物种的整体转录活动进行检测,提供更精确的数字化信号,更高的检测通量以及更广泛的检测范围,是目前深入研究转录组复杂性的强大工具。
基于高通量测序平台的转录组测序技术能够全面获得物种特定组织或器官的转录本信息,从而进行基因表达水平研究、新转录本发现研究、转录本结构变异研究等。
该技术可用于以下研究
1.观察疾病发生过程中病灶部位内部的基因表达水平变化
2.在肿瘤研究中,使用RNA-seq技术可以预测潜在的融合基因
3.新lncRNA预测和已知lncRNA表达水平研究
4.新物种的转录组数据构建和功能研究
数据分析流程图
预期图例展示
示例图1 差异表达基因筛选
示例2 基因聚类分析heatmap图
示例3 差异基因互作网络图
示例4 lncRNA、基因与上游共有miRNA网络图。
真核转录组讲解及数据解读PPT

转录组结果解读转录调控研究部北京诺禾致源科技股份有限公司OUTLINE简介实验部分生物信息分析概述1转录组是指特定组织或细胞在某个时间或某个状态下转录出来的所有RNA的总和,主要包括mRNA和非编码RNA。
转录组研究是研究基因功能和结构的基础,对生物体的发育和疾病的发生具有重要作用。
RNA-seq技术流程主要包含两个部分,建库测序和数据分析。
2实验部分(RNA检测、建库、测序))•琼脂糖凝胶电泳:分析样品RNA完整性及是否存在杂质污染。
•NanoPhotometerspectrophotometer:检测RNA纯度(OD260/280及OD260/230比值)。
•Agilent 2100 bioanalyzer:精确检测RNA完整性。
链特异性文库优势:相同数据量下可获取更多有效信息;能获得更精准的基因定量、定位与注释信息5➢1、一般动物样品会有三条带:28S 、18S 、5S ,如果提取过程经过过柱处理或者利用CTAB+LiCl 方法提取,5S 可能较暗或者没有。
➢昆虫或者软体动物等样品只有1条比较明显的带,例如:牡蛎、果蝇、螨虫、蝗虫、蚊、蚕等➢2、植物样品有三条带:25S 、18S 、5S ,有些特殊物种或部位可能本身含条带比较多,如果条带清晰,也可初步判定合格➢3.原核生物中主要有5S 、16S 、23S rRNA叶片小鼠蚊动物植物原核RIN 5RIN 7RIN 8RIN 9RIN 4RIN 6RIN 10RIN 2RIN 1RIN 值范围示意图问与答文献要求OD260/OD230≥1.8,OD260/OD230如果小于2.0,则表明样品中被碳水化合物、盐类或有机溶剂污染;OD260/OD230合格的标准是多少呢?答:OD260/OD230≥2.0,且OD260/OD280≥2.0这说明RNA提取结果是相当好的,一般在1.8-2.1之间就说明RNA结果十分好,但是nanodrop的灵敏度没有2100好,因此我们主要根据2100检测结果来判定RNA是否合格,一般只要RIN值和RNA总量达到我们的判定标准的话,我们就会判为合格。
转录组高通量测序

转录组高通量测序2010-11-22 09:48(第二代高通量测序技术-454)转录组即特定细胞在某一功能状态下所能转录出来的所有RNA的总和,是研究细胞表型和功能的一个重要手段。
与基因组不同的是,转录组的定义中包含了时间和空间的限定。
同一细胞在不同的生长时期及生长环境下,其基因表达情况是不完全相同的。
罗氏GS-FLX-Titanium第二代高通量测序仪平均读长超过400bp,在测序读长上遥遥领先于其它第二代高通量测序仪,使其成为转录组学研究的首选测序平台,已被广泛应用于基础研究、临床诊断和药物研发等领域。
一、罗氏454测序技术在环境微生物生态多样性研究中的突出优势体现在:(1)测序序列长,便于聚类拼接,可以对转录本进行从头组装(de novo assembly)。
(2)测序通量高,可以检测到低丰度转录本信息。
(3)可以对无基因组参考序列的新物种进行转录组测序,发现新的转录本和亚型。
(4)实验操作简单、结果稳定,可重复性强。
无需进行克隆的文库构建,双链cDNA连接454接头后可以直接进行测序,实验周期短。
(5)测序数据便于进行生物信息分析,可以进行基因差异表达分析、鉴定基因的可变剪切以及预测新基因。
二、美吉公司在环境微生物生态多样性研究中的突出优势体现在:(1)拥有自主实验室和高通量测序平台,可以根据客户要求灵活安排实验,实验周期短,取样方便,质量可靠。
(2)技术人员经验丰富,可以稳定地进行总RNA的提取和双链cDNA的合成,可以根据顾客要求第一时间提供实验方案。
(3)有专业的生物信息团队和大型计算机,可以为客户提供个性化的生物信息分析服务。
(4)开放式实验室,参与式服务。
客户不但可以参与整个实验过程,而且可以参与生物信息分析,提供最为增值的售后服务。
三、服务流程(1)客户提供样本背景信息、实验目的和实验预期。
(2)美吉公司设计实验方案,提供测序深度建议和生物信息分析建议。
(3)客户认可实验方案,双方签订项目合作协议。
转录组高通量测序转录组数据分析差异表达基因分析 PPT

3
➢ 转录组的研究可以提供什么条件下什么基因表达什么信息,从而 推断相应未知基因的功能,揭示特定调节基因的作用机制
➢ 对转录本的定量可以了解特定基因的活性和表达量,用于疾病的 诊断和治疗
➢ 通过对转录组的研究,也让个性化医疗的目标,从共性转移到个 性,成为可能
11
(2)RNA 聚合酶II负责蛋白质编码基因和调控非编码RNA的转录,在 真核生物的不同生理和病理状态下表达量被严格调控,一直吸引着 各生命科学研究领域的重点关注,无比幸运的是,由RNA聚合酶II 生成的转录的末端均含有3’端多聚腺苷尾【3’poly(A)tail】。 转录组测序一般是对用多聚胸腺嘧啶(oligo-dT)进行亲和纯化的 RNA聚合酶II转录生成的成熟mRNA和ncRNA进行高通量测序。这 样的数据有效排除了看家非编码RNA的干扰,可以通过一次测序获 得一种细胞内几乎所有重要基因的表达参数。
1.4转录组测序
➢ (1)RNA聚合酶I和III负责种类稀少、功能重要的看家非编码 RNA基因的转录,包括rRNA,tRNA,snoRNA,snRNA等。由这 两类RNA聚合酶转录的非编码RNA属于看家RNA,在各种生理和 病理状态下都被高水平转录,转录产物占细胞内RNA总量的95% 以上,不是生命科学研究前沿领域的主要关注对象
4
1.3转录组研究的技术
主要包括如下三种:
➢1)基于杂交技术的微阵列技术; ➢2)基于Sanger测序法的SAGE (serial analysis of gene expression) 和 MPSS(multiple parallel signature sequencing); ➢3)基于新一代高通量测序技术的转录组测序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
并在两个末端加上接头(adapter)。 2) 桥式PCR产生DNA簇
现象(如转录衰减)以外,转录组反映的是特定条件下活跃表达 的基因
3
➢ 转录组的研究可以提供什么条件下什么基因表达什么信息,从而 推断相应未知基因的功能,揭示特定调节基因的作用机制
➢ 对转录本的定量可以了解特定基因的活性和表达量,用于疾病的 诊断和治疗
➢ 通过对转录组的研究,也让个性化医疗的目标,从共性转移到个 性,成为可能
6
➢ DNA芯片技术:只适用于检测已知序列,却无法捕获新的mRNA。杂交 技术灵敏度有限,对于低丰度的mRNA,微阵列技术难以检测,也无法 捕获到目的基因mRNA表达水平的微小变化。
7
SAGE(基因表达系列分析):
➢ 可以全面了解特定组织或细胞类型中基因群体表达状态,它的显 著特点是能够大量获取基因组范围基因表达的类别与丰度,该技 术成功地应用于特异组织或细胞的转录组研究和mRNA群体间差 异表达基因鉴定。
11
(2)RNA 聚合酶II负责蛋白质编码基因和调控非编码RNA的转录,在 真核生物的不同生理和病理状态下表达量被严格调控,一直吸引着 各生命科学研究领域的重点关注,无比幸运的是,由RNA聚合酶II 生成的转录的末端均含有3’端多聚腺苷尾【3’poly(A)tail】。 转录组测序一般是对用多聚胸腺嘧啶(oligo-dT)进行亲和纯化的 RNA聚合酶II转录生成的成熟mRNA和ncRNA进行高通量测序。这 样的数据有效排除了看家非编码RNA的干扰,可以通过一次测序获 得一种细胞内几乎所有重要基因的表达参数。
1.4转录组测序
➢ (1)RNA聚合酶I和III负责种类稀少、功能重要的看家非编码 RNA基因的转录,包括rRNA,tRNA,snoRNA,snRNA等。由这 两类RNA聚合酶转录的非编码RNA属于看家RNA,在各种生理和 病理状态下都被高水平转录,转录产物占细胞内RNA总量的95% 以上,不是生命科学研究前沿领域的主要关注对象
4
1.3转录组研究的技术
主要包括如下三种:
➢1)基于杂交技术的微阵列技术; ➢2)基于Sanger测序法的SAGE (serial analysis of gene expression) 和 MPSS(multiple parallel signature sequencing); ➢3)基于新一代高通量测序技术的转录组测序。
17
2.3三种常见的测序平台
18
Illumina Genome Analyzer
• 专利核心技术“DNA 簇”和“可逆性末端终结”,达成自动化样 本制备及基因组数百万个碱基大规模平行测序。具有高准确性, 高通量,高灵敏度,和低运行成本等突出优势,可以同时完成传 统基因组学研究(测序和注释)以及功能基因组学(基因表达及 调控,基因功能,蛋白/核酸相互作用)研究。
➢ 缺点是需要大量的mRNA
8
大家有疑问的,可以询问和交流
可以互相讨ቤተ መጻሕፍቲ ባይዱ下,但要小声点
9
MPSS(多重性平行定序):
➢ 对于功能基因组研究非常有效,能在短时间内捕获细胞或组织内 全部基因的表达特征;对于鉴定致病基因并揭示该基因在疾病中 的作用机制等发挥了重要作用。
➢ 可以侦测到极为罕见的基因表现
10
15
2.1高通量测序优势?
➢ 价格比第一代大幅度降低 ➢ 可扩展的高通量 ➢ 需要样品量少 ➢ 新颖的测序化学技术 ➢ 单个或配对末端支持
16
2.2高通量测序技术的应用
➢ 重头测序(de novo sequencing) ➢ 重测序(resequencing) ➢ 全转录组测序(whole transcriptome resequencing) ➢ 小分子RNA测序(small RNA sequencing) ➢ 染色质免疫共沉淀测序(ChIP-seq)
• 单细胞转录组分析 • 转录组测序确定RNA结构 • 转录组测序在疾病中的应用
14
2.高通量测序
➢ 测序技术的发展 ➢ 高通量测序技术(High-throughput sequencing)又称“第二代”测
序技术(“Next-generation” sequencing technology),高通量测序 使得对一个物种的转录组和基因组进行细致全貌的分析成为可能 ,所以又被称为深度测序(deep sequencing)
➢ 从RNA层次研究基因表达的情况,即为转录组学( transcriptomics),是研究细胞表型和功能的一个重要手段。
2
1.2转录组研究的重要性
➢ 转录组是连接基因组遗传信息与生物功能的蛋白质组的纽带,转 录水平的调控是最重要也是目前研究最广泛的生物体调控方式。
➢ 转录组的研究比基因组的研究能给出更高效的有用信息。 ➢ 与基因组不同,转录组更有时间空间性。除了异常的mRNA降解
5
几种转录组研究所用技术的比较
转录组所用技术 Microarray SAGE和MPSS RNA-seq
原理
信号 分辨率 分辨率 背景 成本 起始RNA用量
寡核苷酸杂交 Sanger测序 高通量测序
荧光信号 数个-上百个 高 高 高 多
数字化信号 单碱基 低 低 高 多
数字化信号 单碱基 高 低 相对较低 少
• 1.转录组 • 2.高通量测序 • 3.转录组数据分析 • 4.差异表达基因分析 • 5.趋势性上调和下调基因分析 • 6.基因集功能富集分析
1
1.1transcriptome
➢ 转录组(transcriptome)是指特定生物体在某种状态或某一生 理条件下,细胞内所有基因转录产物的总和,包括信使RNA 、核糖体RNA、转运RNA及非编码RNA;狭义上指所有 mRNA的集合。
12
转录组高通量测序的优势?
• 高通量、更精确的数字信号、无需已知序列、能够在单核苷酸水 平对任意物种的整体转录活动进行检测,在分析转录本的结构和 表达水平的同时,还能够发现未知转录本和稀有转录本,精确的 识别可变剪接位点以及cSNP(编码序列单核苷酸多态性),提供 最全面的转录组信息。
13
转录组前沿研究简介
