最新无机化学(天津大学版)
天津大学无机化学课件第五章原子结构与元素周期性 共74页PPT资料

例外的还有: 41Nb、 44Ru、 45Rh、 57La、
58Ce、78Pt、89Ac、90Th、91Pa、92U、 93Np
29.11.2019
课件
36
基态原子的价层电子构型
价层——价电子所在的亚层 价层电子构型——指价层的电子分布式
29.11.2019
课件
30
无机化学多媒体电子教案
第五章 原子结构和元素周期性
第三节原子中电子的分布
第三节
原子中电子的分布
29.11.2019
课件
31
5-3-1 基态原子中电子的分布原理
泡利不相容原理——每一个原子轨道,最多
只能容纳两个自旋方向相反的电子.
能量5最-3低-原1理基—态—原原子子为中基态电时子,分电子布尽原可 能地分布在能级较低的理轨道上,使原子处于
课件
29
3. 磁量子数(m)
磁量子数(m)的取值决定于l值,可取(2l+1)个 从-l到+l(包括零在内)的整数。每一个m值代表 一个具有某种空间取向的原子轨道。
4.自旋量子数(ms)
自旋量子数(ms)只有+1/2或-1/2 这两个数值, 其中每一个值表示电子的一种自旋方向(如顺 时针或逆时针方向)。
课件
12
在量子力学中是用波函数和与其对应的 能量来描述微观粒子的运动状态的.
原子中电子的波函数ψ既然是描述电子云
运动状态的数学表达式,而且又是空间坐标的
函数,其空间图象可以形象地理解为电子运动
的空间范围,俗称”原子轨道”.为了避免与经
典力学中的玻尔轨道相混淆,又称为原子轨函
(原子轨道函数之意),亦即波函数的空间图象
激发态(电子处于能
天大第4版无机化学-教学课件-无机化学电子教案 简介

无机化学电子教案
崔建中 主编 崔建中 鲁凡丽 田昀 编制
高等教育出版社
无机化学电子教案 无机化学电子教案 无机化学电子教案
简 介
《无机化学电子教案》为天津大学无机化学教学组编 写的《无机化学》( 第四版 ,2010 年高等教育出版社出版 ) 教材配套的教学软件。 内容涵盖教材中的化学反应基本原理、物质结构基本 理论和元素化学基础知识等内容,其章节划分与教材完全 对应,综合运用了文字、图形、图像、动画、视频录像等 多种媒体技术。适用于高等院校本科(专科)各专业无机化 学教学使用,也可作为学生自学无机化学的参考软件。 本教案由崔建中、鲁凡丽和田昀等修订编制,崔建中 担任主编,杨宏孝、颜秀茹审定。
目 录
第七章 固体的结构与性质 第八章 配位化合物 第九章 氢、稀有气体
第十章 碱金属和碱土金属
第十一章 卤素和氧族元素 第十二章 氮族、碳族和硼族元素
第十三章 过渡元素(一)
无机化学电子教案 无机化学电子教案 无机化学电子教案
目 录
第十四章 过渡元素(二) 第十五章 元素化学综述 第十六章 无机合成
无机化学电子教案 无机化学电子教案 无机化学电子教案
运行环境
1. Windows XP中文系统 2. Microsoft Office 2002 XP中的 PowerPoint 2002 3. Windows media player 和 Realplayer 媒体播放器 4. Flashplayer 动画播放软件
无机化学电子教案 无机化学电子教案 无机化学电子教案
目 录
第〇章 绪论 第一章 化学反应中的质量关系和能量关系 第二章 化学反应的方向、速率和限度
天津大学无机化学第五版习题答案

天津大学无机化学第五版习题答案无机化学是化学学科中的重要基础领域,对于理解化学原理和物质的性质具有关键作用。
天津大学无机化学第五版的习题是帮助学生巩固知识、提高能力的重要工具,而获取准确的习题答案对于学习效果的提升至关重要。
在这一版的无机化学教材中,习题涵盖了诸多方面的知识,包括原子结构、化学键、化学热力学、化学动力学、酸碱平衡、沉淀溶解平衡等等。
每一道习题都经过精心设计,旨在引导学生深入思考、灵活运用所学知识。
对于原子结构部分的习题,答案往往需要我们对量子力学的基本概念有清晰的理解。
例如,在计算原子中电子的能量、轨道半径等问题时,需要准确运用薛定谔方程和相关的量子数规则。
以氢原子为例,其电子的能量取决于主量子数 n,而轨道半径则与 n 的平方成正比。
通过这些习题的练习和答案的对照,我们能够更好地掌握原子结构的奥秘。
化学键的习题答案则涉及到离子键、共价键、金属键等多种类型。
在判断化合物中化学键的类型时,需要考虑元素的电负性差异、原子的价电子构型等因素。
对于共价键,还需要了解其键长、键能、键角等参数的意义和计算方法。
通过对这些习题答案的研究,我们能够深入理解不同化学键的特点和形成机制,为进一步学习化合物的性质打下坚实的基础。
化学热力学部分的习题答案通常围绕着热力学第一定律和热力学第二定律展开。
在计算热力学过程中的内能变化、焓变、熵变等物理量时,需要准确运用相关的公式和定律。
例如,在恒压过程中,焓变等于热量的变化;而熵变则可以通过热力学概率或者物质的状态变化来计算。
通过对这些习题答案的分析,我们能够学会如何运用热力学原理来判断化学反应的方向和限度,以及如何计算反应过程中的能量变化。
化学动力学的习题答案则侧重于反应速率的计算和影响因素的分析。
在确定反应级数、计算反应速率常数等问题时,需要根据实验数据进行合理的处理和分析。
同时,对于温度、浓度、催化剂等因素对反应速率的影响,也需要有清晰的认识和理解。
通过对这些习题答案的学习,我们能够掌握化学动力学的基本原理,从而更好地预测和控制化学反应的速率。
高校无机化学电极电势(天津大学第四版)讲义

电极反应
(-) Pt,H2(100kPa) H+(1mol·L-1) H+(1mol·L-1) H2(100kPa),Pt (+)
2H+ + 2e- → H2
4.2.3 电极电势的测定
2. 电极电势的测定
欲确定某电极的电极电势 可把该电极与标准氢电极组成原电池
E /V -3.040 -2.924 -0.7626
0 0.340 1.229 1.229 3.053
3.4
常用电对的标准电极电势(298.15K)
电对 Li+/Li K+/K Zn2+/Zn H+/H2 Cu2+/Cu O2/H2O Cl2/ClF2/HF(aq) XeF/Xe(g)
电极反应 Li+ + e- Li K+ + e- K EE ((XLei+F/ZL/Xni)e2最+)最+小2大e- Zn LXLXieie+F的的的的还氧还氧原2化原化H性性性+性+最最最最2强弱弱e强- 2H2 Cu2+ + 2e- Cu O2+4H+ + 4e- 2H2O Cl2 + 2e- 2ClF2+2H+ + 2e- 2HF(aq) XeF + e- Xe(g) + F-
K+ + e- K
Zn2+ + 2e- Zn
2H+ + 2e- 2H2 Cu2+ + 2e- Cu
O2+4H+ + 4e-
天津大学无机化学12-2 碳族元素课件

3.氟硅酸的酸性与硫酸相近
12-2-4 硅及其重要化合物
卤化物
通式为SiX4,均为无色 常温 SiF4 SiCl4 SiBr4 SiI4 制取 气体 液体 液体 固体
1.加热硅与氯 Si + 2Cl2 SiCl4 2.将二氧化硅、氯、碳直接加热
无机化学多媒体电子教案
第十二章 氮族、碳族和硼族元素
第二节 碳族元素
12-2-1 碳族元素概述
ⅢA 12Ⅳ-2A-1 碳Ⅴ族A元素ⅥA概述ⅦA
0 He 氦
2 B 硼 C 碳 N 氮 O 氧 F 氟 Ne 氖
3 Al 铝 Si 硅 P 磷 S 硫 Cl 氯 Ar 氩
4 Ga 镓 Ge 锗 As 砷 Se 硒 Br 溴 Kr 氪
SiO2+2C+2Cl2 SiCl4+ 2CO
12-2-4 硅及其重要化合物
卤化物
通式为SiX4,均为无色
1.常刺性温激质性气S无i体F色4 液液Si体C体l4
SiBr4 液体
SiI4 固体
2.易水解,在潮湿空气中产生浓烟
SiCl4+3H2O → H2SiO3 +4HCl
若NH3与SiCl4同时蒸发, 因生成NH4Cl,烟雾更浓
如 CaCO3(难溶)如Ca(HCO3)2(难溶)
易溶碳酸盐对应的碳酸氢盐溶解度较小
(2)水解性
碳酸盐
碳酸盐——水溶液呈碱性
2碳F酸e3+氢+盐3—CO—32- +水3H溶2O液→呈2微Fe碱(O性H)3 +3CO2
22可CAu溶l2+3+性++2碳C3酸OC32O-盐32+-H+可23O作H→2O沉C→淀u22(剂AOlH,()分2OCH离O)3某3 +些+3C离COO2子2
天津大学无机化学第五版习题答案

天津大学无机化学第五版习题答案天津大学无机化学第五版是众多化学专业学生学习的重要教材,而配套的习题对于巩固知识、提升能力起着关键作用。
然而,要获取准确且完整的习题答案并非易事。
首先,让我们来了解一下这本教材的特点和重要性。
天津大学无机化学第五版内容丰富、涵盖面广,包括化学原理、元素化学等多个方面。
它不仅注重基础知识的讲解,还紧跟学科前沿,引入了一些最新的研究成果和应用实例。
这使得学生在学习过程中,既能打下坚实的基础,又能拓宽视野,了解化学领域的最新动态。
对于教材中的习题,它们的设计精心且具有针对性。
通过完成这些习题,学生可以更好地理解和掌握所学的知识,提高分析问题和解决问题的能力。
然而,在解题过程中,学生可能会遇到各种各样的困难。
有些习题可能涉及到复杂的化学原理和计算,需要学生对相关概念有深刻的理解和熟练的运用能力。
比如,在化学平衡这一章节的习题中,要求计算平衡常数、判断反应的方向和限度等。
这就需要学生熟练掌握化学平衡的表达式、平衡常数的计算方法以及各种影响化学平衡的因素。
还有一些习题可能侧重于元素化学部分,要求学生熟悉各种元素的性质、化合物的制备和反应。
例如,在卤素这一元素族的习题中,可能会问到氯、溴、碘等元素的氧化性强弱比较,以及它们与其他物质的反应方程式的书写。
面对这些难题,学生们往往希望能够有一份详细准确的习题答案作为参考。
但是,仅仅依靠答案并不能真正提高学习效果。
重要的是,要通过自己的思考和努力去解题,然后对照答案进行检查和反思。
在寻找天津大学无机化学第五版习题答案的过程中,学生们可以通过多种途径。
其一,可以向老师请教。
老师具有丰富的教学经验和专业知识,能够给予学生针对性的指导和解答。
其二,可以与同学交流讨论。
同学们在解题过程中可能会有不同的思路和方法,通过交流可以相互启发,共同提高。
此外,现在网络上也有一些相关的学习资源。
但需要注意的是,网络上的答案质量参差不齐,有些可能存在错误。
因此,在参考网络答案时,要保持谨慎,进行仔细的甄别和判断。
(完整版)天津大学无机化学考试试卷(下册)及答案

天津大学无机化学考试试卷(下册)答案一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画X)(每小题1分,共10分)1、( X)在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
2、( X)SnS溶于Na2S2溶液中,生成硫代亚锡酸钠。
3、( X )磁矩大的配合物,其稳定性强。
4、( X)氧族元素氢化物的沸点高低次序为H2O>H2S>H2Se>H3Te。
5、( √)已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
6、( √)如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
7、( X)硼是缺电子原子,在乙硼烷中含有配位键。
8、( √)在浓碱溶液中MnO4-可以被OH-还原为MnO42-。
9、( √)配合物Na3[Ag(S2O3)2]应命名为二硫代硫酸根合银(Ⅰ)酸钠。
10、( X)Pb(OAc)2是一种常见的铅盐,是强电解质。
二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(每小题1分,共20分)1、在下列各种酸中氧化性最强的是............... ( B)。
(A)HClO3;(B)HClO;(C)HClO4;(D)HCl。
2、下列浓酸中,可以用来和KI(s)反应制取较纯HI(g)的是............... ( C)。
(A)浓HCl;(B)浓H2SO4;(C)浓H3PO4;(D)浓HNO3。
3、用于说明Pb(Ⅳ)具有强氧化性的是............... ( D)。
(A)熵效应;(B)螯合效应;(C)屏蔽效应;(D)惰性电子对效应。
4、美国的阿波罗飞船上的天线是用钛镍合金制成的,这是因为钛镍合金. ............... ( C)。
(A)机械强度大;(B)熔点高;(C)具有记忆性能;(D)耐腐蚀。
(完整版)无机化学(天津大学版)

(完整版)⽆机化学(天津⼤学版)第⼀章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)⽤于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想⽓体状态⽅程pV = nRT6.理想⽓体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表⽰化学反应进⾏程度的物理量,符号为ξ,单位为mol。
随着反应的进⾏,任⼀化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,⽽与状态变化的途径⽆关。
10.热和功体系和环境之间因温差⽽传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热⼒学能(U)体系内部所含的总能量。
12.能量守恒定律孤⽴体系中能量是不会⾃⽣⾃灭的,它可以变换形式,但总值不变。
13.热⼒学第⼀定律封闭体系热⼒学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下⽓体:纯⽓体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔⽣成焓()最稳定的单质─────—→单位物质的量的某物质=18.标准摩尔反应焓变()⼀般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(⽣成物) + Σνi(反应物)第⼆章化学反应的⽅向、速率和限度[学习指导]1.反应速率:单位体积内反应进⾏程度随时间的变化率,即:2.活化分⼦:具有等于或超过E c能量(分⼦发⽣有效碰撞所必须具备的最低能量)的分⼦。
天津大学无机化学课件第十章碱金属和碱土金属共45页PPT资料

铍镁钙锶钡镭
31.08.2019
课件
4
无机化学多媒体电子教案
第结十束章 碱金属和碱土金属元素
第一节
结束
31.08.2019
课件
5
无机化学多媒体电子教案
第第十二章节s碱区金元属素和概述碱土金属元素
第二节
碱金属和
碱土金属的性质
31.08.2019
课件
6
10-2 碱金属和碱土金属的性质
31.08.2019
课件
16
无机化学多媒体电子教案
第结十束章 碱金属和碱土金属元素
第二节
结束
31.08.2019
课件
17
E (Li+/Li)可用焓变粗略估计
M(s)
+
H+(aq)
→
M+(aq)
+
1 2
H2(g)
rGm = -z’FE
= -z’F{ E (H+/H2) - E (Li+/Li)}
31.08.2019
课件
2
碱金属和碱土金属的存在
ⅠA Li Na K Rb Cs Fr
锂钠钾铷铯钫 最重要的矿石是锂辉石 Ⅱ主我A 要国主矿青海B铍要物海e洋以是钾、NM(钾 盐镁盐aCgL石储湖li形A矿量和C钙l式S(占岩a2i存2KO全石C在6)国中锶Sl·r于M96g.8CB钡%la2·6HR2镭Oa)
碱土金1属. 具有较高的导电性
M(s)+(23x..+化稀2y学碱)N性 金H3质属⇌与氨M金溶2+(属液NH本是3)身还x+2相原e-同剂(NH3)y
31.08.2019
天津大学无机化学ppt课件下载

Inorganic Chemistry
绪论 1学时 第一章 化学反应中 的质量关系和能量 关系(3学时)
目 录
第二章 化学反应的 方向、速率和限度 (8学时)
第三章 酸碱反应和 沉淀反应(7学时)
§1 化学中的计量 §2 化学反应中的质量关系 §3 化学反应中的能量关系
1学时 1学时 1学时
光 学 纤 维 胃 镜
用光导纤维 做手术,不 用开刀
20/51
F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破敌 火力网,压制敌方防空系统,摧毁严密防守的指挥所、战略要地 、重要工业目标,还可执行侦察任务,具有一定空战能力。21/51
近年发现和发明的新物质层出不穷,如球碳、管碳、俄 罗斯套娃、团簇化合物、笼合物等。
§1 镧系元素和锕系元素该素 §2 稀土元素
6/51
1 化学的研究对象 绪论 2 化学的主要分支
3பைடு நூலகம்怎样学习化学
7/51
什么是化学?它研究的对象是什么?如何才能学好化 学?这是开始学化学首先要解决的问题。下面就从回答这些 问题来开始我们的化学学习。
一.化学研 究的物质
物质是不依赖于人们的感觉而存在并且可以 被人们的感觉所认识的客观实在。简而言之,物 质是客观存在的东西。
36/51
(2)炼金术、炼丹时期(公元前后—公元 1500年)
➢ 中国炼丹术的产生有两个原因:一是五行说(五 行无常胜),此为理论基础;二是封建主的贪得 无厌,梦想长生。战国末期有了炼丹术,汉代有 较大发展,唐代达到高潮。当时所谓的丹主要是 三仙丹HgO,丹砂HgS,铅丹Pb3O4等。这些丹 实际上都是剧毒的,许多皇帝因服丹而亡。
1学时 3学时 4学时
高校无机化学沉淀反应(天津大学第四版)讲义

例 在10mL0.10mol· L-1MgSO4溶液中加入10mL
NH3· H2O NH4 + OH平衡浓度/(mol· L-1) 0.050-x x x x· x x· x -5 Kb = 0.050-x ;0.050-x≈0.050; 1.8×10 = 0.050 x=9.5×10-4 c(OH-)=9.5×10-4 mol· L-1
+
例 在10 mL 0.10 mol· L-1 MgSO4溶液中加入10
2. 影响沉淀反应的因素 同离子效应——使难溶电解质溶解度降低 平衡移动方向 如 BaSO4(s) Ba2+ + SO24 2Na2SO4 →2Na+ + SO4 例 计算BaSO4在0.10mol· L-1Na2SO4溶液 中的溶解度。(s=1.04×10-5 mol· L-1) 22+ 解: BaSO4(s) Ba + SO4 平衡浓度/(mol· L-1) x x+0.10
应用计算公式应注意:
2.不适用于难溶弱电解质
AB(s)
A+ + B-
s(AB)=c(AB)+c(A+)=c(AB)+c(B-) s=c(AB) + Ksp(AB) ×c
只有相同类型、基本不水解的难溶强电 解质,可直接根据溶度积大小来比较溶 解度的相对大小
Ksp s/(mol· L-1) 类型 难溶电解质 AgCl 1.77×10-10 1.33×10-5 -13 -7 AgBr 5.35 × 10 7.33 × 10 AB AgI 8.52×10-17 9.25×10-9 AB2 MgF2 6.5×10-9 1.2×10-3 A2B Ag2CrO4 1.12×10-12 6.54×10-5
天津大学无机化学第五版习题答案解析

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数 4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律p (N 2) = 7.6⨯104 Pa p (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ =m f H ∆(CO 2, g) = -393.509 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
最新-天津大学无机化学第五版习题答案 精品

第1章 化学反应中的质量关系和能量关系 习题参考答案1.解:1.00吨氨气可制取2.47吨硝酸。
2.解:氯气质量为2.9×103g 。
3.解:一瓶氧气可用天数33111-1222()(13.210-1.0110)kPa 32L9.6d 101.325kPa 400L d n p p V n p V -⨯⨯⨯===⨯⨯4.解:pV MpVT nR mR== = 318 K 44.9=℃ 5.解:根据道尔顿分压定律ii n p p n=p (N 2) = 7.6⨯104 Pap (O 2) = 2.0⨯104 Pa p (Ar) =1⨯103 Pa6.解:(1)2(CO )n = 0.114mol; 2(CO )p = 42.87 10 Pa ⨯(2)222(N )(O )(CO )p p p p =--43.7910Pa =⨯ (3)4224(O )(CO ) 2.6710Pa0.2869.3310Pan p n p ⨯===⨯ 7.解:(1)p (H 2) =95.43 kPa (2)m (H 2) =pVMRT= 0.194 g 8.解:(1)ξ = 5.0 mol(2)ξ = 2.5 mol结论: 反应进度(ξ)的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
9.解:∆U = Q p - p ∆V = 0.771 kJ 10.解: (1)V 1 = 38.3⨯10-3m 3= 38.3L(2) T 2 =nRpV 2= 320 K (3)-W = - (-p ∆V ) = -502 J (4) ∆U = Q + W = -758 J (5) ∆H = Q p = -1260 J11.解:NH 3(g) +45O 2(g) 298.15K−−−−→标准态NO(g) + 23H 2O(g) m r H ∆= - 226.2 kJ ·mol -1 12.解:m r H ∆= Q p = -89.5 kJ m r U ∆= m r H ∆- ∆nRT= -96.9 kJ13.解:(1)C (s) + O 2 (g) → CO 2 (g)m r H ∆ = m f H ∆(CO 2, g) = -393.518 kJ ·mol -121CO 2(g) + 21C(s) → CO(g)m r H ∆ = 86.229 kJ ·mol -1CO(g) +31Fe 2O 3(s) → 32Fe(s) + CO 2(g)m r H ∆ = -8.3 kJ ·mol -1各反应 m r H ∆之和m r H ∆= -315.6 kJ ·mol -1。
无机化学(天津大学版)

第一章化学反应中得质量关系与能量关系[学习指导]1。
“物质得量”(n)用于计量指定得微观基本单元或其特定组合得物理量,其单位名称为摩[尔],单位符号为mol。
2、摩尔质量(M)M= m/n3、摩尔体积(V m)V m = V/n4、物质得量浓度(cB)c B = nB/V5、理想气体状态方程pV = nRT6、理想气体分压定律p= Σp B ;p B=(nB/n)p7、化学计量式与化学计量数O =ΣνB B ;νBﻫB8、反应进度(ξ)表示化学反应进行程度得物理量,符号为ξ,单位为mol。
随着反应得进行,任一化学反应各反应物及产物得改变量:ΔnB=νBξ9、状态函数状态函数得改变量只与体系得始、终态有关,而与状态变化得途径无关。
10、热与功体系与环境之间因温差而传递得热量称为热.除热以外,其它各种形式被传递得能量称为功.11、热力学能(U)体系内部所含得总能量。
12、能量守恒定律孤立体系中能量就是不会自生自灭得,它可以变换形式,但总值不变。
13、热力学第一定律封闭体系热力学能得变化:ΔU= Q+WﻫQ > 0,W> 0, ΔU > 0;Q〈 0, W〈0, ΔU < 0。
14、恒压反应热(Qp)与反应焓变(Δr Hm)H(焓)≡ U + pV,Q p = ΔrHm15、赫斯定律Q p= ∑Q B,Δr H m= ∑Δr Hm(B)ﻫBB16、标准状况: p= 101、325kPa, T= 273、15 K标准(状)态:pθ= 100kPa下ﻫ气体:纯气体物质液体、固体:最稳定得纯液体、纯固体物质。
ﻫ溶液中得溶质:摩尔浓度为1mol·L-1ﻫ标准态下17 ﻫ、标准摩尔生成焓() 最稳定得单质─────-→ 单位物质得量得某物质=18、标准摩尔反应焓变() 一般反应cC + dD = yY + zZ=[y(Y) + z(Z)]— [c(C)+d(D)]=Σνi(生成物) + Σνi(反应物)第二章化学反应得方向、速率与限度[学习指导]1、反应速率:单位体积内反应进行程度随时间得变化率,即:2、活化分子:具有等于或超过E c能量(分子发生有效碰撞所必须具备得最低能量)得分子。
(完整版)天津大学无机化学考试试卷(上册)答案.docx
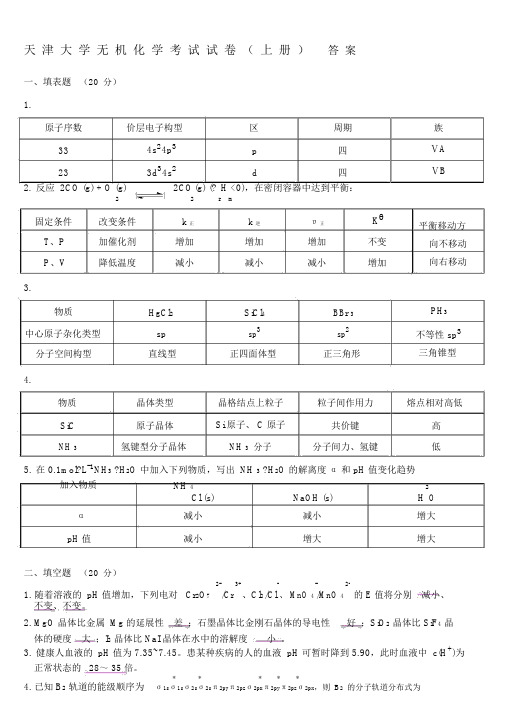
天津大学无机化学考试试卷(上册)答案一、填表题(20分)1.原子序数价层电子构型区周期334s24p3p四233d34s2d四2.反应 2CO (g) + O (g)2CO(g) (?H <0),在密闭容器中达到平衡:22r m固定条件改变条件k 正k 逆υ正KθT、P加催化剂增加增加增加不变P、V降低温度减小减小减小增加3.物质HgCl2SiCl4BBr 3中心原子杂化类型sp sp3sp2分子空间构型直线型正四面体型正三角形4.族ⅤAⅤB平衡移动方向不移动向右移动PH3不等性 sp3三角锥型物质晶体类型晶格结点上粒子粒子间作用力熔点相对高低SiC原子晶体Si 原子、 C 原子共价键高NH 3氢键型分子晶体NH 3分子分子间力、氢键低5.在 0.1mol?L-1NH3 ?H2O 中加入下列物质,写出 NH 3 ?H2O 的解离度α和 pH 值变化趋势加入物质NH 4NaOH (s)2 OCl (s)H α减小减小增大pH 值减小增大增大二、填空题(20分)2-/Cr 3+、Cl2-、 MnO 4-2-的 E 值将分别减小、1. 随着溶液的 pH 值增加,下列电对 Cr2O7/Cl/MnO 4不变、不变。
2. MgO 晶体比金属 Mg 的延展性差;石墨晶体比金刚石晶体的导电性好;SiO2晶体比 SiF4晶体的硬度大;I2晶体比 NaI 晶体在水中的溶解度小。
3.健康人血液的 pH 值为 7.35~7.45。
患某种疾病的人的血液 pH 可暂时降到 5.90,此时血液中 c(H+)为正常状态的28~ 35 倍。
*****4. 已知 B2轨道的能级顺序为σ1sσ1sσ2sσ2sπ2pyπ2pzσ2pxπ2pyπ2pzσ2px,则B2的分子轨道分布式为2* 2 2 * 2 1 1。
(σ1s ) (σ1s ) (σ2s ) (σ2s ) (π2py ) (π2pz ) ,成 数目及名称 两个 子 π ,价 构式θ θ - /Mn 2+ θ 4+ 2+5. 根据 E (PbO 2/PbSO 4) >E (MnO 4 ) >E (Sn /Sn ),可以判断在 成 的六种物 中,氧化性最的是 PbO 2 , 原性最 的是Sn 2+ 。
天津大学《无机化学》课程教学大纲

天津大学《无机化学》课程教学大纲一.课程的性质与目的无机化学是化学的一个分支,是高等学校化学、化工、药学、轻工、材料、纺织、环境、冶金地质等类有关专业的第一门化学基础课。
本课程的任务是:提供化学反应的基本原理、物质结构的基础理论、元素及其化合物的基础知识。
其目的是培养学生具有解决一般无机化学问题、自学无机化学书刊的能力。
因此它是培养上述各类专业技术人才的整体知识结构及能力结构的重要组成部分,同时也为后继化学及其它课程打下基础。
二.教学基本要求1. 在教学过程中,注意运用辩证唯物主义观点和科学思维方法阐明问题,结合科技和学科发展的实际,适当反映现代无机化学的新知识、新领域,注意理论联系实际,培养学生分析问题和解决问题的能力。
2. 基本要求大体划分三个层次:“了解”(或“学习” )、“理解”(或“熟悉” )、“掌握”(或“学会”、“能” ),这三个层次的要求依次提高。
三.教学内容1. 理论部分(1)化学反应速率了解化学反应速率方程(质量作用定律)和反应级数的概念。
能用活化能和活化分子概念说明浓度、分压、温度、催化剂对均相反应速率的影响。
了解影响多相反应速率的因素。
(2)化学平衡掌握化学平衡概念及平衡移动规律,理解反应速率和化学平衡在实际应用中需综合考虑的必要性。
掌握弱电解质的解离度、稀释定律、溶液的酸碱性和pH值、解离平衡(含分级解离平衡)、盐的水解、同离子效应、缓冲溶液、溶解-沉淀平衡、溶度积规则、氧化还原平衡和电极电势、配位平衡等内容,并能分析多重平衡系统中的成分及其相互影响。
能用平衡常数(Kθ)进行有关计算。
能计算一元弱酸、一元弱碱的解离平衡组成以及同离子效应和缓冲溶液的pH值。
能用溶度积规则判断沉淀的产生、溶解。
能用氧化数法、离子电子法配平氧化还原方程式;能通过能斯特方程式计算说明浓度(含酸度)、分压对电极电势的影响;会用电极电势判断氧化剂、还原剂的相对强弱和氧化还原反应进行的方向;会应用元素标准电极电势图讨论元素的有关性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章化学反应中的质量关系和能量关系[学习指导]1.“物质的量”(n)用于计量指定的微观基本单元或其特定组合的物理量,其单位名称为摩[尔],单位符号为mol。
2.摩尔质量(M) M = m/n3.摩尔体积(V m)V m = V/n4.物质的量浓度(c B)c B = n B/V5.理想气体状态方程pV = nRT6.理想气体分压定律p= Σp B ;p B = (n B/n)p7.化学计量式和化学计量数O = ΣνB B ;νBB8.反应进度(ξ)表示化学反应进行程度的物理量,符号为ξ,单位为mol。
随着反应的进行,任一化学反应各反应物及产物的改变量:Δn B = νBξ9.状态函数状态函数的改变量只与体系的始、终态有关,而与状态变化的途径无关。
10.热和功体系和环境之间因温差而传递的热量称为热。
除热以外,其它各种形式被传递的能量称为功。
11.热力学能(U)体系内部所含的总能量。
12.能量守恒定律孤立体系中能量是不会自生自灭的,它可以变换形式,但总值不变。
13.热力学第一定律封闭体系热力学能的变化:ΔU = Q + WQ > 0, W > 0, ΔU > 0;Q < 0, W< 0, ΔU < 0。
14.恒压反应热(Q p)和反应焓变(Δr H m)H(焓) ≡ U + pV, Q p= Δr H m15.赫斯定律Q p= ∑Q B, Δr H m= ∑Δr H m(B)B B16.标准状况:p = 101.325kPa, T = 273.15 K标准(状)态:pθ= 100kPa下气体:纯气体物质液体、固体:最稳定的纯液体、纯固体物质。
溶液中的溶质:摩尔浓度为1mol·L-1标准态下17.标准摩尔生成焓()最稳定的单质─────—→ 单位物质的量的某物质=18.标准摩尔反应焓变()一般反应cC + dD = yY + zZ=[y(Y) + z(Z)] - [c(C)+ d(D)]=Σνi(生成物) + Σνi(反应物)第二章化学反应的方向、速率和限度[学习指导]1.反应速率:单位体积内反应进行程度随时间的变化率,即:2.活化分子:具有等于或超过E c能量(分子发生有效碰撞所必须具备的最低能量)的分子。
3.活化能(1)经验活化能:活化分子具有的平均能量()与反应物分子的平均能量()之差称为反应活化能(E a)。
(2)过渡状态理论中的势能垒:反应进行所必须克服的势能垒(E b)。
4.反应物浓度对反应速率的影响──质量作用定律cC + dD —→ yY + zZ对于基元反应υ= k{c(C)}c·{c(D)}d5.熵变、吉布斯自由能变计算式:=Σνi(生成物) + Σνi(反应物)=Σνi(生成物) + Σνi(反应物)6.吉布斯公式:Δr G m =Δr H m - TΔr S m(T)≈(T)-T(T)7.化学反应方向的判据:8.Δr G m与的关系:Δr G m =+ RT ln J9.实验平衡常数表达式:例cC(g) + dD(g) yY(g) + zZ(g),10.标准平衡常数关系式:11.转化率(α):反应前后体积不变,又可表示为:12.平衡移动原理:当体系达平衡后,若改变平衡状态的任一条件(如浓度、压力、温度),平衡就向着能减弱其改变的方向移动。
第三章酸碱反应和沉淀反应学习指导1. 水的离子积2. pH值3. 弱酸(HA)的解离常数:4. 解离度和稀释定律α为表征弱电解质解离程度大小的特征常数5. 弱酸、弱碱溶液pH值的计算6. 同离子效应:弱电解质溶液中,加入含有相同离子的易溶强电解质而使弱电解质解离度降低的效应。
7. 缓冲溶液:具有保持pH值相对稳定作用的溶液。
8. 盐类水解反应:盐的组分离子与水解离出来的H+或OH-结合成弱电解质的反应。
9. 水解常数:一元弱酸强碱盐一元弱碱强酸盐一元弱酸弱碱盐10. 影响水解度的因素:一般来说,水解产物的解离度越小、溶解度越小;盐溶液的浓度越小,温度越高,盐的水解度越大。
11. 溶度积:一定温度下,难溶电解质的饱和溶液中,各组分离子浓度幂的乘积为一常数。
溶解A mB n(s) mA n+ + nB m-沉淀12. 溶度积与溶解度的换算:13. 溶度积规则:14. 离子沉淀完全的要求:c(M n+) < 10-5mol·L-115. 分步沉淀:离子积(J)首先超过溶度积的难溶电解质先沉出。
16. 溶解难溶电解质的常用方法:生成弱电解质;氧化还原法;生成配离子。
17. 沉淀转化:相同类型的难溶电解质,溶度积较大的易转化为溶度积较小的。
不同类型的难溶电解质,溶解度较大的易转化为溶解度较小的。
第四章氧化还原反应[学习指导]1.氧化还原反应: 参加反应的物质之间有电子转移的化学反应。
2. 氧化数(氧化值):某一元素原子在其化合态中的形式电荷数。
3. 氧化还原反应方程式的配平方法:氧化值法;离子-电子法。
4. 原电池:能使氧化还原反应产生电流的装置。
5. 氧化还原电对:电极反应中氧化型和相应的还原型物质组成的电极。
6. 标准电极电势:标准状态下,以标准氢电极为比较标准测出的某电极的相对电势。
7.电池的标准电动势:Eθ = Eθ(+) - Eθ(-)8.能斯特方程式:9. 影响电极电势的因素:(1) 电极的本性;(2) 离子的浓度或气体分压;(3) 温度;(4) 溶液酸碱性;(5) 沉淀或弱电解质的生成。
10.电极电势的应用(1) 判断原电池的正、负极,计算原电池的电动势;(2) 判断氧化剂、还原剂的相对强弱;(3) 计算弱电解质的解离常数;(4) 计算难溶电解质的溶度积;(5) 判断氧化还原反应的方向和限度;11.原电池的电动势和电池反应的Δr G m与原电池的电动势与电极电势的关系:Δr G m = -Z'FE == Z'F[E(+)-E(-)]= -Z'FEθ == Z'F[Eθ(+)- Eθ(-)]12.氧化还原反应方向的判据: E > 0, 氧化还原反应能自发进行。
13.氧化还原反应限度可以用其化学平衡常数Kθ来衡量。
Kθ的计算公式为:14. 元素标准电极电势图的应用:(1) 计算电对的标准电极电势:(2) 发生歧化反应的判据: 电势图中, Eθ(右) > Eθ(左)(3) 解释元素的氧化还原特性。
第五章原子结构与元素周期性[学习指导]1. 原子和元素:原子是组成物质的基本单元,由一个原子核和若干个核外电子组成。
元素是具有一类单核粒子的总称。
2. 核素、同位素、同量素:具有确定原子数和中子数的单核粒子称为核素。
质子数相同而中子数不等的同一种元素的原子互称为同位素。
质量数相同而原子序数不同的元素称为同量素。
3. 微观粒子具有波粒二象性。
4. 波函数与原子轨道:波函数是描述核外电子运动状态的数学表达式,其空间图像称“原子轨道”。
5. 概率密度与电子云:电子在原子核外空间某处单位体积内出现的概率称为概率密度(│ψ│2),用小黑点代替其分布所得的空间图象称为电子云。
6. s.p.d原子轨道的空间图象。
7. 量子数:描述原子中个电子状态的四个参数(主、副、磁、自旋量子数)。
8. 基态原子中电子分布原理:泡利不相容和能量最低原理,洪特规则。
9. 鲍林近似能级图和核外电子填入轨道顺序:→ n s → (n-2)f →(n-1)d → n p10. 元素在周期表中的位置(周期、区、族),由该元素原子核外电子的分布所决定。
11. 原子性质的周期性:┌ │ ┤│└共价半径:两个相同原子形成共价键时,其核间距离的一半。
原子半径(r)金属半径:金属单质晶体中,两个相邻元素原子间距离之半。
范德华半径:单质分子晶体中,相邻分子距离最近的两个原子核间距之半。
第一电离能(I1):基态的气态原子失去一个电子变为氧化数加一的气态阳离子所需的能量。
第一电自亲合能(E A1):基态的气态原子得到一个电子形成氧化值-1的气态阴离子所释放的能量。
电负性(χ):分子中元素原子吸到电子的能力。
第六章分子的结构与性质[学习指导]1.化学键:分子内或晶体内相邻原子(或离子)间强烈的相互吸引作用。
2.共价键(1) 定义:原子间由于成键电子的原子轨道重叠形成的化学键。
(2) 特征:具有方向性和饱和性。
(3) 分类:按极性分按原子轨道重叠部分的对称性分(4) 配位共价键:共用电子由一个原子单方面提供形成的共价键。
3.价键理论要点(1) 两原子接近时,自旋方向相反的未成对的价电子可以配对成键;(2) 成键电子的原子轨道重叠越多,所成共价键越稳定。
4.离子键:阳、阴离子间的静电引力。
无方向性、无饱和性。
5.s-p杂化与分子几何构型的关系(见表6-4)。
6.运用n=2的同核双原子分子轨道能级图推测一、二周期元素同核双原子分子的存在并阐明其结构;预言分子的顺磁性与反磁性。
7.分子的极性与变形性正负电荷中心不重合的分子称极性分子。
分子极性大小以分子偶极矩(μ=q×d)大小来量度。
μ=0的则为非极性分子。
衡量分子变形性大小的标度为分子极化率(α)。
8.分子间力取向力--固有偶极之间的吸引力。
诱导力--固有偶极与诱导偶极之间的吸引力。
色散力--瞬时偶极之间的吸引力。
结构相似的同系列物质,分子间力越大,物质熔点、沸点越高,硬度越大。
溶质与溶剂分子间力越大,互溶度越大。
9.氢键对物质性质的影响(1) 分子间形成氢键,物质的熔、沸点升高,分子内形成氢键,熔、沸点降低。
(2) 溶质与溶剂分子间形成氢键,互溶度越大。
(3) 分子间有氢键的液体,一般粘度较大,分子易缔合。
第七章固体的结构与性质[学习指导]1.晶体的特征:有一定几何外形;有固定的熔点;各向异性。
2.离子晶体、原子晶体、分子晶体、金属晶体的特征及性质(见表7-2)。
3.三种典型的A-B型离子晶体类型:NaCl型、CsCl型、ZnS型。
4. 晶格能(U)越大,该离子晶体越稳定。
5.金属键:金属晶体中金属原子间的结合力。
6.应用能带理论解释金属的物理性质和阐明导体、半导体及绝缘体的特性。
7.混合型晶体:层状、链状。
8.实际晶体点缺陷类型:空穴、置换、间充。
9.实际晶体的键型变异。
10. 离子的电子构型:2e、8e、(9~17e)、18e、(18+2)e 。
11.离子极化(1) 离子极化力:阳离子的电荷越多、半径越小,极化力越强;不同电子构型离子的极化力 18e、(18+2)e、2e >(9~17e) > 8e。
(2) 离子变形性:离子半径越大,变形性越大。
电子构型相同:阴离子>阳离子离子电荷相同、半径相近:(18+2)e、18e、(9~17e) >> 8e 电场强度(E)一定,极化率(α)越大,变形性越大。
