Williamson 合成法
Williamson反应合成2-月桂氧基-N%2cN-二甲基乙胺

第22卷第7期化学研究与应用V01.22,No.7 2010年7月C he m i ca l R es ea r ch an d Appl ic at io n July,2010文章编号:1004—1656(2010)07-0853-05Williamson反应合成2一月桂氧基一Ⅳ,Ⅳ一二甲基乙胺沈斌,陈洪龄。
(南京工业大学化学化工学院,材料化学工程国家重点实验室,江苏南京210009)摘要:采用Williamson合成方法,以|7、r,^L二甲基乙醇胺(C.H¨NO)、氯代十二烷(C,2H笱a)及固碱(KOH)为原料,环己烷为带水剂,合成了2.月桂氧基.Ⅳ,M二甲基乙胺(C,6H35NO)。
对影响醚化反应各因素:原料配比、反应温度、反应时间以及催化剂的种类进行了探讨。
用气相色谱法分析了产物含量,并用丌'·IR、C,C-MS和元素分析表征了产物结构。
实验结果表明最佳工艺条件为:n(C4H。
NO):n(C,:H签CI):n(KOH)=1.7:1.0:O.6;醚化反应温度:100℃;醚化反应时间:6h;催化剂:PEG-4(D(5m01%K OH),在此条件下2-月桂氧基-j\『。
Ⅳ.二甲基乙胺收率可达84.4%。
关键词:2-月桂氧基W,M二甲基乙胺;Ⅳ,Ⅳ-二甲基乙醇胺;氯代十二烷;W illiamson反应中图分类号:0623.732文献标识码:AWilliamson re a c t io n Synthesis of2-alkoxy-N,N-dimethylethylaminesSHEN Bin,CHEN Ho n g-l i n g‘(College of Che mi st ry a nd C h e mi c a l Engi neeri ng,St ate K e y Laboratory of Mater ial s-O rie nte dC he m i ca l Engineering,Nanjing University of Technology,Nanjing 210009,Chin a)Abstract:2-Alkoxy-N,N-dimethylethylamines(C16 H,5NO)Wal l prep ar ed f r om N,N-dimethyl ethan olam ine(c.Hll NO),l aury l 棚喇de(C12H笱c1)and pohlssi um hydroxide(KOH)with water-c埘ying age nt of cycloh exa ne.T he var io us i n f lu e nc i ng fa c to m of etheri ficat ion,such∞ma teria l ratio,rea ctio n tempera tur e,re aGm on time and c a ta l y s t sp ec i es w ere discusse d.The purity of2-alk ox y-N。
乙二醇甲代烯丙基醚的合成研究

乙二醇甲代烯丙基醚的合成研究摘要乙二醇(ethylene glycol)又名“甘醇”“1,2-亚乙基二醇”简称EG。
化学式、,为(HOCH2)2,是最简单的二元醇,其分子上的羟基可进行酯化、醚化等反应。
甲代烯丙基氯(MAC)是一种重要的有机中间体,在α-C 上连有氯原子,属于烯丙型卤代烃,其α-C—X 键很活泼,卤原子极易被亲核试剂(如醇钠)取代。
乙二醇单甲代烯丙基醚是重要的有机合成中间体,常用于保护基、聚合物单体或交联剂,此外,乙二醇单甲代烯丙基醚结构可以结合氧和聚合,也可以作为聚羧酸系减水剂的合成单体。
本文主要研究乙二醇与甲代烯丙基氯在碱性条件下醚化并制取乙二醇单甲代烯丙基醚,通过改变甲代烯丙基醚的用量、反应温度及反应时间研究此三种因素对反应的影响,并制定出乙二醇单甲代烯丙基醚的最佳合成条件。
研究表明乙二醇单甲代烯丙基醚的最佳合成条件是:甲代烯丙基氯:氢氧化钠:乙二醇=1.2:1.2:5(摩尔比),其中氢氧化钠配成48﹪的氢氧化钠溶液;反应时间是6h;反应温度是前三个小时60℃,后三小时70℃。
在此最佳条件下乙二醇单甲代烯丙基醚的收率可达91.14﹪关键词:乙二醇;甲代烯丙基氯;卤代烃;醚化反应;Williamson 合成1 绪论乙二醇单烯丙基醚类化合物是一种非常有用的双官能团化学中间体,其分子结构如图:图 1 乙二醇单甲代烯丙基醚其分子上的羟基可发生酯化、醚化、加成聚合等常见反应,如与环氧乙烷发生加成聚合形成不饱和聚醚。
图2 乙二醇单甲代烯丙基醚与环氧乙烷的加成聚合反应而其分子上的双键可以在一定条件下聚合成乙烯基梳型聚合物(comb polymer)。
图3 乙二醇单甲代烯丙基醚在引发剂作用下发生聚合反应当其末端羟基与聚乙二醇链节连接时所形成的梳型聚合物具有亲水亲油的两亲属性,具有分散、润湿等高分子表面活性剂的特性。
工业上以题述化合物为原料制得的不饱和聚醚再与丙烯酸等小分子单体聚合可合成得到聚羧酸高性能减水剂。
第二章:烃化反应(1,2节)

CH2CH2NMe2
N
+ ClCH CH NMe . HCl
2 2 2
NaNH2 / Tol , 6h
N
80%
Na2CO3 145~159oC , 2 h 73%
CH3CH(CH3)3
Br
N
O
+
OMe
Na2CO3 CH3CH2(CH4)3
NH N O N
145~150 oC , 8h 93%
NH2
N
Meo
,6h
NH2NH2 (80%) / EtOH
CH3CH2(CH4 )3
NH N
H N N NH
O
CH3CH2 (CH4 )3
NH2 Cl COOH Cl HOOC
CuSO4 / NaOH + pH 5~6 ,
Cl NH
56%
NH2
COOH F3C Cl HOOC
+
CF3
Cu/ K2CO3 105~110oC 73%
HCl
NH
pH=4
3.杂环胺的N 3.杂环胺的N-烃化 杂环胺的 抗组胺药的合成
NHCH2Ph
PhH2CN
第二章
烃化反应
用烃基取代有机分子中的氢原子( 用烃基取代有机分子中的氢原子(官 能团上或碳骨架上) 能团上或碳骨架上)
烃化底物: 烃化底物:
)、酚 醇(ROH)、酚(ArOH) )、 ) 胺类 活性亚甲基 芳烃
反应位点
OH NH CH2 Ar-H
氧原子上的烃化反应
醇的O 一、醇的O-烃化
1. 卤代烃为烃化剂
2. 位阻及螯合对烃化的影响
H O O OH OH O
MeI / NaOH
Williamson醚类合成反应甲基正丁基醚的制备

C C + C6H5CO2OH
O CC
+ C6H5COOH
4、醚類的反應:
(1)一般醚類是比較不具活性的化合物,通常僅進行一種被酸分裂
的反應。分裂僅發生在較強烈的條件--濃酸類(HI 或 HBr)及高
溫下。烷醚起初產生鹵烷與醇;該醇可進一步反應而形成第二莫耳的
鹵烷。
CH3
CH3 CH O
CH3 CH CH3
用於醫藥、香料、染料等工業中。密閉、避光儲
存。
1-Bromobutane
無色液體,比重 1.27,沸點 101.6℃,不溶於水
1-溴丁烷
但溶於酒精及乙醚。易燃,有起火的危險。可作
CH3(CH2)3Br Calcium Chloride
為烷基化試劑。 可行成一水合物、二水合物及六水合物。白色固
氯化鈣
體粉末,味鹹苦,易潮解。無水物比重 2.15,熔
秤重並計算產率
五、儀器裝置:
迴流裝置、蒸餾裝置、分液漏斗、燒杯及漏斗等
六、藥品性質:
Sodium Methoxide 白色粉末,易溶於甲醇、乙醇及水。遇光及空氣
甲醇鈉
中水易潮解成甲醇與氫氧化鈉。可由甲醇與金屬
CH3ONa
鈉反應後蒸去甲醇製得。工業品常為甲醇鈉的甲 醇溶液(23%)機合成反應中作鹼性縮合劑。廣泛
OCH3 + Na+ Br -
OCH3
三、實驗原理:
1、醚類為具有 C-O-C 結構的有機化合物總稱,而根據烴基的結構 可分為:
脂肪醚:兩個烴基是脂肪基(R-O-R') 芳香醚:兩個或一個烴基是芳香烴基(Ar-O-Ar') 當兩個烴基相同時,稱為對稱醚或單醚;當兩個烴基不相同時,稱為 非對稱醚或混合醚。 2、化學性質:一般比較穩定,不與水、氧化劑、還原劑、鹼或烯酸 起反應,但濃而熱的強酸會導致醚鍵的斷裂。其中乙醚是最重要的代 表物。 3、醚類的製備方法: (1)醇類的醚化反應(醇類的脫水法):
醚的化学式

醚的化学式
醚是一种在有机化学中常见的化合物,其化学式一般为 R-O-R',其中 R 和 R' 表示烷基或芳基基团。
醚具有较高的挥发性和不活泼性,常用作溶剂、麻醉剂等。
醚的制备方法多种多样,常见的有Williamson合成、Grignard 反应、金属钠法等。
其中Williamson合成是一种较为常用的合成方法,即通过醇和卤代烃反应制得醚。
醚的性质也十分丰富。
例如,醚具有较弱的氢键作用和较低的沸点,使其易于挥发。
此外,醚还能和水形成氢键,从而形成氢键络合物。
醚也可以发生亲核取代反应、酸催化裂解等反应。
总之,醚的化学式为 R-O-R',其制备方法和性质十分多样,是有机化学中不可或缺的一类化合物。
- 1 -。
六元环内酯的合成

六元环内酯的合成六元环内酯是一种含有六个成员的环状酯类化合物,广泛存在于自然界中,如某些天然产物、香料和药物分子中。
合成六元环内酯的方法多种多样,包括从简单的羟酸或其衍生物直接成环,以及通过多步有机合成构建复杂的环内酯结构。
以下是一些常见的合成六元环内酯的方法:1. 直接成环法:Fischer酯化反应:使用酸催化剂(如HCl或H2SO4)催化羟酸的自缩合反应,生成环内酯。
这种方法适用于制备简单的环内酯。
Yamaguchi酯化反应:使用2,4,6-三氯苯甲酰氯和4-二甲氨基吡啶(DMAP)作为催化剂,可以在温和条件下有效地将羧酸与醇酯化,适用于制备环内酯。
2. 内酯化反应:Williamson醚合成法:首先将羟基转化为良好的离去基团,如甲苯磺酸酯或卤素,然后与羧酸盐发生亲核取代反应,形成环内酯。
Mitsunobu反应:使用偶氮二羧酸二异丙酯(DIAD)和三苯基膦进行的反应,可以将醇与羧酸直接偶联,生成环内酯。
3. 环闭合反应:Seidel's方法:使用硒代羧酸作为起始物,通过硒代羧酸的还原消除反应形成环内酯。
Corey-Nicolaou大环内酯化反应:使用硫酯作为活化的酯基,通过硫酯的还原消除反应合成大环内酯。
4. 酶催化合成:- 利用脂肪酶或酯酶在有机溶剂中催化开环聚合或闭环反应,可以高选择性地合成手性环内酯。
5. 金属催化合成:- 使用钯、铑等过渡金属催化剂,可以通过C-C键形成反应合成复杂的环内酯结构。
6. 自由基反应:- 通过自由基加成到不饱和键上,随后环化形成环内酯,这类反应通常需要引发剂和适当的反应条件。
7. 分子内环化反应:- 利用分子内的亲电或亲核中心,通过分子内环化反应合成环内酯,如分子内Michael加成反应。
在合成六元环内酯时,需要考虑的因素包括原料的可用性、反应的条件、产物的收率和纯度、立体化学的控制以及所需官能团的兼容性。
合成策略的选择往往取决于目标分子的复杂性和所需的特定功能。
Williamson法合成正丁醚

Williamson法合成正丁醚
俞善信
【期刊名称】《江西教育学院学报》
【年(卷),期】1999(020)006
【摘要】在相转移催化剂溴化四下基铵存在下,正了醇、正丁基溴和氢氧化钠在90℃反应二小时,合成了正丁基醚,收率79%以上。
【总页数】2页(P45-46)
【作者】俞善信
【作者单位】湖南师范大学化学化工学院
【正文语种】中文
【中图分类】O623.423
【相关文献】
1.微波法合成正丁醚 [J], 桑国翠;戴咏川;赵德智
2.醚基功能化离子液体催化合成乙酸正丁酯 [J], 胡甜甜;赵地顺;武宇;张拴力;扈士海;翟建华
3.醋酸丁酯一步法乙氧基化合成聚乙二醇丁醚醋酸酯 [J], 张金昌;安维中;孟岩;赵宏斌;周立明;朱建民
4.微波常压法合成正丁醚--基础有机化学实验的一个改进 [J], 范平;杨淑琴;杨奇;葛春华
5.微波常压法合成正丁醚 [J], 范平;崔瑾;葛春华;高晓玮;杨春常
因版权原因,仅展示原文概要,查看原文内容请购买。
苯乙醚的制备
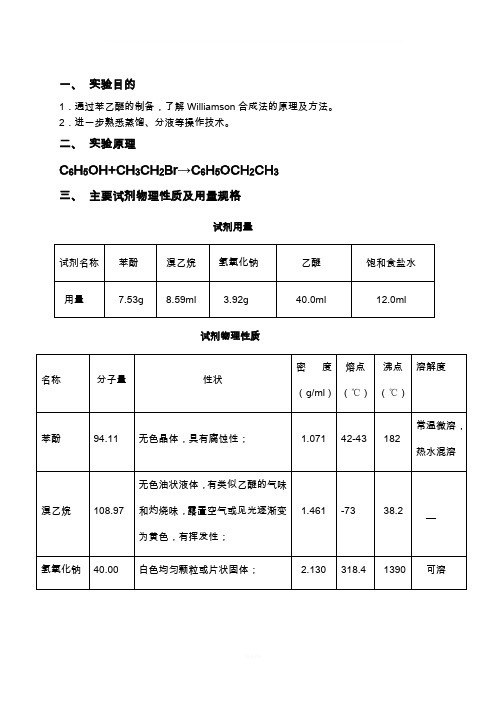
一、实验目的
1.通过苯乙醚的制备,了解Williamson合成法的原理及方法。
2.进一步熟悉蒸馏、分液等操作技术。
二、实验原理
C6H5OH+CH3CH2Br→C6H5OCH2CH3
三、主要试剂物理性质及用量规格
试剂用量
试剂物理性质
四、实验仪器及装置
仪器:三颈烧瓶(150mL)、球形冷凝管、搅拌器、空气冷凝管、温度计(200℃)、量筒、锥形瓶(100mL)、圆底烧瓶、玻璃棒、电炉
五、实验步骤及现象
六、实验结果
锥形瓶质量m=67.98g
产品和锥形瓶总质量M=71.67g
产品质量=M-m=71.67-67.98=3.69g
C6H5OH+CH3CH2Br→C6H5OCH2CH3
三组所取苯酚总质量=7.53+7.67+7.80=23.00 g
理论产量=23.00÷94×122=29.85g
实际产率=实际产量/理论产量×100%=3.69/29.85×100%=12.36%
七、结果与讨论
产率偏低原因分析
1、刚开始滴加溴乙烷时速度控制不当,溴乙烷的沸点为38.2℃,若控制不好滴速,在
80-90℃的水浴中很容易沸腾成气态,导致反应不完全。
2、分液时油层有损失,因为本组实验有机相在下层,水相在上层,且分液很困难,所以
损失较多。
蒸馏时温度最终稳定在148℃,不再上升的原因分析
1、苯乙醚的沸点为172℃,可能是混杂了苯酚,溴乙烷,水等杂志导致沸点降低。
Welcome To Download !!!
欢迎您的下载,资料仅供参考!。
药物合成反应重要人名反应整理 (2)

1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
有机化学试题

有机化学试卷(1)班级姓名一、选择题( 共5题10分)1.下面哪个原料在EtONa-EtOH作用下可以到(A) (B) ( C) (D)2. Williamson合成法是合成哪一种化合物的主要方法?(A) 酮(B) 卤代烃(C) 混合醚(D) 简单醚3. 比较下列化合物的酸性,正确的是:CH31.)COOH2.)CH3O CH2COOH3.)F CH2COOH 4.)CH3()3N+CH2COOHA 4 > 3 > 2 > 1B 1 > 2 > 3 > 4C 1 > 2 > 4 > 3D 1 > 3 > 2 > 44. 下列化合物中不具有芳香性的是:OA B C D5. 下面哪种RX易与格氏试剂发生偶联反应?二、填空题( 共6题20分)6. 写出下列反应的主要有机产物或所需之原料、试剂(如有立体化学问题请注明)。
7. 写出下列反应的主要有机产物或所需之原料、试剂(如有立体化学问题请注明)。
ClOHOHOHOHOH(B) CH2CHCH2X(A) (CH3)2CHXX(C) CH3CH2X(D)COOHCOOH?2Br2/P(3)(2)(1)H2/LindlarEt C CHNaEtBr?催化剂8. 画出顺-和反-1-乙基-4-叔丁基环己烷最稳定的构象。
9. 写出下列反应的主要有机产物,如有立体化学问题,也应注明。
10. 写出下列反应的主要有机产物或所需之原料、试剂(如有立体化学问题请注明)。
11.三、完成下列反应(共19题, 22分)12. 13.14.15.16.17.S +(CH 3)2OH -CH3HCl CH 3COCH 3OHOH +2( S -)CH 3CHCH 2CH 2PhOHPBr CH 2OHOH 3333OHOH H 3O+Cl CHClCH 332?CH 3C CH 2223318.19.20.21.22.23.24.25.HI26.27.NO2O2N NH4HS?28.??H2322O+C H(CH3CO)2OOHCO2H232BrClCH3COCH2CCOOHCH3COOHCCH3O23+BrCH CHCH2Br(CH3)3CCOOK+OH-CH2OCH3CCHOCH2OHCH2OHTHF, H2O2CHOFischer 式+Fischer 式OHHCNCHOOHHCH2OH29.?OCO 2Me1.NaBH 4+230.2. H 2O1.LiAlH 4???CH 3NH 2SOCl2CH 2COOH四、合成题 ( 共 7题 28分 )31. 由五个碳及五个碳以下有机物为原料合成:32. 如何实现下列转换?CH 3OHCH 3OH CHCH 2CH 3CH 333. 如何实现下列转变? 乙炔 氯丁二烯O 2H34. 以环己酮及C 2有机原料合成化合物OCH 2COOHCH 2CH 2CH 335. 如何实现以下转变:36. 如何实现下列转变?苯37. 完成下列转变:CH 3H 3C HDN(CH 3)2HH 3CCH 3DO CH 3CH 3O CH 3CH 3CH 3C 6H 4SH p _五、推结构题 ( 共 2题 11分 )38. 化合物A(C 16H 16)能使Br 2/CCl 4和KMnO 4溶液褪色,在常压下氢化,只吸收1molH 2。
Williamson反应合成二甘醇二甲醚的研究

表 1 物料配比对反应的影响1)
n (NaOH) / n (C5 H12O3) / 摩尔比 1. 1∶1. 0 1. 3∶1. 0 1. 4∶1. 0 1. 5∶1. 0 1. 6∶1. 0
收率/ % 80. 1 84. 3 90. 6 95. 3 95. 1
1) 反应条件 :仅改变配比 ,其它条件同 1. 4
将 500 mL 三颈烧瓶中加入二乙二醇单甲醚 1 mol (120. 0 g) ,和 NaOH 60. 0 g(1. 5 mol) ,装好普通蒸 馏装置 ,在0. 09 MPa 真空下升温至 90~100°C减压 蒸馏除去水 ,反应4. 0 h ,当反应液不再有水珠蒸出 时 ,开始通入氯甲烷 ,控制气体流量使计量的氯甲烷 在所需时间内通完 ,再继续在此反应的温度下反应 1. 0 h ,冷却 ,抽滤 ,所得滤渣用 100 mL 乙醇分 2~3 次浸泡 ,洗涤 ,抽滤从回收滤渣中的产物 ;合并滤液 并分馏 ,收集 161~163 °C 的馏分 ,即得二甘醇二甲 醚 (DMDE) ,色谱分析合成品纯度可达99. 9 %。 2 结果与讨论 2. 1 物料配比对反应的影响
表 2 反应温度对 DMDE 收率的影响1)
反应温度/ °C
收率Π%
70
81. 1
80
86. 4
90
95. 0
100
95. 3
110
80. 5
1) 固定 n (NaOH) / n (C5 H12O3) = 1. 5∶1. 0 ,制备二乙二醇单甲醚 钠盐反应温度 90~100°C。
从表 2 可知 : 由于实验中发现 ,反应温度低于 90°C ,反应物料易成固体 ,不利于提高产品收率 ,因 此适合反应温度为 90~100°C。 2. 3 CH3 Cl 通入时间对反应的影响
第10章醚和环氧化物

2–甲氧基戊烷 (2-methoxypentane)
CH3CH2O
CH3
1–乙氧基–4–甲苯 (1-ethoxy-4-methylbenzene)
CH3OCH2CH2OCH2CH2OCH3
β , β′ –二甲氧基乙醚 二甘醇二甲醚 (diglyme)
OCH3
CH=CH CH3 对甲氧基丙烯基苯
结构特点分析
a碳有亲电性, 但难亲核取代
醚在中性、碱性和弱酸性 条件下稳定,常用作溶剂
a碳有亲电性,可 亲核取代
H+
R' C O R
H
C上连有氧, H易被氧化
氧有碱性, 可与酸结合
H R' C O R
H
较好的 离去基
1、 盐的生成
R O R' 一种Lewis碱 pKb≈ 17.5
与强酸作用生成 盐:
O
(CH2)n
X
CH2 X
(CH2)n+1O
反应速率与环的大小 相关:
≥
>
>≥
>
O
O
O
O
O
O
反应速率依次减小
影响反应的因素: • X与–OH的距离愈小,愈易反应; • 环张力愈小,愈易反应。
4)立体专一性反应——邻基参与作用
分子内的Williamson反应 SN2反应机理
Br
Br
H3C H H3C H
H2O
H+
HO
烯与过氧化物氧化形成环氧物:
RCOOOH
O
CC
常用的过氧化物有H2O2,过氧乙酸,间 (氯)过氧苯甲酸,过氧三氟乙酸。
乙烯基醚的合成
在碱的催化下,醇与炔烃发生亲核加成反应, 生成烯基醚:
醇 和 醚(3)

SN2
CH3 I + HO
CH3 H CH3
• SN1 机理
CH3 CH3 I H O C CH3 CH3
SN2,位阻 , 影响为主
CH3 CH3 CH3 O H C CH3 I CH3 I OH + CH3 C CH3 CH3
第九章
醇 和 醚(3)
主要内容
醚的制备(williamson醚合成法,烯烃的烷氧汞化-脱 醚合成法, 醚的制备(williamson醚合成法 烯烃的烷氧汞化- 汞反应) 汞反应) 醚类的化学性质,酸性条件下C-O键的开裂 醚类的化学性质,酸性条件下C 环氧乙烷衍生物的酸性和碱性开环 冠醚及其性质和应用
例:完成转变 合成路线
H2C CH3 HO Br H2SO4 H3C
HO Br HO
CH3 CH3 C O CH3 H2O H+ HO Br NaC CH
CH3 H3C C O CH3
4. 烯烃的烷氧汞化 —— 还原(脱汞)反应 还原(脱汞) (Alkoxymercuration(Alkoxymercuration-Demercuration)
2. 1, 2-环氧化合物的酸性开环 2-环氧化合物的酸性开环
OH H R X H OH H R CN HCN R R'OH H
+
OH H R HX O H2O H
+
•反应取向: 反应取向:
HO
在取代基多 的一端开环
OH
H R R'O
•立体化学: 立体化学:
反式开环
酸性开环机理
O H R H+
Williamson反应合成2-月桂氧基-N,N-二甲基乙胺

化 学 研 究 与 应 用
Ch mia s a c n p l a in e c lRe e r h a d A p i t c o
Vo . 2, . / 2 No 7 J l, 0 0 uy 2 1
文章 编号 :0 4 15 ( 0 0 0 -8 30 10 —6 6 2 1 ) 70 5 -5
S HEN n, Bi CHEN n -i g’ Ho g- n l
( ol eo h ms yadC e i l n ier g S t K yL brt yo t i s i ne C l g f e ir n h mc g ei ,t e e aoao Mae a - e t e C t aE n n a rf r Or d l C e ia E g er g N ni nvr t o eh o g , aj g20 0 C ia hm c n n e n , aj gU i s y f cnl y N ni 10 9,hn ) l i i n e i T o n
二 甲基乙胺收率可 达 8. %。 44
关键 词 :. 氧基一 Ⅳ 二 甲基 乙胺 ;r . 甲基 乙醇胺 ; 2月桂 Ⅳ, - J, 二 ^Ⅳ 氯代 十二烷 ; la sn Wiim o 反应 l
中 图 分 类 号 : 6 3 72 0 2.3 文献标识码 : A .
S nt sso ako y・ , dm e h lt y a i sW ila s n e c i n y he i f2・ l x N N・ i t y e h l m ne lim o r a to
Wii o la n反 应 合 成 2 月 桂 氧 基 一 Ⅳ一 甲基 乙 胺 l ms . Ⅳ, 二
有关醚的合成方法

有关醚的合成方法一、引言醚是一类重要的有机化合物,具有广泛的应用领域,如溶剂、药物、香料等。
本文将介绍常见的醚的合成方法。
二、Williamson合成法Williamson合成法是制备对称醚的一种常用方法。
该方法是通过两个不同卤代烷与钠或钾的乙醇溶液反应,生成相应的醇钠或醇钾,然后与另一个卤代烷反应得到对称醚。
具体步骤如下:1. 将一个卤代烷加入到乙醇中,并加入少量钠或钾。
在室温下搅拌数小时,直至产生气泡停止。
2. 加入另一个卤代烷并加热数小时。
3. 冷却后过滤得到产物。
三、Williamson改进法由于Williamson合成法只适用于对称醚的制备,因此人们提出了Williamson改进法来制备非对称醚。
该方法是将一个芳香族化合物与一个烷基卤化物反应,在碱性条件下进行缩合反应得到非对称醚。
具体步骤如下:1. 将芳香族化合物和烷基卤化物加入到碱性条件下的溶液中。
2. 搅拌数小时,直至反应完成。
3. 冷却后过滤得到产物。
四、Williamson改进法的变体1. Friedel-Crafts反应法Friedel-Crafts反应法是一种常用的制备非对称醚的方法。
该方法是将苯或其它芳香族化合物与醇在铝氯化物或硫酸铁的催化下反应,生成非对称醚。
具体步骤如下:1. 将芳香族化合物和醇加入到催化剂中。
2. 加热数小时,直至反应完成。
3. 冷却后过滤得到产物。
2. 亲核取代反应法亲核取代反应法是一种制备非对称醚的重要方法。
该方法是通过亲核试剂与卤代烷在碱性条件下进行缩合反应得到非对称醚。
具体步骤如下:1. 将亲核试剂和卤代烷加入到碱性条件下的溶液中。
2. 搅拌数小时,直至反应完成。
3. 冷却后过滤得到产物。
五、总结本文介绍了几种常见的制备醚的方法,包括Williamson合成法、Williamson改进法及其变体。
这些方法可用于制备对称醚和非对称醚,具有广泛的应用前景。
williamson醚合成法

williamson醚合成法1 简介williamson醚合成法是有机化学中一种广泛使用的方法,可用于制备含氧的芳香或脂环醚。
其基本原理是通过碱催化下,使醇或酚反应生成不同的醚。
本文将介绍williamson醚合成法的基本原理、反应机理及其应用。
2 反应机理williamson醚合成法反应机理比较简单,是一种亲核取代反应。
在碱催化下,酚被碘代烷亲核取代,生成相应的醚。
例如:ROH + R'X → ROR' + HX其中ROH为酚,R'X为碘代烷,ROR'为醚,HX为氢卤酸。
该反应机理中,碱扮演的是促进反应的角色,加速酚的负离子生成。
此机理与Williamson醇醚合成法与Williamson醇醚合成法II有所不同,后两种方法利用醇的质子化反应。
实际上,Willians醚合成法具有一定的立体选择性。
这种选择性来源于芳香环的空间保护效应。
例如,尝试合成o-亚甲氧基苯酚甲醚,其产物主要是邻位异构体,即o-CH3OC6H4-O-CH3而不是其对位异构体。
3 应用williamson醚合成法被广泛应用在有机化学的绝大部分领域,如药物合成、化学催化、材料科学等等。
下面将分别介绍这些领域中williamson醚合成法的应用。
##3.1 药物合成醚化合物在药物合成中扮演着重要的角色。
例如,泊沙底单胺是一种用于治疗多囊卵巢综合症的药物,它的合成就采用了williamson醚合成法。
##3.2 化学催化由于williamson醚合成法的优异条件,如简单易操作、反应温和,因此该方法被用于具有催化性质的醚化合物的合成。
例如,Me-immidazolide酰氯作为一种催化剂,可以用该方法合成Me-immidazole。
##3.3 材料科学将醚化合物引入到材料科学中,可以提高材料的电化学性质、分子识别特性等。
例如,用williamson醚合成法合成的3,3'-联苯基二(苯醚)可以被用作材料领域的识别感受器。
威廉姆逊合成法机理

威廉姆逊合成法机理威廉姆逊合成法(Williamson synthesis)是有机化学中一种常用的醚化反应方法,用于合成醚化合物。
它是由英国化学家亨利·威廉姆逊(Henry Williamson)于1851年首次提出的。
威廉姆逊合成法的机理基于亲核取代反应的原理。
在该反应中,一个烷氧基(RO)会取代一个卤素原子(X)从而形成醚化合物。
具体来说,反应中的亲核试剂可以是醇(ROH)或酚(ArOH),而卤素化合物通常是卤代烷烃(RX)或卤代芳烃(ArX)。
在威廉姆逊合成法中,反应通常在碱性条件下进行,以促使亲核试剂与卤素化合物发生反应。
碱性条件有助于生成更强的亲核试剂,从而提高反应效率。
常用的碱包括氢氧化钠(NaOH)和氢氧化钾(KOH)。
反应机理可以分为两个步骤:首先是亲核试剂的亲核取代反应,然后是脱去卤素离子形成醚化合物。
在第一个步骤中,亲核试剂的亲核性质使其攻击卤素化合物中的卤素原子,形成一个中间体离子。
这个中间体离子具有较高的反应活性,因此容易与另一个亲核试剂发生反应。
在第二个步骤中,中间体离子中的卤素离子会被碱中的氢氧根离子(OH-)所取代,从而形成所需的醚化合物。
威廉姆逊合成法的优点之一是适用于各种不同类型的亲核试剂和卤素化合物。
亲核试剂可以是不同结构的醇或酚,而卤素化合物可以是卤代烷烃或卤代芳烃。
这种灵活性使得威廉姆逊合成法成为有机合成中常用的方法之一。
威廉姆逊合成法还可以用于合成具有不同取代基的醚化合物。
通过选择不同的亲核试剂和卤素化合物,可以引入不同的取代基,从而得到多样化的产物。
这种灵活性使得威廉姆逊合成法在药物合成和化学研究中得到广泛应用。
总结起来,威廉姆逊合成法是一种常用的醚化反应方法,通过亲核取代反应形成醚化合物。
该反应在碱性条件下进行,利用亲核试剂与卤素化合物的反应生成醚化合物。
威廉姆逊合成法具有灵活性,适用于不同类型的亲核试剂和卤素化合物,可以合成具有不同取代基的醚化合物。
威廉森合成法

威廉森合成法一、概述威廉森合成法是一种有机合成方法,用于生成醚化合物。
它由英国化学家亨利·埃歇勒·威廉森于1850年首次提出,被广泛应用于有机合成领域。
该方法通过将一个卤代烃与一个醇反应,生成一个醚。
二、原理威廉森合成法通过通过亲核取代反应将卤代烃和醇反应生成醚。
卤代烃中的卤素原子被醇中的羟基取代,生成新的键。
该反应需要使用碱性条件,以便加强醇中羟基的亲核性。
在反应过程中,溶剂的选择和反应温度将对反应速率和产率产生重要影响。
威廉森合成法的一般反应方程式如下: R-X + R’-OH → R-O-R’ + H-X 其中,R 和R’分别代表有机基团,X代表卤素,OH代表羟基。
三、步骤威廉森合成法通常分为以下几个步骤:1. 选择合适的底物和试剂为了进行威廉森合成,需要选择合适的卤代烃和醇作为底物。
理想情况下,卤代烃和醇的反应活性应该适中,以实现良好的反应效果。
2. 准备反应体系将卤代烃和醇溶解在适当的溶剂中,加入一定量的碱性催化剂。
典型的碱性催化剂包括氢氧化钠(NaOH)和氢氧化钾(KOH)。
溶剂的选择将根据反应的条件和反应物的性质进行确定,常用的溶剂有乙醇、二甲基亚砜等。
3. 反应过程将底物和催化剂混合均匀后,加热反应体系。
通常情况下,威廉森合成法需要显著的加热才能促进反应的进行。
反应时间根据具体反应物和条件而定,通常需要几小时至几天的反应时间。
4. 反应结束当反应完成后,冷却反应体系,将其中的产物提取出来,并进行适当的纯化和分离步骤。
纯化的方式包括结晶、蒸馏和萃取等。
四、应用和局限性威廉森合成法在有机合成中具有广泛的应用。
由于其简单的反应条件和高产率,它已成为一种常用的醚化合物制备方法。
醚化合物在药物领域、香料合成和化学品合成中广泛应用。
然而,威廉森合成法也存在一些局限性。
首先,该方法只适用于生成对应的醚化合物,不适用于其他类别的有机化合物合成。
其次,在反应的选择性方面可能存在问题,由于醇和卤代烃中的其他官能团可能发生竞争性反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
——廖云鹏 刘宾
Friedel-Crafts反应
定义: 芳烃在Lewis酸( 无水氯化铝、氯化锌、三氯化铁、 三氟化 硼 等)存在下发生的酰基化和烷基化反应。 Friedel-Crafts 反应常用的催化剂有 AlCl3 、FeCl3、 H2SO4 等, 目前,对Friedel-Crafts 反应已经开发出多种新型催化剂, 如三氟甲 磺酸盐、杂多酸、离子交换树脂等。 概括说明: 该反应是合成芳基酮、烷基苯的重要方法。是有 机合成中最有用的 反应之一。
谢谢观赏
Make Presentation much more fun
1、酰基化反应:在无水氯化铝存在下,苯与酰氯 或酸酐反应生成芳基酮。
2、烷基化反应:在无水氯化铝或无水三氯化 铁存在下,苯与卤代烷反应生成烷基苯。
Williamson 合成法
• 卤代烃与醇钠在无水条件下反应生成醚:
• 如果使用酚类反应,则可以在氢氧化钠水溶液中进行:
酚醚的制备方法
• 是否可以以苯酚为原料,用Williamson法合 成酚醚?
如果可以,那么是否会发生苯环上的 Friedel-Crafts反应干扰合成
• 可以
• 因为williamson反应的本质就是Sn2反应, 反应能否进行主要在于卤代烃的位阻。而且 Friafts反应的发生需要路易斯酸(路易斯酸 (Lewis Acid,LA)是指电子接受体,(即 有可以用来接收电子对的空轨道)。也可看作 形成配位键的中心体。)催化卤代烃形成碳正 离子,对苯环进行亲电取代,Williamson法 中只需要碱来催化
