原电池 化学电源练习题
高三化学电源练习题

高三化学电源练习题电源,作为现代社会中不可或缺的能源供应装置,是各行各业的基础设施之一。
特别是在高三化学学习中,电源作为重要的知识点之一,承担着重要的教学任务。
为了帮助高三学生复习和巩固相关知识,以下是一些化学电源练习题。
1. 下列哪种电池是原电池?A. 闪光灯电池B. 干电池C. 锂电池D. 镍氢电池2. 一种电池中,电极反应为:Zn(s) + 2MnO2(s) + H2O(l) →Zn(OH)2(s) + Mn2O3(s)那么,电极上产生的电子流的方向是?A. 从电解液到电极B. 从电极到电解液C. 由电解液中的溶质向电极内部D. 由电极内部向电解液溶质3. 关于燃料电池的说法,下列哪项是正确的?A. 燃料电池以电能为主要输出B. 燃料电池的反应速度受电解液浓度影响C. 燃料电池可以直接将化学能转化为电能D. 燃料电池只能使用非可再生能源作为燃料4. 下面关于锂离子电池的说法哪项是错误的?A. 锂离子电池是一种可充电电池B. 锂离子电池的电极反应为锂离子的嵌入与脱出C. 锂离子电池的正极材料可以是过渡金属氧化物D. 锂离子电池的电解液通常是含锂盐的有机液体5. 以下哪个物质不属于半导体?A. 硅(Si)B. 硫化镉(CdS)C. 碳化钛(TiC)D. 砷化镓(GaAs)6. 关于二次电池和一次电池的区别,下列说法正确的是?A. 一次电池是可充电的,二次电池是一次性使用的B. 二次电池是可反复充放电的,而一次电池只能使用一次C. 一次电池的电极反应是可逆反应,而二次电池的电极反应是不可逆反应D. 一次电池的电动势较高,而二次电池的电动势较低7. 非金属元素中,以下哪个元素常用于充电式镍氢电池的负极材料?A. 氢(H)B. 硫(S)C. 碳(C)D. 氧(O)8. 下列哪种电源被广泛应用于计算机主板和其他微型电子装置中?A. 锂电池B. 蓄电池C. 小太阳能电池板D. 电网供电9. 当向电池中充放电时,以下哪种说法是正确的?A. 充电时,电池的正负极并不发生变化B. 放电时,电池的负极处于氧化态C. 充电时,电池的正极处于氧化态D. 放电时,电池的正负极的电极反应是相同的10. 镍镉电池中,电极反应是:A. Cd(s) + NiO(OH)(s) + H2O(l) → Cd(OH)2(s) + Ni(OH)2(s)B. Cd(s) + 2Ni(OH)2(s) → Cd(OH)2(s) + 2Ni(OH)(s)C. Cd(OH)2(s) + 2Ni(OH)(s) → Cd(s) + 2NiO(OH)(s) + H2O(l)D. Cd(OH)2(s) + Ni(OH)2(s) → Cd(s) + NiO(OH)(s) + H2O(l)以上是高三化学电源练习题,希望能够为高三学生复习和巩固电源相关知识提供帮助。
高三化学一轮复习【原电池 化学电源 】练习题

高三化学一轮复习原电池 化学电源一、选择题(每题2分)1.下列能量转化过程与氧化还原反应无关的是( ) A .硅太阳能电池工作时,光能转化成电能 B .锂离子电池放电时,化学能转化成电能 C .电解质溶液导电时,电能转化成化学能D .葡萄糖为人类生命活动提供能量时,化学能转化成热能2.一种熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是( )A .反应CH 4+H 2O =====催化剂△3H 2+CO ,每消耗1 mol CH 4转移12 mol 电子 B .电极A 上H 2参与的电极反应为H 2+2OH --2e -===2H 2OC .电池工作时,CO 2-3向电极B 移动D .电极B 上发生的电极反应为O 2+2CO 2+4e -===2CO 2-3K]3.在固态金属氧化物电解池中,高温共电解H 2O-CO 2混合气体制备H 2和CO 是一种新的能源利用方式,基本原理如图所示。
下列说法不正确的是( )A .X 是电源的负极B .阴极的电极反应式是H 2O +2e -===H 2+O 2-、CO 2+2e -===CO +O 2-C .总反应可表示为H 2O +CO 2=====通电H 2+CO +O 2 D .阴、阳两极生成的气体的物质的量之比是1∶14.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a 常用掺有石墨烯的S 8材料,电池反应为:16Li+xS 8=8Li 2S x (2≤x≤8)。
下列说法错误的是( )A .电池工作时,正极可发生反应:2Li 2S 6+2Li ++2e -=3Li 2S 4B .电池工作时,外电路中流过0.02 mol 电子,负极材料减重0.14 gC .石墨烯的作用主要是提高电极a 的导电性D .电池充电时间越长,电池中Li 2S 2的量越多5.X 、Y 、Z 、M 、N 代表五种金属,有以下反应:①Y 与M 用导线连接放入稀硫酸中,M 上冒气泡;②M 、N 为电极,与N 的盐溶液组成原电池,电子从M 极流出,经过外电路,流入N 极; ③Z +2H 2O(冷水)===Z(OH)2+H 2↑;④水溶液中,X +Y 2+===X 2++Y 。
原电池 化学电源 专题训练及答案

原电池化学电源专题训练及答案一、选择题(本题包括6小题,每题7分,共42分)1.如图为氢氧燃料电池驱动LED发光的一种装置示意图。
下列有关叙述正确的是( )A.b处通入H2B.该装置将化学能最终转化为电能C.通入H2的电极发生反应:2H2-4e-4H+D.a处为电池负极,发生氧化反应【解析】选D。
由电子流向可知a为负极通入H2, b为正极通入O2,发生还原反应,A错误、D正确;该装置将化学能最终转化为光能,B错误;电解质为KOH溶液,电极反应式中不能含有H+,C错误。
【加固训练】各式各样电池的迅速发展是化学对人类的一项重大贡献。
下列有关电池的叙述正确的是( )A.手机上用的锂离子电池可以用KOH溶液作电解液B.锌锰干电池中,锌电极是负极C.氢氧燃料电池工作时氢气在负极上被还原D.太阳能电池的主要材料是高纯度的二氧化硅【解析】选B。
锂能与水反应,不能用水溶液作电解液,A错误;锌锰干电池中锌失去电子生成Zn2+为负极,B正确;氢氧燃料电池工作时氢气在负极被氧化,C错误;太阳能电池的主要材料为硅,D错误。
2.(2018·哈尔滨模拟)“便携式乙醇测量仪”运用燃料电池的工作原理。
在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-X+2H+。
下列说法中正确的是( )A.另一极的电极反应式为O2+4e-+2H2O4OH-B.电池内部H+向负极移动C.电池总反应为2CH3CH2OH+O22CH3CHO+2H2OD.乙醇在正极发生反应,电子经过外电路流向负极【解析】选C。
在酸性环境中,正极反应式为O2+4e-+4H+2H2O,A错误;氢离子为阳离子,应由负极向正极移动,B错误;根据元素守恒,可确定X为CH3CHO,电池总反应为2CH3CH2OH+O22CH3CHO+2H2O,C正确;乙醇被氧化,应在负极发生氧化反应,D错误。
3.某学习小组的同学查阅相关资料知氧化性:Cr2错误!未找到引用源。
高中化学《原电池》练习题(附答案解析)

高中化学《原电池》练习题(附答案解析)学校:___________姓名___________班级___________一、单选题1.下列各组的电极材料和电解液,不能组成原电池的是 ( ) A .铜片、石墨棒,稀硫酸 B .铜片、石墨棒,硝酸银溶液 C .锌片、铜片,稀盐酸D .铜片、银片,FeCl 3溶液2.食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按照一定比例组成的混合物,可同时吸收氧气和水,起到抗氧化和干燥的作用。
下列说法不正确的是( ) A .“双吸剂”中的生石灰有吸水作用 B .“双吸剂”吸收氧气时,发生了原电池反应 C .氯化钠的作用是作电解质,传导离子构成回路D .炭粉上发生的电极反应为22O 4e 4H =2H O -+++3.下列关于原电池的叙述中正确的是( ) A .正极和负极必须是金属B .原电池是把化学能转化成电能的装置C .原电池工作时,正极和负极上发生的都是氧化还原反应D .锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g 锌溶解,正极上就有0.1 g 氢气生成 4.下列装置中,能构成原电池的是( )A .B .C .D .5.下列关于原电池的叙述中错误的是( ) A .原电池内部的阳离子向正极移动 B .原电池是将化学能转变为电能的装置C .在原电池中,电子流入的一极是正极,发生还原反应D .构成原电池的正极和负极必须是两种不同的金属 6.下列说法正确的是( ) A .石油是可再生能源 B .化学反应必然伴随着能量变化 C .原电池的正极发生氧化反应D .加入催化剂一定能加快化学反应速率7.用铜片、铁片和硝酸银组成的原电池,负极上发生的是( )A .+-Ag e +=AgB .-2+Cu-2e =CuC .+-3Fe-3e =FeD .+-2Fe-2e =Fe8.下列有关实验装置进行的相应实验,能达到实验目的的是( )A .用图1装置用电流计检验电流的方向B .用图2装置制备Fe (OH )2并能较长时间观察其颜色C .用图3装置可分离CH 3COOC 2H 5和饱和碳酸钠溶液D .用图4装置除去C 2H 4中少量SO 29.化学课外活动小组设计的用化学电源使LED 灯发光的装置示意图如图。
原电池(化学电源)训练带答案.doc

负极: _________________总反应方程式(离子方程原电池(化学电源)训练班级 ______________ 姓名 _____________________1、分析下图所示的四个原电池装置,其中结论正确的是()A. ①②中Mg 作负极,③④中Fe 作负极B.②中Mg 作正极,电极反应式为6比0+6e 「=60IT+3H 昇 C.③中Fe 作负极,电极反应式为Fe — 2e 「=Fe 2+ D. ④中Cu 作正极,电极反应式为2H++2e 「=l {昇2、如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KC1溶 液和琼胶做成的冻胶)() A. 该原电池的总反应式为2Fe 3++Cu^2Fe 2++Cu 2+B. 该电池工作时,Cu”在电极上得到电子,发生还原反应C. 若用此电池电解饱和氯化钠溶液制取C1”当铜电极的质量减少6.4 g 时,产生氯气的体积为2. 24 L (折算为标准状况)D. 电池工作过程中,电子由铜电极经过电流表流向石墨电极3、甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由 甲醇、空气(氧气)、KOH (电解质溶液)构成。
电池的总反应式为2CH 3OH+3O 2+4OH"=2CO3"+6H 20=则下列说法正确的是()A. 电池放电时通入空气的电极为负极B. 电池放电时负极的电极反应式为CH3OH-6e _+H 2O=CO 2 t +6H +C. 由于CO 訂水解显碱性,电池放电时,电解质溶液的pH 逐渐增大D. 电池放电时每消耗1 mol CHsOH 转移6 mol 电子4、伏打电池:(负极 --- Zn 、正极 ---- C u 、电解液 --- H2SO4)______ 正极: _______________________________ Zn + 2H + =H 2 t + Zn 2+ 5、 碱性锌猛干电池:(负极一一Zn 、正极——C 、电解液KOH 、MnO?的糊状物) 负极: ______________________________ 正极: _________________________________ 化学方程式 Zn +MnO 2 +H 20 =ZnO + Mn (0H )26、 银锌电池:(负极 -- Zn 、正极 ---- A gzO 、电解液NaOH )负极: _______________________________ 正极: _________________________________ 化学方程式 Zn + Ag 2O + H 20 = Zn (0H )2 + 2Ag7、 铅蓄电池:(负极 -- Pb 正极------ P b02电解液 ----- 浓硫酸)总化学方程式 Pb+Pb02 + 2H 2S04=ff^2PbS04+2H 20^B H 2SO 4 ① ZaOH 溶液 ② 浓 HZ 。
高考化学一轮复习6.2原电池化学电源练习(含解析)

原电池化学电源1.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
下列有关说法中错误的是( )A.电解质溶液Y是CuSO4溶液B.电极X的材料是CuC.银电极为电池的正极,其电极反应为Ag++e-===AgD.外电路中的电子是从X电极流向Ag电极【答案】A【解析】由电极反应可知,电解质溶液应为AgNO3溶液而不是CuSO4溶液。
2.一定条件下,碳钢腐蚀与溶液pH的关系如下:下列说法不正确的是( )A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.在pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-===2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓【答案】C【解析】 A项,酸性较强条件下,碳钢主要发生析氢腐蚀,正确;B项,在pH>6的溶液中,酸性较弱,主要发生吸氧腐蚀,正确;C项,碳钢腐蚀的正极反应为O2+2H2O+4e-===4OH-,错误;D项,除O2后,腐蚀速率减缓,正确。
3.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由强到弱的顺序是( )A.①③②④B.①③④②C.③④②① D.③①②④【答案】B【解析】①②相连时,外电路电流从②流向①,说明①为负极;①③相连时,①为负极;②④相连时,②上有气泡,说明④为负极;③④相连时,③的质量减少,说明③为负极。
综上所述可知,这四种金属活动性由强到弱的顺序为①③④②,【答案】项B正确。
4.铅蓄电池的示意图如图所示。
下列说法正确的是( )A.放电时,N为负极,其电极反应式为:PbO2+SO2-4+4H++2e-===PbSO4+2H2OB.放电时,c(H2SO4)不变,两极的质量增加C.充电时,阳极反应式为:PbSO4+2e-===Pb+SO2-4D.充电时,若N连电源正极,则该极生成PbO2【答案】D【解析】放电时,是原电池,M作负极,电极反应式为Pb+SO2-4-2e-===PbSO4,A不正确;放电时,正负极均消耗硫酸,c(H2SO4)减小,B不正确;充电时阳极发生氧化反应,电极反应式为PbSO4-2e-+2H2O===PbO2+SO2-4+4H+,C不正确;充电时,若N连电源正极,则该极为阳极,电极反应产物为PbO2,D正确。
原电池练习题(带答案)Word版

原电池练习题1.下列装置不能形成原电池的是( )2.有关如图所示原电池的叙述不正确的是( )A.电子沿导线由Cu片流向Ag片 B.正极的电极反应式是Ag++e-===AgC.Cu片上发生氧化反应,Ag片上发生还原反应 D.反应时盐桥中的阳离子移向Cu(NO3)2溶液3. MgAgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是( )A.负极反应式为Mg-2e-===Mg2+B.正极反应式为Ag++e-===AgC.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应 Mg+2H2O===Mg(OH)2+H2↑4.(教材改编题)如图所示是一位同学在测试水果电池,下列有关说法错误的是( )A.若金属片A是正极,则该金属片上会产生H2 B.水果电池的化学能转化为电能C.此水果发电的原理是电磁感应D.金属片A、B可以一个是铜片,另一个是铁片5.如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )选项M N PA Zn Cu 稀H2SO4B Cu Fe 稀HClC Ag Zn AgNO3溶液D Zn Fe Fe(NO3)3溶液6)A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑7.(2017·泗洪模拟)如图是某同学设计的原电池装置,下列叙述中正确的是( )A.电极Ⅰ上发生还原反应,作原电池的负极B.电极Ⅱ的电极反应式为Cu2++2e-===CuC.该原电池的总反应为2Fe3++Cu===Cu2++2Fe2+D.盐桥中装有含氯化钾的琼脂,其作用是传递电子8.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( )A.加入少量稀NaOH溶液 B.加入少量CH3COONa固体C.加入少量NH4HSO4固体 D.加入少量CuSO4溶液9.(2017·开封高三调研)如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )A.外电路的电流方向为X→导线→YB.若两电极分别为铁和碳棒,则X为碳棒,Y为铁C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y10.一次电池——碱性锌锰干电池11.二次电池(以铅蓄电池为例)1.放电时的反应(1)负极: (氧化反应);(2)正极: (还原反应);(3)总反应:。
原电池 化学电源试题

原电池 化学电源1.课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。
下列结论错误的是( ) A .原电池是将化学能转化成电能的装置 B .原电池由电极、电解质溶液和导线等组成C .图中a 极为铝条、b 极为锌片时,导线中会产生电流D .图中a 极为锌片、b 极为铜片时,电子由铜片通过导线流向锌片 2.根据下图判断,下列说法正确的是()A .装置Ⅰ和装置Ⅱ中负极反应均是Fe -2e -===Fe 2+B .装置Ⅰ和装置Ⅱ中正极反应均是O 2+2H 2O +4e -===4OH -C .装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D .放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH 均增大 3.如图所示是一位同学在测试水果电池,下列有关说法错误的是( )A .若金属片A 是正极,则该金属片上会产生H 2B .水果电池的化学能转化为电能C .当A 、B 分别为Zn 、Fe 金属片时,Zn 作正极D .金属片A 、B 可以一个是铜片,另一个是铁片4.有A 、B 、C 、D 、E 五块金属片,进行如下实验:①A 、B 用导线相连后,同时浸入稀H 2SO 4溶液中,A 极为负极;②C 、D 用导线相连后,同时浸入稀H 2SO 4溶液中,电流由D →导线→C ;③A 、C 相连后,同时浸入稀H 2SO 4溶液中,C 极产生大量气泡;④B 、D 相连后,同时浸入稀H 2SO 4溶液中,D 极发生氧化反应;⑤用惰性电极电解含B 离子和E 离子的溶液,E 先析出。
据此,判断五种金属的活动性顺序是 ( ) A .A>B>C>D>E B .A>C>D>B>E C .C>A>B>D>ED .B>D>C>A>E5.一种光化学电池的结构如图所示,电池总反应式为AgCl(s)+Cu +(aq)===Ag(s)+Cu 2+(aq)+Cl -(aq),下列关于该电池在工作时的说法中正确的是( )A .生成108 g 银,转移电子个数为2 molB .Cu +在负极发生氧化反应C .Ag 电极活泼,Ag 失电子发生氧化反应D .Cl -由负极迁移到正极6.甲醇(CH 3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理如图所示。
高中化学原电池、化学电源练习题

高中化学原电池、化学电源练习题1.某兴趣小组设计的简易原电池装置如图所示。
该电池工作时,下列说法正确的是( )A.锌片作正极B.铜片上有气泡产生C.将电能转化为化学能D.电子由铜片经导线流向锌片解析:选B 根据原电池的工作原理,活泼金属作负极,锌比铜活泼,锌片作负极,A 错误;铜片作正极,电极反应式为2H++2e-===H2↑,铜片上有气泡冒出,B正确;该装置为原电池装置,是将化学能转化成电能的装置,C错误;根据原电池的工作原理,电子从负极经导线流向正极,即电子从锌片经导线流向铜片,D错误。
2.(2016·上海高考)图1是铜锌原电池示意图。
图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )A.铜棒的质量B.c(Zn2+)C.c(H+) D.c(SO2-4)解析:选C 该装置构成原电池,Zn是负极,Cu是正极。
A项,在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B项,由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C项,由于反应不断消耗H+,所以溶液的c(H +)逐渐降低,正确;D项,SO2-4不参加反应,其浓度不变,错误。
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。
下列说法中正确的是( )A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑解析:选B ①中Mg作负极;②中Al作负极;③中铜作负极;④是铁的吸氧腐蚀,Cu 作正极,电极反应式为O2+2H2O+4e-===4OH-。
4.如图所示为锌铜原电池。
下列叙述中,正确的是( )A.盐桥的作用是传导离子B.外电路电子由铜片流向锌片C.锌片上的电极反应式为Zn2++2e-===ZnD.外电路中有0.2 mol电子通过时,铜片表面质量增加约3.2 g解析:选A “双液”原电池中,盐桥连接左、右两个烧杯中的溶液,传导离子,起到导电作用,A正确;锌的活泼性强于铜,则锌片作负极,铜片作正极;在外电路中,电子由负极流向正极,则电子由锌片流向铜片,B错误;锌片是负极,发生失去电子的氧化反应,电极反应式为Zn-2e-===Zn2+,C错误;铜片是正极,电极反应式为Cu2++2e-===Cu,外电路中通过0.2 mol电子时,铜片上析出0.1 mol Cu,其质量为0.1 mol×64 g·mol-1=6.4 g,D错误。
2025届高三化学高考一轮复习《原电池+化学电源》
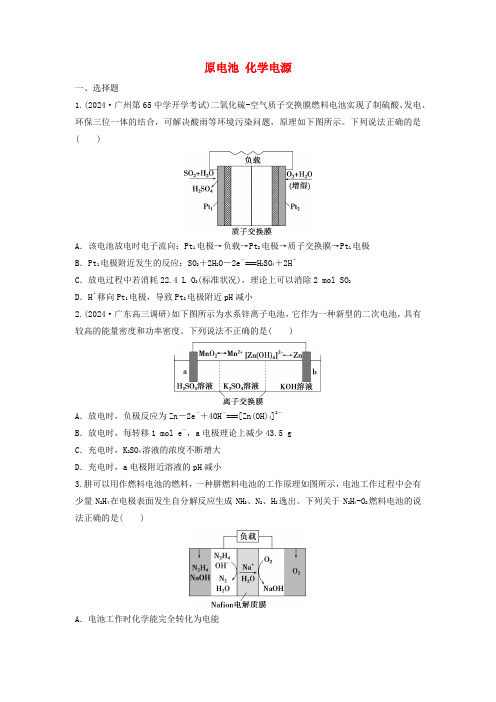
原电池化学电源一、选择题1.(2024·广州第65中学开学考试)二氧化硫-空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,可解决酸雨等环境污染问题,原理如下图所示。
下列说法正确的是( )A.该电池放电时电子流向:Pt1电极→负载→Pt2电极→质子交换膜→Pt1电极B.Pt1电极附近发生的反应:SO2+2H2O-2e-===H2SO4+2H+C.放电过程中若消耗22.4 L O2(标准状况),理论上可以消除2 mol SO2D.H+移向Pt1电极,导致Pt2电极附近pH减小2.(2024·广东高三调研)如下图所示为水系锌离子电池,它作为一种新型的二次电池,具有较高的能量密度和功率密度。
下列说法不正确的是( )A.放电时,负极反应为Zn-2e-+4OH-===[Zn(OH)4]2-B.放电时,每转移1 mol e-,a电极理论上减少43.5 gC.充电时,K2SO4溶液的浓度不断增大D.充电时,a电极附近溶液的pH减小3.肼可以用作燃料电池的燃料,一种肼燃料电池的工作原理如图所示,电池工作过程中会有少量N2H4在电极表面发生自分解反应生成NH3、N2、H2逸出。
下列关于N2H4-O2燃料电池的说法正确的是( )A.电池工作时化学能完全转化为电能B.放电过程中,负极区溶液pH增大C.负极的电极反应式为N2H4-4e-===N2+4H+D.电池工作时,负极区消耗的NaOH与正极区生成的NaOH物质的量相等4.(2024·肇庆高三月考)科学家研发了一种以Al和Pd@石墨烯为电极的Al-N2电池,电池以AlCl-4 -Al2Cl-7离子液体作为电解质,放电时在提供能量的同时实现了人工固氮,示意图如右。
下列说法不正确的是( )A.充电时,Al电极是阴极B.放电时,AlCl-4浓度增大,Al2Cl-7浓度减小C.放电时,正极反应为N2+8Al2Cl-7+6e-===2AlN+14AlCl-4D.放电时,电路中每通过6 mol e-,电池总质量理论上增加28 g5.(2024·广州大学附中高三检测)下列说法不正确的是( )A.原电池中发生的可逆反应达到平衡时,该电池仍有电流产生B.在原电池的负极和电解池的阳极上发生的都是失电子的氧化反应C.普通锌锰电池与碱性锌锰电池的比能量不同D.燃料电池中通入氧气的一极为正极6.下列根据化学反应设计的原电池(选用相同的盐桥)合理的是( )选项正极(金属/电解质溶液) 负极(金属/电解质溶液)A Zn/ZnSO4溶液Fe/H2SO4溶液B Fe/FeCl2溶液Zn/ZnSO4溶液C Zn/H2SO4溶液Fe/FeCl2溶液D Fe/ZnSO4溶液Zn/FeCl2溶液7+-1,阴离子为SO2-4,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色(V2+显紫色,V3+显绿色,VO2+显蓝色,VO+2显黄色)。
高一化学 原电池必做题(附答案)

1 该电池的种类是 A. 一次电池
(填序号)。 B. 二次电池(可充电)
9/11
C. 燃料电池
2 关于该电池的性能和使用说法不正确是
A. 该电池可应用于手电筒、收音机等
B. 该电池在使用过程中锌外壳逐渐变薄
C. 该电池使用后应埋入地下,避免污染环境
3 已知电池的总反应为:
++
电池的负极材料是
,正极反应产物是
确; .稀硫酸可用稀盐酸替换,但若用稀硝酸替换,电极反应会发生变化,故 错
误;
10/11
故选 。
(4) 1 锌锰干电池是一次电池;
故选 。
2 .一次电池可用于手电筒、收音机等,故 不合题意;
. 是负极,在放电时逐渐被消耗,故锌外壳逐渐变薄,故 不合题
意;
.使用后,应回收利用,避免重金属污染,故 符合题意;
腐蚀,故 正确;
故选 。
(3) 燃料电池碱性环境下的反应为
。
考点
电化学 原电池 原电池原理 原电池电极反应及方程式书写
7/11
9 填空。
(1) 选择适宜的材料和试剂设计一个原电池,以便完成下列反应:
。正极为
,电极反应式为
;负极为
,电极反应式
。
(2) 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平
衡。小心地从烧杯中央滴入
溶液。
1 片刻后可观察到的现象是(指悬吊的金属圈)
。
A. 铁圈和银圈左右摇摆不定
B. 铁圈和银圈仍保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜
2 产生上述现象的原因是
。
答案 (1) 1.石墨 2. 3. 4.
原电池 化学电源(高一)练习及答案

原电池化学电源一、选择题1、(2015·成都模拟)金属M和N可构成如图所示的装置。
下列分析正确的是()A、金属活泼性:N>MB、M逐渐溶解C、负极反应为2H++2e-=== H2↑D、SO-24向M极定向移动2、下列关于化学电源的说法不正确的是()A、可以根据硫酸密度的大小来判断铅蓄电池是否需要充电B、燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源C、普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了D、由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极3、(2015·江苏泰州三中月考)如图,石墨Ⅰ电极生成的Y是氧化物,下列有关说法错误的是()A、负载中电子流向为石墨Ⅱ极流向石墨Ⅰ极B、石墨Ⅰ极的电极反应式为NO2+NO-3-e-=== N2O5C、电池中NO-3向石墨Ⅰ极移动D、该装置工作时化学能转化为电能4、(2015·河北衡水中学调研)根据如图,下列判断中正确的是()A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成B、烧杯a中发生反应O2+4H++4e-=== 2H2O,溶液pH降低C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极D、烧杯b中发生反应为Zn-2e-=== Zn2+5、(2015·南昌调研)普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性。
根据这一特点,科学家发明了电动势(E)法测水泥初凝时间,此法原理如图所示。
反应总方程式为2Cu+Ag2O Cu2O+2Ag。
下列有关说法不正确的是()A、工业上制备水泥的原料有黏土、石灰石、石膏B、测量原理装置图中Ag2O/Ag极发生还原反应C、负极的电极反应式为2Cu+H2O-2e-=== Cu2O+2H+D、在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化6、美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200 ℃左右供电。
化学电源考试题及答案

化学电源考试题及答案一、单项选择题(每题2分,共20分)1. 以下哪种物质不是原电池中常见的电解质?A. 硫酸B. 盐酸C. 氢氧化钠D. 氯化钠答案:D2. 铅酸电池中铅和二氧化铅的电化学反应式是什么?A. Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2OB. Pb + PbO2 + 2H2SO4 → PbSO4 + PbSO4 + 2H2OC. Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2OD. Pb + PbO2 + 2H2SO4 → PbSO4 + PbSO4 + 2H2O 答案:A3. 锂离子电池中,锂离子在充电时的移动方向是?A. 从正极到负极B. 从负极到正极C. 在正负极之间来回移动D. 保持不动答案:B4. 以下哪种电池是可充电电池?A. 干电池B. 铅酸电池C. 锂电池D. 镍镉电池答案:B、C、D5. 燃料电池中,氢气和氧气反应生成水的化学反应式是什么?A. 2H2 + O2 → 2H2OB. H2 + O2 → H2OC. 2H2 + O2 → H2OD. H2 + O2 → 2H2O答案:A6. 电解质溶液的导电性主要取决于什么?A. 溶液的pH值B. 溶液中离子的浓度C. 溶液的温度D. 溶液的体积答案:B7. 以下哪种电池是一次性电池?A. 镍氢电池B. 锂电池C. 干电池D. 铅酸电池答案:C8. 锂离子电池中,锂离子在放电时的移动方向是?A. 从正极到负极B. 从负极到正极C. 在正负极之间来回移动D. 保持不动答案:A9. 以下哪种物质是燃料电池中常用的催化剂?A. 铂B. 银C. 铜D. 铁答案:A10. 铅酸电池的电压是多少?A. 1.2VB. 1.5VC. 2VD. 2.1V答案:D二、填空题(每空1分,共10分)1. 电池的总反应式可以表示为+ + → + + 。
答案:阳极反应、电解质、阴极反应、电子、产物2. 锂离子电池的正极材料通常使用的是,而负极材料使用的是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池、化学电源练习题1.下列说法正确的是( )A .原电池是把电能转化为化学能的装置B .原电池中电子流出的一极是正极发生氧化反应C .原电池的两极发生的反应均为氧化还原反应D .形成原电池后,原电池中的阳离子向正极移动2.下列关于实验现象的描述不正确的是( )A .把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B .用铜板和锌板紧靠在一起浸入硫酸铜溶液,负极铜板质量增加C .把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D .把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快。
3. 下列有关化学电池的说法不正确的是 ( )A. 化学电池是将化学能变成电能的装置B. 一次电池的活性物质消耗到一定程度就不能使用了C. 二次电池又称充电电池或蓄电池,放电后可以再充电,故可多次重复使用D. 燃料电池是将燃料燃烧所放出的能量转化为化学能装置4.白铁皮(镀锌铁皮)发生析氢腐蚀,若有0.2摩电子转移,下列说法不正确的是( )A.有6.5克锌被腐蚀B.2.8克铁被腐蚀C.正极上H +被还原D.在标准状况下有2.24升气体放出5.把A 、B 、C 、D 四块金属泡在稀H 2SO 4中,用导线两两相连可以组成各种原电池。
若A 、B 相连时,A 为负极;C 、D 相连,D 上有气泡逸出;A 、C 相连时A 极减轻;B 、D 相连,B 为正极。
则四种金属的活泼性顺序由大到小排列为( )A. A >B >C >DB. A >C >B >DC. A >C >D >BD. B >D >C >A6.将等质量的两份锌粉a 和b ,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a 的烧杯中再加入少量CuO 粉末。
下列各图表示氢气体积V (H 2)与反应时间t 的关系,其中正确的是 ( )7.X 、Y 两根金属棒插入Z 溶液中构成如下图的装置,实验中电流表指针发生偏转,同时X 棒变粗,Y 棒变细,则X 、Y 、Z 可能是下列中的 ( ) 8.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。
电池负极反应为 ( )A .H 2+2OH -==2H 2O+2e -B .O 2+4H ++4e -==2H 2OC .H 2==2H ++2e -D .O 2+2H 2O+4e -==4OH -9.将两个铂电极插入KOH 溶液中,向两极分别通入CH 4和O 2,即构成甲烷燃料电池。
已知通入CH 4的一极,其电极反应式是:CH 4+10OH ――8e -=CO 32-+7H 2O ;通入O 2的另一极,其电极反应式是:O 2+2H 2O+4e -=4OH -,下列叙述不正确的是( )A .通入CH 4的电极为负极B .正极发生氧化反应C .此电池工作时溶液中阴离子向负极移动D .该电池使用一段时间后应补充KOH10.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌锰碱性电池以氢氧化编号 X Y ZA Zn Cu 稀硫酸B Cu Zn 稀硫酸C Cu Ag 硫酸铜溶液D Ag Zn 硝酸银溶液钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是()A.电池工作时,锌失去电子B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g11.普通水泥在固化过程中自由水分子减少并形成碱性溶液。
根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。
此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是()A.工业上以黏土、石灰石和石英为主要原料来制造普通水泥B.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2OC.测量原理示意图中,电流方向从Cu→Ag2OD.电池工作时,OH-向正极移动12.如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。
下列叙述正确的是()A.a中铁钉附近呈现红色B.b中铁钉上发生还原反应C.a中铜丝上发生氧化反应D.b中铝条附近有气泡产生13. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述不正确的是()A.放电时负极反应为:3Zn —6e—+6OH— == 3Zn(OH)2B.放电时正极反应为:2FeO42—+6e—+8H2O===2Fe(OH)3+10OH—C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化D.放电时正极附近溶液的碱性减弱14. 微型锂碘电池可用植入某些心脏病人体内的心脏起搏器所用的电源。
这种电池中的电解质是固体电解质LiI, 其中的导电离子是I-。
下列有关说法正确的是()A. 正极反应:2 Li-2e-==2Li+B. 负极反应:I2+2e-==2I-C. 总反应:2 Li+ I2 == 2 LiI,D. 金属锂作正极15. 微型钮扣电池在现代生活中有广泛应用。
有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-==ZnO+H2O;Ag2O+H2O+2e-==2Ag+2OH-根据上述反应式,判断下列叙述中正确的是()A.在使用过程中,电池负极区溶液的pH减小B.使用过程中,电子由Ag2O极经外电路流向Zn极C.Zn是负极,Ag2O是正极D.Zn电极发生还原反应,Ag2O电极发生氧化反应16.(2008广东理基,20)电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。
下列有关电池的叙述正确的是()A.锌锰干电池工作一段时间后碳棒变细B.氢氧燃料电池可将热能直接转变为电能C.氢氧燃料电池工作时氢气在负极被氧化D.太阳能电池的主要材料是高纯度的二氧化硅17. (2008年海南,7)关于铅蓄电池的说法正确的是()A. 在放电时,正极发生的反应是Pb(s)+SO42-(aq)=== PbSO4(s)+2e -B. 在放电时,该电池的负极材料是铅板C. 在充电时,电池中硫酸的浓度不断变小D. 在充电时,阳极发生的反应是PbSO4(s)+2 e -==Pb(s)+ SO42- ( aq)18. 目前市场上的手提应急灯,主要是“无液干粉”铅酸蓄电池,其原理是将有腐蚀性的浓硫酸灌注到硅胶凝胶中去,使电解质溶液不易发生泄漏,大大改善了电池的性能。
所用的原料仍然是铅─二氧化铅─硫酸。
下列关于该铅酸蓄电池的说法正确的是()A.充电时电源的正极接蓄电池标“+”的一极B.“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理C.放电时在铅酸蓄电池的负极发生还原反应D.充电时电池上标有“—”的极发生氧化反应19.炒过菜的铁锅未及时洗净(残液中含NaCl),第二天会因腐蚀出现红褐色锈斑。
试回答:(1)铁锅的锈蚀应属于______________,腐蚀的原因是___________________。
(2)铁锅锈蚀的电极反应式为:负极,正极。
正负电极反应产物会继续发生反应,反应的离子方程式或化学方程式为20.在A、B、C三个烧杯中分别盛有同体积,同物质的量浓度的NaNO3、HCl和KCl溶液,如果A、B、C杯中电极都为铁和石墨,并用导线连接,(不与电源相连。
)则各杯中铁片受腐蚀情况(写明腐蚀类型、快慢。
)及原因是。
21.阿波罗宇宙飞船使用的是氢氧燃料电池,其电极反应为:2H2+4OH-→4H2O+4e-,2H2O+O2+4e-→4OH-。
在负极反应的物质是,负极发生的是(填氧化或还原)反应,电池反应是22.市场出售的“热敷袋”其中的成分主要是铁粉、碳粉、木屑和少量氯化钠、水等。
热敷袋用塑料袋密封,使用时从袋中取出轻轻揉搓就会放出热量,用完后袋内有大量铁锈生成,回答下列各问:(1)热敷袋放出的热是来自。
(2)碳粉和氯化钠的作用分别是。
(3)写出有关的电极反应式化学方程式、。
23、Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是。
电池工作时,电子流向(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是。
欲除去Cu2+,最好选用下列试剂中的(填代号)。
a.NaOHb.Znc.Fed.NH3·H2O24. 铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。
工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 == 2PbSO4+ 2H2O,据此判断:(1)铅蓄电池的负极材料是________。
(2)工作时正极反应为________________________________。
(3)工作时,电解质溶液的________(填“增大”、“减小”或“不变”)(4)工作时,电解质溶液中阴离子移向________极。
(5)电流方向从________极流向________。
25. 据报道,摩托罗拉公司开发的一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可持续使用一个月。
(1)关于该电池的叙述错误的是()A. 放电时,正极反应为式:O2+4e-+4H+==2H2OB. 放电时,负极反应为式:CH3OH-6e-+8OH-==CO32-+6H2OC. 充电时,原电池的负极与电源的正极相连接D. 充电时,阴极反应式为:4OH--4e-==2H2O+O2↑(2)若以熔融的K2CO3为电解质,正极充入CO2与O2的混合气体。
试写出该燃料电池的电极反应式:负极,正极。
26.科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事。
一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气。
回答下列问题:(1)这种电池放电时发生的化学反应方程式:________________________________________________________________________(2)此电池的正极发生的电极反应:______________,负极发生的电极反应:____________。
(3)电解液中H+向________极移动,向外电路释放电子的电极是________。
