模式植物拟南芥T-DNA插入突变体的PCR鉴定
拟南芥ABI3基因缺失突变体的鉴定及对盐胁迫的响应

拟南芥ABI3基因缺失突变体的鉴定及对盐胁迫的响应赵彦敏;高海琴;瓮巧云【摘要】采用PCR和RT-PCR技术分别在DNA和RNA水平上对由于T-DNA 插入所导致的拟南芥ABI3基因突变体进行鉴定,鉴定后将野生型Col-0与纯合abi3突变体种子分别置于含不同浓度NaCl的MS培养基上培养,测定萌发率、生物量和根长.结果表明:在NaCl胁迫下,野生型Col-0和纯合abi3突变体种子的萌发率、生物量和根长均随着NaCl浓度的增加呈现下降趋势.在相同NaCl浓度下,纯合abi3突变体种子的萌芽率、生物量和根长均低于野生型Col-0.当NaCl浓度达到150 mmol/L时,纯合abi3突变体种子的萌芽率、生物量和根长均降到最低,与野生型Col-0存在极显著差异.可见,拟南芥ABI3基因具有提高拟南芥抗NaCl 胁迫能力的作用.【期刊名称】《上海农业学报》【年(卷),期】2018(034)004【总页数】4页(P7-10)【关键词】ABI3基因;T-DNA插入;突变体;NaCl胁迫【作者】赵彦敏;高海琴;瓮巧云【作者单位】张家口广播电视大学,张家口075000;张家口广播电视大学,张家口075000;河北北方学院农林科技学院,张家口075000【正文语种】中文【中图分类】Q943.2植物在生长发育过程中,不可避免地会受到各种非生物因素如干旱、低温、高盐及高温等的胁迫,导致农作物的生长品质及产量下降。
作为植物体内重要的逆境响应激素之一,脱落酸(Abscisic acid,ABA)既是胁迫的诱导产物,又是胁迫信号的传导者,通过级联放大反应,能迅速参与到植物抗胁迫的反应中。
此外,脱落酸还参与植物生长的其他环节,如能促使马铃薯形成块茎、抑制种子的萌发等。
早期通过正向遗传学方法筛选到一些在萌发率上对 ABA不敏感的拟南芥基因,如 ABI1-1、ABI2-1、ABI3、ABI4和ABI5[1-4];作为ABA信号的正调控转录因子ABI3基因,在植物的抗旱性和耐盐性功能中起重要的作用[5],主要在种子里表达[2]。
T-DNA插入鉴定实验报告

T-DNA插入突变体的鉴定时明辉同组者:薛敏学号:201000220069摘要 Ti质粒是上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移进植物细胞,并插入植物染色体DNA中。
所以Ti质粒上的这一段能转移的DNA被叫做T-DNA。
将感兴趣的基因改造插入到T-DNA区段中,通过农杆菌侵染植物细胞,实现外源基因对植物的遗传转化,得到含有突变的植株。
通过本实验,我们将学习如何用PCR的方法检测所得植株是否为T-DNA的插入突变体。
1.引言T-DNA作为一种实验常用的遗传转化方法,在插入突变过程中,插入到植物染色体上的位置是随机的。
如果T-DNA插入进某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中,有T-DNA 插入的纯合突变体,杂合突变体,和野生型。
在突变体研究中,需要的材料是纯合突变体,所以必须从分离群体中将纯合突变体鉴定出来。
本次实验中,采用液CTAB(或者TSP法)提取拟南芥植株的DNA,然后PCR将所获DNA扩增,在之后采用琼脂糖凝胶电泳技术,分离处长度不一的DNA带,以确定样品是否为T-DNA插入突变纯和体。
PCR(Polymerase ChainReaction),即聚合酶链式反应是体外核算扩增技术,具有特异、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至百万倍,使肉眼能直接观察和判断。
(PCR基本原理如右图)DNA含有PO43-基团,在pH8.0 Buffer(本实验中为TAE)中带负电, 在电场中向正极移动。
自由电泳时,由于不同大小的DNA片段的电荷密度大致相同,各核酸分子难以分开;选用适当浓度的琼脂糖凝胶作为支持物,使之具备一定的孔径,即可发挥分子筛效应,使大小不同的核酸片段迁移率出现较大差异,达到分离的目的;同样条件对Marker电泳;起到鉴定的作用。
拟南芥TDNA插入突变体的鉴定

遗传学实验报告拟南芥T-DNA插入突变体的鉴定一、实验目的:1、学习和掌握基本的植物DNA的CTAB提取法,掌握PCR、琼脂糖凝胶电泳等基本实验操作技能2、了解T-DNA插入突变体的鉴定原理,掌握其方法。
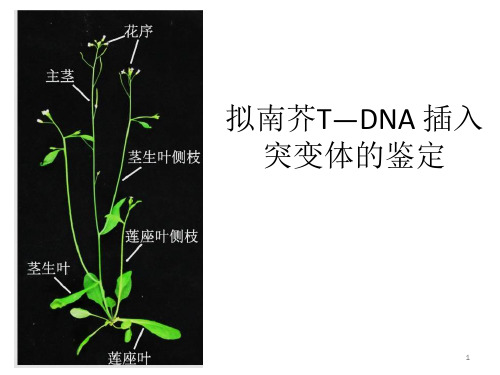
二、实验原理1、拟南芥(Arabidopsis thaliana)十字花科,植物遗传学、发育生物学和分子生物学的模式植物。
植株形态个体小,高度只有30cm左右;生长周期快,从播种到收获种子一般只需8周左右;种子多,每株可产生数千粒种子;形态特征简单,生命力强,用普通培养基就可作人工培养;遗传转化简单,转化效率高;基因组小,只有5对染色体,125MB;在2000年,拟南芥成为第一个基因组被完整测序的植物。
2、突变体突变体是遗传学研究的最重要材料。
突变体可以通过自然突变和人工诱变的方法获得。
拟南芥诱变常用方法有EMS诱变、T-DNA插入突变、激活标签。
由于T-DNA插入突变体便于对突变基因进行追踪,目前拟南芥、水稻中已经有大量的T-DNA插入突变体;SALK中心提供的拟南芥T-DNA插入突变体超过十万种。
3、T-DNA插入突变原理T-DNA,转移DNA(transferred DNA ),是根瘤农杆菌Ti质粒中的一段DNA序列,可以从农杆菌中转移并稳定整合到植物基因组。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
除用于转基因以外,T-DNA插入到植物的基因中可引起基因的失活,从而产生基因敲除突变体,T-DNA大多为单拷贝插入,使其利于进行遗传分析。
4、T-DNA插入突变体PCR鉴定图 1 结果鉴定图 2 PCR引物设计三、实验材料1、材料:T-DNA插入的突变拟南芥植株;2、仪器:离心管,离心机,水浴锅,移液枪,PCR仪,电泳槽等;3、试剂:液氮,CTAB提取液,氯仿/异戊醇(24:1),无水乙醇,70%乙醇,10xTaq buffer,MgCl2,引物,琼脂糖,溴化乙锭(EB)。
拟南芥T-DNA插入突变体的鉴定

拟南芥T-DNA插入突变体的鉴定09生工吴超 200900140129一、实验原理T-DNA插入法是反向遗传学研究的重要手段。
T-DNA是农杆菌的一个大质粒,长度在25kb左右。
野生型农杆菌的T-DNA上带有激素合成基因,感染植物后会导致植物细胞快速增殖形成愈伤组织,失去分化能力。
所以一般实验使用改造后的农杆菌——T-DNA中导入了卡那霉素抗性基因和抗除草剂基因。
因此在农杆菌感染植物后可用除草剂来筛选转化子。
在转化子培养到F2代出现分离后,就需要对其基因型进行鉴定。
T-DNA插入突变体鉴定方法主要有两种:三引物法和双引物法。
在本实验中使用三引物法。
三引物法的原理如图1所示,即采用三引物(LP、RP、BP)进行PCR扩增。
野生型植株目的基因的两条染色体上均未发生T-DNA插入,所以其PCR产物仅有1种,分子量约900bp(即从LP到RP);纯合突变体植株目的基因的两条染色体上均发生T-DNA插入,T-DNA本身的长度约为25kb,过长的模板会阻止目的基因特异性扩增产物的形成,所以也只能得到1种以BP与LP或RP为引物进行扩增的产物,分子量约为400-700bp;杂合突变体植株只在目的基因的一条染色体上发发生了T-DNA插入,所以PCR扩增后可同时得到两种产物。
上述3种情况的电泳结果差异明显,能有效区分不同基因型的植株。
此法优点是可同时鉴定出纯和突变体并确证T-DNA的插入情况。
图1 T-DNA插入示意图CATB,即十六烷基三甲基溴化铵,是一种离子型表面活性剂。
能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来。
并且CATB可在高离子强度的溶液里与蛋白质和大多数多聚糖形成复合物进而形成沉淀,但不沉淀核酸。
本实验使用CATB抽提DNA。
聚合酶链式反应(Polymerase Chain Reaction,PCR)是体外核酸扩增技术。
它具有特异性高、敏感、产率高、快速、简便、重复性好、易自动化等突出优点;能在一个试管内将所要研究的目的基因或某一DNA片段于数小时内扩增至十万乃至几万倍,使肉眼能直接观察和判断。
拟南芥TDNA插入突变
• 器材:离心机,离心管,PCR仪,点泳池,电泳现 象仪
(3)筛选纯和突变体 实验原理
双引物法
• 与“三引物法” 本质相同。 首先以基因组 D N A作为模板,用一对特异引物(LP和RP)扩增 目的基因片段,野生型和突变杂合体均一条带,纯合突变体 没有条带;然后再以基因组DNA 为模板,由T-DNA 片段的特异 引物(LB)与LP 或RP 组成一对引物,扩增目的基因T-DNA 插入 片,野生型没有条带,杂合体和纯合体一条410+N。 不足之处是完成最终鉴定需进行两轮P C R 扩增。
19
(3)筛选纯合突变体
实验方案设计
查看含有相关基因的种子信息
20
(3)筛选纯合突变体
实验方案设计
引物设计
21
(3)筛选纯合突变体
实验方案设计
中间引物的设计
22
(3)筛选纯合突变体
实验方案设计
两侧引物的设计
23
(3)筛选纯合突变体
2、实验材料
• 赤霉素糖基转移酶基因的T-DNA插入突变种子:
The complex that comprises of the T-DNA bound to the binding protein then moves into the nucleus and is integrated into the nuclear genome.
7
2、反向遗传学的重要手段——T-DNA插入突变技术
拟南芥T-DNA插入突变纯合体的鉴定

拟南芥T-DNA插入突变纯合体的鉴定余振洋(高山山、潘红芳)、09级生技1班、200900140156、2011/12/14摘要本实验通过CTAB法提取目的拟南芥的DNA,再用三引物法PCR扩增所需的目的基因后,用电泳检测该拟南芥是否为转基因的拟南芥,并判断其是纯合突变还是杂合突变。
关键词拟南芥;T-DNA;突变纯和体1.引言T-DNA是根癌农杆菌Ti质粒上的一段DNA序列,它能稳定地整合到植物基因组中并稳定地表达。
T—DNA在植物中一般都以低拷贝插入,多为单拷贝。
单拷贝T-DNA一旦整合到植物基因组中,就会表现出孟德尔遗传特性,在后代中长期稳定表达,且插入后不再移动,便于保存。
T—DNA插入突变在反向遗传学和功能基因组学研究中发挥着重要作用。
,T—DNA插入突变能方便地进行正向和反向遗传学研究,因而受到重视。
同时,基因组测序工作的完成使得从位点到表型的反向遗传学研究成为可能,从而使通过T—DNA插入技术构建突变体来研究功能的反向遗传学技术逐渐取代了传统的化学诱变、图位克隆等技术。
借助于农杆菌介导的遗传转化技术,T—DNA插入技术已被广泛应用于拟南芥等模式植物的突变体库构建中。
以T—DNA作为插入元件,不但能破坏插入位点基因的功能,而且能通过插入产生的功能缺失突变体的表型及生化特征的变化,为该基因的研究提供有用的线索。
由于插入的T—DNA序列是已知的,因此可以通过已知的外源基因序列,利用反向PCR、TAIL-PCR、质粒挽救等方法对突变基因进行克隆和序列分析,并对比突变的表型研究基因的功能。
还可以利用扩增出的插入位点的侧翼序列,建立侧翼序列数据库,对基因进行更全面的分析。
由此可见,T—DNA 插入标签技术已成为发现新基因、鉴定基因功能的一种重要手段。
CTAB法提取植物叶片中的DNA是我们常用的方法。
通常采用机械研磨的方法破碎植物的组织和细胞,由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性。
实验十、模式植物拟南芥T-DNA插入突变体的鉴定-23页精选文档

模式植物拟南芥
拟南芥(Arabidopsis thaliana )又称为阿拉伯芥,是一种十字花 科植物,广泛用于遗传、发育和分子生物学的研究,已成为一种典 型的模式植物。该植物具有以下特点:
植株形态个体小,高度只有30cm左右,1个茶杯可种植好几棵; 生长周期快,每代时间短,从播种到收获种子一般只需8周左右; 种子多,每株可产生数千粒种子; 形态特征简单,生命力强,用普通培
养基就可作人工培养; 基因组小,只有5对染色体。 拟南芥是严格的闭花自花受粉植物,
基因高度纯合。易获通过理化处理 获得各种功能的突变体。
外成像仪
实验步骤-拟南芥的栽培
一.在播种前将种子进行消毒,然后置于4℃冰箱中,使 种子在湿润条件下春化2至3天。
二.将春化好的种子播种于有麦氏培养基(MS培养基)的 培养皿中,置于培养室内培养。
三.待幼苗长出后,再选择茁壮的幼苗移栽到土壤中,置 于培养室内培养。
实验步骤-拟南芥T-DNA插入突变体PCR鉴定法
1. CATB法提取DNA:液氮、2×CTAB抽提缓冲溶液、氯仿:异戊醇 =24:1、无水乙醇、70%乙醇、TE
2. PCR:ddH2O、Buffer、MgCl2、dNTP、引物(LP、RP、BP) 、DNA模版、Taq DNA聚合酶
3. 电泳:琼脂糖、Maker、Buffer、EB、TAE
❖ 仪器:离心机,水浴锅,移液器,PCR仪,电泳槽,紫
每小组按10倍准备混合体系; 每个同学需做一颗植株的鉴定(两管PCR)。
LP: JDM17-1NR2 RP: JDM17-1F2 BP: LBb1.3
天津市耀华中学2023-2024学年高三上学期第二次月考(11月)生物试题

天津市耀华中学20232024学年度高三年级生物学科I 卷一、单项选择题(共15题,每题3分,共45分)1. 下列有关教材实验中涉及“分离”的叙述错误的是( )A.《绿叶中色素的提取与分离》实验中,不同色素因在层析液中溶解度不同而分离B.《噬菌体侵染细菌》实验中,搅拌离心的目的是使噬菌体的蛋白质外壳与大肠杆菌分离C.《植物细胞质壁分离》实验中,滴加蔗糖溶液的目的是使原生质层与细胞壁分离D.《观察根尖分生组织细胞的有丝分裂》实验中,解离的目的是使细胞相互分离3. 如图表示在“肺炎链球菌转化实验”和“噬菌体侵染细菌的实验”中相关含量的变化,其它实验操作都合理的情况下,相关叙述错误的是( )A. 曲线1表示在“肺炎链球菌的转化实验”中,S型活细菌的数量变化B. 曲线2表示在“肺炎链球菌的转化实验”中,R型活细菌的数量变化C. 曲线3表示在“32P标记的噬菌体侵染细菌的实验”中,上清液放射性含量的变化D. 曲线4表示在“35S标记的噬菌体侵染细菌的实验”中,上清液放射性含量的变化4. CD163 蛋白是PRRSV病毒感染家畜的受体。
为实时监控CD163 蛋白的表达和转运过程,将红色荧光蛋白RFP 基因与CD163基因拼接在一起(如下图),使其表达成一条多肽。
该拼接过程的关键步骤是除去( )高三年级生物学科第1页(共8页)A. CD163基因中编码起始密码子的序列B. CD163基因中编码终止密码子的序列C. RFP基因中编码起始密码子的序列D. RFP 基因中编码终止密码子的序列5. 图甲表示T₂噬菌体某些基因表达的部分过程,图乙为图甲中“○”部分的放大。
序号表示相关物质。
下列说法正确的是( )A. 合成①②的过程属于转录,转录过程还需要解旋酶参与B.若在②的某位置插入6 个连续的碱基,得到的肽链一定会增加2个氨基酸C. A端为mRNA 的5’一端,参与图乙过程的核酸还有tRNA和 rRNAD. 若用32P标记的T₂噬菌体侵染未被标记的大肠杆菌,则少数①或②含有32P6.若肺炎链球菌的某个质粒含 1000个碱基对,其中碱基A占32%。
模式植物拟南芥T-DNA插入突变体的PCR鉴定资料讲解

▪ 第一管:
▪
10xTaq buffer
min,再转移上清入新管。 5. 向上清液中加等体积的冷异丙醇,小心混匀。-20 ℃ 放置30 min,12000 rpm离心10 min,
弃上清。 6. 用70%乙醇洗涤沉淀一次,12000 rpm稍离心,弃上清。 7. 将沉淀在超净工作台上吹干,或空气中晾干。加50 μl TE (pH 8.0)放4 ℃缓慢溶解。 8. 电泳检测DNA的浓度和质量。
▪
81.8 g NaCl
▪
0.2%(V/V)β-巯基乙醇
▪注:先将除巯基乙醇之外的药品配好,高压蒸汽灭菌后加入巯基乙醇
▪酚/氯仿/异戊醇: 25:24:1
▪氯仿/异戊醇: 24:1
▪TE缓冲液:Tris-HCl (pH 8.0) 10 mmol/L,EDTA 1 mmol/L
▪3 M NaAc(pH 5.2)
左引物 LP: TCATCCACCATGGAAGAAAAG 右引物 RP:
TTGGATACGATGCGAGTAACC 中间引物LB: TGGTTCACGTAGTGGGCCATCG 用LP+RP产生大带:1107bp 用LB+RP产生小带:560-860bp
三、实验步骤
▪ 实验材料:拟南芥T-DNA插入突变体分 离群体30个株号的植株。
3. 用PCR方法鉴定T-DNA插入纯合突变体
▪ 农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中, 有T-DNA插入的纯合突变体,杂合突变体,和野生型。在 突变体研究中,需要的材料是纯合突变体,所以必须从分 离群体中将纯合突变体鉴定出来。
▪ PCR方法为鉴定纯合突变体提供了有利手段。它利用三 个引物LP、RP和BP,其中LP和RP是植物基因组上TDNA插入位点两测的引物,BP是T-DNA区段上的引物。 经过PCR,在野生型植株,LP和RP这对引物扩增出分子 量较大的产物(野生型基因,大带);在杂合突变体, LP和RP能扩增出分子量较大的产物(野生型基因,大 带),另外BP和RP还能扩增出分子量较小的产物(小 带);在纯合突变体,只有BP和RP能扩增出分子量较小 的产物(小带)。因此,利用以上三种引物做PCR,根 据扩增结果能够容易地从群体中区分出纯合突变体。
模式植物拟南芥T-DNA插入突变体的鉴定

模式植物拟南芥T-DNA插入突变体的鉴定摘要:通过本次实验,了解了拟南芥T-DNA插入突变体鉴定的原理,掌握了DNA提取技术、PCR技术以及电泳鉴定技术,对拟南芥的基因型做出判断。
实验首先提取拟南芥的DNA,将获得的DNA进行PCR扩增,将扩增好的DNA加入上样缓冲液后与DNAmarker一起进行电泳,用凝胶成像系统对凝胶进行处理,可以看到大小不同的DNA条带分离。
通过这种方法鉴定出拟南芥是否为突变体。
关键词:T-DNA插入突变体、DNA提取、PCR、电泳鉴定、凝胶成像系统1.前言拟南芥作为生物学研究的模式植物,由于其易于种植、生活周期短、遗传背景清晰、易于转基因操作等特点,已被广泛应用于植物学的各种基础和应用研究领域中。
同时,拟南芥T—DNA饱和突变体库的建立和T-DNA侧翼序列的确定,为功能基因组学提供了丰富、有效的遗传材料。
2.实验2.1实验目的(1)提取植物基因组DNA的方法;(2)PCR操作方法;(3)琼脂糖凝胶分离核酸方法。
2.2实验原理Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移进植物细胞,并插入植物染色体DNA中。
所以Ti质粒上的这一段能够转移的DNA被叫做T-DNA。
将Ti质粒进行改造,将感兴趣的基因放进T-DNA区段中没通过农杆菌侵染植物细胞,实现外源基因对植物的遗传转化。
T-DNA插图到植物染色体上的什么位置,是随机的。
如果T-DNA插入进某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
用PCR方法鉴定T-DNA插入船和突变体。
农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体汇总,有T-DNA插入的纯合突变体,杂合突变体和野生型。
在突变体研究中,需要的材料是纯合突变体,所以必须从分离群体中将纯合突变体鉴定出来。
“三引物法”的原理如图1所示,即用三种引物(LP、BP、RP)进行PCR扩增,野生型植株目的基因的两条染色体上均为发生T-DNA插入,所以其PCR产物仅有一种,分子量约为900bp(即从LP到RP);纯合突变体植株目的基因的两条染色体上均发生T-DNA插入,而T-DNA 本身的长度约为17kb,过长的模版会阻抑目的基因特异扩增产物的形成,所以也只能得到1种以LB与LP(或RP)为引物进行扩增的产物,分子量约为410+N bp(即从LP或RP到T-DNA 插入位点的片段),长度为300+N bp,再加上从LB到T-DNA载体左边界的片段,长度为110bp);杂合突变体植株只在目的基因的一条染色体上发生了T-DNA插入,所以PCR扩增后可同时得到410+N bp和900bp两种产物。
拟南芥隐性抗盐单基因突变体的筛选与鉴定

郭美丽:拟南芥隐性抗盐单基罔突变体的筛选与鉴定1.124抗氧化防御系统的活性J.M.McCord等p“提出的自由基伤害学说,已广泛削于需氧生物细胞伤害机理的研究。
二十世纪80年代以后,人们对盐分胁迫F植物体内抗氧化防御系统进行了大量的研究,并己确定它由一些能清除活性氧的酶系和抗氧化物质组成,如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(cAT)和抗坏血酸(AsA)等,它们协同作用共同抵抗盐分胁迫诱导的氧化伤害,而单一的抗氧化酶不足以防御这种氧化胁迫。
如SOD催化两个超氧自由基发生歧化反应形成02和H202,H202再被POD和CAT催化除掉。
在整个氧化防御系统中,SOD是所有植物在氧化胁迫中起重要作用的抗氧化酶。
根据结合金属离子的不同,SOD可分为Cu/Zn—SOD,Mn.SOD和Fe—SOD3种类型,Cu/Zn-SOD主要存在与叶绿素和细胞质中,Mn.SOD主要存在于线粒体中,Fe—SOD主要存在与叶绿体中【3“。
一般来讲,在盐分胁迫下,植物体内的SOD等酶活性与植物的抗氧化胁迫能力呈正相关,而且在盐分胁迫下,盐生植物与非盐生植物相比,其SOD、CAT、POD活性更高,因而更能有效地清除活性氧,阻抑膜质过氧化。
此外,在盐胁迫下,植物体内的某些过氧化物质,如抗坏衄酸也有清除体内自由基的生理功能。
刘婉等p…认为,离体小麦叶片在盐胁迫加强条件下,体内抗坏血酸含量下降,用活性氧清除剂处理可明显缓解抗坏血酸含量下降,且外源抗坏血酸能明显缓解由盐胁迫造成的对细胞膜的伤害,降低MDA含量,提高叶绿体的Hill反应活力、叶片光合速率和叶片线粒体呼吸速率。
可见SOD和抗氧化物质等自由基清除系统对保护膜结构,提高植物耐盐性有~定作用。
11.2.5盐胁迫蛋白研究发现,植物在盐胁迫F,体内合成一些新蛋白称为应激蛋白或胁迫蛋白,而且证明某些应激蛋白与植物的抗盐性有关。
N.K.Singh【40】等首次报道了,在烟草盐适应悬浮细胞中存在盐胁迫蛋白,此后又发现在烟草、苜蓿、玉米、甜菜等许多作物中存在盐胁迫蛋白,而且尤以分子量为26kD蛋白质的含量显著,可占总蛋白的10%~12%,且增加量与总蛋白置呈正相关H”。
拟南芥突变体相关分析

拟南芥突变体的相关研究遗传学摘要:本文列举了利用正向遗传法对拟南芥突变体的筛选、遗传群体的初步遗传群体及初步遗传图谱的构建和基因的图位克隆、遗传分析及相关基因的功能分析的流程,为拟南芥的研究提供更明确更清晰的思路。
关键词:拟南芥突变体;筛选;图位克隆;功能分析1 拟南芥突变体的筛选拟南芥是十字花科拟南芥属植物,近年来拟南芥以其个体小、生长周期短以及基因组小等特点而成为分子遗传学研究的模式植物。
拟南芥的另一优点是很容易被诱变,目前已从拟南芥中分离得到了几千种突变体,这些突变体的获得为揭示植物生长发育规律起了非常重要的作用。
拟南芥突变体的筛选已成为许多重要理论问题得以解决的前提,而筛选方法是突变体筛选成败的关键。
这里拟南芥耐低钾突变体的筛选为例,介绍一种简单、灵敏、通用的拟南芥突变体的筛选方法。
1.1植物材料诱变以拟南芥为材料,诱变方法如下:称取250mg(约5000粒)野生型种子置于50ml烧杯内并加入25ml 重蒸水,搅拌30 分钟;在4℃,下放置12小时后,把种子转移到盛30ml100mmol/L 磷酸缓冲液(PH6.5)的100ml三角瓶中,加入0.2%(V / V)的甲基磺酸乙酯(EMS),封口后放在水浴(25℃)振荡器上振荡12h。
然后用50ml 蒸馏水漂洗种子4 次,每次15min。
将漂洗好的种子置于4℃下春化3天后种植。
1.2诱变植株培养将经EMS诱变处理后的拟南芥种子(M1)播种于1/4Hoagland 营养液浸透的混有蛭石的营养土中,然后覆膜保湿。
18-22℃、光照强度120umol/m2s-1、光周期16h/8h条件下培养,待种子成熟后分行采收种子。
1.3 突变体的筛选拟南芥种子用0.5 %(v/ v)次氯酸钠加0.1%(v/ v)Tri-tonX-100表面消毒10 分钟,再用无菌水冲洗3遍。
接种前种子与0.4%(w/ v)低熔点琼脂糖混和,然后用吸管将种子吸出,成行地涂于MS 培养基上;将培养皿置于4℃冰箱春化48小时,之后转入光照培养,培养皿垂直放置。
植物发育生物学实验指导

实验一低拷贝质粒的大量提取——碱法【实验原理】质粒是细胞内的一种环状的小分子DNA,是进行DNA重组的常用载体。
作为一个具有自身复制起点的复制单位独立于细胞的主染色体之外,质粒DNA上携带了部分的基因信息,经过基因表达后使其宿主细胞表现相应的性状。
在DNA重组中,质粒或经过改造后的质粒载体可通过连接外源基因构成重组体。
从宿主细胞中提取质粒DNA,是DNA重组技术中最基础的实验技能。
分离质粒DNA有三个步骤:培养细菌使质粒扩增,收集和裂解细菌,分离和纯化质粒DNA。
在质粒提取过程中,由于机械力、酸碱度、试剂等的原因,可能使质粒DNA链发生断裂。
所以,多数质粒粗提取物中含有三种构型的质粒:共价闭合环状DNA(cccDNA):质粒的两条链没有断裂;超螺旋开环DNA(ocDNA):质粒的一条链断裂;松弛的环状分子线形DNA(lDNA):质粒的两条链均断裂;线性分子质粒DNA的分子构型。
质粒DNA琼脂塘凝胶电泳模式图可分为:松弛线性的DNA;松弛开环的OC构型;超螺旋的SC构型。
由于琼脂糖中加有嵌入型染料溴化乙锭,因此,在紫外线照射下DNA电泳带成橘黄色。
道中的SC DNA走在最前沿,OC DNA则位于凝胶的最后边;道中的L DNA 是经核酸内切限制酶切割质粒之后产生的,它在凝胶中的位置介于OC DNA 和SC DNA 之间。
碱法提取质粒是R.Treisman尚未发表的方法,同时也是Brinboim和Doly(1979)及Ish-Horowicz和Burke(1981)所用方法的改进。
该方法对于目前使用的所有大肠菌菌株都卓有成效,并可与随后的纯化步骤,如聚乙二醇沉淀或氯化铯-溴化乙锭梯度平衡离心等,一并联合使用。
【药品试剂】1、溶液I:50 mmol/L葡萄糖、 25 mmol/L Tris.Cl(pH8.0)、10mmol/L EDTA(pH8.0)。
溶液I可成批配制,在10 lbf/in2(6.895x104Pa或者是115 ℃)高压下蒸气灭菌15min,贮存于4 ℃。
t-DNA鉴定1

20
• DNA经溴乙锭(EB)染色,溴乙锭可以插入 DNA经溴乙锭(EB)染色, 经溴乙锭 DNA双螺旋结构两个碱基之间 双螺旋结构两个碱基之间, DNA双螺旋结构两个碱基之间,与核酸形成 络合物,在紫外(300nm,360nm)激发下, 络合物,在紫外(300nm,360nm)激发下, 产生桔黄色荧光( nm可见光 可见光)。 产生桔黄色荧光(590 nm可见光)。
6
• 利用三个引物做PCR鉴定纯合突变体 利用三个引物做PCR鉴定纯合突变体 PCR
• LP和RP是植物基因组上T-DNA插入位点两测的引物 LP和RP是植物基因组上 DNA插入位点两测的引物 是植物基因组上T • BP是T-DNA区段上的引物 BP是 DNA区段上的引物
7
PCR由变性 退火 延伸三个基本反应步骤构成: 由变性--退火 延伸三个基本反应步骤构成: 由变性 退火--延伸三个基本反应步骤构成
11
步骤
• 1.用液氮将100 mg 幼嫩叶片研磨成细粉,置于1.5 ml 离 1.用液氮将100 幼嫩叶片研磨成细粉,置于1.5 用液氮将 心管中加入预热至65℃ 65℃的 CTAB提取液 提取液, 心管中加入预热至65℃的600 μl 的2×CTAB提取液,轻 摇混匀。 摇混匀。 • 2.65℃水浴30 min,其间轻摇混匀。 2.65℃水浴 水浴30 min,其间轻摇混匀。 • 3.向上清液加入等体积的氯仿/异戊醇(24:1),室温下 3.向上清液加入等体积的氯仿/异戊醇(24: ),室温下 向上清液加入等体积的氯仿 轻轻混匀10 min, rpm离心 离心15 min, 轻轻混匀10 min,12000 rpm离心15 min,再转移上清入 新管。 新管。 • 4.向上清液中2倍无水乙醇或等体积的异丙醇,小心混匀, 4.向上清液中 倍无水乙醇或等体积的异丙醇,小心混匀, 向上清液中2 rpm离心 离心15 min,弃上清。 -20 ℃ 下30 min ,12000 rpm离心15 min,弃上清。 • 5.用70%乙醇洗涤沉淀一次,12000 rpm稍离心,弃上清。 5.用70%乙醇洗涤沉淀一次 乙醇洗涤沉淀一次, rpm稍离心 弃上清。 稍离心, • 6.将沉淀晾干,加20-50 μl TE (pH 8.0), 65℃水浴30 6.将沉淀晾干 将沉淀晾干, 208.0), 65℃水浴 水浴30 min溶解DNA。 溶解DNA min溶解DNA。 • 7. 琼脂糖凝胶电泳检测或用紫外分光光度计检测 琼脂糖凝胶电泳检测或用紫外分光光度计检测DNA的浓 度和质量。
拟南芥

姓名沈一鸣班级生技3班同组人无科目遗传学实验题目拟南芥T-DNA插入突变体的鉴定组别无—————————————————————————————————————————————————————一、实验目的1. 学习用PCR方法检测生物遗传差异;2. 了解植物T-DNA插入突变体的鉴定原理。
二、实验原理拟南芥(Arabidopsis thaliana):十字花科,植物遗传学、发育生物学和分子生物学的模式植物拟南芥特点:1)植株形态个体小,高度只有30cm左右;2)生长周期快,从播种到收获种子一般只需8周左右;3)种子多,每株可产生数千粒种子;4)形态特征简单,生命力强,用普通培养基就可作人工培养;5)遗传转化简单,转化效率高;6)基因组小,只有5对染色体,125MB;7)在2000年,拟南芥成为第一个基因组被完整测序的植物突变体是遗传学研究的最重要材料。
自然突变突变体的获得人工诱变拟南芥诱变常用方法:EMS诱变、T-DNA插入突变、激活标签由于T-DNA插入突变体便于对突变基因进行追踪,目前拟南芥、水稻中已经有大量的T-DNA插入突变体;SALK中心提供的拟南芥T-DNA插入突变体超过十万种。
T-DNA插入突变原理:Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移,插入植物染色体DNA中,Ti质粒上的这一段能转移的DNA被叫做T-DNA(transferred DNA )。
人们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,获得转基因植株。
T-DNA插入到植物染色体上的什么位置,是随机的。
如果T-DNA插入某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
T-DNA大多为单拷贝插入,使其利于进行遗传分析。
用PCR方法鉴定T-DNA插入纯合突变体:农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中,有T-DNA插入的纯合突变体,杂合突变体,和野生型。
拟南芥mapkkk15突变体的鉴定及非生物胁迫下的功能分析

热带作物学报2021, 42(9): 2494 2500 Chinese Journal of Tropical Crops收稿日期 2020-07-23;修回日期 2020-09-03基金项目 国家重点研发计划项目“橡胶树抗寒高产品种改良”(No. 2019YFD1001102);国家自然科学基金项目(No. 31870646)。
作者简介 梁 群(1993—),女,硕士,研究方向:作物遗传育种。
*通信作者(Corresponding auther ):程 汉(CHENG Han ),E-mail :******************。
拟南芥mapkkk15突变体的鉴定及非生物胁迫下的功能分析梁 群1,2,邓 治2,雷柯煜1,2,黄华孙2,安泽伟2,程 汉2*1. 海南大学热带作物学院,海南海口 570228;2. 中国热带农业科学院橡胶研究所,海南海口 571101摘 要:低温寒害是制约我国天然橡胶种植的最主要的环境限制因子,阐明橡胶树抗逆机制有助于保障天然橡胶的种植安全。
前期研究发现1个低温诱导的橡胶树MAPKKK 基因参与橡胶树抗寒能力调控,序列比对发现该基因与拟南芥MAPKKK15基因同源,但AtMAPKKK15的功能仍不清楚。
通过对拟南芥MAPKKK15基因功能的研究,揭示该类基因在植物逆境胁迫应答中的作用,将有助于进一步解析橡胶树MAPKKK 基因的功能。
本研究从DNA 和转录水平鉴定拟南芥mapkkk15纯合突变体植株,评价mapkkk15突变体低温和干旱胁迫抗性。
结果显示:低温抑制AtMAPKKK15基因表达。
对2个mapkkk15纯合缺失突变体进行分析,发现与野生型植株相比,mapkkk15突变体植株的抗冻存活率提高,电解质渗漏率下降。
脱水实验表明,突变体叶片脱水率要高于野生型。
上述结果表明,AtMAPKKK15基因在拟南芥中可能反向调控抗寒性,正向调控抗旱性。
关键词:mapkkk15突变体;拟南芥;非生物胁迫;功能鉴定;橡胶树 中图分类号:S961.6 文献标识码:AIdentification of mapkkk15 Mutant from Arabidopsis and Function Analysis to Abiotic StressLIANG Qun 1,2, DENG Zhi 2, LEI Keyi 1,2, HUANG Huasun 2, AN Zewei 2, CHENG Han 2* 1. College of Tropical Crops, Hainan Unviersity, Haikou, Hainan 570228, China; 2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, ChinaAbstract: Abiotic stress severely affects the natural rubber yield in China, so it is necessary to clarify the resistant mechanism of rubber tree to improve natural rubber yield. In previous studies, we found that a MAPPKKK was induced by low temperature in rubber tree. Sequence alignment showed that HbMAPKKK was homologous with MAPKKK15 from Arabidopsis . However, the function of AtMAPKKK15 is unclear. Function of AtMAPKKK15 was identified in re-sponding to stress and provide theoretical basis for further elucidating the function of MAPKKK in rubber tree. The homozygous T-DNA insertion mutants of AtMAPKKK15 were identified at DNA and transcription level, and evaluated resistance under low temperature and drought treatments. The results showed that the expression of AtMAPKKK15 was inhibited by low temperature. Two homozygous null mutants of MAPKKK15 were obtained from Arabidopsis . The mapkkk15 mutant improved low temperature tolerance by increasing survival and decreasing electrolyte leakage com-pared with the wild-type. However, the dehydration ration of mutant leaves increased with the extension of in vitro time. The results indicate that MAPKKK15 negatively regulated tolerance to low temperature and postively regulated resisi-tance to drought.Keywords: mapkkk15 mutant; Arabidopsis thaliana ; abiotic stress; function identification; Hevea brasiliensis DOI: 10.3969/j.issn.1000-2561.2021.09.008All Rights Reserved.第9期梁群等: 拟南芥mapkkk15突变体的鉴定及非生物胁迫下的功能分析 2495植物在整个生长发育过程中不可避免的会遭受低温、干旱和高盐等非生物胁迫危害,导致作物品质及产量下降。
模式植物拟南芥TDNA插入突变体的鉴定

T-DNA插入到植物染色体上的位置是随机的。如果T-DNA插入某个功 能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。利用 农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
2012.11.28
4
模式植物拟南芥
拟南芥全部基因组测序已经完成,每个单倍染色体组 (n=5)的总长只有7000万个碱基对(只有小麦染色 体组长的1/80),预测共有29,454个基因。这样科 学家就可以准确定位插入DNA的位置。
DIFF_TM 0.55 LP TCTAGGAAATCGATCGGGTTC
Len 21 TM 60.40 GC 47.62 SELF_ANY_COMPL 0.55
3'_COMPL 0.00 RP GAGAGCATGTAAGGATGCTGG
Len 21 TM 59.85 GC 52.38 SELF_ANY_COMPL 0.55
模式植物拟南芥T-DNA插 入突变体的鉴定
201L2.O11G.2O8
目录
实验设计思路和原理
拟南芥的栽培
拟南芥T-DNA插入突变体 的PCR鉴定
2012.11.28
1
实验设计的思路和原理
经典遗传学是从生物的性状、表型到遗传物质来研
究生命的发生与发展规律。
反向遗传学则是是在获得生物体基因组全部序列的
打开NCBI主页: http://www.ncbi.nl / 打开的页面如下: 在上面的search内查找 基因名称APETALA1:
从上面可以看到一共有19 个结果,其中第一个是拟 南芥中的,点击AP1:
根据上面的信息我们可以
得到基因在拟南芥内的系
统名称:AT1G69120
拟南芥干旱敏感突变体的筛选及其对干旱胁迫的响应

拟南芥干旱敏感突变体的筛选及其对干旱胁迫的响应李琳琳;王凤茹;韩建民;董金皋【摘要】The drought-sensitive mutant 36-1 plant was obtained under growing T - DNA inserted Arabidopsis thaliana on 1/2 MS medium containing 5% PEG-6000 by observing root tip bending. The seed germination rate, root length of the mutant 36 - lwere lower than wild-type under planting or growing on 1/2 MS medium containing PEG - 6000. The seedling shape, root/ shoot ratio and relative water content of the leaves between mutant 36-1 and wild-type were not obviously different under growing in pot with normal soil water content. The root/ shoot ratio, relative water content of the leaves in mutant 36-1 were obviously lower than in wild-type and the leaves in mutant 36-1 seedling wilt earlier compared with wild-type seedlings under growing in drought conditions. The water loss of the leaves detached from either mutant 36 - 1 or wild-type seedlings was not obviously different during the first 4 h course of the test and after that the water loss of the leaves detached from mutant 36-1 was beginning obviously higher than wild-type leaves. The flanking sequences of T-DNA inserted site was amplified by TAIL-PCR . Sequence alignment proved that T-DNA inserted the seventh exon of the AT2g06025. RT-PCR confirmed that the expression of the AT2g06025 in mutant 36-1 was obviously lower than wild-type Arabidopsis thaliana.%采用质量浓度为5 g/L的PEG - 6000进行渗透胁迫,利用弯根法筛选拟南芥T-DNA插入突变体库,得到干旱敏感突变体36 -1.该突变体在PEG - 6000渗透胁迫下,种子萌发率、根系长度均低于野生型;盆栽试验表明:水分正常条件下,突变体36 -1与野生型幼苗形态、根冠比、叶片含水量等并无明显差异;干旱条件下,突变体36-1叶片相对含水量(62%)明显低于野生型(78%),叶片先于野生型表现出萎蔫症状;根冠比也明显低于野生型.离体叶片失水试验发现:野生型和突变体36-1离体叶片在最初4h内叶片失水量并无明显差异,而4h后突变体36-1离体叶片失水量开始显著高于野生型.采用TAIL-PCR获得了T-DNA插入位点的侧翼序列,序列分析证实T-DNA插入基因为AT2g06025,插入位点位于该基因的第7个外显子上;表达分析发现AT2g06025在突变体36 -1中的表达明显低于野生型.【期刊名称】《河北农业大学学报》【年(卷),期】2011(034)004【总页数】6页(P35-40)【关键词】拟南芥;干旱胁迫;突变体;聚乙二醇【作者】李琳琳;王凤茹;韩建民;董金皋【作者单位】河北农业大学生命科学学院,河北保定071001;河北农业大学生命科学学院,河北保定071001;河北农业大学生命科学学院,河北保定071001;河北农业大学生命科学学院,河北保定071001【正文语种】中文【中图分类】Q945.78干旱在我国诸多的自然灾害中占据首位,严重影响农作物的生长发育。
拟南芥酪氨酸蛋白磷酸酶PTP135基因克

山东农业大学学报(自然科学版),2022,53(5):803-810VOL.53NO.52022 Journal of Shandong Agricultural University(Natural Science Edition)doi:10.3969/j.issn.1000-2324.2022.05.021拟南芥酪氨酸蛋白磷酸酶PTP135基因克隆及功能分析刘静广东职业技术学院,广东佛山528041摘要:拟南芥PTP135T-DNA插入突变体ptp135具有与phyB突变体相似的特征,萌发时下胚轴伸长、子叶张开角度小、展开慢,后期表现为开花早、叶色浅、叶柄长、叶面积增大。
采用PCR法从拟南芥叶片中克隆PTP135启动子基因,PTP135启动子连接到载体pCAMBIA1391,构建植物双元表达载体pCAMBIA1391-135p,构建的载体经过鉴定后,运用农杆菌介导的沾花法将PTP135启动子转化野生型拟南芥,用潮霉素筛选转化阳性株,对阳性株进行GUS组织化学染色,结果表明PTP135基因定位在维管束、柱头和花丝。
采用PCR方法从拟南芥叶片中克隆PTP135基因,连接到载体pEZS-NL,构建瞬时表达载体pEZS-NL-135e,采用基因枪法转化洋葱表皮,结果表明PTP135编码的蛋白定位在细胞核和细胞膜。
拟南芥野生型、ptp135和phyB,待即开花时取样,做光周期特异性基因CO、FT 的RT-PCR表达分析,结果表明CO和FT基因在ptp135突变体中表达时间延长,表达量增加,证明PTP135可以在转录水平上调控CO和FT,PTP135参与植物开花调控途径,作用位点在CO上游。
关键词:拟南芥;酪氨酸蛋白磷酸酶;基因克隆中图法分类号:Q943.2文献标识码:A文章编号:1000-2324(2022)05-0803-08 Expression and Function Analysis on PTP135Gene of ProteinTyrosine Phosphatase in Arabidopsis thalianaLIU JingGuangdong Technical College,Foshan528041,ChinaAbstract:The characteristics of ptp135mutant of Arabidopsis thaliana was similar to phyB mutant.The young seeding had a higher hypocotyl,opening cotyledon with a smaller angle,and slower expansion.At the later stage,it showed early flowering, lighter leaf color.We cloned the PTP135promoter gene from type A.thaliana leaves by PCR.The PTP135promoter gene was connected to the vector pcambia1391,and the vector pcambia1391-135p was constructed.Then the vecter was transformed into wild type A.thaliana by Agrobacterium-mediated flower dipping method.The results showed that ptp135 gene was located in vascular bundle,stigma and filament.We cloned the PTP135gene from Arabidopsis thaliana leaves by PCR.The PTP135gene was connected to the vector pEZS-NL,and the vector pEZS-NL-135e was constructed and transformed into onion epidermis by particle bombardment.The results showed that the protein of ptp135was localized in the nucleus and cell membrane.The RT-PCR results showed that the expression time of CO and FT in ptp135was longer and the expression level was more than in the wild.It was proved that PTP135could regulate CO and FT at the transcriptional level.PTP135worked in the flowering regulation pathway,and the action site was in the upstream of CO gene. Keywords:Arabidopsis thaliana;protein tyrosine phosphatase;gene cloning高等植物的生活史包括种子萌发、营养生长、开花等一系列发育阶段,其中开花过程直接影响作物生育期,与作物产量品质密切相关,该领域相关研究对农业和园艺生产具有重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意事项
1 .研磨后应迅速加入提取液,因为提取液中含
EDTA,能够螯合Mg2+等二价阳离子,防止破碎
细胞中的DNA酶降解DNA。 2 .提取过程中,避免剧烈震荡,以免对 DNA 造 成不必要的机械损伤。 3. 干燥DNA时,要注意过干或过湿都不利于 DNA的溶解。
(二) PCR反应
步骤
提取动物、植物、微生物基因组的DNA所面 临的问题不尽相同,在这个实验中学习植物 总DNA提取与鉴定。
本实验采用CTAB法。 CTAB的主要作用是破膜。 CTAB属阳离子表面活性剂,能溶解膜蛋白与脂类,也 可解聚核蛋白。在高离子强度的溶液里,CTAB与蛋白 质和大多数酸性多聚糖以外的多聚糖形成复合物,但 是不能沉淀核酸。因此,CTAB可以用于从大量产生粘
(一) 拟南芥基因组DNA提取
1. 原理
分离动物、植物、微生物DNA是进行遗传操
作(基因组DNA序列分析、遗传标记分析、基 因克隆、基因定位)的第一个步骤。不同的研 究目的对DN对纯度要求高;
用于PCR分析的DNA则应不含干扰PCR反应的 污染物; 用于遗传标记分析的DNA,纯度要求低但产量 则要高。
3. 用PCR方法鉴定T-DNA插入纯合突变体 农杆菌Ti质粒转化植物细胞后,在获得的后代分离群体中, 有T-DNA插入的纯合突变体,杂合突变体,和野生型。 在突变体研究中,需要的材料是纯合突变体,所以必须从 分离群体中将纯合突变体鉴定出来。 PCR方法为鉴定纯合突变体提供了有利手段。它利用三 个引物LP、RP和BP,其中LP和RP是植物基因组上TDNA插入位点两测的引物,BP是T-DNA区段上的引物。 经过PCR,在野生型植株,LP和RP这对引物扩增出分子 量较大的产物(野生型基因,大带);在杂合突变体, LP和RP能扩增出分子量较大的产物(野生型基因,大 带),另外BP和RP还能扩增出分子量较小的产物(小 带);在纯合突变体,只有BP和RP能扩增出分子量较小 的产物(小带)。因此,利用以上三种引物做PCR,根 据扩增结果能够容易地从群体中区分出纯合突变体。
步骤
用1XTAE或TBE电泳缓冲液配制1%琼脂糖胶; 在15 uL PCR产物中加3uL上样缓冲液(6x), 15uL 基因组DNA中加3uL上样缓冲液(6x),于 1% 琼脂糖胶上电泳, 稳压~100V(5V/cm); 电泳结束,溴化乙锭溶液染色20分钟(如果 你的电泳凝胶中不含溴化乙锭); 在紫外灯下或用凝胶成像仪观察、拍照。
十三 模式植物拟南芥T-DNA插入 突变体的PCR鉴定
一、实验目的:
1. 学习用PCR方法检测生物遗传差异; 2. 了解植物T-DNA插入突变体的鉴定原理。
二、实验原理
1. Ti质粒和T-DNA Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的 DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自 发转移,插入植物染色体DNA中,Ti质粒上的这一段能转 移的DNA被叫做T-DNA。人们根据这一现象,将Ti质粒进 行改造,将感兴趣的基因放进T-DNA区段中,通过农杆 菌侵染植物细胞,实现外源基因对植物的遗传转化。 2. T-DNA插入基因内部导致基因突变 T-DNA插入到植物染色体上的什么位置,是随机的。如 果T-DNA插入某个功能基因的内部,特别是插入到外显 子区,将造成基因功能的丧失。所以利用农杆菌Ti质粒转 化植物细胞,是获得植物突变体的一种重要方法。
一个好的分离程序应符合三个标准:
①所得DNA的纯度满足下游操作要求; ②所得DNA应完整;
③所得DNA量足够。
DNA在化学上是稳定的,但它在物理上是易 碎的,高分子质量的DNA长而弯曲,即具有 极微弱的侧向稳定性,易受到最柔和的流体 剪切力的伤害,由吸液、振荡、搅拌所致的 水流能剪切断DNA双链。
Marker
WT
T
PCR产物电泳结果实例, 纯合的野生型只有大带, 纯合的插入突变型只有小带, 杂合的插入突变型有大小2个带
基因组DNA提取结果实例:左边泳道为分子量Marker
1. 按如下方法调制PCR反应液,因每管加样量少,可几人一组预混除模板DNA之外的 成分。分装后各人再加入自己的模板DNA。PCR管上注意写明株号和引物类型: 第一管: 10xTaq buffer 2.5ul MgCl2 2 ul 某株号模板DNA 2 ul 引物LP 1 ul 引物RP 1 ul dNTP 1 ul Taq酶 0.2 ul H2O 15.3 ul 总共 25 ul 第二管: 10xTaq buffer 2.5ul MgCl2 2 ul 某株号模板DNA 2 ul 引物RP 1 ul 引物BP 1ul dNTP 1 ul Taq酶 0.2 ul H2O 15.3 ul 总共 25 ul
3. DNA提取步骤
1. 2. 3. 4. 5. 6. 7. 8. 用液氮将100 mg 幼嫩叶片研磨成细粉,置于1.5 ml 离心管中,加入预热至65℃的600 μl
的2×CTAB提取液,轻摇混匀。
65℃水浴1 h,其间轻摇混匀。 12000 rpm离心15 min,弃沉淀,取上清转移至另一1.5 ml 离心管中。 向上清液加入等体积的氯仿/异戊醇(24:1),轻轻混匀10 min,然后12000 rpm离心15 min,再转移上清入新管。 向上清液中加等体积的冷异丙醇,小心混匀。-20 ℃ 放置30 min,12000 rpm离心10 min, 弃上清。 用70%乙醇洗涤沉淀一次,12000 rpm稍离心,弃上清。 将沉淀在超净工作台上吹干,或空气中晾干。加50 μl TE (pH 8.0)放4 ℃缓慢溶解。 电泳检测DNA的浓度和质量。
多糖的有机体如植物以及某些革兰氏阴性菌(包括
E.coli的某些株)中制备纯化DNA 。 酚/氯仿/异戊醇的作用是去除核酸制品中的蛋白质,并
有利于水相与有机相的分开,而且可以消除泡沫。
异丙醇或乙醇的作用是脱去DNA周围水分子,使DNA 失水而聚合沉淀。
2、药品
CTAB提取液(1000 ml)组成: 20 g CTAB 100 ml 1 M Tris-HCl pH 8.0 40 ml 0.5 M EDTA pH 8.0 81.8 g NaCl 0.2%(V/V)β-巯基乙醇 注:先将除巯基乙醇之外的药品配好,高压蒸汽灭菌后加入巯基乙醇 酚/氯仿/异戊醇: 25:24:1 氯仿/异戊醇: 24:1 TE缓冲液:Tris-HCl (pH 8.0) 10 mmol/L,EDTA 1 mmol/L 3 M NaAc(pH 5.2in; 94℃变性1min, 50℃复性1min, 72℃ 延伸2min,共30 个循环;72℃最终延伸10min;10℃保持。
3. PCR结束以后,将样品拿出,检查管子上的株号是否清晰,放-20℃ 保存,等待下 次实验,电泳检查结果。
(三) PCR结果的电泳检查
左引物 LP: TCATCCACCATGGAAGAAAAG 右引物 RP:
TTGGATACGATGCGAGTAACC
中间引物LB: TGGTTCACGTAGTGGGCCATCG 用LP+RP产生大带:1107bp 用LB+RP产生小带:560-860bp
三、实验步骤
实验材料:拟南芥T-DNA插入突变体分 离群体30个株号的植株。 实验方法:(每人做1个株号的检测)
