常见物质溶解性
常见物质溶解性溶度积
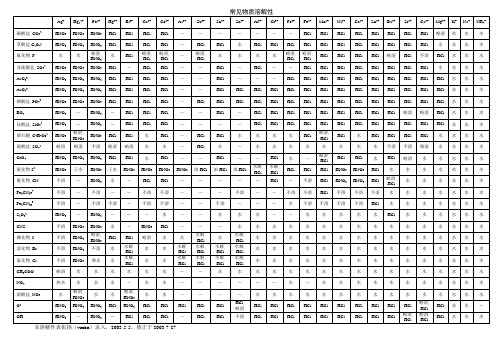
39.5
37.4
46.4
56.7
82.5
118
173
氟硅酸铵
(NH4)2SiF6
18.6
甲酸铵
NH4HCO2
102
143
204
311
533
磷酸一氢铵
(NH4)2HPO4
42.9
62.9
68.9
75.1
81.8
97.2
硫酸氢铵
NH4HSO4
100
酒石酸氢铵
NH4HC4H4O6
1.88
2.7
碘酸铵
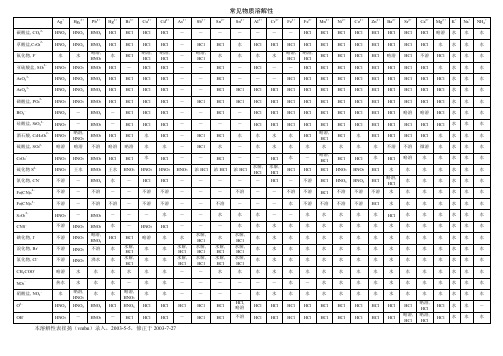
BaCl2
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
铬酸钡
BaCrO4
2.775×10-4
氰化钡
Ba(CN)2
80
亚铁氰化钡
Ba2Fe(CN)6
9.732×10-3
氟化钡
BaF2
0.159
0.16
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
一些常用化学品物性介绍

一些常用化学品物性介绍化学品的物性是指该化学品的物理和化学特性,包括外观、密度、熔点、沸点、溶解性、稳定性等。
以下是一些常见化学品的物性介绍。
1.水(H2O):-外观:无色透明液体- 密度:1 g/cm³-熔点:0℃-沸点:100℃-溶解性:能溶解许多物质,是极好的溶剂-稳定性:作为一种天然分子,水非常稳定2.乙醇(C2H5OH):-外观:无色液体- 密度:0.789 g/cm³-熔点:-114℃-沸点:78℃-溶解性:乙醇具有极好的溶解性,可以与水和许多有机溶剂混溶-稳定性:能被加热和燃烧,但易被氧化3.苯(C6H6):-外观:无色液体- 密度:0.874 g/cm³-熔点:5.5℃-沸点:80.1℃-溶解性:能与其他有机溶剂混溶,但与水的溶解性相对较差-稳定性:苯在空气中相对稳定,但容易被氧化,生成苯酚4.氯气(Cl2):-外观:黄绿色气体-密度:3.2g/L-熔点:-101℃-沸点:-34℃-溶解性:能够溶于水,生成氢氯酸-稳定性:氯气在室温下相对稳定,但与一些物质如金属和有机物反应强烈,易发生爆炸5.硫酸(H2SO4):-外观:无色液体- 密度:1.84 g/cm³-熔点:10℃-沸点:337℃-溶解性:能与水剧烈反应,产生大量热量,是一种强酸-稳定性:硫酸具有强腐蚀性,应小心存放和处理6.盐酸(HCl):-外观:无色气体或无色液体(浓缩时)- 密度:1.49 g/cm³(浓缩时)-熔点:-26℃-沸点:-85℃-溶解性:盐酸能与水剧烈反应,生成氢氯酸-稳定性:盐酸具有强酸性和腐蚀性,应小心存放和处理以上只是一些常见化学品的物性介绍,每种化学品都有具体的物性数据,这些数据对于化学实验、工业生产和风险评估等方面都非常重要。
在使用化学品时,需要谨慎处理,遵守相应的操作规程和安全措施。
常见物质溶解性及溶度积
常见物质溶解性本溶解性表崔扬(vmbn)录入,2003-5-5,修正于2003-7-27]锕、氨、铵物质化学式0°C10°C20°C30°C40°C50°C60°C70°C80°C90°C100°C 氢氧化锕(III)Ac(OH)30.0022氨NH388.5 70 56 44.5 34 26.5 20 15 11 8 7叠氮化铵NH4N316 25.3 37.1苯甲酸铵NH4C7H5O220碳酸氢铵NH4HCO311.9 16.1 21.7 28.4 36.6 59.2 109 170 354 溴化铵NH4Br60.6 68.1 76.4 83.2 91.2 108 125 135 145 碳酸铵(NH4)2CO3100氯酸铵NH4ClO328.7氯化铵NH4Cl29.4 33.2 37.2 41.4 45.8 50.4 55.3 60.2 65.6 71.2 77.3 氯铂酸铵(NH4)2PtCl60.289 0.374 0.499 0.637 0.815 1.44 2.16 2.61 3.36铬酸铵(NH4)2CrO425 29.2 34 39.3 45.3 59 76.1重铬酸铵(NH4)2Cr2O718.2 25.5 35.6 46.5 58.5 86 115 156 砷酸二氢铵NH4H2AsO433.7 48.7 63.8 83 107 122磷酸二氢铵NH4H2PO422.7 39.5 37.4 46.4 56.7 82.5 118 173 氟硅酸铵(NH4)2SiF618.6甲酸铵NH4HCO2102 143 204 311 533磷酸一氢铵(NH4)2HPO442.9 62.9 68.9 75.1 81.8 97.2硫酸氢铵NH4HSO4100酒石酸氢铵NH4HC4H4O6 1.88 2.7碘酸铵NH4IO3 2.6碘化铵NH4I155 163 172 182 191 209 229 250 硝酸铵NH4NO3118 150 192 242 297 421 580 740 871碳酸氢钆(III)Cd(HCO3)3 5.61溴酸钆(III)Gd(BrO3)3·9H2O50.2 70.1 95.6 126 166氢氧化钆(III)Gd(OH)3 1.882×10-5硫酸钆(III)Gd2(SO4)3 3.98 3.3 2.6 2.32氯化钙CaCl259.5 64.7 74.5 100 128 137 147 154 159乙酸钙Ca(C2H3O2)2·2H2O37.4 36 34.7 33.8 33.2 32.7 33.5 31.1 29.7砷酸钙Ca3(AsO4)2 3.629×10-3叠氮化钙Ca(N3)245苯甲酸钙Ca(C7H5O2)2·3H2O2.32 2.45 2.723.02 3.424.71 6.87 8.55 8.7碳酸氢钙Ca(HCO3)216.1 16.6 17.1 17.5 17.9 18.4 溴酸钙Ca(BrO3)2230溴化钙CaBr2125 132 143 213 278 295 312 霰石CaCO3-霰石7.753×10-4方解石CaCO3-方解石 6.170×10-4氯酸钙Ca(ClO3)2209铬酸钙CaCrO4 4.5 2.25 1.83 1.49 0.83磷酸二氢钙Ca(H2PO4)2 1.8氟化钙CaF28.575×10-3氟硅酸钙CaSiF60.518甲酸钙Ca(HCO2)216.1 16.6 17.1 17.5 17.9 18.4 磷酸氢钙CaHPO4 4.303×10-3氢氧化钙Ca(OH)20.189 0.182 0.173 0.16 0.141 0.121 8.6×10-27.6×10-2碘酸钙Ca(IO3)29×10-20.24 0.38 0.52 0.65 0.66 0.67碘化钙CaI264.6 66 67.6 70.8 74 78 81 钼酸钙CaMoO4 4.099×10-3硝酸钙Ca(NO3)2·4H2O102 115 129 152 191 358 363亚硝酸钙Ca(NO2)2·4H2O63.9 84.5 104 134 151 166 178草酸钙CaC2O4 6.7×10-4高氯酸钙Ca(ClO4)2188高锰酸钙Ca(MnO4)2338磷酸钙Ca3(PO4)22×10-3硒酸钙CaSeO4·2H2O9.73 9.77 9.22 8.79 7.14硫酸钙CaSO4·2H2O0.223 0.244 0.255 0.264 0.265 0.244 0.234 0.205 钨酸钙CaWO4 2.387×10-3氟化锆ZrF4 1.32硫酸锆Zr(SO4)2·4H2O52.5砷酸镉Cd3(AsO4)27.091×10-6苯甲酸镉Cd(C7H5O2)2 2.81溴酸镉Cd(BrO3)2125溴化镉CdBr256.3 75.4 98.8 129 152 153 156 160 碳酸镉CdCO3 3.932×10-5氯酸镉Cd(ClO3)2299 308 322 348 376 455氯化镉CdCl2100 135 135 135 135 136 140 147 氰化镉Cd(CN)2 2.2×10-2亚铁氰化镉Cd2Fe(CN)68.736×10-5氟化镉CdF2 4甲酸镉Cd(HCO2)28.3 11.1 14.4 18.6 25.3 59.5 80.5 85.2 94.6氢氧化镉Cd(OH)2 2.697×10-4碘酸镉Cd(IO3)29.7×10-2碘化镉CdI278.7 84.7 87.9 92.1 100 111 125 硝酸镉Cd(NO3)2122 136 150 194 310 713草酸镉CdC2O4.3H2O 6.046×10-3高氯酸镉Cd(ClO4)2180 188 195 203 221 243 272 磷酸镉Cd3(PO4)2 6.235×10-6硒酸镉CdSeO472.5 68.4 64 58.9 55 44.2 32.5 27.2 22 硫酸镉CdSO475.4 76 76.6 78.5 81.8 66.7 63.1 60.8 硫化镉CdS 1.292×10-12钨酸镉CdWO4 4.642×10-2硝酸铬Cr(NO3)3108 124 130 152溴酸汞Hg(BrO3)2·2H2O0.08溴化汞HgBr20.3 0.4 0.56 0.66 0.91 1.68 2.77 4.9 氯酸汞Hg(ClO3)225氯化汞HgCl2 3.63 4.82 6.57 8.34 10.2 16.3 30 61.3 氰化汞Hg(CN)29.3碘酸汞Hg(IO3)2 2.372×10-3碘化汞HgI26×10-3草酸汞HgC2O4 1.1×10-2硫化汞HgS 2.943×10-25硫氰酸汞Hg(SCN)2 6.3×10-2溴酸钴Co(BrO3)2·6H2O45.5溴化钴CoBr291.9 112 128 163 227 241 257氯酸钴Co(ClO3)2135 162 180 195 214 316氯化钴CoCl243.5 47.7 52.9 59.7 69.5 93.8 97.6 101 106 氟化钴CoF2 1.36氟硅酸钴CoSiF6·6H2O118碘酸钴Co(IO3)2·2H2O1.02 0.9 0.88 0.82 0.73 0.7碘化钴CoI2203硝酸钴Co(NO3)284 89.6 97.4 111 125 174 204 300亚硝酸钴Co(NO2)27.6×10-20.24 0.4 0.61 0.85高氯酸钴Co(ClO4)2104硫酸钴CoSO425.5 30.5 36.1 42 48.8 55 53.8 45.3 38.9 二氧化硅SiO2 1.2×10-2溴酸铅Pb(BrO3)27.92溴化铅PbBr20.45 0.63 0.86 1.12 1.5 2.29 3.32 3.86 4.55 碳酸铅PbCO37.269×10-5氯酸铅Pb(ClO3)2 3.7×10-2氯化铅PbCl20.67 0.82 1 1.2 1.42 1.94 2.54 2.88 3.2 铬酸铅PbCrO4 1.71×10-5亚铁氰化铅PbFe(CN)6 5.991×10-4氟化铅PbF2 4.634×10-2氟硅酸铅PbSiF6190 222 403 428 463 磷酸氢铅PbHPO4 3.457×10-4亚磷酸氢铅PbHPO3 2.187×10-2。
高中化学溶解性表
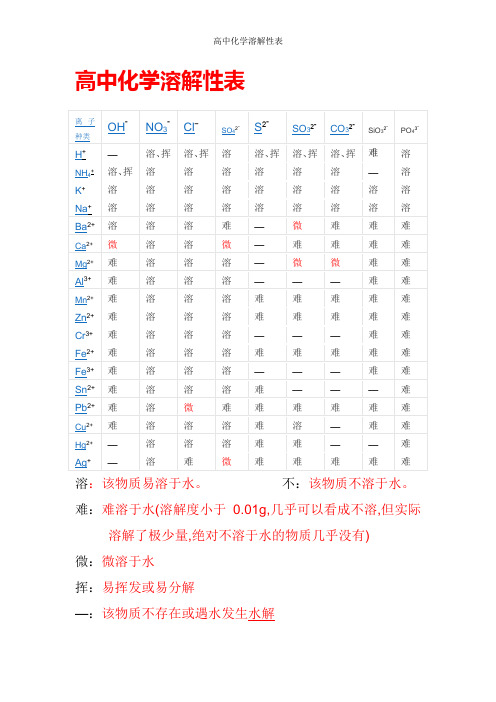
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
红褐色:Fe(OH)3
沉淀鉴别
沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);
BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);
不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
分类:各种物质的溶解性质分类及例子解析,从教案二中学习

本文将介绍几种常见的物质的溶解性质分类及例子解析,让我们更好地了解不同物质之间的相互作用及其影响。
1.盐类物质的溶解性质
盐类物质的溶解性主要取决于其离子性质。
一般来说,阳离子电荷越大、离子半径越小,盐类物质的溶解度越低。
以氯化铅和氯化钙为例,氯化铅由于正离子Pb2+电荷较大、离子半径较小,因此溶解度较低;而氯化钙正离子Ca2+电荷较小、离子半径较大,相对溶解度较高。
2.非极性物质的溶解性质
非极性物质之间主要通过范德华力(van der Waals force)相互作用,因此其溶解性取决于分子间范德华力的大小及形状。
举例来说,甲苯和环己烷都为非极性物质,但由于甲苯分子内部的范德华力较大,其分子结构更加紧密,因此溶解度较低;而环己烷分子结构则较松散,分子间相互作用较弱,因此溶解度较高。
3.极性物质的溶解性质
极性物质之间主要通过氢键(hydrogen bond)相互作用,因此其溶解性取决于分子间氢键的形成能力。
例如,甲酸和乙酸均为极性物质,但由于甲酸分子结构中的羧基较小、氢键形式较紧密,因此其溶解度低于乙酸。
4.酸碱物质的溶解性质
酸碱物质之间的溶解性主要与其化学性质有关。
酸的性质是能够失去一个或多个质子,而碱是能够接受质子形成盐和水。
因此,在水中,弱酸或弱碱的溶解度通常比较高,而强酸或强碱则溶解度通常较低。
以上是几种常见物质的溶解性质分类及例子解析。
通过深入了解不同物质之间的相互作用,我们可以更好地掌握化学反应的本质,从而更好地应用化学知识。
高考化学物质溶解性规律总结

高考化学物质溶解性规律总结物质溶解性规律:(1)气体的溶解性①常温极易溶解的NH3[1(水)∶700(气)] HCl(1∶500)还有HF,HBr,HI,甲醛(40%水溶液—福尔马林)。
②常温溶于水的CO2(1∶1)Cl2(1∶2)H2S(1∶2.6)SO2(1∶40)③微溶于水的O2,O3,C2H2等④难溶于水的H2,N2,CH4,C2H2,NO,CO等。
(2)液体的溶解性①易溶于水或与水互溶的如:酒精、丙酮、醋酸、硝酸、硫酸。
②微溶于水的如:乙酸乙酯等用为香精的低级酯。
③难溶于水的如:液态烃、醚和卤代烃。
(3)固体的水溶性(无机物略)有机物中羟基和羧基具有亲水性,烃基具有憎水性,烃基越大,则水溶性越差,反而易I溶于有机溶剂中。
如:甲酸、乙酸与水互溶,但硬脂酸、油酸分子中因—COOH比例过少反而不溶于水而溶于CCl4,汽油等有机溶剂。
苯酚、三溴苯酚、苯甲酸均溶于苯。
(4)从碘、溴、氯的水溶液中萃取卤素的有机溶剂如:苯、汽油、乙醚、乙酸乙酯、CCl4、CS2等。
(5)白磷、硫易溶于CS2(6)常见水溶性很大的无机物如:KOH,NaOH,AgNO3溶解度在常温超过100g(AgNO3超过200g)。
KNO3在20℃溶解度为31.6g,在100℃溶解度为246g。
溶解度随温度变化甚少的物质常见的只有NaCl。
(7)难溶于水和一般溶剂的物质①原子晶体(与溶剂不相似)。
如:C,Si,SiO2,SiC等。
其中,少量碳溶于熔化的铁。
②有机高分子:纤维素仅溶于冷浓H2SO4、铜氨溶液和CS2跟NaOH 作用后的溶液中,已热固化的酚醛树脂不溶于水或一般溶剂。
常见物质溶解性及溶度积

溴化铵
NH4Br
60.6
68.1
76.4
83.2
91.2
108
125
135
145
碳酸铵
(NH4)2CO3
100
氯酸铵
NH4ClO3
28.7
氯化铵
NH4Cl
29.4
33.2
37.2
41.4
45.8
50.4
55.3
60.2
65.6
71.2
77.3
氯铂酸铵
(NH4)2PtCl6
0.289
0.374
0.499
37.4
36
34.7
33.8
33.2
32.7
33.5
31.1
29.7
砷酸钙
Ca3(AsO4)2
3.629×10-3
叠氮化钙
Ca(N3)2
45
苯甲酸钙
Ca(C7H5O2)2
·3H2O
2.32
2.45
2.72
3.02
3.42
4.71
6.87
8.55
8.7
碳酸氢钙
Ca(HCO3)2
16.1
16.6
17.1
1.352×10-7
氟化钚(III)
PuF3
3.144×10-4
氟化钚(IV)
PuF4
3.622×10-4
碘酸钚(IV)
Pu(IO3)4
7.998×10-2
[编辑]氮、镝
物质
化学式
0°C
10°C
20°C
30°C
40°C
50°C
60°C
70°C
80°C
溶解性表
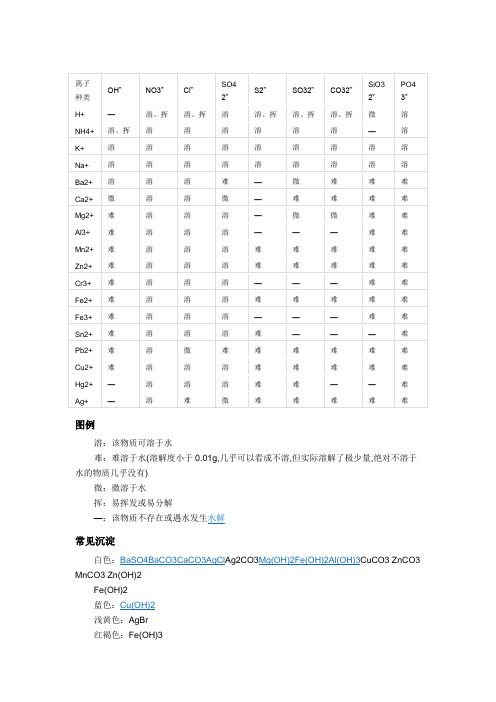
图例溶:该物质可溶于水难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀白色:BaSO4BaCO3CaCO3AgCl Ag2CO3Mg(OH)2Fe(OH)2Al(OH)3CuCO3 ZnCO3 MnCO3 Zn(OH)2Fe(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3编辑本段常见化合物沉淀Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)编辑本段溶解性口诀钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3. BaCO3 . BaSO4. AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③氢氧根多溶一个钡④口诀中未有皆下沉。
⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀及常见物质颜色

常见
液体颜色Biblioteka 1、蓝色溶液:CuSO4溶液、Cu(NO3)2溶液、CuCl2溶液 、蓝色溶液: 溶液、 溶液、 2、浅绿色溶液:FeSO4溶液、FeCl2溶液 、浅绿色溶液: 溶液、 3、黄色溶液:Fe2(SO4)3溶液、FeCl3溶液 、黄色溶液: 溶液、 4、无色溶液:大部分溶液 无色溶液: 5、I2 遇淀粉→蓝色溶液 、
常见固体颜色
1、黑色固体:铁粉、木炭、Fe3O4、CuO、MnO2、FeO 、黑色固体:铁粉、木炭、 、 2、绿色固体:Cu2(OH)2CO3 、绿色固体: 3、紫黑色固体:KMnO4、I2 、紫黑色固体: 4、红色固体:Cu、Fe2O3、HgO、Cu2O(氧化亚铜,砖 、红色固体: 、 、 (氧化亚铜, 红色) 红色) 5、蓝色固体:Cu(OH)2、CuSO4·5H2O(胆矾,五水硫酸 、蓝色固体: (胆矾, 铜) 6、淡黄色固体:S(硫磺) 、淡黄色固体: (硫磺) 7、银白色固体:铁丝(铁片 )、 、Al、Ag、Zn… )、Mg、 、 、 、银白色固体:铁丝(铁片…)、 8、白色固体:MgO、CaCO3、P2O5、CuSO4(无水硫酸 、白色固体: 、 )、NaCl、…… 铜)、 、
溶 解 性 口 诀
易溶, 钾钠铵硝都 易溶, 氯化物中银不溶, 氯化物中银不溶, 硫酸钡不钙银微, 硫酸钡不钙银微, 还有碳酸镁微溶, 还有碳酸镁微溶, 溶碱有五位, 溶碱有五位, 四微溶: 四微溶:氢氧化钙 ( Ca(OH)2 ) 钾钠氨钙钡, 钾钠氨钙钡, 硫酸钙 碳酸磷酸盐, 碳酸磷酸盐, 硫酸银 只溶钾钠铵。 只溶钾钠铵。 碳酸镁 ( MgCO3 ) ( Ag2SO4 ) ( CaSO4 )
常见物质的溶解性、颜色、俗称

常见物质的溶解性1、气体:溶的:CO2、HCl、SO2、NH3等。
不溶(或不易溶):O2、H2、CH4、CO、N2等。
2、金属氧化物:除CaO、Na2O、K2O、BaO溶外,大多数不溶3、酸:大多数溶4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水;5、盐:含有钾、钠、硝酸根、铵根的盐都溶于水;含Cl-的盐只有AgCl不溶于水,其他都溶于水;含SO42-的盐只有BaSO4不溶于水,其他都溶于水;含CO32-的盐只有含K+、Na+、NH4+溶于水,其他都不溶于水。
酸碱盐溶解性口诀:1、酸类多数都易溶;2、碱类易溶钾钠钡铵,钙是微溶余不溶;3、盐类:①钾盐钠盐硝酸盐,还有铵盐都易溶;(钾钠铵硝都易溶)②硫酸盐中钡不溶,硫酸钙银是微溶。
③氯化物中银不溶;④碳酸盐只溶钾钠氨,但是全能溶于酸。
⑤AgCl、BaSO4遇酸也不溶,加稀硝酸不溶解。
常见物质的颜色(一)固体的颜色1、黑色固体:木炭C,氧化铜CuO,二氧化锰MnO2,四氧化三铁Fe3O4,铁粉Fe(铁块银白色)2、紫黑色固体:高锰酸钾KMnO43、红色固体:铜Cu—紫红色,氧化铁Fe2O3——红(棕)色红磷P4、红褐色沉淀:氢氧化铁Fe(OH)35、浅黄色固体:硫磺S6、蓝色:硫酸铜晶体CuSO4·5H2O(无水硫酸铜白色),氢氧化铜沉淀Cu(OH)27、大部分固体:白色,如无水硫酸铜CuSO4,CaO,CaCO3沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) 等;②碱:蓝色↓:Cu(OH)2;红褐色↓:Fe(OH)3;白色↓:其余不溶性碱为白色。
(二)液体的颜色1、大部分液体:无色,如水,稀盐酸,稀硫酸,酚酞试液等2、蓝色溶液:含有Cu2+的溶液—硫酸铜Cu SO4溶液,氯化铜CuCl2溶液,硝酸铜Cu(NO3)2溶液3、黄色溶液:含有Fe3+的溶液—Fe2(SO4)3溶液,FeCl3溶液,Fe(NO3)3硝酸铁溶液4、浅绿色溶液:含有Fe2+的溶液—FeSO4溶液,FeCl2溶液,硝酸亚铁Fe(NO3)2溶液5、紫红色溶液:高锰酸钾溶液KMnO46、紫色溶液:石蕊溶液(三)常见气体、无色气体:单质:氧气O2,氢气H2,氮气N2。
最新初中化学中常见物质的溶解性情况

初中化学中常见物质的溶解性情况单质1、【金属单质....】:所有金属几乎难溶于水(但一些金属由于很活泼,在常温下能够和水发生反应:例如K、Ca、Na等)。
2、【非金属单质.....】:①(固态)C、S、P等难溶于水;②(气态) N2、H2 等难溶于水,O2 不易溶于水。
化合物1、【酸的溶解性.....】【大部分酸及酸性氧化物(非金属氧化物)能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物(金属氧化物)不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)】。
2、【碱的溶解性.....】▲溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钠和氨水。
▲其他的碱大部分不溶于水:难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色(包括Fe(OH)2)。
▲其中AgOH 为白色固体,属于碱,常温下AgOH极不稳定,易分解为棕褐色难溶于水的氧化银固体.低温下可制得氢氧化银在水中的白色沉淀,Ca(OH)2为微溶于水的白色固体。
3、【盐的溶解性.....】★含有钾、钠、硝酸根、铵根的物质都溶于水;★含Cl- 的化合物只有AgCl不溶于水,其他都溶于水;★含SO42-的化合物只有BaSO4不溶于水,Ag2SO4、CaSO4微溶于水, 其他都溶于水;★含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他绝大部分不溶于水,一些微溶于水或者遇到水发生水解。
注意:【沉淀物中AgCl和BaSO4不溶于稀硝酸,其他沉淀物能溶于酸。
如:Mg(OH)2、CaCO3、BaCO3、Ag2 CO3等】4、【氧化物的溶解性.......】▲金属氧化物一般都不溶解,例如:CuO, Fe2O3, Fe3O4 ,MgO, Al2O3 ,MnO2等, 其中CaO能与水反应。
▲非金属氧化物:①难溶于水,例如:CO、NO等。
②可溶于水,例如:CO2(其中CO2 溶于水后又能与水反应)。
化学常见酸碱盐溶解性

化学常见酸碱盐溶解性中考重点|化学常见酸碱盐溶解性1.酸:氢离子和各酸根离子构成酸,都是可溶的。
注意:硝酸(HNO3),盐酸(HCl)以及硫酸(H2SO4)属于三大强酸,碳酸(H2CO3)则属于弱酸。
除了浓硫酸具有吸水性,另外三种酸都具有挥发性。
2.碱:由金属元素或铵根与氢氧根组成的化合物,称为碱。
记住常见的碱中可溶性的碱,五个字:“钾钠钙钡铵”【KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3∙H2O】都是可溶性的碱。
补充:氢氧化钙微溶于水,也就是我们经常提到的澄清石灰水,氢氧化铜是蓝色絮状沉淀,氢氧化铁是红棕色的絮状沉淀。
物质的特性,在推断题中常作为物质的信息点和突破口。
Cu(OH)2沉淀Fe(OH)3沉淀前方高能!重!点!来!了!3.盐:金属离子(或铵根)与酸根离子构成的化合物3.1.三个字——“钾钠铵”。
在盐的分类中,根据盐中金属元素(或铵根) 的种类,盐可以分为钾盐(KCl、K2CO3、K2SO4),钠盐(NaCl、Na2CO3、NaNO3),铵盐(NH4Cl、NH4NO3、NH4HCO3)等。
由钾、钠、铵【K、Na、NH4】组成的盐,一定都是可溶的,以上已举例。
3.2. 三个字——“三强酸”找三强酸的酸根,前面讲到三大强酸,分别是硝酸,盐酸,和硫酸。
当盐中有盐酸根(Cl−),硫酸根(SO42−),硝酸根(NO3−)的时候,都是可溶的。
比如:NaCl、Na2SO4、NaNO3。
但是!但是!记住两个挑事儿的特例①含有盐酸根(Cl−)的盐当中,氯化银(AgCl)是不可溶的白色沉淀;②含有硫酸根(SO42−)的盐中,硫酸钡(BaSO4)是不可溶的白色沉淀;这两个是含有三强酸酸根的常见盐当中唯一两个不可溶的碱。
所以,如果某种盐中既没有钾钠铵,也没有三强酸酸根,则该种盐为不可溶性盐。
你也会发现,大部分的碳酸盐,都是不可溶的。
下面你可以花30s时间来记住以上几点。
然后检查一下自己是否有理解和记住:判断以下三种物质的溶解性:(1) MgSO4 (2) BaCO3 (3) Mg(OH)2(1) MgSO4:属于盐,以三强酸中的硫酸根结尾,为可溶性盐;(2) BaCO3:属于盐,没有钾钠铵,也没有三强酸的酸根,为不可溶性盐;(3) Mg(OH)2:属于碱,非“钾钠钙钡铵”其中之一,为不可溶性碱。
高中化学溶解性表
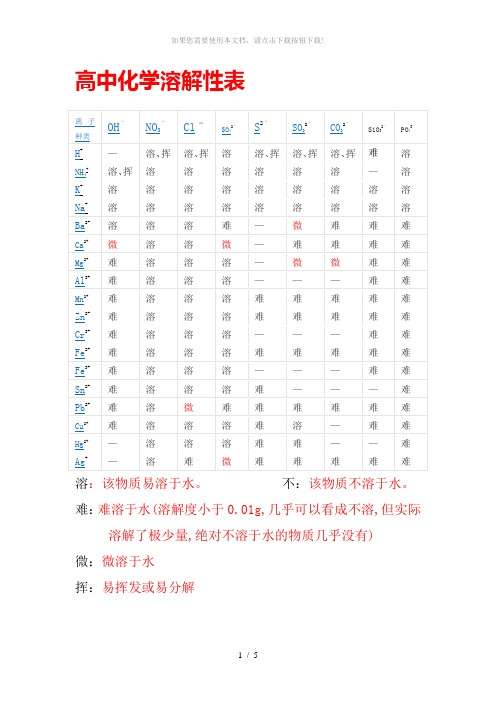
高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解沉淀鉴别色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
9、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。
10、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。
(注:可编辑下载,若有不当之处,请指正,谢谢!)。
化学小学常见物质的溶解性质

化学小学常见物质的溶解性质一、常见物质的溶解性质概述溶解是化学中一种常见的物质性质,指的是将固体、液体或气体溶质(底物)溶解于溶剂中,形成溶液的过程。
化学小学常见物质的溶解性质是我们学习化学的基础,掌握物质的溶解性质有助于我们了解物质之间的相互作用和溶解规律。
在这篇文章中,我们将重点讨论一些常见物质的溶解性质。
二、常见物质溶解性质的影响因素物质的溶解性质受到许多因素的影响,包括温度、溶剂的性质、溶质和溶剂的相互作用力以及溶剂的浓度等。
1. 温度的影响温度是影响物质溶解性质的重要因素之一。
一般来说,随着温度的升高,物质的溶解度也会增加。
这是因为在较高温度下,分子运动速度加快,分子间的相互作用力减弱,使得物质更容易溶解。
但是也有一些物质在升高温度后溶解度减小或无明显变化,这是由于在溶解过程中伴随着吸热反应,加热会使吸热反应逆转而使物质难以溶解。
2. 溶剂的性质溶剂的性质对物质的溶解性质也有着重要影响。
不同类型的溶剂对不同物质有着不同的溶解性。
比如,极性溶剂可以溶解极性和部分极性物质,而非极性溶剂则更适合溶解非极性物质。
这是因为溶剂和溶质之间的相互作用力能够影响溶解的程度。
3. 相互作用力分子间的相互作用力也是影响溶解性的重要因素之一。
通常来说,溶剂和溶质之间的相互作用力越强,溶解度就越高。
比如,极性溶剂中的极性分子具有强的分子间相互作用力,能够更好地溶解其他极性分子。
而溶剂和溶质之间没有相互作用力或相互作用力较弱的情况下,溶解度就较低。
4. 浓度的影响溶剂的浓度对物质的溶解性质也有一定的影响。
一般来说,在一定温度和压力下,溶剂的浓度越高,溶解物质的能力也就越强。
这是因为增加溶剂的浓度能够提高溶质与溶剂之间的相互碰撞频率,从而增加溶解度。
三、常见物质的溶解性质举例1. 盐的溶解性盐是我们生活中常见的溶质之一。
一般来说,大多数普通盐类在水中具有良好的溶解性。
这是因为水分子是极性分子,而盐中的阳离子和阴离子与其之间的相互作用力能够使盐晶体逐渐解离为离子并与水分子形成溶液。
常见物质溶解性记忆口诀(精)

常见物质溶解性记忆口诀
1、钾钠硝铵溶
2、盐酸盐可溶除银汞
3、再说硫酸盐,
不溶有钡铅
4、最后说碱类
可溶钾钠铵和钡
另:有四种微溶物:
氢氧化钙、硫酸银、硫酸钙、碳酸镁
解释:
1、在初中阶段认为:含钾元素、钠元素、硝酸根或铵根的化合物均为可溶的
2. 盐酸盐即金属氯化物中,除了氯化银
氯化亚汞,都是可溶的
3、硫酸盐(金属离子或铵根离子与酸根离子构成的化合物中, 只有硫酸钡和硫酸铅是不溶的
4、碱 (金属离子和氢氧根粒子构成的化合物及氨水这类物质中, 只有氢氧化钾、氢氧化钠、氨水和氢氧化钡是可溶的。
常见物质溶解性表(20℃)

附:常见物质溶解性表(20℃)OH - NO -3Cl -SO -24S -2SO -23 CO -23 SiO -23 PO -34H +溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 微 溶 NH +4 溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 K+溶 溶 溶 溶 溶 溶 溶 溶 溶 Na+溶 溶 溶 溶 溶 溶 溶 溶 溶 Ba 2+溶 溶 溶 不 溶 不 不 不 不 Ca 2+微 溶 溶 微 微 不 不 不 不 Mg 2+不 溶 溶 溶 溶 微 不 不 不 Al 3+不 溶 溶 溶 - - - 不 不 Mn 2+不 溶 溶 溶 不 不 不 不 不 Zn 2+不 溶 溶 溶 不 不 不 不 不 Cr 3+不 溶 溶 溶 - - - 不 不 Fe 2+不 溶 溶 溶 不 不 不 不 不 Fe 3+不 溶 溶 溶 - - 不 不 不 Sn 2+不 溶 溶 溶 不 - - - 不 Pb 2+不 溶 微 不 不 不 不 不 不 Bi 3+不 溶 - 溶 不 不 不 - 不 Cu 2+不 溶 溶 溶 不 不 不 不 不 Hg+- 溶 不 微 不 不 不 - 不 Hg 2+- 溶 溶 溶 不 不 不 - 不 Ag+-溶不微不不不不不说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
阴离子阳离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见物质溶解性(一)
钾盐铵盐都易溶,
硝酸盐遇水影无踪。
硫酸盐不溶钡和铅,
氯化物不溶银、亚汞。
其它盐类溶三种,①
沉淀溶于强酸中。
钾钠钡钙碱可溶,②
其它也溶强酸中。
注:①除硝酸盐、硫酸盐、氯化物以外的盐类只有钾、钠、铵盐可溶。
②氢氧化
钙Ca(OH)2是微溶。
常见物质溶解性(二)
钾钠铵盐水易溶,
硝酸盐类性相同;
“硫”盐不溶钡与铅,①
“氯”盐不溶银亚汞;②
弱碱和那弱酸盐,
水中大部分不能溶。
注:①“硫”盐,指硫酸盐。
②“氯”盐,指盐酸盐。
盐类物质的溶解性
一切钠、钾盐全部溶,
铵盐、硝酸盐也相同。
硫酸钡、铅要除外,
氯化亚汞、银不溶,
亚硫酸盐、磷酸盐,
钠、钾、铵溶余不溶,
碳酸盐和硅酸盐,
全跟上面相雷同。
硫化钾、钡、钠、镁溶,
硫化钙微溶余不溶。
盐类溶解性歌
硝酸钾钠溶,
碳硅和亚硫,
盐酸除银汞,
钠后都不溶。
①
硫酸去钡铅,
微溶氯化铅,
磷盐多不溶。
硫酸钙银汞。
注:①溶解性表中钠以后的金属盐都不溶于水。
酸碱盐溶解性
钾钠铵盐硝酸盐,
都能溶于水中间,
盐酸除了银和汞,
硫酸难溶是钡铅。
碳酸磷酸不多溶,
溶者只有钾钠铵,
碱有钾钠铵和钡,
硫化物中加镁盐。
余者皆是难溶物,
微溶几个记心间:
碱中只有钙一个,
亚汞、钙银是硫酸盐,
氯化物中仅有铅,
附着镁是亚硫酸;
硫化物里有个钙,
有心记住并不难。
主要碱、盐溶解性口诀
钾、钠、铵、硝、溶
(钾盐、钠盐、铵盐、硝酸盐全溶)
盐酸除银、汞(Hg+),
(盐酸盐中AgCl和Hg2Cl2不溶)
硫酸不溶有钡、铅,
(硫酸盐中BaSO4和PbSO4不溶)
溶碱只有钾、钠、钡、钙、铵。
[Ca(OH)2微溶]
(碳酸、磷酸盐、只溶钾、钠、铵)。
