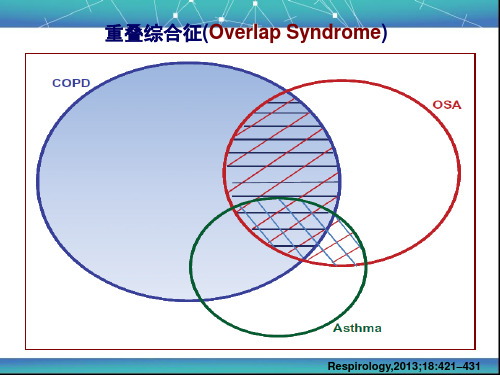
重叠综合征-COPD与OSA
COPD-OSAS重叠综合征患者呼吸衰竭的影响因素分析

Mod Diagn Treat 现代诊断与治疗2020Apr 31(7)慢性阻塞性肺疾病(COPD )-阻塞性睡眠呼吸暂停综合征(OSA S )重叠综合征指COPD 与OSA S 并存的疾病,其发病机制暂未明确,可能与炎症状态、氧化/抗氧化失衡等因素有关[1]。
患者因存在肺换气或通气功能障碍,难以正常进行气体交换,可导致一系列代谢和生理功能紊乱,气道炎症加重,气道重构加速,进一步加重肺功能障碍,可引发多种严重并发症。
呼吸衰竭是一种功能性障碍状态,是COPD -OSAS 重叠综合征的常见并发症,其可影响患者病情恢复,并有较高致死率[2]。
为预防呼吸衰竭发生,本研究回COPD -OSAS 重叠综合征患者呼吸衰竭的影响因素分析卢晏民(商丘市第一人民医院呼吸与危重症医学一科,河南商丘476000)摘要:目的分析慢性阻塞性肺疾病(C OPD )-阻塞性睡眠呼吸暂停综合征(O SAS )重叠综合征患者呼吸衰竭的影响因素。
方法回顾性分析我院2019年1~12月收治的C OPD-OSAS 重叠综合征患者300例的临床资料,按照是否发生呼吸衰竭分为观察组37例和对照组263例,观察组发生呼吸衰竭,对照组未发生呼吸衰竭,分析导致C OPD-OSAS 重叠综合征患者呼吸衰竭的危险因素。
结果观察组年龄、性别、病程、身体质量指数(BMI )、吸烟史、夜间憋醒及机械通气占比与对照组比较,差异无统计学意义(P >0.05);观察组颈围≥40cm 、呼吸困难/发绀及最长呼吸暂停时间(LAT )≥45s 占比高于对照组,差异均有统计学意义(P <0.05);经Logistic 回归分析发现,颈围≥40cm 、呼吸困难/发绀及最长呼吸暂停时间(LAT )≥45s 是导致C OPD-OSAS 重叠综合征患者呼吸衰竭的危险因素(O R >1,P <0.05)。
结论颈围等多种因素是C OPD-OSAS 重叠综合征患者呼吸衰竭的危险因素,可通过上述特征及时划分具有呼吸衰竭高危因素的患者,对其进行针对性的治疗及护理,以预防呼吸衰竭发生。
重叠综合征PPT课件
其确切的机制尚不清楚,推断重叠综合征患者降低肺部过
度通气有可能会改善睡眠质量。
Kwon JS, et al. COPD. 2009;6:441-445.
OSA与重叠综合征的氧化应激反应
COPD与OSA存在氧化应激反应,反应产生大量ROS. 过量
1.49
Results.
治疗组 慢波睡眠时间%延长 (27.9±2.7 vs 42.3±4.2; p<0.01) 睡眠效率改善 (90.8±1.3 vs 94.4±1.5; p<0.05). AHI减低 (61.2±8.5 vs 43.1±8.6; p<0.05), 暂停相关觉醒 (22.2±7.6 vs 11.6±4.7; p<0.05), 最长呼吸暂停时间(S) (54.9±7.1 vs 37.8±5.6; p<0.01), 每小时低氧事件 (51.8±7.7 vs 37±7.8; p<0.01) 、 Epworth 评分(16.6±0.8 vs 9.2±0.9; p<0.001) 显著减低. 这些变化对照组未能见到. N-乙酰半胱氨酸显著减低血脂质过氧化物,增加抗氧化指标(谷胱 甘肽).
Lo´pez-Acevedo,et al.报告OSA患者中有10–20%为 重叠综合征。
最近的一篇综述指出,COPD与OSA共存的患者在成 年人群中近1%。
Lee R, et al. Curr Opin Pulm Med 2011,17:79–83 McNicholas WT. Am J Respir Crit Care Med 2009; 180:692–700.
COPD-OSAHS_重叠综合征患者的相关研究进展

Advances in Clinical Medicine 临床医学进展, 2023, 13(6), 10022-10028 Published Online June 2023 in Hans. https:///journal/acm https:///10.12677/acm.2023.1361401COPD-OSAHS 重叠综合征患者的相关研究进展刘淑宪1,华 毛21青海大学研究生院,青海 西宁 2青海大学附属医院呼吸病系学科,青海 西宁收稿日期:2023年5月21日;录用日期:2023年6月14日;发布日期:2023年6月26日摘要 阻塞性睡眠呼吸暂停低通气综合和慢性阻塞性肺疾病代表着成年人群中高度普遍存在的主要健康问题,两者均为呼吸系统常见的慢性疾病,当两种疾病出现在同一患者时称为OSAHS-COPD 重叠综合征,其至少影响1%的人群。
但到目前为止,OS 特殊的临床特征并未得到很好地描述,临床对于重叠综合征的诊断也仅仅是通过COPD 或者是OSAHS 诊断标准来识别,还有目前存在绝大多数呼吸健康专业人员及临床医师团队对OS 仍未有充分的认识,使得重叠综合征的漏诊与误诊率只升不降。
关键词慢性阻塞性肺疾病,阻塞性睡眠呼吸暂停低通气综合征,重叠综合征,肺功能,睡眠检测,代谢综合征Correlational Research Progress in Patients with COPD-OSAHS Overlap SyndromeShuxian Liu 1, Mao Hua 21Graduate School of Qinghai University, Xining Qinghai 2Department of Respiratory Diseases, Affiliated Hospital of Qinghai University, Xining Qinghai Received: May 21st , 2023; accepted: Jun. 14th , 2023; published: Jun. 26th , 2023AbstractObstructive sleep apnea hypopnea syndrome and chronic obstructive pulmonary disease represent major health problems that are highly prevalent in the adult population. Both of them are com-mon chronic diseases of the respiratory system. When the two diseases appear in the same patient,刘淑宪,华毛they are called OSAHS-COPD overlap syndrome, which affects at least 1% of the population. How-ever, so far, the special clinical characteristics of OS have not been well described, and the clinical diagnosis of OS is only identified by COPD or OSAHS diagnostic criteria. In addition, most respira-tory health professionals and clinical physician teams have not fully understood OS, which makes the missed diagnosis and misdiagnosis rate of overlap syndrome only rise.KeywordsChronic Obstructive Pulmonary Disease, Obstructive Sleep Apnea Hypopnea Syndrome, Overlap Syndrome, Pulmonary Function, Polysomnography, Metabolic SyndromeThis work is licensed under the Creative Commons Attribution International License (CC BY 4.0)./licenses/by/4.0/1. 前言慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD),简称慢阻肺,根据最新的指南,COPD被定义为一种可预防和可治疗的疾病,其临床表现主要是呼吸道症状,如咳嗽、痰液的产生和不同程度的呼吸困难,以及部分可逆的气流阻塞[1][2],最新的两项调查显示COPD影响了中国约13.6%~13.7%的40岁或以上成年人群[3][4],这将造成我国巨大的医疗经济负担。
慢性阻塞性肺疾病与睡眠呼吸疾病重叠综征的诊断与治疗

apnea[J].COPD,2013,10:4—10.
K,Tomiyama H,Takata Y,et a1.Overlap syndrome:
[2]Shiina
additive with
e如ets
of COPD
on
the cardiovascular damages in patients
[1]Sharma
B,Neilan TG,Kwong RY,et a1.Evaluation of right
[10]Luo
YM,He
BT,Wu YX,et a1.Neural respiratory drive and
chronic obstructive pulmonary disease J Respir Crit Care Med,2014,190:227—
relationtoCOPD[J].Int J
MH,Newman
Chron ObstructPulmon Dis,2014,
[6]saIlders
AB,Haggerty
CL,et a1.Sleep
Heart
Health Study.Sleep and sleep-disordered breathing in adults with predominantly mild obstructive airway Crit Care Med,2003,167:7-14.
[8]郭红喜,罗远明.重叠综合征的诊断与治疗[J].中国全科医 学:医生读者版,2012,15:15—16,19. [9]徐靖,袁红,伍颖欣,等.慢性阻塞性肺疾病患者夜间低通气 与呼吸中枢驱动的关系[J].中华医学杂志,2013,93:411-
慢性阻塞性肺疾病合并osa的重叠综合征研究进展

慢性阻塞性肺疾病合并OSA的重叠综合征研究进展马畅㊀吴晓梅㊀彭京兰doi:10.3969/j.issn.1009-6663.2020.04.033作者单位:150081㊀黑龙江哈尔滨ꎬ哈尔滨医科大学附属第二医院呼吸内科通信作者:吴晓梅ꎬE ̄mail:wuxiaomeihx@163.com㊀㊀DavidFlenley[1]是第一个创造 重叠综合征(o ̄verlapsyndromeꎬOS) 一词的人ꎬ这个词指的是慢性阻塞性肺疾病(简称慢阻肺)和阻塞性睡眠呼吸暂停(obstructivesleepapneaꎬOSA)并存ꎬ同时他认为其他肺部疾病也可能重叠ꎮ与单独的两种疾病相比ꎬOS患者夜间低氧血症和睡眠障碍更严重[2]ꎮOS具有重要的临床和治疗意义ꎬ不同于每一种潜在疾病的表现和管理ꎮ然而ꎬ这定义有些不精确ꎬ这适用于严重范围的混合疾病(慢性阻塞性肺病表型ꎬ肺囊性纤维化和特发性肺纤维化)ꎬ并未考虑到病理机制相互作用的可能性ꎬ每种疾病均可进展或彼此加重ꎮ这篇综述重点阐述 重叠 概念演变ꎬ着重于慢阻肺ꎮ定义一㊁慢阻肺和OSA慢阻肺特征是持续存在的呈进行性发展的气流受限ꎬ伴有气道及肺对有害颗粒或气体所致慢性炎症反应增加ꎬ加速肺功能的损失和不可逆的肺损伤ꎮ慢阻肺是在局部炎症的背景下演变而来的ꎬ而最近才认识到局部炎症也与全身炎症有关ꎬ并且具有相当高的发病率和死亡率ꎮ经典研究显示夜间发病率和死亡率都有所上升[3]ꎮOSA以睡眠过程中反复出现阻塞性呼吸暂停事件为主ꎬ伴有打鼾㊁白天嗜睡㊁性格改变㊁记忆力下降等临床症状 所有这些都有神经认知和心血管后遗症ꎮ肥胖是OSA最常见的危险因素ꎬ尤其是在白种人中ꎬ但约有三分之一的患者并非肥胖[4]ꎮ目前ꎬOSA相关共病研究是OSA临床研究的一项重要课题ꎮ最近的一些研究报道了OSA患者共病的高患病率[5-8]ꎻ在心血管㊁神经系统产生间歇性缺氧的病理机制已经确定[9]ꎮ二㊁OSOS为慢阻肺患者在睡眠中并发上气道阻塞继发的呼吸暂停ꎮ潜在的缺氧会增加心血管疾病的风险ꎬ包括房颤㊁右心衰和肺动脉高压ꎬ从而增加与该疾病相关的死亡率ꎮ最近的观察性研究报告了OS患者与OSA患者相比死亡率有所增加[10-11]ꎬ持续正压通气(continuouspositiveairwaypressureꎬCPAP)的使用消除了单纯慢阻肺和OS患者之间的差异且具有保护作用ꎮ其他研究小组也报道了使用CPAP的OS患者的死亡率比不使用CPAP的OS患者的死亡率要低ꎮ但是ꎬCPAP的使用是否可以预防更坏的结果ꎬ或者与其他行为(例如坚持他汀类药物治疗)相关ꎬ从而改善患者的结果ꎬ目前并未完全确认ꎮ越来越多的数据显示ꎬ与单纯的慢阻肺相比ꎬOS患者心脏的有害变化更严重[12-13]ꎬ这些变化通常是由低氧血症造成的ꎮOS患者还可表现为高碳酸血症和较轻的下气道阻塞[14]ꎮ流行病学慢阻肺和OSA是临床中常见的且可能发生在同一患者ꎮ据最新文献ꎬ慢阻肺是否易患OSA并未明确ꎮOS在一般人群中的患病率为1 0%~3 6%ꎬOSA患者为8%~56%ꎬ慢阻肺患者为3%~66%[15]ꎮ在OSA患者中ꎬOS的发生率随着年龄的增长而增加ꎬ这与慢阻肺在老年人中比中年人更普遍的说法一致[15]ꎮ数据证实OS通常比OSA患者年龄大ꎬ但除肺动脉高压外ꎬ其共病患病率与OSA几乎相同ꎬ这似乎表明ꎬ在OS中ꎬ共病的患病率受年龄(或慢阻肺)的影响比受呼吸暂停本身的影响更大ꎬ与睡眠障碍有直接关系ꎮ睡眠与代谢和心血管疾病发病率之间的关系可能是由间歇性低氧血症引起的氧化应激和睡眠剥夺(或睡眠碎片化)所介导ꎬ后者激活交感神经并改变下丘脑-垂体-肾上腺轴的作用ꎮ因此ꎬ即使确切的机制尚不清楚ꎬ炎症㊁交感神经激活和睡眠质量之间的双向关系似乎很清晰ꎮ在慢阻肺患者中ꎬ睡眠期间呼吸异常发生率较高ꎬ66%的中重度慢阻肺患者存在睡眠呼吸紊乱(sleep ̄disorderedbreathingꎬSDB)[16]ꎮ这似乎表明慢阻肺在OSA的发病机制中发挥作用ꎬ但仍有几个需要考虑的因素ꎮ首先ꎬ慢阻肺和OSA的患病率都会受到年龄的影响ꎮ其次ꎬ慢阻肺的严重程度可能影响以AHI评估的OSA严重程度的测量ꎮ这使得寻找相互作用的机制变得困难ꎬ即一种疾病会导致另一种疾病的发生或恶化ꎮ最近一项对6000多名一般人群进行的复合研究报告ꎬAHIȡ5的SDB患者死亡率更高ꎬ但SDB的发生和SDB的严重程度可以减轻FEV1降低对死亡率的影响[2]ꎮ这些数据提示ꎬOSA与慢阻肺的病理机制可能相互作用ꎬ慢阻肺患者低体重指数(bodymassindexꎬBMI)和肺过度通气能够防止OSAꎬ而慢阻肺上气道和全身炎症能加重OSA的负面影响ꎮ一项睡眠与心脏健康研究(SleepHeartHealthStudyꎬSHHS)中并没有显示慢阻肺中OSA风险的增加ꎮ这可能是因为该研究纳入了气道轻度阻塞的受试者ꎬ这些受试者年龄较大(平均为66岁)ꎬ并且仅使用较老的热敏电阻技术进行测试[17]ꎮ此外ꎬ慢阻肺患者可能不会描述睡眠症状ꎬ或将其归因于原发性肺部疾病ꎮ问卷调查也并不完善ꎮ由于OSA的发病率在30~60岁期间上升最多ꎬ并加速了死亡率ꎬ因此ꎬ有可能患有更严重ꎬ气道阻塞的人ꎬ已经死亡ꎬ而无法在本研究中捕捉到ꎮ也有可能没有增加的风险ꎬ这两种疾病只是偶然共存ꎮ因而ꎬ需要对OS患者进行更好的表型描述ꎬ以优化这两种疾病的治疗策略ꎮ病理机制具体病理机制尚不清楚ꎬ简要回顾已知的机制ꎮ一㊁觉醒和睡眠呼吸紊乱在睡眠中ꎬ慢阻肺患者夜间低通气主要发生在快速动眼期(RapidEyeMovementꎬREM)ꎬ这是由于肋间肌肉松弛和胸壁活动减少造成的ꎮ另一方面ꎬOSA患者发生呼吸暂停的主要原因是上气道塌陷㊁胸内压降低ꎬ因而交感神经兴奋导致夜间觉醒ꎬ白天嗜睡过多ꎮ与慢阻肺或OSA患者相比ꎬ伴有高碳酸血症的夜间低氧血症在OS患者中更为严重ꎮ可能会进一步增加心血管事件的风险ꎬ尤其是肺动脉高压和房颤ꎬ从而导致较慢阻肺或OSA患者预后不良ꎬ增加死亡风险ꎮ二㊁气道结构改变慢阻肺㊁活动性吸烟ꎬ都与慢性黏膜炎症㊁扁桃体和腺体肥大有关ꎬ将增加上呼吸道阻力ꎬ甚至气管塌陷ꎬ均有利于OSA的发展ꎮ最近的数据显示ꎬ针对鼻腔炎症的治疗(如鼻用皮质类固醇和孟鲁司特)有改善OSA的作用ꎮ仰卧位时头部的体液转移使上气道狭窄在夜间加重ꎬ这种狭窄在液体过载的状态下更严重ꎬ如肺心病ꎮ皮质类固醇的使用可能导致中央肥胖和液体限制ꎬ从而促进上气道狭窄ꎮ在磁共振成像研究的一组受试者显示ꎬ上气道结构中存在脂肪堆积ꎮ此外ꎬ睡眠剥夺可能是由慢阻肺引起的ꎬ睡眠剥夺会通过减少颏舌肌活动而加重上呼吸道塌陷[18]ꎮ三㊁肺活量对气道的影响肺容量的增加会产生一种机械力ꎬ也就是所谓的 气管牵张力 ꎬ使上气道变硬ꎬ防止塌陷ꎮ在慢阻肺病例中ꎬ肺气肿对肺实质的破坏和组织弹性的降低是否会对大气道产生同样的拉力尚不清楚ꎮ然而ꎬBiselli等[19]对上气道塌陷性进行了测量ꎬ发现肺过度通气患者的上气道塌陷性确实较低ꎬ而且肺过度通气的X线征象与OSA严重程度的降低有关[20]ꎮ这些数据将推翻组织破坏导致重度慢阻肺过度通气致OSA发病的假说ꎮ四㊁炎症在慢阻肺存在时ꎬ存在一个复杂的细胞环境ꎬ其临床特征包括粘液分泌㊁支气管反应性以及气道壁和实质的重塑ꎮ对于每种疾病ꎬ包括嗜酸性粒细胞和中性粒细胞在内的多种细胞都参与其中ꎬ导致疾病的异质性ꎮ最近的人类和动物研究表明OSA可以影响下气道炎症和重塑ꎮ与仅患有慢阻肺的患者相比ꎬ通过OSA共存慢阻肺患者的气道灌洗液中ꎬ中性粒细胞水平ꎬ肿瘤坏死因子(tumornecrosisfac ̄torꎬTNF ̄α)ꎬ白细胞介素 ̄8(interleukinꎬIL ̄8)的升高ꎬ证明OSA能够引起慢阻肺患者气道炎症[21]ꎮ五㊁慢性间歇性缺氧OSA诱导的慢性缺氧引起下气道炎症模式改变㊁蛋白酶与抗蛋白酶失衡诱导的肺组织重构ꎬ包括近端气道壁纤维化和周围形成 肺气肿样变 ꎬ最终导致呼气流量受限的肺实质结构改变ꎮ诊㊀㊀断一般认为OS的诊断需同时满足慢阻肺和OSA的诊断ꎮ一㊁慢阻肺诊断标准参照2019版慢性阻塞性肺病诊断㊁治疗和预防全球策略(GOLD2019)ꎮ二㊁OSA的诊断标准参照中华医学会制定的成人阻塞性睡眠呼吸暂停基层诊疗指南(2018年)ꎮ治㊀㊀疗一㊁治疗慢阻肺/OSA针对慢阻肺患者ꎬ阻塞性肺病的治疗可以改善低氧血症ꎬ从而减少低氧血症的发生ꎮ治疗慢阻肺或减少口服类固醇ꎬ也可改善睡眠连续性ꎮ这两种效应都能减少低通气的次数ꎮ因此ꎬ从理论上讲ꎬ治疗慢阻肺可能会降低OSA严重程度的指标ꎮ在观察性研究中ꎬ慢阻肺患者的OSA治疗与降低死亡率有关ꎮ也有新的数据表明ꎬ慢阻肺中OSA的早期识别和治疗与降低医疗利用率有关ꎮKonikkara[22]等筛查了所有BMI为>30kg/m2的OSA合并慢阻肺加重的患者ꎮ如果筛查出OSA阳性ꎬ立即启动研究ꎬ符合条件后ꎬ则进行CPAP治疗ꎮ在随后的6个月ꎬ患者通过诊断和应用CPAP治疗与干预前6个月相比ꎬ减少了后续医疗利用率(急诊和再入院)ꎬ那些确诊但未应用CPAPꎬ则在诊断前后有相同的医疗利用率ꎮ二㊁吸氧治疗吸氧已成为慢阻肺日间重度低氧血症(静息动脉血氧饱和度SaO2ɤ88%)患者的主要治疗手段ꎬ这与改善生存率有关ꎮ在接受肺康复治疗的慢阻肺患者中ꎬ45%的样本AHIȡ15/h[23]ꎮ慢阻肺患者常表现为睡眠质量差和睡眠时换气不足ꎮ在睡眠中吸氧可能会增加OSA的诊断不确定性ꎮ最近ꎬ长期氧疗试验(long ̄termoxygentherapytestꎬLOTT)研究没有发现吸氧治疗对中度低氧血症(SaO2:89%~93%)患者有益ꎬ表明这些患者可能在夜间低氧比较明显[24]ꎮ到目前为止ꎬ只有一项研究专门针对OS患者进行了吸氧治疗ꎮAlford等人对20名同时患有OSA和慢阻肺的男性患者给予4L/min的吸氧ꎮ夜间低氧症状改善的同时ꎬ阻塞持续时间增加5 7sꎬ呼吸末二氧化碳分压升高9 5mmHg[25]ꎮ因此ꎬ在OS患者的治疗中不应仅使用氧ꎮ夜间吸氧后出现晨间头痛的慢阻肺患者应立即检测是否合并OSAꎮ三㊁最佳治疗方案目前没有专门的研究能够解决这个问题ꎮ长期以来ꎬ重度慢阻肺和高碳酸血症呼吸衰竭患者首选使用无创通气(noninvasiveventilationꎬNIV)ꎮ最近的这类研究表明ꎬ将日间二氧化碳分压水平正常化时ꎬ死亡率有所提高[26]ꎮ慢阻肺急性发作以外的高碳酸血症患者ꎬ可通过双水平治疗从NIV中获益[26-28]ꎬ目的是逆转日间高碳酸血症㊁减轻与睡眠呼吸不足和住院率有关的症状ꎮ实现更有效的通气及降低二氧化碳张力水平ꎬ可能需要高流量㊁高压力支持ꎮ近期一项针对重度慢阻肺的研究表明患者生存率得到了改善ꎬ报告再次入院的时间延长[28]ꎮ为达到改善健康相关的生活质量ꎬ则需要良好的治疗依从性ꎮ对于同时患有慢阻肺和OSA的患者ꎬ未明确的是ꎬ高碳酸血症是由慢阻肺单独引起的ꎬ还是由慢阻肺和OSA共同引起的ꎬ也就是说ꎬ用CPAP(而不是NIV)治疗OSA不知是否可以逆转某些低通气ꎬ如同肥胖低通气综合征[29]ꎮ高碳酸血症重叠综合征患者的最佳初始治疗方案仍不清楚ꎮ美国睡眠医学学会(AmericanAcademyofSleepMedicineꎬAASM)建议患有严重肺部疾病(如慢阻肺)的患者先不要考虑使用CPAP[30]ꎮ结㊀㊀论关于慢阻肺或OSA严重程度对OS的临床表现或结果的影响ꎬ目前还没有足够的数据ꎬ因为重度OSA合并轻度慢阻肺的后果可能与轻度OSA合并重度慢阻肺的后果不同ꎮ然而从目前来看ꎬ新的数据表明慢阻肺与OSA之间有相互作用的病理机制ꎮ例如ꎬ鼻腔疾病对皮质类固醇的影响可能促进OSAꎻ而OSAꎬ尤其是间歇性缺氧ꎬ可能会对下气道造成不利影响ꎬ甚至恶化预后和死亡ꎮ如果不能诊断出OSAꎬ反而加强标准的治疗ꎬ只会加速这种恶性循环ꎮ目前已经证实ꎬCPAP治疗OSA有可能改善肺部疾病ꎬ提高生活质量ꎬ甚至可能提高死亡率ꎮ考虑到死亡率的风险ꎬ临床医师必须对OSA或慢阻肺患者进行临床评估ꎬ以确定OS的发生率ꎬ并提供有效的治疗方案ꎮ医生需要意识到ꎬ对OSA和慢阻肺患者的治疗有可能改善以患者为中心的治疗结果ꎬ并可能降低医疗利用率ꎮ参考文献[1]㊀FLENLEYDC.Sleepinchronicobstructivelungdisease[J].ClinChestMedꎬ1985ꎬ6(4):651-661.[2]㊀PUTCHANꎬCRAINICEANUCꎬNORATOGꎬetal.Influenceoflungfunctionandsleep ̄disorderedbreathingonall ̄causemortali ̄ty:acommunity ̄basedstudy[J].AmJRespirCritCareMedꎬ2016ꎬ194(8):1007-1014.[3]㊀MCNICHOLASWTꎬFITZGERALDMX.Nocturnaldeathsamongpatientswithchronicbronchitisandemphysema[J].BrMedJꎬ1984ꎬ289(6449):878.[4]㊀LECUBENAꎬSAMPOLGꎬLLOBERESPꎬetal.Asymptomaticsleep ̄disorderedbreathinginpremenopausalwomenawaitingbari ̄atricsurgery[J].ObesSurgꎬ2010ꎬ20(4):454-461. [5]㊀APPLETONSLꎬGILLTKꎬLANGCJꎬetal.Prevalenceandco ̄morbidityofsleepconditionsinAustralianadults:2016SleepHealthFoundationnationalsurvey[J].SleepHealthꎬ2018ꎬ4(1):13-19.[6]㊀MOKHLESIBꎬHAMSAꎬGOZALD.TheeffectofsexandageonthecomorbidityburdenofOSA:anobservationalanalysisfromalargenationwideUShealthclaimsdatabase[J].EurRespirJꎬ2016ꎬ47(4):1162-1169.[7]㊀SENARATNACVꎬENGLISHDRꎬCURRIERDꎬetal.Sleepap ̄noeainAustralianmen:diseaseburdenꎬco ̄morbiditiesꎬandcorre ̄latesfromtheAustralianlongitudinalstudyonmalehealth[J].BMCPublicHealthꎬ2016ꎬ16(Suppl3):1029.[8]㊀TVEITRLꎬLEHMANNSꎬBJORVATNB.Prevalenceofseveralsomaticdiseasesdependsonthepresenceandseverityofobstruc ̄tivesleepapnea[J].PLoSOneꎬ2018ꎬ13(2):e0192671. [9]㊀DEWANNAꎬNIETOFJꎬSOMERSVK.IntermittentHypoxemiaandOSA:implicationsforComorbidities[J].Chestꎬ2015ꎬ147(1):266-274.[10]DUWꎬLIUJꎬZHOUJꎬetal.ObstructivesleepapneaꎬCOPDꎬtheoverlapsyndromeꎬandmortality:resultsfromthe2005-2008Na ̄tionalHealthandNutritionExaminationSurvey[J].IntJChronObstructPulmonDisꎬ2018ꎬ13:665-674.[11]KENDZERSKATꎬLEUNGRSꎬAARONSDꎬetal.Cardiovascularoutcomesandall ̄causemortalityinpatientswithobstructivesleepapneaandchronicobstructivepulmonarydisease(overlapsyn ̄drome)[J].AnnAmThoracSocꎬ2019ꎬ16(1):71-81. [12]NEILANTGꎬBAKKERJPꎬSHARMABꎬetal.T1measurementsfordetectionofexpansionofthemyocardialextracellularvolumeinchronicobstructivepulmonarydisease[J].CanJCardiolꎬ2014ꎬ30(12):1668-1675.[13]SHARMABꎬNEILANTGꎬKWONGRꎬetal.Evaluationofrightventricularremodelingusingcardiacmagneticresonanceimaginginco ̄existentchronicobstructivepulmonarydiseaseandobstructivesleepapnea[J].COPDꎬ2013ꎬ10(1):4-10.[14]RESTAOꎬFOSCHINOBARBAROMPꎬBRINDICCICꎬetal.Hy ̄percapniainoverlapsyndrome:possibledeterminantfactors[J].SleepBreathꎬ2002ꎬ6(1):11-18.[15]SHAWONMSRꎬPERRETJLꎬSENARATNACVꎬetal.Currentevidenceonprevalenceandclinicaloutcomesofco ̄morbidobstruc ̄tivesleepapneaandchronicobstructivepulmonarydisease:asys ̄tematicreview[J].SleepMedRevꎬ2017ꎬ32:58-68.[16]SOLERXꎬGAIOEꎬPOWELLFLꎬetal.Highprevalenceofob ̄structivesleepapneainpatientswithmoderatetoseverechronicobstructivepulmonarydisease[J].AnnAmThoracSocꎬ2015ꎬ12(8):1219-1225.[17]SANDERSMHꎬNEWMANABꎬHAGGERTYCLꎬetal.Sleepandsleep ̄disorderedbreathinginadultswithpredominantlymildobstructiveairwaydisease[J].AmJRespirCritCareMedꎬ2003ꎬ167(1):7-14.[18]LEITERJCꎬKNUTHSLꎬBARTLETTJRD.Theeffectofsleepdeprivationonactivityofthegenioglossusmuscle[J].AmRevRe ̄spirDisꎬ1985ꎬ132(6):1242-1245.[19]BISELLIPꎬGROSSMANPRꎬKIRKNESSJPꎬetal.Theeffectofincreasedlungvolumeinchronicobstructivepulmonarydiseaseonupperairwayobstructionduringsleep[J].JApplPhysiolꎬ2015ꎬ119(3):266-271.[20]KRACHMANSLꎬTIWARIRꎬVEGAMEꎬetal.Effectofemphy ̄semaseverityontheapnea–hypopneaindexinsmokerswithob ̄structivesleepapnea[J].AnnAmThoracSocꎬ2016ꎬ13(7):1129-1135.[21]WANGYꎬHUKꎬLIUKꎬetal.Obstructivesleepapneaexacerbatesairwayinflammationinpatientswithchronicobstructivepulmonarydisease[J].SleepMedꎬ2015ꎬ16(9):1123-1130.[22]KONIKKARAJꎬTAVELLARꎬWILLESLꎬetal.EarlyrecognitionofobstructivesleepapneainpatientshospitalizedwithCOPDexac ̄erbationisassociatedwithreducedreadmission[J].HospPractꎬ2016ꎬ44(1):41-47.[23]SCHREIBERAꎬCEMMIFꎬAMBROSINONꎬetal.Prevalenceandpredictorsofobstructivesleepapneainpatientswithchronicob ̄structivepulmonarydiseaseundergoinginpatientpulmonaryreha ̄bilitation[J].COPDꎬ2018ꎬ15(3):265-270.[24]Long ̄TermOxygenTreatmentTrialResearchGroup.Arandomizedtrialoflong ̄termoxygenforCOPDwithmoderatedesaturation[J].NEnglJMedꎬ2016ꎬ375(17):1617-1627.[25]ALFORDNJꎬFLETCHERECꎬNICKESOND.AcuteoxygeninpatientswithsleepapneaandCOPD[J].Chestꎬ1986ꎬ89(1):30-38.[26]KÖHNLEINTꎬWINDISCHWꎬKÖHLERDꎬetal.Non ̄invasivepositivepressureventilationforthetreatmentofseverestablechro ̄nicobstructivepulmonarydisease:aprospectiveꎬmulticentreꎬran ̄domisedꎬcontrolledclinicaltrial[J].LancetRespirMedꎬ2014ꎬ2(9):698-705.[27]RANDERATHWꎬVERBRAECKENJꎬANDREASSꎬetal.Defini ̄tionꎬdiscriminationꎬdiagnosisandtreatmentofcentralbreathingdisturbancesduringsleep[J].EurRespirJꎬ2017ꎬ49(1):1600959.[28]MURPHYPBꎬREHALSꎬARBANEGꎬetal.Effectofhomenon ̄invasiveventilationwithoxygentherapyvsoxygentherapyaloneonhospitalreadmissionordeathafteranacuteCOPDexacerbation:arandomizedclinicaltrial[J].JAMAꎬ2017ꎬ317(21):2177-2186.[29]MASAJFꎬCORRALJꎬALONSOMLꎬetal.Efficacyofdifferenttreatmentalternativesforobesityhypoventilationsyndrome.Pick ̄wickstudy[J].AmJRespirCritCareMedꎬ2015ꎬ192(1):86-95.[30]MORGENTHALERTIꎬAURORARNꎬBROWNTꎬetal.Practiceparametersfortheuseofautotitratingcontinuouspositiveairwaypressuredevicesfortitratingpressuresandtreatingadultpatientswithobstructivesleepapneasyndrome:anupdatefor2007.AnA ̄mericanacademyofsleepmedicinereport[J].Sleepꎬ2008ꎬ31(1):141-147.[收稿日期:2019-11-11]。
COPD-OSAHS重叠综合征的研究进展

derived neural cells in a primate model of Parkinson's
21 世纪以来,由于我国工业的迅猛发展而导致 与OSAHS 患者具有某些相同特征,两种疾病常同时
的大气污染、人民生活水平的改善、人口老龄化及自 或先后发生,1958 年David Flenley 首次将COPD 合
身不良嗜好等多种因素影响,使得慢性呼吸系统疾 并OSAHS 这种现象称为重叠综合征(overlap syn
临床误诊误治 2019 年 7 月 第 32 卷 第 7 期 Clinical Misdiagnosis & Mistherapy熏 Vol.32熏 No.7 May 2019
·107·
[] , , ( ): J . Nat Cell Biol 2016 18 3 246254. [30]徐梦莎,华允芬. 干细胞药物筛选模型研究进展
COPD 是目前最普遍的一种慢性肺部疾病,近 年来发病率逐年升高,尤其是在发达国家中,有研究 表明,美国、法国、英国、意大利、西班牙、波兰等西方 国家发病率为8% ~ 10% ,全球约有8000 万COPD 患者[6]。随着COPD 发病率的升高,其病死率也在 升高,其居美国居民死亡原因第四位,居欧盟国家死 亡原因第三位。我国王辰等在《柳叶刀》上发表的 一篇关于COPD 流行病学调查研究显示,20 岁及以 上成人的COPD 患病率为8. 6% ,40 岁以上人群患 病率达13. 7% ,60 பைடு நூலகம்以上人群患病率已超过27% ,
哮喘慢阻肺重叠综合征

根据患者的具体情况制定个体化的治疗方案,以提高治疗效果和患 者生活质量。
新型治疗手段
探索新型治疗手段,如细胞治疗、基因治疗等,为哮喘慢阻肺重叠综 合征的治疗提供更多选择。
社会支持与政策研究
社会认知提升
加强公众对哮喘慢阻肺 重叠综合征的认知,提 高患者自我管理和预防 意识。
医疗保障政策
诊断率
由于ACOS临床表现复杂, 诊断率较低,许多患者可 能长期被误诊或漏诊。
临床表现
症状
ACOS患者可能出现咳嗽、 咳痰、呼吸困难等症状, 其中呼吸困难常呈持续性, 且在活动后加重。
体征
肺部听诊可能闻及哮鸣音 和湿啰音,严重时可出现 桶状胸、呼吸浅快等 COPD典型体征。
病程
ACOS病程较长,且容易 反复发作,严重影响患者 的生活质量和预后。
研究制定针对哮喘慢阻 肺重叠综合征的医疗保 障政策,减轻患者经济 负担。
康复与护理支持
建立完善的康复与护理 支持体系,为患者提供 全方位的关怀和支持。
THANKS FOR WATCHING
感谢您的观看
03
哮喘慢阻肺重叠综合征 的诊断与鉴别诊断
诊断标准
支气管哮喘病史
症状和肺功能异常
患者通常有长期反复发作的哮喘病史, 症状包括喘息、胸闷、咳嗽等。
患者同时具备哮喘和慢阻肺的症状和 肺功能异常,如活动后气短、喘息、 咳嗽、咳痰等。
慢阻肺气流受限
在哮喘控制良好的情况下,患者仍存 在不可逆的气流受限,符合慢阻肺的 诊断标准。
新药研发
新型抗炎药物
研发针对哮喘慢阻肺重叠综合征的特异性抗炎药物,以减轻气道 炎症和气道重塑。
新型免疫调节剂
探索新型免疫调节剂,以调节免疫失衡,降低气道高反应性。
重叠综合征-慢性阻塞性肺疾病合并睡眠呼吸暂停低通气综合征

·287·
.综述.
重叠综合征一慢性阻塞性肺疾病合并 睡眠呼吸暂停低通气综合征
何忠明 杨晶晶 韩芳
【摘要】慢性阻塞性肺疾病和睡眠呼吸暂停低通气综合征都属于常见病,两者并存称为重叠综合征, 估计40岁以上的人群中患病率为o.5%左右。本文就慢性阻塞性肺疾病和睡眠呼吸暂停低通气综合征的 关系、重叠综合征的临床表现及治疗原则作一综述。
· 288·
垦匿哩咝盘查!!!!至!旦筮!!鲞笙!塑 !!!』垦!塑i!!坚!竺!!!!!:∑!!:!!:盟!:!
COPD的定义符合目前COPD的最新诊断标准[1引。 SHHS主要研究结果如下[3]:纳入者FEV。/FVC
平均为(75.5士7.9)%,伴有气道阻塞者(n=1138, 19%)FEV。/FVC平均为(63.8士6.6)%,没有气道 阻塞者(n一4816,81%)FEV。/FVC平均为(78.3± 5.3)%,其中少部分纳入者(n=226,3.8%) FEV。/FVC<60%,呼吸紊乱指数[平均每小时呼吸 暂停指数和低通气指数(RDI)]在气道阻塞者中并 不比没有气道阻塞者高。相反,气道阻塞者的呼吸 紊乱指数低于无气道阻塞者,校正体质量指数后,两 者RDI相似。无论按RDI>10次/h或RDI> 15次/h作为诊断标准。COPD患者中SAHS的患病 率并不比没有COPD患者的普通人群高,提示 COPD与SAHS两种疾病之间并无必然联系。
DOI:lO.3760/cma.j.issn.1 673—436X.2009.05.009 基金项目:克拉玛依市科委资助项目fsK2007—21) 作者单位:834000克拉玛依市中心医院呼吸科(何忠明、杨晶 晶);100044北京大学人民医院呼吸科(韩芳)
COPD与OSA重叠综合征

9.13±12.59
4.51 (1.36,11.59)
28.86 18.63
3.51 (1.35,8.81) *
22.32* 13.97*
Am J Respir Crit Care Med 2003;167:7–14
经过BMI校正后,两组无显著性差异
近期研究:OSAHS和COPD共存 可能是巧合
• 较长时间(常数分钟)的低氧和较缓慢 的恢复可以与OSA的间歇低氧鉴别,后 者的低氧很少超过1分钟,并且往往很快 就恢复到正常水平。
COPD
OSA
COPD睡眠低氧与OSA睡眠低氧
COPD与OSAHS睡眠低氧的异同
重叠综合征的流行病学研究
• 早期研究:认为两者同时存在的可能性非常 高
– Guilleminault 等研究了26例COPD患者,发现 其中22例伴呼吸暂停(85%)(因嗜睡而在睡眠 门诊就诊患者) – Bradley 等和Chaouat 等观察了OSA患者(n = 50和265)的COPD发生率,结果发现分别为 14% 和11% (40岁以上人群)
OSAHS影响 1、Sanders等发现与单纯阻塞性肺疾病患 者相比,重叠综合征者有较高的Epworth 睡眠评分,总睡眠时间缩短,睡眠效率下 降,觉醒指数增加 2、而重叠综合征与单纯SAHS患者相比, 两者的差别并不明显 —— 提示重叠综合征睡眠质量的下降主要 受SAHS的影响,而并非气流受限的程度 影响。
• 睡眠质量下降 1、总睡眠时间缩短、睡眠效率下降、微觉 醒指数增加 2、ESS评分增加 3、打鼾、夜间憋醒
• 睡眠质量下降原因 COPD的影响: 1、许多COPD患者睡眠质量差,EEG检查 也发现睡眠质量下降的证据,尤其是重 度COPD者。 2、另一方面,轻度COPD可能不影响睡眠 质量。在上面SHHS研究中观察到1138 例不伴OSA的轻度COPD患者,睡眠较 少受到影响,睡眠结构与FEV1水平无明 显相关性。
布地奈德联合噻托溴铵治疗哮喘-慢阻肺重叠综合征的疗效

布地奈德联合噻托溴铵治疗哮喘-慢阻肺重叠综合征的疗效【摘要】布地奈德联合噻托溴铵是一种用于治疗哮喘-慢阻肺重叠综合征的药物。
它通过抑制气道炎症和平滑肌收缩,起到帮助患者呼吸更加顺畅的作用。
临床研究表明,这种联合治疗方案在改善患者的呼吸功能、减少呼吸急促症状和减少急性加重次数方面取得了良好的效果。
在安全性评估方面,布地奈德联合噻托溴铵的不良反应较轻,潜在不良反应较少。
这种治疗方案在改善哮喘-慢阻肺重叠综合综合征的症状和预防加重方面表现出良好的疗效和安全性,为今后该病种的治疗提供了有益的参考。
未来还有待更多研究来进一步验证其疗效和完善治疗方案。
【关键词】关键词:布地奈德、噻托溴铵、哮喘、慢阻肺、重叠综合征、药物作用机制、临床研究、疗效评估、安全性评估、不良反应、治疗需求、未来展望1. 引言1.1 疾病背景哮喘-慢阻肺重叠综合征(ACOS)是指患者同时具有哮喘和慢性阻塞性肺病(COPD)的特征。
哮喘是一种慢性炎症性疾病,通常表现为可逆性气道阻塞和支气管痉挛,导致呼吸困难和喘息等症状。
而COPD是一种进行性疾病,主要由吸入有害物质引起的气道炎症和气道重塑所致,导致气道壁肥厚、黏液分泌增加和气道狭窄等症状。
ACOS患者往往表现出哮喘和COPD的混合特征,病情复杂且易于误诊、漏诊。
1.2 治疗需求哮喘-慢阻肺重叠综合征是一种疾病,其发病机制复杂,病情严重且难以治愈。
目前现有的治疗方法往往难以满足患者的需求,存在一定的局限性。
寻找一种更有效的治疗方案变得尤为重要。
患有哮喘-慢阻肺重叠综合征的患者常常面临着呼吸困难、咳嗽、胸闷等症状,给他们的生活造成了极大的困扰。
目前市场上的治疗药物虽然可以缓解症状,但并不能从根本上解决问题。
患者和医生都急需一种能够更好地控制病情、提高生活质量的治疗方案。
2. 正文2.1 药物作用机制布地奈德联合噻托溴铵治疗哮喘-慢阻肺重叠综合征的药物作用机制主要是通过多种途径发挥作用。
布地奈德是一种糖皮质激素,通过激活细胞内的胺基酸受体,抑制炎症细胞的释放和活性,减轻气道炎症和水肿。
稳定期COPD、OSAHS及重叠综合征患者间呼出气一氧化氮水平差异及nCPAP治疗的影响

稳定期COPD、OSAHS及重叠综合征患者间呼出气一氧化氮水平差异及nCPAP治疗的影响张炜;孙丽丹;王利菊;李美玲【摘要】目的探讨稳定期慢性阻塞性肺疾病(COPD)、阻塞性睡眠呼吸暂停低通气综合征(OSAHS)及重叠综合征(OS)患者呼出气一氧化氮(FeNO)的水平差异,分析FeNO与多导睡眠指标的相关性及nCPAP治疗对FeNO的影响.方法收集经多导睡眠监测(PSG)、肺功能检查确诊患者71例,分为稳定期COPD组28例、OSAHS 组23例、OS组20例,并收集健康对照组25例.采用一氧化氮测定仪检测FeNO 水平,分析比较各组FeNO的差异,对FeNO水平与睡眠监测指标进行直线相关分析.经nCPAP治疗2周,观察中重度OSAHS、OS组各18例FeNO水平的变化.结果稳定期COPD、OSAHS、OS组患者FeNO水平均显著高于健康对照组(P<0.05);OS组FeNO水平显著高于OSAHS组和稳定期COPD组(P<0.05);FeNO 与AHI、血氧饱和度<90%的时间比率呈正相关,与夜间最低血氧饱和度呈负相关(P<0.05);nCPAP治疗后中重度OSAHS组、OS组FeNO水平较治疗前均显著下降(P<0.01).结论 FeNO水平增高可提示气道炎症水平较高,与病情严重程度相关,nCPAP治疗可减轻气道炎症.【期刊名称】《大连医科大学学报》【年(卷),期】2018(040)005【总页数】4页(P424-426,433)【关键词】呼出气一氧化氮;OSAHS;重叠综合征;nCPAP【作者】张炜;孙丽丹;王利菊;李美玲【作者单位】大连市友谊医院呼吸科,辽宁大连116000;大连市友谊医院呼吸科,辽宁大连116000;大连市友谊医院呼吸科,辽宁大连116000;大连市友谊医院呼吸科,辽宁大连116000【正文语种】中文【中图分类】R56慢性阻塞性肺疾病(COPD)已成为危害人类健康的呼吸系统疾病之一,据最新GOLD指南指出,COPD居全球死亡原因的第4位,而阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种常见的睡眠障碍性疾病,人群患病率也呈逐年增高趋势,也是一种潜在的致死性疾病。
D哮喘慢阻肺重叠综合征PPT课件

目录
CONTENTS
• 什么是哮喘慢阻肺重叠综合征 • 哮喘慢阻肺重叠综合征的病因 • 哮喘慢阻肺重叠综合征的治疗方法 • 哮喘慢阻肺重叠综合征的预防 • 哮喘慢阻肺重叠综合征的案例分析 • 总结与展望
01 什么是哮喘慢阻肺重叠综 合征
定义
01
哮喘慢阻肺重叠综合征是指同时 具有哮喘和慢性阻塞性肺疾病( COPD)特征的一组疾病。
患者基本信息
女性,55岁,无吸烟史,有过敏性 鼻炎和哮喘家族史。
症状表现
反复发作的喘息、胸闷、呼吸困难, 尤其在夜间和清晨加重。
诊断过程
通过肺功能检查和过敏原检测,医生 确诊为哮喘慢阻肺重叠综合征。
治疗建议
采用吸入性糖皮质激素和长效抗胆碱 能药物治疗,同时进行免疫治疗和生 活方式调整。
案例三:儿童患者
避免诱发因素
避免接触过敏原
避免剧烈运动和情绪激动
如烟雾、花粉、宠物毛发等,减少室 内外空气污染物的接触。
这些因素可能诱发哮喘和慢阻肺症状 。
避免感染
注意个人卫生,加强免疫力,预防感 冒和其他感染。
定期检查
定期进行肺功能检查
监测呼吸系统的状况,及早发现异常。
定期进行体检
检查身体状况,评估营养状况和免疫力。
肺重叠综合征的诊断标准。
治疗方法的展望
新药研发
针对哮喘慢阻肺重叠综合征的发病机制, 研发新的药物,以更有效地控制症状、改
善肺功能和提高患者的生活质量。
A 个体化治疗
根据患者的具体情况,制定个体化 的治疗方案,包括药物治疗、生活
方式调整和环境控制等。
B
C
Dபைடு நூலகம்
长期管理
重叠综合征的临床治疗

重叠综合征的临床治疗吴支喜【摘要】重叠综合征(OS)是指慢性阻塞性肺疾病(COPD)和阻塞性睡眠呼吸暂停低通气综合征(OSAHS)合并发生于同一患者。
临床表现主要包括咳嗽、咳痰、气短、夜间睡眠差、白天嗜睡及记忆力减退等,同时易伴低氧血症、肺动脉高压、肺心病等并发症,严重影响了患者的日常生活,增加死亡率。
临床中常采用抗感染、化痰止咳、解痉平喘等基本治疗,并及时处理气道梗阻,而气道通畅是改善患者病情和预后的关键。
本文对OS的流行病学、病理生理改变、临床特征及治疗进展作一综述,旨在提高OS的治疗水平。
%Overlap syndrome (OS) was the combination of chronic obstructive pulmonary disease (COPD) and obstructive sleep apnea hypopnea syndrome (OSAHS) in the same patient.The main clinical manifestations included cough, expectoration, shortness of breath, bad sleep at night, day-time sleepiness and loss of memory etc., also easily associated with hypoxemia, pulmonary hyper-tension, pulmonary heart disease, such as complications, serious impact on the patient's daily life, increase mortality.Clinical often use anti infection, cough and phlegm, relieving asthma and other basic treatment, and timely treatment of airway obstruction and airway unobstructed was the key to improve the disease condition and prognosis in patients with.This article reviewed the epidemi-ology, pathophysiology, clinical features and treatment of OS in order to improve the treatment level of OS.【期刊名称】《现代诊断与治疗》【年(卷),期】2016(027)015【总页数】5页(P2792-2796)【关键词】重叠综合征;慢性阻塞性肺疾病;阻塞性睡眠呼吸暂停低通气综合征;药物治疗;机械通气【作者】吴支喜【作者单位】江西中医药大学第二附属医院呼吸内科,江西南昌 330012【正文语种】中文【中图分类】R56慢性阻塞性肺疾病(COPD)是一种常见慢性疾病,近年来发生率呈不断上升趋势[1]。
无创呼吸机联合布地奈德福莫特罗治疗重叠综合征—OSAHS合并COPD急性加重期的疗效评估

37现代养生 2021年5月第21卷第10期临床论著无创呼吸机联合布地奈德福莫特罗治疗重叠综合征—OSAHS 合并COPD 急性加重期的疗效评估龙初文【摘要】 目的 分析无创呼吸机联合布地奈德福莫特罗治疗重叠综合征—睡眠呼吸暂停低通气综合征(OSAHS)合并慢性阻塞性肺疾病(COPD)急性加重期的治疗效果。
方法 选取2019年1月—2020年1月医院收治的90例急性加重期的重叠综合征—OSAHS 合并COPD 患者,按照组间年龄、性别均衡可比的原则分成对照组和观察组,每组各45例。
对照组仅采取布地奈德福莫特罗治疗,观察组则在对照组治疗基础上联合无创呼吸机治疗,比较两组治疗效果。
结果 观察组患者的治疗总有效率高于对照组,差异有统计学意义(P <0.05);观察组患者的肺功能指标、血气分析指标均优于对照组,差异有统计学意义(P <0.05)。
结论 对于急性加重期的重叠综合征—OSAHS 合并COPD 患者,单纯药物治疗不理想,可联合无创呼吸机治疗,疗效显著,能有效加强患者的肺功能,改善其血气分析指标,缓解呼吸困难症状。
【关键词】 无创通气;布地奈德福莫特罗;COPD;OSAHS;疗效中图分类号 R245 文献标识码 A 文章编号 1671-0223(2021)10-037-03作者单位:541199 广西桂林市临桂西城医院急诊科睡眠呼吸暂停低通气综合征(0SAHS)合并慢性阻塞性肺疾病(COPD)患者的疾病症状主要是与睡眠相关的高碳酸血症以及低血氧症,致使患者的肺动脉压升高,发生呼吸衰渴。
目前,0SAHS 合并COPD 对广大国民的健康安全造成了严重威胁,成为公众的一个重点关注问题[1]。
有关研究证实了,急性加重期0SAHS 合并COPD 患者相较于非急性加重期者,其临床症状严重程度、肺功受损程度均更加严重[2]。
本研究分析采取无创呼吸机联合布地奈德福莫特罗治疗急性加重期OSAHS 合并COPD 的临床疗效,报告如下。
