药物合成反应卤化反应
药物合成反应第1章卤化反应

2. 卤化氢对炔烃的加成: 离子型加成:与烯烃的情况类似
五、不饱和烃的硼氢化-卤解反应 硼氢化反应:硼氢化物对π 键加成的反应。 反应历程:经过烯烃的硼氢化反应,再通过卤解
反应转化成卤代饱和烃或烯烃。
1、烯烃的硼氢化-卤解反应 常用的硼氢化试剂:二硼烷(B2H6)、BH3/THF和BH3/ Me2S(TMS)等; ①烯烃的硼氢化反应
π键 :原子轨道重叠部分对键轴所在的某 一平面具有反对称性时所形成的键。
p原子轨道的角度分布剖面图:
z(或y)
+
x
-
y(或z)
注:其中+、-号不表示正、负电荷,而是表示原子轨道角度分布图形 的对称关系
若两原子成键是由p轨道重叠形成的,且形成的是σ 键,则成键图形为:
-
++ -
如果形成的是π键, 则:
3R-CH=CH2 + 1/2B2H6 → (RCH2CH2)3B ②卤解反应:用碘、溴素等将硼基置换出来,得到相
应的碘代烷或溴代烷。
2、炔烃的硼氢化-卤解反应 常用的硼氢化试剂:儿茶酚硼烷(由儿茶酚和BH3/THF 制得);
反应机理:
第二节 烃类的卤取代反应
一、 脂肪烃的卤取代反应 1. 饱和脂肪烃的卤取代反应 反应条件:高温、紫外光照或过氧化物引发 反应历程:自由基反应 烷基氢原子的活性: 叔C-H> 仲C-H > 伯 C-H
CH3
CO OH
CH2I CO
OH
O CH2OCCH3
CO OH
I2/CaO
CH3COOK
CH3OH/CaCl2
DMF
O
O
O
催眠镇静药巴比妥中间体二乙基丙二酸二乙酯的制 备:
药物合成 卤化反应

Halogenation Reaction
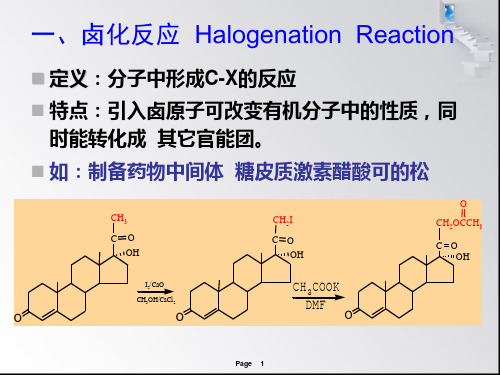
定义:有机化合物分子中引入
卤素原子(X)的反应称卤 化反应。 用途: 作为特定活性化合物 作官能团转化的中间体
如:制备药物中间体 糖皮质激素醋酸可的松
O CH3 C O OH
I2/CaO CH3OH/CaCl2
CH2 I C O OH
CH2 OCCH3 C O OH
R2
C
C O SMe2
H
H2O
Br C H R1 C OH H R2 Br C R1 C O H
R2
-消 除 (在 燥 MSO中 干 D )
第一节 不饱和烃的卤加成反应
▲三、 不饱和烃 和 【次卤酸(酯)】、【N-卤代酰胺】的反应
OAc NBS/DMSO AcOCH2 O OgluAc4 OAc Br O AcOCH2 O OgluAc4 r.t
Cl2/CH2Cl2
h
降冰片烷
Cl
外向型(exo) 70~95%
第二节 烃类的卤代反应
▲一、脂肪烃的卤取代反应
苄位、烯丙位的卤取代:
X2
h 或 他 其 引 剂 发
X
(X=Cl, Br)
O N +X O
O h N X 或 由 自 基 引 剂 发 O
第二节 烃类的卤代反应
▲一、脂肪烃的卤取代反应
C
R2
C
R4
X-OH
R1 R2
OH
R3 R4
C
X
C
H2O
R1 R2
OH
R3
C
C
X R4
HClO HBrO
Cl--OH Br--OH
第一节 不饱和烃的卤加成反应
药物合成反应资料文档

烯丙醇、叔醇等会发生重排
CH3CH CHCH2OH H+ CH3 CH CHCH2+OH2
巴豆醇
H2O
CH3 CH CH +CH2
CH3 +CH CH CH2
杂原子化合物合成设计 环状化合物合成设计
第一章 卤化反应
定义:有机化合物分子中引入 卤素原子(X)的反应称卤 化反应。
用途: 作为特定活性化合物 作官能团转化的中间体
H3C Cl
SO2NHCONH(CH2)3CH3
甲苯磺丁脲 t1/2 5.7hr
SO2NHCONH(CH2)2CH3
氯苯磺丙脲 t1/2 33hr
N Cl
OH Ph3PBr2
Br
CH3CN
60~70℃, 0.5hr
三、醚的卤置换
R O R' HX RX + R'OH
eg:
O
HX:HI, HBr, KI/H3PO4
KI/H3PO4/P2O5 ICH2CH2CH2CH2I , 3hr
1,4-二碘丁烷
四、羧酸的卤置换
O
卤化剂
O
R C OH
RCX
药物合成反应
单元反应
卤化反应 烃化反应 酰化反应 缩合反应 重排反应 氧化反应 还原反应
3学时 自学
3学时
3学时 3学时 3学时
合成设计概论 目标分子考察 3学时
药物合 反合成分析 3学时×5 成设计 选择性控制设计
合成路线评价 3学时
综合练习
4学时
反合成分析常用术语 一基团切断合成设计
反合成 二基团切断合成设计 分 析 非逻辑切断合成设计
C Ph OTms
药物合成反应-卤化反应
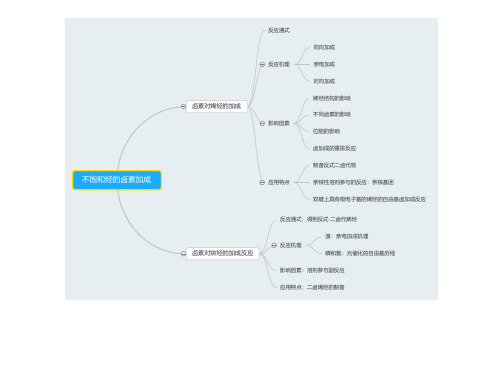
通式
烯醇酯的卤化反应
机理
应用特点
通式
烯醇硅烷醚的卤化反应
机理 应用特点
区域性卤化 制备α卤代醛
反应通式
烯胺的卤化反应
反应机理:卤化剂对烯胺双键的亲电加成
应用特点:选择性的α卤代反应
反应通式
机理:亲电取代机理
酰卤、酸酐、腈、丙二酸及其酯的α卤取代反应
应用
饱和脂肪酸酸的α卤取代反应
羧酸的α卤取代反应
反应通式
机理:亲核取代反应
影响因素:醇的结构,卤化剂的影响
将醇转化为响应的卤化物 Vilsmeier-Haack试剂
应用特点
反应通式
机理:醇和有机磷化物生成酯或加成物,卤素负离子SN2反应,构型反转
将光学活性的仲醇转化成构型反转的卤代烃
用于酸性条件下不稳定的化合物的卤化
适用于易重排醇的卤化 适用于甾体醇卤置换
醇的卤置换 酚的卤置换 醚的卤置换
醇、酚、醚的卤置换反应
羧羟基的卤置换 羧酸的脱羧卤置换反应
羧酸的卤置换反应
卤化物的卤素交换 磺酸酯的卤置换反应 芳香重氮盐化物的卤置换反应
其他官能团的卤置换
卤化反应
卤化反应机理
电子反应机理 自由基反应机理
亲电反应 亲核反应:亲核取代
自由基加成 自由基取代
不饱和烃的卤加成反应
制备碘代烃 制备氟代烃
磺酸酯的卤置换反应
反应通式
机理:亲核取代,卤化剂为亲核试剂
应用特点
醇的间接卤置换 磺酰化-卤置换反应常比卤素置换更有效
芳香重氮盐化合物的卤置换反应
通式:可将卤素原子引入到芳烃的位置上 机理:自由基反应 应用特点:芳香重氮盐化合物的氯置换和溴置换反应 芳香重氮盐化合物的碘置换反应 芳香重氮盐化合物的氟置换反应:希曼反应
药物合成反应 卤化反应

Halogenation Reaction
卤化反应
❖ 一、卤取代反应
❖ 1、不饱和烃的卤取代反应 ❖ 2、芳烃的卤取代反应 ❖ 3、羰基化合物的卤取代反应(烯醇和烯胺衍生物)
❖ 二、卤加成反应
❖ 1、不饱和烃的卤加成反应 ❖ 2、不饱和烃和次卤酸(酯)、N-卤代酰胺的反应 ❖ 3、不饱和烃的硼氢化-卤解反应
❖ 芳杂环的苄位也可发生卤取代反应。
三、芳烃的卤取代反应
❖ 反应机理:亲电取代
or其它 卤化剂
δ—络合物
卤化剂:X2、N-卤代酰胺、HOX、t-BuOCl、Cl2O、 以及XX’等。
❖ 常用lewis酸做催化剂:
AlCl3 SbCl5 FeCl3 FeBr3 SnCl4 TiCl4 ZnCl2
难点
❖ 1、各类卤化剂的特点和应用,新型的卤化试 剂;
❖ 2、不饱和烃的硼氢化-卤解反应的立体化学 问题;
❖ 3、羰基化合物α-位的卤化,烯胺的卤化反应; ❖ 4、卤素之间的置换反应。
卤化反应
❖ 指在有机化合物分子中建立碳-卤键的反应。 ❖ 目的: ❖ 1、制备具不同生理活性的含卤素有机药物,如麻
也可直接用Fe, Al, P, I2等
卤化剂的活性次序: Cl2>BrCl>Br2>ICl>I2
X2 + MXn
X + MXn+1
I2 + Br2
I2Br + Br
氯取代和溴取代反应
❖ 芳环上取代基的电子效应和卤素的定位效应 规律遵守一般的芳烃亲电取代反应,但选择 不同的卤化剂及其用量和反应条件,可影响 单或多卤取代物以及位置异构体的比例。
醉药氟烷、抗菌药诺氟沙星、抗肿瘤药氟尿嘧啶、 氮芥、抗精神病药氯丙嗪、抗抑郁药氟西汀、抗过 敏药扑尔敏、抗真菌药氟康唑、非甾体抗炎药双氯 灭痛等等。
卤化反应药物合成反应课件

卤化反应的历程与机理
历程
卤化反应通常包括三个步骤:亲核试剂或亲电试剂接近底物、形成碳卤键、离 去基团离去。
机理
根据不同的卤化反应类型,其机理也有所不同。例如,亲核卤化反应通常是通 过SN2(双分子亲核取代)机理进行的,而亲电卤化反应则通常是通过SE2(单 分子亲电取代)机理进行的。
02 卤化反应在药物合成中的 应用
过渡金属催化的卤化
研究过渡金属催化剂在卤化反应中的作用机制和应用 范围。
新型卤化剂的开发
探索新型、高效的卤化剂,以替代传统卤化剂,降低 环境影响。
THANKS FOR WATCHING
感谢您的观看
杂环化合物的卤化
杂环化合物的卤化是指将杂环化合物中的氢原子被卤素取代的反应。在药物合成 中,杂环化合物的卤化常用于制备杂环族卤代烃,作为合成其他复杂化合物的中 间体。
杂环化合物的卤化通常采用强酸或强氧化剂作为催化剂,例如硫酸、硝酸等。在 卤化反应中,杂环化合物可以与卤素发生亲电取代反应,生成杂环族卤代烃。
03 卤化反应的工业应用
卤化反应的工业化过程
原料准备
选择合适的原料,确保 原料的纯度和供应稳定
性。
反应条件控制
调节温度、压力、浓度 等反应条件,确保反应
顺利进行。
产物分离与纯化
采用蒸馏、萃取、结晶 等方法对产物进行分离 和纯化,得到高纯度的
卤化物。
废物处理与环保
对产生的废物进行妥善 处理,确保符合环保要
卤化反应的未来发展方向
开发高效催化剂
通过研究新的催化体系, 提高卤化反应的活性和选 择性。
绿色化学方向
探索环境友好的反应条件 和替代品,降低卤化反应 的环境影响。
计算机辅助设计
药物合成反应 第二章 卤化反应

醇羟基的置 换反应
一、卤素对不饱烃的加成反应
烯烃和炔烃中的双键和叁键,存在有不稳定的π键, 它们容易被亲电试剂进攻而发生断裂,进而发生加成反应 。药物原料分子中大多含有双键,利用药物原料分子中的 双键与亲电型卤化剂的加成是药物原料分子卤化的常用方 法,加成后得到相应的邻二卤化物。炔烃类含叁键的化合 物,在与卤素的加成中,叁键的反应活性比双键小得多, 应用远没有烯烃广泛。在药物合成技术中主要学习双键的 有关反应。
(三)常用卤化试剂
类别
分子式 Cl2
特
点
应用范围
常 见 卤 化 试 剂
Br2 HCl HBr HClO HBrO
活性高,易进行 ,但需注意反应的特 殊条件。
与不饱和键加成 • 在芳环上、芳环侧链上和羰 基α 位上取代
价廉易得,应用 广泛,反应条件要控 制。
不稳定,需新制 ;条件温和,但有副 产物。
CH2
CH2 + Cl2 + H2O
60
ClCH2CH2OH + HCl
用次溴酸合成氯霉素中间体(9):
H CH CH CH2OH
Br2/H2O
Br C CH2OH
C
OH H (9)
又如用N-卤化酰胺合成α–卤代醇:
O H C C + RC N Br
H2O
Br C C OH
三、卤素与芳香烃的反应பைடு நூலகம்
CCl4 60
杂环中的五员环(呋喃、吡咯、噻吩等),环中碳的 电子密度比苯大,均为多电子杂环,亲电取代活性大于苯 ,卤代要容易进行些; 六员杂环(吡啶、吡喃、吡嗪等),环中碳的电子密 度比苯小,均为缺电子杂环,使位碳上的电子密度减小, 亲电取代活性小于苯,卤代要难进行些。
药物合成反应(08级)(卤化)

CH3 CH2 CH2 CH2Br (亲核置换)
三、卤化反应的应用
1、制备具有不同生理活性的含卤素药物。
2、在官能团转换中,卤化物常常是重要的中间体。
3、为提高反应的选择性,卤原子可作为保护基、
阻断基等。
第一节 卤化反应机理
一、电子反应机理(P1-3)
1、亲电反应
(1)亲电加成 ① 桥型卤正离子或离子对的过渡态形式 ② 三分子协同亲电加成 (2)亲电取代
CH3(CH2)4 CH
CH2
NBA/HF/Et 2O
CH3(CH2)4 CHCH2Br F
四、卤化氢对不饱和烃的加成反应 1、卤化氢对烯烃的加成反应 (1)反应通式 生成卤素取代的饱和烃。反应时可采用卤化氢 气体或其饱和有机溶剂,或用浓的卤化氢水溶液, 或用无机碘化物/磷酸等方法。
H C R2 C X R4
(3)卤化试剂(P16)
常用卤化剂为卤素、 N-卤代酰胺(NBS和
NCS)、次卤酸酯等,其中N-卤代酰胺最好,
无芳核取代和羰基α位取代(亲电取代)等副反
应,特别适用于苄位和烯丙位的卤取代。 (4)溶剂(P16) 常用惰性溶剂,如CCl4、CHCl3、苯等。 (5)作用物结构(P13-15)
主要取决于中间体自由基的稳定性。
① 芳烃的卤取代反应
② 羰基α位的卤取代反应
③ 炔烃的卤取代反应
2、亲核反应:亲核取代
二、自由基反应机理(P3-4)
1、自由基加成
2、自由基取代
第二节 不饱和烃的卤加成反应
一、不饱和烃和卤素的加成反应 1、卤素对烯烃的加成反应
(1)反应通式
生成邻二卤化物。其中,氯化和溴化最常用,
氟化和碘化的应用受到限制(P5)。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
药物合成反应习题 第一章 卤化反应ppt课件

C r O /P y /C H C l 3 2 2
L i A l H / E t O 4 2
O H O H
C l C H C H C H ( C H ) C H O H 2 2 2 4 2 C l C H C H C H ( C H ) C O O C H 2 2 2 4 2 5
N a B H / E t O H 4
N R X N N+ N N X N NR N
环 六 亚 甲 基 四 胺 ( 乌 洛 托 品 )
四、药物合成反应课程的学习方法
3. 了解一些新试剂,新反应的特点、应用 范围,并与类似反应进行比较. 4.课后要做练习; 5.重视《药物合成实验》提高自己的动手 能力。
五.药物合成反应授课的要求和安排
H O 2
N H 2
B r
B r
(3)阻断基
• 阻断基的引入使反应物分子中某一活性部位被 封闭,让分子中其他活性低的部位发生反应并 顺利引入所需的基团,等目的达到后再除去阻 断基。
N H 2
( C H C O ) O 3 2
N H C O C H 3
H S O 9 8 % 2 4
N H C O C H 3
• 课堂讲授为主、自学为辅。课堂上的重 点突出,讲解主要内容及难点,因课时 有限,有部分内容要求同学自学。 • 课前要预习.
讨论与练习
1.学好本课程对从事药物及其中间体合 成工作有何意义? 2.药物合成反应有哪些特点?应如何学 习和掌握? 3.什么是导向基?具体包括哪些类型? 举例说明。 4.查阅报道药物合成领域的新技术及发 展动态资料?
药物合成反应习 题 第一章 卤化 反应
绪论
一、药物合成课程的目的 二、药物合成的发展趋势与新技术 三、药物合成反应课程教授内容 四、药物合成反应课程的学习方法 五、药物合成反应授课的要求和安排
药物合成反应知识点总结

药物合成反应知识点总结
药物合成反应是化学制药领域中的重要知识点,以下是一些可能有用的药物合成反应知识点总结:
1. 卤化反应:卤化反应是药物合成中常用的反应之一,主要用于将药物分子中的醇或酮羟基转化为卤代烃。
卤代烃的优点是具有广泛的药物合成应用,可以用于制备多种药物分子。
2. 烃化反应:烃化反应是将药物分子中的羟基或酮基转化为烃基的反应。
烃化反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
3. 缩合反应:缩合反应是药物合成中常用的反应之一,主要用于将两个或多个分子缩合成为一个分子。
缩合反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
4. 氧化反应:氧化反应是药物合成中常用的反应之一,主要用于将药物分子中的不饱和键氧化为饱和键。
氧化反应可以用于制备多种药物分子,例如杀虫剂、抗生素等。
5. 还原反应:还原反应是药物合成中常用的反应之一,主要用于将药物分子中的氧化剂还原为还原剂。
还原反应可以用于制备多种药物分子,例如维生素、甾体激素等。
6. 重排反应:重排反应是药物合成中常用的反应之一,主要用于将药物分子中的官能团进行重排。
重排反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
7. 官能团保护反应:官能团保护反应是药物合成中常用的反应
之一,主要用于保护药物分子中的某些官能团,避免在合成过程中受到破坏。
官能团保护反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
药物合成反应是化学制药领域中的重要知识点,掌握这些反应可以有助于更好地理解和设计药物合成路线。
药物合成反应_第一章___卤化反应

R1 R2
R3 + ROX R4
Nu
R1 R2
R3 R4 Nu
(2)反应机理
R1 R2 X R3 X R4 OH H2O R1 R2 OH R3 X R4 OH R1 R2 X OH R3 R4
• (3)应用特点 • 次卤酸水溶液,制备卤代醇
Cl2/NaOH/H2O70~73% HgCl2/15~20 C
良好的药物合成反应须具备的特点: (1) 反应条件温和,操作简便,收率高;
(2) 具有较高的化学、位置和立体选择性;
(3) 导向基的应用;
(4)适应性强、适用面广,实用性好;
(5) 原铺材料价廉易得,有丰富的来源;
(6) 不产生公害,不污染环境。
二、药物合成反应的分类方法及所用原料
(一)药物合成反应的分类方法 1、按新键的形成分类:碳 -氢键、碳-卤键、碳-氧键、 碳-氮键等形成反应 2、按引入的原子、基团或采用的试剂分类: (1)按引入的原子、基团不同可分为:卤化、磺化 、消化、重氮化、酰化、烃化等反应。 ( 2 )按采用的试剂和原料不同分类:氧化、还原、 水解、醇解、氨解、缩合、环和等反应 3、按反应机理分类:亲电取代反应、亲电加成反应、 亲核取代反应、亲核加成反应、游离基型反应等
(三)需用的原辅材料多,且有多种易燃、易爆、 有毒以及具有刺激性和腐蚀性等物质。药物的化学结构 一般都较为复杂,需经过多步化学反应才能得到产品; (四)质量要求严格 ,符合GMP要求;
(五)批量小,需用急。
四、理论联系实际,学好药物合成反应
有机合成药物归根结蒂是有机化合物,可以采用 不同的原料,由不同的途径加以合成。 掌握药物合成 反应的基本原理和知识非常重要,而药物合成实验操 作技能,更是必不可少的基本功之一。 在学习中,既立足于各药物合成反应的通性和一 般规律,又注重反应的特性、具体反应条件、应用和 限制等;既重视合成实验操作技能的基本训练,又要 认真钻研一些合成实例;同时,还迫切需要我们不断 培养自己查阅科学技术文献的能力。
药物合成反应-2卤化反应

直接法通常在高温或光照条件下进行,卤素作为亲电试剂与 有机物分子中的碳-氢键发生反应,生成2卤化物。这种方法 需要使用大量的卤素,且反应条件较为剧烈,因此具有一定 的局限性。
取代法
总结词
取代法是一种通过卤素取代有机物分子中特定基团的合成方法。
详细描述
在取代法中,卤素作为亲电试剂攻击有机物分子中的特定基团,如羟基、氨基等,将其取代为卤化物。这种方法 具有较高的选择性,可以合成结构较为复杂的2卤化物。
2卤化反应在药物合成中的重要性
合成关键中间体
简化合成路线
2卤化反应可以合成多种药物的关键 中间体,为后续的药物合成提供必要 的物质基础。
在某些药物合成中,2卤化反应可以 作为关键步骤,简化整体的合成路线, 提高合成效率。
结构多样性
通过选择不同的起始原料和反应条件, 2卤化反应可以实现多种类型的结构 转化,为药物分子设计提供更多可能 性。
详细描述
在抗生素的合成过程中,2卤化反应常被用于合成具有特定结构的中间体或活性物质。 例如,通过2卤化反应可以将某些烯醇类化合物转化为具有抗菌活性的卤代酮或卤代酸。 这些卤代酮或卤代酸化合物可以作为先导化合物,进一步优化和改良以获得具有更高活
性和更低毒性的新型抗生素。
在抗癌药物合成中的应用
总结词
2卤化反应在抗癌药物合成中具有重要作 用,能够为药物分子的设计和合成提供 关键的中间体或活性物质。
2卤化反应的类型与机理
类型
常见的2卤化反应包括芳香族2卤化、脂肪族2卤化、羟基2卤化等。
机理
不同类型的2卤化反应具有不同的反应机理,如亲电取代、亲核取代等。了解反 应机理有助于更好地选择合适的反应条件和催化剂,提高反应效率和选择性。
药物合成中常见反应
丁卡因药效为普鲁卡因的10倍
Page 17
氧原子上的烃化反应
一) 醇的O-烃化 1 卤代烷为烃化剂 2 磺酸酯 3 环氧乙烷类作烃化剂 4 烯烃作为烃化剂 5 醇作为烃化剂 6 其它烃化剂
二 )酚的O-烃化 1 烃化剂 2 多元酚的选择性烃化
Page 18
1 、以卤代烷为烃化剂:醇在碱的条件下与 卤代烷生成醚
Ar-COOH
合成芳醛
CH3
4Br2/光
CH3
CHBr2
水解
CHBr2
CHO CHO
Page 9
芳烃卤代反应
CH3
+
Cl2/Fe 2mol
Br2/Fe
CH3
CH3
Cl +
CH3
Cl
Cl
Cl
CH3
CH3
Br
+
Br
Page 10
芳烃卤代反应
OH
OH
H2O Br
Br
3Br2 Br
OH
H2O 2Br2
OH Br
Br
OH
OH
Br
Br
2Br2/Bu-NH2 -70°C
OH
OH
1molBr2/CS2
0 °C
Br
Page 11
芳烃卤代反应
OH
OH
Br2/CS2 CH3
CH3 Br
OH
OH
Br Br2
CH3
CH3
Page 12
二、烃化反应 Hydrocarbylation Reaction
定义:有机物分子中C、 N、 O被烃基取代的反应
ph C
C-CH3
Br2 LiBr
药物合成反应-第一章-卤化反应讲课讲稿

E tOO
t-B u O C l/R O H
C l R O H
C l
E tOO
O R
E tOO
与 次 卤 酸 酯 的 加 成
3
反应机理: N-卤代酰胺只提供卤正离子,环状卤桥正离子需要靠溶剂去进攻以完成加成。
应用特点
常见的N-卤代酰胺
O
O
O H3C C NHBr
(NBA)
O H3C C NHCl
卤 素
对向加成比例
对
碳正离子越稳定,环状卤桥正离子的比重
Br
烯
越低,对向加成相对越低;
烃
Br Br
的
溴的极化能力比氯强,更容易形成环状卤桥正离子,对向加成更多;
加
无位阻时,环状卤桥上下朝向概率相
Br Br
成
同,加成产生外消旋体混合产物。有 位阻时,依位阻来确定三元环朝向;
Br Br
1
次要反应机理:自由基加成
实际上是自身酸根负离子替代了
卤素负离子完成对环状卤桥正离
子的进攻,最终完成加成。
应用特点
O H X2/K I/N aH C O 3 O H 2O /r.t.
可制造五~六元环状内酯,进一步还可还原为半缩醛。
X O
O
X
O O
X 2 /K I/N a H C O 3
XD IB A H
X
H 2 O /r .t . C H 2 C O O H
OO
- 7 2 ℃H OO
不 饱 和 羧 酸 的 卤 内 酯 化
2
反应机理:与卤素加成类似
δ+δXOH
反应条件 次卤酸很不稳定,需现制现用。可用 氯气或溴与中性或含汞盐的碱性水溶 液反应而得到。
药物合成反应第一章卤化反应-PPT课件

反应机理
在亲电取代卤化反应中,卤 素离子首先与芳香环上的电 子云密度较高的区域结合, 形成正碳离子中间体。随后 ,正碳离子中间体发生重排 和消除质子,最终形成卤代 芳香烃。
影响因素
亲电取代卤化的反应速度和 选择性受多种因素的影响, 包括底物结构、反应条件( 如温度、催化剂、溶剂等) 、卤素原子的性质等。
药物合成反应第一章卤化反应ppt课件
目录
• 卤化反应简介 • 亲电取代卤化 • 亲核取代卤化 • 自由基卤化 • 其他卤化方式
01
卤化反应简介
卤化反应的定义
卤化反应
在有机化学中,卤化反应通常指 的是将氢原子替换为卤素(如氟 、氯、溴、碘)的反应。
卤化反应的分类
根据卤素和氢原子的取代位置, 卤化反应可以分为芳香族取代、 脂肪族取代和乙烯基取代等类型 。
非芳香族化合物的亲电取代卤化
01
非芳香族化合物的亲电取代卤化
对于非芳香族化合物,亲电取代卤化反应通常发生在具有电子富集基团
的碳-氢键上。这些基团可以是醇、醚、硫醇等。
02 03
反应机理
在非芳香族化合物的亲电取代卤化反应中,卤素离子首先与具有电子富 集基团的碳-氢键结合,形成正碳离子中间体。随后,正碳离子中间体 发生重排和消除质子,最终形成卤代烃。
HI>HBr>HCl。
溶剂和酸碱度
选择合适的溶剂和调整酸碱度 可以促进或抑制亲核取代卤化
的反应。
温度和压力
温度和压力也是影响亲核取代 卤化反应的重要因素。
04
自由基卤化
芳香族化合物的自由基卤化
总结词
芳香族化合物的自由基卤化是卤化反应的一种重要类型,主 要通过卤素与芳香族化合物发生自由基取代反应来实现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
和影响因素 5 芳香环的卤置换反应的卤化剂的种类、反应历程和影响因素 6 醛酮羰基α-位的卤置换反应的反应历程及其影响因素 7 用于醇酚羟基的卤置换反应的卤化剂的种类、反应历程及影
响因素 8 用于羧酸的卤置换反应的卤化剂种类、特点及使用条件
授课人:孙斌
课程简介 Organic Reaction of
Drugs Synthesis
➢本课程共48学时。 ➢主要介绍各类基本有机合成反应及其在
药物合成中的应用。
教材及参考书
• 教材:药物合成反应,第三版 闻韧主编, 化学工业出版社。
• 参考书:药物合成反应,张胜建编,化学工 业出版社 2010.
次卤酸及其酯对不饱和烃的加成反应 N-卤代酰胺对不饱和烃的加成反应 卤化氢对不饱和烃的加成反应
一、 卤素对烯烃的加成反应
烯烃和卤素加成,得到1,2-二卤代物。
CC X2
X CC
X
F> Cl> Br> I RF<RCl<RBr<RI
❖氟与烯烃的加成在有机合成上无实用意义(副反应多)。 ❖碘与烯烃的反应不容易发生,应用亦很少。 ❖氯、溴与烯烃的加成是精细化工领域普遍应用的单元反 应技术之一,我们将重点介绍。
过多种途径发挥作用,其中最主要的作用方 式是作为胸苷酸合成酶抑制剂,阻断DNA复 制的必需原料——胸腺嘧啶的合成
溴苯那敏(Brompheniramine)是一种 用于过敏症状的药物,属于第一代组 胺H1受体拮抗剂(又称抗组织胺药)
溴苯那敏(Brompheniramine)
学习重点
1 不饱和烃与卤素加成反应的历程 2 次卤酸(酯)和N-卤代酰胺对于不饱和烃反应的历程及影响
卤化反应的类型
♦不饱和烃的卤加成
♦饱和烷烃、芳香环上的卤取代
Fe +Cl2
Cl + H Cl
♦烯丙位、苄位上的卤置换
CH2
X H C C H C+ X 2 C C H C X 2 = C l2 ,B r 2
♦醛酮羰基α-位的卤置换
HCCCH+X 2 XCCCHX 2= C l2,B r2
O
O
♦羧酸羟基的卤置换:形成酰卤、卤代烃
➢药物合成反应学习指导,曾步兵等编,华东 理工大学出版社 2013
教材特点
1.按照反应类型编排,主要介绍在药物合 成中最常见的反应类型;
2. 信息量大; 3.叙述性材料多,结论性材料相对较少; 4. 缩写多; 5. 实用性强(附有参考文献,供大家深入
学习参考。)
现实意义
1、与就业关系密切 (面试、实习、研发工作等必备) 2、考研 (在有机化学中占的比重很大)
CC
H
COOC2H5
Br2 / CCl4
Br
C6H5
C
H C
H Br COOC2H5
C6H5 H CC
H Br COOC2H5
C6H5
Br H CC
H Br COOC2H5
主要产物
♦对于过渡态(2): 卤负离子进攻开放式的碳正离子,得到相当量的顺式加 成产物。
R1 R3
CC
R2
X R4
热稳定性、光稳定性都很差
1. 卤素与烯烃的亲电加成反应(掌握)
(1)反应历程: 第一步:卤正离子向π 键进攻,形成三员环卤正离子 或开放式碳正离子的过渡态。
R1 R3
R2
R4
δ +δ XX
R1 R3 CC
R2 X R4
(1)
R1 R3
CC
R2
X R4
(2)
♦第二步:
对于过渡态(1): 卤负离子从环状卤正离子的背面向碳原子做亲核进攻, 得到一对外消旋体的反式加成产物。
卤化氢(HX):HCl、HBr
第一节 不饱和烃的卤加成反应 p4
♦学习内容: 卤素、次卤酸(酯)、N-卤代酰胺、卤化氢 对不饱和键的加成反应
♦基本要求: 掌握以上卤化剂对不饱和键的加成反应的机理、
反应条件与产物之间的关系以及应用实例。
Contents
卤素对不饱和烃的加成反应
不饱和羧酸的卤内酯化反应
卤化反应
♦定义:有机化合物分子中引入卤素原子(X)的反应称卤化 反应
♦用途: 制备特定活性化合物 制备官能团转化的中间体 引入卤素原子作为保护基、阻断基等
卤化反应在有机合成中的用途:
1.制备含卤素的有机药物
H NHCOCHCl2
O
F
Hale Waihona Puke COOHH2NC C CH2OH
OH H
NH
N
氯霉素
诺氟沙星 C2H5
机理:亲电加成 溶媒:CH2Cl2 CHCl3 CCl4 CS2
F2
♦ F2是卤素中最活泼的元素,与烯烃的反应非常剧烈, 放出大量的热,易发生爆炸。常伴随取代、聚合等副 反应,难以得到单纯的加成产物。因此,在合成上, 烯烃的氟加成应用价值很小。 ♦ 由于C-F键比C-H键还稳定,氟化物不宜作为有机合 成的中间体。
♦含氟药物:引入氟原子的方法:卤素-卤素置换反应
I2
♦光引发下的自由基反应 碘与烯烃的反应不容易发生。(原因:C-I键不稳定,碘加成 反应是一个可逆过程。
H 3CCCC H 3 I2,hν HH
I
H H hν
CC H 3C I C H 3
r.t.
(~100% )
H 3CCCC H 3 HH (>90% )
R1 R3 CC
R2 X R4
δX
X R1 CC R3 R2 XR4
X R1 CC R3 R2 X R4
(1)
注:卤负离子究竟从三员环背面进攻哪一个碳原子,
取决于形成碳正离子的稳定性。
碳正离子的稳定性:叔>仲>伯
连有烷基、烷氧基、苯基等给电子基团的烯键
碳原子是卤负离子优先进攻的位置。
例1.
C6H5 H
反应机理 p1-4
♦亲电加成---大多数不饱和烃的卤加成反应 ♦亲电取代---卤取代反应 ♦亲核取代---卤置换反应 ♦自由基反应---某些不饱和烃的卤加成反应
♦常用的卤化剂(提供卤素正离子)P1 卤素(X2):Cl2、Br2
次卤酸(HOX):HOCl、HOBr
N-卤代酰胺:
如 N-溴(氯)代乙酰胺( NBA,NCA) N-溴(氯)代丁二酰亚胺(NBS,NCS)
2.卤化物是官能团转化中一类重要的中间体。药物中间体
糖皮质激素醋酸可的松
CH3
CO OH
CH2I CO
OH
O CH2OCCH3
CO OH
O
I2/CaO CH 3OH /CaCl2
O
CH3COOK DMF O
3.将卤素原子作为保护基、阻断基,用于提高反应的选择性
5-氟尿嘧啶
一种嘧啶类似物,主要用于治疗肿瘤。可通
