初三化学方程式汇总默写版
九年级化学知识点化学方程式复习默写

化学方程式是化学反应过程的简化和符号化表示。
默写化学方程式可以帮助巩固化学知识,提高对化学反应的理解和记忆。
以下是一些常见的九年级化学知识点的化学方程式,供参考:1.金属与非金属的单质反应:-钠与氯化铜反应:2Na+CuCl2->2NaCl+Cu-铁与硫反应:Fe+S->FeS2.金属活动性序列和金属的置换反应:-镁与盐酸反应:Mg+2HCl->MgCl2+H2-铜与硫酸反应:Cu+H2SO4->CuSO4+H23.酸与碱的中和反应:-盐酸与氢氧化钠反应:HCl+NaOH->NaCl+H2O-硫酸与氢氧化钡反应:H2SO4+Ba(OH)2->BaSO4+2H2O4.金属碱式氧化物与非金属酸的中和反应:-氢氧化钠与盐酸反应:NaOH+HCl->NaCl+H2O-氢氧化铝与硫酸反应:Al(OH)3+H2SO4->Al2(SO4)3+3H2O5.金属碳酸盐与酸的反应:-碳酸钠与盐酸反应:Na2CO3+2HCl->2NaCl+H2O+CO2-碳酸镁与硫酸反应:MgCO3+H2SO4->MgSO4+H2O+CO26.金属氢氧化物与酸的反应:-氢氧化钠与盐酸反应:2NaOH+HCl->NaCl+2H2O-氢氧化铜与硫酸反应:Cu(OH)2+H2SO4->CuSO4+2H2O7.钙、镁与水的反应:-钙与水反应:Ca+2H2O->Ca(OH)2+H2-镁与水反应:Mg+2H2O->Mg(OH)2+H28.酸与金属碱的反应:-醋酸与氢氧化钠反应:CH3COOH+NaOH->CH3COONa+H2O-磷酸与氢氧化镁反应:H3PO4+Mg(OH)2->Mg3(PO4)2+2H2O9.氯水与亚硫酸钠的反应:Cl2+2Na2SO3+H2O->2NaHSO4+2NaCl10.电解质溶液的电解反应:-铜电解:Cu2++2e-->Cu-氯电解:2Cl-->Cl2+2e-以上只是一些九年级化学知识点的化学方程式示例,还有很多其他化学方程式需要掌握和复习。
初中化学方程式默写

化学方程式大全一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:11.甲烷在空气中燃烧:12.酒精在空气中燃烧:二.几个分解反应:13.水在直流电的作用下分解:14.加热碱式碳酸铜:15.加热氯酸钾(有少量的二氧化锰):16.加热高锰酸钾:17.碳酸不稳定而分解:18.高温煅烧石灰石:三.几个氧化还原反应:19.氢气还原氧化铜:20.木炭还原氧化铜:21.焦炭还原氧化铁:22.焦炭还原四氧化三铁:23.一氧化碳还原氧化铜:24.一氧化碳还原氧化铁:25.一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸-------- 盐+氢气(置换反应)26.锌和稀硫酸27.铁和稀硫酸28.镁和稀硫酸29.铝和稀硫酸30.锌和稀盐酸31.铁和稀盐酸32.镁和稀盐酸33.铝和稀盐酸(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34.铁和硫酸铜溶液反应:35.锌和硫酸铜溶液反应:36.铜和硝酸汞溶液反应:(3)碱性氧化物+酸-------- 盐+水37.氧化铁和稀盐酸反应:38.氧化铁和稀硫酸反应:39.氧化铜和稀盐酸反应:40.氧化铜和稀硫酸反应:41.氧化镁和稀硫酸反应:42.氧化钙和稀盐酸反应:(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:44.苛性钠吸收二氧化硫气体:45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:(5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:(6)酸+ 盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应:63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:(8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:。
九年级化学方程式默写

九年级化学方程式默写篇一:初中化学方程式大全默写初中化学方程式化合反应1.镁在空气中燃烧2、铁在氧气中燃烧:3.铝在空气中的燃烧:4、氢气在空气中燃烧:5.红磷在空气中的燃烧:6、硫粉在空气中燃烧:7.碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧9.二氧化碳通过热碳层:10、一氧化碳在氧气中燃烧:11.二氧化碳与水的反应(二氧化碳变成紫色石蕊试液):12、生石灰溶于水:13.无水硫酸铜作为干燥剂:14、钠在氯气中燃烧:分解反应15、实验室用双氧水制氧气:16.高锰酸钾加热:17、水在直流电的作用下分解:18.不稳定碳酸导致的分解:19、高温煅烧石灰石(二氧化碳工业制法):置换反应20、铁和硫酸铜溶液反应:21.锌和稀硫酸之间的反应(实验室制氢):22、镁和稀盐酸反应:23.氧化铜的氢还原:24、木炭还原氧化铜:25.水蒸气通过热碳层:26、焦炭还原氧化铁:其他27.氢氧化钠溶液与硫酸铜溶液的反应:28、甲烷在空气中燃烧:29.酒精在空气中燃烧:32、二氧化碳通过澄清石灰水(检验二氧化碳):33.氢氧化钠和二氧化碳之间的反应(去除二氧化碳):34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):35.碳酸钠与浓盐酸的反应(泡沫灭火器原理)一.物质与氧气的反应:(1)单质与氧的反应:1.镁在空气中燃烧:2.铁在氧气中燃烧:3.铜在空气中受热:4.铝在空气中的燃烧:5.氢气中空气中燃烧:6.红磷在空气中的燃烧:7.硫粉在空气中燃烧:8.碳在氧气中充分燃烧:9.碳在氧气中不充分燃烧:(2)化合物与氧的反应:10.一氧化碳在氧气中燃烧:11.甲烷在空气中的燃烧:12.酒精在空气中燃烧:二、几个分解反应:13.水在直流电的作用下分解:14.加热碳酸铜基:15.加热氯酸钾(有少量的二氧化锰):16.高锰酸钾加热:17.碳酸不稳定而分解:18.高温煅烧石灰石:三.几个氧化还原反应:19.氧化铜的氢还原:20.木炭还原氧化铜:21.焦炭还原氧化铁:22.焦炭还原四氧化三铁:25.通过一氧化碳还原Fe3O4:四.单质、氧化物、酸、碱、盐的相互关系(1)金属元素+酸-盐+氢(置换反应)26.锌和稀硫酸27.铁和稀硫酸28.镁和稀硫酸29.铝和稀硫酸30.锌和稀盐酸31.铁和稀盐酸32.镁和稀盐酸33.铝和稀盐酸⑵金属单质+盐(溶液)-------另一种金属+另一种盐34.铁和硫酸铜溶液之间的反应:35.锌和硫酸铜溶液反应:36.硝酸汞溶液和硝酸铜溶液之间的反应:⑶碱性氧化物+酸--------盐+水37.氧化铁与稀盐酸的反应:38.氧化铁和稀硫酸反应:39.氧化铜与稀盐酸的反应:40.氧化铜和稀硫酸反应:41.氧化镁与稀硫酸的反应:42.氧化钙和稀盐酸反应:(4)酸氧化物+碱-盐+水43.苛性钠暴露在空气中变质44.烧碱吸收二氧化硫气体45.苛性钠吸收三氧化硫气体:46.熟石灰在空气中变质:47.消石灰吸收二氧化硫:(5)酸+碱-盐+水48.盐酸和烧碱起反应:49.盐酸和氢氧化钾的反应:50.盐酸和氢氧化铜反应:51.盐酸和氢氧化钙的反应:52.盐酸和氢氧化铁反应:53.用于治疗胃酸过多症的氢氧化铝:54.硫酸和烧碱反应:55.硫酸和氢氧化钾的反应:56.硫酸和氢氧化铜反应:57.硫酸和氢氧化铁的反应:58.硝酸和烧碱反应:(6)酸+盐-另一种酸+另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸的反应:61.碳酸镁与稀盐酸反应:62.盐酸与硝酸银溶液的反应63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液的反应:⑺碱+盐--------另一种碱+另一种盐65.氢氧化钠和硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠和氯化镁:68.氢氧化钠与氯化铜:69.氢氧化钙和碳酸钠:⑻盐+盐-----两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五、其他反应:72.二氧化碳溶解于水:73.溶解在水中的生石灰:74.氧化钠溶于水:75.溶解在水中的三氧化硫:76.硫酸铜晶体受热分解:77.无水硫酸铜作为干燥剂:化学方程式反应现象应用它猛烈燃烧耀眼的白光,形成白色固体放热,产生大量白烟和白色耀斑银白液、生成红色固体拉瓦锡实验红色金属变成黑色固体银白金属变为白色固体强烈燃烧,火星射击,黑色固体形成,放热剧烈燃烧、白光、放热、使石灰水变浑浊强烈燃烧、放热、刺鼻的气体、空气中的浅蓝色火焰、氧气中的蓝紫色火焰淡蓝火焰、放热、生成使无水cuso4变蓝的液体(水)高能燃料强烈的燃烧、大量的白烟、热量释放和白色固体的形成证明了空气中的氧含量蓝色火焰、放热、生成使石灰水变浑浊气体和使无水cuso4变蓝的液体(水)甲烷和天然气的燃烧蓝色火焰、热释放、黑烟、产生液体(水)氧乙炔火焰,使石灰水浑浊,无水硫酸铜呈蓝色、焊接和切割金属以产生气体,用火花重建木条、实验室氧气制备紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气红色变成银白色,并产生一种气体,使木条与火星重新点燃。
初三化学方程式必背集锦(打印版)

初三化学方程式必背集锦(打印版)1. 化学方程式概述化学方程式是化学反应的数学表达式,它描述了反应物和物之间的定量关系。
在初三化学学习中,掌握化学方程式是理解和应用化学反应的基础。
本集锦将汇总初三化学教材中常见的化学方程式,帮助同学们更好地记忆和应用。
2. 常见化学反应类型(3) 置换反应:一种单质和一种化合物反应另一种单质和另一种化合物的反应。
例如,铁和硫酸铜反应硫酸亚铁和铜:Fe + CuSO4 → FeSO4 + Cu。
(4) 复分解反应:两种化合物相互交换成分,两种新的化合物的反应。
例如,盐酸和氢氧化钠反应氯化钠和水:HCl + NaOH → NaCl+ H2O。
3. 初三化学方程式必背集锦(1) 氢气和氧气反应水:2H2 + O2 → 2H2O。
(2) 水电解氢气和氧气:2H2O → 2H2 + O2。
(3) 铁和硫酸铜反应硫酸亚铁和铜:Fe + CuSO4 → FeSO4 + Cu。
(4) 盐酸和氢氧化钠反应氯化钠和水:HCl + NaOH → NaCl +H2O。
(5) 氢氧化钙和二氧化碳反应碳酸钙和水:C a(OH)2 + CO2 → CaCO3↓ + H2O。
(6) 碳酸钙和盐酸反应氯化钙、水和二氧化碳:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑。
(7) 氢气和氧化铜反应铜和水:H2 + CuO → Cu + H2O。
(8) 氧气和甲烷反应二氧化碳和水:CH4 + 2O2 → CO2 + 2H2O。
(9) 氧气和硫反应二氧化硫:S + O2 → SO2。
(10) 氧气和铁反应四氧化三铁:3Fe + 2O2 → Fe3O4。
初三化学方程式必背集锦(打印版)3. 化学方程式的书写规则(1) 反应物和物之间用箭头“→”表示。
(2) 化学式中的数字表示物质的量,写在化学式的下方,称为化学计量数。
化学计量数表示反应物和物之间的摩尔比例。
(3) 在某些情况下,反应物和物之间可能需要添加状态符号,如固体(s)、液体(l)、气体(g)和溶液(aq)。
初三化学方程式默写

初三化学方程式默写初三化学方程式默写1)单质与氧气的反应:1.镁在空气中燃烧。
Mg + O2 → MgO2.铁在氧气中燃烧。
4Fe + 3O2 → 2Fe2O33.铜在空气中受热。
2Cu + O2 → 2CuO4.铝在空气中燃烧。
4Al + 3O2 → 2Al2O35.氢气中空气中燃烧。
2H2 + O2 → 2H2O6.红磷在空气中燃烧。
P4 + 5O2 → 2P2O57.硫粉在空气中燃烧。
S + O2 → SO28.碳在氧气中充分燃烧。
C + O2 → CO29.碳在氧气中不充分燃烧。
2C + O2 → 2CO2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧。
2CO + O2 → 2CO211.甲烷在空气中燃烧。
CH4 + 2O2 → CO2 + 2H2O12.酒精在空气中燃烧。
C2H5OH + 3O2 → 2CO2 + 3H2O二.几个分解反应:13.水在直流电的作用下分解。
2H2O → 2H2 + O214.加热碱式碳酸铜。
CuCO3·Cu(OH)2 → 2CuO + 2CO2 + H2O15.加热氯酸钾(有少量的二氧化锰)。
2KC lO3 → 2KCl + 3O216.加热高锰酸钾。
2KMnO4 → K2MnO4 + MnO2 + O217.碳酸不稳定而分解。
CaCO3 → CaO + CO218.高温煅烧石灰石。
CaCO3 → CaO + CO2三.几个氧化还原反应:19.氢气还原氧化铜。
CuO + H2 → Cu + H2O20.木炭还原氧化铜。
CuO + C → Cu + CO21.焦炭还原氧化铁。
Fe2O3 + 3C → 2Fe + 3CO22.焦炭还原四氧化三铁。
Fe3O4 + 4C → 3Fe + 4CO23.一氧化碳还原氧化铜。
CuO + CO → Cu + CO224.一氧化碳还原氧化铁。
Fe2O3 + CO → 2FeO + CO225.一氧化碳还原四氧化三铁。
初中化学方程式大全默写版和答案版

初中化学方程式大全一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧(研究空气组成实验):7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:(3)氧气的来源:13.玻义耳研究空气的成分实验14.加热高锰酸钾:15.过氧化氢在二氧化锰作催化剂条件下分解反应15.氯酸钾在二氧化锰作催化剂加热条件下分解:二、自然界中的水:16.水在直流电的作用下分解: 17.生石灰溶于水:18.二氧化碳可溶于水:三、质量守恒定律:19.镁在空气中燃烧: 20.铁和硫酸铜溶液反应:21.氢气还原氧化铜:四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧不充分燃烧:24.木炭还原氧化铜: 25.焦炭还原氧化铁:(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层: 27.煤炉的中层:28.煤炉的上部蓝色火焰的产生:(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):30.碳酸不稳定而分解: 31.二氧化碳可溶于水:32.高温煅烧石灰石(工业制二氧化碳):33.石灰水与二氧化碳反应(鉴别二氧化碳):(4)一氧化碳的性质:34.一氧化碳还原氧化铜: 35.一氧化碳的可燃性:其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):五、燃料及其利用:37.甲烷在空气中燃烧:38.酒精在空气中燃烧:39.氢气中空气中燃烧:六、金属(1)金属与氧气反应:40.镁在空气中燃烧: 41.铁在氧气中燃烧: 42.铜在空气中受热: 43. 铝在空气中形成氧化膜:(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸45. 铁和稀硫酸46. 镁和稀硫酸47.铝和稀硫酸48. 锌和稀盐酸49. 铁和稀盐酸50. 镁和稀盐酸51.铝和稀盐酸(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应: 53. 锌和硫酸铜溶液反应: 54. 铜和硝酸汞溶液反应:(3)金属铁的治炼原理:55. CO和 Fe2O3七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应: 57. 氧化铁和稀硫酸反应:58. 氧化铜和稀盐酸反应: 59. 氧化铜和稀硫酸反应:(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:61. 盐酸和氢氧化钙反应:62. 氢氧化铝药物治疗胃酸过多:63. 硫酸和烧碱反应:(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:65.碳酸钠与稀盐酸反应:66.碳酸氢钠与稀盐酸反应:67. 硫酸和氯化钡溶液反应:2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:69.苛性钠吸收二氧化硫气体: 70.苛性钠吸收三氧化硫气体: 71.消石灰放在空气中变质: 72. 消石灰吸收二氧化硫:(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应碳酸氢钠与稀盐酸反应:(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:(4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液78.检验硫酸根:硫酸钠和氯化钡:79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,初中化学方程式大全三、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O2 2CuO4. 铝在空气中燃烧:4Al + 3O2 2Al2O35. 氢气中空气中燃烧:2H2 + O2 2H2O6. 红磷在空气中燃烧(研究空气组成实验):4P + 5O2 2P2O57. 硫粉在空气中燃烧: S + O2 SO28. 碳在氧气中充分燃烧:C + O2 CO29. 碳在氧气中不充分燃烧:2C + O2 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgOHg+ O2↑14.加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 2H2O+ O2↑15.氯酸钾在二氧化锰作催化剂加热条件下分解:2KClO3 2 KCl +3O2↑四、自然界中的水:16.水在直流电的作用下分解:2H2O 2H2↑+ O2↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4+ Cu21.氢气还原氧化铜:H2 + CuO Cu + H2O四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 CO2不充分燃烧:2C + O2 2CO24.木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 CO227.煤炉的中层:CO2 + C 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO Cu + CO235.一氧化碳的可燃性:2CO + O2 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 2MgO41.铁在氧气中燃烧:3Fe + 2O2 Fe3O442. 铜在空气中受热:2Cu + O2 2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ Fe2O3 2Fe + 3CO2七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O (3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O 61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O 62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O 63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O (4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.检验硫酸根:硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,NH4NO3+ NaOH == NaNO3+NH3↑+ H2ONH4HCO3+ NaOH == Na2CO3+NH3↑+ H2O。
九年级化学方程式默写(最新整理)

1.碳在氧气中完全燃烧:2.双氧水制氧气:3.铁与盐酸反应:4.盐酸除铁锈:5.中和胃酸:第二天1.碳在氧气中不完全燃烧:2.高锰酸钾制氧气:3.氢气还原氧化铜:4.铝与盐酸的反应:5.硫酸除铁锈:第三天1硫在氧气中燃烧火焰颜色(),在空气中燃烧火焰的颜色()化学方程式:2.氯酸钾制氧气:3.碳还原氧化铜:4.铁与硫酸的反应:5.盐酸与氢氧化钠:1.红磷在氧气中燃烧(测空气中氧气的含量):2.电解水:3.木碳还原氧化铁:4.熟石灰与硫酸的反应:5.铝与硫酸的反应:第五天1.氢气的燃烧:2.碳酸不稳定易分解:3.一氧化碳还原氧化铁4.铁与硫酸铜反应:5.氢氧化钠吸收二氧化碳:第六天1.铁丝在纯氧中燃烧:2.工业制二氧化碳:3.一氧化碳还原四氧化三铁:4.铝与硫酸铜反应:5.检验二氧化碳:1.镁条燃烧:2.碳还原二氧化碳(吸热反应):3.铜与硝酸银反应:4.氧化铜与硫酸放映:5.盐酸与硝酸银反应:第八天1.一氧化碳在氧气中燃烧:2.氧化汞受热分解:3.一氧化碳还原氧化铜(CO早到晚退,CuO迟到早退):4.锌与盐酸反应:5.氢氧化钠与二氧化硫反应:第九天1.铝在空气中形成氧化膜:2.实验室制氢气:3.氧化铜与氢氧化钠反应:4.碳酸钠与氢氧化钙反应(工业制氢氧化钠):5.氢氧化钠与三氧化硫反应:1.铜在空气中加热:2.泡沫灭火器原理(碳酸钠与盐酸的反应):3.镁与氯化铝反应:4.氢氧化钠与二氧化硅反应(碱溶液不能用玻璃塞):5.验证二氧化碳:第十一天1.二氧化碳溶于水:2.生石灰制熟石灰:3.氢气与氯气点燃制氯化氢:4.氢氧化钡与硫酸反应:5.甲烷燃烧:第十二天1.熟石灰与硫酸反应:2.配置波尔多液(氢氧化钙与硫酸铜):3.实验室制二氧化碳:4.硝酸银与盐酸反应:5.氢氧化钡与硫酸铜反应:第十三天1.氢氧化钡与硫酸铁反应:2.实验室制氧气(反应装置中塞棉花):3.实验室制二氧化碳:4.氢氧化钠与氯化铁:5.氯化铵与氢氧化钠:第十四天1.酒精燃烧:2.检验二氧化碳:3.盐酸除铁锈:4.一氧化碳还原氧化铁:5.铝与盐酸反应:第十五天1.生石灰制熟石灰:2.工业制二氧化碳:3.氯酸钾制氧气:4.铁与盐酸放:5.硫酸除铁锈:“”“”At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。
人教版九年级全册化学方程式默写(共19页)
43.铝和硝酸铜溶液: 2Al + 3Cu(NO3)2
3Cu + 2Al(NO3)3
Fe+ ZnSO4
44.锌和硫酸亚铁溶液: Zn +FeSO4
45.铝和硫酸亚铁溶液: 2Al + 3FeSO4 3Fe+ Al2(SO4)3 46.锌和氯化亚铁溶液: Zn + FeCl2
Fe + ZnCl2
47.铝和氯化亚铁溶液: 2Al + 3FeCl2 3Fe + 2AlCl3
四、复分解反应
48.氧化铜和稀盐酸反应 : CuCl2 + H2O CuO + 2HCl 49. 氧化镁和稀盐酸反应 : MgO + 2HCl MgCl2 + H2O 50.氧化铁和稀盐酸反应: Fe2O3 + 6HCl Al2O3 + 6HCl 2FeCl3 + 3H2O 51.氧化铝和稀盐酸反应:
MgCl2 + H2 ↑
28.铝和稀盐酸:2Al + 6HCl
2AlCl3 + 3H2 ↑
Zn + H2SO4 29.锌和稀硫酸:
ZnSO4+ H2 ↑
Fe + H2SO4 30.铁和稀硫酸:
Mg + H2SO4 31.镁和稀硫酸: 32.铝和稀硫酸: 2Al +3H2SO4
FeSO4+ H2 ↑
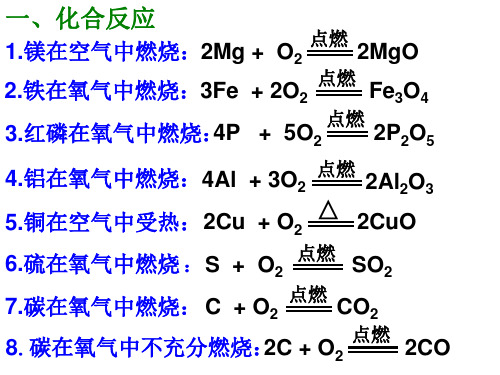
一、化合反应
1.镁在空气中燃烧:2Mg + O2 2.铁在氧气中燃烧:3Fe + 2O2
点燃
2MgO
Fe3O4 2P2O5 2Al2O3 2CuO
点燃 点燃
4P + 5O2 3.红磷在氧气中燃烧: 4.铝在氧气中燃烧:4Al + 3O2 5.铜在空气中受热: 2Cu + O2 6.硫在氧气中燃烧 : S + O2 7.碳在氧气中燃烧: C + O2
九年级所有化学方程式总汇全

九年级所有化学方程式总汇全一、化学反应类型1. 置换反应金属置换反应:例如,铁与硫酸铜反应硫酸亚铁和铜。
Fe + CuSO₄ → FeSO₄ + Cu非金属置换反应:例如,氯气与溴化钠反应氯化钠和溴。
Cl₂ + 2NaBr → 2NaCl + Br₂2. 复分解反应中和反应:例如,氢氧化钠与盐酸反应氯化钠和水。
NaOH + HCl → NaCl + H₂O盐与盐的反应:例如,硫酸钠与氯化钡反应硫酸钡和氯化钠。
Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl3. 分解反应热分解:例如,碳酸钙在高温下分解氧化钙和二氧化碳。
CaCO₃ → CaO + CO₂↑光解:例如,氯酸钾在光照下分解氯化钾和氧气。
2KClO₃ → 2KCl + 3O₂↑4. 合成反应燃烧反应:例如,碳与氧气反应二氧化碳。
C + O₂ → CO₂氢化反应:例如,氮气与氢气反应氨气。
N₂ + 3H₂ → 2NH₃二、化学方程式实例1. 氢气与氧气反应水2H₂ + O₂ → 2H₂O2. 铁与硫酸铜反应硫酸亚铁和铜Fe + CuSO₄ → FeSO₄ + Cu3. 氢氧化钠与盐酸反应氯化钠和水NaOH + HCl → NaCl + H₂O4. 碳酸钙在高温下分解氧化钙和二氧化碳 CaCO₃ → CaO + CO₂↑5. 氯酸钾在光照下分解氯化钾和氧气2KClO₃ → 2KCl + 3O₂↑6. 氮气与氢气反应氨气N₂ + 3H₂ → 2NH₃7. 碳与氧气反应二氧化碳C + O₂ → CO₂8. 氯气与溴化钠反应氯化钠和溴Cl₂ + 2NaBr → 2NaCl + Br₂9. 硫酸钠与氯化钡反应硫酸钡和氯化钠 Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl 10. 氢气与氯气反应氯化氢H₂ + Cl₂ → 2HCl九年级所有化学方程式总汇全三、氧化还原反应1. 氧化反应例如,铁在氧气中燃烧四氧化三铁。
3Fe + 2O₂ → Fe₃O₄2. 还原反应例如,氧化铜在氢气中还原铜和水。
(完整版)初中化学方程式大全默写

初中化学方程式大全化合反应1、镁在空气中燃烧2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、水蒸气通过灼热碳层:26、焦炭还原氧化铁:其他27.氢氧化钠溶液与硫酸铜溶液反应:28、甲烷在空气中燃烧:29、酒精在空气中燃烧:32、二氧化碳通过澄清石灰水(检验二氧化碳):33、氢氧化钠和二氧化碳反应(除去二氧化碳):34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):35、碳酸钠与浓盐酸反应(泡沫灭火器的原理)一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:25. 一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和稀盐酸33. 铝和稀盐酸⑵金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:⑶碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:⑷酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质44.苛性钠吸收二氧化硫气体45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:⑸酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57.硫酸和氢氧化铁反应:58.硝酸和烧碱反应:⑹酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:⑺碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:⑻盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:化学方程式反应现象应用剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹银白液、生成红色固体拉瓦锡实验红色金属变为黑色固体银白金属变为白色固体剧烈燃烧、火星四射、生成黑色固体、放热剧烈燃烧、白光、放热、使石灰水变浑浊剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属生成使带火星的木条复燃的气体实验室制备氧气紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验水通电分解为氢气和氧气电解水绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失有大量气泡产生、锌粒逐渐溶解实验室制备氢气有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性冶炼金属钨、利用氢气的还原性冶炼金属钼、利用氢气的还原性剧烈燃烧、黄色火焰离子化合物的形成、苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸蓝色沉淀生成、上部为澄清溶液质量守恒定律实验煤炉中常见反应、空气污染物之一、煤气中毒原因蓝色火焰煤气燃烧黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属冶炼金属碳酸使石蕊变红证明碳酸的酸性石蕊红色褪去澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁白色沉淀逐渐溶解溶洞的形成,石头的风化白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成产生使澄清石灰水变浑浊的气体小苏打蒸馒头工业制备二氧化碳和生石灰固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理固体逐渐溶解、有使澄清石灰水变浑浊的气体黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属原理冶炼金属原理冶炼金属原理醋酸与烧碱的反应甲醇的燃烧蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧银白色金属表面覆盖一层红色物质湿法炼铜、镀铜溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银青白色金属表面覆盖一层红色物质镀铜铁锈溶解、溶液呈黄色铁器除锈白色固体溶解白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解白色固体溶解白色固体溶解蓝色固体溶解白色固体溶解白色固体溶解胃舒平治疗胃酸过多红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2O生成白色沉淀、不溶解于稀硝酸检验Cl—的原理铁锈溶解、溶液呈黄色铁器除锈白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解2NaOH+H2SO4==Na2SO4+2H2O蓝色固体溶解白色固体溶解白色固体溶解红褐色沉淀溶解、溶液呈黄色生成白色沉淀、不溶解于稀硝酸检验SO42—的原理生成白色沉淀、不溶解于稀硝酸检验SO42—的原理生成白色沉淀、不溶解于稀硝酸检验SO42—的原理白色固体溶解黑色固体溶解、溶液呈蓝色白色固体溶解白色固体溶解白色固体溶解蓝色固体溶解白色固体溶解白色固体溶解红褐色沉淀溶解、溶液呈黄色吸收CO、O2、H2中的CO2处理硫酸工厂的尾气(SO2)溶液黄色褪去、有红褐色沉淀生成有白色沉淀生成溶液蓝色褪去、有蓝色沉淀生成白色块状固体变为粉末、生石灰制备石灰浆有白色沉淀生成初中一般不用有白色沉淀生成工业制烧碱、实验室制少量烧碱有白色沉淀生成有白色沉淀生成蓝色晶体变为白色粉末白色粉末变为蓝色检验物质中是否含有水白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子有白色沉淀生成有白色沉淀生成生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子生成使湿润石蕊试纸变蓝色的气体。
九年级上册化学方程式汇总(学生默写用)

1-8单元化学方程式汇总(学生默写用)
佛山市南海区桂江第一中学梁均豪
1.镁在空气中燃烧:
2.铁在氧气中燃烧:
3.硫粉在空气(或氧气)中燃烧:
4.碳在氧气中燃烧:
5.红磷在空气中燃烧:
6.氢气中空气中燃烧:
7.铜在空气中受热:
8.水在直流电的作用下分解:
9.过氧化氢溶液制氧气:
10.加热氯酸钾:
11.加热高锰酸钾:
12.高温煅烧石灰石:
13.氧化铜与氢气在加热条件下反应:
14.铁和硫酸铜溶液:
15.氢氧化钠与硫酸铜:
16.碳在氧气中不充分燃烧:
17.二氧化碳通入炽热的碳:
18.木炭还原氧化铜:
19.焦炭还原氧化铁:
20.碳酸不稳定而分解:
21.大理石与稀盐酸反应:
22.碳酸钠与稀盐酸反应:
23.二氧化碳通入紫色石蕊溶液(和水反应):
24.二氧化碳和石灰水反应:
25.一氧化碳在氧气中燃烧:
26.一氧化碳还原氧化铜:
27.一氧化碳还原氧化铁:
28.生石灰与水反应:
29.锌和稀硫酸反应:
30.甲烷在空气中燃烧:
31.酒精在空气中燃烧:
32.碳酸氢钠受热分解:
33、铝在空气中与氧气反应
34、铁和稀硫酸反应:
35、镁和稀硫酸反应:
36、铝和稀硫酸反应:
37、锌和稀盐酸反应:
38、铁和稀盐酸反应:
39、镁和稀盐酸反应:
40、铝和稀盐酸反应:
41、铝和硫酸铜溶液反应:
42、铜和硝酸银溶液反应:。
九年级化学方程式默写

九年级化学方程式默写篇一:初中化学方程式大全默写初中化学方程式大全化合反应1、镁在空气中燃烧2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、水蒸气通过灼热碳层:26、焦炭还原氧化铁:其他27. 氢氧化钠溶液与硫酸铜溶液反应:28、甲烷在空气中燃烧:29、酒精在空气中燃烧:32、二氧化碳通过澄清石灰水(检验二氧化碳):33、氢氧化钠和二氧化碳反应(除去二氧化碳):34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):35、碳酸钠与浓盐酸反应(泡沫灭火器的原理)一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:置换反应)25. 一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸盐+ 氢气26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和稀盐酸另一种金属+ 另一种盐33. 铝和稀盐酸⑵金属单质+ 盐(溶液)-34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:⑶碱性氧化物+酸37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:⑷酸性氧化物+碱43.苛性钠暴露在空气中变质44.苛性钠吸收二氧化硫气体45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:⑸酸+ 碱盐+ 水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53. 氢氧化铝药物治疗胃酸过多:54. 硫酸和烧碱反应:55. 硫酸和氢氧化钾反应:56. 硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:⑹酸+ 盐----- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应63. 硫酸和碳酸钠反应:64. 硫酸和氯化钡溶液反应:⑺碱+ 盐----- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:⑻盐+ 盐--- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:化学方程式反应现象应用剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹银白液、生成红色固体拉瓦锡实验红色金属变为黑色固体银白金属变为白色固体剧烈燃烧、火星四射、生成黑色固体、放热剧烈燃烧、白光、放热、使石灰水变浑浊剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰淡蓝火焰、放热、生成使无水CuSO较蓝的液体(水)高能燃料剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属生成使带火星的木条复燃的气体实验室制备氧气紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验水通电分解为氢气和氧气电解水绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失有大量气泡产生、锌粒逐渐溶解实验室制备氢气有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解有大量气泡产生、金属颗粒逐渐溶解红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性冶炼金属钨、利用氢气的还原性冶炼金属钼、利用氢气的还原性剧烈燃烧、黄色火焰离子化合物的形成、苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸蓝色沉淀生成、上部为澄清溶液质量守恒定律实验煤炉中常见反应、空气污染物之一、煤气中毒原因蓝色火焰煤气燃烧黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属冶炼金属冶炼金属篇二:初三化学上册化学方程式默写初中化学知识记忆大赛得分:__________________________________________班级:__________ 姓名: ___________一、元素符号(30 分)氧___ 氢____ 氮___ 氯____ 氟____ 碳 ___ 磷___硫 ___ 碘___ 氦___ 氩氖________ 钾____ 钙钠镁铝锌___ 铁___ 铜____ 汞___ 银____ 锰___ 钡_____ 铂 ___ 金____ 氢氧根 ______ 硝酸铵 _____ 碳酸根_______ 硫酸根____ 铵根______ 二、写出下列仪器的名称(10分)ab c de f ghJka _______b _______c _______d ________e ___________f _______g ________ h______ j _______ k ___________ 三、化合价口诀(5分)___ 四、化学方程式(55 分)1、硫在氧气中燃烧:___________________________ 现象:_______________________________________ 、2 铁在氧气中燃烧:现象:______________________________________3、磷在氧气中燃烧:____________________________现象:______________________________________4、铜在空气中加热:_________________________________ 、5 镁在空气中燃烧: _______________________________ 、6 碳与氧气充分反应:7、碳与氧气不充分反应:_______________________________ 、8 氢气在氧气中燃烧: ________________________________ 、9 一氧化碳与氧气反应:_______________________________ 10 CO2与水反应:11、生石灰和水化合:__________________________________ 12 CO2与C在高温反应: ________________________________ 1、3 氯酸钾与二氧化锰制O2:___________________________ 1、4 加热高锰酸钾制O2:______________________________ 15、过氧化氢溶液与二氧化锰制O2 __________________________16、电解水:___________________________ (正极负极气体体积比为________ ) 17 、碳酸不稳定分解:_____________ 1、8 高温煅烧石灰石:1、9 氢气还原氧化铜:______________________________ 2、0 木炭还原氧化铜:21、大理石和稀盐酸(实验室制CO2):22二氧化碳与澄清石灰水(C02勺检验)2、3 一氧化碳还原氧化铜:________________________________ 现_ 象:24、CO还原氧化铁(铁的冶炼原理)125、甲烷的燃烧(天然气作燃料)___________________________________2篇三:九年级化学方程式默写1. 碳在氧气中完全燃烧:2. 双氧水制氧气:3. 铁与盐酸反应:4. 盐酸除铁锈:5. 中和胃酸:第二天1. 碳在氧气中不完全燃烧:2. 高锰酸钾制氧气:3. 氢气还原氧化铜:4. 铝与盐酸的反应:5. 硫酸除铁锈:第三天)化学方1 硫在氧气中燃烧火焰颜色(),在空气中燃烧火焰的颜色(程式:2. 氯酸钾制氧气:3. 碳还原氧化铜:4. 铁与硫酸的反应:5. 盐酸与氢氧化钠:1. 红磷在氧气中燃烧(测空气中氧气的含量):2. 电解水:3. 木碳还原氧化铁:4. 熟石灰与硫酸的反应:5. 铝与硫酸的反应:第五天1. 氢气的燃烧:2. 碳酸不稳定易分解:3. 一氧化碳还原氧化铁4. 铁与硫酸铜反应:5. 氢氧化钠吸收二氧化碳:第六天1. 铁丝在纯氧中燃烧:2. 工业制二氧化碳:3. 一氧化碳还原四氧化三铁:4. 铝与硫酸铜反应:5. 检验二氧化碳:1. 镁条燃烧:2. 碳还原二氧化碳(吸热反应):3. 铜与硝酸银反应:4. 氧化铜与硫酸放映:5. 盐酸与硝酸银反应:第八天1. 一氧化碳在氧气中燃烧:2. 氧化汞受热分解:3. 一氧化碳还原氧化铜(CO早到晚退,CuO迟到早退):4. 锌与盐酸反应:5. 氢氧化钠与二氧化硫反应:第九天1. 铝在空气中形成氧化膜:2. 实验室制氢气:3. 氧化铜与氢氧化钠反应:4. 碳酸钠与氢氧化钙反应(工业制氢氧化钠):5. 氢氧化钠与三氧化硫反应:1. 铜在空气中加热:2. 泡沫灭火器原理(碳酸钠与盐酸的反应):3. 镁与氯化铝反应:4. 氢氧化钠与二氧化硅反应(碱溶液不能用玻璃塞):5. 验证二氧化碳:第十一天1. 二氧化碳溶于水:2. 生石灰制熟石灰:3. 氢气与氯气点燃制氯化氢:4. 氢氧化钡与硫酸反应:5. 甲烷燃烧:第十二天1. 熟石灰与硫酸反应:2. 配置波尔多液(氢氧化钙与硫酸铜):3. 实验室制二氧化碳:4. 硝酸银与盐酸反应:5. 氢氧化钡与硫酸铜反应:第十三天1. 氢氧化钡与硫酸铁反应:2. 实验室制氧气(反应装置中塞棉花):3. 实验室制二氧化碳:4. 氢氧化钠与氯化铁:5. 氯化铵与氢氧化钠:1. 酒精燃烧:2. 检验二氧化碳:3. 盐酸除铁锈:4. 一氧化碳还原氧化铁:5. 铝与盐酸反应:1. 生石灰制熟石灰:2. 工业制二氧化碳:3. 氯酸钾制氧气:4. 铁与盐酸放:5. 硫酸除铁锈:第十四天第十五天继续组织两周一次的专题学习沙龙和互动式评课沙龙,结合教研活动的主题组织好教师学习、交流。
初三必背的77个化学方程式

初三必背的77个化学方程式一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧:4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3高温CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3+ 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 +Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 47.消石灰吸收二氧化硫:Ca(OH)2+ SO2 ==== CaSO3↓+H2O(5)酸+ 碱--------盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49.盐酸和氢氧化钾反应:HCl + KOH==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ====CuCl2 + 2H2O51.盐酸和氢氧化钙反应:2HCl +Ca(OH)2 ==== CaCl2 + 2H2O52.盐酸和氢氧化铁反应:3HCl +Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+ Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4+ 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4+ 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2 ==== CuSO4 + 2H2O57.硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58.硝酸和烧碱反应:HNO3+NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4+ H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+2HCl(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+2NaOH(8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓+ NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O==== 2NaOH75.三氧化硫溶于水:SO3 + H2O==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O。
初三化学方程式汇总默写版

初三化学方程式之【四大基本反应类型】一、化合反应:由二种或二种以上的物质生成一种物质的反应(多变一)1、二氧化碳和水反应:、二氧化硫和水反应3、三氧化硫和水反应、氧化钙和水反应5、氧化钠和水反应、碳在高温下和二氧化碳反应7、碳在空气中燃烧、一氧化碳燃烧9、硫燃烧、磷燃烧11、铁在氧气中燃烧、铝在氧气中燃烧13、镁在空气中燃烧、铜在空气中加热二、分解反应:由一种物质生成二种或二种以上的物质的反应。
(一变多)1、高锰酸钾加热分解2、双氧水和二氧化锰混合3、氯酸钾和二氧化锰加热分解4、水通电分解氧化汞受热分解6、碳酸分解7、氢氧化铜受热分解:8、石灰石高温分解9、水通电分解10、碳酸氢铵受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。
(一)金属和酸反应,可制氢气1、锌和稀硫酸反应2、锌和稀盐酸反应3、铁和稀硫酸反应(注意:)4、铁和稀盐酸反应(注意:)5、铝和稀硫酸反应6、铝和稀盐酸反应7、镁和稀硫酸反应8、镁和稀盐酸反应你能把上面这四种和酸反应的金属和酸反应时的激烈程度按由大到小排列一下吗:你做出这样的排列的理由是:()(二)金属氧化物和氢气或碳反应,可治炼金属1、氢气还原氧化铜2、氢气还原氧化铁:5、氢气还原氧化铜、碳高温还原氧化铜 7、碳还原氧化铁、碳还原氧化亚铁注意:一氧化碳还原氧化铜这个反应不是置换反应,因为,一氧化碳不是单质,它不满足置换反应的定义。
Co+CuO=Cu+Co2 (不是置换反应(三)金属与某些盐溶液反应,可治炼金属(1)铁和硫酸铜反应(2)铝和硫酸铜反应(3)铜和硝酸汞反应(4)铜和硝酸银反应注意:金属与某些盐溶液能否发生置换反应的条件是:金属活动性顺序表中,排在前面的金属能把排在后面的金属从他的盐溶液中置换出来。
Mg+Al2(SO4 3= (可以反应 Fe+AlCl3= (不反应四、复分解反应:两种化合物相互交换成分生成两种新的化合物的反应。
(通式:)(一)酸+某些金属氧化物 === 盐+水(1)盐酸与氧化铁反应(2)硫酸与氧化铁反应(3)硫酸与氧化铜反应(4)盐酸与氧化铜反应(二)酸+碱 === 盐+水(中和反应)1、氢氧化钠和稀盐酸反应2、氢氧化铜和盐酸反应3、氢氧化铜和硫酸反应4、氢氧化钠和硫酸反应5、氢氧化钡和硫酸反应(三)盐+酸 === 新盐+新酸(生成物中有气体、沉淀或水)1、大理石(石灰石)和稀盐酸反应2、碳酸钠和稀盐酸反应3、硝酸银和盐酸反应4、氯化钡和稀硫酸反应(四)盐+碱 === 新盐+新碱(反应物均溶于水,生成物中有沉淀)1、硫酸铜和氢氧化钠反应2、氯化铁和氢氧化钠反应3、碳酸钠和氢氧化钙反应4、硫酸铜和氢氧化钡反应5、硫酸镁和氢氧化钡反应6、氯化铵和氢氧化钙反应(五)盐+盐两种新盐(反应物均溶于水,生成物中有沉淀)1、氯化钾和硝酸银反应2、氯化钠和硝酸银反应3、硫酸钠和氯化钡反应4、碳酸钠与氯化钡反应五、不属基本反应类型的反应(一)某些非金属氧化物与碱的反应1、二氧化碳与澄清石灰水反应2、二氧化碳与氢氧化钠反应3、二氧化硫与氢氧化钠反应(二)一氧化碳与某些金属氧化物的反应1、一氧化碳还原氧化铜2、一氧化碳还原氧化铁3、一氧化碳还原氧化亚铁4、一氧化碳还原四氧化三铁(三)甲烷、酒精等有机物的燃烧1、甲烷(天然气、沼气、瓦斯气)燃烧2、酒精(乙醇)燃烧化学方程式的运用写出下列化学方程式(一)化合反应:由二种或二种以上的物质生成一种物质的反应。
初三化学方程式大全默写

化学方程式:一.氧气的性质⒈制取氧气:⑴过氧化氢溶液中添加入二氧化锰:⑵加热氯酸钾并添加二氧化锰:⑶加热高锰酸钾:⒉单质与氧气的反应(化合反应):⑴氢气在空气中燃烧:⑵碳在空气充分中燃烧:⑶碳在空气不充分中燃烧:⑷硫在空气中燃烧:⑸磷在空气中燃烧:⑹镁在空气中燃烧:⑺铁在氧气中燃烧:⑻铜在空气中受热:⑼铝在空气中燃烧:⒊化合物与氧气反应:⑴一氧化碳在空气中燃烧:⑵甲烷在空气中燃烧:二.自然界中的水⑴水在直流电的作用下分解:⑵制取氢气:⑶生石灰与水反应:⑷二氧化碳溶于水:三.质量守恒定律⑴镁在空气中燃烧:⑵铁与硫酸铜溶液反应:⑶用氢气还原氧化铜:四.碳和碳的氧化物⒈碳的氧化化学性质:⑴碳在空气充分中燃烧:⑵碳在空气不充分中燃烧:⑶木炭还原氧化铜:⑷焦炭还原氧化铁:⑸焦炭还原四氧化三铁:高温⑵煤炉的中层:C+CO22CO ⒊二氧化碳的制取和性质::⑴理石(或石灰石)与稀盐酸反应(实验室制取二氧化碳)⑵⑵二氧化碳可溶于水⑶碳酸不稳定而易分解:⑷高温煅烧石灰石(工业制取二氧化碳):⑸澄清石灰水与二氧化碳反应(检验二氧化碳):⑹氢氧化钠与二氧化碳的反应(去除二氧化碳):⒋一氧化碳的性质:⑴一氧化碳在空气中燃烧:⑵一氧化碳还原氧化铜:⑶氧化碳还原氧化铁:⑷一氧化碳还原四氧化三铁:五.燃料及其运用⑴碳酸钠与稀盐酸反应(灭火器的原理):⑶甲烷在空气中燃烧:⑸氢气在空气中燃烧:六.金属⒈金属与氧气的反应:⑴镁在空气中燃烧:⑵铁在氧气中燃烧:⑶铜在空气中受热:⑷铝在空气中形成氧化膜:⒉酸+金属盐+氢气(置换反应):⑴锌与稀硫酸反应:⑵铁与稀硫酸反应:⑶镁与稀硫酸反应:⑷铝与稀硫酸反应:⑸锌与稀盐酸反应:⑹铁与稀盐酸反应:⑺镁与稀盐酸反应:⑻铝与稀盐酸反应:⒊金属+盐新盐+新金属:⑴铁与硫酸铜溶液反应:⑵锌与硫酸铜溶液反应:⑶铜与硝酸银溶液反应:七.酸、碱、盐⒈酸的化学性质:⑴酸+金属盐+氢气(见上)⑵酸+金属氧化物盐+水:①氧化铁与稀盐酸反应:②氧化铁与稀硫酸反应:③氧化铜与稀盐酸反应:④氧化铜与稀硫酸反应:⑶酸+碱盐+水(中和反应):①盐酸与烧碱反应:②盐酸与氢氧化钙反应:③氢氧化铝与盐酸反应(治疗胃酸过多):④硫酸与氢氧化钠反应:⑷酸+盐新酸+新盐:①大理石与稀盐酸反应:②碳酸钠与稀盐酸反应:③碳酸氢钠与稀盐酸反应:④硫酸与氢氧化钡溶液反应:⒉碱的化学性质:①碱+非金属氧化物盐+水:①氧化钠溶液暴露在空气中变质:②②氢氧化钠溶液吸收二氧化硫气体:③氢氧化钠溶液吸收三氧化硫气体:④氢氧化钙暴露在空气中变质:⑤消石灰吸收二氧化硫:⑵碱+酸盐+水(见上)⑶碱+盐新碱+新盐:①氢氧化钙与碳酸钠反应:②氢氧化钙与硫酸铜反应(制取波尔多液):⒊盐的化学性质:⑴盐+金属新金属+新盐(见上):①铁与硝酸汞反应:⑵盐+酸新酸+新盐(见上):①硝酸银溶液与盐酸反应:⑶盐+碱新碱+新盐:①硫酸铜溶液与盐酸反应:②氯化铁溶液与氢氧化钠溶液反应:③硝酸钠溶液与氢氧化钙溶液反应:④硫酸钙溶液与氢氧化钠溶液反应:⑤氢氧化钠溶液与氯化铵溶液反应:⑥氢氧化钠溶液与氯化镁溶液反应:⑷盐+盐新盐+新盐:①氯化钠与硝酸银反应:②硫酸钠与氯化钡反应:⑸石笋和钟乳石的形成:①酸钙与二氧化碳、水反应:。
初中化学方程式总结 默写版.

初中化学反应常见基本的化学方程式:(1单质与氧气的反应:(化合反应1.镁在空气中燃烧:2.铁在氧气中燃烧:3.铜在空气中受热:4.铝在空气中燃烧5.氢气中空气中燃烧:6.红磷在空气中燃烧(研究空气组成的实验:7.硫粉在空气中燃烧: 8.碳在氧气中充分燃烧:9.碳在氧气中不充分燃烧:(2化合物与氧气的反应:10.一氧化碳在氧气中燃烧: 11.甲烷在空气中燃烧:12.酒精在空气中燃烧:(3氧气的来源:13.玻义耳研究空气的成分实验14.加热高锰酸钾:(实验室制氧气原理115.过氧化氢在二氧化锰作催化剂条件下分解反应:(实验室制氧气原理2二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验:17.生石灰溶于水: 18.二氧化碳可溶于水:三、质量守恒定律:19.镁在空气中燃烧 20.铁和硫酸铜溶液反应:21.氢气还原氧化铜: 22.镁还原氧化铜:四、碳和碳的氧化物:(1碳的化学性质23.碳在氧气中充分燃烧: 24.木炭还原氧化铜:25.焦炭还原氧化铁:(2二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳:30.碳酸不稳定而分解:31.二氧化碳可溶于水:H 2O+CO 2==H 2CO 332.高温煅烧石灰石(工业制二氧化碳:CaCO 3====高温CaO+CO 2↑33.石灰水与二氧化碳反应(鉴别二氧化碳:Ca(OH2+CO 2===CaCO 3↓+H 2O(4一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO====加热Cu+CO 2 35.一氧化碳的可燃性:2CO+O 2====点燃2CO 2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O 38.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O39.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O六、金属(1金属与氧气反应:40.镁在空气中燃烧:2Mg+O 2====点燃2MgO 41.铁在氧气中燃烧:3Fe+2O2====点燃Fe 3O 442.铜在空气中受热:2Cu+O 2====加热2CuO 43.铝在空气中形成氧化膜:4Al+3O2=2Al 2O 3(2金属单质+酸--------盐+氢气(置换反应44.锌和稀硫酸Zn+H 2SO 4=ZnSO 4+H 2↑ 45.铁和稀硫酸Fe+H 2SO 4=FeSO 4+H 2↑46.镁和稀硫酸Mg+H2SO 4=MgSO 4+H 2↑ 47.铝和稀硫酸2Al+3H 2SO 4=Al 2(SO 43+3H 2↑48.锌和稀盐酸Zn+2HCl==ZnCl 2+H 2↑ 49.铁和稀盐酸Fe+2HCl==FeCl 2+H 2↑50.镁和稀盐酸Mg+2HCl==MgCl 2+H 2↑ 51.铝和稀盐酸2Al+6HCl==2AlCl3+3H 2↑(3金属单质+盐(溶液-------新金属+新盐52.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu 53.锌和硫酸铜溶液反应:Zn+CuSO 4==ZnSO 4+Cu54.铜和硝酸汞溶液反应:Cu+Hg(NO 32==Cu(NO 32+Hg(3金属铁的治炼原理: 55.3CO+2Fe 2O 3====高温4Fe+3CO 2↑七、酸、碱、盐1、酸的化学性质(1酸+金属--------盐+氢气(见上(2酸+金属氧化物--------盐+水56.氧化铁和稀盐酸反应:Fe 2O 3+6HCl==2FeCl 3+3H 2O57.氧化铁和稀硫酸反应:Fe 2O 3+3H 2SO 4==Fe 2(SO 43+3H 2O58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl 2+H 2O 59.氧化铜和稀硫酸反应:CuO+H 2SO 4==CuSO 4+H 2O(3酸+碱--------盐+水(中和反应60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H 2O 61.盐酸和氢氧化钙反应:2HCl+Ca(OH2==CaCl 2+2H 2O62.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH3==AlCl 3+3H 2O63.硫酸和烧碱反应:H 2SO 4+2NaOH==Na 2SO 4+2H 2O(4酸+盐--------另一种酸+另一种盐64.大理石与稀盐酸反应:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑65.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑66.碳酸氢钠与稀盐酸反应:NaHCO 3+HCl==NaCl+H 2O+CO 2↑67.硫酸和氯化钡溶液反应:H 2SO 4+BaCl 2==BaSO 4↓+2HCl2、碱的化学性质(1碱+非金属氧化物--------盐+水68.苛性钠暴露在空气中变质:2NaOH+CO 2==Na 2CO 3+H 2O69.苛性钠吸收二氧化硫气体:2NaOH+SO 2==Na 2SO 3+H 2O70.苛性钠吸收三氧化硫气体:2NaOH+SO 3==Na 2SO 4+H 2O71.消石灰放在空气中变质:Ca(OH2+CO 2==CaCO 3↓+H 2O72.消石灰吸收二氧化硫:Ca(OH2+SO 2==CaSO 3↓+H 2O(2碱+酸--------盐+水(中和反应,方程式见上(3碱+盐--------另一种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH2+Na 2CO 3==CaCO 3↓+2NaOH3、盐的化学性质(1盐(溶液+金属单质-------另一种金属+另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu(2盐+酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑碳酸氢钠与稀盐酸反应:NaHCO 3+HCl==NaCl+H 2O+CO 2↑(3盐+碱--------另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH2+Na 2CO 3==CaCO 3↓+2NaOH(4盐+盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl+AgNO 3==AgCl ↓+NaNO 3。
初三化学必背知识点方程式

初三化学必背知识点方程式一、必背化学方程式。
1. 氧气的制取。
- 过氧化氢分解制取氧气。
- 化学方程式:2H_2O_2{MnO_2}{===}2H_2O + O_2↑- 反应原理:过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气。
- 氯酸钾分解制取氧气。
- 化学方程式:2KClO_3{MnO_2,}{===}2KCl+3O_2↑- 反应原理:氯酸钾在二氧化锰作催化剂并加热的条件下分解生成氯化钾和氧气。
- 高锰酸钾分解制取氧气。
- 化学方程式:2KMnO_4{}{===}K_2MnO_4+MnO_2+O_2↑- 反应原理:高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气。
2. 氢气的制取。
- 锌和稀硫酸反应制取氢气。
- 化学方程式:Zn + H_2SO_4===ZnSO_4+H_2↑- 反应原理:锌的活动性比氢强,能置换出稀硫酸中的氢元素生成氢气。
3. 二氧化碳的制取。
- 大理石(或石灰石)与稀盐酸反应制取二氧化碳。
- 化学方程式:CaCO_3+2HCl===CaCl_2+H_2O + CO_2↑- 反应原理:碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳。
大理石或石灰石的主要成分是碳酸钙。
4. 水的电解。
- 化学方程式:2H_2O{通电}{===}2H_2↑+O_2↑- 反应现象:电极上有气泡产生,正极产生的气体能使带火星的木条复燃(氧气),负极产生的气体能燃烧,产生淡蓝色火焰(氢气),氢气和氧气的体积比约为2:1。
5. 碳的化学性质相关方程式。
- 碳在氧气中充分燃烧。
- 化学方程式:C + O_2{点燃}{===}CO_2- 反应现象:发出白光,放出热量,生成能使澄清石灰水变浑浊的气体。
- 碳在氧气中不充分燃烧。
- 化学方程式:2C+O_2{点燃}{===}2CO- 碳还原氧化铜。
- 化学方程式:C + 2CuO{高温}{===}2Cu+CO_2↑- 反应现象:黑色固体逐渐变成红色,生成能使澄清石灰水变浑浊的气体。
初中化学方程式默写(总结)

初中化学方程式总汇一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:()2. 铁在氧气中燃烧:()3. 铜在空气中受热:()4. 氢气中空气中燃烧:()6. 红磷在空气中燃烧:()7. 硫粉在空气中燃烧:()8. 碳在氧气中充分燃烧:()9. 碳在氧气中不充分燃烧:()(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:13.葡萄糖缓慢氧化:二.几个分解反应:14. 电解水:15. 氯酸钾制氧气:16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 一氧化碳还原氧化铜:23. 一氧化碳还原氧化铁:四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)24. 锌和稀硫酸:25. 铁和稀硫酸:26. 镁和稀硫酸:27. 铝和稀硫酸:28. 锌和稀盐酸:29. 铁和稀盐酸:30. 镁和稀盐酸:31. 铝和稀盐酸:(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐32. 铁和硫酸铜溶液反应:33. 铝和硫酸铜溶液反应:34. 铜和硝酸银溶液反应:(3)金属氧化物+酸-------- 盐+ 水35. 氧化铁和稀盐酸反应:36. 氧化铁和稀硫酸反应:37. 氧化铜和稀盐酸反应:38. 氧化铜和稀硫酸反应:39. 氧化镁和稀硫酸反应:40. 氧化钙和稀盐酸反应:(4)非金属氧化物+碱-------- 盐+ 水41.苛性钠暴露在空气中变质:42.苛性钠吸收二氧化硫气体:43.苛性钠吸收三氧化硫气体:44.消石灰放在空气中变质:(5)酸+ 碱-------- 盐+ 水45.盐酸和烧碱起反应:46.盐酸和氢氧化铜反应:47. 盐酸和氢氧化钙反应:48. 盐酸和氢氧化铁反应:49. 氢氧化铝药物治疗胃酸过多:50. 硫酸和烧碱反应:51. 硫酸和氢氧化钾反应:52. 硫酸和氢氧化铜反应:53. 硫酸和氢氧化铁反应:54. 硝酸和烧碱反应:(6)酸+ 盐-------- 另一种酸+ 另一种盐55.大理石与稀盐酸反应:56.碳酸钠与稀盐酸反应:57.盐酸和硝酸银溶液反应:58. 硫酸和碳酸钠反应:59. 硫酸和氯化钡溶液反应:(7)碱+ 盐-------- 另一种碱+ 另一种盐60.氢氧化钠与硫酸铜:61.氢氧化钠与氯化铁:62.氢氧化钠与氯化镁:63. 氢氧化钠与氯化铜:64. 氢氧化钙与碳酸钠:65.熟石灰和氯化铵反应:(8)盐+ 盐----- 两种新盐66.氯化钠溶液和硝酸银溶液:67.硫酸钠和氯化钡:五.其它反应:68.二氧化碳溶解于水:69.生石灰溶于水:70.光合作用:。
九年级全册化学方程式默写(背现象)

九年级全册化学方程式默写(背现象)1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12 酒精在空气中燃烧:13. 水在直流电的作用下分解:14. 加热碱式碳酸铜:15 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:19. 氢气还原氧化铜:20. 木炭还原氧化铜:21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:23. 一氧化碳还原氧化铜:24. 一氧化碳还原氧化铁:25. 一氧化碳还原四氧化三铁:26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和稀盐酸33. 铝和稀盐酸34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:43.苛性钠暴露在空气中变质:44.苛性钠吸收二氧化硫气体:45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53. 氢氧化铝药物治疗胃酸过多:54. 硫酸和烧碱反应:55. 硫酸和氢氧化钾反应:56. 硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸氢钠与稀盐酸反应:62.盐酸和硝酸银溶液反应:63. 硫酸和碳酸钠反应:64. 硫酸和氯化钡溶液反应:65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:70. 氢氧化钠与氯化铵:71. 氢氧化钙与硫酸铵:72.氯化钠溶液和硝酸银溶液:73.硫酸钠和氯化钡:74.氯化钙溶液和碳酸钠溶液:75.硝酸钡和硫酸铜:76.二氧化碳溶解于水:77.生石灰溶于水:78.氢氧化铜加热分解:79.三氧化硫溶于水:80.碳酸钙与水、二氧化碳反应:81.碳酸氢钙分解:82.葡萄糖在酶作用下转变成二氧化碳和水:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初三化学方程式之【四大基本反应类型】
一、化合反应:由二种或二种以上的物质生成一种物质的反应(多变一)
1、二氧化碳和水反应: 2 、二氧化硫和水反应
3、三氧化硫和水反应
4、氧化钙和水反应
5、氧化钠和水反应
6、碳在高温下和二氧化碳反应
7、碳在空气中燃烧 8、一氧化碳燃烧
9、硫燃烧 10、磷燃烧
11、铁在氧气中燃烧 12、铝在氧气中燃烧
13、镁在空气中燃烧 14、铜在空气中加热
二、分解反应:由一种物质生成二种或二种以上的物质的反应。
(一变多)
1、高锰酸钾加热分解
2、双氧水和二氧化锰混合
3、氯酸钾和二氧化锰加热分解
4、水通电分解 5,氧化汞受热分解
6、碳酸分解
7、氢氧化铜受热分解:
8、石灰石高温分解
9、水通电分解
10、碳酸氢铵受热分解
三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。
(一)金属和酸反应,可制氢气
1、锌和稀硫酸反应
2、锌和稀盐酸反应
3、铁和稀硫酸反应(注意:)
4、铁和稀盐酸反应(注意:)
5、铝和稀硫酸反应
6、铝和稀盐酸反应
7、镁和稀硫酸反应
8、镁和稀盐酸反应
你能把上面这四种和酸反应的金属和酸反应时的激烈程度按由大到小排列一下吗:
你做出这样的排列的理由是:()(二)金属氧化物和氢气或碳反应,可治炼金属
1、氢气还原氧化铜
2、氢气还原氧化铁:
5、氢气还原氧化铜
6、碳高温还原氧化铜
7、碳还原氧化铁 8、碳还原氧化亚铁
注意:一氧化碳还原氧化铜这个反应不是置换反应,因为,一氧化碳不是单质,它不满足置换反应的定义。
Co+CuO=Cu+Co 2 (不是置换反应)
(三)金属与某些盐溶液反应,可治炼金属
(1)铁和硫酸铜反应(2)铝和硫酸铜反应
(3)铜和硝酸汞反应(4)铜和硝酸银反应
注意:金属与某些盐溶液能否发生置换反应的条件是:金属活动性顺序表中,排在前面的金属能把排在后
面的金属从他的盐溶液中置换出来。
Mg+Al2(SO4)3= (可以反应) Fe+AlCl3= (不反应)
四、复分解反应:两种化合物相互交换成分生成两种新的化合物的反应。
(通式:)(一)酸+某些金属氧化物 === 盐+水
(1)盐酸与氧化铁反应
(2)硫酸与氧化铁反应
(3)硫酸与氧化铜反应
(4)盐酸与氧化铜反应
(二)酸+碱 === 盐+水(中和反应)
1、氢氧化钠和稀盐酸反应
2、氢氧化铜和盐酸反应
3、氢氧化铜和硫酸反应
4、氢氧化钠和硫酸反应
5、氢氧化钡和硫酸反应
(三)盐+酸=== 新盐+新酸(生成物中有气体、沉淀或水)
1、大理石(石灰石)和稀盐酸反应
2、碳酸钠和稀盐酸反应
3、硝酸银和盐酸反应
4、氯化钡和稀硫酸反应
(四)盐+碱 === 新盐+新碱(反应物均溶于水,生成物中有沉淀)
1、硫酸铜和氢氧化钠反应
2、氯化铁和氢氧化钠反应
3、碳酸钠和氢氧化钙反应
4、硫酸铜和氢氧化钡反应
5、硫酸镁和氢氧化钡反应
6、氯化铵和氢氧化钙反应
(五)盐+盐两种新盐(反应物均溶于水,生成物中有沉淀)
1、氯化钾和硝酸银反应
2、氯化钠和硝酸银反应
3、硫酸钠和氯化钡反应
4、碳酸钠与氯化钡反应
五、不属基本反应类型的反应
(一)某些非金属氧化物与碱的反应
1、二氧化碳与澄清石灰水反应
2、二氧化碳与氢氧化钠反应
3、二氧化硫与氢氧化钠反应
(二)一氧化碳与某些金属氧化物的反应
1、一氧化碳还原氧化铜
2、一氧化碳还原氧化铁
3、一氧化碳还原氧化亚铁
4、一氧化碳还原四氧化三铁
(三)甲烷、酒精等有机物的燃烧
1、甲烷(天然气、沼气、瓦斯气)燃烧
2、酒精(乙醇)燃烧
化学方程式的运用
写出下列化学方程式
(一)化合反应:由二种或二种以上的物质生成一种物质的反应。
A +
B === AB
4、碳在氧气中完全燃烧
5、碳在氧气中不完全燃烧
6、硫在氧气中燃烧
7、磷在空气中燃烧
8、氢在氧气中燃烧生成水
9、镁在空气中燃烧生成氧化镁
10、铁在氧气中燃烧生成四氧化三铁
11、铝在氧气中燃烧生成氧化铝
12、铜在空气中加热生成氧化铜
13、碳在高温下和二氧化碳反应生成一氧化碳
14、一氧化碳在氧气中燃烧生成二氧化碳
1、二氧化碳和水反应生成碳酸
(二)分解反应:由一种物质生成二种或二种以上的物质的反应。
AB?A+B
1、氯酸钾和二氧化锰加热分解生成氯化钾、氧气
2、高锰酸钾加热分解生成锰酸钾、二氧化锰、氧气
3、碱式碳式铜加热分解生成氧化铜、水、二氧化碳。
4、氧化汞加热分解生成汞和氧气
1、碳酸氢铵加热分解生成氨气、水、二氧化碳。
6、水通电分解生成氢气、氧气
7、碳酸分解生成二氧化碳和水
8、石灰石高温分解生成氧化钙和二氧化碳
(三)置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。
A+BC?B+AC (A)金属和酸发生的置换反应:
15、锌和稀硫酸反应生成硫酸锌和氢气
16、锌和稀盐酸反应生成氯化锌和氢气
17、铁和稀硫酸反应生成硫酸亚铁和氢气
18、铁和稀盐酸反应生成氯化亚铁和氢气
19、铝和稀硫酸反应生成硫酸铝和氢气
铝和稀盐酸反应生成氯化铝和氢气。
