第七章 分离工程吸附
第7章 吸附 化学分离工程

(7-3)
单分子层最大吸附量
Langmuir常数,与温度有关
由实验数据确定
35
二、气体混合物的吸附平衡 如果气体混合物中两个或多个组分都被吸附,而 且被吸附程度大致相同,一般被吸附的两个组分之间 相互有影响。通常,纯组分是易吸附的,在混合物中 也易吸附,但整体吸附情况较复杂。 吸附等温式: ①扩展Langmuir吸附等温式:忽略各吸附组分之间 的相互作用,其他组分的吸附仅仅减少了吸附表面上 的空位,用扩展的Langmuir方程式表示。含c个组分 的混合物,每个组分的吸附量为:
吸附:吸附质由流体转向吸附剂
吸附和脱附
进行的条件:
xi x* i 或
y i y* i
脱附:吸附质由吸附剂转向流体
x i x* i
或 y i y * i
吸附过程进行的基本依据:吸附平衡关系。 吸附平衡关系决定吸附进行的方向和限度!
27
吸附平衡时,可用吸附量表示吸附剂的吸附能力。 (1)吸附量:被吸附的吸附质的摩尔数/单位表面吸附剂m2 (2)吸附量:被吸附的吸附质的摩尔数/单位质量吸附剂kg 目前尚没有成熟的理论来估计流体与固体之间的吸 附平衡关系。因此,需要对特定的物系,通过实验进行 测定: (1)在等温条件下,表示吸附剂上吸附质的吸附量与流 体中吸附质浓度或分压的关系曲线称为吸附等温线 (2)在等压条件下,表示吸附量和温度的关系曲线称为 吸附等压线;
分离工程
(Separation Engineering)
7 吸附
(Chapter7 Adsorption)
1
本章主要学习内容
7.1 概述 7.2 吸附平衡 7.3 吸附机理
7.4 吸附分离过程
2
本章主要学习要求
化工分离工程第7章 吸附

FLGC
活性氧化铝和分子筛的脱水性能比较
活性氧化铝:在水蒸气分压高的范围内吸附容量较高 沸石分子筛:在低水蒸气分压下吸附容量较高 因此,若要求水蒸气的脱除程度高,应选用? 若吸附容量更为重要,则应选用? 也可混用,先用氧化铝脱除大部分水,之后用分子筛进 行深度干燥。
FLGC
其他吸附剂
反应性吸附剂:能与气相或液相混合物中多组分进行化学 反应而使之去除。适用于去除微量组分(反应不可逆,不 能现场再生;吸附负荷高时,吸附剂更换过于频繁,不经 济)。 生物吸着剂:利用微生物将吸附的有机物氧化分解成二氧 化碳和水等,如工业废水的生化处理
FLGC
分子筛
分子筛亦称沸石,是一种晶态的金属水合铝硅酸盐晶体。
化学通式:Mex/n[(AlO2)x(SiO2)y]mH2O,其中Me阳离子,n 为原子价数,m为结晶水分子数 每一种分子筛由高度规则的笼和孔组成,它具有高度选择 性吸附性能,是由于其结构形成许多与外部相通的均一微 孔。
FLGC
根据原料配比、组成和制造方法不同可以制成各种孔 径和形状的分子筛。见课本表7-3。 强极性吸附剂,对极性分子如H2O、CO2、H2S等有 很强的亲和力,对氨氮的吸附效果好,而对有机物的 亲和力较弱。 分子筛主要用于气态物的分离和有机溶剂痕量水的去 除。
工业吸附剂可以是球形、圆柱形、片状或粉末状 粒度范围从50μm至1.2cm,比表面积从300至1200m2/g, 颗粒的孔隙度30%—85%, 平均孔径1-20nm 孔径:按纯化学和应用化学国际协会的定义,微孔孔径 小于2nm,中孔为2~50nm,大孔大于50nm
FLGC
1.密度
1)填充密度B(又称体积密度): 是指单位填充体积的吸 附剂质量。通常将烘干的吸附剂装入量筒中,摇实至体积 不变,此时吸附剂的质量与该吸附剂所占的体积比称为填 充密度。
第七章 吸附分离法课件

吸附机理——表面性质
界面
三、吸附类型与特性
1. 物理吸附 2. 化学吸附 3. 交换吸附
1. 物理吸附——分子间作用力的吸附
1)吸附区域为自由界面 2)吸附层数为多层 3)吸附可逆性—可逆 4)吸附选择性—差
羟基磷酸钙—Ca5(PO4)3 .OH
3)吸附性质:其中Ca2+与蛋白质负电荷基团的静电吸附 作用
6. 活性炭
1)组成结构:由木屑、兽骨、兽血或煤屑等原料高温 (800℃)碳化而成的多孔网状结构
2)种类:粉末活性炭、颗粒活性炭、锦纶活性炭
吸附能力为粉末活性炭>颗粒活性炭>锦纶活性炭
3)吸附特性:非极性吸附剂,在极性介质中,对非极性 物质具有较强的吸附
1、吸附作用机理是什么? 2、吸附法有几种?各自有何特点? 3、大孔网状聚合物吸附与活性炭吸附剂相比有何
优缺点? 4、影响吸附过程的因素有那些? 5、已知80g的活性炭最多能吸附0.78 mol腺苷三磷
酸(ATP),这种吸附过程符合兰缪尔等温线。 其中b=1.9×10E5 mol/L,请问在1.2L的料液浓度 为多少时才能使活性炭吸附能力达90%?
2. 吸附剂的种类
1)无机:硅胶、氧化铝、磷酸钙凝胶、沸石等 2)有机:活性炭、(大孔)吸附树脂、纤维素等
3. 硅胶
1)组成结构:SiO2. nH2O ,多孔网状结构
O
O
│
│
Si—O—Si—OH
││OLeabharlann O││2)吸附性质:极性吸附剂
吸附活性与含水量有关
4. 氧化铝
在非极性介质中,对极性物质具有较强的吸附
分离工程_朱家文_第七章超临界萃取

分离工程
超临界萃取
7.3物质在超临界流体中的溶解度计算
假设物质溶解经历如下过程: (1)溶质分子A由其主流扩散到二相界面; (2)分子A穿过界面进入溶剂相;
(3)分子A在界面上或和溶剂相内与溶剂分子B发生缔合作用
A(s) nB (s) AB n(s)........1.)(. A(E) A(s)...............2.)..(
现在是14页\一共有40页\编辑于星期五
分离工程
超临界萃取
Soave-Redlich-Kwong方程
P RT a (T ) V b V (V b)
b 0.08664
RT c Pc
; a(T
)
a
(Tc
)
(T
);
a (Tc ) 0.42748
R
2
T
2 c
;
Pc
(T ) [1 (0.480 10574 0.176 2 )(1 (T /T c) 0.5 )] 2
现在是13页\一共有40页\编辑于星期五
分离工程
超临界萃取
为此,后人在此基础上进行了改进,其中的 Soave, Redlich and Kwong 和 Peng and Robinson 的改进较为成功。
S-R-K 方程建立于 1974 年,能对高压流体进 行 P-V-T 的关系有效计算,精度大大改进,但在 汽—液平衡计算尚存在不足。
计算式:
RT a
P
V b V2
a
8a
Vc 3b, Pc 27b2 , Tc 27Rb
现在是12页\一共有40页\编辑于星期五
分离工程
超临界萃取
Van der Waals 假设物质为球形分子,且在一定的分子 距离内有吸力和斥力。方程中参数 b 为斥力,参数 a 为吸 引力。
分离工程第七章 其它分离方法6

表 溶质-溶剂基团相互作用的罗宾斯
基团
组
与拉乌尔定律的偏差
号 1 2 3 4 5 6 7 8 9 10 11 12
结合氢的给予体 酚
1 0 0 - 0 ----- - - -
酸、硫醇
2 0 0 - 0 -- 0 0 0 0 - -
醇、水
3 -- 0 ++ 0 --- - - -
从固体或液体中提取出待分离的高沸点或热敏性
物质的新型萃取技术。
• 萃取原理
超临界流体具有选择性 溶解物质的能力,并随着临 界条件(T,P)而变化。超 临界流体可从混合物中有选 择地溶解其中的某些组分, 然后通过减压,升温或吸附 将其分离析出。
• 超临界流体:处于临 界温度和临界压力 之上的物质状态。
当用炭分子筛作为吸附剂时,由于空气 中氧与氮分子的动力直径不同,氧在吸附剂 孔道中的扩散系数比氮要大两个数量级
当干燥的空气通过装填了炭分子筛吸附 剂颗粒的固定床吸附塔时,空气中的氧被迅 速吸附,而氮分子大多数随气流带出吸附塔。
只要吸附剂装填量足够多,就有可能得 到纯度较高的产品氮气,通常氮的浓度可以 达到99.5%(摩尔分数)
除去的污染物
染料
进水中有机物浓度,
mg/L
200
出水浓度,mg/L 无颜色
流速,m3/min 接触时间,min 活性炭规格,mm
1.32 40-44 12×40
活性炭用量,m3 56.6
567 杀虫剂
50-200
酚<1 0.36 53 12×40 8吨/塔
720
378.5
16000
酚
多元醇
炼油废水COD
醚、氧化物、亚砜
《分离工程》知识点笔记

《分离工程》知识点笔记第一章:分离工程概论1.1 分离过程的重要性在化学工业中,分离技术扮演着至关重要的角色。
从原油提炼到制药生产,从食品加工到废水处理,几乎所有的化工过程中都离不开有效的分离操作。
通过这些操作,可以将原料中的有用成分与不需要的杂质分开,或是根据产品的不同规格要求进行提纯。
因此,掌握先进的分离技术对于提高产品质量、降低能耗以及减少环境污染具有重要意义。
1.2 常见的分离技术简介分离方法依据其物理或化学性质的不同而异,主要包括但不限于以下几种:•蒸馏:利用组分沸点差异实现液体混合物的分离。
•吸收:一种或多种气体被溶解于液体溶剂中以达到净化目的。
•萃取:借助另一种液体(萃取剂)选择性地提取原溶液中的某一成分。
•吸附:固体表面吸引并保持流体分子的能力,广泛应用于空气净化及水处理领域。
•结晶:通过控制温度等条件使溶液中的溶质形成晶体沉淀出来。
•膜分离:依靠半透膜的选择透过性对物料进行浓缩和净化。
•干燥:去除物料中水分或其他挥发性物质的过程。
•沉降与过滤:基于颗粒大小差异来分离悬浮体系的方法。
1.3 分离过程的选择标准选择合适的分离方法时需考虑多个因素,包括但不限于:•经济成本:设备投资费用、运行维护开支及能源消耗水平。
•环境影响:是否会产生有害废弃物?如何妥善处置?•效率高低:目标产物回收率、纯度指标能否满足需求?•安全性考量:操作过程中是否存在安全隐患?应急措施是否到位?此外,还需结合具体应用场景综合分析,比如对于热敏性材料,则应避免采用高温加热方式;当面对易燃易爆物质时,则要特别注意防火防爆设计。
第二章:相平衡基础2.1 相律及其应用相律是描述系统处于平衡状态时各相之间关系的基本法则之一,由吉布斯提出。
其数学表达式为:F = C - P + 2,其中F表示自由度数,C代表独立组分数目,P指相数。
该定律揭示了给定条件下能够独立改变变量的数量上限,有助于指导实验设计与数据分析工作。
例如,在一个二元液液系统里,若已知总压强恒定不变,则只需调整温度即可观察两相间组成变化情况。
制药分离工程 第七章 大孔树脂吸附技术(50张)

3.料液pH ——通常由溶质的酸碱度来判断,如酸性溶质宜偏酸性
第七章 大孔树脂吸附技术
第三节 大孔吸附树脂的分离操作与装置
三、吸附工艺条件的筛选、优化、确定 一切以实际的实验研究结果作为依据!
预处理合格的常用判定标准: ——至加数倍水于乙醇溶液中不显浑浊 ——或:处理液在200-400nm无紫外吸收峰
第七章 大孔树脂吸附技术
第三节 大孔吸附树脂的分离操作与装置
一、基本工艺流程 2.大孔吸附树脂的前处理 前处理工艺流程:
(1)在吸附柱中盛入一半体积的乙醇/丙酮 (2)投入一定量树脂,使液面高出树脂表面约30cm (3)自然浸泡24h以上 (4)用大量乙醇以2BV/h流速洗脱树脂,并浸泡4-6小时 (5)再用大量乙醇以2BV/h流速洗脱树脂 (6)流出液中加入2BV蒸馏水不显白色浑浊、且200-400nm内无乙 醇之外的其他吸收峰为止
作答
第七章 大孔树脂吸附技术
第三节 大孔吸附树脂的分离操作与装置
✓ 多用于从大量样品中浓集微量物质 ✓ 工业脱色、环境保护、药物分析、抗生素等的分离提纯、
中药成分的提取精制等领域
第七章 大孔树脂吸附技术
第三节 大孔吸附树脂的分离操作与装置
一、基本工艺流程 1.大孔吸附树脂的选择
——根据树脂本身的物性、被吸附质本身的物性来预选择 如极性对极性(水溶性)、非极性对非极性(脂溶性)
多选题 1分
此题未设置答案,请点击右侧设置按钮
关于大孔吸附树脂的选用,通常通过实验结果来 选择和确定,一般关注的指标有哪些?
A 有无离子型功能基团 B 有无极性 C 孔大小、多少 D 比表面积
E 吸附容量 F 吸附快慢 G 能否解吸 H 机械强度
《分离工程第七章》PPT课件

• 1、什么是亲和反胶团萃取? • 2、什么是亲和沉淀?
思考题
53
本章内容到此结束
谢谢大家
54
感谢下 载
55
感谢下 载
56
称亲和作用。
• 通过亲和作用发生的结合称特异性结
合(specific binding)或亲和结合
(affinity binding)。
2
• 亲和纯化技术
• 定义:利用生物分子间的这种特异性结 合作用的原理进行生物物质分离纯化的 技术。
• 应用:通常与其他分离纯化技术相结合 ,如亲和层析技术、亲和膜分离技术等 。
化合物,再与氨基偶联 • 甲苯磺酰氯法:双功能试剂法 二乙烯砜
22
环氧化法
Activation
OH + CH2 CH
O
C Cl H2
表氯醇
O C CH CH2 H2 O
+
P
NH2
O C NH P H2
23
配基偶联方法
• 载体经活化后,就可以进行与配基的偶联反应。具体方法如下: • 碳二亚胺缩合法(脱水) • 酸酐法 • 叠氮化法 • 重氮化法
•思考题:简述亲合错流过滤技术分离 蛋白质的操作过程?
42
第五节
其他亲和纯化技 术
一、亲和双水相分配
• 原理:利用偶联亲和配基的PEG为成相聚合物进行目标产物的双水相萃取,可在亲和配 基的亲和结合作用下促进目标产物在PEG相的分配,提高目标产物的分配系数和选择性 。
• 操作:包括亲和分配(进料)、杂蛋白反萃取(清洗)和目标产物反萃取(洗脱)等 步骤。
作用、配位键、弱共价键等。
• 生物亲和作用是一种复杂的生物现象
,这也是亲和作用特异性高的主要原
化工传质分离工程课后习题答案

目录第一章绪论 (1)第二章单级平衡过程 (6)第三章多组分精馏和特殊精馏 (19)第四章气体吸收 (24)第五章液液萃取 (27)第六章多组分多级分离的严格计算 (28)第七章吸附 (34)第八章结晶 (35)第九章膜分离 (36)第十章分离过程与设备的选择与放大 (37)第一章绪论1.列出5种使用ESA和5种使用MSA的分离操作。
答:属于ESA分离操作的有精馏、萃取精馏、吸收蒸出、再沸蒸出、共沸精馏。
属于MSA分离操作的有萃取精馏、液-液萃取、液-液萃取(双溶剂)、吸收、吸附。
2.比较使用ESA与MSA分离方法的优缺点。
答:当被分离组分间相对挥发度很小,必须采用具有大量塔板数的精馏塔才能分离时,就要考虑采用萃取精馏(MSA),但萃取精馏需要加入大量萃取剂,萃取剂的分离比较困难,需要消耗较多能量,因此,分离混合物优先选择能量媒介(ESA)方法。
3.气体分离与渗透蒸发这两种膜分离过程有何区别?答:气体分离与渗透蒸发式两种正在开发应用中的膜技术。
气体分离更成熟些,渗透蒸发是有相变的膜分离过程,利用混合液体中不同组分在膜中溶解与扩散性能的差别而实现分离。
4. 海水的渗透压由下式近似计算:π=RTC/M ,式中C 为溶解盐的浓度,g/cm 3;M 为离子状态的各种溶剂的平均分子量。
若从含盐0.035 g/cm 3的海水中制取纯水,M=31.5,操作温度为298K 。
问反渗透膜两侧的最小压差应为多少kPa? 答:渗透压π=RTC/M =8.314×298×0.035/31.5=2.753kPa 。
所以反渗透膜两侧的最小压差应为2.753kPa 。
5. 假定有一绝热平衡闪蒸过程,所有变量表示在所附简图中。
求: (1) 总变更量数Nv;(2) 有关变更量的独立方程数Nc ; (3) 设计变量数Ni;(4) 固定和可调设计变量数Nx ,Na ;(5) 对典型的绝热闪蒸过程,你将推荐规定哪些变量?思路1:3股物流均视为单相物流, 总变量数Nv=3(C+2)=3c+6 独立方程数Nc 物料衡算式 C 个热量衡算式1个 相平衡组成关系式C 个 1个平衡温度等式1个平衡压力等式 共2C+3个 故设计变量Ni=Nv-Ni=3C+6-(2C+3)=C+3固定设计变量Nx =C+2,加上节流后的压力,共C+3个 可调设计变量Na =0 解:(1) Nv = 3 ( c+2 )(2) Nc 物 c 能 1 相 cF ziT F P FV , yi ,T v , P vL , x i , T L , P L习题5附图内在(P ,T) 2 Nc = 2c+3 (3) Ni = Nv – Nc = c+3 (4) Nxu = ( c+2 )+1 = c+3 (5) Nau = c+3 – ( c+3 ) = 0 思路2:输出的两股物流看成是相平衡物流,所以总变量数Nv=2(C+2) 独立方程数Nc :物料衡算式 C 个 ,热量衡算式1个 ,共 C+1个 设计变量数 Ni=Nv-Ni=2C+4-(C+1)=C+3固定设计变量Nx:有 C+2个加上节流后的压力共C+3个 可调设计变量Na :有06. 满足下列要求而设计再沸汽提塔见附图,求: (1) 设计变更量数是多少? (2) 如果有,请指出哪些附加变量需要规定?解: N x u 进料 c+2压力 9 c+11=7+11=18N a u 串级单元 1 传热 1 合计 2 N V U = N x u +N a u = 20 附加变量:总理论板数。
第七章_分离工程吸附教材

115
120
125
128
124
126
135
126
126
138
127
从表中数据可看出, Langmuir 方程比Freundlich 方程拟合结果好得多。平均 偏差为1.0%和8.64%, 其原因是Langmuir 方程在高 压下q趋于渐近值,与实测数 据类型相吻合。
7.2.1 气体吸附平衡
3.气体混合物吸附平衡
活性炭在制造过程中,当挥发性有机物去除后,晶格 间的空隙形成形状和大小不同的细孔。半径100~ 1000nm为大孔,半径2~100nm为中孔,半径小于 2nm为微孔。
7.1.2 吸附剂
2. 沸石分子筛
沸石分子筛:Mx/n[(AlO2)x(SiO2)y]·mH2O表示的结 晶硅铝酸盐的多水化合物,具有Al-Si晶形结构,典 型的几何形状如图7-2
K /kPa-1
0.001987 0.000905
用扩展Langmuir预测CH4和CO气体混合物的比吸附体积(STP)。 已知吸附温度294K;总压2512kPa;组成: CH4 69.6%(mol), CO 30.4%(mol)。计算结果与下列实验数据进行比较。
总吸附量/ [cm3 (STP) /g]
例7-1,解:
由(a)式拟合得: K=8.979, n=3.225,
故Freundlich 方程为: q 8.979 p 0.3101
由(b)式拟合得:1/qm=0.007301,1/qmK=3.917, qm=137.0,K=0.001864, 故Langmuir 方程为:
q 0.2553 p 1 0.001864 p
7.1.1 吸附过程
1. 吸附定义
吸附质(adsoቤተ መጻሕፍቲ ባይዱbate) —— 被吸着和浓缩于多孔固 体表面的物质
《分离工程》7.吸附-07

相对压力P/P0
І类:简单,适应单分子层吸附,常用于处于临界温度以上 的气体; Ⅱ类:复杂,与多分子层吸附有关,气体温度低于临界温度, 压力较低,但接近饱和蒸汽压。第一吸附层的吸附热大于后 继吸附层的吸附热,后者等于冷凝。 ——显示出强吸附能力,是人们希望的。 Ⅲ类:
只有在高压下才变的易吸附,相应于多层吸附,少见。
4.活性氧化铝——极性吸附剂
活性氧化率的化学通式为:Al2O3· 2O nH 用无机酸的铝盐与碱反应生成氢氧化铝的溶 胶,然后转变为凝胶,经过灼烧脱水而得。
活性氧化铝的表面活性中心是羟基和路易斯 酸中心,极性强,对水具有很高的亲和作用, 广泛用于脱除气体中的水分。
不同吸附剂的脱水性能
一般:脱气体中微量水份——分子筛 脱气体中大量水份——硅胶、活性氧化铝
1. 疏水吸附剂;
2. 亲水吸附剂
影响吸附剂性能的主要因素:
1. 化学组成;
2. 制造方法
1.活性碳——非极性吸附剂
活性碳是碳质吸附剂的总称。各种含碳有机 物均可以制造活性碳,活性碳的制造主要有 两步: 1碳化;2 活化。 活性炭具有非极性表面。为疏水亲有机物的 吸附剂;它具有性能稳定、抗腐蚀、吸附容 量大、解吸容易及再生性能好的优点。 广泛用于:脱除水中有机物;水溶液 中的色素等。
3
2.沸石分子筛:
分子筛有天然和合成分子筛。
沸石分子筛一般用 x / m [( AlO2 ) x ( SiO2 ) y ] ZH 2O M
每一种沸石分子筛都具有特定的均一孔径,它因
原料的配比、组成和制造方法不同而不同,通过改变
这些因素可以制造出各种孔径和形状的沸石分子筛。 沸石分子筛是强极性吸附剂,对极性分子如H2O、 CO2、H2S和其他类似物质有很强的亲和力。而对有机 物的亲和力较弱。
第七章__吸附1..

化学吸附:基于在固体吸附剂表 面发生化学反应使吸附质和吸附剂 之间以化学键力结合的吸附过程, 因此选择性较强。化学吸附一般速 度较慢,只能形成单分子层且不可 逆。
一般而言,较低温度下有利于物 理吸附,较高温度(有时可超过 200℃)下有利于化学吸附。
吸附类型的判断
(1)物理吸附热与冷凝热在一个数量级上,而化学吸附热与其反 应热在一个数量级上;
五、孔径分布
除多孔晶体外,吸附剂中的孔径都是有一定分布的。 孔径分布常用孔径与孔容之间的关系来表示。
几种吸附剂的孔径分布曲线
The concept of porosity
Non-porous solids: very low surface area Porous solids: medium high surface area, pore volume and dimension
物理吸附
化学吸附
弱, 长程键 强, 短程键 范德华力相互作用 (如 London 色散 包括轨道重叠和电荷转移的化学键. 力, 偶极力).. 非表面专一性 表面专一性 只要温度足够低,任何分子在任何表 例如氢可以在过渡金属表面发生化学吸 面上都可以发生物理吸附 附,但不能化学吸附在金或汞上 DHads = 5 ….. 50 kJ mol-1 DHads = 50 ….. 500 kJ mol-1
吸附剂孔结构
吸附对孔径分布的要求主要有两方面: (1)孔径不应小于吸附质的尺寸; ( 2 )孔径大小应有适宜的分布,从而使吸 附质分子在粒内的扩散过程顺畅。
CO, CH4, CO2, N2, A, NH3/H2 丙酮/废气流 C2H4/废气流 H2O/乙醇
沸石, 活性炭 活性炭 活性炭 沸石分子筛
气体纯化 (c) 分离物系 溶剂/空气 臭味气体/空气 吸附剂 活性炭 活性炭
水处理工程吸附7-文档资料

HCl、H2SO4、NaOH、氧化 剂 有机溶剂(苯、丙酮等)
生物再生
常温
好气菌、厌气菌
湿式氧化分解 电解氧化
100~200℃,加压 O2、空气、氧化剂
常温
O2
水处理工程
水处理工程
水处理工程
第三节吸附工艺与设计
分间歇和连续:
– 间歇:搅拌吸附 – 连续:通过吸附床
一、间歇操作
– 搅拌池型:连续搅拌 – 泥渣接触型:类似澄清池 1.多级平流吸附
5-第一反应室;6-第二反应室;7-泥渣浓缩室;8-分离室
泥渣接触型吸附池
水处理工程
2.多级逆流吸附
• 充分利用吸附剂的吸附能力,使接近饱和的吸附 剂与高浓度的进水先接触:
原水Q,c0 失效炭
反应池1
W, q1
c1
反应池2
q2
c2 q3
Q,c3 处理水
反应池3
水处理工程
第七章 吸附
吸附的基本理论 吸附剂及其再生 吸附工艺与设计 吸附法的应用
水处理工程
固体表面的分子或原子因受力不均衡而具有剩余的表面能, 当某些物质碰撞固体表面时,受到这些不平衡力的吸引而 停留在固体表面上,这就是吸附。这里的固体称吸附剂。 被固体吸附的物质称吸附质。吸附的结果是吸附质在吸附 剂上浓集,吸附剂的表面能降低。
当吸附量很小时,即当b·ce<<1时,qe=abce,即qe与 ce成正比,等温线是一条直线;
当吸附量很大时,即当b·ce>>1时,qe≈a,即平衡吸 附量接近于定值,等温线趋于水平。
水处理工程
• ②BET等温式
– 多分子吸附
qe
(cs
Bace ce )[(1 (B
化工分离工程第七章__新分离方法

化工分离工程第七章__新分离方法在化工分离工程中,分离过程是非常重要的环节。
传统的分离方法包括蒸馏、萃取、吸附、结晶等。
然而,随着科学技术的不断进步和发展,新的分离方法也逐渐被应用于化工分离工程中。
本章将介绍几种目前最新的分离方法。
一、离子交换膜技术离子交换膜技术是一种通过离子交换作用实现离子分离的方法。
它利用具有选择性离子渗透性的膜,通过对电渗透效应和离子交换效应的结合实现对溶液中离子的分离。
离子交换膜技术具有高选择性、高透过率和稳定性好等优点,已广泛应用于水处理、电力工业、化工领域等。
二、超临界流体萃取技术超临界流体萃取技术是利用超临界流体具有可调节性、高扩散系数和低表面张力等特点,用于有效分离和提取化合物。
在超临界条件下,流体的物理和化学性质发生了很大的改变,使得溶液和非溶质之间的传质和传热效果得到了提高。
超临界流体萃取技术已广泛应用于天然药物提取、废水处理等领域。
三、薄膜分离技术薄膜分离技术是指利用薄膜具有选择透过性,通过物质在薄膜表面的扩散和渗透,实现对混合物的分离。
薄膜分离技术具有结构简单、成本低、操作方便等优点,广泛应用于分离纯化、浓缩、脱水等领域。
薄膜分离技术包括微滤、超滤、纳滤、反渗透等多个方法。
四、离子液体分离技术离子液体是一类具有独特性质的新型溶剂,由有机阳离子和无机阴离子组成。
离子液体分离技术是指利用离子液体的溶解性、热稳定性和反应性等特点,实现对混合物的分离和提纯。
离子液体分离技术已广泛应用于化学、生物、环境等领域,具有非常广阔的应用前景。
以上介绍的是目前化工分离工程中的一些新分离方法,它们在分离效率、能耗、环保性等方面都具有优势。
随着科技的不断进步,新的分离方法也将不断涌现,为化工分离工程提供更多的选择和可能性。
作为化工工程师,需要不断学习和掌握新的分离技术,以提高分离工程的效率和质量。
水污染课件第七章 吸附

式中:K——Freundlich吸附系数; n——常数,通常大于l。
Freundlich经验公式:
(7-7)
将式(7-7)两边取对数,得: lgqe=lgK+(1/n)lgCe (7-8)
Freundlich式在一般的浓度范围内与Langmiur式比较接近.
两者的区别是:在高浓度时前者不像后者那样趋于一定值;在 低浓度时,也不会还原为直线关系。
(7-2)
式中: a—与最大吸附量有关的常数 b—吸附系数,与吸附能有关。
qe
Ce
Ce
当吸附量很少时,b·Ce《1,qe≌abCe,即Ce与qe成正比,等温线近似于 一直线。 当吸附量很大时,b·Ce》1,qe≌ a,即平衡吸附量接近于定值,等温线 趋向水平。
第七章 吸附 19
水污染 控制工程I
第七章 吸附
9
水污染 控制工程I
(1) 物理吸附
分子间力(范德华力)引起 没有选择性
但分子引力随分子量增大而增加 对同一系化合物,吸附量随分子量增大而增大—Traube规则。
多分子层吸附
吸附时表面能降低,放热较小,约42kJ/mol或更少, 低温就能进行。
吸附力弱,比较容易解吸。
主要影响因素:吸附剂的比表面积和细孔分布。
Ce 1 ( B 1) Ce qe (Cs Ce ) aB aB Cs
(7-6)
由吸附实验数据, 按式(7-6)作图 可求得常数a和B。
Ce qe (Cs Ce )
Cs值估计偏低
( B 1) aB
Cs值估计偏高
1 aB
Ce Cs
第七章 吸附
23
水污染 控制工程I
分离工程第七章
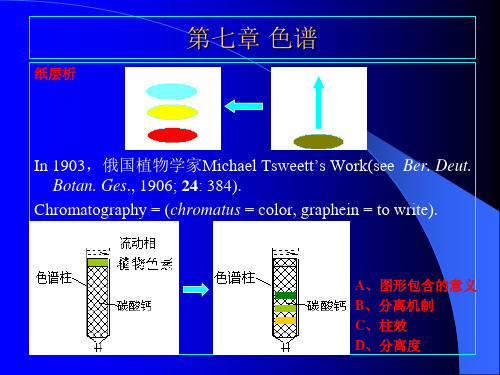
4.3 色谱分离度
分离度也称分辨度。它是指相邻两色谱保留值之差与两峰底 宽平均值之比,即
一般来说,当Rs < 1时,两峰总有部分重叠;当Rs =1时,两 峰能明显分离;Rs >1.5时,两峰才能完全分离。当然,更 大的Rs值,分度效果会更好,但会延长分析时间。 利用上式,可以直接从色谱图上计算分离度。但该式没有体 现影响分离度的诸因素。而下式清楚地指出了,分离度受 柱效n、选择性x和容量因子k三个参数的控制:
5)、按原理分类
2
国际通用色谱法分类及其缩写
色谱分类
3
分配系数m:
m cs cm
色谱的名词术语
式中, cs 和 cm 分别为组份在固定相 和流动相中的浓度。 m类型:A、B型曲线是一条典型的 吸附等温线,吸附色谱法属于这 类曲线。 C 和 D 型吸附等温线很 少遇到。 C 曲线为线性分配等温 线。 线性色谱:溶质浓度低时, m 为常 数时的色谱 意义:容易理解,溶质流过色谱柱 时,m大的组份通过色谱柱所需 要的时间长,m小的组份需要的 时间短;当样品中各组份在两相 的m不同时,就能实现差速迁移, 达到分离的目的。 Why?
4.4 定性分析
制备性色谱定性分析
特异性检测
4.4 定性分析
分析性色谱定性分析
1st 在色谱条件一定时,任何 一种物质都有确定的保留 时间。
ti , m
L1 mi u0
2nd 相对保留值2,1:
.
4.5 定量分析
定量依据
在一定色谱条件下,组份i的质量(mi) 或其在流动 相中的浓度,与检测器响应讯号(峰面积Ai或峰高 hi )成正比: 式中fiA和fih是绝对校正因子。
色谱分类
A)、洗脱法:料液中的溶质根据其在固定相和流动相 中的分配行为的不同,在柱出口处被展开形成相互分 离的色谱峰。 B)、顶替法:与A相似, 不同在于:采用的洗脱液中 含有与固定相的亲和力比料 液中各个组分都大的物质 (称顶替剂),它将料液中 所有溶质按其与固定相的亲 和力的大小不同从柱中按次序出来。适于大量处理稀溶液。 C)、迎头法:与一般的固定床吸附操作相同,大量料液连续输入到层析 柱中,直到在出口处发生溶质穿透,只有最先穿透的(分配系数大 OR小?)组分能以纯粹的状态得到部分回收,之后的流出液均为双 组分或多组分的混合物。 最常见的是A,本章主要讨论的内容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.1.1 吸附过程
1. 吸附定义
吸附质(adsorbate) —— 被吸着和浓缩于多孔固 体表面的物质 吸附剂(adsorbent)
—— 具有选择性吸着溶质的
多孔表面固体
7.1.1 吸附过程
1. 吸附定义
吸附操作 流动相与多孔的固体颗粒相接触, 使固体颗粒能有选择地累积和凝聚流动
Ⅰ类吸附等温线和Ⅱ类吸附等温线显示出强吸附 性能,是人们所希望的。
7.2.1 气体吸附平衡
Ⅲ类—吸附等温线
压力低时,吸附量很低,只有在 压力高时才容易吸附,相应于多 层吸附,它的特点是吸附热与被 吸附组分的液化热大致相等。
多分子层吸附
第一吸附层的吸附热小于后继吸
附层的吸附热; Ⅲ类比较少见。
j 1 n
qA
133.4(0.001987)(1748) 89.7cm3 ( STP) / g 1 0.001987(1748) (0.000905)(763.6)
7.2.1 气体吸附平衡
例7-2,解:
同理得: qB =16.9 cm3 (STP) /g 实验值114.1 实验值0.867 实验值0.133 总吸附量:q = qA +qB =106.6
例7-1,解:
由(a)式拟合得: K=8.979, n=3.225,
故Freundlich 方程为: q 8.979p 0.3101
由(b)式拟合得:1/qm=0.007301,1/qmK=3.917, qm=137.0,K=0.001864, 故Langmuir 方程为:
0.2553 p q 1 0.001864 p
(1)扩展Langmuir方程 假设各组分互不影响,Langmuir方程用于含n个组分 的混合物,组分i的吸附量为:
qi qm,i
Ki pi 1 K j p j
j 1 n
7.2.1 气体吸附平衡
(2) 扩展Freundlich-Langmuir方程 相似的方法将Freundlich-Langmuir方程,用于气 体混合物的如下关系:
5. 其它吸附剂
7.2 吸附平衡
7.2.1 气相吸附平衡 7.2.2 液相吸附平衡
7.2.1 气体吸附平衡
1. 吸附平衡定义
吸附平衡 ——在一定条件下,经过足够长的时 间,吸附质在两相中的浓度不再变化,称 为吸附平衡,对应的浓度称为平衡浓度。 吸附平衡关系决定了吸附过程的方向和极 限,是吸附过程的基本依据。
现 象
热效应
类似于冷凝
近似于冷凝热
类似于化学反应
近似于化学反应热
吸附方式
解吸结果 吸附过程
单分子层或多分子层
吸附质能还原 可逆,速度快
一般为单分子层
吸附质不能还原 不可逆
7.1.1 吸附过程
4. 吸附过程在工业上的应用
应用领域: ① 石油、化工、冶金、食品、医药 ② 日常生活中的应用:家用净水剂、冰箱 除异味„„
7.2.1 气体吸附平衡
例7-1
两个等温线预测的q值如下:
q/ [cm3 (STP) CH4/g活性炭]
从表中数据可看出, Langmuir 方程比Freundlich 方程拟合结果好得多。平均 偏差为1.0%和8.64%, 其原因是Langmuir 方程在高
p/kPa
276 1138 2413 3758 5240 6274 6688
Ⅰ类是平缓地接近饱和
值的朗格谬尔型等温吸
附曲线。
单分子层吸附,常适用 于吸附温度处于该气体 临界温度以上。
7.2.1 气体吸附平衡
Ⅱ类—吸附等温线
是最普通的物理吸附;
多分子层吸附 单分子层吸附
能形成多分子层吸附,第一吸附层吸 附热大于后继吸附层的吸附热; 吸附气体的温度低于其临界温度,吸 附压力较低,但接近于饱和蒸汽压。
相中一定组分在其内表面上,从而达到
分离的目的。
7.1.1 吸附过程
2 . 吸附原理
吸附质单个原子、离子或分子与固体 表面之间存在着相互作用力而被吸附在固 相吸附剂的内外表面上。
7.1.1 吸附过程
3 . 物理吸附和化学吸附
表1 物理吸附和化学吸附比较
物理吸附 作用力 Van der waals力 化学吸附 化学键力,电子得失与 转移、分子解离等
吸附温度 296 K,拟合方程为:(a)Freundlich 方程; (b)Langmuir 方程。哪个方程拟合更好些?
解: 将等温方程线性化,使用线性方程回归方法得到常数。
(a)Freundlich (b)Langmuir
q Kp1/ n
p 1 p q qm K qm
7.2.1 气体吸附平衡
第七章
吸附
7.1 概述 7.2 吸附平衡 7.3 吸附动力学和传递 7.4 吸附分离过程
7.1 概述
7.1.1 吸附过程 7.1.2 吸附剂
7.1.1 吸附过程
1. 吸附定义
吸附(adsorption)
当两相组成一个体系时,其组成在两相
界面(Interface)与相内部是不同的,处在两相
界面处的成分产生了积蓄(浓缩)。这种现象称
工业吸附分离应用实例如书本表7-1
7.1.1 吸附过程
4. 吸附过程在工 业上的应用
工业吸附分离应用实例
7.1.2 吸附剂
工业上常用的吸附剂 —— 活性碳、沸石分子筛、硅胶 和活性氧化铝。 吸附剂的主要特征 ——多孔特征和具有很大的比表面, 约300~l 200m2/g,以及具有足够强度。
7.1.2 吸附剂
单分子层吸附理论,均匀表面,被吸附溶质分子之 间没有相互作用力。
Kp q qm 1 Kp
q-吸附量 qm-饱和吸附量 p定律,符合热力学一致 性要求,公认为定性或半定量研究变压吸附的基础。
7.2.1 气体吸附平衡
③Freundlich吸附等温方程
活性炭在制造过程中,当挥发性有机物去除后,晶格 间的空隙形成形状和大小不同的细孔。半径100~ 1000nm为大孔,半径2~100nm为中孔,半径小于 2nm为微孔。
7.1.2 吸附剂
2. 沸石分子筛
沸石分子筛:Mx/n[(AlO2)x(SiO2)y]· 2O表示的结 mH 晶硅铝酸盐的多水化合物,具有Al-Si晶形结构,典 型的几何形状如图7-2
实验值 45.5 91.5 113 121 125 126 126
Freundlich
Langmuir
51.3 79.6 101 115 128 135 138
46.5 93.1 112 120 124 126 127
压下q趋于渐近值,与实测数
据类型相吻合。
7.2.1 气体吸附平衡
3.气体混合物吸附平衡
7.2.1 气体吸附平衡
Ⅳ类和Ⅴ类—吸附等温线
图7-5中的Ⅳ类和V类分别是Ⅱ类和Ⅲ类因毛细管冷 凝现象而演变出来的吸附等温线。
解吸 吸附
可以认为是由 于产生毛细管凝 结现象所致。
Brunauer提出,微孔尺寸可限制吸附的层数,并且由于发 生毛细管冷凝现象,在达到饱和蒸汽压之前显示出很大的吸 附程度。
计算吸附相组成:xA = 89.7/106.6 =0.841
xB = 16.9 /106.6=0.159
性是因为吸附剂的活性中心与被吸附分子的活性 点必须在几何上排成一条线。
7.1.2 吸附剂
5 . 其它吸附剂
环保用分子筛采用专用分子筛脱除硫酸厂尾气中 的SO2和硝酸厂尾气中的NOx以及氢碱厂氩气中
的汞的方法已经在工业上应用。
处理放射性废物专用分子筛在原子能工业中,含
有这类物质的废水量一般都较大。
7.1.2 吸附剂
7.2.1 气体吸附平衡
(2) 吸附平衡方程
①亨利定律
气体在液体中的溶解度与气体的分压成正比(一定 温度下),这就是亨利定律。 在吸附过程中,吸附量与压力(或浓度)成正比。
q K p
或
q Kc
式中:K或Kˊ为亨利系数,随温度的增高而降低。
7.2.1 气体吸附平衡
②朗格谬尔方程(Langmuir)
吸附质的mol分数:
CH4
CO
0.867
0.133
0.841
0.159
7.2.1 气体吸附平衡
例7-2,解:
pA= yA p = 0.696×2512 = 1748( kPa) pB= yB p = 0.304× 2512 = 763.6( kPa)
qi qm,i
Ki pi 1 K j p j
K /kPa-1
0.001987 0.000905
用扩展Langmuir预测CH4和CO气体混合物的比吸附体积(STP)。 已知吸附温度294K;总压2512kPa;组成: CH4 69.6%(mol), CO 30.4%(mol)。计算结果与下列实验数据进行比较。
总吸附量/ [cm3 (STP) /g] 114.1 106.6
q Kp 1/ n qs 1 Kp
该式纯属经验关系。
1/ n
7.2.1 气体吸附平衡
例7-1 纯甲烷气体在活性炭上的吸附平衡数据如下:
q /[cm3(STP)CH4 /g活性炭]
P=PCH4 /kPa
45.5 275.8 91.5 1137.6 113 2413.2 121 3757.6 125 5240.0 126 6274.2 126 6687.9
7.1.2 吸附剂
2. 沸石分子筛
7.1.2 吸附剂
3. 硅胶
组成:化学式是SiO2· 2O nH 性质和特点:硅胶处于高亲水和高疏水性
质的中间状态。典型的物理性质如书中表
7-5所示。
7.1.2 吸附剂
