盐酸左氧氟沙星氯化钠注射液生产过程质量控制
氧氟沙星注射液生产工艺规程

制药有限公司氧氟沙星注射液生产工艺规程颁发单位:GMP办公室工艺规程批准程目录1. 剂型、规格 (3)2. 生产工艺流程 (3)3. 操作过程及工艺条件 (4)4.质量控制要点 (7)5.设备一览表、主要设备生产能力 (7)6.工艺过程中的SOP (8)7.中间产品的控制 (9)8.验证工作要点 (9)9.工艺验证的具体要求 (10)10.工艺卫生和环境卫生 (10)11.劳动组织及岗位定员 (10)一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。
10ml:0.2g二、流程图:氧氟沙星注射液生产工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、干燥灭菌2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。
在理瓶室将安瓶的合格品摆满瓶盘。
2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯化水洗安瓿瓶内外壁。
将安瓿瓶盘对称放置,固定在甩水机上,启动甩水机,甩水处理8分钟,至安瓶甩干。
重复上述操作。
2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的注射用水清洗安瓿瓶内外壁,重复粗洗步骤。
定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热原。
2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。
氧氟沙星氯化钠注射液配制工艺的研究

氧氟沙星氯化钠注射液配制工艺的研究作者:许茹画来源:《科学与财富》2019年第02期摘要:目的:通过全方位的对比试验,优化氧氟沙星氯化钠注射液(100mL:0.2g+0.9g)的配置生产工艺。
方法:通过对注射液配置过程中的注射用水温度、pH值,加料顺序等项目的考察,同时对不同工艺所产成品的相关物质与该批氧氟沙星原料的有关物质进行比较,找出工艺稳定,适宜工业化大生产的制剂工艺。
结果:氧氟沙星在酸性环境下溶解迅速,成品有关物质稳定,质量可靠。
结论:加酸工艺可以解决氧氟沙星氯化钠注射液(100mL:0.2g+0.9g)成品有关物质偏高,不稳定的现象,工艺简单,能耗降低,适宜于工业化大生产。
关键词:氧氟沙星;氧氟沙星氯化钠注射液;盐酸氧氟沙星氯化钠注射液在临床输液当中应用是非常广泛的,但是现在我国对于该药品的制备并没有一个统一的标准,其原因在于国家药典当中的标准也在不断发生变化,这也导致了当前氧氟沙星氯化钠注射液的质量无法得到保证的问题。
在最新的国家药典当中,氧氟沙星氯化钠注射液的ph值范围进一步放宽,为3.5-7.5之间,同时有关物质的成分标准也得到了提高,。
但是在水中,氧氟沙星是一种难溶的物质,但是在酸性环境下则易溶,在本次研究当中,针对水温、ph值和加酸顺序进行对比,以此来保证溶液质量、节约成本,生成稳定的配制工艺。
1 实验环节1.1 不加酸配制工艺简介取有刻度的烧杯,其中加入注射用水1L,然后将其加入设定温度的恒温水浴锅当中,保证温度达到相同状态后,结合配制处方加入氯化钠溶液,并进行搅拌,在其溶解后就可以加入氧氟沙星,搅拌至完全溶解,之后补充注射用水1L,之后将半成品取样进行检验,其余半成品要经过过滤后加入输液瓶,在115摄氏度环境下进行0.5h的灭菌,之后冷却。
1.2 加酸的配制工艺取有刻度的烧杯,其中加入注射用水1L,然后将其加入设定温度的恒温水浴锅当中,保证温度达到相同状态后,结合配制处方加入氯化钠溶液,并进行搅拌,加入稀盐酸到适当的酸度,之后加入氧氟沙星,搅拌至完全溶解,之后补充注射用水1L,之后将半成品取样进行检验,其余半成品要经过过滤后加入输液瓶,在115摄氏度环境下进行0.5h的灭菌,之后冷却。
氯化钠注射液生产过程质量控制要点推荐word范文
每箱
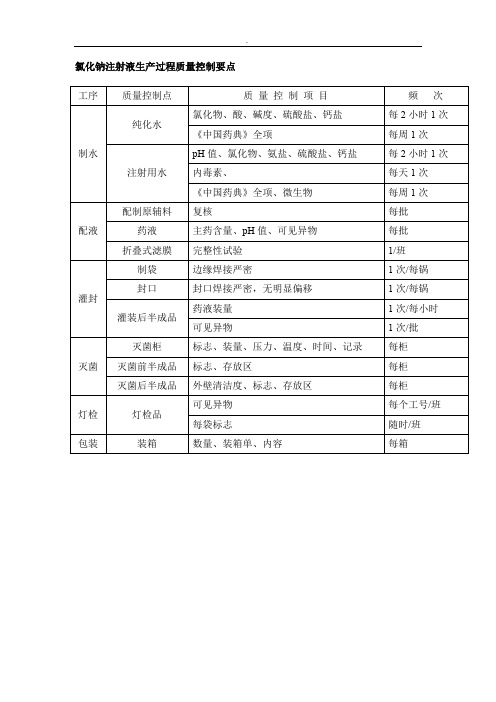
氯化钠注射液生产过程质量控制要点
工序
质量控制点
质量控制项目
频次
制水
纯化水
氯化物、酸、碱度、硫酸盐、钙盐
每2小时1次
《中国药典》全项
每周1次
注射用水
pH值、氯化物、氨盐、硫1次
《中国药典》全项、微生物
每周1次
配液
配制原辅料
复核
每批
药液
主药含量、pH值、可见异物
每批
折叠式滤膜
完整性试验
1/班
灌封
制袋
边缘焊接严密
1次/每锅
封口
封口焊接严密,无明显偏移
1次/每锅
灌装后半成品
药液装量
1次/每小时
可见异物
1次/批
灭菌
灭菌柜
标志、装量、压力、温度、时间、记录
每柜
灭菌前半成品
标志、存放区
每柜
灭菌后半成品
外壁清洁度、标志、存放区
每柜
灯检
灯检品
可见异物
每个工号/班
每袋标志
随时/班
包装
装箱
氯化钠注射液成品质量标准
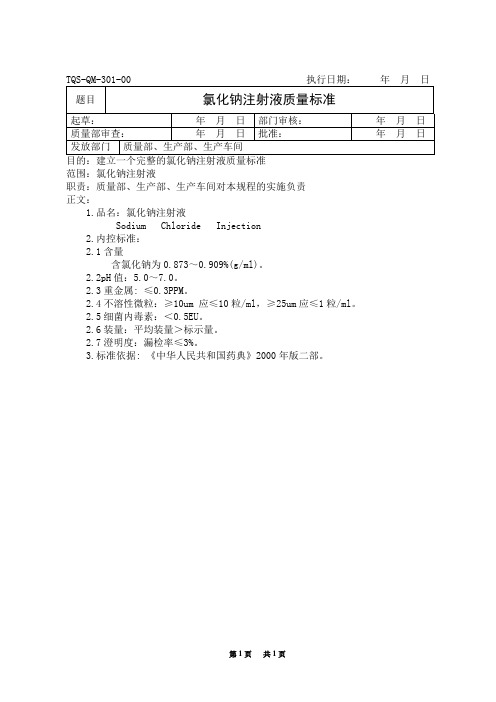
3.标准依据: 《中华人民共和国药典》2000年版二部。
Sodium ChlorideInjection
2.内控标准:
2.1含量
含氯化钠为0.873~0.909%(g/ml)。
2.2pH值:5.0~7.0。
2.3重金属:≤0.3PPM。
2.4不溶性微粒:≥10um应≤10粒/ml,≥25um应≤1粒/ml。
2.5细菌内毒素:<0.5EU。
2.6装量:平均装量>标示量。
TQS-QM-301-00执行日期: 年 月 日
题目
氯化钠注射液质量标准
起草:
年 月 日
部门审核:
Байду номын сангаас年 月 日
质量部审查:
年 月 日
批准:
年 月 日
发放部门
质量部、生产部、生产车间
目的:建立一个完整的氯化钠注射液质量标准
范围:氯化钠注射液
职责:质量部、生产部、生产车间对本规程的实施负责
正文:
1.品名:氯化钠注射液
左氧氟沙星质量标准

左氧氟沙星质量标准左氧氟沙星是一种广谱抗生素,常用于治疗呼吸道、泌尿道、肠道和皮肤软组织感染。
作为一种重要的药物,左氧氟沙星的质量标准显得尤为重要。
质量标准是评价药物质量优劣的重要标准,合理的质量标准可以保证药物的疗效和安全性,因此,左氧氟沙星的质量标准应受到重视。
首先,左氧氟沙星的理化性质是确定其质量标准的重要依据。
理化性质包括外观、溶解性、熔点、纯度等指标,这些指标直接关系到药物的质量。
例如,左氧氟沙星的外观应为白色或类白色结晶性粉末,溶于水,几乎不溶于乙醇。
此外,左氧氟沙星的熔点、纯度也是质量标准的重要指标。
只有合格的理化性质,才能保证药物的质量。
其次,左氧氟沙星的药效和安全性是质量标准的核心内容。
药效和安全性是药物的基本属性,直接关系到患者的治疗效果和用药安全。
因此,左氧氟沙星的质量标准应包括对药效和安全性的要求。
药效方面,左氧氟沙星应具有较强的抗菌活性,对感染病原体有较好的杀菌作用。
安全性方面,左氧氟沙星应具有较低的毒副作用,对人体的损害较小。
只有具备良好的药效和安全性,才能保证左氧氟沙星的质量标准。
最后,左氧氟沙星的生产工艺和质量控制是保证质量标准的重要保障。
生产工艺直接关系到药物的质量,合理的生产工艺可以保证药物的稳定性和纯度。
质量控制是对生产过程中各个环节的监控,包括原料药的采购、生产工艺的控制、成品药的检验等。
只有严格执行生产工艺和质量控制要求,才能保证左氧氟沙星的质量标准。
综上所述,左氧氟沙星的质量标准是一个综合性的评价体系,包括理化性质、药效和安全性、生产工艺和质量控制等多个方面。
只有全面考虑,合理确定质量标准,才能保证左氧氟沙星的质量,为患者的治疗提供有效的保障。
希望生产企业和监管部门能够加强对左氧氟沙星质量标准的管理,共同维护药物市场的良好秩序,保障患者的用药安全和疗效。
浅析药用氯化钠生产过程中的质量控制

2017年04月浅析药用氯化钠生产过程中的质量控制王东强(天津长芦海晶集团有限公司,天津300457)摘要:为了提高药用氯化钠的纯度,保证其质量,提出一种药用氯化钠生产过程的质量控制方法。
首先详细分析了药用氯化钠的各个生产过程,然后对易出现的质量问题进行了分析,并提出了针对性的解决方案,从而保证了药用氯化钠的质量。
关键词:药用氯化钠;生产过程;质量控制;氯化钠是人体各项生理活动中不可缺少的一种化合物,相关研究表明,钠离子在成年人体内中的总量约为60克[1],其中80%左右分布在细胞外液中,氯离子在细胞外液中也有着广泛的分布[2]。
氯化钠的生理功能主要包括:(1)使细胞外液的渗透压保持合理的状态;(2)对人体内的酸碱平衡进行调节;(3)参与生成消化液;因此,在医学应用中,高纯度的氯化钠溶液更多的被当作人体的电解质补充液,补充人体中失去的水分和电解质[3]。
此外,氯化钠溶液还可以与其它药剂一起配制氯化钠注射液使用,产生不同的功效。
因此,如何提高药用氯化钠的纯度已经成为药用氯化钠生产过程中的一个核心课题,受到了越来越多人们的重视。
1药用氯化钠的生产过程原盐是药用氯化钠的主要生产原料。
原盐是由盐田晒制的海盐或者湖盐,其主要成分为氯化钠。
原盐在结晶的过程中会不可避免的夹杂着大量的泥沙和可溶性的钙盐、镁盐等杂质。
为了消除这些杂质,获得高纯度的药用氯化钠,需要对原盐的杂质进行过滤去除。
由于氯化钠的溶解度不会随着温度的变化而发生较大改变,因此,不能通过重结晶的方法获取高纯度的氯化钠,需要首先对原盐进行溶解,将不溶于水的杂质进行沉淀去除,然后再利用化学方法消除其它可溶性的钙盐、镁盐等杂质。
具体的生产过程如下所述:(1)Na 2SO 4的清除:在原盐溶液中加入BaCl 2溶液,它能够将溶液中的SO 42-转变为易沉淀的BaSO 4沉淀物,Na +转变为NaCl 。
相关化学反应式为:BaCl 2+Na 2SO 4=BaSO 4↓+2NaCl 。
如何有效进行药用氯化钠生产过程中的质量控制

如何有效进行药用氯化钠生产过程中的质量控制摘要:本文针对药用氯化钠的生产过程进行剖析,包括清除SO42-、清除Ca2+、清除Mg2+、其他杂质去除等,通过研究去杂质阶段的控制、过滤阶段的控制、生产过程水的控制、生产过程的空气控制等质量控制措施,目的在于提升人们对药用氯化钠生产过程的控制,提升药用氯化钠的生产质量。
关键词:药用氯化钠;生产过程;质量控制氯化钠是维持人体各项机能正常运转的重要物质,通常情况下,成年人体内钠离子的总量在60g左右,并且大部分钠离子都是在细胞外液当中,是调节细胞内外渗透压的重要物质。
氯离子也是维持人体机能的重要物质,和钠离子类似,也是广泛分布于细胞外液当中。
药用氯化钠溶液可以起到调节人体电解质平衡的作用,使人体钠离子和氯离子含量始终保持在合理范围内。
1药用氯化钠的生产过程药用氯化钠的生产过程其实就是一个去除杂质的过程,这是因为药用氯化钠的生产原料主要是原盐,原盐在最初结晶的过程中,会携带许多类型的杂质,包括泥沙、各类结晶物等。
这种原盐溶液是无法作为药用氯化钠的,因此在药用氯化钠生产的过程中,需要对这些杂质进行除杂,具体除杂过程可以分为以下几方面内容。
1.1清除SO42-SO42-是原盐溶液中非常常见的杂质类型,这是因为在原盐结晶时,周围环境比较复杂,所以会形成中性盐Na2SO4,其中的SO42-进入人体后会影响细胞的内外渗透压情况,尤其是过量SO42-进入人体后,会造成严重的影响,因此在生产药用氯化钠的时候需要将SO42-清除掉,通常可以在原盐溶液中通入BaCl2溶液,Na2SO4会和BaCl2反应生成BaSO4,BaSO4属于白色沉淀物质,并且另外一种生成物为NaCl,没有生成新的杂质,所以该方法得到了非常充分的应用[1]。
1.2清除Ca2+在原盐溶液当中Ca2+的含量也是非常多的,Ca2+进入人体之后,很容易与人体内的其他离子反应生成沉淀物质,尤其是药用氯化钠通常会直接注入人体静脉,这样很有可能会威胁到人体健康。
氧氟沙星注射液的制备及质量控制

实测浓度 ( B D C8) ! " ( //4 J # ( #4/ ) ( #"4 J # ( ’"0 4 ( #’) J # ( ’"#
在 #、 " ( 0 ( " 留样观察 本品经 ’’!F 热压灭菌 "#C=> 后, "#、 各取 ! 瓶按上述方法测定浓度 G ( B D C8) , 灭菌前 )#、 /#、 ’#! 天, 结果见表 &。 浓度 G . # ( &##0* ; 表& 序号 ’ & " 0 留样浓度观察结果 (时间: 天) # # ( &##/ # ( &##) # ( &##4 # ( &##! "# # ( &##4 # ( &#’’ # ( &##) # ( &##0 # ( &#’& # ( &##4 )# # ( &#’" # ( &#’# # ( &#’& # ( &#’0 # ( &##5 # ( &#’’ /# # ( &##/ # ( &#’’ # ( &#’! # ( &##4 # ( &#’" # ( &#’’ ’#! # ( &##4 # ( &#’0 # ( &#’& # ( &#’’ # ( &#’! # ( &#’&
参考文献(1条) 1.国家药典委员会 中国药典(二部) 2000
本文链接:/Periodical_yjmzyxyxb200106090.aspx
氧氟沙星注射液的制备及质量控制
氧氟沙星注射液质量标准

氧氟沙星注射液质量标准氧氟沙星注射液是一种广泛应用于临床的抗菌药物,具有广谱、强效、耐受性好等特点。
为了确保氧氟沙星注射液的质量安全,保障患者用药的有效性和安全性,制定了相应的质量标准。
一、外观和性状。
氧氟沙星注射液应为无色或微黄色透明液体,无异物悬浮物和沉淀物,有特有的氟味。
在光线下应无色淡黄色沉淀。
二、主要成分。
氧氟沙星注射液的主要成分是氧氟沙星,其化学名称为(6S)-6-氟-1-[(2S)-2-环丙基]-7-(3-氨基-1-环丙基)-1,4-二氢喹啉-4-酮。
每支注射液含有氧氟沙星200mg。
三、规格。
氧氟沙星注射液的规格为每支2ml,每盒10支。
四、质量控制。
1. 氧氟沙星注射液的生产应符合《药品生产质量管理规范》中有关注射剂的相关要求。
2. 原料药应符合国家药典规定的质量标准,严格把关原料药的采购和质量控制。
3. 生产过程中应严格按照标准操作规程进行,确保生产过程的严谨和规范。
4. 对成品进行严格的质量检验,确保每批产品符合国家药典规定的质量标准。
五、贮存。
氧氟沙星注射液应存放在阴凉干燥处,避免阳光直射。
贮存期内,应避免冻结和高温,保持温度在15-25摄氏度之间。
六、包装。
氧氟沙星注射液应采用无菌玻璃制品包装,每支注射液应独立包装,包装完好,无破损。
七、使用。
使用氧氟沙星注射液前应先检查包装是否完好,观察外观和性状是否符合要求。
使用时应严格按照医嘱用药,避免过量使用或长期使用。
八、注意事项。
1. 使用氧氟沙星注射液时,应注意过敏史和禁忌症,避免不必要的风险。
2. 使用过程中如出现不良反应,应及时就医并停止使用氧氟沙星注射液。
总结,氧氟沙星注射液作为一种重要的抗菌药物,在临床应用中具有重要意义。
为了确保其质量安全和有效性,制定了相应的质量标准,包括外观和性状、主要成分、规格、质量控制、贮存、包装、使用和注意事项等方面。
只有严格按照这些标准要求进行生产、贮存和使用,才能保证患者用药的安全有效。
盐酸左氧氟沙星氯化钠注射液生产过程质量控制

制参数研 究。结果
选择杂质低的原料 , 在原料 、 制剂生产过程 及 临床使 用过程 中采取避 光措施 , 中间产品 p 将 H控 制 对生产过程 中的工 艺条件加 以控制 , 可有效提 高 盐酸 左氧 氟沙星氯化 钠 注射 液 的质
在 4 1~ . . 4 5范围内为 宜。结论
量 , 少 其 临 床 不 良反 应 的 发 生 。 减
Ke od :eooai hdoho d ; de erat n ; ulyC nr yw r sL vf xc yrclr e A v ̄ eco sQ at ot l l n i i i o
盐酸左氧氟沙星为氟喹诺 酮类药物 , 有选择性抑 制细 具 菌螺旋 酶( N yae 的作用 , 有抗 菌谱 广 、 D A grs ) 具 抗菌 作用 强 的特 点 , 目前广泛应用于临床 。但其制剂 产品临床应 用不 良 反应较 多 , 且其不 良反应多与其杂质含 量及种类相关 。据 文 献报道…杂 质的来源 主要分 为 2个 途径 , 是工艺 杂质 , 一 即
A src: jc v T e r n eot u rcs aa tr f eooai H doh r eadSdu ho d - b t t0bet e od tmiet pi m poes r e vf xc yrcl i n oim C l eI a i e h m p me o L l n od i r n
t lo h rc s i g c n i o a d i l ia d e s e ci n c n b e u e . r f e p o e s o d t n- n sc i c a v re ra t a e r d c d o t n i t n l o
关键词 : 盐酸左氧氟沙星 ; 良反应 ; 不 质量控 制 中图分类号 :1 7 1 文献标识码 : 文章编号 :6 2— 7 8 2 1 0 0 5 0 12 . : 9 A 1 7 7 3 o a i d o ho iea d S du C lr eIjcini r d cinp o es u lyc nrl v f x cnHy rc l d n o im ho i et p o u t rc s t oL l r d n o n o
盐酸左氧氟沙星氯化钠注射液生产工艺研究

盐酸左氧氟沙星氯化钠注射液生产工艺研究摘要】目的探讨盐酸左氧氟沙星氯化钠注射液生产中,乙二胺四乙酸二钠(EDTA-2Na)用量、配制时间、氮气加入速度和灭菌后出柜温度等因素对盐酸左氧氟沙星氯化钠注射液质量的影响,以确定其最佳生产工艺。
方法本实验对EDTA-2Na用量、加热时间、氮气加入速度和灭菌后出柜温度进行考察,检查有关物质变化情况。
结果根据实验数据的方差分析,得出生产盐酸左氧氟沙星氯化钠注射液的最佳生产工艺条件为:EDTA-2Na用量为:0.03%,氮气的加入速度0.1Pa,配制温度为60℃,灭菌后出柜温度为60℃。
结论优化后的盐酸左氧氟沙星氯化钠注射液生产工艺可行,质量可控,适用于工业化大生产。
【关键词】盐酸左氧氟沙星氯化钠注射液生产工艺【中图分类号】R943 【文献标识码】A 【文章编号】2095-1752(2013)02-0032-02左氧氟沙星(Levofloxacin,LVFX)是第三代喹诺酮类抗菌药,其结构为氧氟沙星的左旋光学异构体,其抗菌活性约为氧氟沙星的2倍[1],不良反应低。
对革兰阳性菌及革兰阴性菌均有良好的抗菌活性,在临床应用广泛[2]。
盐酸左氧氟沙星氯化钠注射液(以下简称LVFX-SC注射液)生产过程中,投料温度、活性炭用量、氮气加入速度及加热时间等因素会影响其产品的含量、有关物质、澄明度等质量项目。
为了探讨这些因素对盐酸左氧氟沙星氯化钠注射液的质量项目的影响程度,拟用正交试验进行探讨。
1 仪器与试药仪器:Agilent 1100高效液相仪(美国安捷伦公司);751GW分光光度计(上海分析仪器厂);pHS-3C型精密pH计(上海雷磁仪器厂);YB-3澄明度检测仪(天津大学精密仪器厂)试药:盐酸左氧氟沙星(上虞京新药业有限公司,批号:DK20-1104122);氯化钠(中盐鸿博集团云梦云虹制药有限公司,批号:20110705);乙二胺四乙酸二钠(EDTA-2Na,湖南尔康制药有限公司,批号:20110406);活性炭(上海活性炭厂有限公司,批号:1154021)。
左氧氟沙星注射液的制备及质量控制

左氧氟沙星注射液的制备及质量控制张念森;李玉兰;张海霞;高新富;李珂;王春检【期刊名称】《中国药业》【年(卷),期】2003(012)003【摘要】目的:制备合格的盐酸左氧氟沙星氯化钠注射液.方法:用氯化钠调节注射液渗透压,用盐酸调节pH值,使pH值在4.0~6.0范围内;采用紫外分光光度法测定左氧氟沙星的含量.结果:制备的左氧氟沙星注射液符合国家标准,其回收率为99.36%,RSD=0.945%(n=5).结论:制备方法合理,左氧氟沙星注射液质量可控,稳定性好.【总页数】2页(P56-57)【作者】张念森;李玉兰;张海霞;高新富;李珂;王春检【作者单位】山东滨州医学院附属医院药剂科,山东,滨州,256603;山东滨州医学院附属医院药剂科,山东,滨州,256603;山东滨州医学院附属医院药剂科,山东,滨州,256603;山东滨州医学院附属医院药剂科,山东,滨州,256603;山东滨州医学院附属医院药剂科,山东,滨州,256603;山东滨州医学院附属医院药剂科,山东,滨州,256603【正文语种】中文【中图分类】TQ460.6;R927.2【相关文献】1.青紫颗粒制备工艺及质量控制方法研究 [J], 马葆睿;曲昌海;倪健;庞琳诺;蔡梦如;覃柳莹;白杰;张志勤;张萌;王晓玲2.加味五子衍宗浓缩丸制备工艺及质量控制研究 [J], 欧阳若水;钟兰英;文桂卿;钟倪俊;卓进盛;邢益涛;王利胜3.果蔬农药残留检测样本制备与质量控制技术研究 [J], 孟摆;罗婷婷;金保元;邢尔凡4.青紫颗粒制备工艺及质量控制方法研究 [J], 马葆睿;倪健;庞琳诺;蔡梦如;覃柳莹;白杰;张志勤;张萌;王晓玲;曲昌海5.卵蛋白源胰脂肪酶抑制肽的制备及其对小鼠体质量控制效果 [J], 王璐;武雅珍;焦明雅;李志成因版权原因,仅展示原文概要,查看原文内容请购买。
氯化钠注射药物 的生产质量管理

氯化钠注射药物的生产质量管理摘要无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
无菌药品的生产质量管理对于消费者在药品方面的安全使用有着极为重要的意义。
在此,以氯化钠注射药物为例,讲述无菌药物生产质量管理。
以最终灭菌药品氯化钠注射液为例,讲述其生产质量管理的具体内容。
一、厂区车间平面布置图工艺流程:(一)生产用物料包括原辅料、纯化水、注射用水、包装材料。
原辅料、包装材料(包括安瓿)应检验合格后使用。
纯化水为原水制得,清洗安瓿使用;注射用水为纯化水制得,清洗安瓿和配制使用,均应定时检查,制得后及时使用。
(二)纯化水、注射用水1、原水处理(纯化水的制备)原水处理方法有离子交换法、电渗析法及反渗透法。
离子交换法制得的去离子水可能存在热原、乳光等问题,主要供蒸馏法制备注射用水使用,也可用于洗瓶,但不得用来配制注射液。
2、注射用水的制备注射用水为蒸馏水或去离子水经蒸馏所得的水,又称重蒸馏水。
其质量要求见《中国药典》,除氯化物、硫酸盐、钙盐、硝酸盐、亚硝酸盐、二氧化碳、易氧化物、不挥发物与重金属按蒸馏水检查应符合规定外,还规定pH应为5.0~7.0,氨含量不超过0.00002%,热原检查应符合规定,应于制备后12h内使用。
(三)人员操作人员应身体健康,每年体检一次,并建立健康档案。
操作作人员按生产区域进行划分,严格遵守工作服穿戴制度,并不得将工作服穿出该区域。
不得将头发、胡须外露,不得化妆,不得佩带饰物、手表,操作前后、接触污物后均应洗手并且消毒。
工作服应定期清洗,更换。
(四)、领料按生产指令领取处方原料,核对物料品名,批号、规格、数量应相符,所领物料应有检验合格报告书。
(五)、配料领取的原料核对品名、批号、数量、合格证,按生产处方配料,装入清洁容器转入下一工序。
称量时需由第二人复核。
(六)、安瓿清洗将安瓿轩洗瓶机内,依次用饮用水、纯化水、注射用水进行清洗,清洗后干燥灭菌,置相应区域,检验合格后及时使用。
氧氟沙星氯化钠注射液工艺

盐酸左氧氟沙星氯化钠注射液工艺验证摘要:为验证盐酸左氧氟沙星氯化钠注射液的制备工艺,在制备过程中对左氧氟沙星、氯化钠、EDTA-2Na、药用炭[1]的用量及配制时间、灭菌温度等可能会影响到成品质量的因素进行严格控制,从而对盐酸左氧氟沙星氯化钠注射液的工艺进行再验证。
结果:按照处方工艺配制盐酸左氧氟沙星氯化钠注射液,通过检测其性状为淡黄绿色澄明液体;pH在4.6-4.7范围之内;装量在100-102mL(111.66g-113.67g)范围内;内毒素< 0.6EU/mg;氯化钠的平均含量为101.50%,相对偏差为0 小于2010年版药典规定的3%。
左氧氟沙星的平均含量为99.40%;相对偏差为0.2%小于2010年版药典规定的 1.5%;澄明度检查无白点、白块、纤维、色点、塑胶屑等不合格品。
以上结果表明,按照处方工艺进行生产,生产出的盐酸左氧氟沙星氯化钠注射液各项指标均符合国家药典标准,证实该系统能持续稳定地生产出符合质量标准和预定用途的盐酸左氧氟沙星氯化钠注射液。
关键词:盐酸左氧氟沙星氯化钠注射液;制备;性状;pH;装量;内毒素;含量;澄明度Levofloxacin hydrochloride and sodium chloride injection processrevalidationLI FAN-fan1(Class 1 of Pharmaceutic Preparation, Graduated in 2015)Abstract Objective: levofloxacin hydrochloride a nd sodium chloride injection process in the preparation of centre-left ofloxacin, sodium chlo ride, EDTA - 2 na, the dosage of the medicinal charcoal and preparation time, sterilization temperature will affect the quality of products, through strict control of the process of levofloxacin hydrochloride and sodium chloride injection process for revalidation. Methods: according to the prescription craft compound levofloxacin hydrochloride and sodium chloride injection, good control during the process of preparation may be all the external factors affect the finished product. Results: according to the prescription craft to produce the levofloxacin hydrochloride and sodium chloride injection of various indexes meet the national pharmacopoeia standards. Conclusion: Carried out in accordance with the prescription craft production, confirm the system steady and can produce meet quality standards and the usage of levofloxacin hydrochloride and sodium chloride injection.Keywords: levofloxacin hydrochloride and sodium chloride injection, preparation, test左氧氟沙星(Levofloxacin LVFX)是第三代喹诺酮类抗菌药,是氧氟沙星的左旋体,其抗菌活性约为氧氟沙星的2倍,它的主要作用机制为抑制细菌DNA旋转酶活性,抑制DNA复制。
盐酸左氧氟沙星注射液生产工艺

盐酸左氧氟沙星注射液生产工艺一、引言盐酸左氧氟沙星注射液是一种广泛应用于临床的抗菌药物,用于治疗各类感染疾病。
本文将对盐酸左氧氟沙星注射液的生产工艺进行全面、详细、完整和深入地探讨。
二、盐酸左氧氟沙星注射液的成分盐酸左氧氟沙星注射液的主要成分是左氧氟沙星(Levofloxacin Hydrochloride),其化学名为(+) -9-(2,3-二氟苯基)氟苯基-6-氟氮杂二环[2,3-d]-1,4-嘧啶-3(2H)-酮的盐酸盐。
三、盐酸左氧氟沙星注射液的生产工艺3.1 原料准备1.左氧氟沙星的制备:根据药典中的配方和制备方法,采用合成工艺将左氧氟沙星合成。
2.辅料的准备:根据药典要求,准备辅料包括生理盐水、无菌水、适量的酸和碱等。
3.2 注射液的制备1.左氧氟沙星的溶解:将合成好的左氧氟沙星溶解于适量的生理盐水中,得到一定浓度的左氧氟沙星溶液。
2.调整pH值:用适量的酸和碱调整左氧氟沙星溶液的pH值,保证其符合要求。
3.灭菌处理:使用高温高压的方法对左氧氟沙星溶液进行灭菌处理。
4.分装:将灭菌后的左氧氟沙星溶液分装至无菌注射器中,每支注射器中含有合适剂量的左氧氟沙星溶液。
5.储存:对分装好的盐酸左氧氟沙星注射液进行密封和储存,保证其在一定温度和湿度条件下的稳定性和安全性。
3.3 质量控制1.外观检查:对盐酸左氧氟沙星注射液的外观进行检查,包括透明度、色泽等指标。
2.pH值测定:使用专用的pH计仪器对盐酸左氧氟沙星注射液的pH值进行测定,确保其符合规定的范围。
3.杀菌效果检测:通过无菌实验室的培养和检测,测试盐酸左氧氟沙星注射液的杀菌效果。
4.包装完整性检查:对盐酸左氧氟沙星注射液的包装进行检查,确保其密封完好,无破损和漏液。
5.含量测定:使用分析仪器对盐酸左氧氟沙星注射液中左氧氟沙星的含量进行测定,确保其符合规定的范围。
四、盐酸左氧氟沙星注射液生产工艺的优化为了提高盐酸左氧氟沙星注射液的生产效率和质量,可以从以下几个方面进行优化:4.1 原料采购选择优质的原料供应商,确保从源头上控制原料的质量,避免原料带来的质量问题。
氧氟沙星注射液(成品)检验操作规程

GMP管理文件一、目的:为规定氧氟沙星注射液生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于氧氟沙星注射液成品的检验。
三、责任者:生产部经理、检验员、生产人员四、正文:质量标准:见氧氟沙星注射液(成品)内控质量标准操作内容:【性状】本品为淡黄色或淡黄绿色澄明液体一。
【鉴别】(1)取本品适量(约相当于氧氟沙星20mg),置水浴上蒸干,加丙二酸30mg,加醋酐约10滴,置沸水浴上加热3分钟,显红棕色。
(2)取本品适量,加0.1mol/l盐酸溶液制成每1ml中含氧氟沙星10mg的溶液,作为供试品溶液;另取氧氟沙星对照品适量,加0.1mol/l盐酸溶液制成每1ml中含10mg的溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述两种溶液各5ul,分别点于同一硅胶GF254薄层板上,以氯仿-甲醇-氨溶液(4→100)(10:5:1)为展开剂,展开后,晾干,置紫外光灯(254nm)下检视,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
(3)取含量测定项下的溶液,照分光光度法测定,在294nm波长处有最大吸收。
【检查】 PH值应为3.6~4.9。
颜色取本品,加水稀释成每1ml中含2mg的溶液,与黄色5号或黄绿色5号标准比色液比较,不得更深。
热原取本品,加灭菌注射用水制成每1ml中含氧氟沙星10mg的溶液,依法检查,剂量按家兔每1kg体重注射2ml,应符合规定。
其他应符合注射剂项下有关的各项规定。
【含量测定】精密量取本品适量(约相当于氧氟水沙星60mg),置200ml量瓶中,加0.1mol/l盐溶液稀释至刻度,摇匀;精密量取2ml,置100ml量瓶中,用0.1mol/l盐酸溶液稀释至刻度,摇匀,照分光光度法,在294nm波长处测定吸收度;另取在105℃干燥至恒重的氧氟沙星对照品约60mg,同法测定;计算,即得。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pH 6. 0 0. 008 0. 019 0. 019 未检出 0. 010 0. 022 0. 022 未检出
2. 4 不同厂家原料质量对比情况 不同厂家的原料因生产 工艺存在一定差异,故其杂质种类及数量也不尽相同。选用 不同厂家的原料进行对比检验。综合比较,③的杂质 A 最 小; ①、③杂质 B 最小; ①、②的杂质 E 最小; 其他厂家原料杂 质 B 及 E 峰面积均较大; ③及⑤的原料药右旋异构体含量同 比其他厂家偏高,检验结果见表 4。
0. 014 0. 014 0. 014
0. 008 0. 007 0. 009
0. 007 0. 007 0. 007
未检出 未检出 未检出
0. 24
0. 24
0. 24
2. 3 不同 pH 值对产品有关物质影响的试验 按照处方配 制盐酸左氧氟沙星氯化钠注射液 5 L,原液灌装 5 瓶; 剩余药
液用 NaOH 分别调节 pH 至 4. 5、5. 0、5. 5、6. 0 左右,各灌装 5 瓶,压盖。每个条件留 2 瓶,剩余 3 瓶做好标记随同产品灭 菌。灭菌前、后产品一起检验有关物质及右旋异构体。由检 测结果可见,pH 值不同,杂质含量不同。产品灭菌前后,随 着 pH 值的升高,杂质 B 及杂质 E 均有所升高,尤其是 pH 在 5. 0 以上时,杂质 B 明显升高; 灭菌后比灭菌前杂质略有升 高; 在 pH 为 4. 1 ~ 4. 5 之间,灭菌前后各杂质均无明显变化。 本次试验中,均未检出 N - 氧化杂质,结果见表 3。
右旋异构体 ( %) 0. 24 0. 16 0. 30 0. 21 0. 38
3 讨论与小结
不同的工艺控制手段一定程度上决定着盐酸左氧氟沙
星注射剂的有关物质及异构体的量,从而对不良反应存在显
著影响。
3. 1 控制制剂质量必须先控制原料质量。制剂厂家在选择
原料时应注意比较其杂质,特别是要选用与不良反应有关的
2. 2 药液存放时间试验 分别取正常灌装的产品以及盛放 在不锈钢容器中密封药液,各存放 8、10、12、14 h 后,对比检 验有关物质及光学异构体的区别。结果可知,药液与不锈钢 容器的接触时间长短对杂质 A、B 及 E、右旋异构体均无明显 影响,N - 氧化杂质均未检出,具体实验数据见表 2。
表 2 药液存放时间试验各杂质一览表
条件下时,这个降解产物会有明显的增加。杂质 B 及 N - 氧 化杂质存在光毒性,与盐酸左氧氟沙星的不良反应有一定关 系[2],杂质 A 及 E 与盐酸左氧氟沙星不良反应的相关性未 查找到相关文献。
为降低盐酸左氧氟沙星氯化钠注射液的不良反应,针对 盐酸左氧氟沙星引起不良反应的可能因素,以杂质 B 及 N - 氧化杂质等有关物质及光学异构体为指标,设计系列试验, 进行相关研究分析。
表 1 光照试验各杂质一览表
有关物质 杂质 A( % ) 杂质 B( % ) 杂质 E( % ) N - 氧化杂质 右旋异构体( % )
0d 0. 017 0. 007 0. 011 未检出 0. 25
光照 5 d 0. 014 0. 109 0. 120 未检出 0. 25
光照 10 d 0. 018 0. 200 0. 220 未检出 0. 25
表 4 不同厂家原料各杂质峰面积一览表
生产厂家 ①
杂质 A ( %) 0. 040
② 0. 030
③ 未检出
④ 0. 010
⑤ 0. 026
杂质 B ( %) 未检出 0. 008 未检出 0. 010 0. 007
杂质 E N - 氧化杂质
( %) 0. 006 未检出 0. 006 未检出 0. 050 未检出 0. 039 未检出 0. 035 未检出
·452·
齐鲁药事·Qilu Pharmaceutical Affairs 2012 Vol. 31,No. 8
盐酸左氧氟沙星氯化钠注射液生产过程质量控制
倪华丽1,2 ,董 旭2 ,黄桂华1
( 1. 山东大学药学院,山东 济南 255012; 2. 山东齐都药业有限公司,山东 淄博 255400)
摘要: 目的 确定盐酸左氧氟沙星氯化钠注射液最佳生产过程参数,减少临床不良反应的发生。方法 通过光照试 验、药液存放时间试验、药液 pH 值试验、不同厂家原料对比进行盐酸左氧氟沙星氯化钠注射液的最佳生产过程质量控 制参数研究。结果 选择杂质低的原料,在原料、制剂生产过程及临床使用过程中采取避光措施,将中间产品 pH 控制 在 4. 1 ~ 4. 5 范围内为宜。结论 对生产过程中的工艺条件加以控制,可有效提高盐酸左氧氟沙星氯化钠注射液的质 量,减少其临床不良反应的发生。
有关物质 正常灌装 杂质 A( % ) 0. 039 杂质 B( % ) 0. 007 杂质 E( % ) 0. 007 N - 氧化杂质 未检出 右旋异构体( % ) 0. 24
存放 8 h 0. 040 0. 006 0. 007 未检出 0. 24
存放 10 h 存放 12 h 存放 14 h
Key words: Levofloxacin hydrochloride; Adverse reactions; Quality Control
盐酸左氧氟沙星为氟喹诺酮类药物,具有选择性抑制细 菌螺旋酶( DNA gyrase) 的作用,具有抗菌谱广、抗菌作用强 的特点,目前广泛应用于临床。但其制剂产品临床应用不良 反应较多,且其不良反应多与其杂质含量及种类相关。据文 献报道[1]杂质的来源主要分为 2 个途径,一是工艺杂质,即 生产中可能带入的起始原料、试剂、中间体、副产物和异构体 等; 二是降解产物,即药品在贮藏、运输、使用过程中由于自 身性质不稳定而产生的各种杂质。
N - 氧化杂质 未检出 未检出 未检出 未检出
杂质 A( % ) 0. 008 0. 009 0. 008 0. 009
杂质 B( % ) 灭菌后
杂质 E( % )
0. 004 0. 016
0. 004 0. 009 0. 009 0. 021 0. 018 0. 016
N - 氧化杂质 未检出 未检出 未检出 未检出
表 3 不同 pH 值对比试验各杂质一览表
有关物质 pH 4. 1( 原液) pH 4. 5 pH 5. 0 pH 5. 5
杂质 A( % ) 0. 008 0. 009 0. 008 0. 008
杂质 B( % ) 灭菌前
杂质 E( % )
0. 004 0. 016
ቤተ መጻሕፍቲ ባይዱ
0. 004 0. 005 0. 008 0. 016 0. 016 0. 017
关键词: 盐酸左氧氟沙星; 不良反应; 质量控制 中图分类号: R927. 1 文献标识码: A 文章编号: 1672 - 7738( 2012) 08 - 0452 - 03
Quality control of Levofloxacin Hydrochloride and Sodium Chloride Injection in production process NI Hua-li1,2 ,DONG Xu2 ,HUANG Gui-hua1
选取不同厂家的盐酸左氧氟沙星原料药进行对比研究,
齐鲁药事·Qilu Pharmaceutical Affairs 2012 Vol. 31,No. 8
·453·
确定不同原料生产工艺对产品杂质的影响; 同时选取不同工 艺条件进行对比研究,确定不同的制剂生产工艺对产品杂质 的影响因素。 1 仪器与试剂 1. 1 仪 器 Agilent1200 高 效 液 相 色 谱 仪 ( 美 国 安 捷 伦 公 司) 。 1. 2 试剂 盐酸左氧氟沙星对照品( 中国药品生物制品检 定所) ,盐酸左氧氟沙星杂质 A、杂质 B、杂质 E 及 N - 氧化杂 质 ( 上虞京新药业有限公司) ,盐酸左氧氟沙星( 上虞京新药 业有限公司、浙江普洛康裕制药有限公司、浙江司太立制药 有限公司、河南天方药业股份有限公司、江西大地制药有限 责任公司) ,盐酸左氧氟沙星氯化钠注射液( 山东齐都药业有 限公司) ,盐酸( 莱阳市康德化工有限公司) ,三乙胺( 天津市 广成化学试剂有限公司) ,乙腈( 天津市科密欧化学试剂有限 公司) ,甲醇( 天津市科密欧化学试剂有限公司) 。( 说明: 下文 中分别用①、②、③、④、⑤代替各盐酸左氧氟沙星原料药生产 厂家名称,代号排列顺序与中文厂家排列顺序无对应关系) 。 2 方法与结果 2. 1 光照试验 取盐酸左氧氟沙星氯化钠注射液置光照度 为 2 500 ~ 3 000 Lx 光照箱中放置 10 d,分别于第 5 天及第 10 天取出数瓶,连同避光保存样品一起对比检验有关物质及光 学异构体。结果杂质 B 及 E 受光照的影响较大,杂质 B 在光 照 5 d 及 10 d 的峰面积分别为 0 天的 16 倍及 29. 4 倍,杂质 E 在光照 5 d 及 10 d 的面积百分比分别为 0 d 的 10. 9 倍及 20. 0 倍。光照对杂质 A 及光学异构体几乎无影响。本试验 中均未检出 N - 氧化杂质,考察结果见表 1。
( 1. School of Pharmaceutical Sciences,Shandong University,Jinan 250012,China; 2. Shandong Qidu Pharmaceutical Co. ,Ltd. ,Zibo 255400,China)
Abstract: Objective To determine the optimum process parameter of Levofloxacin Hydrochloride and Sodium Chloride Injection for reduction of clinical adverse reaction. Methods The optimum process parameter was investigated through light test, test of liquid storage time and different pH and comparison of raw materials from different manufactures. Results It was appropriate to select materials low in impurity,take measures to avoid light and control the pH of intermediate product to 4. 1 ~ 4. 5. Conclusion The quality of Levofloxacin Hydrochloride and Sodium Chloride Injection can be effectively improved through control of the processing condition,and its clinical adverse reaction can be reduced.
