高中化学选修三__全套课件
合集下载
人教版高中化学选修三课件:物质结构与性质 (共46张PPT)

例题5
(4)请用原子结构的知识解释C燃烧时发出
黄色的原因:
。
燃烧时,电子获得能量从能量低的轨道
跃迁到能量高的轨道上,跃迁到能量高的轨
道的电子处于不稳定状态,随即跃迁回原来
轨道,并向外界释放能量(光能)
2
微
粒 间
化学 键
作
用
与
物
质
的
分子
性
性质
质
共价键
配位键和配位 化合物 金属键
σ键和π键 键参数 杂化轨道理论
例题4
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高
化合价氧化物的水
化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分
子呈正四面体结构,W的氧化物的晶体类型
是
;
(2)Q的具有相同化合价且可以相互转变的氧化物
是
;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物
(子Cu4。2)+已形往知成硫N配酸F3离铜与子溶N,H液3其的中原空加因间入是构过_型量__都氨_是水__三,__角可__锥生__形成_,_[C_单u。(NNFH32不)2]易2+与配离 解析:NF3分子中氟原子非金属性强是吸电子的,使得 氮原子上的孤对电子难于与Cu2+形成配位键。
(5)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请 解释原因__________。 解析: Cu2O和Cu2S均为离子化合物,离子化合物的熔点 与离子键的强弱有关。 由于氧离子的例子半径小于硫离子的离子半径,所以亚铜 离子与氧离子形成的离 子点键比C强u于2S亚的铜高离。子与硫离子形成的离子键,所以Cu2O的熔
A.共价键的方向性 B.共价键的饱和性 C.共价键原子的大小 D.共价键的稳定性
人教版高中化学选修三课件第三章第一节.pptx

(3)晶体呈现自范性的原因:晶体的自范性是 晶体中粒子在微观空间里呈现 _周__期__性__的__有__序__排__列____的宏观表象。 想一想 1.固体粉末一定不是晶体吗? 提示:不一定。许多固体粉末用肉眼看不到 晶体外形,但在光学显微镜或电子显微镜下 可观察到规则的晶体外形,因此许多固体粉 末是晶体。
空白演示
• 在此输入您的封面副标题
第三章 晶体结构与性质
第三章 晶体结构与性质
第一节 晶体的常识
课程标准导航 1.了解晶体的特点。 2.了解晶体与非晶体的本质区别和性质上的 区别差异。 3.了解晶胞的概念,能够计算晶胞中的粒子 个数。
新知初探自学导引
自主学习
一、晶体与非晶体
1.晶体与非晶体的本质差异
解析:选C。晶体内粒子在三维空间里呈周 期性有序排列,这一结构特征决定了晶体具 有自范性、固定的熔点。硝酸钾粉末用肉眼 看不到晶体外形,但在光学显微镜或电子显 微镜下可观察到规则的晶体外形,因此硝酸 钾粉末是晶体。
要点2 晶体化学式的确定方法 探究导引2 怎样描述晶体中粒子在微观空间 的排列? 提示:描述晶体中粒子在微观空间的排列时, 只需描述晶胞的结构。 探究导引3 晶体和晶胞有什么关系? 提示:晶胞是晶体微观空间里的一个基本单 元,整块晶体可以看作是数量巨大的晶胞“ 无隙并置”而成。
(1)无隙:是指相邻晶胞之间没有任何间隙。 (2)并置:是指所有晶胞都是_平__行__排列的,取 向_相__同___。 (3)整块晶体中所有晶胞的__形__状___及内部的原 子_种__类__、个数及_几__何__排__列__是完全相同的。
想一想 2.由晶胞构成的晶体,其化学式是否表示一 个分子中原子的数目? 提示:不表示,只表示每个晶胞中各类原子 的最简整数比。
人教版高中化学选修三1.1《原子结构》课件 (共106张PPT)

电子排布式
电子排布图
小结:
方法导引
解答基态原子电子排布问题的一般思路:
能量最低原则
确定原子序数 泡利不相容原理 洪特规则
能级排布
电子排布
巩固练习
1、某元素原子序数为24,试问:
(1)该元素电子排布式: 1s2 2s22p6 3s23p63d5 4s1
(2)它有 4 个能层; 7 个能级;占有 15 个原子轨道。 (3)此元素有 6 个未成对电子;它的价电子 数是 6 。
洪特规则
对于基态原子,电子在能量相同 的轨道上排布时,将尽可能分占不同 的轨道并且自旋方向相同。
C :1s2 2s22p2
√
科学研究
C
N
O
1.每个原子轨道上最多能容纳____ 2 个电子, 且自旋方向_______ 不同 ——泡利原理 2.当电子排在同一能级时有什么规律? 当电子排布在同一能级的不同轨道时, 首先单独占一个轨道,而且自旋 总是___________________ 相同 ——洪特规则 方向______
铁Fe: 1s22s22p63s23p63d64s2 钴Co:
;
; ; ;
1s22s22p63s23p63d74s2
镍Ni: 1s22s22p63s23p63d84s2
练习:请写出第四周期21—36号元素原子 的基态电子排布式。
铜Cu:1s22s22p63s23p63d104s1 锌Zn:1s22s22p63s23p63d104s2 ; ;
钠 Na
铝 Al
原子结构示意图
电子排布式
Li: 1s22s1
练一练
请写出4~10号元素原子的电子排布式。
4
铍Be
1s2 2s2
人教版高中化学选修三《物质结构与性质》优质课件【全套】

1926年,奥地利物理学家薛定谔等 以量子力学为基础提出电子云模型
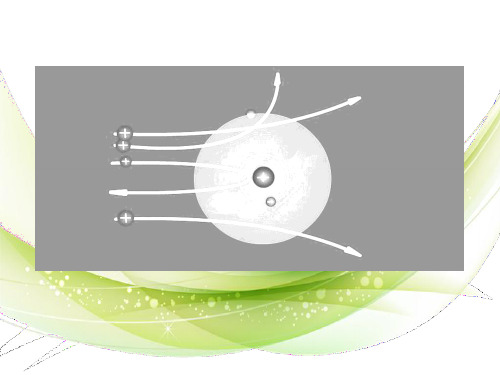
质子(正电) 原子核 原子 (正电) 中子(不带电)
不显 电性 核外电子 分层排布
(负电) 与物质化学性质密切相关
学与问
核外电子是怎样排布的?
二、能层与能级
1、能层
电子层
能层名称 一 二 三 四 五 六 七 能层符号 K L M N O P Q
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
32
数 2n2 2n2
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s
→ 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
一、开天辟地——原子的诞生
1、原子的诞生
宇宙大爆炸2小时:大量氢原子、少量氦原子 极少量锂原子
140亿年后的今天: 氢原子占88.6% 氦原子为氢原子数1/8 其他原球中的元素
绝大多数为金属元素 包括稀有气体在内的非金属仅22种 地壳中含量在前五位:O、Si、Al、Fe、Ca
22 钛 Ti 1s2 2s22p6 3s23p63d2 4s2
序数 名称 符号 K
L
M
N
1 氢 H 1s1
2 氦 He 1s2
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5
硼
B 1s2 2s22p1
6
人教版高中化学选修3课件-原子结构与元素周期表

知识点二 元素周期表的分区
1.根据原子的外层电子结构特征分区 (1)周期表中的元素可根据原子的外层电子结构特征划分为 如下图所示的 5 个区。
①s 区元素:最外层只有 1~2 个 s 电子,价电子分布在 s 轨道上,价电子构型为 ns1~2,包括ⅠA 族、ⅡA 族的所有元素。
②p 区元素:最外层除有两个 s 电子外,还有 1~6 个 p 电 子(He 无 p 电子),价电子构型为 ns2np1~6,包括ⅢA→ⅦA 族和 零族的所有元素。
a.元素的分区规律:按照元素的原子核外电子最后排布的能 级分区,如 s 区元素的原子的核外电子最后排布在 ns 能级上,d 区、ds 区元素的原子核外电子最后排布在n-1d 能级上。
b.s 区、p 区均为主族元素包括稀有气体,且除 H 外,非 金属元素均位于 p 区。
c.应根据外围电子排布判断元素的分区,不能根据最外层电 子排布判断元素的分区。p 区中,He 的外围电子排布1s2较特 殊。
第一章
原子结构与性质
第二节 原子结构与元素的性质
第一课时 原子结构与元素周期表
[学习目标] 1.通过碱金属和稀有气体的元素核外电子排布 对比进一步认识电子排布和价电子层的含义。
2.通过元素周期表认识周期表中各区、各周期、各族元素 原子核外电子的排布规律。
3.通过“螺壳上的螺旋”体会周期表中各区、各周期、各 族元素的原子结构和位置间的关系。
①原子序数-稀有气体原子序数(相近且小)=元素所在的 纵行数。第 1、2 纵行为ⅠA、ⅡA 族,第 3~7 纵行为ⅢB~ⅦB 族,第 8~10 纵行为Ⅷ族,第 11、12 纵行为ⅠB、ⅡB 族,第 13~17 纵行为ⅢA~ⅦA 族,第 18 纵行为 0 族。而该元素的周 期数=稀有气体元素的周期数+1。
高中化学选修三全套共张PPT课件
①电子云
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
处于一定空间运动状态的电子在原子核外空间
的概率密度分布的形象化描述
小黑点:概率密度
单位体积内出现的概率
小黑点越密概率密度越大
小黑点不是电子!
23
②电子云轮廓图
电子出现的概率约为90%的空间
即精简版电子云
③电子云轮廓图特点
a.形状
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
nd能级的电子云轮廓图:多纺锤形
能级符号:ns、np、nd、nf…… n代表能层
最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一
K
二
L
三
M
四……
N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
14
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
2、电离能
①第一电离能
气态电中性基态原子失去一个电子转
化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
②逐级电离能
利用逐级电离能判断化合价
43
3、电负性(第三课时)
键合电子:参与化学键形成
原子的价电子
孤对电子:未参与化学键形成
①电负性
不同元素的原子对键合电子吸引能力
②特点
头碰头
重叠程度大,稳定性高
轴对称
可绕键轴旋转
H
Cl
s-p σ键
H
H
56
5、π键
定义:两个原子轨道以平行
即“肩并肩”方式重叠
人教版高中化学选修3课件第一节晶体的常识

务
3.有规则的几何外形的固体一定是晶体吗? 提示 有规则几何外形或美观、对称外形的固体不一定是晶体。例如,玻璃制品 可以塑造出规则的几何外形,也可以具有美观对称的外观。
4.有固定组成的物质一定是晶体吗? 提示 具有固定组成的物质也不一定是晶体,如某些无定形体也有固定的组成, 如无定形SiO2。
完成课前学 习
探究核心任 务
(8)同一物质可能是晶体,也可能是无定形体。( ) (9)区分晶体和非晶体最可靠的科学方法是确定有没有固定熔点。( ) (10)雪花是水蒸气凝华得到的晶体。( ) (11)溶质从溶液中析出可以得到晶体。( ) 答案 (1)× (2)√ (3)× (4)√ (5)× (6)× (7)× (8)√ (9)× (11)√
第一节 晶体的常识
完成课前学 习
探究核心任 务
学业要求
素养对接
1.能说出晶体与非晶体的区别。
2.能结合实例描述晶体中微粒排列的 微观探析:晶体与非晶体的区别。
周期性规律。
模型认知:晶胞的判断与相关计算。
3.认识简单的晶胞。
完成课前学 习
探究核心任 务
一、晶体 1.晶体与非晶体的本质差异
晶体 非晶体
提示 不表示,只表示每个晶胞中各类原子的最简整数比。
完成课前学 习
探究核心任 务
[自 我 检 测]
1.判断正误,正确的打“√”;错误的打“×”。 (1)有规则几何外形的固体就是晶体。( ) (2)熔融态的晶体冷却凝固,得到的固体不一定呈规则的几何外形。( ) (3)晶胞都是平行六面体。( ) (4)晶胞是晶体的最小重复单元。( ) (5)不同的晶体中晶胞的大小和形状都相同。( ) (6)晶胞中的任何一个粒子都只属于该晶胞。( ) (7)已知晶胞的组成也无法推知晶体的组成。( )
3.有规则的几何外形的固体一定是晶体吗? 提示 有规则几何外形或美观、对称外形的固体不一定是晶体。例如,玻璃制品 可以塑造出规则的几何外形,也可以具有美观对称的外观。
4.有固定组成的物质一定是晶体吗? 提示 具有固定组成的物质也不一定是晶体,如某些无定形体也有固定的组成, 如无定形SiO2。
完成课前学 习
探究核心任 务
(8)同一物质可能是晶体,也可能是无定形体。( ) (9)区分晶体和非晶体最可靠的科学方法是确定有没有固定熔点。( ) (10)雪花是水蒸气凝华得到的晶体。( ) (11)溶质从溶液中析出可以得到晶体。( ) 答案 (1)× (2)√ (3)× (4)√ (5)× (6)× (7)× (8)√ (9)× (11)√
第一节 晶体的常识
完成课前学 习
探究核心任 务
学业要求
素养对接
1.能说出晶体与非晶体的区别。
2.能结合实例描述晶体中微粒排列的 微观探析:晶体与非晶体的区别。
周期性规律。
模型认知:晶胞的判断与相关计算。
3.认识简单的晶胞。
完成课前学 习
探究核心任 务
一、晶体 1.晶体与非晶体的本质差异
晶体 非晶体
提示 不表示,只表示每个晶胞中各类原子的最简整数比。
完成课前学 习
探究核心任 务
[自 我 检 测]
1.判断正误,正确的打“√”;错误的打“×”。 (1)有规则几何外形的固体就是晶体。( ) (2)熔融态的晶体冷却凝固,得到的固体不一定呈规则的几何外形。( ) (3)晶胞都是平行六面体。( ) (4)晶胞是晶体的最小重复单元。( ) (5)不同的晶体中晶胞的大小和形状都相同。( ) (6)晶胞中的任何一个粒子都只属于该晶胞。( ) (7)已知晶胞的组成也无法推知晶体的组成。( )
化学选修三《原子结构与元素的性质》PPT课件(原文)

❖ 5、掌握原子半径的变化规律 ❖ 6、能说出元素电离能的涵义,能应用元素的电离
能说明元素的某些性质
❖ 7、进一步形成有关物质结构的基本观念,初步认 识物质的结构与性质之间的关系
❖ 8、认识主族元素电离能的变化与核外电子排布的 关系
❖ 9、认识原子结构与元素周期系的关系,了解元素 周期系的应用价值
(G)碱 酸 s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
最高价氧化物对应的水化物的酸性逐渐
;
(横行) 第6周期:32 种元素 查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这
些元素的电负性解释对角线规则。
元素(除第一周期外)是 __碱_金__属___, 1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
试确定32号元素在周期表中的位置。 d区元素:包含第IIIB族到VIII族元素。
最外层电
子排布为_n_s____,每一周期的最后一种元素都 1 每个纵行的价电子层的电子总数是否相等?主族元素的价电子数和族序数有何关系?
样多,而是随着周期序号的递增渐渐增多。
元素周期系周期发展像螺壳上的螺旋
一、原子结构与元素周期表
1. 为什么副族元素又称为过渡元素?
副族元素处于金属元素向非金属元素过渡的 区域,因此,又把副族元素称为过渡元素。
2.为什么在元素周期表中非金属元素主要集中在右上角 三角区内(如图)?处于非金属三角区边缘的元素常被 称为半金属或准金属。为什么?
镧 La – 镥 Lu 共15 种元素称镧系元素 已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
电负性相差不大的两种非金属元素化合,通常形成共价键;
能说明元素的某些性质
❖ 7、进一步形成有关物质结构的基本观念,初步认 识物质的结构与性质之间的关系
❖ 8、认识主族元素电离能的变化与核外电子排布的 关系
❖ 9、认识原子结构与元素周期系的关系,了解元素 周期系的应用价值
(G)碱 酸 s区、d区、ds区的元素最外层电子数为1-2个电子,在反应中易失去,所以都是金属。
最高价氧化物对应的水化物的酸性逐渐
;
(横行) 第6周期:32 种元素 查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这
些元素的电负性解释对角线规则。
元素(除第一周期外)是 __碱_金__属___, 1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
试确定32号元素在周期表中的位置。 d区元素:包含第IIIB族到VIII族元素。
最外层电
子排布为_n_s____,每一周期的最后一种元素都 1 每个纵行的价电子层的电子总数是否相等?主族元素的价电子数和族序数有何关系?
样多,而是随着周期序号的递增渐渐增多。
元素周期系周期发展像螺壳上的螺旋
一、原子结构与元素周期表
1. 为什么副族元素又称为过渡元素?
副族元素处于金属元素向非金属元素过渡的 区域,因此,又把副族元素称为过渡元素。
2.为什么在元素周期表中非金属元素主要集中在右上角 三角区内(如图)?处于非金属三角区边缘的元素常被 称为半金属或准金属。为什么?
镧 La – 镥 Lu 共15 种元素称镧系元素 已知一元素的价层电子结构为3d54s2,试确定其在周期表中的位置。
电负性相差不大的两种非金属元素化合,通常形成共价键;
人教版高中化学选修3课件-金属晶体

知识点二
金属晶体的结构
1.金属晶体的原子堆积模型
2.晶胞中原子的空间利用率的计算方法 (1)以面心立方晶胞为例,求晶胞中原子的空间利用率
图乙是面心立方晶胞的结构剖面图,晶胞的面对角线为金 属原子半径的 4 倍。设金属原子的半径为 R,则晶胞的面对角线 为 4R,晶胞立方体的体积为(2 2R)3。每个面心立方晶胞中实际 含有 4 个金属原子,4 个金属原子的体积为 4×43πR3,因此晶胞 中原子的空间利用率为42×432πRR33×100%=74%。
Hale Waihona Puke ①该晶胞“实际”拥有的铜原子是____4____个。
②该晶胞称为_____C___(填序号)。
A.立方晶胞
B.体心立方晶胞
C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为 a cm, Cu 的相对原子质量为 64, 金属铜的密度为 ρ g·cm-3,则阿伏加德罗常数为___ρ2_·5a_63__m_o_l_-_1(用
1金属晶体在受外力作用下,各层之间发生相对滑动,但 金属键并没有被破坏。
2金属晶体中只有金属阳离子,无阴离子。 3原子晶体的熔点不一定都比金属晶体的高,如金属钨的 熔点就高于一般的原子晶体。 4分子晶体的熔点不一定都比金属晶体的低,如汞常温下 是液体,熔点很低。
1.晶体中有阳离子,一定有阴离子吗?反之, 晶体中有阴离子,一定有阳离子吗?
(4)颜色/光泽——自由电子吸收所有频率光释放一定频率光 由于金属原子以最紧密堆积状态排列,内部存在自由电子, 所以当光辐射到它的表面上时,自由电子可以吸收所有频率的 光,然后很快释放出各种频率的光,这就使得绝大多数金属呈 现银灰色以至银白色光泽,金属能反射照射到其表面的光而具 有光泽。而金属在粉末状态时,金属的晶面取向杂乱,晶格排 列不规则,吸收可见光后辐射不出去,所以金属粉末常呈暗灰 色或黑色。
人教版高中化学选修三第一章第一节 原子结构 课件(共54张PPT)
二、10电子微粒和18电子微粒 1.10电子微粒
【典例3】 已知A、B、C、D四种物质分别是由短周 期元素组成的微粒,它们之间有如图所示的转化关系,且A 是一种含有18电子的微粒,C是一种含有10电子的微粒。请 完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的 化学方程式:________________;
是O2置换H2S中的S。问题(4)中H、O形成的原子个数为1:1 的化合物是H2O2,N、H形成的化合物分子中电子数也为18 的分子只能是N2H4。
[答案] (1) (2)X(或氧) 2H2S+O2===2H2O+2S↓ (3)NH4HSO4
点燃 (4)N2H4+2H2O2=====N2+4H2O
2.(2012·长沙模考)下列有关化学用语使用正确的是 ()
A.硫原子的结构示意图: B.11H2、12H2、31H2是氢的三种同位素 C.原子核内有10个中子的氧原子:188O D.金刚石和石墨、甲烷和乙烷都属于同素异形体
解析 硫原子的结构示意图应为
A项错误。同位
素的研究对象是原子,但B选项中三种粒子是氢的单质,故
(4)若D是一种含有22个电子的分子,则符合如图关系的 A的物质有________(写化学式,如果是有机物则写相应的结 构简式)。
[解析] 本题把指定电子数目的有关微粒作为命题素 材,着重考查考生的有序思维能力。寻找10电子、18电子、 22电子微粒,必须从元素周期表出发,遵循由原子到分子, 再到离子的思考途径,列出相应的微粒。关于18电子微粒的 推断,对有序思维的要求更高,技巧性更强,我们可以以推 断10电子微粒的思路来进行分析,对数字18作一拆分,把18 拆成9+9,找出F2后会使18电子微粒的推断打开一个大“空
人教版高中化学选修3课件第一节能量最低原理、基态与激发态、光谱电子云与原子轨道

完成课前学 习
探究核心任 务
@《创新设计》
【自主思考】 1.为什么原子的核外电子排布要遵循能量最低原理呢? 提示 能量最低原理是自然界普遍遵循的规律。能量越低,物质越稳定,物质 都有从高能量状态转化到低能量状态的趋势。
完成课前学 习
探究核心任 务
@《创新设计》
二、电子云与原子轨道 1.电子云
用小黑点来描述电子在原子核外空间出现的概__率__密__度__分__布__图____,被形象地称为 电子云。 2.电子云轮廓图 为了表示_电__子__云__轮__廓___的形状,对核外电子的_空__间__状__态__有一个形象化的简便描 述,把电子在原子核外空间出现概率P=_9_0_%_的空间圈出来,即为电子云轮廓图。
@《创新设计》
【点拨提升】 宏观物体的运动与微观电子的运动对比 1.宏观物体的运动有确定的运动轨迹,可以准确测出其在某一时刻所处的位置及
运行的速度,描绘出其运动轨迹。 2.由于微观粒子质量小、运动空间小、运动速度快,不能同时准确测出其位置与
速度,所以对于核外电子只能确定其在原子核外各处出现的概率。 (1)电子云图表示电子在核外空间出现概率密度的相对大小。电子云图中小黑点 密度越大,表示电子出现的概率密度越大。 (2)电子云图中的小黑点并不代表电子,小黑点的数目也不代表电子真实出现的 次数。
在激动人心的巨响和脆响中,整个城市的上空都被焰火照亮了,染红了。一团 团盛大的烟花象一柄柄巨大的伞花在夜空开放;像一簇簇耀眼的灯盏在夜空中 亮着;像一丛丛花朵盛开并飘散着金色的粉沫。焰火在夜空中一串一串地盛开, 最后像无数拖着长长尾巴的流星,依依不舍地从夜空滑过。
完成课前学 习
探究核心任 务
@《创新设计》
@《创新设计》
高中化学人教版选修三:1.1原子结构(共44张PPT)

核外电子分成不同的能层。 电子层 (2)能层的表示方法及各能层最多容纳的电子数如下:
能层 一 二 三 M 四 五 六 P 七 …… Q ……
K ___ L 符号 ___ 最多 电子 数
N ___ O ___
பைடு நூலகம்
各能层最多容纳的电子数为 2n2 ______
2.能级 能量 的不同, (1)根据多电子原子中同一能层电子_________ 将它们分成不同的能级。 (2)能级的表示方法及各能级最多容纳的电子数如下:
四、能量最低原理、基态与激发态、光谱
1.能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理 能使整个原子的能量处于最低状态,简称____________ 能量最低原理 。 2.基态与激发态: 基态原子: 处于最低能量的原子 (稳定)
发射光谱
电子放 出能量
激发态原子:基态原子的电子吸收能量后电子会跃迁到 较高的能级,变为激发态原子。 (不稳定)
电子云
知识回顾
原子:是化学变化中最小的粒子 化学反应的实质:是原子的重新组合。 质子(+) 原子结构: 原子核 中子(不带电) 原子 核外电子(-) 核电荷数(z)= 核内质子数= 核外电子数
{
{
质量数(A) = 质子数(Z) + 中子数(N) 原子核外电子排布: (1)核外电子总是尽量先排布在能量较低的电子层; (2)原子核外各电子层最多容纳2n2个电子。 (3)原子最外层电子数目不能超过8个(K层为最外层时不能超过2个 电子)。 (4)次外层电子数目不能超过18个(K层为次外层时不能超过2个), 倒数第三层电子数目不能超过32个。
A.ClB. C. D.1s22s22p63s23p6
3、构造原理揭示的电子排布能级顺序,实质是各能级能量高低。 若以E(nl)表示某能级的能量,以下各式中正确的是( )AB A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(5s)>E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)>E(3d) 4、某元素原子的价电子构型为3s23p4, 则此元素在周期表的位置是 第3周期,第VIA族 ____________
31认识晶体-安徽省太和第一中学高中化学选修三教学课件(共43张PPT)

认识晶体
知识解第读32 页
知识点1、认识几种晶胞
3. 晶胞按其周期性在三维空间重复排列(无隙并置堆砌)成晶体
A3型最密堆积:
A
A
C
12
B
B
63
54
A
A C
B
B
A
A
现象解第读18 页
1 3
5
认识晶体
1. 等径圆球的密堆积
归纳总第结19 页
金属晶体的结构形式可归结为等径圆球的密堆积。 (1)每一层都是最紧密堆积,也就是每个等径球与周围相接触。而层 与层之间的堆积时有多种方式:一种是“…ABAB…”重复方式,叫A3 型的最密堆积,例如:金属镁的晶体属于A3型最密堆积。 (2)一种是“…ABCABC…” 重复方式,叫 A1型的最密堆积。 例如:金属铜的晶体属于 A1型最密堆积。
认识晶体
内容解第读13 页
5、晶体的特性
① 有规则几何外形
雪 花
水 晶 石
(晶体内部质点高度有序性的周期性重复排列——本质特征)
② 有固定的熔沸点
③ 各向异性 晶体在不同方向上表现出不同的物理性质
④ 对称性 晶体的外形和内部结构都具有特有的对称性
认识晶体
6、晶体的分类 根据晶体构成微粒和微粒间相互作用不同分为四种类型:
太和一中化学组 吴波
认识晶体
第 29 页
三、晶体结构最小重复单元——晶胞
认识晶体
知识点1、认识几种晶胞
简单立方晶胞
面心立方晶胞
图片导第学30 页
体心立方晶胞 简单单斜晶胞
A3型最密堆积及其六方晶胞
A1型最密堆积及其面心立方晶胞
六方最密堆积(含三个晶胞)
立方最密堆积
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 Ⅷ族: 16
1 0族: 特点:副族、Ⅷ族通称过渡元素,过渡金属
主族元素族序数=原子最外层电子数
一些族的别名
3、分区 按最后填入电子所属能级符号
ds区除外 s区 ⅠA、ⅡA 1、2 两列 d区 ⅢB~ⅦB、 Ⅷ 3 ~ 7、8 ~ 10 八列 ds区 ⅠB、ⅡB 11、12两列 p区 ⅢA~ⅦA、O 13 ~ 17、18 六列
原子的核外电子排布
• 2、能用电子排布式表示常见元素(1~36号)原 子核外电子的排布
• 3、知道原子核外电子的排布遵循能量最低原理、 泡利原理和洪特规则
• 4、知道原子的基态和激发态的涵义 • 5、初步知道原子核外电子的跃迁及吸收或发射光
谱,了解其简单应用
四、电子云与原子轨道
1、电子云 薛定谔等 以量子力学为基础
轴对称 可绕键轴旋转
5、π键
定义: 两个原子轨道以平行 即“肩并肩”方式重叠
①类型 p-p π键 例:CH2=CH2
d-p π键 例:金属配合物
②特点 肩并肩 重叠程度较小,稳定性较差 镜面对称 不能旋转
键型 项目 成键方向
σ键
π键
沿轴方向“头碰头” 平行方向“肩并肩”
电子云形状 轴对称
镜像对称
能层 K L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
32
数 2n2 2n2
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s
→ 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
元素的某些性质 • 3、进一步形成有关物质结构的基本观念,初步认识物质
的结构与性质之间的关系 • 4、认识主族元素电离能的变化与核外电子排布的关系 • 5、认识原子结构与元素周期系的关系,了解元素周期系
的应用价值 • 6、能说出元素电负性的涵义,能应用元素的电负性说明
元素的某些性质
复习 元素:具有相同核电荷数的一类原子的总称
核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子
核电荷数=核内质子数=核外电子数=原子序数
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表 (一课时)
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
②周期的组成
金属键 按成键方式分为: 共价键
金属晶体 分子晶体
离子键
离子晶体
2、共价键
共价键:分子内原子间通过共用 电子对形成的相互作用
作用 共用电子对 本质:(两单个电子形成一对电子)
发生:分子内原子之间 存在: 于绝大多数物质中
酸、碱、盐、非金属氧化物
氢化物、有机物、非金属单质
3、共价键分类
按共用电子对的偏移
同周期的主族元素从左至右 金属性减弱,非金属性增强
金属性强弱的判断依据 跟水(酸)反应置换出氢的难易程度
越容易发生,金属性越强
最高价氧化物对应水化物——最高价氢氧化物 碱性强弱
最高价氢氧化物碱性越强,金属性越强
金属活动性顺序 单质与盐溶液的置换反应 普通原电池正负极
非金属性强弱的判断依据 跟氢气化合生成气态氢化物的难易程度
越易反应,非金属性越强 气态氢化物的稳定性
越稳定,非金属性越强 最高价氧化物对应水化物——最高价含氧酸
酸性强弱 酸性越强,非金属性越强
5、化合价
主族元素族序数=最高正价=价电子数 F、O 非金属最低负化合价=主族元素族序数—8
同周期的主族元素从左至右 化合价由+1→+7, -4 →0递增 巩固练习见资料
nd能级的电子云轮廓图:多纺锤形
b.电子云扩展程度
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态
②原子轨道与能级
ns能级 ns轨道
npx轨道 简
np能级 npy轨道 npz轨道
并 轨 道
nd能级
ndz2轨道
ndx2—y2轨道
基态原子吸收能量后,电子发生跃迁变为激 发态原子
3、光谱
①吸收光谱 光亮普带上的孤立暗线 电子吸收能量跃迁时产生 ②发射光谱 暗背景下的孤立亮线 电子释放能量跃迁时产生
同种原子的两种光谱是可以互补的
第一章
原子的结构与性质
第二节 原子结构与元素性质 (共三课时) 高二化学组
知识与技能目标:
• 1、掌握原子半径的变化规律 • 2、能说出元素电离能的涵义,能应用元素的电离能说明
同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用
一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性
对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性 同主族元素从上至下 金属性增强,非金属性减弱
牢固程度 强度大,不易断 强度较小,易断
成键判断规 律
单键是σ键,双键中一个 σ键,另 一个是π键,共价三键中一个是σ键, 另两个为π键。
共价键特征
饱和性 方向性
共价键类型
σ键
s-s s-p
头碰头
p-p 轴对称
(按电子云 重叠方式分) π键 p-p 肩并肩
d-p 镜面对称
第二课时
• 教学目标: • 1、了解键的参数,能用键能、键长、键角
化学 选修三
原子结构 原子结构与性质
原子结构与元素的性质 共价键
分子结构与性质 分子的立体结构
晶体结构与性质
分子的性质 晶体的常识 分子晶体与原子晶体 金属晶体 离子晶体
第一章 原子的结构与性质
第一节 原子结构(第一课时) 高二化学组
知识与技能目标:
1.进一步认识原子核外电子的分层排布
2.知道原子核外电子的能层分布及其能
自旋量子数
能层 能级 轨道 自旋
大范围 小范围
公转 自转
1、泡利原理
填多少
每个轨道最多只能容纳2个电子
且它们的自旋方向相反
2、洪特规则
怎么填
电子总是优先单独地占据简并轨道
且它们的自旋方向相同
3、电子排布图
例:写出O原子的电子排布图 O原子的电子排布式: 1s2 2s2 2p4
1s2 2s2
2p4
f区
二、元素周期律(第二课时)
元素周期律:元素的性质随着原子序数
的递增而呈周期性的变化
1、原子半径
层数 层数多半径大 电子间斥力大 决定因素
核电 核电荷数大半径小 正负电荷
荷数
间引力大
同周期主族元素:从左至右原子半径递减
同主族元素:从上至下原子半径递增
ห้องสมุดไป่ตู้
电子层结构相同的离子原子序数小的半径大!
2、电离能
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
②能量关系 EK﹤EL ﹤ EM ﹤ EN Ens﹤Enp ﹤ End ﹤ Enf Ens﹤E(n+1) s ﹤ E(n+2) s ﹤ E(n+3) s Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
①第一电离能 气态电中性基态原子失去一个电子转 化为气态基态正离子所需最低能量 同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高 ②逐级电离能
利用逐级电离能判断化合价
3、电负性(第三课时)
键合电子:参与化学键形成 原子的价电子
孤对电子:未参与化学键形成 ①电负性 不同元素的原子对键合电子吸引能力 电负性越大,对键合电子吸引能力越大
周期序数 起始原子序数 终止原子序数 元素种类
短
一
1
2
2
周
二
3
10
8
期
三
11
18
8
长
四
周
五 六
期
七
19
36
18
37
54
18
55
86
32
87
118/112 32/26
第七周期也称为不完全周期
镧系:57~71 锕系:89~103
2、族元素周期表的纵行
7主族:A结尾 ,ⅠA~ⅦA 族 7副族:B结尾 , ⅢB~ⅦB,ⅠB,ⅡB
不显 电性 核外电子 分层排布
(负电) 与物质化学性质密切相关
二、能层与能级
1、能层
电子层
能层名称 一 二 三 四 五 六 七 能层符号 K L M N O P Q
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
1 0族: 特点:副族、Ⅷ族通称过渡元素,过渡金属
主族元素族序数=原子最外层电子数
一些族的别名
3、分区 按最后填入电子所属能级符号
ds区除外 s区 ⅠA、ⅡA 1、2 两列 d区 ⅢB~ⅦB、 Ⅷ 3 ~ 7、8 ~ 10 八列 ds区 ⅠB、ⅡB 11、12两列 p区 ⅢA~ⅦA、O 13 ~ 17、18 六列
原子的核外电子排布
• 2、能用电子排布式表示常见元素(1~36号)原 子核外电子的排布
• 3、知道原子核外电子的排布遵循能量最低原理、 泡利原理和洪特规则
• 4、知道原子的基态和激发态的涵义 • 5、初步知道原子核外电子的跃迁及吸收或发射光
谱,了解其简单应用
四、电子云与原子轨道
1、电子云 薛定谔等 以量子力学为基础
轴对称 可绕键轴旋转
5、π键
定义: 两个原子轨道以平行 即“肩并肩”方式重叠
①类型 p-p π键 例:CH2=CH2
d-p π键 例:金属配合物
②特点 肩并肩 重叠程度较小,稳定性较差 镜面对称 不能旋转
键型 项目 成键方向
σ键
π键
沿轴方向“头碰头” 平行方向“肩并肩”
电子云形状 轴对称
镜像对称
能层 K L
M
N
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
能级 电子 2 2 6 2 6 10 2 6 10 14
数
能层 2 8 电子
18
32
数 2n2 2n2
2n2
2n2
三、构造原理与电子排布式
1、构造原理
多电子基态原子的电子按能级交错的形式排布
电子排布顺序 1s
→ 2s → 2p → 3s → 3p → 4s → 3d → 4p → → 5s → 4d → 5p → → 6s → 4f → 5d → 6p……
元素的某些性质 • 3、进一步形成有关物质结构的基本观念,初步认识物质
的结构与性质之间的关系 • 4、认识主族元素电离能的变化与核外电子排布的关系 • 5、认识原子结构与元素周期系的关系,了解元素周期系
的应用价值 • 6、能说出元素电负性的涵义,能应用元素的电负性说明
元素的某些性质
复习 元素:具有相同核电荷数的一类原子的总称
核素:含有一定数目质子和中子的一种原子 同位素:质子数相同中子数不同的 同一种元素的不同原子
核电荷数=核内质子数=核外电子数=原子序数
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表 (一课时)
1、周期 元素周期表的横行
①特点 同周期元素电子层数相同 同周期元素从左至右原子依次序数递增
②周期的组成
金属键 按成键方式分为: 共价键
金属晶体 分子晶体
离子键
离子晶体
2、共价键
共价键:分子内原子间通过共用 电子对形成的相互作用
作用 共用电子对 本质:(两单个电子形成一对电子)
发生:分子内原子之间 存在: 于绝大多数物质中
酸、碱、盐、非金属氧化物
氢化物、有机物、非金属单质
3、共价键分类
按共用电子对的偏移
同周期的主族元素从左至右 金属性减弱,非金属性增强
金属性强弱的判断依据 跟水(酸)反应置换出氢的难易程度
越容易发生,金属性越强
最高价氧化物对应水化物——最高价氢氧化物 碱性强弱
最高价氢氧化物碱性越强,金属性越强
金属活动性顺序 单质与盐溶液的置换反应 普通原电池正负极
非金属性强弱的判断依据 跟氢气化合生成气态氢化物的难易程度
越易反应,非金属性越强 气态氢化物的稳定性
越稳定,非金属性越强 最高价氧化物对应水化物——最高价含氧酸
酸性强弱 酸性越强,非金属性越强
5、化合价
主族元素族序数=最高正价=价电子数 F、O 非金属最低负化合价=主族元素族序数—8
同周期的主族元素从左至右 化合价由+1→+7, -4 →0递增 巩固练习见资料
nd能级的电子云轮廓图:多纺锤形
b.电子云扩展程度
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态
②原子轨道与能级
ns能级 ns轨道
npx轨道 简
np能级 npy轨道 npz轨道
并 轨 道
nd能级
ndz2轨道
ndx2—y2轨道
基态原子吸收能量后,电子发生跃迁变为激 发态原子
3、光谱
①吸收光谱 光亮普带上的孤立暗线 电子吸收能量跃迁时产生 ②发射光谱 暗背景下的孤立亮线 电子释放能量跃迁时产生
同种原子的两种光谱是可以互补的
第一章
原子的结构与性质
第二节 原子结构与元素性质 (共三课时) 高二化学组
知识与技能目标:
• 1、掌握原子半径的变化规律 • 2、能说出元素电离能的涵义,能应用元素的电离能说明
同周期主族元素从左至右电负性逐渐变大 同主族元素从上至下电负性逐渐变小
②电负性应用
一般而言 金属<1.8,非金属>1.8 1.8左右的既有金属性,又有非金属性
对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性 同主族元素从上至下 金属性增强,非金属性减弱
牢固程度 强度大,不易断 强度较小,易断
成键判断规 律
单键是σ键,双键中一个 σ键,另 一个是π键,共价三键中一个是σ键, 另两个为π键。
共价键特征
饱和性 方向性
共价键类型
σ键
s-s s-p
头碰头
p-p 轴对称
(按电子云 重叠方式分) π键 p-p 肩并肩
d-p 镜面对称
第二课时
• 教学目标: • 1、了解键的参数,能用键能、键长、键角
化学 选修三
原子结构 原子结构与性质
原子结构与元素的性质 共价键
分子结构与性质 分子的立体结构
晶体结构与性质
分子的性质 晶体的常识 分子晶体与原子晶体 金属晶体 离子晶体
第一章 原子的结构与性质
第一节 原子结构(第一课时) 高二化学组
知识与技能目标:
1.进一步认识原子核外电子的分层排布
2.知道原子核外电子的能层分布及其能
自旋量子数
能层 能级 轨道 自旋
大范围 小范围
公转 自转
1、泡利原理
填多少
每个轨道最多只能容纳2个电子
且它们的自旋方向相反
2、洪特规则
怎么填
电子总是优先单独地占据简并轨道
且它们的自旋方向相同
3、电子排布图
例:写出O原子的电子排布图 O原子的电子排布式: 1s2 2s2 2p4
1s2 2s2
2p4
f区
二、元素周期律(第二课时)
元素周期律:元素的性质随着原子序数
的递增而呈周期性的变化
1、原子半径
层数 层数多半径大 电子间斥力大 决定因素
核电 核电荷数大半径小 正负电荷
荷数
间引力大
同周期主族元素:从左至右原子半径递减
同主族元素:从上至下原子半径递增
ห้องสมุดไป่ตู้
电子层结构相同的离子原子序数小的半径大!
2、电离能
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
3、注意问题
①能层与能级的关系
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
②能量关系 EK﹤EL ﹤ EM ﹤ EN Ens﹤Enp ﹤ End ﹤ Enf Ens﹤E(n+1) s ﹤ E(n+2) s ﹤ E(n+3) s Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
①第一电离能 气态电中性基态原子失去一个电子转 化为气态基态正离子所需最低能量 同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高 ②逐级电离能
利用逐级电离能判断化合价
3、电负性(第三课时)
键合电子:参与化学键形成 原子的价电子
孤对电子:未参与化学键形成 ①电负性 不同元素的原子对键合电子吸引能力 电负性越大,对键合电子吸引能力越大
周期序数 起始原子序数 终止原子序数 元素种类
短
一
1
2
2
周
二
3
10
8
期
三
11
18
8
长
四
周
五 六
期
七
19
36
18
37
54
18
55
86
32
87
118/112 32/26
第七周期也称为不完全周期
镧系:57~71 锕系:89~103
2、族元素周期表的纵行
7主族:A结尾 ,ⅠA~ⅦA 族 7副族:B结尾 , ⅢB~ⅦB,ⅠB,ⅡB
不显 电性 核外电子 分层排布
(负电) 与物质化学性质密切相关
二、能层与能级
1、能层
电子层
能层名称 一 二 三 四 五 六 七 能层符号 K L M N O P Q
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
