电解原理应用公开课 ppt课件
合集下载
电解原理应用(共25张PPT)

第15页,共25页。
2、活泼金属的制备
能否用置换反应来制备单质铝?为什么?
Al
熔融的AL2O3
石墨 阳极: 2O2——4e— == O2↑
阴极: Al3++ 3e— == Al
总反应方程式:
通电
2Al2O3
==
熔融
4Al + 3O2↑
MgCl2 2NaCl
通电
== Mg + Cl2 ↑
熔融
通电 == 2Na + Cl2 ↑
2NaCl == 2Na + Cl2 ↑ Na+、 Ba2+、 Ca2+ 、 Cl- 、 OH-
Ⅰ与Ⅳ区:放氢生碱型
2Cl- -2e- = Cl2↑ 以石墨为电极,电解NaCl水溶液,两极上又分别发生什么变化? 成次氯酸钠影响氢氧化钠的 以石墨为电极,电解熔融的NaCl,两极上分别发生什么变化?
金属腐蚀的快慢程度:
第24页,共25页。
第25页,共25页。
电解原理应用
第二节 氯碱工业
第1页,共25页。
复习: 当用石墨做电极,电解不同的
电解质时有什么规律?
第2页,共25页。
S2->I->Br->Cl->OH->含氧酸根>F-
Ⅰ
Ⅱ
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg
2+>Na+
Ⅲ
Ⅳ
Ⅱ与Ⅳ区:电解水型 Ⅰ与Ⅲ区:电解电解质型
(少量)、Cu2+、H+(少量)
2、活泼金属的制备
能否用置换反应来制备单质铝?为什么?
Al
熔融的AL2O3
石墨 阳极: 2O2——4e— == O2↑
阴极: Al3++ 3e— == Al
总反应方程式:
通电
2Al2O3
==
熔融
4Al + 3O2↑
MgCl2 2NaCl
通电
== Mg + Cl2 ↑
熔融
通电 == 2Na + Cl2 ↑
2NaCl == 2Na + Cl2 ↑ Na+、 Ba2+、 Ca2+ 、 Cl- 、 OH-
Ⅰ与Ⅳ区:放氢生碱型
2Cl- -2e- = Cl2↑ 以石墨为电极,电解NaCl水溶液,两极上又分别发生什么变化? 成次氯酸钠影响氢氧化钠的 以石墨为电极,电解熔融的NaCl,两极上分别发生什么变化?
金属腐蚀的快慢程度:
第24页,共25页。
第25页,共25页。
电解原理应用
第二节 氯碱工业
第1页,共25页。
复习: 当用石墨做电极,电解不同的
电解质时有什么规律?
第2页,共25页。
S2->I->Br->Cl->OH->含氧酸根>F-
Ⅰ
Ⅱ
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg
2+>Na+
Ⅲ
Ⅳ
Ⅱ与Ⅳ区:电解水型 Ⅰ与Ⅲ区:电解电解质型
(少量)、Cu2+、H+(少量)
6.3.2 电解原理的应用.pptx

四、拓展提升
通过4 mol e-为基准可构建电极产物之间的如下关系式
4e-~2Cl2 (Br2、I2)~O2~4H+~阳极产物 4OH-~ 4 2H2~2Cu~4Ag~xM 阴极产物 (M 为金属,x 为其化合价)
电解原理的应用
01
教材ห้องสมุดไป่ตู้
高考
02
典例剖析 反思归纳
03
04
拓展提升
教材图解 人教版选修4 P81 图4-11 电镀制品
视频1:电解食盐水 视频2:电解精炼铜 动画 视频3:电镀(铁钉 上镀铜) 视频4:电镀锌
一、教材
高考
2.(溯源题)(2017· 课标全国Ⅱ,11)用电解氧化法可以 在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶 Al 变为 液一般为 H2SO4 - H 2C2O4 混合溶液。判断下列叙述是 Al2O3 否正确 (1)待加工铝质工件为阳极( (2)可选用不锈钢网作为阴极( ) )
A.阳极反应式为4OH--4e-===2H2O+O2↑
B.通电后阴极区溶液pH会增大
C.K+通过交换膜从阴极区移向阳极区
D.纯净的KOH溶液从b口导出
转解 析
三、反思归纳 1.阳离子交换膜 (以电解NaCl溶液为例),只 允许阳离子(Na+)通过,而阻止阴离子(Cl-、 OH-)和分子(Cl2)通过,这样既能防止H2和Cl2 混合爆炸,又能避免 Cl2 和 NaOH 溶液作用生 成NaClO,影响烧碱质量。 2.电解或电镀时,电极质量减少的电极必为 金属电极 —— 阳极;电极质量增加的电极必 为阴极,即溶液中的金属阳离子得电子变成 金属吸附在阴极上。 3.电解精炼铜,粗铜中含有的Zn、Fe、Ni等 活泼金属失去电子,变成金属阳离子进入溶 液,其活泼性小于铜的杂质以阳极泥的形式 沉积。电解过程中电解质溶液中的 Cu2 +浓度
电解原理的应用课件.pptx
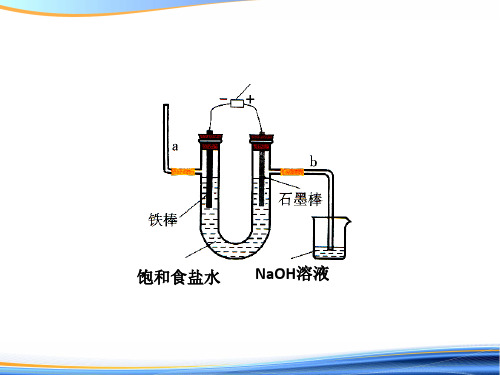
+
稀NaCl溶液 NaClO溶液
__ _
NaOH溶液
很稀的NaOH 溶液
饱和食盐水
水(含少量NaOH)
思考1:若将阳离子交换膜撤去,能否得到次氯 酸钠?有无不足之处?
思考2:若将阳离子交换膜改为阴离子交换膜, 能否得到次氯酸钠?
思考3:家庭一般没有配备离子交换膜, 你能不能利用电解饱和食盐水原理设 计一套家用简易环保型消毒液发生器?
饱和食盐水 NaOH溶液
实验用品:
电源、导线、两支铅笔芯、玻璃片、PH试纸、 标准比色卡、饱和NaCl溶液
电解饱和食盐水(离子交换膜电解槽)
+
C
阳— 极— 室
— —
阴 极 室
D饱和食盐水ຫໍສະໝຸດ 水(含少量NaOH)思考:A,B,C,D分别是什么物质?阳离子交换膜 有什么作用 ?
阳离子交换膜的作用 1、防止阴极产生的H2和阳极产生的Cl2混合 引起爆炸 2、避免Cl2与NaOH作用生成NaClO影响 烧碱质量
水 质 电 解 器
纯净水
自来水
你能不能从水质电解器 骗局中得到一些启发, 运用电解原理制备较纯净 的Fe(OH)2?
第三节电解原理精品PPT课件
= CO32-+7H2O C2H6-14e-+18OH-
= 2CO32-+12H2O
CH3OH-6e-+8OH= CO32-+6H2O
C3H8-20e-+26OH-
(6)
=3CO32-+17H2O
C4H10-26e-+34OH-
(7)
=4CO32-+22H2O
电池总反应
pH变化
2H2+O2==2H2O 2CO+O2+4OH-
将一个化学体系构成一个能够产生电流的装置的条件 1. 该体系必须包含一个能自发发生的氧化还原反应 2. 该体系必须有适当的装置能够将氧化反应和还原反应
分别在不同的区域进行 3. 内、外电路必须闭合
22 J & G CHEMWORLD
氧化还原反应与电现象-1
碱性燃料电池中有机物(如CH4、C2H6、CH3OH 等)的得失电子关系?负极反应的书写?
=2CO32+2H2O CH4+2O2+2OH-
=CO32-+3H2O 2C2H6+7O2+8OH-
=4CO32-+10H2O 2CH3OH+3O2+4OH-
=2CO32-+6H2O
C3H8+5O2+6OH=3CO32-+7H2O
2C4H10+13O2+16OH=8CO32-+18H2O
变小 变小 变小 变小 变小 变小 变小
⑴ 外接电源、
⑵与电源相连接的两电极、
⑶电解质溶液(或熔融的电解质)
2. 实验:电解氯化铜溶液
现象:
阳极:
= 2CO32-+12H2O
CH3OH-6e-+8OH= CO32-+6H2O
C3H8-20e-+26OH-
(6)
=3CO32-+17H2O
C4H10-26e-+34OH-
(7)
=4CO32-+22H2O
电池总反应
pH变化
2H2+O2==2H2O 2CO+O2+4OH-
将一个化学体系构成一个能够产生电流的装置的条件 1. 该体系必须包含一个能自发发生的氧化还原反应 2. 该体系必须有适当的装置能够将氧化反应和还原反应
分别在不同的区域进行 3. 内、外电路必须闭合
22 J & G CHEMWORLD
氧化还原反应与电现象-1
碱性燃料电池中有机物(如CH4、C2H6、CH3OH 等)的得失电子关系?负极反应的书写?
=2CO32+2H2O CH4+2O2+2OH-
=CO32-+3H2O 2C2H6+7O2+8OH-
=4CO32-+10H2O 2CH3OH+3O2+4OH-
=2CO32-+6H2O
C3H8+5O2+6OH=3CO32-+7H2O
2C4H10+13O2+16OH=8CO32-+18H2O
变小 变小 变小 变小 变小 变小 变小
⑴ 外接电源、
⑵与电源相连接的两电极、
⑶电解质溶液(或熔融的电解质)
2. 实验:电解氯化铜溶液
现象:
阳极:
电解原理的应用 PPT

三种溶液;均以Pt作电极,将它们串联在一起电解一定
时间,测得电极增重总和2.8 g,这时产生的有色气体与
无色气体的物质的量之比为
()
A.4∶1
B.1∶1
C.4∶3
D.3∶4
[解析] 串联电路中,相同时间内各电极得或失的电子的 物质的量相同,各电极上放出气体的物质的量之比为定 值.不必注意电极增重是多少.只要判断出生成何种气 体及生成该气体一定物质的量所得失电子的物质的量, 就可以通过得失电子守恒,判断气体体积之比,第一个 烧杯中放出Cl2,第二个烧杯中放出Cl2和H2,第三个烧 杯中放出O2.在有1 mol电子转移时,分别是0.5 mol、0.5
[特别关注] 电解的计算
首先正确书写电极反应式(要特别注意阳极材料); 其次注意溶液中多种离子共存时,要根据离子放电顺序 确定离子放电的先后; 最后根据得失电子守恒进行相关计算.
考查点一 电解原理的应用
[例1]
下列描述中,不符合生产实际的是 .
()
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
极后生成的Cl2发生反应生成NaClO.NaClO具有强 氧化性,将其蓝色漂白而使之褪去.
3.电解精炼铜应用的是电镀原理
()
提示:正确.阳极粗铜中的铜失电子后,阴极有铜
析出,符合电镀原理.
一、原电池、电解池、电镀池的比较
原电池
电子 负极―导―线→ 流向 正极
电解池
电镀池
电源负极―导―线→阴极 同电解池
mol、 0.5 mol和0.25 mol.所以共放出有色气体(Cl2) 0.5 +0.5=1 mol,无色气体(O2和H2) 0.5+0.25=0.75 mol.
电解原理的应用【共18张PPT】

③合并两个电极反应式,得电解总反应式。
(1)根据守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
知识点1
知识点2
电镀和电冶金
【例题2】 金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
。
a.Fe2O3 b.NaCl
最后根据总反 先写出电极反应式, , (2) : 若X、Y都是惰性电根极,据a是饱总和反NaC应l溶液式,实计验开算始时,同时在两边各滴入几滴酚酞溶液,再则:写出总反应式
向CuSO4溶液中加入镁条时有气体生成,该气体是
。
应式计算。
(3)根据关系式计算:根据得失电子守恒关系,在已知量与未知量之间,建立 计算所需的关系式。
反应中铜、硫元素化合价升高,Cu2S作还原剂,由关系式5O2~20e-可知,1 mol O2反应时还原剂所失电子的物质的量为4 mol。因CuSO4溶液水解呈酸 性,故加入镁条产生气体为H2。
(3)电解精炼时阳极为含有杂质的金属,因此 a 极为粗银。b 极产 生红棕色气体为 NO2,则 b 电极的反应物为 NO3- ,故其电极反应式为 NO3- +2H++e- NO2↑+H2O。
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴
入几滴酚酞溶液,则:
(1)电解池中X极上的电极反应式是
,在X极附近观察到的现象
是
。
(2)Y电极上的电极反应式是
,检验该电极反应产物
的方法是
。
知识点1
知识点2
解析:本题通过电解饱和 NaCl 溶液实验来考查电极反应式的书 写问题。由题意或图形可知,此池为电解池,X 极为阴极,Y 极为阳极。 电极为惰性电极,饱和 NaCl 溶液中存在 Na+、Cl-、H+、OH-,在阴极 上,H+放电能力强于 Na+,故阴极上发生的电极反应为 2H++2eH2↑,因而导致 X 极附近有气体放出,溶液呈碱性,溶液颜色由无色变 为红色;在阳极上,Cl-放电能力强于 OH-,故阳极上发生的电极反应为 2Cl--2e- Cl2↑。
电解原理应用精品课件

计算关系式:
O2~2Cu~4Ag~4H+~2H2~2Cl2~4OH-
例2 : 用石墨电极电解100mL H2SO4与CuSO4的混合 液,通电一段时间后,两极均收集到2.24L(标况)气 体,则原混合液中Cu2+的物质的量浓度为( A )
A.1mol/L B.2mol/L C.3mol/L D.4mol/L 阳极O2为0.1mol,电子为0.4mol 则H2为0.1mol,所以Cu为0.1mol,浓度为A
②电镀液须含有镀层金 属的离子
阳极:电源正极相连 阳极:不纯金属; 阴极:电源负极相连 阴极:纯金属
阳极:镀层金属; 阴极:镀件
电极 反应
阳极:氧化反应 阴极:还原反应
阳极:氧化反应 阴极:还原反应
阳极:氧化反应 阴极:还原反应
四、电解计算——电子守恒法
例1 : 铂电极电解1LCu(NO3)2和KNO3混合溶 液,通电一段时间,两极均产生11.2L(标况)气 体.求电解后溶液的pH,并确定析出铜的物质 的量.
解析:阳极 4OH--4e-=2H2O+O2↑ 阴极 Cu2++2e- =Cu 2H++2e- =H2↑
阳极转移电子的物质的量为: 0.5×4 = 2mol,消耗 OH- 2mol,即产生H+ 2mol.
阴极生成0.5molH2,消耗H+ 1mol;所以溶液中 C(H+)=1mol/L pH=0
生成H2转移的电子:0.5 ×2=1mol,故还有1mole用于还原Cu2+,可析出铜为0.5mol.
化学腐蚀>
+
—
原电池的正极>
C
Fe
电解池的阴极
海水
拓展练习
电解原理的应用 课件

【解析】 (1)①依题意可知,乙装置装有硫 酸铜溶液,其电极反应式为:阴极:2Cu2+ +4e-===2Cu;阳极:4OH--4e-===2H2O +O2↑。 c电极质量增加,说明该电极上析出 铜,为阴极,则d极为阳极,依次类推:e极 为阴极,f极为阳极,N极为正极,M极为负 极,a极为阴极,b极为阳极。
出金属质量为 m(Cu)=0.25 mol×64 g/mol=16 g。 ⑤甲、丙装置实质是电解水,乙装置电解反应式为: 2CuSO4+2H2O==电=解==2Cu+2H2SO4+O2↑,溶液酸 性增强。(2)如果铜全部析出,甲装置装有氢氧化钠 溶液,乙装置装有硫酸溶液,丙装置装有硫酸钾溶液, 电解仍能继续进行,三个装置都相当于电解水。
(2)乙池中若滴入少量酚酞试液,电解一段时 间后,铁极附近呈________色,C极附近呈 ________色。
(3)若甲槽阴极增重43.2 g,则乙槽中阳极上放 出的气体在标准状况下的体积是________mL, 若乙槽中剩余溶液仍为400 mL,则电解后所 得NaOH溶液的物质的量浓度为 ________mol/L,pH等于________。
c(NaOH)=00.4.4mLol=1 mol/L,pH=14。
【答案】 (1)铁 阴极 Ag++e-===Ag 银 阳极 Ag-e-===Ag+ AgNO3溶液 (2)红 无 (3)4480 1 14
电化学计算的基本方法
1.根据电子守恒计算 用于串联电路、阴阳两极产物、正负两极产 物、相同电量等类型的计算,其依据是电路 上转移的电子数相等。 2.根据总反应式中的计量关系计算 先写出电极反应式,再写出总反应式或直接 运用总反应式,最后根据总反应式列比例式 计算。
电解原理的应用
原电池、电解池、电镀池三者比较
电解原理的应用PPT教学课件

(05天津高考12 )金属镍有广泛的用途。粗镍中含 有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯
度的镍,下列叙述正确的是( D )
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加 相等
阳极:Ag→ Ag+ +e阴极:Ag++e- → Ag
一、电镀
1、定义: 利用电解原理在某些金属的表面镀上 一薄层其它金属或是合金的过程。
2、目的:使金属增强抗腐 蚀的能力,增加美观和 表面硬度。
3、电镀材料的选择:
阴极——镀件
阳极——镀层金属 电镀液——含有镀层金属离子的溶液 4、电镀的特点: 1)阳极本身参加电极反应
点 的离子
生成了新物质
联系
电解必须建立在电离的基础上
小结2 原电池和电解池知识总结比较表
内容
原电池
电极 较活泼金属做负极 规定
电极 负极发生氧化反应 反应
电子移 动方向
负极流向正极
能量 转变
化学能变为电能
电解池 阴极:连接电源负极 的一极 阳极氧化、阴极还原
阳极流向阴极
电能变为化学能
分析电解反应的一般思路:
阴离子放电(失电子)能力:逐渐减弱
电解的基本规律
举例
电解
类型 物质类别 实例
电极反应
水
含氧酸
H2SO4
电
强碱
NaOH
解 活泼金属的 Na2SO4
含氧酸盐
溶
无氧酸
HCl
质
电 不活泼金属 CuCl2 解 的无氧酸盐
电解原理的应用化学课件PPT

64.伟大的事业不是靠力气、速度和身体的敏捷完成的,而是靠性格、意志和知识的力量完成的。 39.生活的道路一旦选定,就要勇敢地走到底,决不回头。 93.选对事业可以成就一生,选对朋友可以智能一生,选对环境可以快乐一生,选对伴侣可以幸福一生,选对生活方式可以健康一生。
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
上述装置的弱点:
1.H2和Cl2 混合不安全 2.Cl2会和NaOH反应,会使得到的 NaOH不纯
淡盐水
阳极 金属钛网
Cl2 +
Cl2
H2 -
H+ Na+
NaOH溶液
阴极 碳钢网
Cl—
OH—
阴
阳
极
极
室
室 精制饱和
离子交换膜
NaCl溶液
阴极:
无论是惰性电极还是活性电极都不参与电极反应,发生反应的 是溶液中的阳离子。阳离子在阴极上放电顺序是:
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>
Al3+>Mg2+>Na+>Ca+>K+
放电
Hale Waihona Puke 放电由易到难顺序1、以石墨作电极分别电解下列溶液,在阴 极不能得到氢气的是( B) A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
H2O(含少量NaOH)
1、生产设备名称:离子交换膜电解槽 阳极:金属钛网(涂钛钌氧化物) 阴极:碳钢网(有镍涂层) 阳离子交换膜:只允许阳离子通过,把电解
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
上述装置的弱点:
1.H2和Cl2 混合不安全 2.Cl2会和NaOH反应,会使得到的 NaOH不纯
淡盐水
阳极 金属钛网
Cl2 +
Cl2
H2 -
H+ Na+
NaOH溶液
阴极 碳钢网
Cl—
OH—
阴
阳
极
极
室
室 精制饱和
离子交换膜
NaCl溶液
阴极:
无论是惰性电极还是活性电极都不参与电极反应,发生反应的 是溶液中的阳离子。阳离子在阴极上放电顺序是:
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>
Al3+>Mg2+>Na+>Ca+>K+
放电
Hale Waihona Puke 放电由易到难顺序1、以石墨作电极分别电解下列溶液,在阴 极不能得到氢气的是( B) A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
H2O(含少量NaOH)
1、生产设备名称:离子交换膜电解槽 阳极:金属钛网(涂钛钌氧化物) 阴极:碳钢网(有镍涂层) 阳离子交换膜:只允许阳离子通过,把电解
人教版《电解原理》公开课课件PPT3

活泼金属作阳极,则金属首先失电子,发生氧化反应。
活泼金属作阳极,金属失电子被氧化,
当溶液中有多种离子时,哪种离子先放电?
惰性电极(C、Pt、Au):
【思考】 原电池是 把化学能转化为电能 的装置。 电解池是 把电能转化为化学能 的装置。
【实验4-2】
在U形管中注入质量分数为25%CuCl2溶液,插入两根石墨棒 作电极材料,把湿润的碘化钾淀粉试纸放在与直流电源正极 相连的石墨棒附近。接通直流电源,观察U形管内的现象和试 纸颜色的变化。
【练一练】 1.判断正误
(1)电解是把化学能转化为电能( × ) (2)电解质溶液导电一定发生化学反应( √) (3) 某 些 不 能 自 发 进 行 的 氧 化 还 原 反 应 , 通 过 电 解 可 以 实 现
( √) (4)任何溶液被电解时,必须导致氧化还原反应的发生( √) (5)电解、电离均需要通电才能实现( × ) (6)电解质溶液的导电过程就是该溶液的电解过程( √ )
人生不得行胸怀,虽寿百岁犹为无也。
壮志与毅力是事业的双翼。
三、放电顺序 阳极:活泼金属作阳极,则金属首先失电子,发生氧化反应。 若是惰性电极作阳极,则只有溶液中阴离子放电。 失电子能力(还原性)强的离子先放电。
S2->I- >Br - > Cl- > OH- >含氧酸根(NO3- 、SO42-、CO32-)>F-
困,你是人类艺术的源泉,你将伟大的灵感赐予诗人。
电解是最强的氧化还原反应手段,是不可逆的。
Cu 在阴极放电: 2+ 与其当一辈子乌鸦,莫如当一次鹰。
电解池是
的装置。
活泼金属作阳极,则金属首先失电子,发生氧化反应。
Cl-在阳极放电:
1.3 课时2 电解原理的应用(18张PPT) 课件 高二化学鲁科版(2019)选择性必修1

四、冶炼活泼金属
电解熔融的氯化钠制取金属钠
电解工业上常利用电解法冶炼较活泼的金属(如钠、钙、镁、铝等),但不能电解其盐溶液,应电解其熔融态。
阳极:2Cl--2e-===Cl2↑
阴极:2Na++2e-===2Na
电解熔融的氧化铝制取金属铝
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-===4Al
Ni-2e-===Ni2+
(主要反应)
粗铜中比铜活泼的金属Zn、Fe、Ni等失去电子形成的阳离子进入溶液;不如铜活泼的金属Ag、Au、Pt等以金属单质的形式沉积在电解池的底部,与其他不溶性杂质混在一起形成阳极泥;阴极上得到精铜。
三、电镀
1.定义:应用电解原理,在金属表面镀上一薄层金属或合金的方法。2.目的:提高金属的抗腐蚀能力、耐磨性能或改善金属制品的外观。
电解熔融的氯化镁制取金属镁
阳极:2Cl--2e-===Cl2↑
阴极:Mg2++2e-===Mg
思考:电镀和电解精炼时,电解液的浓度分别有何变化?
电镀池中,电解液的浓度不变;电解精炼池中,电解液的浓度减小。
1.正误判断(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液(2)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变(3)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3(4)电解精炼时,阳极泥可以作为提炼贵重金属的原料(5)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等
电镀池
电镀液:
含有镀层金属离子的盐溶液
阳 极:
镀层金属
(与直流电源正极相连)
阴 极:
镀件
(与直流电源负极相连)
铁钉镀铜实验
电解熔融的氯化钠制取金属钠
电解工业上常利用电解法冶炼较活泼的金属(如钠、钙、镁、铝等),但不能电解其盐溶液,应电解其熔融态。
阳极:2Cl--2e-===Cl2↑
阴极:2Na++2e-===2Na
电解熔融的氧化铝制取金属铝
阳极:6O2--12e-===3O2↑
阴极:4Al3++12e-===4Al
Ni-2e-===Ni2+
(主要反应)
粗铜中比铜活泼的金属Zn、Fe、Ni等失去电子形成的阳离子进入溶液;不如铜活泼的金属Ag、Au、Pt等以金属单质的形式沉积在电解池的底部,与其他不溶性杂质混在一起形成阳极泥;阴极上得到精铜。
三、电镀
1.定义:应用电解原理,在金属表面镀上一薄层金属或合金的方法。2.目的:提高金属的抗腐蚀能力、耐磨性能或改善金属制品的外观。
电解熔融的氯化镁制取金属镁
阳极:2Cl--2e-===Cl2↑
阴极:Mg2++2e-===Mg
思考:电镀和电解精炼时,电解液的浓度分别有何变化?
电镀池中,电解液的浓度不变;电解精炼池中,电解液的浓度减小。
1.正误判断(1)在Fe上镀Ag,应用Fe作阳极,Ag作阴极,用AgNO3溶液作电镀液(2)电解精炼铜和电镀铜,电解质溶液中的c(Cu2+)均保持不变(3)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3(4)电解精炼时,阳极泥可以作为提炼贵重金属的原料(5)电解精炼铜和电镀铜过程中,阳极质量的减少与阴极质量的增加都相等
电镀池
电镀液:
含有镀层金属离子的盐溶液
阳 极:
镀层金属
(与直流电源正极相连)
阴 极:
镀件
(与直流电源负极相连)
铁钉镀铜实验
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重难点点拨三
三、电解液中离子浓度变化的分析 1、写出电极反应 2、分析离子消耗和离子生成的关系 例如:阳极: Ag — e- = Ag+
阴极: Ag+ + e- = Ag 电解时每当有1个电子发生转移,阳极上生成 1个Ag+ ,阴极上消耗1个Ag+ ,故电解液中 Ag+浓度不变。 注意:阴阳极电子数相等时才能分析
规律总结 思维升华
一、电解精炼铜 1、粗铜作阳极,精铜作阴极,
电解液含有Cu2+ 2、 Cu2+ 浓度减小 二、电镀 1、镀层金属作阳极,镀件作阴极,
电解液含有镀层金属阳离子 2、镀层金属阳离子浓度不变
三、知识迁移、思维发散
讨论要求: 各组讨论2—3分钟,统一答案 展示要求: 讨论结束,各组进行自由展示。准备好的小 组即可黑板展示。
二、合作探究、思维碰撞
讨论要求:
各组重Байду номын сангаас对电解精炼铜、电镀的电极反应、 计算、离子浓度变化讨论10分钟左右,统一 答案,总结方法规律
展示要求:
老师在讨论过程中下发《任务卡》,每题有 两个小组进行展示,讨论结束,两个小组自 由点评,后点评小组对先点评小组进行补充 或质疑,其它小组也可补充质疑。
电解精炼铜Cu2+浓度分析
第一阶段: 阳极: Zn - 2 e- = Zn2+ 阴极: Cu2+ + 2e- = Cu
阴极消耗Cu2+ ,阳极不生成Cu2+ ,故Cu2+ 浓度减小 第二阶段
阳极: Cu - 2 e- = Cu 2+ 阴极: Cu2+ + 2e- = Cu 阴极消耗Cu2+ ,阳极生成Cu2+ ,且消耗等 于生成,故Cu2+浓度不变
【学习目标】
1、能够准确分析电解精炼铜、电 镀的电极反应、溶液中离子的浓度 变化 2、学会电解精炼铜、电镀过程中 的计算题的解题方法
一、自主探究、温故旧知
要求:
认真观察后黑板指定小组展示的答案, 判断是否有误,如果有误,其它小组 可以用红色笔进行纠错。点评小组做 好准备,注意语言简洁。
方法小结 思维导引
• 分析电解反应的一般思路 • 一看 电极材料
阳极是否为活性电极 (除惰性电极Au、Pt、C外) • 二看 阴阳极离子
阳极找阴离子,阴极找阳离子 • 三看 放电顺序
阳极:活性电极>Cl->OH- >含氧酸根 阴极:Ag+ > Cu2+>H+>Na+
重难点点拨一
一、粗铜的放电顺序 1、粗铜中主要含有锌、银、金三种杂质。 2、根据金属活动性顺序表,可知其放电顺序:
电解原理的应用 ——电解精炼铜及电镀
高2016届高一化学备课组 孙晓林
学案反馈
一、优秀个人、优秀小组
1、优秀小组:2组
4组 6组 9组
2、优秀个人:屈万利 李仙 左宇鹏
张博 王瑞 李京京
二、存在问题
1、对电解精炼铜、电镀的内容不熟练,导致电极 反应式书写、离子浓度变化易出错。
2、对电解精炼铜、电镀中涉及的计算题的解题方 法不够熟练,导致不会计算或者计算错误。
锌> 铜>银 注意: 金属单质的放电顺序与金属离子的放电顺序 相反
重难点点拨二
二、电解反应中的计算 1、写出电极反应 2、从中找出电子和所求物质的比值关系 例如: 阳极: Zn - 2 e- = Zn2+
阴极: 2Ag+ + 2e- = 2Ag 电解时每当有2 mol 电子发生转移,阳极上失去 2 mol 电子,消耗1 mol锌 ,质量减少65g;阴极上 得到2 mol 电子,生成2 mol Ag,质量增加216g 注意: 转移的电子数=得到的电子数=失去的电子数
