高考化学图框流程图题的做法
高考化学工艺流程题解题方法

高考化学工艺流程题一、探究解题思路呈现形式:流程图、表格、图像 设问方式:措施、成分、物质、缘由实力考查:获得信息的实力、分解问题的实力、表达实力 学问落点:基本理论、元素化合物、试验无机工业流程图题能够以真实的工业生产过程为背景,体现实力立意的命题指导思想,能够综合考查各方面的基础学问及将已有学问敏捷应用在生产实际中解决问题的实力。
【例题】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO 3、MgSiO 3、CaMg(CO 3)2、Al 2O 3和Fe 2O 3等,回收其中镁的工艺流程如下:原 料:矿石(固体) 预处理:酸溶解(表述:“浸出”)除 杂:限制溶液酸碱性使金属离子形成沉淀核心化学反应是:限制条件,调整PH ,使Mg 2+全部沉淀 1. 解题思路明确整个流程及每一部分的目的 → 细致分析每步发生的反应及得到的产物 → 结合基础理论与实际问题思索 → 留意答题的模式与要点在解这类题目时:首先,要粗读试题,尽量弄懂流程图,但不必将每一种物质都推出。
其次,再精读试题,依据问题去细心探讨某一步或某一种物质。
第三,要看清所问题,不能答非所问,并留意语言表达的科学性在答题时应留意:前一问回答不了,并不肯定会影响回答后面的问题。
分析流程图须要驾驭的技巧是:① 阅读全题,确定该流程的目的——由何原料获得何产物(副产物),对比原料和产物;② 了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;③ 解析流程图并思索:从原料到产品依次进行了什么反应?利用了什么原理(氧化还原?溶解度?溶液中的平衡?)。
每一步操作进行到什么程度最佳?每一步除目标物质外还产生了什么杂质或副产物?杂质或副产物是怎样除去的?无机化工题:要学会看生产流程图,对于比较生疏且困难的流程图,宏观把握整个流程,不必要把每个环节的原理都搞清晰,针对问题分析细微环节。
考察内容主要有: 1)、原料预处理2)、反应条件的限制(温度、压强、催化剂、原料配比、PH 调整、溶剂选择)3)、反应原理(离子反应、氧化还原反应、化学平衡、电离平衡、溶解平衡、水解原理、物质的分别与提纯) 4)、绿色化学(物质的循环利用、废物处理、原子利用率、能量的充分利用) 5)、化工平安(防爆、防污染、防中毒)等。
解化学框图题的思维技巧

解化学框图题的思维技巧框图题是近几年高考化学命题的热点,这类题融元素化合物知识与基本概念、基础理论于一体,沟通各分散知识点间的内在联系,使之成为一个完整的知识网,侧重考查学生的综合应用能力。
本文以近年高考化学框图题为例,探讨解此类题的思维方法。
1 正向思维,“顺藤摸瓜”对某些框图题,解题时运用正向思维,根据题给条件,结合有关的化学知识,循着题意层次结构,逐步推理得出结论。
例1:从环己烷可制备1,4一环己二醇的二醋酸醋。
下面是有关的8步反应(其中所有无机产物都已略去):解析:反应①是环烷烃在光照条件下与C12发生取代反应,生成反应②是卤代烃与NaOH的醇溶液反应,其发生的是消去反应,生成物A则为反应③是环烯烃与C12在不见光的条件下发生加成反应,产物B为。
由到生成物,符合消去反应特点,故反应④为消去反应,显然条件为“浓H2SO4、醇、△”。
而到到减少一个双键,增加两个溴原子,则反应⑤为加成反应。
为最终得到环己二醉的二醋酸醋,反应⑥只能是卤代烃水解生成醇,则C为,反应⑦是二元醇和醋酸发生醋化反应,也是取代反应,生成,再经反应⑧加氢就得到最终产物O2。
该题正确答案为:①、⑥、⑦属于取代反应。
B为,C为,④所用试剂和条件是浓NaOH、醇、△。
2 逆向思维,发挥联想对某些框图题,解题时运用逆向思维,从产物入手分析,按流程相反方向步步推至主要原料,得出一系列正确的结论。
例2:由丁炔二醇可以制备1,3一丁二烯。
请在下面这个流程图的空框中填人有机产物的结构简式,在括号内填入反应试剂和反应条件。
解析:1,3一丁二烯含不饱和键,联想通过消去反应引入不饱和键的分子是醇或卤代烃,引入两个不饱和碳碳双键必为二元醇或二卤代烃,且烃基或卤原子在1,4两个碳原子上,则分别为1, 4一丁二醇(HO-CH2CH2CH2CH2 -OH)(条件:浓H2SO4、加热170°,工业上一般用Al2O3、加热36°C)。
1,4一二溴(或二氯)丁烷(Br一CH2CH2CH2CH2一Br)(条件:碱的醇溶液、加热)。
高中化学-化学工业流程图题解题技巧

高中化学-化学工业流程图题解题技巧高中化学化学工业流程图题解题技巧在高中化学的学习中,化学工业流程图题是一类常见且具有一定难度的题型。
这类题目通常以工业生产为背景,将化学知识与实际生产过程相结合,考查同学们对化学原理、实验操作、物质转化等多方面知识的理解和应用能力。
要想在这类题目中取得好成绩,掌握一些有效的解题技巧是至关重要的。
一、认真审题,把握整体拿到一道化学工业流程图题,首先要做的就是认真审题,仔细观察流程图的结构和走向。
了解题目所涉及的工业生产背景,明确生产的目的和主要产品。
同时,注意题目中的文字说明、数据、条件等信息,这些都是解题的关键线索。
在审题过程中,要对整个流程有一个大致的认识,搞清楚原料是什么,经过了哪些主要的反应和操作步骤,最终得到了什么样的产物。
通过这样的整体把握,可以为后续的解题思路奠定基础。
二、分析流程中的关键环节1、原料预处理原料往往需要经过一系列的预处理,如粉碎、溶解、除杂等。
思考这些预处理步骤的目的是什么,比如粉碎可以增大反应物的接触面积,提高反应速率;溶解是为了使反应物在溶液中更好地进行反应;除杂则是为了除去可能影响反应进行或产品质量的杂质。
2、化学反应流程图中会涉及多个化学反应,要弄清楚每个反应的反应物、生成物以及反应条件。
判断反应的类型(如氧化还原反应、酸碱中和反应等),并运用化学平衡、化学反应速率等知识分析反应的进行情况。
3、分离提纯在工业生产中,得到的产物往往需要进行分离提纯,以获得高纯度的产品。
常见的分离提纯方法有过滤、结晶、蒸馏、萃取等。
要理解每种方法的适用条件和原理,根据题目中的具体情况判断应该采用哪种方法。
4、循环利用注意流程图中是否存在物质的循环利用。
循环利用可以提高原料的利用率,降低生产成本,减少废弃物的排放。
分析哪些物质可以循环利用以及循环利用的途径。
三、关注题目中的设问题目中的设问通常是有针对性的,要根据设问的要求有重点地分析流程图。
如果是问某一步骤的作用,就要结合前后的步骤和相关的化学知识进行回答;如果是计算某种物质的含量或产率,就要找出相关的化学反应方程式,利用题目中给出的数据进行计算。
化学流程图题解题思路

化学流程图是一种表示化学反应过程的图形工具。
通常由反应物、产物、化学反应、转化和箭头等符号组成。
化学流程图可以帮助理解化学反应的过程,并分析化学反应的机理。
解题时,需要从左到右、从上到下依次阅读化学流程图,并逐步分析反应物、产物、反应条件和反应过程。
根据化学流程图中的信息,可以得出反应方程式并计算反应的化学计量数据。
在解题时,还可以考虑化学流程图中的其他信息,例如反应所需的能量、温度、压强、催化剂等。
这些信息可以帮助理解反应的物理化学机理,并为进一步研究化学反应提供依据。
总的来说,解题时需要仔细阅读化学流程图,并依次分析反应物、产物、反应条件和反应过程等信息,同时考虑其他影响反应的因素,最后得出反应方程式并计算化学计量数据。
流程图化学题做法总结

流程图化学题做法总结下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!一、流程图化学题的特点。
流程图化学题是一种常见的化学题型,它通常以流程图的形式呈现化学反应或化学过程,并要求学生根据流程图回答相关问题。
高考化学专题复习试题:化学工业流程图题解题技巧

高考化学专题复习试题:化学工业流程图题解题技巧高考化学专题复习试题:化学工业流程图题解题技巧 1、工业流程图题做题原则:(1)、首先快速审题,明确实验目的,解决“干什么”(2)、“怎么做”:迅速把握文字材料和方框中有效信息,仔细分析每一步发生的反应及得到的产物。
把产物或得到的滤液、滤渣等成分写在流程图相应位置上。
(3)、遇到不懂的信息或问题可以跳过去,到时再说,有些提供的信息可能在问题中根本没及,有些信息则可以结合问题帮助理解。
4)、可以在问题中寻找一些相对独立的问题作答,节约审题时间。
(2、在化学工业中应考虑的问题,可以归纳如下:化学反应原理——化学原理在实际工业上是否可行成本要低——原料的选取使用、设备的损耗等,这是整个过程都需考虑的问题 ?原料的利用率要高——利用好副产品、循环使用原料、能量尽可能利用 ?生产过程要快——化学反应速率产率要高——化学平衡产品要纯——产品的分离、提纯环保问题——反应物尽可能无毒无害无副作用,“三废”的处理 3、由此,化工题常考查的知识点则总结如下:化学反应原理——化学(离子)方程式的书写、无机物的性质及制备 ?化学反应速率原理化学平衡原理水解理论化学反应与能量——热量的计算(盖斯定律),电化学(电解、电镀) ?物质制备和分离的知识——基础实验 ?绿色化学的观点 4、工业流程题目在流程上一般分为3个过程:原料处理?分离提纯?获得产品(1)原料处理阶段的常见考点与常见名词加快反应速率溶解:通常用酸溶。
如用硫酸、盐酸、浓硫酸等水浸:与水接触反应或溶解浸出:固体加水(酸)溶解得到离子酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程 ?灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解 ?控制反应条件的方法(2)分离提纯阶段的常见考点调pH值除杂a(控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀b(调节pH所需的物质一般应满足两点:,能与H反应,使溶液pH值增大;不引入新杂质。
高中化学-化学工业流程图题解题技巧

高中化学-化学工业流程图题解题技巧1、工业流程图题做题原则:(1)、首先快速审题,明确实验目的,解决“干什么”(2)、“怎么做”:迅速把握文字材料和方框中有效信息,仔细分析每一步发生的反应及得到的产物。
把产物或得到的滤液、滤渣等成分写在流程图相应位置上。
(3)、遇到不懂的信息或问题可以跳过去,到时再说,有些提供的信息可能在问题中根本没及,有些信息则可以结合问题帮助理解。
(4)、可以在问题中寻找一些相对独立的问题作答,节约审题时间。
2、在化学工业中应考虑的问题,可以归纳如下:①化学反应原理——化学原理在实际工业上是否可行②成本要低——原料的选取使用、设备的损耗等,这是整个过程都需考虑的问题③原料的利用率要高——利用好副产品、循环使用原料、能量尽可能利用④生产过程要快——化学反应速率⑤产率要高——化学平衡⑥产品要纯——产品的分离、提纯⑦环保问题——反应物尽可能无毒无害无副作用,“三废”的处理3、由此,化工题常考查的知识点则总结如下:①化学反应原理——化学(离子)方程式的书写、无机物的性质及制备②化学反应速率原理③化学平衡原理④水解理论⑤化学反应与能量——热量的计算(盖斯定律),电化学(电解、电镀)⑥物质制备和分离的知识——基础实验⑦绿色化学的观点4、工业流程题目在流程上一般分为3个过程:原料处理→分离提纯→获得产品(1)原料处理阶段的常见考点与常见名词①加快反应速率②溶解:通常用酸溶。
如用硫酸、盐酸、浓硫酸等水浸:与水接触反应或溶解浸出:固体加水(酸)溶解得到离子酸浸:在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解过程③灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解④控制反应条件的方法(2)分离提纯阶段的常见考点①调pH值除杂a.控制溶液的酸碱性使其某些金属离子形成氢氧化物沉淀b.调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH值增大;不引入新杂质。
高考化学考点突破:无机框图与微型工艺流程图推断题的解题策略

无机框图与微型工艺流程图推断题的解题策略[解题思维]推断思路:迅速浏览、整体扫描、产生印象、寻找“突破口”,突破口由点到面、随时检验、注意联系、大胆假设、全面分析(正推或逆推)、验证确认。
推断题的解题方法及推理过程表示如下:框图流程图 ――→审题⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫明显条件隐含条件――→抓关键(突破口)⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫结构特征反应特征现象特征其他特征――→推断结构―→验证 1.方法一——抓住“物质颜色”作为突破口(1)有色固体:①红色:Cu 、Cu 2O 、Fe 2O 3;②红褐色:Fe(OH)3;③黄色:AgI 、Ag 3PO 4;④淡黄色:Na 2O 2、AgBr 、S ;⑤蓝色:Cu(OH)2、CuSO 4·5H 2O ;⑥黑色:炭粉、CuO 、FeO 、FeS 、CuS 、Ag 2S 、PbS ;⑦紫黑色:KMnO 4、I 2。
(2)有色溶液:Fe 2+(浅绿色)、Fe 3+(黄色)、Cu 2+(蓝色)、MnO -4(紫红色)、I 2水(棕黄色)、I 2/CCl 4(或汽油、苯)(紫红色)、Fe 3+与SCN -(红色)、I 2与淀粉(蓝色)等。
(3)有色气体:Cl 2(黄绿色);Br 2(g)、NO 2(红棕色);I 2(g)(紫色);O 3(淡蓝色)等。
(4)火焰颜色:①焰色反应:Na +(黄色)、K +(紫色,透过蓝色钴玻璃)、Ca 2+(砖红色)等;②淡蓝色:S 、H 2、H 2S 、CH 4等在空气中燃烧;③苍白色:H 2在Cl 2中燃烧。
2.方法二——抓住“物质的特征性质”作为突破口(1)能使品红溶液褪色的气体:SO 2(加热后又恢复红色),Cl 2(加热后不恢复红色)等。
(2)沉淀特殊的颜色变化白色沉淀先变灰绿色,再变红褐色:Fe(OH)2――→放置于空气中Fe(OH)3 (3)在空气中变为红棕色:NO ――→空气NO 2。
(4)通入CO 2气体变浑浊的溶液:澄清石灰水(CO 2过量则变澄清)、Na 2SiO 3溶液、饱和Na 2CO 3溶液、NaAlO 2溶液等。
高考化学化工流程题如何答题

高考化学化工流程题如何答题第一,要对“化工流程图”试题的结构有全面充分的认识,通过对试题结构的分析可知,该类试题一样可由以下几个部分组成。
1.“化工流程图”试题要紧分三部分:(1)题干部分:介绍原材料及所要得到的目标产品,以图表、化学反应方程式、文字表达等提供解决问题的信息。
(2)流程图部分:出现整个化工生产过程。
一样流程图也可分为三部分:即原料的预处理,物质的分离提纯(题目的关键部分)和产品获得。
有的流程图在这三部分中还包括三条线索,主线主产品、侧线副产品、回头线为可循环利用的反应物。
(3)问题部分:提出了所要解决的问题。
2.解题思路明确整个流程及每一部分的目的→认真分析每步发生的反应及得到的产物→结合基础理论与实际问题摸索→注意答题的模式与要点,并注意语言表达的科学性,在答题时应注意:前一问回答不了,并不一定会阻碍回答后面的问题。
分析流程图需要把握的技巧是:①扫瞄全题,确定该流程的目的———由何原料获得何产物(副产物),对比原料和产物;②了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;③解析流程图并摸索:从原料到产品依次进行了什么反应?利用了什么原理(氧化还原、溶解度、溶液中的平稳)?每一步操作进行到什么程度最佳?每一步除目标物质外还产生了什么杂质或副产物?杂质或副产物是如何样除去的?关于比较生疏且复杂的流程图,宏观把握整个流程,不必要把每个环节的原理都搞清晰,针对问题分析细节。
努力做到以下几点:(1)正确解读试题信息,明白得问题的实质。
这是准确回答试题的前提。
(2)善于运用化学学科思想、观点、方法分析问题,正确沟通现实问题与学科知识的关系,找到解决问题的途径、思路。
(3)能熟练调动和运用已学知识并与问题提供的信息整合起来。
这是正确解答试题的关键。
(4)能正确运用规范的化学用语,清晰、严密地组织和表述答案。
这是成功解答试题的保证。
流程图题的解题方法与技巧

高考化学“流程图”试题的解答

原料(含Br—)
氧化剂
产物(Br2)
空气吹出法是目前从海水中提取溴的常用方法,流程 如下(苦卤:海水蒸发结晶分离出食盐后的母液):
Cl2+2Br-=Br2+2Cl反应物 生成物
反应物 2+2H2O=2Br-+SO42-+4H+ Br2+SO 生成物
(1)反应①中通入Cl2气体的目的是(用离子方程式 Cl2+2Br-=Br2+2Cl-。 表示) (2)通入空气、水蒸汽的目的是 吹出Br2 。 蒸馏 或萃取 (3)已知溴的沸点是59℃,操作1的名称是 。
3.一般有三大类工艺流程:
其一,化工生产工艺流程; 其二,物质提取工艺流程; 其三,水处理工艺流程。
4、解题方法
解题思路:工艺流程的主要框架是:
原料
Ⅰ预处理
Ⅱ分离提纯
Ⅲ核心反应
产物
原料预处理
除杂、净化
产品的分离 提纯
原料 无机矿物
核心 化学反应
反应条件的控制 原料的循环利用
所需 产品
排放物的无害化处理
一步骤对 Cl-和 SO2-是没什么影响的, 所以流程图中出现 4 了一个蒸发浓缩结晶和趁热过滤的操作, 这肯定是为了使 一个随温度升高溶解度变化不大或减小的物质析出来, 通 过读图可得出 Na2CO3· 2O 符合这一条件, H 这样可以通过
2 趁热过滤除去 Cl-、SO4-和一些沉淀不完全的离子。由于
NaOH pH=5.5 过 滤 NaOH pH=12.5 滤液: 过滤
MgCl2 Mg(OH)2
滤液Ⅱ: Ca2+、Na+ SO42-
滤渣Ⅰ:
Mg2+、Ca2+、 SO42-、Na+
化学框图题的求解方法
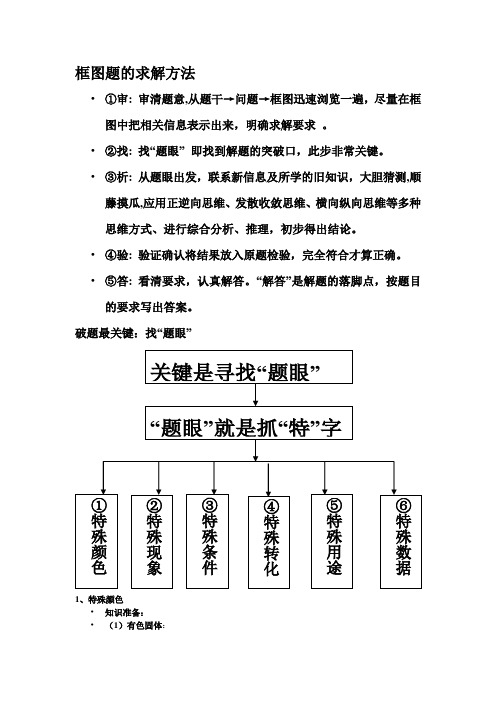
框图题的求解方法•①审: 审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
•②找: 找“题眼”即找到解题的突破口,此步非常关键。
•③析: 从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论。
•④验: 验证确认将结果放入原题检验,完全符合才算正确。
•⑤答: 看清要求,认真解答。
“解答”是解题的落脚点,按题目的要求写出答案。
破题最关键:找“题眼”1、特殊颜色•知识准备:•(1)有色固体:•红色:Cu、Fe2O3;•紫黑色:KMnO4•黑色:Fe3O4、MnO2、C粉、CuO、Fe粉•(2)有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)•(3)沉淀颜色:CaCO3(白色可溶于酸的沉淀)2、典型性质:常温下的无色液体H2O;不溶于水的白色固体一般是CaCO3;密度最小的气体为H2;地壳中含量最多的元素为O,最多的金属元素为Al;常见的气体:O2、H2、CO、CO2、CH4;具有可燃性的物质:H2、CO、C;助燃性的气体:O2等3、特征现象•1、特征反应现象:(1)物质与酸反应有大量气泡产生的金属与酸或碳酸盐与酸(2)产生白色沉淀反应:二氧化碳与石灰水、碳酸钠与石灰水、氯化钙和碳酸钠(3)能使紫色的石蕊变红的是酸,变蓝的是碱;使无色的酚酞变红的是碱或碳酸钠4、特殊条件•点燃: 一般是有氧气参加的反应•通电: 电解水•催化剂:过氧化氢分解制氧气•高温:一氧化碳与氧化铁反应;•碳酸钙高温分解5、特殊转化掌握一些互相转化关系各类物质间的三角关系网•二氧化碳•有二氧化碳生成的反应:•C、CO、CH4 、C2H5OH的燃烧•碳酸钙、碳酸的分解•碳酸盐与酸的反应•一氧化碳还原氧化铁•有二氧化碳参加的反应•二氧化碳与水•二氧化碳与氢氧化钙•二氧化碳与氢氧化钠•水•有水生成的反应:•氢气、甲烷、酒精燃烧•碳酸、过氧化氢的分解•金属氧化物与酸的反应•非金属氧化物与碱的反应•酸碱中和•碳酸盐与酸的反应•有水参加的反应:•二氧化碳与水的反应•氧化钙与水的反应•电解水•有氧化铁参加的反应•1、氧化铁与酸的反应;•2、氧化铁与一氧化碳的反应•有氧化钙参加的反应•1、氧化钙与水的反应;•2、氧化钙与酸的反应6、常用做突破的反应类型•分解反应:H2O2、KMnO4、H2O、H2CO3 CaCO3分解•置换反应:金属与酸(金属→非金属)•金属与盐溶液(金属→金属)7、从特殊用途中寻找•知识准备:•O2:炼钢、医疗CO:炼铁、燃料CO2:灭火人工降雨CaO:建筑材料Ca(OH)2:制波尔多液、改良酸性土壤CaCO3:建筑材料、工业制CO2NaOH:化工原料、制肥皂、精炼石油、造纸、纺织;固体可作某些气体干燥剂HCl :除锈、少量助消化、制化肥H2SO4:除锈、制化肥,浓硫酸可作某些气体干燥剂碳酸钠:用于玻璃、造纸、纺织和洗涤剂生产碳酸氢钠:发酵粉的主要成分,可治疗胃酸•氯化钠:医疗生理食盐水,农业选种,融雪剂,工业制碳酸钠、氢氧化钠、氯气、盐酸等。
高中化学框图题的解答技巧学法指导
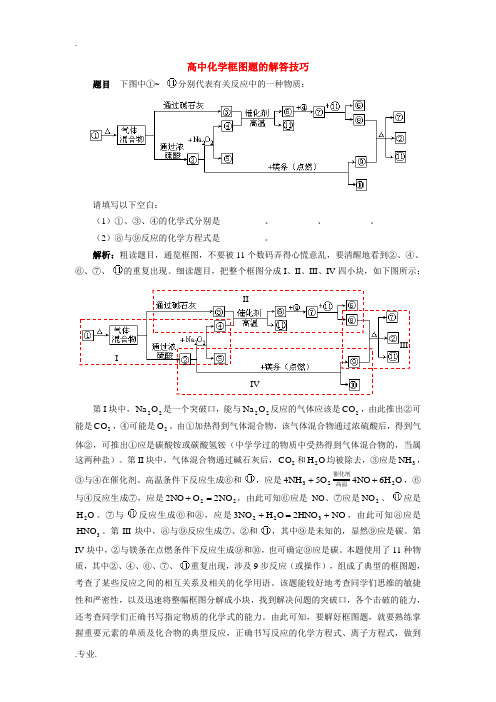
高中化学框图题的解答技巧题目 下图中①~ 分别代表有关反应中的一种物质:请填写以下空白:(1)①、③、④的化学式分别是__________、__________、__________。
(2)⑧与⑨反应的化学方程式是__________。
解析:粗读题目,通览框图,不要被11个数码弄得心慌意乱,要清醒地看到②、④、⑥、⑦、的重复出现。
细读题目,把整个框图分成I 、II 、III 、IV 四小块,如下图所示: IVIII III第I 块中,22O Na 是一个突破口,能与22O Na 反应的气体应该是2CO ,由此推出②可能是2CO ,④可能是2O 。
由①加热得到气体混合物,该气体混合物通过浓硫酸后,得到气体②,可推出①应是碳酸铵或碳酸氢铵(中学学过的物质中受热得到气体混合物的,当属这两种盐)。
第II 块中,气体混合物通过碱石灰后,2CO 和O H 2均被除去,③应是3NH ,③与④在催化剂、高温条件下反应生成⑥和,应是O H 6NO 4O 5NH 4223++高温催化剂,⑥与④反应生成⑦,应是22NO 2O NO 2=+,由此可知⑥应是NO 、⑦应是2NO 、应是O H 2。
⑦与反应生成⑥和⑧,应是NO HNO 2O H NO 3322+=+,由此可知⑧应是3HNO 。
第III 块中,⑧与⑨反应生成⑦、②和,其中⑨是未知的,显然⑨应是碳。
第IV 块中,②与镁条在点燃条件下反应生成⑨和⑩,也可确定⑨应是碳。
本题使用了11种物质,其中②、④、⑥、⑦、重复出现,涉及9步反应(或操作),组成了典型的框图题,考查了某些反应之间的相互关系及相关的化学用语。
该题能较好地考查同学们思维的敏捷性和严密性,以及迅速将整幅框图分解成小块,找到解决问题的突破口,各个击破的能力,还考查同学们正确书写指定物质的化学式的能力。
由此可知,要解好框图题,就要熟练掌握重要元素的单质及化合物的典型反应,正确书写反应的化学方程式、离子方程式,做到知识存储有序。
高考化学图框流程图题的解法

高考化学图框流程图题的解法高考理综Ⅱ卷中,化学几乎年年有一个流程图的大题,涉及元素化合物组成、性质、变化、制备、分离、除杂、提纯等,信息量大、生僻,学生不易下手,往往望而生畏。
熟练掌握元素化合物知识和实验知识,注重结合化学在生产生活中的应用,是做好这类题的基础。
解题过程中,还可能涉及化学原理的应用。
做好这类题,要抓住三点:题干、图框、单箭号挖掘信息:一、题干信息的挖掘:题干中往往提示初始原料的成分和流程设计的要求或原理。
初始原料一定要分析全面:相互之间有无影响、如何分离?流程设计要求是什么?主要原理是什么?这些信息往往在题干中出现,只要学生不恐慌,都能挖掘出来。
二、图框信息的挖掘:图框中物质的成分一定要分析全面,相互之间如何分离?是进一步做好的关键。
如果成分分析不全面,往往断章取义,后面不可能再做正确。
三、单箭号信息的挖掘:单箭号上往往设计再加入的物质、反应条件、分离方法等。
只有全面挖掘出以上三点的信息,才能整合信息,利用所学化学知识:元素化合物知识和实验知识,解决好这类题目。
【例】过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。
“绿色自由”构想技术流程如下(1)写出吸收池中主要反应的离子方程式_________________;在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式________________。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________。
(3)甲醇可制作燃料电池。
写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________________。
当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
高考化学常见题型解题技巧——解无机框图题六法 (4)

解无机框图题六法循序渐进法循序渐进法有顺推法和逆推法。
当框图中给出了起始物质时,采用顺推法,即根据框图中的关系,结合有关化学知识,以题意的层次结构,沿着一条链一步一步往某个方向走,分析递变过程而获解。
当框图中给出了生成物时,采用逆推法,即以最终产物作为起点,层层逆推,形成思路,得出结论。
解题的关键是要熟练掌握已知物的俗名、组成和性质。
图1 物质转化关系请填写以下空白:⑴孔雀石的主要成分是CuCO3 . Cu(OH)2(碱式碳酸铜),受热易分解。
上图中的F是。
⑵写出明矾溶液与过量NaOH溶液反应的离子方程式:。
⑶图1中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式。
⑷每生成1molD,同时生成molE。
解析:明矾的化学式为KAl(SO4)2 . 12H2O,其中只有Al3+能与NaOH溶液反应,产物是NaAlO2和水,根据难溶碳酸盐、难溶的碱受热分解的规律知,孔雀石受热分解的产物为CuO、CO2和H2O,其中只有CO2可与NaAlO2及H2O反应生成Al(OH)3和Na2CO3(或NaHCO3), Al(OH)3受热分解产生Al2O3,电解Al2O3生成Al和O2,由铝和铁的氧化物的反应可推得Al和CuO高温一定能反应生成Cu。
答案:⑴CO2⑵Al3+ + 4OH—== AlO2—+ 2H2O ⑶2Al + 3CuO高溫3Cu + Al2O3 ⑷0.75题眼扩展法若未给出框图中起始物质或最终产物时,可通过题中的文字说明和框图中的实验现象等,找出解题的突破口,即“题眼”。
题眼可以是一种物质,也可以是一类物质,在从题眼中的物质向前或向后扩展,找出其它物质。
解题的关键是要熟悉中学化学范围内的元素化合物的特征性质、特征的实验现象等,一般都能顺利解答这类推断题。
NaOH 溶液 盐酸 NaOH 溶液过滤② 足量CO 2 盐酸NaOH 溶液 氨水图2 物质转化关系请回答:⑴A 、B 的化学式分别为 、 。
最新高考化学无机框图题的解法与技巧

最新高考化学无机框图题的解法与技巧2.题眼扩展法当框图中未给出起始物质时,可通过题中的文字和框图中的实验现象等,找出解题的突破囗,也即“题眼”,题眼可以是一种物质,也可以是一类物质,再从题眼中的物质向前或后扩展,找出其它物质。
3.试探法当通过题中文字说明和框图中的变化无法找到相应物质时,此时,可通过题中规律,将中学化学中的常见物质代入试探,如发现试探的物质不符合时,再代入其它物质,直至获得结果。
4.迁移类比法当框图中的物质不是中学化学中的常见物质时,可依据元素周期表中元素的递变规律,将学过的物质的性质迁移到新物质中,而进行类比分析。
经典题:例题1:(2001年上海高考)利用天然气合成氨的工艺流程示意如下:依据上述流程,完成下列填空:(1)天然气脱硫时的化学方程式是(2)nmolCH4经一次转化后产生CO0.9nmol、产生H2mol(用含n的代数式表示)(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是(多选扣分)a.相似相溶原理b.勒夏特列原理c.酸碱中和原理(4)由KHCO3分解得到的CO2可以用于(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
方法:从起始物质循序渐进分析。
捷径:(1)根据框图中的物质变化,可得脱硫方程式3H2S+2Fe(OH)3→Fe2S3+6H2O。
(2)一次转化所发生的反应是CH4+H2O=CO+3H2,根据产生CO0.9nmol知,参加反应的CH4为0.9nmol,生成的H2为3某0.9n=2.7nmol(3)K2CO3(aq)+CO2(g)+H2O(l)=2KHCO3(aq)这是气体体积缩小的反应,根据平衡移动原理,增大压强有利于KHCO3的生成。
以此得b。
(4)CO2的用途较多,如纯碱、作制冷剂、人工降雨等。
(5)根据图示,将课本中的知识迁移知,在合成氨的反应中,N2、H2经合成塔合成氨后,还有大量的N2、H2未参加合成,所以除NH3后的N2、H2重新回到合成塔,再进行合成氨反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学图框流程图题的做法
高考理综Ⅱ卷中,化学几乎年年有一个流程图的大题,涉及元素化合物组成、性质、变化、制备、分离、除杂、提纯等,信息量大、生僻,学生不易下手,往往望而生畏。
熟练掌握元素化合物知识和实验知识,注重结合化学在生产生活中的应用,是做好这类题的基础。
解题过程中,还可能涉及化学原理的应用。
做好这类题,要抓住三点:题干、图框、单箭号挖掘信息:
一、题干信息的挖掘:题干中往往提示初始原料的成分和流程设计的要求或原理。
初始原料一定要分析全面:相互之间有无影响、如何分离?流程设计要求是什么?主要原理是什么?这些信息往往在题干中出现,只要学生不恐慌,都能挖掘出来。
二、图框信息的挖掘:图框中物质的成分一定要分析全面,相互之间如何分离?是进一步做好的关键。
如果成分分析不全面,往往断章取义,后面不可能再做正确。
三、单箭号信息的挖掘:单箭号上往往设计再加入的物质、反应条件、分离方法等。
只有全面挖掘出以上三点的信息,才能整合信息,利用所学化学知识:元素化合物知识和实验知识,解决好这类题目。
【例】(16分)过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,
经化学反应后使空气中的CO2转变为可再生燃料甲醇。
“绿色自由”构想技术流程如下:
(1)写出吸收池中主要反应的离子方程式;
在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(3)甲醇可制作燃料电池。
写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。
当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。
某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K= ;此时在B点时容器的体积V B 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间t A t C(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施
是(答出两点即可)。
【分析】:(一)分析题干,获得信息:
(1)含CO2的空气的主要成分:N2、O2、CO2
(2)CO2被K2CO3吸收变为KHCO3;然后分解收集CO2;CO2与H2制备CH3OH
(二)分析图框、箭号,获得信息:
(1)图框一成分:K2CO3;CO2被其吸收生成KHCO3后,N2、O2逸出。
(2)图框二成分:KHCO3;在箭号加入物质高温水蒸气作用下,分解,K2CO3溶液循环利用,CO2进入下一图框
(3)图框三成分:CO2与箭号加入物质H2,在一定条件下合成甲醇,水蒸气循环利用。
这样,这道题的主干信息全部捕捉到了,剩下的按题目的要求解决问题。
【答案】
(1)CO32-+ CO2+H2O =2HCO3-
CO2(g)+3H2(g) ==CH3OH(g)+H2O(g) ΔH=-49.47kJ•mol-1
(2)高温水蒸气
(3)CH3OH+8OH-—6e-=CO32-+6H2O;1.2mol
(4)①1(L/mol)2 小于②大于
③降温、加压, 将甲醇从混合体系中分离出来(答出两点即可)
【例2】(12分)(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是 .
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
范围。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是。
(3)在硝酸铜溶液中,各种离子浓度由大到小的顺序
是。
【分析】
(一)分析题干,获得信息:
(1)原料粗铜成分为Cu、Fe
(2)制备Cu(NO3)2晶体
(二)分析图框、箭号,获得信息:
(1)图框一和箭号加入物质硝酸:粗铜加硝酸,氮氧化物重新转化为硝酸(需要氧气),既提高硝酸的利用率,又防止污染。
“保温去铁”:反应后成分为Cu(NO3)2、Fe(NO3)3,怎样去“铁”?(Fe3+),利用其易水解,加入试剂除铁同时,不引入新杂质。
用什么?
(2)图框二:过滤掉Fe(OH)3
(3)图框三:滤液为Cu(NO3)2溶液,加HNO3抑制其水解。
(4)图框四:冷却结晶,过滤,得目标晶体,滤液为其溶液循环利用。
【答案】
(1)①提高原料的利用率,减少污染物的排放(2分)②3.2~4.7 (2分)加水会将溶液稀释,不利于将滤液蒸发浓缩(2分)③由于Cu2+
发生水解:Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解(2分)
(2)Cu2++2e-=Cu (2分)
(3)[NO3-]>[Cu2+]>[H+]>[OH-] (2分)。
