2013届高三《铁铜及其化合物》复习--FFQ
高三化学第一轮复习方程式专练---铁铜及其化合物

铁铜及其化合物方程式1.铁与氧气反应:___________ ________________2.铁与硫反应:_________ __________________3.铁与氯气反应:____________ _______________4..铁与盐酸反应:离子方程式:____________ _______________5.铁与CuSO4溶液:离子方程式:__________ _________________6、铁和水蒸气:________________ ____________________________7、少量的铁与浓硝酸共热: ___________ ______________离子方程式:_______________ ___________8、过量的铁与浓硝酸共热:离子方程式:____________ _______________9、少量的铁与稀硝酸反应:___________ ________________离子方程式:_________________ __________10、过量的铁与稀硝酸反应:____________ _______________ 离子方程式:___________ ________________11.铁与硝酸银溶液反应:离子方程式:_____________________12、铁与氯化铁溶液反应:离子方程式:__________ _____________13.氧化亚铁与稀硫酸反应:______ _______________离子方程式:___________ _________14.氧化铁与盐酸反应:_______ ___________离子方程式:___________ ___________15.CO还原氧化铁:________________________ __________________16.铝和氧化铁高温下反应:______________ _________17.氢氧化亚铁在空气中被氧化:___________ ____________18.氢氧化铁与稀硫酸反应:_____________ ________离子方程式:________ ____________19、氢氧化铁受热分解:____________ ___________20.氯化亚铁溶液中通入氯气:___________ _________离子方程式:_________ ___________21、氯化亚铁溶液中加入溴水:离子方程式:____________________22、氯化亚铁溶液呈酸性:_________ ______________离子方程式:______ ______________23、氯化亚铁溶液中加入氢氧化钠溶液:________ _______离子方程式:______ _________24、氯化铁溶液中加入氨水:______ ___________离子方程式:____________ ________25、铜和氯化铁溶液反应:________ __________离子方程式:_____________ _______26、氯化铁溶液呈酸性:______________ _____离子方程式:_____ _______________27、氯化铁与氢氧化钠溶液:__________ __________离子方程式:_________ ___________28、向氯化铁溶液中加入碳酸钠溶液::离子方程式:__________ __________29、向氯化铁溶液中加入碳酸氢钠溶液:离子方程式:_______ _____________30、向氯化铁溶液中加入偏铝酸钠溶液:离子方程式:_________ ___________31.除去FeCl2中的FeCl3:__________ ___________离子方程式:__________ _____________32.氯化铁与硫氰化钾溶液反应:___________ ____________________铜及其化合物1.铜与氧气反应:________ ___________________2.铜与氯气反应:__________________ _________3.铜与硫反应(产物为硫化亚铜): _______________ ____________4.铜与浓硫酸反应: _______________ ____________5.铜与浓硝酸反应: ________________ ___________离子方程式 ____________________ _______6.铜与稀硝酸反应:_________________ __________离子方程式 _________________ __________7.与硝酸银溶液反应;______________ _____________离子方程式 _____________________ ______9.湿法炼铜(铁和硫酸铜反应)_________________ __________ 离子方程式_____________________ ______11.一氧化碳还原氧化铜 ___________ ________________12.Cu(OH)2受热分解 __________________ _________复习巩固1.钠与水反应:_________ ___________离子方程式:_______________ _____________2.过氧化钠与二氧化碳反应:3.过氧化钠与水反应: _4.NaOH溶液中吸收氯气:离子方程式:_________ __ ________5.NaOH溶液中加入铝片:离子方程式:___________ _ _________6.除去碳酸钠溶液中的碳酸氢钠:离子方程式:7.除去碳酸钠固体中的碳酸氢钠:8、铝和氢氧化钠溶液反应:______________________________________________离子方程式:______________________________________________9、氧化铝与稀硫酸反应:离子方程式:______________________________________________10.氧化铝与氢氧化钠溶液反应:离子方程式:_________________________________________11、氢氧化铝与稀硫酸反应:离子方程式:_____________________________________________12、氢氧化铝与氢氧化钠溶液反应:离子方程式:_______________________________________13、硫酸铝溶液中加入足量的氨水:离子方程式:_______________________________14、向硫酸铝溶液中加足量的氢氧化钠溶液:离子方程式:_______________________________15、偏铝酸钠溶液通入足量二氧化碳气体:_____________________________________离子方程式:_______________________________________________________16、镁与二氧化碳反应:___________________________________________17、氯化镁与氨水反应:离子方程式:________________________。
高三化学一轮复习——铁铜及其重要化合物
(5)向硫酸亚铁溶液中滴加 NaOH 溶液,边加边搅拌,即可制得白色的氢氧化亚 铁。( ) )
(6)Fe2O3 是红棕色粉末,俗称铁红,常用作红色油漆和涂料。( (7)氧化铁能与酸反应,所以可用于制作红色染料。( ) )
(8)铁表面自然形成的氧化层能保护内层金属不被空气氧化。(
答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)× (8)×
△ △
Cu(OH)2=CuO+H2O Cu(OH)2+4NH3· H2O= [Cu(NH3)4](OH)2+4H2O
Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
注意:(1)溶液中的Cu2+常为蓝色(浓CuCl2为绿色, 稀CuCl2为蓝色),可作为Cu2+的判断依据。
(2) Cu2+与碱反应生成蓝色沉淀Cu(OH)2, Cu(OH)2溶于氨水形成深蓝色溶液,这是鉴定 Cu2+的原理之一。无水CuSO4遇水变为蓝色, 生成CuSO4· 5H2O,可作为水的检验依据。
4Fe(OH)2 + O2 +2H2O = 4Fe(OH)3
思考: 1、实验中为什么要用新制的 硫酸亚铁溶液? 2、实验中为什么滴入经煮沸 的NaOH溶液? 3、实验中为什么要将滴管尖 端插入试管里溶液底部,慢慢 挤出NaOH溶液? 4、还可以采用什么方法和措 施以保证制得氢氧化亚铁?
3.制备 Fe(OH)2 常用的 3 种方法
反思归纳 防止 Fe(OH)2 氧化的方法 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有 NaOH 溶液的胶头滴管尖端插入试管中的亚铁盐溶液底部,并慢慢挤 出 NaOH 溶液。 (3)在亚铁盐溶液上面充入保护气,如 H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
高三一轮复习课件--铁铜及其化合物

(3)简述生成Fe(OH)2的操作过程_____________________。 (4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应 为_________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
①②③④
项目活动三:科学制备补铁剂的主要成分
(1)写出符合Ⅰ的离子方程式
①将 H2S 气体通入 FeCl3 溶液中产生淡黄色沉淀:
H2S+2Fe3+===S↓+2Fe2++2H+
。
②向 FeCl3 溶液滴入 KI-淀粉溶液,溶液变蓝:
2I-+2Fe3+===I2+2Fe2+ 。
③FeCl3 可溶解铁片: 2Fe3++Fe===3Fe2+ 。
请写出上述关系的有关反应方程式。
铁与水蒸气反应:
高温
3Fe +4H2O(g)=====Fe3O4+4H2(g)
课本实验的拓展:证明生成的气体是氢气
明白:原理、装置用途、现象等 思考:如何证明生成的固体物质是Fe3O4?
Fe2+
Fe3+
Fe2+和强氧化剂作用例如:O2、 Cl2、Br2、HNO3 等
反应结束关闭恒 压滴液漏斗活塞
加入 药品
打开分液漏斗 塞子和旋塞
高三化学一轮复习铁、铜及其化合物学案

铁、铜及其化合物〖复习目标〗1.了解铁、铜及其重要化合物的主要性质和重要应用。
2.了解铁、铜的不同类型化合物之间转化的条件和方法,认识化学在金属矿物等自然资源综合利用方面的重要作用。
〖知识清单〗考点一铁及其化合物一、铁1.物理性质2.化学性质⑴与非金属反应(O2、Cl2、S)⑵与水蒸气反应的化学方程式为:。
⑶与酸反应①与非氧化性酸如与稀H2SO4、盐酸等反应,其离子方程式为:。
②与氧化性酸如与稀HNO3反应,一般不产生H2,常温下,可被、钝化。
a.稀HNO3过量时生成Fe3+,其离子方程式:b.铁过量时生成Fe2+,其离子方程式:⑷与盐溶液反应①能与活动性较弱的金属盐溶液反应,如Fe和CuSO4溶液反应的离子方程式为:。
②与FeCl3溶液反应,其离子方程式为:。
二、铁的氧化物和氢氧化物1.铁的氧化物2.铁的氢氧化物〖典型例析〗例1、取100mL 0.2mol/L FeCl 3溶液置于烧杯中,向其中加入一定量的Fe 、Cu 混合物,充分反应后仍有固体剩余,下列叙述一定正确的是(设溶液体积不变,不考虑水解因素)A .若烧杯中有Fe 无Cu ,c (Fe 2+)=0.2 mol·L -1B .若烧杯中有Cu 无Fe ,c (Fe 2+)=0.3 mol·L -1C .若烧杯中有Cu 无Fe ,c (C1-)=0.6 mol·L -1D .若烧杯中Cu 、Fe 均有,c (Fe 2+)=0.3 mol·L -1互动探究:在符合C 、D 两项要求的溶液中,金属阳离子的存在情况如何?例2、某学生拟用含有FeSO 4和Fe 2(SO 4)3的CuSO 4溶液提纯CuSO 4,并测定铜的相对原子质⑴试剂A 的化学式为 ,加入试剂A 反应的离子方程式为,试剂B 的化学式为 ,加入B 的作用是,操作①的名称是 。
⑵操作②中所用仪器装置如图所示:则X 应接直流电源的 极,Y 电极上发生的电极反应式为: 。
高三化学铁铜及其化合物试题答案及解析

高三化学铁铜及其化合物试题答案及解析1.铁单质及其化合物在生活、生产中应用广泛。
请回答:(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是。
(2)硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)。
在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是。
(3)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO3Fe+4CO2,若有1.5 molFe3O4参加反应,转移电子的物质的量是。
【答案】(1)O2+2H2O+4e-=4OH-(2分)(2)Fe3++3H2O Fe(OH)3+3H+(2分);酸性条件抑制了铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉降除去(2分)(3)12 mol(1分)【解析】(1)在钢铁的吸氧腐蚀中,正极上发生的是氧气得电子的还原反应,即O2+2H2O+4e-=4OH-。
(2)三价铁水解生成的氢氧化铁胶体具有净水作用,原理方程式为:Fe3++3H2O⇌Fe(OH)3+3H+,硫酸铁中由于三价铁水解导致溶液显酸性,而酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去。
(3)氧化还原反应Fe3O4十4CO3Fe+4CO2中,化合价升高值=化合价降低值=转移电子数=8,即有1mol Fe3O4参加反应,转移电子的物质的量是8mol,所以有1.5mol Fe3O4参加反应,转移电子的物质的量是12mol。
【考点】本题考查钢铁腐蚀原理、盐类的水解、氧化还原反应的计算。
2.除去FeSO4溶液中少量的硫酸铁,可行的办法是A.加入铁粉B.加入铜粉C.加入氢氧化钠溶液D.滴入KSCN溶液【答案】A【解析】A、加入铁粉,与硫酸铁反应生成硫酸亚铁,然后过滤除去铁粉,正确;B、加入铜粉,与硫酸铁反应生成硫酸亚铁和硫酸铜,溶液中引入了铜离子杂质,错误;C、硫酸铁与硫酸亚铁都与氢氧化钠溶液反应生成沉淀,错误;D、滴入KSCN溶液,与铁离子反应生成络合物,不能除去,错误,答案选A。
高三一轮复习_铁、铜及其化合物.ppt

Ⅲ.写出铁与浓硫酸加热时,可能发生的有关反应方程式: 。
【提出猜想】 Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种; Ⅱ.所得气体中可能含有 SO2、H2 中的一种或两种。
【实验探究】
实验操作 预期现象 结论
目的
验证猜想 Ⅰ
取少量溶液A, 滴入酸性KMnO4溶液 另取少量溶液A, 滴入KSCN溶液
(2)分别将FeCl2、 FeCl3溶液加热蒸干、灼烧最后剩下什么固体?
(3)分别往FeCl2、 FeCl3溶液滴加氨水,现象是否相同? (4)分别往FeCl2、 FeCl3溶液滴加KSCN溶液,现象是否相同?
2. Fe2+、Fe3+在水溶液中的相互转化 思考:
从氧化还原反应的角度分析:下列试剂:
反应不能大量共存。 (2)盐溶液的配制与保存
①Fe2+的盐溶液:加少量铁粉,防止Fe2+被氧
化;加少量相应的酸,防止Fe2+水解。
②Fe3+的盐溶液:加少量相应的酸防止Fe3+水解。
(3)制取Fe(OH)3胶体
Fe3++3H2O(沸水) +3H+ FeCl3·6H2O (6)除杂方法 ①Fe2+(Fe3+): (4)制备无水FeCl3
(3)Fe2O3和Cu2O
Fe2O3+6H+ Cu2O+2H+ 2Fe3++Cu 2Fe3++3H2O, Cu+Cu2++H2O, 2Fe2++Cu2+
向一定量的Fe、FeO和Fe2O3的混合物投入100 ml 1 mol/L
的盐酸,恰好使混合物完全溶解,放出224 ml(标准状况)
高三一轮复习课件--铁铜及其化合物

2、铁的化学性质:
Cl2、 Br2、 稀HNO3(足量) 强氧+
Fe3O4 (Fe2+/Fe3+) Fe2+ 钝化
I2 、 S 、H+、CuSO4 弱氧化剂
常温,浓硫酸、浓硝酸
重点注意: 铁和稀硝酸的反应
铁粉不足:
Fe+4HNO3=Fe(NO3)3+NO+2H2O n (Fe) :n( HNO3 )= (3∶12) 铁粉过量:
2011高考综合实验模拟
PAFC—[AlFe(OH)nCl6-n]m 是高效净水剂 。( 1 )以废料 (金属铁、铝及其氧化物)为原料制取PAFC 设计生产流程如下: ①所得酸性溶液中,不能确定是否存在的阳离子是( ) A.Al3+ B.Fe2+ C.Fe3+ D.H+ 为证明该离子确实存在,可采用的操作是(必须指明所 采用的试剂及观察到的现象)_______________________ ②往酸性溶液中加入试剂X的目的是_______________
Zn、H2、Al、C、CO等
Fe
6)Fe3+
Zn(过量)、CO、Al等
Fe
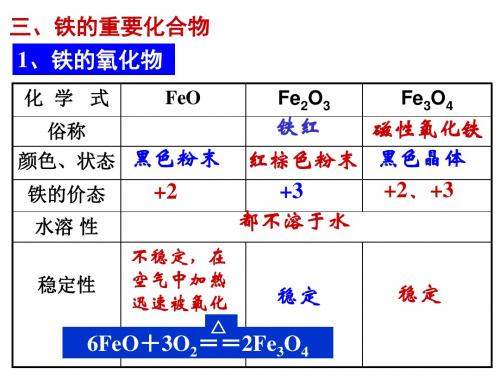
二、铁的重要化合物
(1)铁的氧化物
FeO 俗名
色态 价态 稳定性 与稀酸 反应 黑色粉末 +2 不稳定
Fe2O3 铁红
红棕色粉末 +3 稳定
Fe3O4 磁性氧化铁
黑色晶体 +2,+3 稳定
FeO+2H+= Fe2O3+6H+= Fe2++H2O 2Fe3++3H2O
答案(1)固体完全溶解,溶液呈红色
高考化学一轮总复习专题十三铁、铜及其化合物课件

除杂方法 加氯水
加过量铁粉后过滤 加过量铁粉后过滤
加Mg、MgO、MgCO3、Mg(OH)2中之一后过滤 先加氧化剂,然后再加Mg、MgO、MgCO3等物 质后过滤
Cu2+
Fe3+
加CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3中之 一后过滤
Cu2+
Fe2+
先加氧化剂,然后再加CuO、CuCO3、Cu(OH)2 等物质后过滤
第十七页,共48页。
下列离子的检验方法合理的是( ) A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶 液中含有(hán yǒu)Fe2+ C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有 (hán yǒu)Fe3+ D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变 为红褐色,说明该溶液中只含有(hán yǒu)Fe2+,不含有(hán yǒu)Mg2+
△ 2Cu+O2=====2CuO
2Cu+O2+CO2+H2O===Cu2(OH)2CO2
△ Cu+Cl2=====CuCl2
棕黄色烟
第二十一页,共48页。
②与酸的反应(fǎnyìng)
不反应(fǎnyìng)
△ Cu+2H2SO4(浓)=====CuSO4+SO2↑+2H2O Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
溶解性 铁的化合价
难溶于水 _+__2__
难溶于水 _+__3__
难溶于水 _+__2,__+__3__
稳定性 与H+反应 生成的离子 与CO反应
不稳定
稳定Biblioteka 稳定_F_e_2_+_
_F_e_3_+_
铁铜及其重要化合物高三一轮复习

钢 高碳钢 >0.6%
具有各种不同 的优良性能
合金钢
在碳素钢中加入铬 锰钨镍钼钴硅等
合金元素 7
2 、铜合金:
青铜: 含Cu Sn Pb等——硬而脆,强度大
铜 黄铜: 含Cu Zn——耐腐蚀,耐磨,可塑性强,
合
硬度较小。
金 白铜: 含Ni Zn(少量Mn)——制酒具等
3、铝合金:密度小、强度大
合金的成分不同,其性质也不 相同;如果改变某一合金元素的含 量,合金的性质也会发生改变。
2
金属概述
1.金属晶体的特点: 金属晶体是由金属阳离子和自由电子组成,
其中自由电子并不属于某个固定的金属阳离子, 而可以在整个金属中自由移动
2.金属的性质特点: ①常温下,单质都是固体,汞(Hg)除外; ②大多数金属呈银白色,有金属光泽, 但金(Au)—黄—色,铜(Cu)—红—色,铋(Bi) 微红 色,
可溶性碱与亚铁盐溶液反应 可溶性碱与铁盐溶液反应
制法
Fe2++2OH—= Fe(OH)2↓
Fe3++3OH—= Fe(OH)231↓
专题 Fe(OH)2制备
思考1.制取Fe(OH)2并使之能久存,可采取的操作有: ①加入一些植物油. ②溶解FeSO4配成溶液. ③把蒸馏水加热煮沸并密封冷却.
④加入少量铁屑. ⑤加入少量CCl4, ⑥向FeSO4溶液中滴入足量氨水. ⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。
物理性质 白色絮状,不溶于水
红褐色胶状,不溶于水
1.弱碱性2.还原性3.热不稳定性
化学性质
Fe(OH)2+2H+= Fe2++2H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3
高考化学一轮复习 专题3.4 铁、铜及其他化合物讲案(含

专题3.4 铁、铜及其他化合物讲案(含解析)复习目标:1、掌握铁及其化合物的物理、化学性质。
2、掌握Fe 2+、Fe 3+的相互转化,能鉴别溶液中的Fe 2+、Fe 3+。
3、掌握Fe(OH)2、FeCl 3的制备方法。
4、了解铜及其重要化合物的主要性质及其应用基础知识回顾: 一、铁及其化合物 1、铁的存在2、铁的性质 (1)物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
(2)化学性质:铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。
用化学方程式或离子方程式表示下列变化 Fe +⎩⎪⎨⎪⎧—O 2――→① ①3Fe+2O 2=====点燃Fe 3O 4—Cl 2――→② ②2Fe+3Cl 2=====点燃2FeCl 3—S ――→③ ③Fe+S=====△FeSFe +H 2O(g)――→④④3Fe+4H 2O(g)=====高温Fe 3O 4+4H 2Fe —⎩⎪⎨⎪⎧――→⑤Fe 2+⑤Fe+2H +===Fe 2++H 2↑、 Fe +Cu 2+===Cu +Fe2+――→⑥Fe 3+⑥Fe+4H ++NO -3===Fe 3++NO↑+2H 2O3、铁的氧化物的比较化学式 FeO Fe 2O 3 Fe 3O 4 俗称 — 铁红 磁性氧化铁 色态 黑色粉末红棕色粉末黑色晶体价态 +2 +31/3正2价,2/3正3价水溶性 不溶不溶不溶与酸的反应 FeO+2H +==Fe 2++H 2O 遇氧化性酸生成Fe 3+盐Fe 2O 3+6H +=2Fe 3++3H 2O Fe 3O 4+8H +=Fe 2++2Fe 3++4H 2O与CO 反应 高温Fe x O y +y CO=x Fe+y CO 24、Fe 2+和Fe 3+的比较Fe 2+Fe 3+水合离子颜色 浅绿色棕黄色 氧化还原性 既有氧化性,又有还原性 只有氧化性水解性 Fe 2++2H 2O←→Fe(OH )2+2H +Fe 3++3H 2O←→Fe(OH )3+3H +与碱的反应Fe 2++2OH —=== Fe (OH )2 ↓Fe 3++3OH —=== Fe (OH )3 ↓5、Fe(OH)2与Fe(OH)3的比较Fe (OH )2 Fe (OH )3 颜色状态 白色固体 红褐色固体 水溶性 不溶不溶稳定性易氧化为Fe (OH )3,空气中加热得不到FeO较稳定: ∆Fe (OH )3== Fe 2O 3+3H 2O 与酸的反应 Fe (OH )2+2H +=== Fe 2++3H 2O Fe (OH )3+3H +=== Fe 3++3H 2O制法在隔绝O 2的条件下Fe 2+与碱反应Fe 3+与碱反应【典型例题1】铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加 热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是 ( )A .Fe(OH)3 Fe 2O 3B .Fe(OH)2 Fe 2O 3C .Fe(OH)2 Fe(OH)3D .Fe(OH)2 Fe 3O 4【迁移训练1】【甘肃省玉门市油田一中2013—2014学年高三第三次摸底考试】向一定量的Fe 、FeO 、Fe3O4 的混合物中加人100mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,生成224 mL(标准状况)气体,向溶液中 滴加KSCN 溶液无红色出现。
2013届高考化学一轮精品教学案3.3《铁铜及其重要化合物》(2)

2013届高考化学一轮精品教学案 3.3 铁铜及其重要化合物(2)一、选择题(本题包括10小题,每小题5分,共50分)1.下列关于铁的叙述正确的是( )①铁能被磁铁吸引,但纯铁易锈蚀②在人体的血红蛋白中含有铁元素③不能通过化合反应生成FeCl2和Fe(OH)3④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧⑤铁与硝酸反应的产物仅是Fe(NO3)3A.①③B.②④C.②⑤ D.④⑥2.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是( )A.FeS B.Fe2O3C.FeCl3D.Fe3O43.下列离子方程式书写正确的是( )A.FeO固体放入稀硝酸溶液中:FeO+2H+===Fe2++H2OB.过量的铁粉与稀硝酸溶液反应:Fe+4H++NO-3===Fe3++NO↑+2H2OC.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2OD.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O解析:A项,产物中生成的是Fe3+;B项,铁粉过量生成的是Fe2+;C项,二价铁被氧化生成的应是Fe3+。
答案:D4.Al、Fe、Cu都是重要的金属元素。
下列说法正确的是( )A.三者对应的氧化物均为碱性氧化物B.三者的单质放置在空气中均只生成氧化物C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al5.某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:现对A、B、C、D作出的如下推断中,不.正确的是( )A.盐A一定是FeBr3B.浅黄色沉淀B是AgBrC.滤液C中一定含Fe3+D.D溶液中有Fe(SCN)3解析:生成浅黄色沉淀证明A中含Br-,B为AgBr,A与酸化的AgNO3溶液反应生成C,C 遇KSCN生成D红色溶液,C中一定含Fe3+,A中也可能含Fe2+。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
其化学方程式为: 4Fe(OH)2+2H2O+O2=4Fe(OH)3
方法三 集气排液法
方法四 电解法
Fe(OH)3胶体的制备
水解法 FeCl3 + 3H2O Fe(OH)3(胶体)+3HCl
将1—2ml饱和FeCl3溶液,逐滴加入到20ml 沸水中,并继续加热至溶液呈红褐色,停止加热
③把蒸馏水加热煮沸并密封冷却, ④加入少量铁屑, ⑤加入少量CCl4, ⑥向FeSO4溶液中滴入足量氨水, ⑦把盛有氨水的滴管伸入FeSO4 溶液中后再挤出氨 水。其中必须进行的操作及其正确顺序是( B )
A. ③②⑤⑥④
C. ③②④⑤⑦
B.③②④①⑦
D.②④①⑦⑤
Fe(OH)2制备
方法一 直接滴加法
1mol/L的 NaOH溶液 (不含O2) O2 苯 5%FeSO4
溶液
方法二 微型混合法
橡皮管
5%FeSO4溶液 1mol/LNaOH(不含O2)
(1)将右边注射器中的NaOH溶液推入左边注射器, 有白色絮状沉淀生成 可观察到的现象是 。 (2)若拔去连接管,将有白色沉淀的注射器抽入 空气,振荡,则可观察到 白色沉淀迅速转变为灰绿色, 。
B.已知Fe2O3和HNO3反应的离子方程式是Fe2O3 + 6H+=2Fe3++3H2O,推测FeO和HNO3 反应的离子方 程式为FeO +2H+=Fe2++H2O
C.已知Fe3O4可以改写成FeO· Fe2O3,推测Pb3O4 可以改写成PbO· Pb2O3;已知Fe3O4可以改写成 Fe(Fe2O4)推测Pb3O4可以改写成Pb(Pb2O4) 高温 D.已知Fe2O3+3CO==2Fe+3CO2,推测 FeO + CO==Fe+CO2, Fe3O4+4CO==3Fe+4CO2
Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 放置在空气中的现象?
4Fe(OH)2+O2+2H2O=4Fe(OH)3
不反应(常温下放置于 空气中能稳定存在)
制备Fe(OH)2时,为了防止或减慢Fe(OH)2的氧化, 可以采取哪些措施,如何改进实验装置?
→
红褐色
铁丝在氯气中燃烧,棕黄色的烟, 加水生成黄色的溶液 。
2Fe+3Cl2==2FeCl3
3Fe+2O2====Fe3O4 △ Fe+S====FeS(黑色固体)
规律:变价金属铁与非金属单质反应时,强氧化 剂可以将铁氧化为高价;较弱氧化剂可以将铁氧 化为低价。注意区分
点燃
点燃
2、铁跟酸的反应
(1)铁与盐酸(浓稀一样的)反应: 反应实质: Fe + 2H+=== Fe2++ H2↑
(2)铁与硝酸的反应
a.浓硝酸
常温下钝化
加热时反应生成NO2 △ Fe+6HNO3(浓) ==Fe(NO3)3+3NO2↑ +3H2O
b.稀硝酸
Fe+4HNO3 (稀) ===Fe(NO3)3+NO ↑ +2H2O
(3)铁与硫酸的反应: a.浓硫酸
常温下钝化 加热时反应生成SO2 △ 2Fe+6H2SO4(浓) ==Fe2(SO4)3+3SO2↑ +6H2O
2
Fe2+ Fe3+
Fe2+-----Fe3+:HNO3 浓H2SO4 强氧化剂 Cl2 Fe3+------- Fe2+: Fe CU I- S2还原剂
3Fe2++4H++NO3- =3Fe3++ NO↑+2H2O 2Fe2++Cl2=2Fe3++2Cl2Fe3++Cu=2Fe2++Cu2+ 2Fe3++2I-=2Fe2++I2
注意: Ⅰ不能过度加热,以免出现Fe(OH)3胶体凝聚。 Ⅱ不能搅拌,防止生成Fe(OH)3沉淀。 Ⅲ FeCl3溶液
1、浓溶液(饱和) 2、在配制时将其加入煮沸过的蒸馏水
小结
铁的氢氧化物
HCl等非氧化性酸 碱
白色 Fe(OH)2
Fe2+
H2SO4等非氧化性酸
Fe(OH)3
Fe3+
红褐色
碱
例题5 实验室有两瓶溶液,一瓶是FeSO4溶液,另 一瓶是FeCl3溶液,但瓶上无标签,请你设计 方案判断哪一瓶是FeCl3?
D.纯铁熔点比生铁的低,纯铁比生铁易生锈
E.与同浓度的盐酸反应,生铁速度快 F.铁制容器贮可存冷的浓HNO3与浓H2SO4 是因为 铁和冷的浓HNO3与浓H2SO4 不反应。
G. Fe是一种常见的黑色重金属具有多种变价。
一、铁元素在元素周期表中的位置
(1)铁的原子结构
外围电子排布 3d64s2
+26 2 8 14 2
三、铁(纯铁)的化学性质 金属活动顺序表: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
铁的化学性质比较活泼
二、铁(纯铁)的化学性质
1、铁与非金属的反应 (1)与氧气反应 条件:点燃 现象:火星四射、生成黑 色固体、放出大量的热 点燃 3Fe+2O2====Fe3O4
考纲要求:
掌握铁及其化合物的主要性质,了解 其应用 以Fe2+、Fe3+的相互转化为例,理解变 价金属元素的氧化还原性
了解铜的物理性质和重要用途。
掌握铜及其重要化合物的化学性质。
例题1 下列有关铁的说法中正确的是( BCEG )
A.Fe位于元素周期表中第四周期ⅧB族
B. Fe的原子结构示意图为:
C.生活中的 “增铁酱油”中的铁指的是铁元素 。
高温 高温
四、铁的氧化物比较
比较内容
化学式 俗名 色、态 化合价 黑色固体
氧化亚铁
FeO
氧化铁 Fe2O3 有什么用途? 铁红 红棕色粉末 +3
四氧化三铁
Fe3O4 磁性氧化铁 黑色固体
+2
+2、+3
难溶于水 稳定
水溶性
类别 稳定性 与酸 氧化性酸 反应 非氧化性酸 与还原剂CO反应
难溶于水 难溶于水 在空气中加热生成什么? 碱性氧化物 稳定 不稳定 反应的产物,方程式? 反应的产物,方程式?
b. 稀硫酸 Fe + 2H+=== Fe2++ H2↑
3.铁与水的反应
在常温下,纯铁与水不起反应,但不纯的 铁在水和空气里的二氧化碳和氧气的作用 的下,铁很容易被腐蚀。在高温下: 3Fe+4H2O(g) == Fe3O4+4H2↑
高温
【实验方案的设计】
•如何产生水蒸气?
•在什么容器中进行化学反应比较合适?
2.下列物质 不能通过化合反应制备的是( D F )
A. FeCl3
D. Fe(OH)2
B.
E.
FeCl2
Fe(OH)3
C. Fe3O4
F. H2SiO3
八、铁及其化合物性质的典型实验
(1)NO3- 与Fe2+在酸性条件下,不能共存.
(2)FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体 的区别:
反应的产物,方程式?
五、铁的氢氧化物比较 明矾、或FeCl3溶液净水的原理?
比较内容 氢氧化亚铁 Fe(OH)2 白色固体 难溶于水 与HNO3反应的方程式? 弱碱 加热分解 氢氧化铁 Fe(OH)3 红褐色固体
化学式
色 、态 溶解性 类别 热稳定性 与酸的作用 与O2的作用
难溶于水
弱碱 加热分解
特性:能被磁铁吸引
例题2 下列几种类推的结论中正确的是( E )
A.已知Fe与S能直接化合得FeS,推测Cu与S化合 直接化合生成CuS B.已知Fe与Cl2能直接化合得FeCl3,推测Fe与I2能直 接化合得FeI3 C.已知Fe与HCl反应产生H2,推测Fe与HNO3反应 产生H2 D.已知Na与水常温下反应产生NaOH和H2,Mg与 沸水反应产生Mg(OH)2和H2,推测Fe与水要在高温 下反应生成Fe(OH)3和H2 E..已知Fe与CuSO4溶液能反应,推测Fe与FeCl3溶
Fe 2+ Fe 3+
Fe Fe
Fe3O4 (Fe 2+ 、Fe 3+)
化学性质小结
S I2 H+ Cu2+ O2、H2O
弱氧化剂
Fe2+ Fe3+
Fe
强氧化剂
O2 Cl2 Br2 HNO3 H2SO4(浓)
例题3 下列几种类推的结论中正确的是 A.已知Fe2O3+6HCl=2FeCl3+3H2O, ( D ) 推测Fe2O3+6HI=2FeI3+3H2O
•用什么化学仪器产生高温条件?
•生成的气体中可能混有什么气体?
•如何干燥气体?如何收集气体?
•如何检验生成的气体?
例题、某校化学小组利用下图所列装置进行铁与水反应的 实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装 置中的铁架台、铁夹等必要的夹持仪器在图中均已略去) (1) 烧瓶A中常加入碎瓷片,其作用是 , 小试管C的作用是 。 (2) 为了安全,在E管中的反应发生前,在F出口处必须——— 。 ———— ,E管中的反应开始后, 在F出口处应 (3) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充 分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现 象 。
