2016年九年级化学第九单元溶解度课件人教版
合集下载
人教版九年级化学下册第九单元《溶解度》图文展示课件

点
实验9-5 在常温下,向盛有20mL
击
水的烧杯中加入5g食盐,搅拌,等食盐
图 片
溶解后,再加5g食盐,搅拌,观察现象。
播
放
然后再加入15mL水,搅拌,观察现象。
视
频
人教版 化学 九年级 下册
实验现象
操作 加入5g氯化钠,搅拌 再加5g氯化钠,搅拌
再加15mL水,搅拌
现象 烧杯中形成无色溶液 烧杯中溶液底部有未
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
人教版 化学 九年级 下册
曲线法
温度℃ 0 20 40 60 80 90 溶解度g 13.3 31.6 63.9 110 169 202
硝酸钾
这样比较可以吗? 36gNaCl
31.6gKNO3
可行
20℃ 100g水
20℃ 100g水
人教版 化学 九年级 下册
比较溶解性 的大小
比较固体物质在溶剂中溶解的最大量
温度 溶剂质量 达到饱和状态 溶解的溶质质量
溶解度
人教版 化学 九年级 下册
溶解度:在一定温度下,某固体物质在100g溶剂里达到 饱和状态时所溶解的质量。
归纳总结
结晶的方法
蒸发溶剂:适用于固体溶解度随温度变化影响不大的物质。 如氯化钠。 冷却热饱和溶液:适用于固体溶解度随温度的降低而减小且 溶解度受温度影响变化较大的固体物质。如硝酸钾。
人教版 化学 九年级 下册
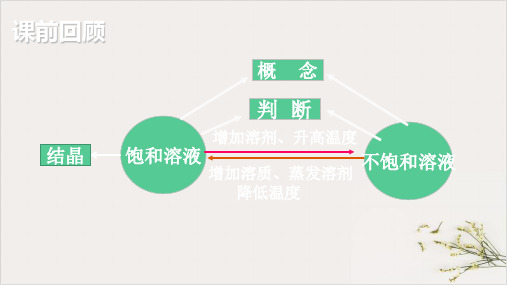
饱和溶液与不饱和溶液的相互转化
不饱和溶液
增加溶剂、升高温度 增加溶质、降低温度、蒸发溶剂
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若 不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。 2.如果溶液中无剩余物质,则加少量的溶质,溶质能继 续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
初中化学人教版九年级《溶解度》教育教学课件

化学实验:指导化学实验操作和数据处理
• 根据溶解度数据,选择合适的溶剂和溶质 • 通过测定溶解度,验证化学理论知识和实验方法
溶解度在农业领域的应用
农业生产:指导化肥、农药的使用,提高作物产量 和品质
• 利用溶解度数据,选择合适的化肥和 农药品种 • 通过测定溶解度,评价化肥和农药的 使用效果
农业环保:评估农业生产过程中的环境 污染问题
04
溶解度与温度、压力的关系
温度对溶解度的影响
温度升高,一般溶质的溶解度增大
• 分子热运动加剧,溶质分子与溶剂分子之间的相互作用增强 • 溶解过程中,溶质分子需要克服的能量障碍减小
温度降低,一般溶质的溶解度减小
• 分子热运动减缓,溶质分子与溶剂分子之间的相互作用减弱 • 溶解过程中,溶质分子需要克服的能量障碍增大
初中化学人教版九年级《溶解度》教育 教学课件
01
溶解度的概念及意义
溶解度的定义与单位
溶解度定义:溶质在一定温度下,达到饱和状态时, 溶解在溶剂中的溶质的质量与溶剂的质量之比。
• 溶质:溶解在溶剂中的物质 • 溶剂:能溶解溶质的物质 • 饱和状态:溶质在溶剂中的浓度达到 最大值
溶解度单位:g/100g溶剂或mol/L
极性溶剂对溶解度的影响
极性溶剂对极性溶质的溶解度影响较大
• 极性溶剂与极性溶质之间的相互作用 较强,有利于溶质的溶解 • 极性溶剂中,溶质分子与溶剂分子之 间的氢键作用有利于溶质的溶解
极性溶剂对非极性溶质的溶解度影响较 小
• 非极性溶质与极性溶剂之间的相互作 用较弱,不利于溶质的溶解 • 非极性溶剂中,溶质分子与溶剂分子 之间的范德华作用较弱,不利于溶质的 溶解
温度与压力综合影响下的溶解度变化规律
• 根据溶解度数据,选择合适的溶剂和溶质 • 通过测定溶解度,验证化学理论知识和实验方法
溶解度在农业领域的应用
农业生产:指导化肥、农药的使用,提高作物产量 和品质
• 利用溶解度数据,选择合适的化肥和 农药品种 • 通过测定溶解度,评价化肥和农药的 使用效果
农业环保:评估农业生产过程中的环境 污染问题
04
溶解度与温度、压力的关系
温度对溶解度的影响
温度升高,一般溶质的溶解度增大
• 分子热运动加剧,溶质分子与溶剂分子之间的相互作用增强 • 溶解过程中,溶质分子需要克服的能量障碍减小
温度降低,一般溶质的溶解度减小
• 分子热运动减缓,溶质分子与溶剂分子之间的相互作用减弱 • 溶解过程中,溶质分子需要克服的能量障碍增大
初中化学人教版九年级《溶解度》教育 教学课件
01
溶解度的概念及意义
溶解度的定义与单位
溶解度定义:溶质在一定温度下,达到饱和状态时, 溶解在溶剂中的溶质的质量与溶剂的质量之比。
• 溶质:溶解在溶剂中的物质 • 溶剂:能溶解溶质的物质 • 饱和状态:溶质在溶剂中的浓度达到 最大值
溶解度单位:g/100g溶剂或mol/L
极性溶剂对溶解度的影响
极性溶剂对极性溶质的溶解度影响较大
• 极性溶剂与极性溶质之间的相互作用 较强,有利于溶质的溶解 • 极性溶剂中,溶质分子与溶剂分子之 间的氢键作用有利于溶质的溶解
极性溶剂对非极性溶质的溶解度影响较 小
• 非极性溶质与极性溶剂之间的相互作 用较弱,不利于溶质的溶解 • 非极性溶剂中,溶质分子与溶剂分子 之间的范德华作用较弱,不利于溶质的 溶解
温度与压力综合影响下的溶解度变化规律
人教九年级化学溶解度 PPT

37.5 37
36.5 36
35.5 35
34.5
0
10
20
30
40
50
60
温度/0C
氯化钠溶解度曲线
溶解度/g
37.5 37
36.5 36
35.5 35
34.5
0
10
20
30
40
50
60
温度/0C
氯化钠溶解度曲线
溶解度/g
37.5 37
36.5 36
35.5 35
34.5
0
10
20
30
40
50
什么关系? 答:大多数物质得溶解度随温度得升高而增大如KNO3 ;
少数物质得溶解度随温度得升高变化不大如NaCl; 极少数物质得溶解度随温度升高而减小如Ca(OH)2 。
5、为什么汗水带有咸味?被汗水浸湿得衣服晾干后,常出 现白色得斑迹,这是为什么?
答:汗水中含有盐。水分蒸发后,盐留在衣服上形成白斑 6、现有一瓶蒸馏水和一瓶氯化钾溶液,可用什么简单得办
8、氨在常温下是一种气体,它易溶于水,溶于水后就形成
氨水,当温度升高时氨又会逸出。氨水是一种常用得化
学肥料,平时贮存在氨水罐中。试设想在保存氨水时应
注意什么?
答:放在阴凉处、密封保存在氨水罐中。
9、下图是a、b两种固体物质得溶解度曲线。从图中你能
得
溶解到哪些信息?a开放b题
度
t ℃时,a、b两种物质得溶解度相等;
溶质
110g
溶剂
100g
溶液
210g
待溶解后
5ml水
5克氯化钠
再加5克氯化钠
20ml水
氯化钠溶液
【人教版】九年级化学下册:第9单元 课题2 溶解度(共20张PPT)

80 90 100
60
70
温度/℃
溶解度 溶解度
人教版九年级下册第九单元课题2 人教版九年级下册第九单元课题2
3
a A 1 2
观察右图填空
(1)A点的意义是 (2)t2时,1,2,3,4四种物质溶解 度由大到小的顺序是 (3) 物质的溶解度受温 度影响最大, 物质的溶解 度随温度的升高而增大, 物 质的溶解度随温度的升高而减少。
氯化钾 氯化钠
练习: 68 ℃时硝酸钾和硝酸钠的溶解 3、在___
氯化铵
40
30 20 10 0 10
B.
硼酸
20 30 40 50
60
70
80
90
100
温度/℃
溶 200 解 度 190
180 170 160 150 140 130 120 110 100 90 80 70 60 50
熟石灰的溶解度曲线:
20.9g
KClO3
7.4g
CaCO3
0.013g
结论: 不同的物质在水中溶解能力不相同。
化学上,为了表示不同物质的溶解能力,引 入了溶解度的概念。
溶解度 溶解度
人教版九年级下册第九单元课题2 人教版九年级下册第九单元课题2
一, 固体的溶解度
定义: 在一定温度下,某固体物质在100g溶剂里达 到饱和状态时所能溶解的质量,叫做这种物 质在这种溶剂里的溶解度。 概念的四要素:
硝酸钾在不同温度时的溶解度:
温 度
溶 200 解 度 190
180
g
170
160 150
. .
硝 酸 钾
/
℃ 溶 解 度 /g
0
10
20
30
60
70
温度/℃
溶解度 溶解度
人教版九年级下册第九单元课题2 人教版九年级下册第九单元课题2
3
a A 1 2
观察右图填空
(1)A点的意义是 (2)t2时,1,2,3,4四种物质溶解 度由大到小的顺序是 (3) 物质的溶解度受温 度影响最大, 物质的溶解 度随温度的升高而增大, 物 质的溶解度随温度的升高而减少。
氯化钾 氯化钠
练习: 68 ℃时硝酸钾和硝酸钠的溶解 3、在___
氯化铵
40
30 20 10 0 10
B.
硼酸
20 30 40 50
60
70
80
90
100
温度/℃
溶 200 解 度 190
180 170 160 150 140 130 120 110 100 90 80 70 60 50
熟石灰的溶解度曲线:
20.9g
KClO3
7.4g
CaCO3
0.013g
结论: 不同的物质在水中溶解能力不相同。
化学上,为了表示不同物质的溶解能力,引 入了溶解度的概念。
溶解度 溶解度
人教版九年级下册第九单元课题2 人教版九年级下册第九单元课题2
一, 固体的溶解度
定义: 在一定温度下,某固体物质在100g溶剂里达 到饱和状态时所能溶解的质量,叫做这种物 质在这种溶剂里的溶解度。 概念的四要素:
硝酸钾在不同温度时的溶解度:
温 度
溶 200 解 度 190
180
g
170
160 150
. .
硝 酸 钾
/
℃ 溶 解 度 /g
0
10
20
30
人教版九年级化学9.2《溶解度》课件(共25张PPT)

(2)其它条件相同,KNO3在水中和KNO3在酒质精中的
溶
溶剂性
解度不同,影响溶解度是因素是__质________
(3)其它条件相同,KNO3在20°C时的溶解度与温在度 30°C的溶解度不同,影响溶解度是因素是
_______
43、、物质溶解性的分类
溶解性 易溶 可溶
溶解/g
( 适用于溶解度受温度变化影响相当大的固体物质
(2)蒸发溶剂 适用于溶解度受温度变化影响不大的固体物质
3、饱和溶液和不饱和溶液的相互转化:
对大多数溶液来说:
降温或减溶剂、加溶质
不饱和溶液
升温.加溶剂.
饱和溶液
对Ca(OH)2溶液来说:
升温. 减溶剂、加溶质
不饱和石灰水
3、20°C时硝酸铵的溶解度是190克。
20°C时,在100克水里达到饱和状态时 溶解NH4NO3的质量是190克。
2 影响因素: 内因:溶质和溶剂的性质。 外因:温度
探究小实验:
(1)其它条件相同,KNO3在水中的溶解度与NaCl在水 中的溶解度不同,影响溶解度是因素是_溶__质__性_____
5、饱不饱和与浓稀的关系:
⑴饱和溶液不一定是浓溶液, 不饱和溶液不一定是稀溶液
⑵同一温度下,同种溶质: 饱和比不饱和溶液浓
小测验
1、饱和溶液: 在一定温度下,在一定量的溶剂里, 不能再溶解某种溶质的溶液, 叫做这种溶质的饱和溶液;
升温 加溶剂
2、饱和溶液
不饱和溶液(多数)
降温 蒸发溶剂 加溶质
3、检验溶液是否饱和:
(1)水中溶有一定量的空气(2)加热使水的温度升高,溶解在 水中的空气的溶解度减小,空气从水中逸出,就会有气泡
3、阴雨天,鱼塘里的鱼为什么成群的把头浮出水面呼吸? (1)水中溶有一定量的氧气(2)阴雨天温度高,气压低,溶解 在水中的氧气的溶解度减小,鱼缺氧就会把头浮出水面呼吸
第9单元溶解度PPT溶解度及溶解度曲线—九年级化学人教版下册精品课件
5.在一定温度下,向100 g水中依次加入一定质量的KCl固体,充分
溶解,加入KCl固体的质量与所得溶液质量的关系如图K9-2-4所示。
(1)该温度下,实验①所得溶液是_不__饱__和___(填“饱和”或“不饱
和”)溶液。 (2)①根据水样呈酸性判断需要的测量仪器;
【答案】C
(2)该温度下,KCl的溶解度为___4_0__g__。 解析 A中Fe3+和SCN-不能大量共存;C中酸性条件下NO-3和Fe2+发生氧化还原反应不能共存;D中Fe2+和OH-不能大量共存。
看 1.D [解析] 聚氯乙烯塑料是一种不可降解60塑料,所以在长时间光照下不能分解。 度 氯化钠 [酸解,化析]学(1方)将程干式燥为的:S紫O2色+石H2蕊O小H花2S放O入3,2盛H有25S二0O氧3+化O硫2 2的H集2S气O瓶4。内(,3观)以察上到两小个花化没学有反变应色都,说属明于二化氧合化反硫应不;氢能元使素紫显色+石1价蕊,变氧红元。素(显2)-二2价氧,化所硫以和亚水硫反酸应中生硫成元亚素硫的酸化,合亚价硫为酸+和4氧。气(4)反亚应硫生酸成、硫硫 出 酸、盐酸和碳酸都能使石蕊溶液变红的原4因0是溶液中都含有氢离子。(5)吸收二氧化硫常用氢氧化钠溶液,氢氧化钠和二氧化硫反应生成亚硫酸钠和水。
(二)、溶解度曲线法
3、应用
(1).确定某种物质在某温度时的溶解度。 (2).比较不同物质在同一温度时的溶解度大小。 (3).可以比较不同物质的溶解度受温度变化影响的大小。 (4).根据物质的溶解度曲线确定饱和溶液与不饱和溶液 相互转化的方法。 (5).确定混合物的分离、提纯方法。
1.如图是甲、乙、丙 三种固体物质的溶解度曲线。
若再降温到10℃,会怎样?
初中化学人教九年级下册第九单元 溶液 溶解度PPtPPT

10
68 0 10 20 30 40 50 60 70 80 90 100 温度/℃
溶 200
解
度 190
/
g 180
在80℃时,将110g硝酸钾加入 169170
.
到100g水中,充分溶解后,形
160 150
成的溶液为该温度下硝酸钾的
140 130
_不__饱__和_溶液。欲使其刚好形成 120
110
60
50
40
36
30
氯化钠 39
20
若再降温,会怎样?
10
会析出极少量的晶体
0 10 20 30 40 50 60 70 80 90 100
温度/℃
(1)物质C的溶解性为_可__溶__
溶
解
(2)M点表示_1_0_℃__时__B_、__C_的_ 溶解度度相同
/g
A
(3)在5℃时A、B、C溶解度 P
大小_C_>__B_>A
饱和溶液,可采用的方法有: 100
90
加入一定量的硝酸钾
80
70
. 59g . 硝
酸 钾
. .89g
蒸发掉一定量的水份
60
50
. . 降温到60℃
40 30
. 21
20
. 若再降温到10℃,会怎样? 10
会析出89g硝酸钾晶体
0 10 20 30 40 50 60 70 80 90 100
温度/℃
记在课本溶34页 固体溶解度曲线
饱和溶液
即是不饱和 1、室温下有一杯接近饱和的蔗糖溶 液,怎样把它变为饱和溶液?
加入蔗糖 蒸发溶剂 水 降温
Hale Waihona Puke 2、 20℃时,100g 饱和氯化钠溶液若保持
人教版-化学-九年级下册-9.2《溶解度》教学课件

溶解性 易溶 可溶 微溶
溶解度/g >10g >1g
(20℃)
<1g
难(不)溶 微溶
可溶
难(不)溶 <0.01g
易溶
. . .
× 练习: 0.01g 1g
10g
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 _难__溶物质。
3、20℃时氯化钠的溶解度是36g,则氯化钠属于( A )
知识巩固
1、碘酒中的溶质是___溶剂是____,盐酸的溶质________. 2、溶液的特征是____________和_____________ 3、溶于水能放热的是_______和________
溶于水能吸热的是_______和________ 溶于水温度不变的是_______和________ 4、从溶液中得到固体物质的方法叫做_________.
2、固体物质的溶解度:在_____一__定__温__度____下,某固
态物质的在__1_0_0_克__溶剂里达到__饱__和___状态时所 溶解的质量
3、某物质在20ºC的溶解度为21.5克,其含义是什么?
(1)在20ºC时,该物质在100克水中达到饱和状态时溶解的质量 为21.5克。 (2)在20ºC时,该物质在100克水中最多能溶解21.5克。
饱和溶液
升温 加溶剂
蒸发 溶剂
冷却
结晶
练习1、把室温下的不饱和食盐水变成饱和溶液,最简便的方法
是( B)
A 蒸发水 B 加食盐 C 给溶液降温 D 给溶液升温
练习2、在其它条件不变的情况下,要使接近饱和溶液的硝酸钾溶
液达到饱和溶液,下列措施达不到目的的是( C )
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)

3.要使接近饱和溶液的硝酸钾溶液达到饱和溶液,可采
取的措施是:(1)__蒸__发__水___分___;(2)__降__低__温___度____; (3)__增__加__硝__酸___钾___。
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
2.某学生在一定的温度下,进行溶解硝酸钾实验,记录
的数据如下:
实验序号
所用水的质量 加入硝酸钾的质量
所得溶液的质量
1 100g 80g 180g
2 100g 100g 200g
3 100g 120g 210g
4
100g 140g
x
(1)根据上述数据分析,实验1得到的溶液是_________;
(填“饱和”或“不饱和”)溶液。实验3得到的溶液
学习目标
1.理解固体溶解度的涵义。 2.了解溶解度与溶解性的关系。 3.初步学会绘制和查阅溶解度曲线。
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
·…······…·…·…....
…··…·..
A
B
C
D
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
1.欲将100g不饱和的KNO 溶液变为饱和溶液.可采用的 人教版九年级下册化学《9.2溶解度》课件(43张PPT)
3
方法是( )
①升温 ②降温 ③蒸发水分 ④增加溶质
A ①③ B ②④ C ②③④ D ①②③④
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
6、A、B、C、D四个烧杯里分别盛有质量相等的同种溶 剂,向四个烧杯加入某溶质,且固体溶质质量依次减 少(温度相同),充分溶解,(如下图所示)回答下 列各问(填序号)
2016年九年级化学第九单元溶解度课件人教版

多少,分为浓溶液和稀溶液 一定量溶液中含溶质的量相对多 的是浓溶液,否则是稀溶液。
饱和溶液一定是浓溶 液,不饱和溶液一定是稀 溶液吗?
含有较多溶质的溶液叫浓溶液, 你能说说它们之间的相同点和不同点吗? 相同点:都是食盐溶液,溶质是食盐,溶剂是水。
不同点:A是食盐的不饱和溶液,溶质比较少
含有较少溶质的溶液叫稀溶液。 B是食盐的饱和溶液。溶质比较多。
或
在20℃时,100g水中溶解203.9g蔗糖,溶液 达到饱和。
42
由于溶液是否饱 和与温度有关, 因此在谈及物质 的溶解度时,应 指明温度。
【思考】理解了溶解度的概念,那你了解平时所说 的“易溶”“难溶”与溶解度的关系吗?
溶解性和溶解度的关系
溶解性 易溶 溶解度 20℃
S>10g
可溶
10g > S>1g
1、使用什么方法可将粗盐中的泥沙除去?
溶解、过滤: 2、除去泥沙后,再怎样操作才能得到食盐 晶体?
蒸发结晶
蒸发结晶:
蒸发操作过程中的注意事项:
a、注意蒸发皿的溶液不超过蒸发皿 容积的2/3; b、加热过程中要不断搅拌,以免溶 液溅出; c、不能蒸干,应当析出大量晶体时 就应熄灭酒精灯,利用余热蒸发至 干
不饱和溶液
升温或增加溶质或蒸发溶剂
饱和溶液
降温或增加溶剂
3.判断溶液是否饱和的方法:
依据:在一定温度下向原溶液中再加入少量 原溶质,看能否溶解。 如果溶解的量不再增大,则说明原溶液是饱 和溶液;如果溶解的量还能增大,则说明原 溶液是不饱和溶液。
4.浓溶液和稀溶液
为了粗略表示溶液中溶质含量的
微溶
0.01g <S<1g
难溶
S<0.01g
溶解度PPT—九年级化学人教版下册精品课件

溶 200 解 度 190
/
3、溶解度的表示方法: g 180 170
.
(1)列表法:
160 150
硝酸钾在不同温度时的溶解度: 140
.
130
120
温
110
度
/
0
10 20 30 40
50
60 70 80 90 100 100
℃
90
.
硝
.酸
钾
溶
解 度 /
80
110 138 169 202 246 70
溶质:被溶解的物质称为溶质
像蔗糖、食盐、高锰酸钾、碘等
溶剂:能溶解其他物质的物质
(如水、酒精、汽油等,水是较好的溶剂,许 多物质能溶在其中)
溶液:溶质在溶剂中溶解后得到的混合物
(碘酒、高锰酸钾溶液、糖水、盐水)
通常不指明溶剂的溶液,一般指的是水溶液。
溶液:是一种均一、稳定(透明、澄清)的混和物。
一、饱和溶液和不饱和溶液
铵
160 150
140
130
120
110
100 90 80 70 60 50
40 30 20
10
.B硝
酸 钠
A.
硝 酸 钾
氯化铵 氯化钾 氯化钠
硼酸
固体的溶解度曲线:
练习:
1、横坐标60,纵坐标110 的 A点表示什么意义?
2、40℃时氯化铵的溶解度为4__4_g_ 70℃时氯化铵的溶解度为_6__0_g__。 70℃时氯化钾的溶解度为_4_7_g_。
一2.C般不高能改变而。 增大,如硝酸铵,硝酸钾,硝酸钠等,
表现为曲线陡升; (13)CO2+C 2CO(煤炉中的反应之一)
人教新版九年级化学第九单元课题2溶解度(共59张PPT)

用纵坐标表示溶解度,用横坐标表示温度.
溶 解 度
温度
溶 几种物质的溶解度曲线
解度(克211109870000
硝酸铵 硝酸钾
熟石灰的溶解度曲线
)160
150 140
.a
130
120
110
硝酸钠
100
90
80
氯化铵
70
60
50 40 30
氯化钠 从这些溶解度曲线图
20 10
硼酸
你能获取哪些信息?
0 10 20 30 40 50 60 70 80 90 100
蔗糖
179.2 190.5 203.9 219.5 238.1 260.4 287.3 320.4 362.1 415.7 487.2
从表中你能获取的信息有哪些:
从表中你能获取的信息有哪些?
归纳总结
①查出固体在某一温度的溶解度; ②查出固体某一溶解度对应的温度; ③查出两种固体溶解度相等的温度范围; ④看出固体溶解度受温度影响情况:
海水晒盐,原理: 利用日光、风力使水分蒸发。 属于蒸发溶剂法
• 结晶的方法
① 降温结晶 (即:冷却热的饱和溶液)
②蒸发结晶 (即把溶剂蒸发出来)
饱和溶液、不饱和溶液与浓溶液、 稀溶液之间的关系:
(1)0.1克NaCl溶于10克水,可以再溶解 不饱和溶液、稀溶液
(2)1克NaCl溶于10克水,可以再溶解
温度(℃)
溶解度曲线的含义:
①不同物质在各温度时的溶 解度; ②曲线与曲线的交点的含义: 表示两物质在某温度时有相 同的溶解度; ③能很快比较出两种物质在 某温度范围内溶解度的大小 ④多数物质溶解度随温度升 高而增大、有的变化不大 (如NaCl)、少数随温度升 高而降低(如Ca(OH)2)。
溶 解 度
温度
溶 几种物质的溶解度曲线
解度(克211109870000
硝酸铵 硝酸钾
熟石灰的溶解度曲线
)160
150 140
.a
130
120
110
硝酸钠
100
90
80
氯化铵
70
60
50 40 30
氯化钠 从这些溶解度曲线图
20 10
硼酸
你能获取哪些信息?
0 10 20 30 40 50 60 70 80 90 100
蔗糖
179.2 190.5 203.9 219.5 238.1 260.4 287.3 320.4 362.1 415.7 487.2
从表中你能获取的信息有哪些:
从表中你能获取的信息有哪些?
归纳总结
①查出固体在某一温度的溶解度; ②查出固体某一溶解度对应的温度; ③查出两种固体溶解度相等的温度范围; ④看出固体溶解度受温度影响情况:
海水晒盐,原理: 利用日光、风力使水分蒸发。 属于蒸发溶剂法
• 结晶的方法
① 降温结晶 (即:冷却热的饱和溶液)
②蒸发结晶 (即把溶剂蒸发出来)
饱和溶液、不饱和溶液与浓溶液、 稀溶液之间的关系:
(1)0.1克NaCl溶于10克水,可以再溶解 不饱和溶液、稀溶液
(2)1克NaCl溶于10克水,可以再溶解
温度(℃)
溶解度曲线的含义:
①不同物质在各温度时的溶 解度; ②曲线与曲线的交点的含义: 表示两物质在某温度时有相 同的溶解度; ③能很快比较出两种物质在 某温度范围内溶解度的大小 ④多数物质溶解度随温度升 高而增大、有的变化不大 (如NaCl)、少数随温度升 高而降低(如Ca(OH)2)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
37
【溶解度】在一定温度下,某固体物质在100g溶剂 里达到饱和状态时所溶解的质量。
四大要素:①一定温度 ②100克溶剂
③饱和状态
④指溶质的质量
如:在20℃时,100g水中溶解36g氯化钠达饱和,
我们就说20℃时,氯化钠的溶解度是36g。 又如:60℃时,硝酸钾的溶解度是110克,说明在 60℃时,100g水里最多能溶解110g硝酸钾。
④20℃时36克食盐溶解在100克水中恰好饱和, ×
状态是饱和
故20℃时食盐的溶解度是36。溶解度的单位是“克”
41
20℃时NaCl的溶解度为36g,其含义是什么?此时 溶液中溶质、溶剂、溶液的质量比是多少? ①在20℃时,NaCl在100g水中达到饱和状态 时,溶解溶质的质量是36g。 ②在20℃时, NaCl 在 100g 溶剂中最多能溶 或 解36g。 溶质:溶剂:溶液 = 9:25:34 例:蔗糖在20℃是的溶解度是203.9g。 在20℃时,100g水中最多可溶解203.9g蔗糖。
10ml水
10ml汽油
10ml水
10ml水
溶解性的大小跟溶质和溶剂的性质有关。
且受温度等外界条件的影响。
一、溶解性
定义: 一种物质溶解在另一种物质的能力
与溶质和溶剂的性质、及温度有关 影响因素:
表示方法: 溶解性能力的大小常用溶解度来 表示
讨论:设计实验——怎样比较食
盐和硝酸钾哪一个更易溶于水?
较多的食盐 较少的熟石灰
10ml水
答:不同。例如食盐在水中溶解能力较大, 而熟石灰在水溶解能力很差。
提问: 2.同种物质在不同溶剂中溶解能力是否相同?
等量的植物油
10ml水
10ml汽油
答:不同。例如油易溶于汽油而难溶于水。
演示实验:一、物质的溶解性
(2) (1) 通常把一种物质溶解在另一种物质里的能 等量的植物油 较多的蔗糖 较少的熟石灰 力叫做溶解性。
饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
结论:
1.饱和溶液不一定是浓 溶液,可能是稀溶液. 2. 不饱和溶液不一定是 稀溶液,可能是浓溶液.
饱和溶液 浓溶液
稀溶液
3.对于同一种溶质的 溶液来说,在一定温 度下,饱和溶液比不 饱和溶液浓 .
不饱和 溶液
粗盐的主要成分:不溶性泥沙、氯化钠
提纯粗盐的步骤:
讨论
浓溶液一定是饱和溶液吗? 稀溶液一定是不饱和溶液吗?
氢氧化钙 0.165克 硝酸银 222克 食盐 36克
20℃时,在100克水中达到饱和时溶解不同物质的质量:
碳酸钙 0.0013克
判断:
1、 20℃时,在100克水中加入0.165克的氢氧化钙,充分溶解所得的溶 液是 稀溶液 (浓溶液或稀溶液),是 饱和溶液 (饱和溶液或不饱和溶 液)。 2、 20℃时,在100克水中加入0.1克的氢氧化钙,充分溶解所得的溶液
难 ( 不 )溶 <0.01g 易溶
>10g
难(不)溶 微溶 0.01g
可溶
1g
.
练习:
A.易溶 物质
1、不溶物就是绝对不溶于水的物质。此话是否正确? 难 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___ 溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( A ) B.可溶物质 C.微溶物质 D.难溶物质
2.饱和溶液和不饱和溶液的相互转化问题:
大多数:
不饱和溶
增加溶质或降低温或蒸发溶剂 增加溶剂或升高温度
饱和溶液
注意: 1.此转化条件对多数固体物质适合, 因 为大多固体 物质在一定量水中溶解的最大量 随温度的升高而增大。 2.熟石灰在一定量水中溶解的最大限 量随温度升高而降低则不适合。
对于氢氧化钙:
列表法:3-2 几种固体物质在不同温度时的 溶解度(克)
温度 (°C)
0
10
20
30
40
50
60
70
80
90
100
氯化钠 硝酸钾
35.7 13.3
35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8 20.9 31.6 45.8 63.9 85.5 110. 0 138 169 202 246
30
随堂练习
• 3.在一定温度下,将一瓶接近饱和的 硝酸钾溶液变为饱和溶液,可采取的方 法有: • ①升高温度 ②降低温度 ③增加硝酸钾 ④减少硝酸钾 ⑤增加溶剂 ⑥减少溶剂, 其中正确的一组是( ) D • A.①②③ B.②③④ C.③④⑤ D.②③⑥
31
提问:
1.不同物质在水中溶解能力是否相同?举例说明。
1、使用什么方法可将粗盐中的泥沙除去?
溶解、过滤: 2、除去泥沙后,再怎样操作才能得到食盐 晶体?
蒸发结晶
蒸发结晶:
蒸发操作过程中的注意事项:
a、注意蒸发皿的溶液不超过蒸发皿 容积的2/3; b、加热过程中要不断搅拌,以免溶 液溅出; c、不能蒸干,应当析出大量晶体时 就应熄灭酒精灯,利用余热蒸发至 干
再加15ml水,搅 拌
结论:可溶物在一定量的水中不能无限溶解;
7
实验探究二
• 硝酸钾去哪里了?
在室温下
盛有20ml 水的烧杯 加入5g 硝酸钾 搅拌 再加入5g 硝酸钾 搅拌 再加入5g硝 酸钾,搅拌 加热烧杯
8
冷却热的饱和溶液时,硝酸钾晶体从溶液中析出
硝酸钾晶体
现象及结论
操作
加5g硝酸钾,搅拌 再加5g硝酸钾,搅 拌 加热 再加5g硝酸钾,搅 拌 冷却
.
10g
.
【课堂练习】
乘风破浪会有时, 直挂云帆济沧海!
【例2】 ①不溶物就是绝对不溶的物质。这句话是否正确? × 不正确。通常所说的不溶物即难溶物,溶解度<0.01g。 实际上没有绝对不溶的物质。 ②20℃时碳酸钙的溶解度是0.0013克,所以碳酸钙 难溶 是___物质。 易溶 ③20℃时食盐的溶解度是36克,所以食盐属于__ 物质。
微溶
0.01g <S<1g
难溶
S<0.01g
小结: 溶解性:是定性的表示物质溶解能力的大小,
常用易溶、可溶、微溶、难溶来表示。
溶解度:是用具体的数值定量的表示物质在
一定温度下,在100g溶剂中的最大溶解能力。
2、溶解度与溶解性的关系
溶解性
溶解度/g (20℃)
易溶
可溶 1g~10g
微溶
0.01~1g
梦幻般的青海湖
夏天晒盐 冬天捞碱
课题2
第一课时
4
最多能溶解多少氯化钠,是无限制的溶解吗
实验探究一
20ml的水能无限地溶解氯化钠吗? 在室温下
加5g的 搅拌
NaCl
加20ml 的水
搅拌 继续加5g 的NaCl 搅拌
加15ml 的水
6
现象及结论
操作 加5g氯化钠,搅 拌 再加5g氯化钠, 搅拌 现象 全部溶解 部分未溶解 全部溶解 结论 未饱和 已饱和 未饱和
• 归纳:若某物质在某温度时的溶解度为x 克,则此时
M质 =x克,M剂 = 100克, M液= M质+M剂 = 100+x克
从溶解度可以获得的信息
如果不指明溶剂, 通常所说的溶解度 是指物质在水中的 溶解度。
【课堂练习】
【例1】判断下列说法是否正确,并指明错误原因。 ①把20克某物质溶解在100克水里恰好制成饱和溶 × 液,这种物质的溶解度就是20克。 未指明温度 ②20℃时10克氯化钠溶解在水里制成饱和溶液, × 未指明溶剂的量 故20℃时氯化钠的溶解度是10克。 ③20℃时10克氯化钠可溶解在100克水里,故 × 20℃时氯化钠的溶解度是10克。未指明溶液的
多少,分为浓溶液和稀溶液 一定量溶液中含溶质的量相对多 的是浓溶液,否则是稀溶液。
饱和溶液一定是浓溶 液,不饱和溶液一定是稀 溶液吗?
含有较多溶质的溶液叫浓溶液, 你能说说它们之间的相同点和不同点吗? 相同点:都是食溶液,溶质是食盐,溶剂是水。
不同点:A是食盐的不饱和溶液,溶质比较少
含有较少溶质的溶液叫稀溶液。 B是食盐的饱和溶液。溶质比较多。
或
在20℃时,100g水中溶解203.9g蔗糖,溶液 达到饱和。
42
由于溶液是否饱 和与温度有关, 因此在谈及物质 的溶解度时,应 指明温度。
【思考】理解了溶解度的概念,那你了解平时所说 的“易溶”“难溶”与溶解度的关系吗?
溶解性和溶解度的关系
溶解性 易溶 溶解度 20℃
S>10g
可溶
10g > S>1g
饱和溶液是否一定是浓溶液? 不饱和溶液是否一定是稀溶液?
【实验二 】
多
相等 不饱和 浓溶液
少
相等 饱和
稀溶液
饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
①
① 10g蔗糖 不饱和溶液 浓溶液
②
② 0.2g熟石灰
③
③一匙食盐 不饱和溶液 稀溶液
④
④四匙食盐 饱和溶液 浓溶液
饱和溶液 稀溶液
• 结论: • 1.对于不同溶质来说:饱和溶液不一定 是浓溶液,不饱和溶液也不一定是稀 溶液。 • 2. 在同一条件下,对于同一种溶质来 说,饱和溶液要比不饱和溶液浓些。
不饱和溶液: 还能继续溶解原来的溶 质的溶液,叫做这种 溶质的不饱和溶液
12
一、饱和溶液、不饱和溶液
1.在一定温度下,向一定量溶剂里加入某溶质,当溶质 不能继续溶解时,所得到的溶液叫做饱和溶液;还能 继续溶解的的溶液,叫做不饱和溶液。
注意:1. “一定温度”、 “ 一定量的溶剂” 2. 应明确“某溶质”的饱和溶液或不饱 和溶液,如在一定条件下不能再溶解 NaCl的溶液,还能溶解蔗糖,对NaCl 来说饱和,对蔗糖来说不饱和.
【溶解度】在一定温度下,某固体物质在100g溶剂 里达到饱和状态时所溶解的质量。
四大要素:①一定温度 ②100克溶剂
③饱和状态
④指溶质的质量
如:在20℃时,100g水中溶解36g氯化钠达饱和,
我们就说20℃时,氯化钠的溶解度是36g。 又如:60℃时,硝酸钾的溶解度是110克,说明在 60℃时,100g水里最多能溶解110g硝酸钾。
④20℃时36克食盐溶解在100克水中恰好饱和, ×
状态是饱和
故20℃时食盐的溶解度是36。溶解度的单位是“克”
41
20℃时NaCl的溶解度为36g,其含义是什么?此时 溶液中溶质、溶剂、溶液的质量比是多少? ①在20℃时,NaCl在100g水中达到饱和状态 时,溶解溶质的质量是36g。 ②在20℃时, NaCl 在 100g 溶剂中最多能溶 或 解36g。 溶质:溶剂:溶液 = 9:25:34 例:蔗糖在20℃是的溶解度是203.9g。 在20℃时,100g水中最多可溶解203.9g蔗糖。
10ml水
10ml汽油
10ml水
10ml水
溶解性的大小跟溶质和溶剂的性质有关。
且受温度等外界条件的影响。
一、溶解性
定义: 一种物质溶解在另一种物质的能力
与溶质和溶剂的性质、及温度有关 影响因素:
表示方法: 溶解性能力的大小常用溶解度来 表示
讨论:设计实验——怎样比较食
盐和硝酸钾哪一个更易溶于水?
较多的食盐 较少的熟石灰
10ml水
答:不同。例如食盐在水中溶解能力较大, 而熟石灰在水溶解能力很差。
提问: 2.同种物质在不同溶剂中溶解能力是否相同?
等量的植物油
10ml水
10ml汽油
答:不同。例如油易溶于汽油而难溶于水。
演示实验:一、物质的溶解性
(2) (1) 通常把一种物质溶解在另一种物质里的能 等量的植物油 较多的蔗糖 较少的熟石灰 力叫做溶解性。
饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
结论:
1.饱和溶液不一定是浓 溶液,可能是稀溶液. 2. 不饱和溶液不一定是 稀溶液,可能是浓溶液.
饱和溶液 浓溶液
稀溶液
3.对于同一种溶质的 溶液来说,在一定温 度下,饱和溶液比不 饱和溶液浓 .
不饱和 溶液
粗盐的主要成分:不溶性泥沙、氯化钠
提纯粗盐的步骤:
讨论
浓溶液一定是饱和溶液吗? 稀溶液一定是不饱和溶液吗?
氢氧化钙 0.165克 硝酸银 222克 食盐 36克
20℃时,在100克水中达到饱和时溶解不同物质的质量:
碳酸钙 0.0013克
判断:
1、 20℃时,在100克水中加入0.165克的氢氧化钙,充分溶解所得的溶 液是 稀溶液 (浓溶液或稀溶液),是 饱和溶液 (饱和溶液或不饱和溶 液)。 2、 20℃时,在100克水中加入0.1克的氢氧化钙,充分溶解所得的溶液
难 ( 不 )溶 <0.01g 易溶
>10g
难(不)溶 微溶 0.01g
可溶
1g
.
练习:
A.易溶 物质
1、不溶物就是绝对不溶于水的物质。此话是否正确? 难 2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___ 溶物质。 3、20℃时氯化钠的溶解度是36g,则氯化钠属于( A ) B.可溶物质 C.微溶物质 D.难溶物质
2.饱和溶液和不饱和溶液的相互转化问题:
大多数:
不饱和溶
增加溶质或降低温或蒸发溶剂 增加溶剂或升高温度
饱和溶液
注意: 1.此转化条件对多数固体物质适合, 因 为大多固体 物质在一定量水中溶解的最大量 随温度的升高而增大。 2.熟石灰在一定量水中溶解的最大限 量随温度升高而降低则不适合。
对于氢氧化钙:
列表法:3-2 几种固体物质在不同温度时的 溶解度(克)
温度 (°C)
0
10
20
30
40
50
60
70
80
90
100
氯化钠 硝酸钾
35.7 13.3
35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8 20.9 31.6 45.8 63.9 85.5 110. 0 138 169 202 246
30
随堂练习
• 3.在一定温度下,将一瓶接近饱和的 硝酸钾溶液变为饱和溶液,可采取的方 法有: • ①升高温度 ②降低温度 ③增加硝酸钾 ④减少硝酸钾 ⑤增加溶剂 ⑥减少溶剂, 其中正确的一组是( ) D • A.①②③ B.②③④ C.③④⑤ D.②③⑥
31
提问:
1.不同物质在水中溶解能力是否相同?举例说明。
1、使用什么方法可将粗盐中的泥沙除去?
溶解、过滤: 2、除去泥沙后,再怎样操作才能得到食盐 晶体?
蒸发结晶
蒸发结晶:
蒸发操作过程中的注意事项:
a、注意蒸发皿的溶液不超过蒸发皿 容积的2/3; b、加热过程中要不断搅拌,以免溶 液溅出; c、不能蒸干,应当析出大量晶体时 就应熄灭酒精灯,利用余热蒸发至 干
再加15ml水,搅 拌
结论:可溶物在一定量的水中不能无限溶解;
7
实验探究二
• 硝酸钾去哪里了?
在室温下
盛有20ml 水的烧杯 加入5g 硝酸钾 搅拌 再加入5g 硝酸钾 搅拌 再加入5g硝 酸钾,搅拌 加热烧杯
8
冷却热的饱和溶液时,硝酸钾晶体从溶液中析出
硝酸钾晶体
现象及结论
操作
加5g硝酸钾,搅拌 再加5g硝酸钾,搅 拌 加热 再加5g硝酸钾,搅 拌 冷却
.
10g
.
【课堂练习】
乘风破浪会有时, 直挂云帆济沧海!
【例2】 ①不溶物就是绝对不溶的物质。这句话是否正确? × 不正确。通常所说的不溶物即难溶物,溶解度<0.01g。 实际上没有绝对不溶的物质。 ②20℃时碳酸钙的溶解度是0.0013克,所以碳酸钙 难溶 是___物质。 易溶 ③20℃时食盐的溶解度是36克,所以食盐属于__ 物质。
微溶
0.01g <S<1g
难溶
S<0.01g
小结: 溶解性:是定性的表示物质溶解能力的大小,
常用易溶、可溶、微溶、难溶来表示。
溶解度:是用具体的数值定量的表示物质在
一定温度下,在100g溶剂中的最大溶解能力。
2、溶解度与溶解性的关系
溶解性
溶解度/g (20℃)
易溶
可溶 1g~10g
微溶
0.01~1g
梦幻般的青海湖
夏天晒盐 冬天捞碱
课题2
第一课时
4
最多能溶解多少氯化钠,是无限制的溶解吗
实验探究一
20ml的水能无限地溶解氯化钠吗? 在室温下
加5g的 搅拌
NaCl
加20ml 的水
搅拌 继续加5g 的NaCl 搅拌
加15ml 的水
6
现象及结论
操作 加5g氯化钠,搅 拌 再加5g氯化钠, 搅拌 现象 全部溶解 部分未溶解 全部溶解 结论 未饱和 已饱和 未饱和
• 归纳:若某物质在某温度时的溶解度为x 克,则此时
M质 =x克,M剂 = 100克, M液= M质+M剂 = 100+x克
从溶解度可以获得的信息
如果不指明溶剂, 通常所说的溶解度 是指物质在水中的 溶解度。
【课堂练习】
【例1】判断下列说法是否正确,并指明错误原因。 ①把20克某物质溶解在100克水里恰好制成饱和溶 × 液,这种物质的溶解度就是20克。 未指明温度 ②20℃时10克氯化钠溶解在水里制成饱和溶液, × 未指明溶剂的量 故20℃时氯化钠的溶解度是10克。 ③20℃时10克氯化钠可溶解在100克水里,故 × 20℃时氯化钠的溶解度是10克。未指明溶液的
多少,分为浓溶液和稀溶液 一定量溶液中含溶质的量相对多 的是浓溶液,否则是稀溶液。
饱和溶液一定是浓溶 液,不饱和溶液一定是稀 溶液吗?
含有较多溶质的溶液叫浓溶液, 你能说说它们之间的相同点和不同点吗? 相同点:都是食溶液,溶质是食盐,溶剂是水。
不同点:A是食盐的不饱和溶液,溶质比较少
含有较少溶质的溶液叫稀溶液。 B是食盐的饱和溶液。溶质比较多。
或
在20℃时,100g水中溶解203.9g蔗糖,溶液 达到饱和。
42
由于溶液是否饱 和与温度有关, 因此在谈及物质 的溶解度时,应 指明温度。
【思考】理解了溶解度的概念,那你了解平时所说 的“易溶”“难溶”与溶解度的关系吗?
溶解性和溶解度的关系
溶解性 易溶 溶解度 20℃
S>10g
可溶
10g > S>1g
饱和溶液是否一定是浓溶液? 不饱和溶液是否一定是稀溶液?
【实验二 】
多
相等 不饱和 浓溶液
少
相等 饱和
稀溶液
饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
①
① 10g蔗糖 不饱和溶液 浓溶液
②
② 0.2g熟石灰
③
③一匙食盐 不饱和溶液 稀溶液
④
④四匙食盐 饱和溶液 浓溶液
饱和溶液 稀溶液
• 结论: • 1.对于不同溶质来说:饱和溶液不一定 是浓溶液,不饱和溶液也不一定是稀 溶液。 • 2. 在同一条件下,对于同一种溶质来 说,饱和溶液要比不饱和溶液浓些。
不饱和溶液: 还能继续溶解原来的溶 质的溶液,叫做这种 溶质的不饱和溶液
12
一、饱和溶液、不饱和溶液
1.在一定温度下,向一定量溶剂里加入某溶质,当溶质 不能继续溶解时,所得到的溶液叫做饱和溶液;还能 继续溶解的的溶液,叫做不饱和溶液。
注意:1. “一定温度”、 “ 一定量的溶剂” 2. 应明确“某溶质”的饱和溶液或不饱 和溶液,如在一定条件下不能再溶解 NaCl的溶液,还能溶解蔗糖,对NaCl 来说饱和,对蔗糖来说不饱和.
